高血压作为心血管疾病的危险因素,已成为最常见的慢性健康问题之一[1]。高血压是全球性问题,影响20%~45%的人口,特别是老年人中50%~60%的人,高血压的预防和治疗措施可以有效地减少心血管疾病,包括动脉硬化、中风和心肌梗死[2-3]。血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽是一类具有良好抗高血压活性的生物活性多肽,具有潜在的抗高血压作用[4],现已成为生物活性肽研究领域的热点之一,也已经有大量研究证明食源性生物活性肽具有ACE抑制活性。但长期服用合成药物会产生耐药性,肝脏损伤等,且传统方法筛选ACE抑制肽的周期长且成本高,因此,寻找具有安全和可靠副作用的食源性ACE抑制剂已经引起了相当大的研究兴趣,从天然蛋白资源中高效筛选ACE抑制肽成为研究的焦点,采用生物活性多肽作为辅助降血压食品方面的研究也已经受到广泛关注[5]。
由于猪肉是世界上食用最广泛的肉类,占世界肉类摄入量的36%以上,而在动物加工过程中,近40%被视为副产品[6]。在中国,统计数据显示,猪肉加工过程中每年产生近800万t骨,700万t皮和500万t内脏[7],将这些副产物转化为胶原蛋白、胶原蛋白肽等,可增加其利用价值。猪胶原蛋白肽与人胶原蛋白肽结构相似,一般不会引起过敏反应,且其中含有大量的蛋白质、维生素、钙、铁、磷等营养成分,具有补充营养、提供能量、促进骨骼生长、辅助改善贫血和皮肤状态等功效与作用[8]。近年来,随着组合生物技术等高新技术的发展,低分子生物活性肽的高值化利用成为研究热点。目前已通过生物信息学结合网络药理学等方法,从猪副产物中筛选鉴定出多种猪胶原生物活性肽[9],为动物副产品的高值化利用提供了机会。
网络药理学是一种基于系统生物学和网络与药理学分析等多种技术集成的预测疾病-药物相互作用潜在机制的有效方法[10]。随着网络药理学的不断发展,现已从传统的寻找单一靶点转变为从系统层次和生物网络的整体角度研究,分析具有多成分、多途径和多靶点协同作用等特点,阐述多靶点与多成分间复杂网状相互作用关系[11]。近年来,网络药理学已被广泛应用于预测研究活性成分与疾病之间的作用机制。潘若瑶等[12]通过网络药理学揭示芦荟大黄素的降糖机制,结果表明芦荟大黄素具有22个改善治疗Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)的核心靶点,如蛋白激酶B1(serine/threonine-protein kinase-1,AKT1)、丝裂原活化蛋白激酶8(mitogen-activated protein kinase 8,MAPK8)等,这些靶点主要富集在PI3K-Akt和胰岛素抵抗等信号通路。ZHOU等[13]研究中国大螈皮肤胶原水解物中筛选出来的多肽GPPGPA在T2DM中的作用及相关分子机制,通过网络药理学确定核心靶点为AKT1、MAPK8、和转录因子AP-1(transcription factor AP-1,JUN),这些靶点主要集中在与T2DM相关的PI3K-Akt信号通路、糖尿病并发症中的AGE-RAGE信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、胰岛素抵抗等方面。田薇等[11]基于网络药理学研究板蓝根抑菌活性成分及其作用机制,结果表明板蓝根主要通过豆甾醇调控胱天蛋白酶3(apoptosis-related cysteine peptidase,CASP3)、人前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)等靶点,基因功能富集于细胞凋亡、转录调控等参与癌症途径、TNF信号通路发挥抑菌作用。
因此,本研究旨在通过网络药理学和分子对接揭示猪胶原蛋白源降压肽的潜在作用机制,为猪胶原蛋白肽的深入研究提供理论基础,为作为高血压改善治疗的新食品资源的开发提供了新的依据。
1 材料与方法
1.1 数据库平台
硅法筛选及网络药理学研究所用数据库和平台网址见表1。
表1 本文所用数据库及网址
Table 1 Database and website used in this paper
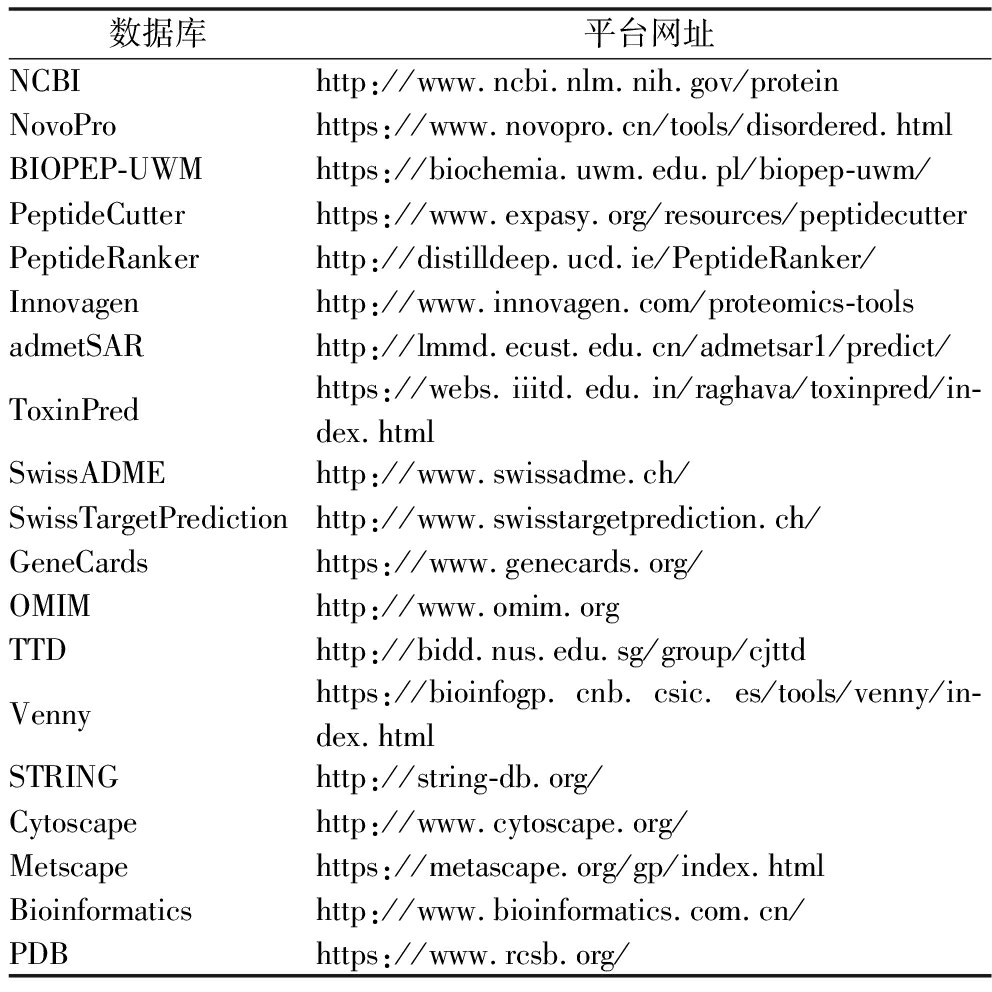
数据库平台网址NCBIhttp://www.ncbi.nlm.nih.gov/proteinNovoProhttps://www.novopro.cn/tools/disordered.htmlBIOPEP-UWMhttps://biochemia.uwm.edu.pl/biopep-uwm/PeptideCutterhttps://www.expasy.org/resources/peptidecutterPeptideRankerhttp://distilldeep.ucd.ie/PeptideRanker/Innovagenhttp://www.innovagen.com/proteomics-toolsadmetSARhttp://lmmd.ecust.edu.cn/admetsar1/predict/ToxinPredhttps://webs.iiitd.edu.in/raghava/toxinpred/in-dex.htmlSwissADMEhttp://www.swissadme.ch/SwissTargetPredictionhttp://www.swisstargetprediction.ch/GeneCardshttps://www.genecards.org/OMIMhttp://www.omim.orgTTDhttp://bidd.nus.edu.sg/group/cjttdVennyhttps://bioinfogp.cnb.csic.es/tools/venny/in-dex.htmlSTRINGhttp://string-db.org/Cytoscapehttp://www.cytoscape.org/Metscapehttps://metascape.org/gp/index.htmlBioinformaticshttp://www.bioinformatics.com.cn/PDBhttps://www.rcsb.org/
1.2 研究方法
1.2.1 猪胶原蛋白的蛋白序列
所有蛋白质的信息分别从国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的蛋白质数据库中选择并应用于我们当前的研究,选取了常见的,2个具有代表性的猪胶原蛋白α-1(Ⅰ)链和α-2(Ⅰ)链,蛋白序列为(NCBI Accession BAX02568.1 GI:1159729721,length 1 466 aa和BAX02569.1 GI:1159729723,length 1 366 aa)。
1.2.2 猪胶原蛋白作为ACE抑制肽来源的评价
使用在线工具NovoPro分析所选胶原蛋白蛋白质疏水性。利用BIOPEP-UWM评估从NCBI数据库获得的猪胶原蛋白序列中潜在的ACE抑制肽的潜力[14]。ACE抑制肽的出现频率(A)由公式(1)计算[15]:
(1)
[:a,蛋白质序列中ACE抑制肽的数量;N,蛋白质氨基酸残基的数量。
1.2.3 虚拟酶解与筛选
按1.2.1节所述方法获得的α-1和α-2胶原蛋白链以FASTA格式复制到PeptideCutter中[16],通过胃肠道消化酶:即胃蛋白酶(pH值>1.3,EC 3.4.23.1)和胰蛋白酶(EC 3.4.21.4)进行虚拟酶解,得到理论多肽序列。从序列中选出二肽、三肽和四肽,并分别使用在线工具PeptideRanker计算其活性分数(活性评分>0.5的多肽被认为是有生物活性潜力的寡肽)[17];用Innovagen预测其水溶性;admetSAR预测其ADMET性质[主要包括人体肠道吸收(human intestinal absorption,HIA)、血脑屏障穿透(blood-brain barrier penetration,BBB)][18];用 ToxinPred预测毒性;用SwissADME根据Lipinski规则(Lipinski规则筛选条件为:a)分子质量(Mw)≤500 Da;b)氢键供体≤5个;c)氢键受体≤10个;d)脂水分配系数≤5)筛选出符合“类药物”性质的肽。最终得到生物活性高、水溶性、ADMET性质良好、无毒且符合类药性的猪胶原蛋白源目标肽序列。
1.2.4 目标预测和网络构建
使用SwissTargetPrediction数据库,设置物种胃 “Homo sapiens”(概率≥0.1),识别与所选肽相关的靶基因。以“hypertension”和“high blood pressure”为关键词,从人类基因组数据库GeneCards、OMIM数据库和TTD数据库中筛选出高血压相关靶标。将目标肽相关的靶基因和高血压的靶标通过Venny2.1.0绘制韦恩图并获得共同靶标,然后将共同靶标上传到STRING数据库,将物种设置为 “Homo sapiens” 和最小相互作用阈值为“中等信度(0.4)”,得到蛋白-蛋白相互作用网络进行进一步分析。使用Cytoscape 3.9.1对结果进行可视化,并使用其插件Centiscape 2.2对得到的蛋白-蛋白相互作用网络进行拓扑分析以获得关键靶点。
1.2.5 基因本体论(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)途径富集分析
将目标肽与高血压的共同靶点导入Metscape平台,设置P<0.01进行GO和KEGG通路的富集分析,使用生物信息学工具对结果进行可视化。
1.2.6 分子对接
为了阐明多肽网络药理预测与核心靶点相互作用的可能机制,将核心靶点与活性多肽进行对接[19]。选择关键靶点,在PDB中找到分辨率较高的相应蛋白三维结构下载,采用Autodock Tools 1.5.6软件去除水分子和氢化蛋白,将关键靶标和筛选的肽结构导入Autodock Tools 1.5.6软件进行分子对接验证试验,最后利用PyMol 2.5.2软件构建三维原理图。用于模拟的数据包括蛋白质文件、配体(.pdbqt)文件和网格大小。
2 结果与分析
2.1 猪胶原蛋白中潜在ACE抑制肽的评价
疏水性是指水不溶性分子在水溶液中具有排除其自身周围的水分子而相互聚集在一起的一种现象或性质,以达到这些分子和水分子最小接触程度的目的,从而降低水不溶性分子和水分子的相互作用,进而降低系统的能量,达到一种相对稳定的状态[20]。如图1所示,横轴代表蛋白的氨基酸序号,纵轴代表疏水性,越大代表越疏水,如果为负值,代表亲水,结果表明,2条猪胶原蛋白链中都含有大量的疏水性氨基酸,是释放ACE抑制肽的潜在来源。此外,BIOPEP-UWM预测2种猪胶原蛋白序列(Ⅰ型α1链和Ⅰ型α2链)释放ACE抑制肽的理论释放量分别为85.1%和87.3%,理论片段分别为1 247个和1 193个,表明猪胶原蛋白具有显著释放ACE抑制肽潜力。由于ACE在高血压的发生发展中起着重要的作用,因此,抑制ACE仍然是开发抗高血压策略的首要目标[21]。ACE抑制剂可阻断血管紧张素的转化,使血管松弛,从而降低血压水平,直到今天,人们的主要注意力都集中在发现更安全、更温和的ACE抑制剂和食源性ACE抑制肽上,这些肽仍然是最具吸引力的天然ACE抑制生物活性来源多肽,因为它们没有任何副作用[22]。
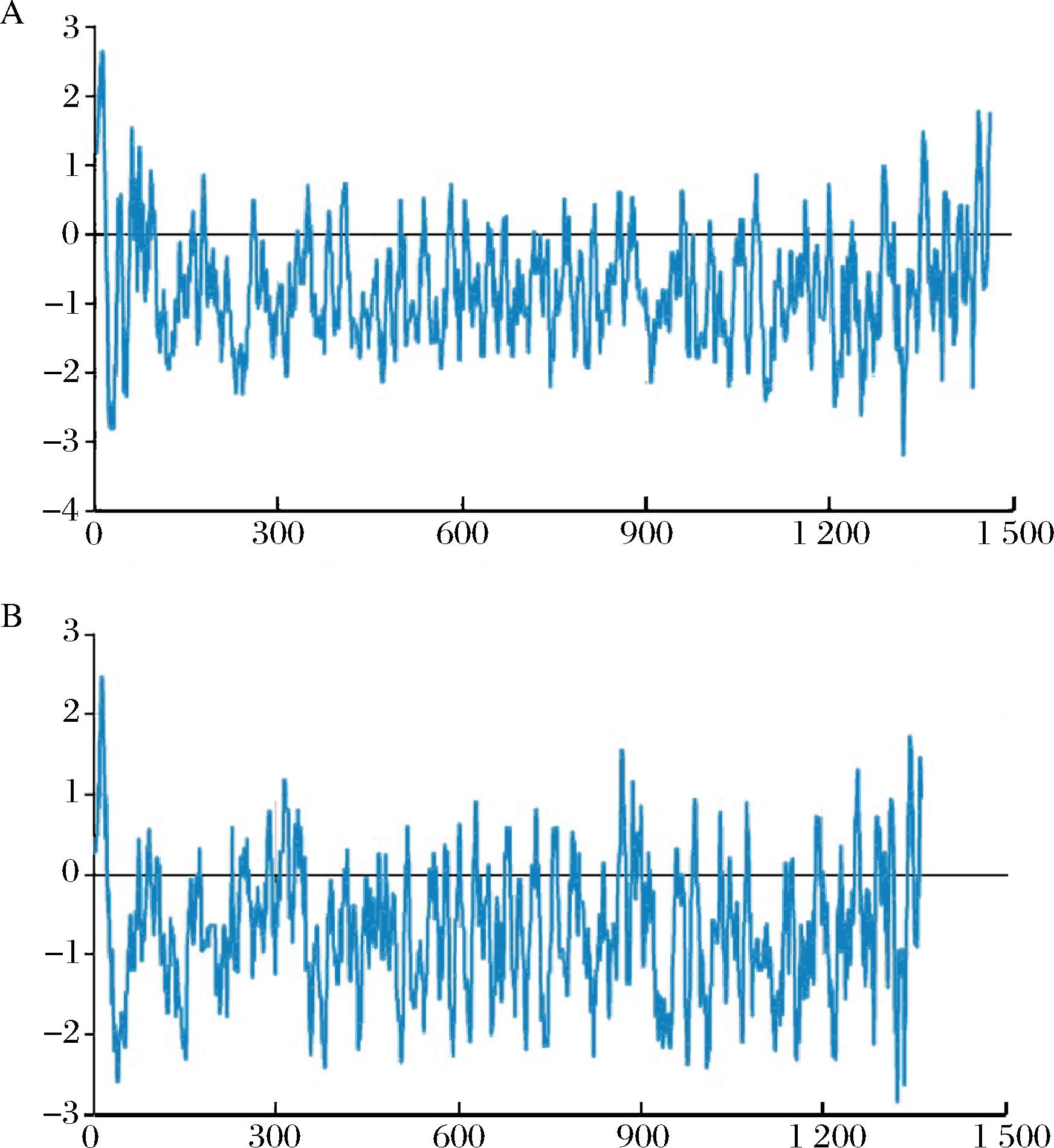
A-Ⅰ型α1链;B-Ⅰ型α2链
图1 猪胶原蛋白链的疏水性分析
Fig.1 Hydrophobicity analysis of pig collagen chains
注:横轴代表蛋白的氨基酸序号,纵轴代表疏水性。
2.2 猪胶原蛋白中ACE抑制肽的硅化鉴定
将所选猪胶原蛋白序列以FASTA格式从NCBI复制到Peptide Cutter中进行虚拟酶解,胃蛋白酶,它催化与Phe、Tyr、Trp、Leu、Glu、Gln形成的肽键的裂解;胰蛋白酶,主要水解羧基侧的肽键Lys和Arg;这两种水解酶水解的蛋白质在C端产生许多带正电荷的肽(如Lys,Arg),通常表现出较强的ACE抑制活性[23-24]。多肽的功能和生物活性与其氨基酸链长和序列密切相关,短链多肽片段相对稳定,容易在体内吸收[25],因此收集二肽、三肽和四肽,去除重复肽后共筛选出50个寡肽;并对其水溶性和生物活性进行了预测。一般来说,生物活性肽被定义为在0~1的范围内,PeptideRanker评分>0.5的肽,可能具有潜在生物活性,且值越高,生物活性越大[26-27]。为了减少假阳性分数,选择阈值≥0.6的寡肽,结果共获得5个具有潜在生物活性和良好水溶性的肽序列,为了在admetSAR中预测这5种肽的ADMET特性,使用NovoPro(https://www.novopro.cn/tools/)在线工具简化了肽的分子线性输入规范(SMILES)格式。结果(表2)表明,5种寡肽具有高生物活性和良好的水溶性,NWYR和RL(Arg-Leu)具有良好的药物的吸收、分配、代谢、排池和毒性(absorption、distribution、metabolism、excretion、toxicity,ADMET)特性,均表现出HIA+和BBB+,表明它们易于吸收,可以通过血脑屏障,但只有RL表现出良好的类药物性质,其氨基酸序列为Arg-Leu(RL,Mw= 287.19 Da),其分子结构如图2-A所示。因此,筛选出水溶性和ADMET良好、生物活性分数>0.6且符合Lipinski法则的寡肽(RL)进行下一步研究。大量的科学研究已经确定,大量的降压肽来自各种食源性蛋白质资源,如海鲜中的肽序列PPN、PPS[28]、牛奶中的肽序列SLPEW、VSLPEW、GVSLPEW、VGINYW 和LDQWL[29]、鸡蛋蛋白中的肽序列FQK、WGK和ADW[15]和动物肉中的肽序列EACF、CDF[26]、YW、LRY和GPRGF[30]等。从中可以发现生物活性肽的功能与其氨基酸组成密切相关,这些ACE抑制肽通常含有大量的非极性疏水氨基酸,而非极性疏水氨基酸具有降低血压中的胆固醇浓度,防治高血压且对高血压有疗效作用,如Gly、Ile、Leu、Phe、Pro、Trp和Val[31],这些氨基酸是ACE抑制肽活性的重要决定因素,所筛选的活性肽RL非极性氨基酸占比为50%,符合此特点。
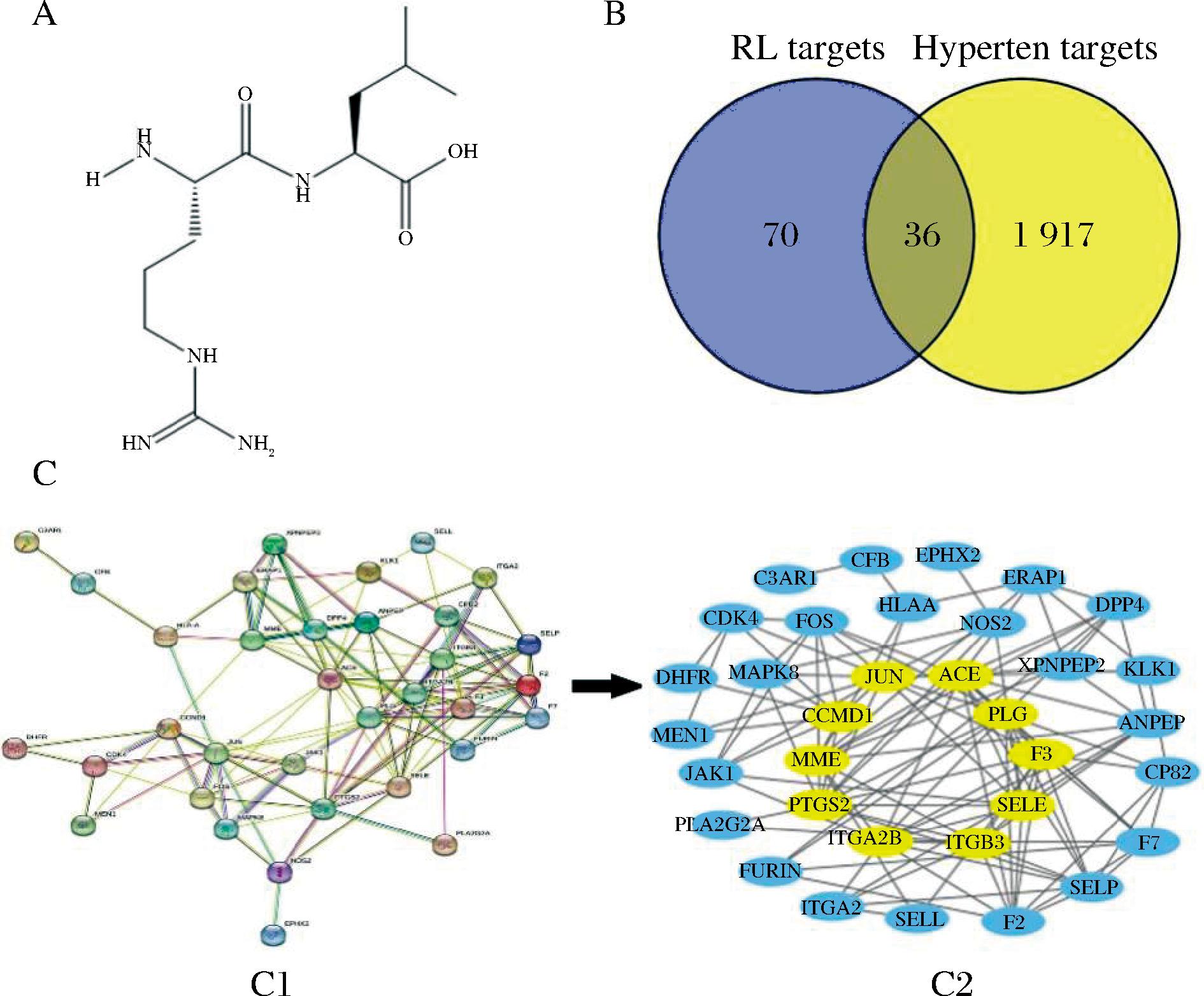
A-肽RL结构;B-RL与高血压交集靶点韦恩图;C-共同靶点蛋白相互作用网络图(C1-RL与高血压共同靶点相互作用网络图,C2-拓扑分析图)
图2 肽RL结构、RL与高血压交集靶点韦恩图、RL与高血压共同靶点相互作用网络图、拓扑分析图
Fig.2 Structure of peptide RL,Venn diagram of intersection targets of RL and hypertension,interaction network diagram of common targets of RL and hypertension; topological analysis diagram; yellow denotes key targets screened according to threshold
注:黄色表示根据阈值筛选的关键靶点;黄色表示根据阈值筛选的关键靶点。
表2 所选肽的虚拟筛选分析结果
Table 2 Virtual screening analysis results of selected peptides
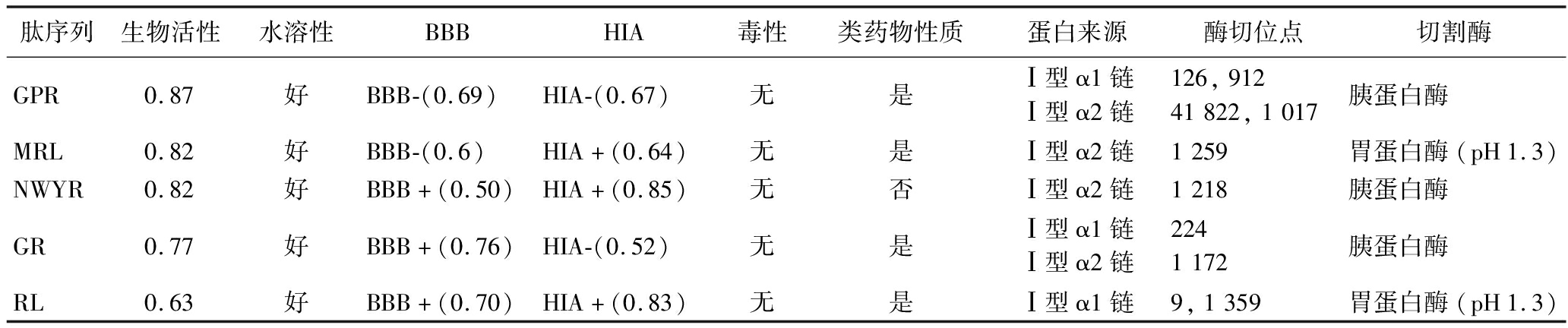
肽序列生物活性水溶性BBBHIA毒性类药物性质蛋白来源酶切位点切割酶GPR0.87好BBB-(0.69)HIA-(0.67)无是Ⅰ型α1链Ⅰ型α2链126,91241822,1017胰蛋白酶MRL0.82好BBB-(0.6)HIA+(0.64)无是Ⅰ型α2链1259胃蛋白酶(pH1.3)NWYR0.82好BBB+(0.50)HIA+(0.85)无否Ⅰ型α2链1218胰蛋白酶GR0.77好BBB+(0.76)HIA-(0.52)无是Ⅰ型α1链Ⅰ型α2链2241172胰蛋白酶RL0.63好BBB+(0.70)HIA+(0.83)无是Ⅰ型α1链9,1359胃蛋白酶(pH1.3)
2.3 RL-高血压的共同目标和关键目标
将筛选得到的猪胶原蛋白肽(RL)的三维结构上传到SwissTargetPrediction网站进行多肽靶点预测,去除重复后显示106个相关靶点。在GeneCards数据库中,以关键字“hypertension”,“Relevance score≥2”为基础的搜索结果显示1 910个相关目标,TTD和OMIM数据库共收集了84个相关目标,以补充相关指标并删除重复指标,共获得1 954个与高血压相关的目标。通过Venny 2.1.0绘制目标肽靶标与高血压靶标韦恩图(图2-B),共获得了36个共同靶标。选择RL与高血压靶点相交后的36个靶点作为RL-高血压的共同靶点,通过STRING绘制共同靶点蛋白相互作用网络图(图2-C)。使用Cytoscape 3.9.1中的插件Centiscape 2.2对网络进行拓扑分析,根据筛选参数计算结果,阈值(degree=7,betweenness=41.529,closeness=0.014),最终获得10个关键目标,占总目标数的27.78%,这些靶点在整个网络中起着关键作用,是辅助治疗高血压的重要靶点。
2.4 RL-高血压的GO和KEGG富集分析
使用Metascape数据库对36个共同靶点进行GO和KEGG途径富集度分析(P<0.01)。GO富集分析共获得364条记录,其中生物学过程(biological process,BP)(281条)、分子功能(molecular function,MF)(48条)和细胞组成(cellular component,CC)(35条)分别占77.20%、13.19%和9.61%,分别选取前10个分析条目绘制柱状(图3-A)。在生物过程类中,靶蛋白主要参与细菌、脂多糖的反应、凝血调节、系统动脉血压的调节、环化酶活性的正向调节以及血液循环和血压调节。在分子功能类别中,靶蛋白主要参与蛋白酶结合、肝素结合、蛋白激酶调节活性、丝氨酸型肽酶活性和G蛋白偶联受体结合。在细胞成分类别中,靶蛋白主要存在于细胞外基质、膜筏、血液微粒和外体中,参与细胞粘附的蛋白质复合物。KEGG分析得到75条信号通路,其中包括PI3K-Akt信号通路、IL-17信号通路、T细胞受体信号通路、MAPK信号通路、Wnt信号通路以及血小板活化通路等,选取前15条通路绘制气泡图(图3-B)。PI3K-Akt信号通路是一条经典的转导通路,可参与细胞的激活,生长,分化,存活,恶变,凋亡等一系列细胞活动及调控蛋白合成,能量代谢,血管生成等重要的生理过程[32];现研究发现,通过调控PI3K/AKt信号通路可从修复血管内皮功能,抑制心肌细胞凋亡,维持大脑功能等多方面达到调控血压作用,是当前高血压疾病防控的重要信号通路之一[32]。Wnt信号分子是一类在无脊椎与脊椎动物的多种组织中广泛表达且进化上高度保守的信号刺激分子,他们在生长、发育、代谢和干细胞调节等多种生物学过程中发挥重要作用在健康成人的器官中Wnt信号是沉默的,但是在病理情况下Wnt信号激活[33];近年发现Wnt信号通路在心血管疾病的发生发展过程中扮演重要角色。血小板异常活化有可能是高血压患者动脉血栓前状态的重要指标,可能是促使高血压引起的缺血性心脑血管疾病等并发症的发生和发展原因,改善其血小板功能,抑制血小板活性,降低血小板黏附和聚集率,对预防、降低或延缓高血压患者病情发展及其并发症的发生有重要意义[33]。这些结果均表明RL可以通过多种途径和靶点发挥降血压作用。
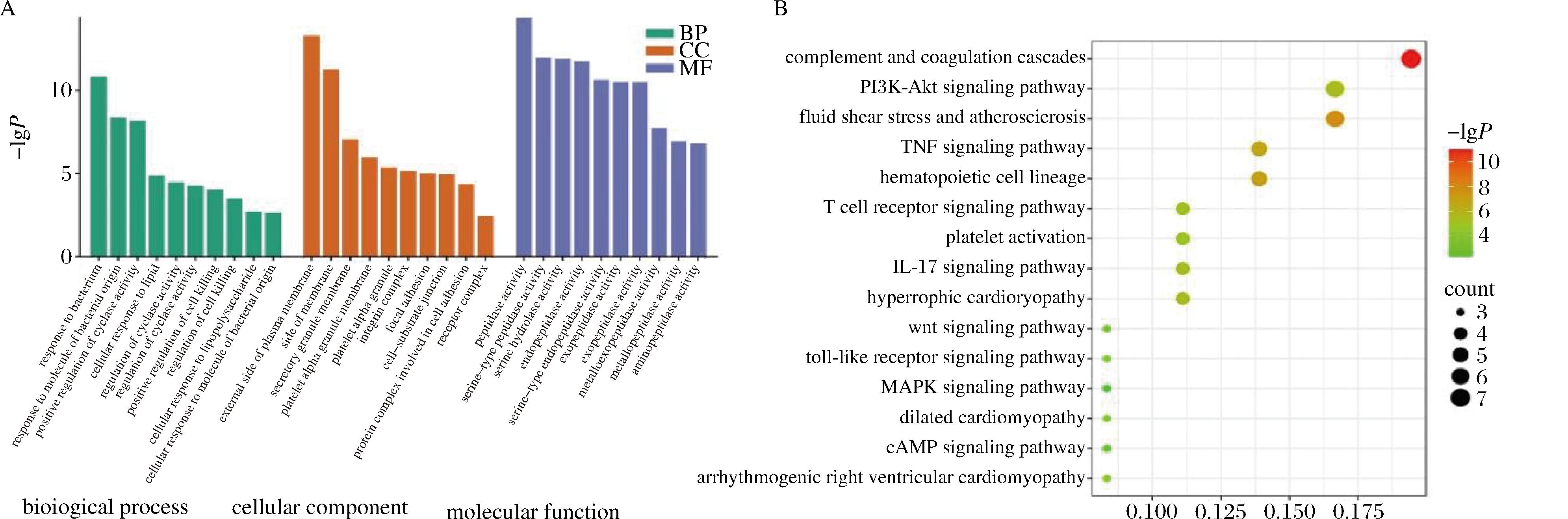
A-GO分析;B-KEGG通路富集分析
图3 RL与高血压共同靶点富集分析
Fig.3 Common target enrichment analysis of RL and hypertension
2.5 分子对接结果
为了证明它们可能的相互作用机制,将筛选得到的核心靶点蛋白通过PDB数据库检索,得到对应的蛋白质结构,下载其三维结构:ACE(6p0z)、ITGA2B(4yo0)、F3(6lje)、PTGS2(5f19)、PLG(8aql)、MME(7ven)、ITGB3(6bxj)、CCND1(6p8e)、JUN(6y3v)和SELE(1 g1t),并与筛选的活性肽对接,对接结果如表3所示。所有组合对接结合能均<0 kcal/mol,表明蛋白质与小分子能够自发结合[11]。借助分子对接技术预测活性肽与靶标分子的结合位点,有助于活性肽与高血压关键靶点相互作用模式与结合机理的研究,并阐明肽与关键靶点特定的抑制性位点[34]。结合能越小,结合越强,越稳定。因此,选择前3个进行构效分析(图4),核心靶点ACE(6p0z)通过8个氢键与RL相互作用,结合能为-7.0 kcal/mol,键距在2.1~2.7 Å,参与氢键相互作用的主要结合位点残基为Asp-153、Gln-150、Glu-143、Arg-149、Asn-26和Lys-42(图4-A);ITGA2B与RL的对接结果显示有8根氢键相互作用,结合能为-6.6 kcal/mol,键距在2.4~4.4 Å,这些相互作用出现在氢键和氨基酸残基Ser-82、Lys-62、Ile-117、Val-118和Leu-23之间(图4-B);F3与RL在Ser-351、Lys-319和Ala-323处通过氢键连接,共形成4个氢键,键距分别为2.3、3.0、3.1、2.0 Å,结合能为-6.2 kcal/mol(图4-C)。结果表明,ACE与RL的相互作用是最稳定的,ACE(6p0z)是辅助治疗高血压的最佳核心靶点,其网格大小(x,y,z)分别为42.86,41.73,71.05,网格中心指定为(x,y,z)-36.23,-23.35,139.56。由对接结果可知生物活性肽(RL)主要通过氢键与靶点蛋白结合,并与多种氨基酸残基结合,从而影响靶点在各个通路中的作用,达到改善降血压的目的。
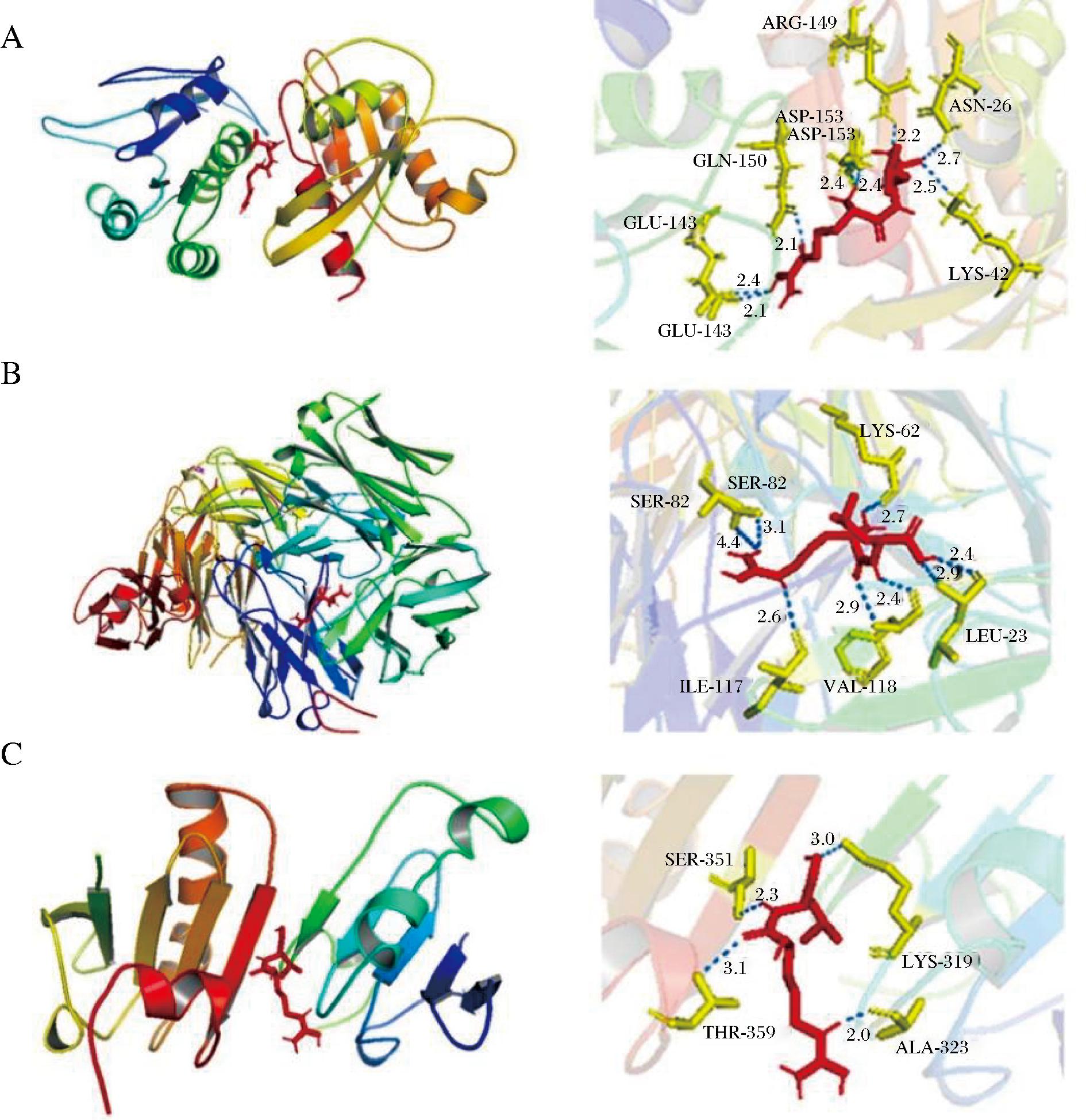
A-RL-ACE;B-RL-ITGA2B;C-RL-F3
图4 分子对接3D图
Fig.4 3D molecular docking diagram
表3 配体与受体蛋白分子对接结果
Table 3 Results of ligand-receptor protein molecular docking
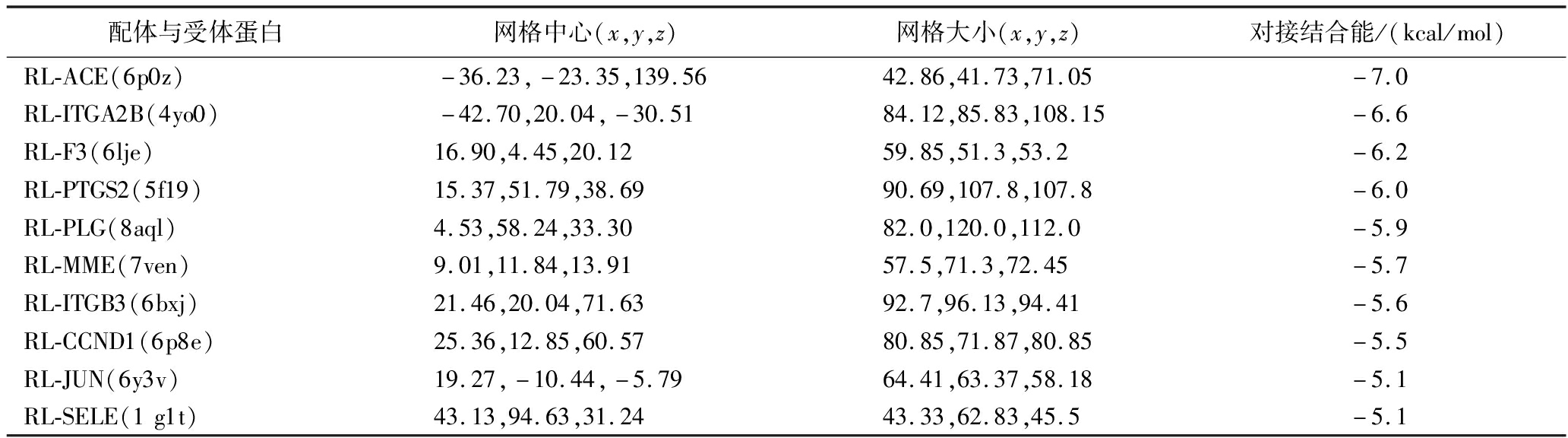
配体与受体蛋白网格中心(x,y,z)网格大小(x,y,z)对接结合能/(kcal/mol)RL-ACE(6p0z)-36.23,-23.35,139.5642.86,41.73,71.05-7.0RL-ITGA2B(4yo0)-42.70,20.04,-30.5184.12,85.83,108.15-6.6RL-F3(6lje)16.90,4.45,20.1259.85,51.3,53.2-6.2RL-PTGS2(5f19)15.37,51.79,38.6990.69,107.8,107.8-6.0RL-PLG(8aql)4.53,58.24,33.3082.0,120.0,112.0-5.9RL-MME(7ven)9.01,11.84,13.9157.5,71.3,72.45-5.7RL-ITGB3(6bxj)21.46,20.04,71.6392.7,96.13,94.41-5.6RL-CCND1(6p8e)25.36,12.85,60.5780.85,71.87,80.85-5.5RL-JUN(6y3v)19.27,-10.44,-5.7964.41,63.37,58.18-5.1RL-SELE(1g1t)43.13,94.63,31.2443.33,62.83,45.5-5.1
3 结论
本文通过在线数据库对猪胶原蛋白进行虚拟酶解,筛选得到高生物活性、水溶性和ADMET性质良好以及符合类药性的目标肽序列(RL),其潜在靶点106个,改善治疗高血压的靶点1 954个,将两者取交集共获得36个靶点,交集靶点即为RL改善治疗高血压的潜在靶点;根据GO富集分析和KEGG通路分析,发现这些靶点可通过调节多种生物学过程,如凝血调节、系统动脉血压的调节、环化酶活性的正向调节以及血液循环和血压调节等,并在不同的细胞成分中发挥多种分子功能,基因功能主要富集于PI3K-Akt信号通路、IL-17信号通路、T细胞受体信号通路、MAPK信号通路、Wnt信号通路以及血小板活化通路等通路;根据阈值筛选出10个靶点,分别为ACE、ITGA2B、F3、PTGS2、PLG、MME、ITGB3、CCND1、JUN和SELE,这是RL发挥作用改善高血压的关键靶点;通过分子对接发现RL主要通过氢键与靶点蛋白结合,并与多种氨基酸残基结合,从而影响靶点在通路中的作用,达到改善高血压的目的。总之,本研究揭示了RL改善高血压的潜在作用靶点和作用机制,猪胶原蛋白可作为制备ACE抑制肽的合适原料。然而,在后续的研究中,还需进一步验证猪胶原蛋白活性肽(RL)的ACE抑制能力,并结合高血压动物模型从关键靶点基因、蛋白表达水平及代谢产物差异等多个角度探索RL的降血压作用机制,这将为明确其改善治疗高血压提供更深入的理论支持。
[1] SUO S K,ZHAO Y Q,WANG Y M,et al.Seventeen novel angiotensin converting enzyme (ACE) inhibitory peptides from the protein hydrolysate of Mytilus edulis:Isolation,identification,molecular docking study,and protective function on HUVECs[J].Food &Function,2022,13(14):7831-7846.
[2] CAO Y Q,HUANG J C,SUN M Z,et al.Network pharmacology and molecular docking combined to investigate the mechanism of duck-derived active peptides in preventing hypertension[J].International Journal of Food Science &Technology,2023,58(10):e12-e25.
[3] MUDGIL P,BABY B,NGOH Y Y,et al.Molecular binding mechanism and identification of novel anti-hypertensive and anti-inflammatory bioactive peptides from camel milk protein hydrolysates[J].LWT,2019,112:108193.
[4] CHEN J D,SUN S S,LI Y S,et al.Proteolysis of tilapia skin collagen:Identification and release behavior of ACE-inhibitory peptides[J].LWT,2020,139:110502.
[5] 孙晨松,陈雯祺,陈盈盈,等.基于分子对接虚拟筛选含酪氨酸残基的ACE抑制三肽[J].食品工业科技,2021,42(16):20-27.SUN C S,CHEN W Q,CHEN Y Y,et al.Virtual screening of ACE inhibitory tripeptides containing tyrosine residues based on molecular docking[J].Science and Technology of Food Industry,2021,42(16):20-27.
[6] 梁敬林.猪皮胶原蛋白的提取及其结构表征[D].佛山:佛山科学技术学院,2020.LIANG J L.Extraction and structural characterization of collagen from pigskin[D].Foshan:Foshan University,2020.
[7] SHEN X,ZHANG M,BHANDARI B,et al.Novel technologies in utilization of byproducts of animal food processing:A review[J].Critical Reviews in Food Science and Nutrition,2019,59(21):3420-3430.
[8] PEARMAN N A,RONANDER E,SMITH A M,et al.The identification and characterisation of novel bioactive peptides derived from porcine liver[J].Current Research in Food Science,2020,3:314-321.
[9] K![]() SKA P,STADNIK J.Porcine myofibrillar proteins as potential precursors of bioactive peptides-an in silico study[J].Food &Function,2016,7(6):2878-2885.
SKA P,STADNIK J.Porcine myofibrillar proteins as potential precursors of bioactive peptides-an in silico study[J].Food &Function,2016,7(6):2878-2885.
[10] 黄广伟,陈风晨,刘渝,等.基于网络药理学和分子对接技术芩苏胶囊干预新型冠状病毒肺炎(COVID-19)的潜在药效物质预测分析[J].上海中医药杂志,2020,54(10):1-11.HUANG G W,CHEN F C,LIU Y,et al.Predictive analysis of active compounds in Qinsu Capsule for prevention of COVID-19 based on network pharmacology and molecular docking[J].Shanghai Journal of Traditional Chinese Medicine,2020,54(10):1-11.
[11] 田薇,李秀梅,杨娟,等.基于网络药理学研究板蓝根抑菌活性成分及其作用机制[J].畜牧兽医学报,2022,53(8):2782-2793.TIAN W,LI X M,YANG J,et al.Network pharmacology study on the antibacterial activity components and mechanism of Isatis indigotica[J].Acta Veterinaria et Zootechnica Sinica,2022,53(8):2782-2793.
[12] 潘若瑶,任国艳,马富利.基于网络药理学及分子对接揭示芦荟大黄素的降糖机制[J].食品与发酵工业,2024,50(14):69-77.PAN R Y,REN G Y,MA F L.Network pharmacology and molecular docking reveal hypoglycemic mechanism of Aloe-emodin[J].Food and Fermentation Industries,2024,50(14):69-77.
[13] ZHOU M,REN G Y,ZHANG B,et al.Screening and identification of a novel antidiabetic peptide from collagen hydrolysates of Chinese giant salamander skin:Network pharmacology,inhibition kinetics and protection of IR-HepG2 cells[J].Food &Function,2022,13(6):3329-3342.
[14] DAREWICZ M,MINKIEWICZ P,IWANIAK A.The biopep-database of food biologically active peptides and proteins[J].Annals of Nutrition &Metabolism,2017,71:1170.
[15] 于志鹏,樊玥,赵文竹,等.鸡蛋蛋白ACE抑制肽的筛选、鉴定及其作用机制[J].食品科学,2020,41(12):129-135.YU Z P,FAN Y,ZHAO W Z,et al.Identification and mechanism of action of angiotensin-I converting enzyme inhibitory peptides from hen egg proteins[J].Food Science,2020,41(12):129-135.
[16] WIWANITKIT S,WIWANITKIT V.Prediction of enzyme cleavage possibility on Ebola virus glycoprotein by PeptideCutter[J].Annals of Tropical Medicine and Public Health,2015,8(6):317.
[17] MOONEY C,HASLAM N J,POLLASTRI G,et al.Towards the improved discovery and design of functional peptides:Common features of diverse classes permit generalized prediction of bioactivity[J].PLoS One,2012,7(10):e45012.
[18] CHENG F X,LI W H,ZHOU Y D,et al.Correction to “admetSAR:A comprehensive source and free tool for assessment of chemical ADMET properties”[J].Journal of Chemical Information and Modeling,2012,52(11):3099-3105.
[19] 樊玥.基于分子对接的海水鱼ACE抑制三肽鉴定及作用机制研究[D].锦州:渤海大学,2019.FAN Y.Identification and mechanism of ACE inhibitory tripeptide in Marine fish based on molecular docking[D].Jinzhou:Bohai University,2019.
[20] 舒顺顺.抗菌肽Mytichitin-CB的重组表达、纯化和抑菌活性研究[D].天津:天津科技大学,2016.SHU S S.Recombinant expression,purification and antibacterial activity of antibacterial peptide Mytichitin-CB[D].Tianjin:Tianjin University of Science &Technology,2016.
[21] SARKAR P,BORA N,HAOKIP N.Identification and structure-activity modeling of ACE inhibitory peptides demonstrating anti-inflammatory effects:Extracted from Antheraea assama and Philosomia ricnii pupae[J].Food Bioscience,2023,53:102625.
[22] 邹基豪.绿豆ACE抑制肽的纯化及功能特性研究[D].长春:吉林农业大学,2018.ZOU J H.Purification and functional characteristics of ACE inhibitory peptide from mung bean[D].Changchun:Jilin Agricultural University,2018.
[23] BHANDARI D,RAFIQ S,GAT Y,et al.A review on bioactive peptides:Physiological functions,bioavailability and safety[J].International Journal of Peptide Research and Therapeutics,2020,26(1):139-150.
[24] CHAKRABARTI S,GUHA S,MAJUMDER K.Food-derived bioactive peptides in human health:Challenges and opportunities[J].Nutrients,2018,10(11):1738.
[25] TOLDR F,REIG M,ARISTOY M C,et al.Generation of bioactive peptides during food processing[J].Food Chemistry,2018,267:395-404.
F,REIG M,ARISTOY M C,et al.Generation of bioactive peptides during food processing[J].Food Chemistry,2018,267:395-404.
[26] CHEN J B,YU X D,CHEN Q Z,et al.Screening and mechanisms of novel angiotensin-I-converting enzyme inhibitory peptides from rabbit meat proteins:A combined in silico and in vitro study[J].Food Chemistry,2022,370:131070.
[27] DUVAUD S,GABELLA C,LISACEK F,et al.Expasy,the Swiss Bioinformatics Resource Portal,as designed by its users[J].Nucleic Acids Research,2021,49(W1):W216-W227.
[28] DEVITA L,LIOE H N,NURIlMALA M,et al.The bioactivity prediction of peptides from tuna skin collagen using integrated method combining in vitro and in silico[J].Foods,2021,10(11):2739.
[29] XIE D W,DU L,LIN H S,et al.In vitro-in silico screening strategy and mechanism of angiotensin I-converting enzyme inhibitory peptides from α-lactalbumin[J].LWT,2022,156:112984.
[30] FU Y,YOUNG J F,LØKKE M M,et al.Revalorisation of bovine collagen as a potential precursor of angiotensin I-converting enzyme (ACE) inhibitory peptides based on in silico and in vitro protein digestions[J].Journal of Functional Foods,2016,24:196-206.
[31] 郑锦晓.宣威火腿抗菌肽的特性研究及分离纯化[D].南京:南京农业大学,2018.ZHENG J X.Study on characteristics,separation and purification of antimicrobial peptides from Xuanwei ham[D].Nanjing:Nanjing Agricultural University,2018.
[32] 邹连玉,郑丽维.PI3K/AKt信号通路在高血压疾病防治中的研究进展[J].中国医学创新,2021,18(34):176-179.ZOU L Y,ZHENG L W.Research progress of PI3K/AKt signaling pathway in the prevention and treatment of hypertension diseases[J].Medical Innovation of China,2021,18(34):176-179.
[33] 王怡文,姜黔峰,焦阳,等.Wnt信号通路与高血压疾病的研究进展[J].现代生物医学进展,2017,17(1):198-200,176.WANG Y W,JIANG Q F,JIAO Y,et al.Progress on Wnt signaling pathway and hypertensive disorders[J].Progress in Modern Biomedicine,2017,17(1):198-200,176.
[34] 田文慧.啤酒中血管紧张素转化酶及二肽基肽酶-Ⅳ抑制肽的筛选及活性研究[D].昆明:昆明理工大学,2021.TIAN W H.Screening and activity study of angiotensin converting enzyme and dipeptidyl peptidase-Ⅳ inhibitory peptide in beer[D].Kunming:Kunming University of Science and Technology,2021.