痛风性关节炎是一种反复发作的关节炎症,其病因为嘌呤代谢障碍导致血尿酸水平升高,进而使尿酸盐结晶沉积于关节囊、滑囊、软骨、骨质等组织中,典型症状包括关节红肿热痛等,是最常见的炎症性关节炎之一。痛风性关节炎患者常会感到关节疼痛,尤其是在夜间,严重影响患者的睡眠质量和生活。随着病情的进展,关节还会变得僵硬,甚至出现畸形,限制患者的活动能力[1]。另外,痛风性关节炎是一种与高尿酸水平和痛风石形成相关的疾病,对肾脏和泌尿系统会造成不同程度的损害,影响正常排尿功能,严重情况下患者可能因为肾功能衰竭而死亡。随着疾病的进展,痛风性关节炎还可导致血管发生不同程度的变化。日常生活中,一些患者可能同时存在高血压或糖尿病等疾病,从而可能影响整个循环系统,进而引发心脑血管疾病[2]。
我国新疆阿勒泰地处我国西北部,与蒙古和俄罗斯接壤,地理位置十分特殊。由于长期以来不同民族的聚居,这个地区形成了多民族、多文化相互交融的独特环境。因此,阿勒泰地区的饮食习惯和文化也呈现出多样性。其中,各个民族人民都有食用酸奶的传统习惯,在当地酸奶是一种非常普遍的乳制品。同时,由于阿勒泰地区地貌多样且复杂,夏季干热,冬季严寒,牲畜需要转场以适应不同季节的气候变化[3]。因此,当地的牧民们养成了夏季自制酸奶和发酵乳制品的习惯,以便在冬季储备食品。新疆地区的自然发酵酸奶具有丰富的营养价值和良好的保健功效。同时,酸奶中的发酵微生物具有抗性强、多样性好的特点,这使其具备了极高的价值和广泛的应用潜力[4]。因此,进一步开发和利用这些优势,对于酸奶产业的发展具有重要意义。
鼠李糖乳酪杆菌是一类有益的肠道菌,对预防和治疗胃肠道疾病具有积极作用。它可以帮助预防和缓解肠道感染、抗生素相关腹泻、肠炎、大肠癌和肠易激综合征等疾病[5]。补充鼠李糖乳酪杆菌对于维持肠道微生态健康和调节免疫应答具有帮助,它可以调节脾脏、肠道和肠系膜淋巴结的免疫反应。此外,鼠李糖乳酪杆菌的补充还可以降低肠道炎症水平,从而降低由肠炎引起的肠癌风险[6]。本团队从新疆阿勒泰地区采集到牧民自制的自然发酵酸奶,并从中分离鉴定到一株鼠李糖乳酪杆菌,并命名AFY05,前期试验显示该菌株在pH 3.0人工胃液中表现出了98.85%的存活率,具有很好的体外抗性。硫酸氨基葡萄糖是一种用于治疗和预防全身各个部位的骨关节炎的药物。本研究将其用作阳性对照,本研究的研究目的是验证鼠李糖乳酪杆菌AFY05对痛风性关节炎具有良好的干预效果,并且证明它是一种能有效预防和干预关节炎的益生菌。
1 材料与方法
1.1 材料与试剂
鼠李糖乳酪杆菌AFY05是本团队从新疆阿勒泰地区切木尔切克镇牧民家庭采集到的自然发酵酸奶中分离并鉴定出的一株乳酸菌,菌株经过16S rDNA测序鉴定为鼠李糖乳酪杆菌后命名为AFY05,然后该菌株被专利保藏于中国微生物菌种保藏管理委员会普通微生物中心,菌种保藏号是CGMCC No.27365。
SPF级6周龄雄性BALB/c小鼠,上海斯莱克实验动物有限责任公司,生产许可证号为SCXK(沪)2022-0004。本动物实验经重庆第二师范学院儿童健康与健康发展协同创新中心动物实验伦理委员会批准实施,批准号为2022070035B。
尿酸钠盐(2,6,8-三羟基嘌呤)、硫酸氨基葡萄糖,美国Sigma公司;苏木精-伊红染色试剂盒,上海碧云天生物科技有限公司;IL-6、IL-10、IL-1β、TNF-α ELISA试剂盒、实时定量检测试剂盒与反转录试剂盒、PCR引物,美国Thermo Fisher公司;骨髓过氧化物酶(marrow peroxidase,MPO)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(glutathione,GSH)活性检测试剂盒、丙二醛(malondialdehyde,MDA)含量测定试剂盒,南京建成科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DB026智能热板仪,北京智鼠多宝生物科技有限责公司;BX43显微镜,日本奥林巴斯公司;Nicolet Evolution 300紫外分光光度计、Stopone Plus实时荧光定量PCR仪,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 动物模型
小鼠被随机分为5组,分别为正常组、模型组、硫酸氨基葡萄糖(阳性对照)组、鼠李糖乳酪杆菌AFY05低浓度实验(AFY05-L)组、鼠李糖乳酪杆菌AFY05高浓度实验(AFY05-H)组,每组10只。正常组和模型组小鼠每日按0.1 mL/10 g bw剂量灌胃蒸馏水,硫酸氨基葡萄糖组小鼠按195 mg/kg bw剂量灌胃硫酸氨基葡萄糖,AFY05-L和AFY05-H组小鼠分别按108 CFU/kg bw和109 CFU/kg bw灌胃AFY05实验菌,持续7 d。然后所有实验小鼠被异氟烷麻醉后,正常组小鼠的右爪胫跗关节(踝关节)内被注射50 μL的PBS缓冲液。将尿酸钠盐50 mg加入PBS缓冲液1 mL中配制成混悬液,除模型组外其余小鼠右爪胫跗关节(踝关节)内被注射50 μL混悬液诱导痛风性关节炎。小鼠苏醒后,继续按前7 d灌胃样品的剂量继续灌胃对应样品7 d。
1.3.2 热板法测定疼痛阈值
实验最后一天采用热板法利用热刺激使小鼠体内产生疼痛感。小鼠被放置在55 ℃的热板上,以刺激其足部产生疼痛反应,观察记录小鼠舔脚的时间作为疼痛反应的指标。将5组小鼠分别置于热板上,分别观察每只小鼠舔右足的时间。
1.3.3 小鼠关节水肿的评价
热板测定小鼠痛阈值后所有小鼠休息6 h,然后采用颈椎脱臼法处死小鼠,然后使用数字卡尺测量右足踝部直径,来评估踝部水肿的程度。
1.3.4 小鼠踝关节组织氧化状态测定
称量0.1 g小鼠右足踝关节组织,并将其加入到0.9 mL生理盐水中进行混合。随后,将混合后的组织样本以4 000 r/min的转速进行离心,离心时间为10 min,以获取上清液。接下来,使用MPO、SOD、GSH和MDA检测试剂盒来测定组织匀浆上清液中的相关指标含量。
1.3.5 小鼠血清炎症细胞因子测定
采用眼眶取血法收集小鼠全血,取出的小鼠全血样本在4 ℃下以4 000 r/min的转速离心10 min获得上层血清。采用IL-6、IL-10、IL-1β、TNF-α ELISA试剂盒测定血清相关炎症指标。
1.3.6 小鼠组织病理学观察
取出小鼠踝关节部位组织然后用10%多聚甲醛固定,再用由浓盐酸、福尔马林和蒸馏水(体积比为10∶9∶81)混合成的脱钙固定液脱钙20 d。经过以上程序处理的踝关节组织样品经过石蜡包埋、切片,并进行苏木精-伊红(H&E)染色,之后使用光学显微镜观察组织进行病理学变化的分析。
1.3.7 小鼠踝关节组织中mRNA表达的测定
称量1 g的踝关节组织,将踝关节组织置于容器中,加入9 mL生理盐水,进行均匀混合。然后,加入1 mL的RNAzol溶液,用于提取小鼠踝关节组织中的RNA。使用超微分光光度法测定在260 nm和280 nm处的吸光度值,以计算RNA的纯度和浓度,并将RNA的质量浓度调整为1 μg/μL。然后,将经过反转录的cDNA生成,配制含有1 μL cDNA的反应体系。其他试剂包括10 μL SYBR Green PCR Master Mix,7 μL无菌蒸馏水,上下游各1 μL引物(表1)溶液。将混合溶液放入定量PCR仪中进行反应,反应条件为95 ℃持续60 s;95 ℃持续15 s,进行40个循环;55 ℃持续30 s;72 ℃持续35 s;95 ℃持续30 s;55 ℃持续35 s。最后以GAPDH作为内参,按照2-ΔΔCt法对待测基因进行分析[7]。
表1 本实验中使用的引物序列
Table 1 Primer sequences used in this experiment

基因名称引物序列ERK1/2上游序列:5′-TCAAGCCTTCCAACCTC-3′下游序列:5′-GCAGCCCACAGACCAAA-3′COX-2上游序列:5′-CATCCCCTTCCTGCGAAGTT-3′下游序列:5′-CATGGGAGTTGGGCAGTCAT-3′PGE2上游序列:5′-TGGAGGTGAATCCCGTGAGA-3′下游序列:5′-AAACTCGGTCACCTCCTTGC-3′IL-6上游序列:5′-ATGAAGTTCCTCTCTGCAA-3′下游序列:5′-AGTGGTATCCTCTGTGAAG-3′IFN-γ上游序列:5′-GCTTTGCAGCTCTTCCTCAT-3′下游序列:5′-GTCACCATCCTTTTGCCAGT-3′TNF-α上游序列:5′-ATGGGGGGCTTCCAGAA-3′下游序列:5′-CCTTTGGGGACCGATCA-3′Cu/Zn-SOD上游序列:5′-AACCAGTTGTGTTGTCAGGAC-3′下游序列:5′-CCACCATGTTTCTTAGAGTGAGG-3′Mn-SOD上游序列:5′-CAGACCTGCCTTACGACTATGG-3′下游序列:5′-CTCGGTGGCGTTGAGATTGTT-3′CAT上游序列:5′-GGAGGCGGGAACCCAATAG-3′下游序列:5′-GTGTGCCATCTCGTCAGTGAA-3′GAPDH上游序列:5′-AGGTCGGTGTGAACGGATTTG-3′下游序列:5′-GGGGTCGTTGATGGCAACA-3′
1.4 数据分析
所有实验实施3次平行测定,计算平均值作为结果,并计算出标准偏差。实验结果以平均值±标准偏差的形式表示。同时,使用单因素方差分析测试各组数据之间是否有显著差异(P<0.05)。
2 结果与分析
2.1 小鼠踝关节水肿程度
由图1可知,模型组的踝关节肿胀程度最大,硫酸氨基葡萄糖和AFY05菌能够显著(P<0.05)减轻关节炎造成的轻踝关节肿胀程度,且高浓度AFY05菌的效果最好。
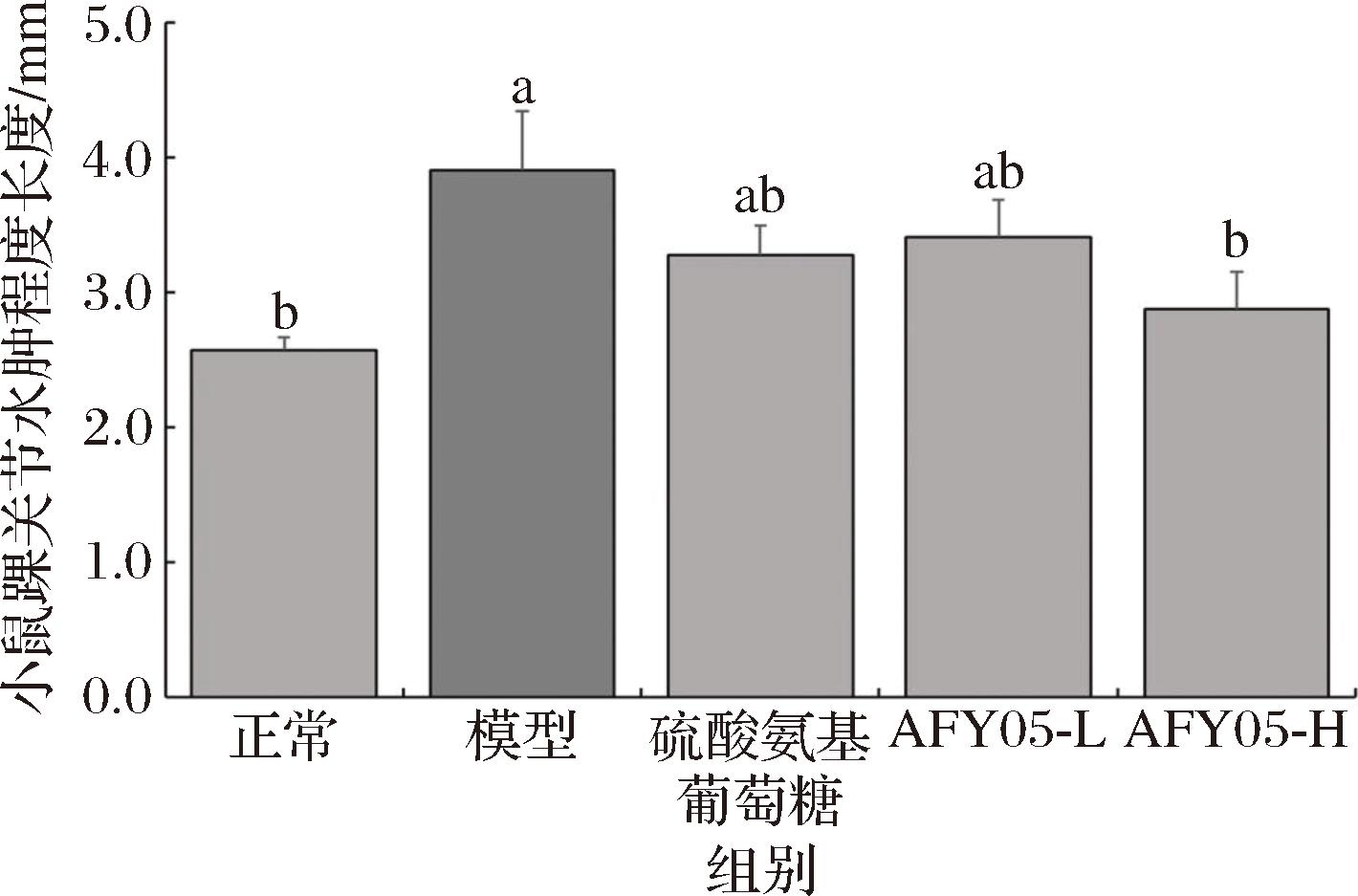
图1 各组小鼠踝关节水肿程度
Fig.1 The degree of ankle joint swelling in each group of mice
注:相同小写字母表示对应两组之间没有显著差异,不同小写字母表示对应两组之间有显著差异(P<0.05)(下同)。
2.2 小鼠痛阈
由图2可知,正常组小鼠的痛阈值(时间)最长,而模型组小鼠最短。相较于模型组,硫酸氨基葡萄糖和AFY05菌能够显著(P<0.05)提高小鼠的痛阈值,且高浓度AFY05菌(AFY05-H)提升痛阈值的效果强于硫酸氨基葡萄糖和低浓度的AFY05菌(AFY05-L)。
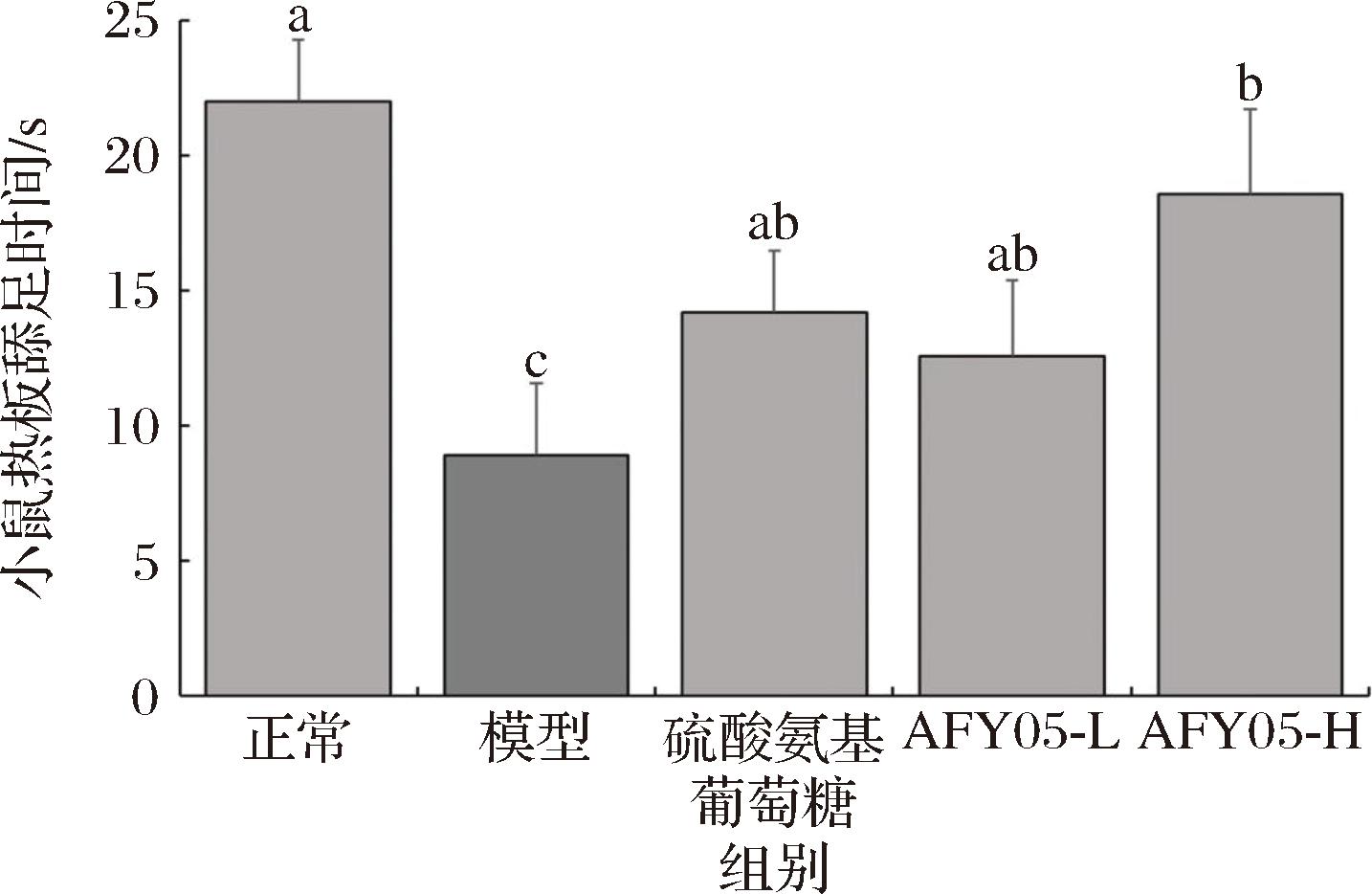
图2 各组小鼠痛阈的情况
Fig.2 The pain threshold of each group of mice
2.3 小鼠踝关节组织的MPO、SOD酶活力和GSH、MDA水平
由表2可知,正常组小鼠踝关节组织的MPO酶活力和MDA水平最低,而SOD酶活力和GSH水平最高。模型组小鼠显示出了相反的趋势,踝关节组织的MPO酶活力和MDA水平最高,而SOD酶活力和GSH水平最低。经过硫酸氨基葡萄糖和AFY05菌灌胃,关节炎小鼠踝关节组织的MPO酶活力和MDA水平下降,而SOD酶活力和GSH水平增加,且高浓度AFY05菌(AFY05-H)的效果最为明显。
表2 小鼠踝关节组织的MPO、SOD、GSH酶活力和MDA水平
Table 2 The activities of MPO,SOD,GSH enzyme,and the level of MDA in mouse ankle joint tissue
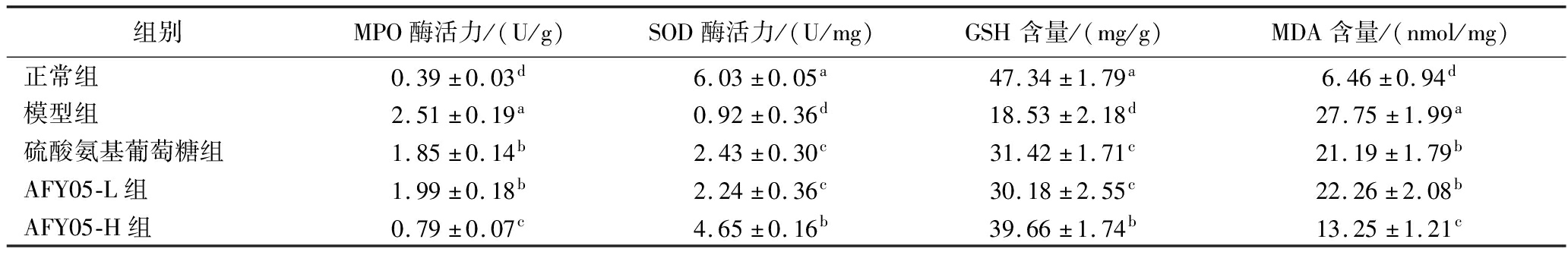
组别MPO酶活力/(U/g)SOD酶活力/(U/mg)GSH含量/(mg/g)MDA含量/(nmol/mg)正常组0.39±0.03d6.03±0.05a47.34±1.79a6.46±0.94d模型组2.51±0.19a0.92±0.36d18.53±2.18d27.75±1.99a硫酸氨基葡萄糖组1.85±0.14b2.43±0.30c31.42±1.71c21.19±1.79bAFY05-L组1.99±0.18b2.24±0.36c30.18±2.55c22.26±2.08bAFY05-H组0.79±0.07c4.65±0.16b39.66±1.74b13.25±1.21c
注:相同小写字母表示对应两组之间没有显著差异,不同小写字母表示对应两组之间有显著差异(P<0.05)(下同)。
2.4 小鼠血清的IL-6、IL-10、IL-1β、TNF-α的细胞因子水平
由表3可知,正常组小鼠血清的IL-6、IL-1β、TNF-α的细胞因子水平最低,诱导关节炎小鼠(模型组)踝关节组织的IL-6、IL-1β、TNF-α的细胞因子水平显著上升(P<0.05),硫酸氨基葡萄糖和AFY05菌可以抑制IL-6、IL-1β、TNF-α细胞因子水平的上升,且高浓度AFY05菌(AFY05-H)的抑制效果最好。同时,正常组小鼠的IL-10细胞因子水平最高,模型组最低;相比模型组,AFY05菌和硫酸氨基葡萄糖能够提升小鼠血清的IL-10水平,且AFY05-H效果最好。
表3 小鼠血清的IL-6、IL-10、IL-1β、TNF-α的细胞因子水平
Table 3 The cytokine levels of IL-6,IL-10,IL-1β,and TNF-α in mouse serum
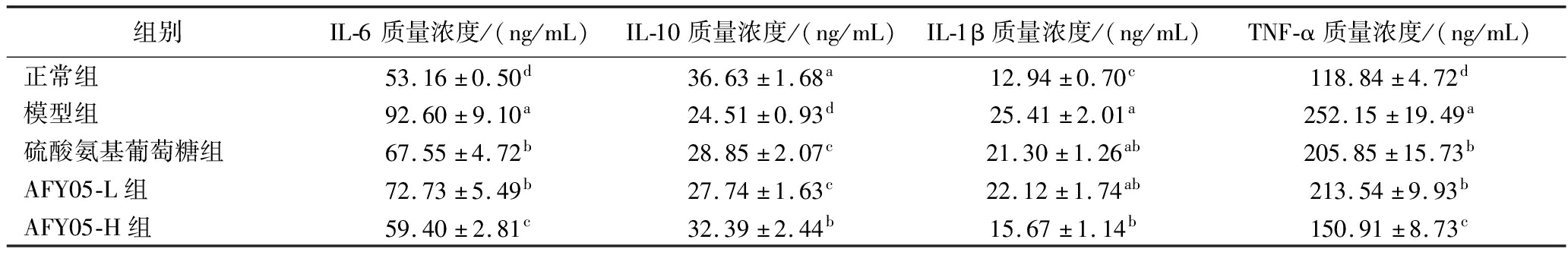
组别IL-6质量浓度/(ng/mL)IL-10质量浓度/(ng/mL)IL-1β质量浓度/(ng/mL)TNF-α质量浓度/(ng/mL)正常组53.16±0.50d36.63±1.68a12.94±0.70c118.84±4.72d模型组92.60±9.10a24.51±0.93d25.41±2.01a252.15±19.49a硫酸氨基葡萄糖组67.55±4.72b28.85±2.07c21.30±1.26ab205.85±15.73bAFY05-L组72.73±5.49b27.74±1.63c22.12±1.74ab213.54±9.93bAFY05-H组59.40±2.81c32.39±2.44b15.67±1.14b150.91±8.73c
2.5 小鼠踝关节组织的病理学观察
由图3可知,模型组的踝关节切片中存在明显增加的炎症细胞浸润,而硫酸氨基葡萄糖和AFY05菌的作用,关节炎小鼠炎症水平得到了显著的控制,炎症细胞浸润也有所降低,随着AFY05菌剂量的增加对踝关节炎症的抑制效果也越好,且AFY05-H的效果优于硫酸氨基葡萄糖。
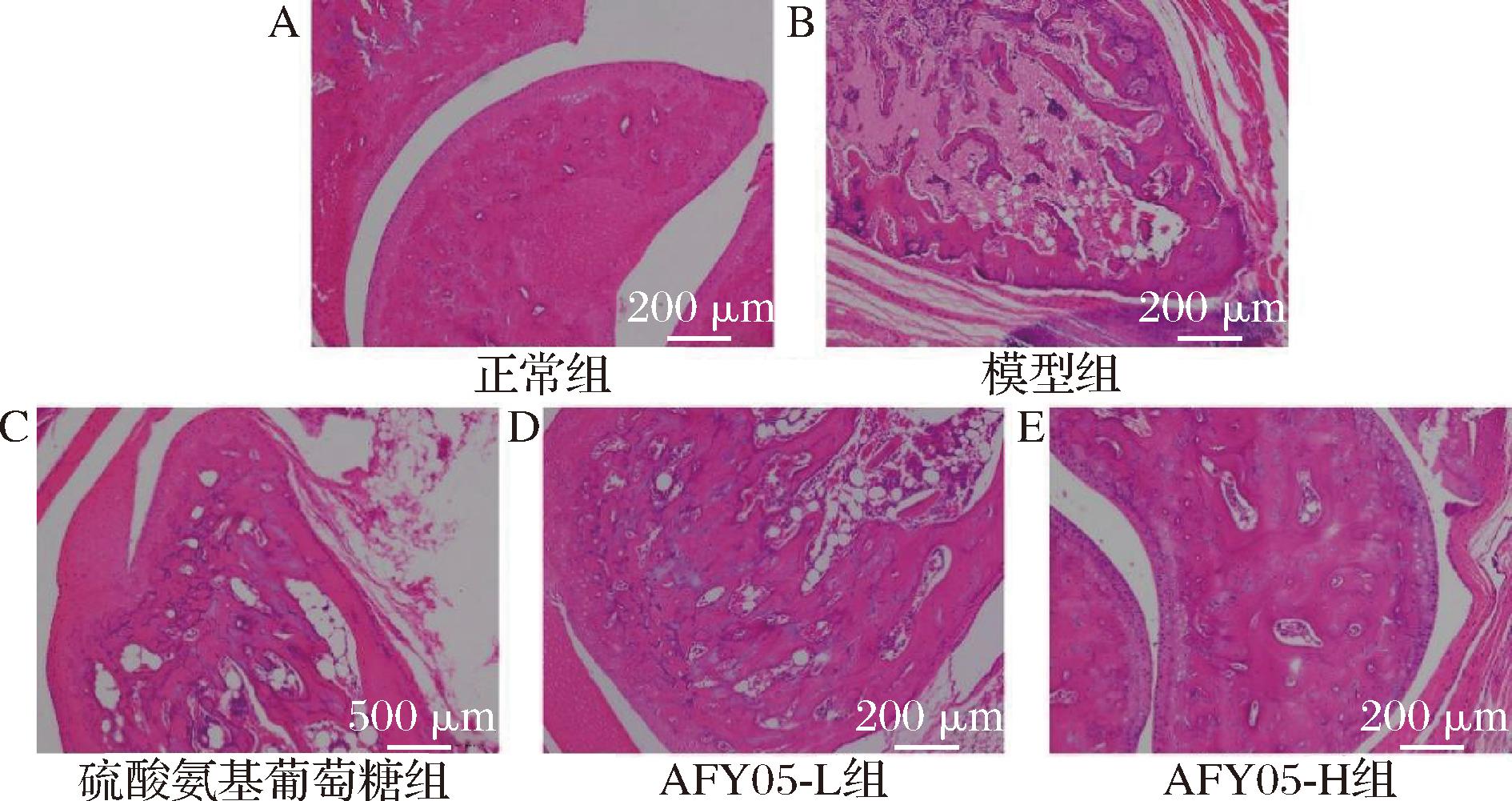
A-正常组;B-模型组;C-硫酸氨基葡萄糖组;D-AFY05-L组;E-AFY05-H组
图3 小鼠踝关节病理学观察(100×)
Fig.3 The pathological observation of mouse ankle joint (100×)
2.6 小鼠踝关节组织的mRNA表达
由图4可知,模型组小鼠踝关节组织的细胞外调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、环氧合酶-2(cyclooxygenase-2,COX-2)、前列腺素E2(prostaglandin E2,PGE2)、IL-6、干扰素-γ(interferon γ,IFN-γ)和TNF-α的mRNA表达最强,而正常组小鼠相应表达最弱。硫酸氨基葡萄糖和AFY05菌可以下调关节炎小鼠踝关节组织的ERK1/2、COX-2、PGE2、IL-6、IFN-γ和TNF-α表达,且AFY05菌下调ERK1/2、COX-2和PGE2表达的能力最强。同时,正常组小鼠踝关节组织显示出最强的Cu/Zn-SOD、Mn-SOD和过氧化氢酶(catalase,CAT)的mRNA表达,这些表达在模型组中表现得最弱,相对模型组AFY05菌可以上调Cu/Zn-SOD、Mn-SOD和CAT的表达,且AFY05-H组的表达强度强于AFY05-L组和硫酸氨基葡萄糖组。
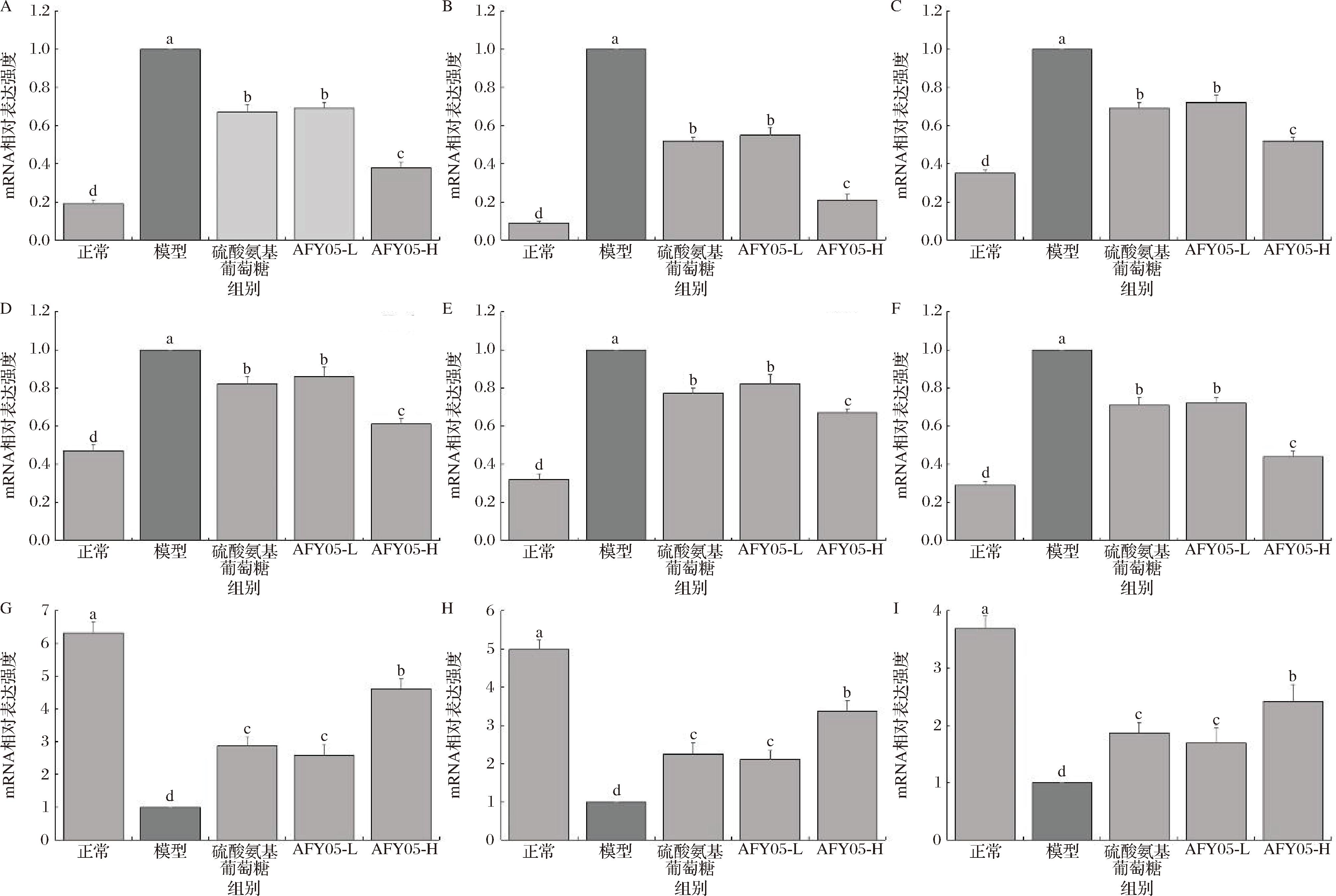
A-ERK1/2;B-PGE2;C-COX-2;D-IL-6;E-IFN-γ;F-TNF-α;G-Cu/Zn-SOD;H-Mn-SOD;I-CAT
图4 小鼠踝关节组织的mRNA表达
Fig.4 mRNA expression in mouse ankle joint tissue
3 讨论
痛风性关节炎表现为突然出现的、剧烈的关节疼痛,导致关节囊、滑囊、软骨、骨质和其他组织局部出现炎症反应。同时,痛风性关节炎急性发作期间的关节损伤与炎症的激活以及各种氧自由基的产生和氧化应激反应的激活密切相关。不同免疫和炎症过程是高水平氧自由基的主要来源。因此调控机体的炎症反应和氧化应激过程将有可能对关节炎起到关键作用[8]。肠道菌群及其代谢产物在宿主免疫系统中起着至关重要的作用。肠道菌群与机体内炎症和氧化应激失衡密切相关,并与关节炎的发生和发展有密切关系[9]。临床研究发现,关节炎患者肠道微生物的数量和种类与健康人群相比发生了明显变化。肠道菌群失调会导致关节炎的发生和发展,同时关节炎的持续进展又进一步加剧了肠道菌群的失调,两者相互影响且相互作用[10]。研究发现,肠道微生物能够通过多种方式影响宿主的免疫功能,包括调节免疫细胞分化、利用分子模拟机制以及诱导炎症介质产生。这些作用可能会导致自身免疫性疾病的发生。一些方法,如益生菌和粪便微生物移植,可以恢复正常的肠道菌群,改善菌群不平衡,并且可能预防关节炎的发病和进展,甚至可能改善关节炎相关症状[11]。
关节炎急性活动期表现为关节肿胀、疼痛和活动受限。为了评估关节炎的程度,较多研究均采用了观察实验动物足部肿胀和痛阈值的方法[12]。因此,本研究也通过直观测定小鼠足部肿胀程度,并利用热板仪测定小鼠的痛阈值。实验结果也反映出鼠李糖乳酪杆菌AFY05能够有效预防急性关节炎造成的小鼠足肿胀和痛阈值下降。
MPO具有氧化剂的性质,可以引发氧化应激反应,并造成氧自由基的产生。氧自由基能够造成细胞和组织的氧化损伤,导致关节组织的炎症和损伤加重。此外,MPO还可以诱导炎症细胞激活并产生一系列的炎症介质,如细胞因子和趋化因子,进一步加剧关节炎的炎症反应。在关节炎中,炎症反应的存在会导致氧化应激,即细胞内氧自由基生成过多,超过了细胞自身的抗氧化能力。这些氧自由基可以对关节组织造成损伤,引发关节炎的炎症和疼痛[13]。SOD和GSH都有助于清除氧自由基,减轻氧化应激的程度,保护关节组织免受氧自由基的损伤[14]。在关节炎中,炎症反应和氧化应激都可以导致脂质过氧化的增加,进而产生更多的MDA。MDA的过量积累可能对关节组织产生负面影响,引发关节炎的症状和炎症反应的加剧。此外,MDA还可以激活炎性细胞和介质的产生,促进对骨骼、软骨和关节组织的破坏[15]。实验结果显示鼠李糖乳酪杆菌AFY05具备的氧化应激能力也可能是预防急性关节炎的重要手段。
炎症细胞因子在机体组织损伤中起着关键作用,人体发生病变引发组织氧化和炎症,机体在氧化应激损伤过程中释放各种炎症介质。包括IL-6、IL-10、IL-1β、TNF-α在内的促炎细胞因子异常增加,有加剧机体组织损伤的进展[16]。IL-6是一种在炎症过程中发挥重要作用的细胞因子。IL-6能够刺激滑膜细胞和其他炎症细胞产生炎症介质,如IL-1β、TNF-α等,导致关节炎炎症反应的加剧。此外,IL-6还可以促进滑膜细胞的增殖和血管生成,进一步加重关节组织的炎症和破坏。IL-6还参与调节免疫细胞的分化和功能,包括对T细胞、B细胞和巨噬细胞的影响。在关节炎中,过度产生的IL-6可以激活和增殖炎症性T细胞和B细胞,引发免疫反应和自身抗体的生成,从而加剧关节炎的发展[17]。IL-10是一种抗炎细胞因子,其主要功能是抑制炎症反应和调节免疫系统的平衡。IL-10可以抑制包括IL-1β和TNF-α在内的炎症介质的产生和炎症反应的加剧,从而减轻关节炎的症状和炎症程度。同时,IL-10的缺乏可能导致免疫细胞的过度活化和炎症反应的持续性,从而加剧关节炎的进展[16]。IL-1β在关节炎发病过程中发挥着重要的作用,能够引发炎症反应并促进关节内炎症细胞的活化和增殖。IL-1β可以刺激炎症反应并促使关节滑膜细胞和软骨细胞释放引起炎症的其他细胞因子,如TNF-α和IL-6。这些炎症因子进一步导致关节内的炎症反应加剧,引起关节肿胀、疼痛和功能障碍。此外,IL-1β还能够促进关节内骨质疏松和软骨损伤,导致关节破坏和损伤的进一步加重[18]。TNF-α可刺激炎症反应,使炎症细胞聚集于关节部位,并促进炎症细胞的活化和增殖。它可以刺激关节滑膜细胞和软骨细胞产生其他炎症介质,如IL-1β、IL-6和IL-8,进一步加剧关节内的炎症反应,并引起关节肿胀、疼痛和功能障碍[19]。本研究的实验结果也显示鼠李糖乳酪杆菌AFY05具有调控炎症细胞因子的效果,从而发挥预防急性关节炎的功效。
ERK1/2信号通路和COX-2/PGE2通路之间存在相互作用。ERK1/2被活化后,可以直接或间接调控COX-2的表达和活性,进而影响PGE2的合成。ERK1/2是一种被广泛研究的细胞信号传导分子,参与调控细胞增殖、分化和炎症反应等多种生物过程。在关节炎中,ERK1/2的活化水平常常会显著增加,这可能与炎症细胞的增殖、炎症介质的合成以及关节组织的破坏有关[20]。COX-2是一种关键的酶,参与合成炎症反应中的前列腺素类物质,其中PGE2是其中的重要代表。关节炎炎症过程中,COX-2的表达常常会增加,从而导致PGE2的合成增加[21]。PGE2在关节炎中起到促炎作用,可以引起关节炎疼痛、炎症细胞的活化和骨骼破坏等病理过程[22]。IFN-γ可以刺激炎症细胞产生导致关节炎症状的炎症介质,如肿TNF-α、IL-1以及多种趋化因子等。这些炎症介质可以引起关节炎的炎症反应和组织损伤。IFN-γ在炎症反应中扮演着重要的角色,它能够调控炎症细胞的功能和促进炎症介质的产生,从而影响关节炎的发展[23]。Cu/Zn-SOD和Mn-SOD是主要的抗氧化酶,它们参与细胞内清除超氧离子的过程,维持细胞的氧化稳态。Cu/Zn-SOD主要存在于胞浆中,而Mn-SOD主要存在于线粒体中。炎症引发的氧化应激是关节炎发展中的重要机制之一,Cu/Zn-SOD和Mn-SOD的活性上升能够抑制细胞内超氧离子的积累,减轻氧化应激和炎症反应,从而预防和干预关节炎[24]。CAT主要存在于细胞质中,它是清除细胞内过氧化氢的重要酶。过氧化氢也是关节炎引发氧化应激的主要产物之一,在高浓度下可以导致关节的脂质过氧化和蛋白质的氧化损伤[25]。鼠李糖乳酪杆菌AFY05对关节组织mRNA的有效调节作用能够使这些关节炎相关的表达向有利于机体恢复的趋势转变,起到调控急性关节炎的作用在本研究中,经过尿酸钠盐诱导后,除正常组外其余各组小鼠成功诱导踝关节关节炎。鼠李糖乳酪杆菌AFY05能够减轻小鼠踝关节的肿胀程度和减轻痛楚。对血清和组织的观察发现鼠李糖乳酪杆菌AFY05可以抑制踝关节的炎症和氧化损伤。进一步的mRNA表达实验观察到AFY05菌可以从分子层面抑制关节炎造成的踝关节肿痛。由此可见,鼠李糖乳酪杆菌AFY05是一株对痛风性关节炎有良好干预效果的益生菌。实验结果为调控关节炎的优质益生菌的开发提供了参考,有助于打造具有自主知识产权的益生菌产品。但是这些结果还需要进一步的临床研究来验证,未来也需要对鼠李糖乳酪杆菌AFY05进行更加深入的探索。
[1] WILSON L,SASEEN J J.Gouty arthritis:A review of acute management and prevention[J].Pharmacotherapy,2016,36(8):906-922.
[2] ZAFARI P,ZARIFIAN A,ALIZADEH-NAVAEI R,et al.Asymmetric and symmetric dimethylarginine concentration as an indicator of cardiovascular diseases in rheumatoid arthritis patients:A systematic review and meta-analysis of case-control studies[J].Clinical Rheumatology,2020,39(1):127-134.
[3] 刘俊峰,尹雪,郭雪峰.新疆阿勒泰地区酸奶疙瘩中乳酸菌的分离和鉴定[J].中国酿造,2017,36(9):116-119.LIU J F,YIN X,GUO X F.Isolation and identification of lactic acid bacteria in yogurt pimple from Aletai prefecture of Xinjiang[J].China Brewing,2017,36(9):116-119.
[4] ZHAO X,YI R K,ZHOU X R,et al.Preventive effect of Lactobacillus plantarum KSFY02 isolated from naturally fermented yogurt from Xinjiang,China,on D-galactose-induced oxidative aging in mice[J].Journal of Dairy Science,2019,102(7):5899-5912.
[5] NIU Z H,ZOU M J,BEI T T,et al.Effect of fructooligosaccharides on the colonization of Lactobacillus rhamnosus AS 1.2466T in the gut of mice[J].Food Science and Human Wellness,2023,12(2):607-613.
[6] ROLLER M,PIETRO FEMIA A,CADERNI G,et al.Intestinal immunity of rats with colon cancer is modulated by oligofructose-enriched inulin combined with Lactobacillus rhamnosus and Bifidobacterium lactis[J].The British Journal of Nutrition,2004,92(6):931-938.
[7] ZHOU X R,DU H H,JIANG M Q,et al.Antioxidant effect of Lactobacillus fermentum CQPC04-fermented soy milk on D-galactose-induced oxidative aging mice[J].Frontiers in Nutrition,2021,8:727467.
[8] UMAR S,ZARGAN J,UMAR K,et al.Modulation of the oxidative stress and inflammatory cytokine response by thymoquinone in the collagen induced arthritis in Wistar rats[J].Chemico-Biological Interactions,2012,197(1):40-46.
[9] 刘雪梅,于泓.肠道菌群在类风湿关节炎治疗中的研究进展[J].医学综述,2019,25(4):711-715;721.LIU X M,YU H.Research progress of intestinal flora in treatment of rheumatoid arthritis[J].Medical Recapitulate,2019,25(4):711-715;721.
[10] 方勇飞,刘晓飞.肠道菌群失调与类风湿关节炎发病及疾病进展的相关性[J].西部医学,2017,29(11):1485-1487;1491.FANG Y F,LIU X F.Progress of intestinal flora in the pathogenesis of rheumatoid arthritis[J].Northwest Pharmaceutical Journal,2017,29(11):1485-1487;1491.
[11] TERANAKA K,SAKAMOTO J,KONDO Y,et al.Effects of immobilization and low-intensity isotonic muscle contractions on swelling and pain threshold in a model of rat experimental arthritis[J].PAIN RESEARCH,2014,29(3):151-160.
[12] EDWARDS S W,HUGHES V,BARLOW J,et al.Immunological detection of myeloperoxidase in synovial fluid from patients with rheumatoid arthritis[J].The Biochemical Journal,1988,250(1):81-85.
[13] WETSCHER G J,HINDER P R,BAGCHI D,et al.Free radical scavengers prevent reflux esophagitis in rats[J].Digestive Diseases and Sciences,1995,40(6):1292-1296.
[14] 袁望舒,陈丽霞,刘淑芬.负重游泳运动对膝骨性关节炎大鼠关节软骨及血清超氧化物歧化酶和丙二醛的影响[J].中华物理医学与康复杂志,2014,36(2):81-85.YUAN W S,CHEN L X,LIU S F.The effects of loaded swimming exercise on articular cartilage and serum SOD and MDA in osteoarthritic knees[J].Chinese Journal of Physical Medicine and Rehabilitation,2014,36(2):81-85.
[15] TRIPATHY A S,VISHWAKARMA S,TRIMBAKE D,et al.Pro-inflammatory CXCL-10,TNF-α,IL-1β,and IL-6:Biomarkers of SARS-CoV-2 infection[J].Archives of Virology,2021,166(12):3301-3310.
[16] GOTTENBERG J E,DAYER J M,LUKAS C,et al.Serum IL-6 and IL-21 are associated with markers of B cell activation and structural progression in early rheumatoid arthritis:Results from the ESPOIR cohort[J].Annals of the Rheumatic Diseases,2012,71(7):1243-1248.
[17] CZERNY B,KAMINSKI A,KURZAWSKI M,et al.The association of IL-1beta,IL-2,and IL-6 gene polymorphisms with bone mineral density and osteoporosis in postmenopausal women[J].European Journal of Obstetrics,Gynecology,and Reproductive Biology,2010,149(1):82-85.
[18] REDLICH K,HAYER S,RICCI R,et al.Osteoclasts are essential for TNF-α-mediated joint destruction[J].The Journal of Clinical Investigation,2002,110(10):1419-1427.
[19] MAROTTE H,AHMED S,RUTH J H,et al.Blocking ERK-1/2 reduces tumor necrosis factor α-induced interleukin-18 bioactivity in rheumatoid arthritis synovial fibroblasts by induction of interleukin-18 binding protein A[J].Arthritis &Rheumatism,2010,62(3):722-731.
[20] KUMAR V,AL-ABBASI F A,AHMED D,et al.Paederia foetida Linn.inhibits adjuvant induced arthritis by suppression of PGE2 and COX-2 expression via nuclear factor-κB[J].Food &Function,2015,6(5):1652-1666.
[21] BOUFFI C,BONY C,COURTIES G,et al.IL-6-dependent PGE2 secretion by mesenchymal stem cells inhibits local inflammation in experimental arthritis[J].PLoS One,2010,5(12):e14247.
[22] JUSTA S,ZHOU X Q,SARKAR S.Endogenous IL-22 plays a dual role in arthritis:Regulation of established arthritis via IFN-γ responses[J].PLoS One,2014,9(3):e93279.
[23] KURZ B,JOST B,SCHÜNKE M.Dietary vitamins and selenium diminish the development of mechanically induced osteoarthritis and increase the expression of antioxidative enzymes in the knee joint of STR/1 N mice[J].Osteoarthritis and Cartilage,2002,10(2):119-126.
[24] SEN R T,DAS D,BISHAYI B.Staphylococcal catalase regulates its virulence and induces arthritis in catalase deficient mice[J].Indian Journal of Physiology and Pharmacology,2009,53(4):307-317.
[25] KORIEM K M M,SELIM A Y,MAZEN R A.N-acetylcysteine-amide improves tissue oxidative stress,DNA damage,and proteins disappearance in methamphetamine toxicity more efficiently than N-acetyl-L-cysteine[J].Toxicologie Analytique et Clinique,2021,33(2):123-135.