短链脂肪酸(short-chain fatty acids,SCFAs)是指含6个碳原子以下的脂肪酸,主要包括乙酸、丙酸、丁酸、戊酸及异戊酸等;其中,乙酸、丙酸和丁酸是肠道产生的主要SCFAs,分别以3∶1∶1的摩尔比混合存在于肠道中[1]。大多数SCFAs是在肠道中产生并被利用的,主要由厌氧菌产生,并以直链和支链形式存在[2];SCFAs可以通过直接影响细胞活性和功能来降低患心血管疾病、糖尿病和结肠癌的风险[3-4],在维持肠道屏障完整性、减轻炎症反应、提供结肠细胞能量等生理过程中发挥重要作用[5];同时,作为肠道菌群与神经系统的信号调控分子,在微生物-肠-脑通讯过程中也具有重要作用[6]。
SCFAs具有较低的相对分子量,比其他脂肪酸更容易在肠道中被消化和吸收。在正常生理条件下,SCFAs以离子和非离子形式通过3种途径被人体肠上皮细胞顶膜吸收至细胞内[6]:a)以SCFA-形式与![]() 等比例交换吸收;b)以SCFA-形式分别通过单羧酸转运蛋白(monocarboxylate transporter 1,MCT1)和Na+耦合单羧酸转运蛋白-1(sodium-coupled monocarboxylate transporter,SMCT1)2种转运蛋白转运吸收;c)以非离子短链脂肪酸(non-dissociated short-chain fatty acids,HSCFA)形式的非离子扩散吸收;非离子的SCFA可通过与H+结合后在肠上皮细胞顶膜被细胞吸收,同时释放出的H+会激活细胞膜的Na+/H+交换泵(Na+-H+ exchanger 3,NHE3),来保持细胞内外pH的稳定[7];进而表明NHE3的表达与细胞吸收SCFAs密切相关。最后,被肠上皮细胞吸收的SCFAs会通过其基底侧进入淋巴和血管被机体吸收利用,同时,还可以通过门静脉进入肝脏,为肝细胞能量代谢提供底物[8]。
等比例交换吸收;b)以SCFA-形式分别通过单羧酸转运蛋白(monocarboxylate transporter 1,MCT1)和Na+耦合单羧酸转运蛋白-1(sodium-coupled monocarboxylate transporter,SMCT1)2种转运蛋白转运吸收;c)以非离子短链脂肪酸(non-dissociated short-chain fatty acids,HSCFA)形式的非离子扩散吸收;非离子的SCFA可通过与H+结合后在肠上皮细胞顶膜被细胞吸收,同时释放出的H+会激活细胞膜的Na+/H+交换泵(Na+-H+ exchanger 3,NHE3),来保持细胞内外pH的稳定[7];进而表明NHE3的表达与细胞吸收SCFAs密切相关。最后,被肠上皮细胞吸收的SCFAs会通过其基底侧进入淋巴和血管被机体吸收利用,同时,还可以通过门静脉进入肝脏,为肝细胞能量代谢提供底物[8]。
当由肠道病原菌引起肠道微生态紊乱时,会影响食物在肠道中的消化代谢,造成肠道中CO2及![]() 的浓度发生较大的变化[9],从而影响SCFA-与
的浓度发生较大的变化[9],从而影响SCFA-与![]() 等比例交换吸收;同时,还会造成肠道内pH和H+浓度的变化[9-11],改变细胞膜电位的超极化和去极化,进而通过影响SMCT1对SCFA-的亲和力导致细胞对SCFA-的吸收异常[12];而肠道微生态的紊乱还会通过下调细胞中MCT1和NHE3的表达[13-14]来影响肠道对SCFA-和HSCFA的吸收。因此,肠道微生态的紊乱会造成机体对SCFAs的吸收异常,但并不会改变机体对SCFAs的吸收方式。而机体异常吸收SCFAs会导致其营养物质代谢紊乱、加速肠上皮细胞的凋亡,增加高血压、肥胖等风险[15-16]。越来越多的研究表明,益生菌不仅可以调节肠道微生态平衡[17],还能够促进肠上皮细胞对SCFAs的吸收[18];前期的研究也发现,植物乳杆菌能够促进肠上皮细胞对SCFAs的吸收[19]。但是,目前的研究只报道了益生菌能够通过调控单个SCFAs转运体的表达来促进细胞对单个SCFAs的吸收,而益生菌能否通过同时调控多个SCFAs转运体的表达,来促进细胞对多个SCFAs的吸收以及是否具有抑制作用还尚不清楚。
等比例交换吸收;同时,还会造成肠道内pH和H+浓度的变化[9-11],改变细胞膜电位的超极化和去极化,进而通过影响SMCT1对SCFA-的亲和力导致细胞对SCFA-的吸收异常[12];而肠道微生态的紊乱还会通过下调细胞中MCT1和NHE3的表达[13-14]来影响肠道对SCFA-和HSCFA的吸收。因此,肠道微生态的紊乱会造成机体对SCFAs的吸收异常,但并不会改变机体对SCFAs的吸收方式。而机体异常吸收SCFAs会导致其营养物质代谢紊乱、加速肠上皮细胞的凋亡,增加高血压、肥胖等风险[15-16]。越来越多的研究表明,益生菌不仅可以调节肠道微生态平衡[17],还能够促进肠上皮细胞对SCFAs的吸收[18];前期的研究也发现,植物乳杆菌能够促进肠上皮细胞对SCFAs的吸收[19]。但是,目前的研究只报道了益生菌能够通过调控单个SCFAs转运体的表达来促进细胞对单个SCFAs的吸收,而益生菌能否通过同时调控多个SCFAs转运体的表达,来促进细胞对多个SCFAs的吸收以及是否具有抑制作用还尚不清楚。
已有研究通过建立肠道吸收单个SCFAs(丙酸或丁酸)模型来探究乳酸菌对单个SCFAs的促吸收作用[19-20],而乙酸、丙酸和丁酸是以混合物的形式存在于机体内肠道内;同时,肠上皮Caco-2细胞在吸收SCFAs后,还会通过其基底侧转运到其他器官[8];因此,通过建立肠道吸收混合SCFAs(乙酸、丙酸和丁酸)模型,并测定模型中肠上皮Caco-2细胞内和模型基底侧培养液中SCFAs的含量来研究植物乳杆菌对细胞吸收和转运SCFAs的调控作用,从而更好地模拟机体肠道吸收SCFAs的过程。同时,还通过测定细胞中SCFAs转运体的蛋白和基因表达水平,来探究菌株对肠道吸收SCFAs可能的调控机制,为具有改善机体吸收SCFAs的功能益生菌筛选及其制品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌f28、f2、f5、f16和f19分离自广西巴马长寿地区人群肠道,由江苏省益生菌与乳品深加工重点实验室提供;人源结肠癌细胞Caco-2细胞株,由中国科学院上海生命科学研究院细胞资源中心提供。
MEM培养液(minimum essential medium,MEM) 武汉普诺赛生命科技有限公司;澳洲特级胎牛血清,美国CLARK Bioscience公司;细胞活力/毒性检测试剂盒(cell counting Kit 8,CCK-8),上海东仁化学科技有限公司;苯酚红,BBI生命科学有限公司;乙酸标准溶液(纯度为99.55%)、丙酸标准溶液(纯度为99.49%)、丁酸标准溶液(纯度为99.7%),英国LGC有限公司;12孔Transwell板,美国Corning公司;RNA抽提试剂盒,上海生工生物工程股份有限公司;反转录PCR试剂盒,南京诺唯赞生物科技股份有限公司;荧光定量PCR试剂盒,南京诺唯赞生物科技股份有限公司;兔抗MCT1、SMCT1多克隆抗体,武汉博士德生物工程有限公司;鼠抗NHE3单克隆抗体,武汉三鹰生物技术有限公司。
1.2 仪器与设备
HERACELL型CO2培养箱、1510型多功能酶标仪,美国塞默飞世尔科技有限公司;IC1000型细胞计数仪,上海睿钰生物科技有限公司;IX2-ILL100型荧光倒置显微镜,日本OLYMPUS公司;SU8020型扫描电镜、HT7800型透射电镜,日本日立公司;Alilent 7890A/5975C型气质联用仪、Agilent DB-WAX型色谱柱,美国安捷伦公司。
1.3 实验方法
1.3.1 肠上皮Caco-2细胞的培养
肠上皮Caco-2细胞解冻后移至离心管中,加入3.0 mL MEM完全培养基(含80% MEM培养液和20%优质胎牛血清),1 000×g离心5 min,弃液体;加入1.0 mL MEM完全培养基,移液枪吹打使其均匀重悬,然后移至含有5.0 mL MEM完全培养基的细胞培养瓶中,置于37 ℃、5% CO2的培养箱中培养;之后24 h内更换1次培养液,当细胞生长至80%~90%融合并呈贴壁生长时,用0.25%(体积分数)胰酶消化液消化后进行传代培养。
1.3.2 肠道吸收SCFAs模型的建立
a)Caco-2细胞单层模型跨膜电阻(transepithelial electrical resistance,TEER)值和苯酚红通透性的测定:消化后的肠上皮Caco-2细胞调节密度至1.3×105 cell/mL后,接种于Transwell板上进行培养,用荧光倒置显微镜定期观察细胞形态;前7 d每隔2 d换液,7 d后每天换液,培养至15~21 d后,分别利用细胞电阻仪和酶标仪测定Caco-2细胞单层的TEER值和苯酚红通透性,具体试验方法参照文献[19]进行。
b)肠上皮Caco-2细胞的形态观察:肠上皮Caco-2细胞在Transwell培养板中培养21 d后,取出Transwell小室,固定细胞后用系列梯度酒精脱水,然后进行临界点干燥,最后采用真空喷镀法对干燥后的样品进行导电处理;喷镀完成后,参照文献[21]的方法利用扫描电镜(scanning electron microscopy,SEM)观察Caco-2细胞单层的表面形态。同时参考文献[19]的方法,利用透射电镜(transmission electron microscope,TEM)观察Caco-2细胞单层的超微结构。
c)模型中SCFAs的添加浓度:将肠上皮Caco-2细胞密度调整至1×105 cell/mL后接种于96孔板,置于37 ℃、5% CO2的培养箱中培养24 h,显微镜观察到细胞贴壁并融合后,分别加入SCFAs混合物(乙酸∶丙酸∶丁酸=3∶1∶1,摩尔比),使得模型中的SCFAs混合物浓度分别为2.5、3、4、4.5、5、10、20及100 mmol/L,在CO2培养箱中培养3 h 后,加入CCK-8试剂继续培养2 h;以不加SCFAs混合物为对照,以不加SCFAs混合物、不含有肠上皮Caco-2细胞的为空白,根据公式(1)计算细胞的存活率,进而筛选得到SCFAs的最佳添加浓度。具体实验方法参照文献[22]进行。
细胞存活率![]()
(1)
[:As为试验组的OD450值,Ab为空白组的OD450值,Ac为对照组的OD450值。
1.3.3 乳酸菌菌悬液的制备
将植物乳杆菌活化后,4 ℃、3 000×g离心20 min,收集菌体沉淀;用无菌PBS缓冲液洗涤菌体沉淀2次,重悬后备用。
1.3.4 模型中SCFAs 含量的测定
1.3.4.1 肠上皮Caco-2细胞的处理
去除肠道吸收SCFAs模型中的培养基,无菌PBS洗涤2~3次,处理组孔中加入500 μL含有最佳SCFAs混合物浓度的MEM完全培养基,并接种植物乳杆菌菌株悬液,使其终浓度为1×109 CFU/mL;以不接种菌株为对照组,置于37 ℃,5% CO2培养箱中培养3 h;收集培养后的细胞单层,4 ℃无菌PBS和无菌生理盐水清洗后,加入1.0 mL混合液[V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1],-80 ℃保存备用。
1.3.4.2 肠上皮Caco-2细胞内和基底侧SCFAs 含量的测定
取0.8 mL处理后的细胞单层混合物,加入0.9 mL 0.5%(体积分数)的磷酸重悬,摇匀离心后吸取上清液,并加入等量的乙酸乙酯,摇匀后离心再吸取上清,向上清中加入4-甲基戊酸为内标(终浓度为0.5 mmol/L),混匀后加入进样瓶,注入1 μL上清液进行分析,基底侧培养液中SCFAs 的含量测定方法同细胞内的测定方法。样品采用Agilent DB-WAX 毛细管柱(30 m×0.25 mm ID×0.25 μm)气相色谱系统进行分离,并利用气-质联用仪进行质谱分析。具体实验方法参考文献[19]的方法进行。
1.3.5 肠上皮Caco-2细胞SCFAs转运体基因和蛋白的表达水平
利用RNA 抽提试剂盒提取Caco-2细胞RNA,反转录为cDNA后进行qRT-PCR扩增,检测菌株干预前后肠上皮Caco-2细胞的SCFAs转运体MCT1、SMCT1及NHE3的基因表达水平,具体方法参照文献[18,23]的方法进行。
提取Caco-2细胞表面蛋白,送至武汉博士德生物工程有限公司检测菌株干预前后肠上皮Caco-2细胞转运体MCT1、SMCT1及NHE3的蛋白表达水平,具体方法参照文献[20]的方法进行。
1.3.6 数据统计与处理
采用GraphPad Prism 8、SPSS 21.0软件对试验数据进行统计和分析,各组结果以均数±标准差(mean±SD)表示,P<0.05说明具有显著性差异。
2 结果与分析
2.1 肠道吸收SCFAs模型的构建
2.1.1 肠上皮Caco-2细胞的形态观察
肠上皮Caco-2细胞活化后,接种在细胞培养瓶中,37 ℃、5% CO2培养箱中培养至对数生长期,利用荧光倒置显微镜观察其形态,结果见图1。
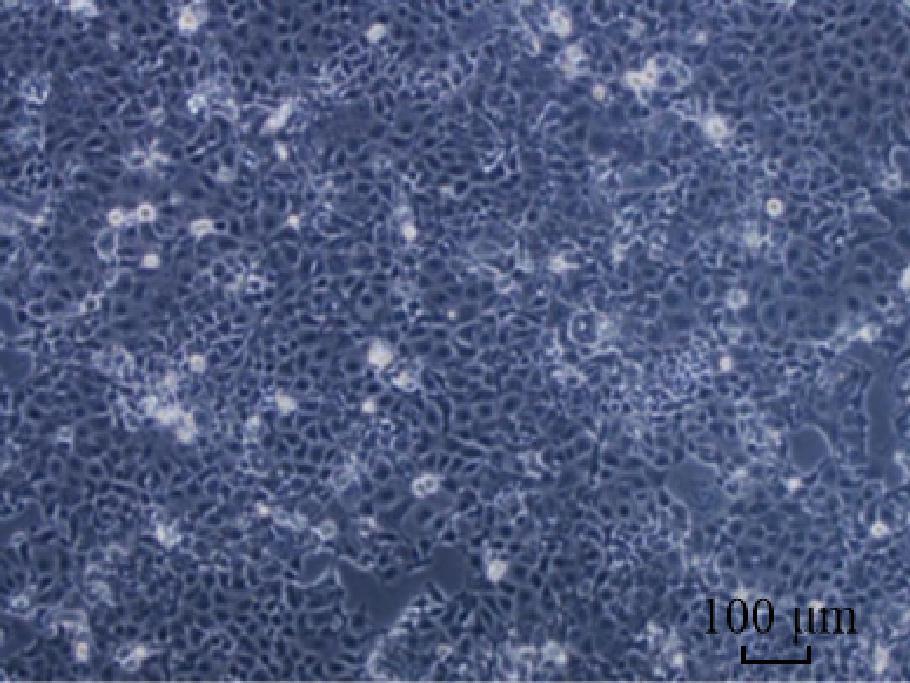
图1 显微镜下贴壁生长的肠上皮Caco-2细胞形态(×100)
Fig.1 Morphology of intestinal epithelial Caco-2 cells adhered the wall under a microscope(×100)
由图1可知,在显微镜下贴壁生长的肠上皮Caco-2细胞呈现典型的铺路石状排列,形成了紧密的细胞连接,细胞边界清晰连续,表面光滑,仅有少量细小空泡,表明细胞生长状态良好。
2.1.2 肠上皮Caco-2细胞的单层致密性
细胞单层致密性是指细胞单层紧密排列在一起,形成一个完整的屏障,从而阻止物质通过;通过观察细胞单层TEER值的变化,可以反映细胞单层致密性的变化情况。因此,试验利用细胞电阻仪测定Transwell板上的肠上皮Caco-2细胞在不同培养时间的TEER值,结果见图2。
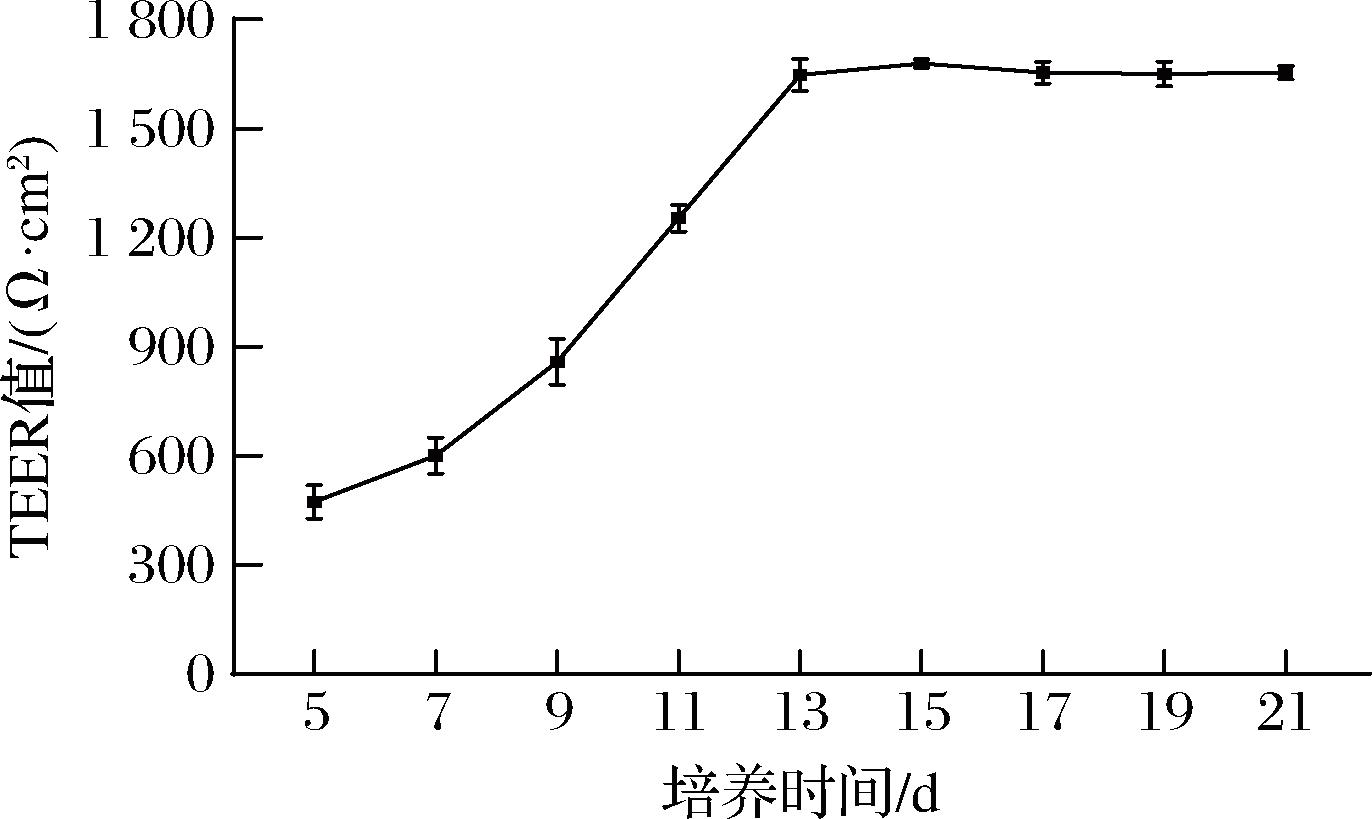
图2 Caco-2细胞单层的跨膜电阻值
Fig.2 TEER value of Caco-2 cell monolayer
如图2所示,肠上皮Caco-2细胞在第7天时开始迅速增殖,表明细胞开始融合;在第13天达到1 647.33 Ω·cm2,在第15天和第17天时均>1 654.33 Ω·cm2,至第21天保持相对稳定的状态;表明肠上皮Caco-2细胞已经形成连续、致密且稳定的单层,具有转运和吸收功能[24]。
2.1.3 肠上皮Caco-2细胞单层的苯酚红通透性
肠上皮Caco-2细胞单层的苯酚红表观渗透系数(apparent permeability coefficients,Papp)可反映肠上皮Caco-2细胞单层的苯酚红通透性,进而用于评价肠上皮细胞吸收营养物质的能力,试验测定了Caco-2细胞单层Papp,结果见表1。
表1 苯酚红的表观渗透系数![]()
Table 1 Papp of phenol red(n=3,![]()

项目结果回归方程y=0.0227x+0.0438相关系数0.9995表观渗透系数/(cm/s)0.221×10-6参考值/(cm/s)1×10-6
由表1可知,试验得到的线性回归方程为y=0.022 7x+0.043 8(R2=0.999 5),表明苯酚红在一定的浓度范围内,其溶液的吸光度与浓度之间呈现良好的线性相关性;根据标准曲线测定并计算得到肠上皮Caco-2细胞单层模型培养至第21天时的苯酚红Papp为0.22×10-6 cm/s,而当Papp<1×10-6 cm/s,表明苯酚红没有从Transwell板滤膜顶侧渗漏到基底侧,肠上皮Caco-2细胞单层的屏障完整性良好[25]。
2.1.4 扫描电镜观察
当Caco-2细胞培养至第21天时,利用扫描电镜对Caco-2细胞单层模型进行形态观察,结果见图3。

A-Caco-2细胞形态(2 000×);B-Caco-2细胞形态(15 000×)
图3 Caco-2细胞单层的扫描电镜形态观察
Fig.3 SEM morphologies of Caco-2 cell monolayer
如图3-A所示,低倍镜(2 000×)可见视野下肠上皮Caco-2 细胞表面被微绒毛覆盖,排列紧密,融合成连续而完整的细胞单层,边界清晰;如图3-B所示,放大到15 000×可清晰观察到细胞微绒毛较长且均匀。
2.1.5 透射电镜观察
为了进一步研究Caco-2细胞模型的超微形态特征,采用透射电镜对细胞模型进行形态学观察,结果见图4。

A-Caco-2细胞形态(8 000×);B-Caco-2细胞形态(20 000×)
图4 Caco-2细胞单层的透射电镜形态观察
Fig.4 TEM morphologies of Caco-2 cell monolayer
如图4-A所示,肠上皮Caco-2细胞经过21 d培养后,低倍镜下(8 000×)可观察到细胞微绒毛较长、均匀且细胞之间出现紧密连接,部分细胞微绒毛短且呈不规则状;进一步放大到20 000×时,可清晰观察到细胞的微绒毛分化良好,且细胞间无明显间隙,达到致密状态(图4-B),可作为体外肠道吸收模型。
2.1.6 模型中SCFAs的添加量
分别将不同浓度的SCFAs mix接入Caco-2细胞单层模型中,培养后利用CCK-8法测定模型中细胞的存活率,结果见图5。
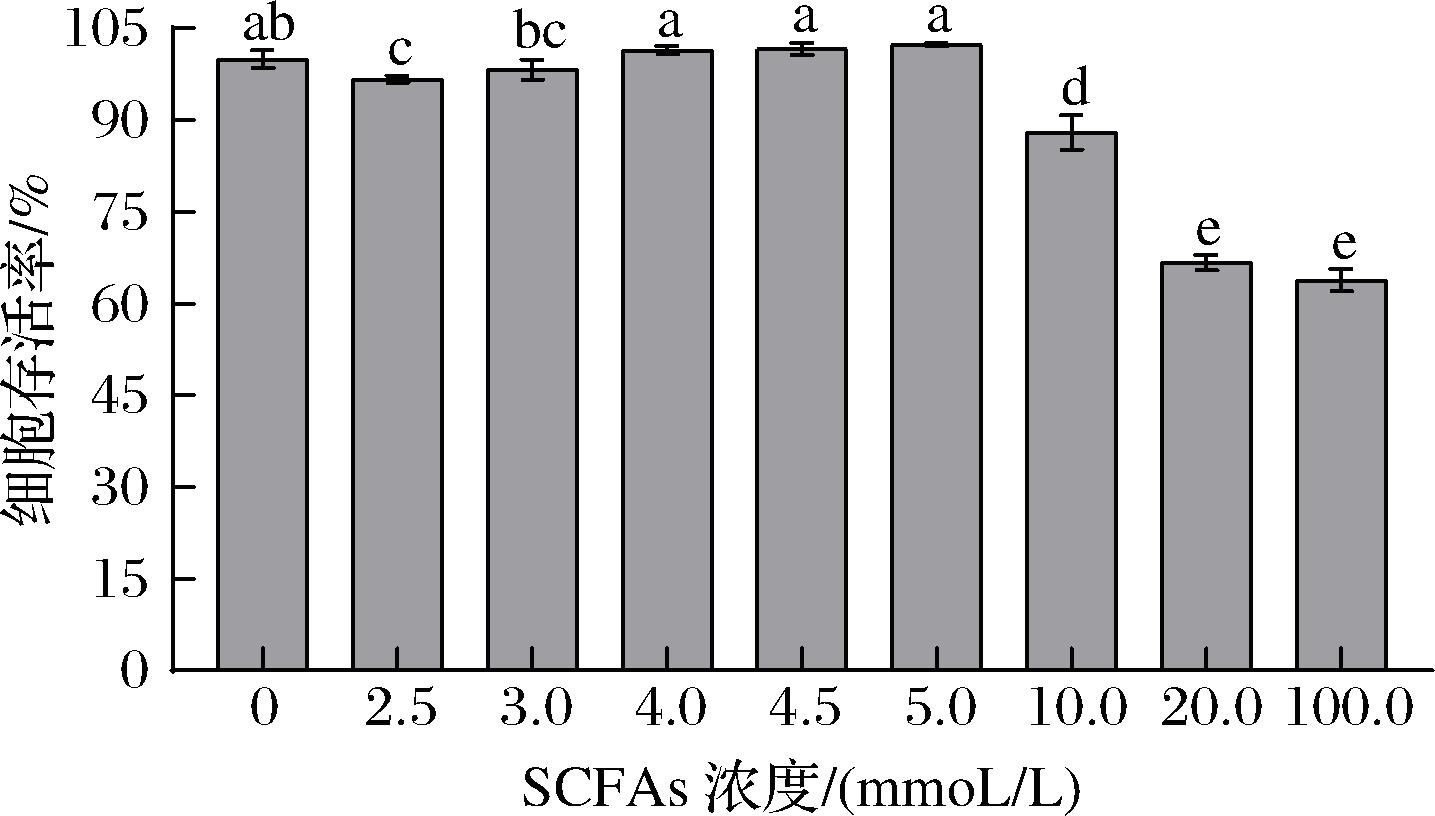
图5 SCFAs浓度对模型中肠上皮Caco-2细胞存活率的影响
Fig.5 Effect of SCFAs concentration on the survival rate of intestinal epithelial Caco-2 cells in model
注:不同小写字母表示差异显著(P<0.05)(下同)。
由图5可知,当模型中SCFAs mix的浓度分别为2.5、10.0、20.0、100.0 mmol/L时,肠上皮Caco-2细胞的存活率显著低于0 mmol/L(P<0.05),表明这4个浓度的SCFAs mix对细胞具有一定的毒性,会显著降低细胞的活力(P<0.05);而当SCFAs混合物的浓度分别为3.0、4.0、4.5、5.0 mmol/L时,细胞的存活率与0 mmol/L时无显著性差异(P>0.05),表明这4个浓度的SCFAs对细胞无毒性;而5.0 mmol/L时的细胞存活率较高于3.0、4.0、4.5 mmol/L;因此,试验选择5.0 mmol/L作为模型中SCFAs的添加量。
2.2 植物乳杆菌对肠道吸收SCFAs的影响
将植物乳杆菌接种至含有SCFAs混合物的肠道吸收SCFAs模型中,以未接菌为对照,干预3 h后,分别测定肠上皮Caco-2 细胞内和基底侧培养液中SCFAs 的含量,结果见图6~图8。
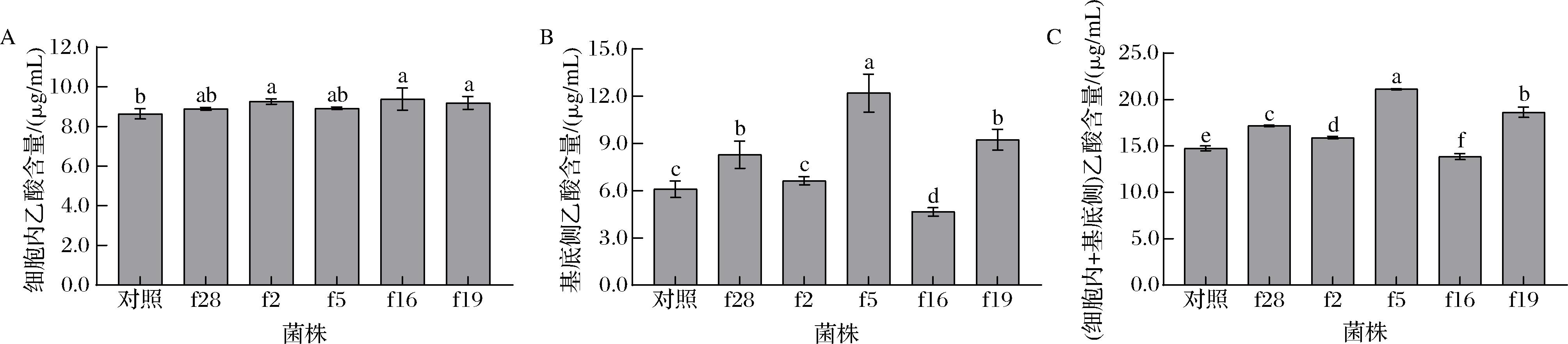
A-细胞吸收乙酸;B-细胞转运乙酸;C-细胞吸收和转运乙酸
图6 植物乳杆菌对肠上皮Caco-2细胞吸收和转运乙酸的影响
Fig.6 Effect of L.plantarum on the absorption and transportation of acetic acid by intestinal epithelial Caco-2 cells
由图6可知,菌株f28、f2、f5及f19干预模型后,细胞内和基底侧培养液中乙酸的含量均显著大于对照组(P<0.05),而菌株f16则显著低于对照组(P<0.05);表明菌株f28、f2、f5及f19显著促进了细胞对乙酸的吸收(P<0.05),而菌株f16则起到显著抑制作用(P<0.05)。
由图7可知,试验的5株菌株干预模型后,细胞内和基底侧培养液中丙酸的含量均显著大于对照组(P<0.05);表明5株菌株均能显著促进细胞对丙酸的吸收(P<0.05)。
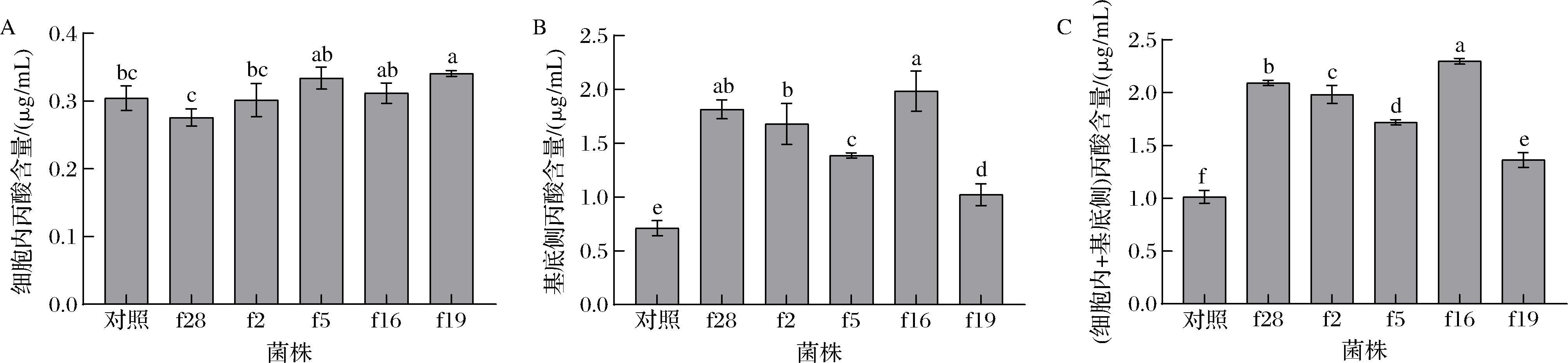
A-细胞吸收丙酸;B-细胞转运丙酸;C-细胞吸收和转运丙酸
图7 植物乳杆菌对肠上皮Caco-2细胞吸收丙酸的影响
Fig.7 Effect of L.plantarum on the absorption of propionic acid by intestinal epithelial Caco-2 cells
由图8可知,菌株f28、f2、f5及f16干预模型后,细胞内和基底侧培养液中丁酸含量显著高于对照组(P<0.05),而菌株f19干预后,则显著低于对照组(P<0.05);表明菌株f28、f2、f5及f16能显著促进细胞对丁酸的吸收(P<0.05),而菌株f19则起到显著抑制作用(P<0.05)。
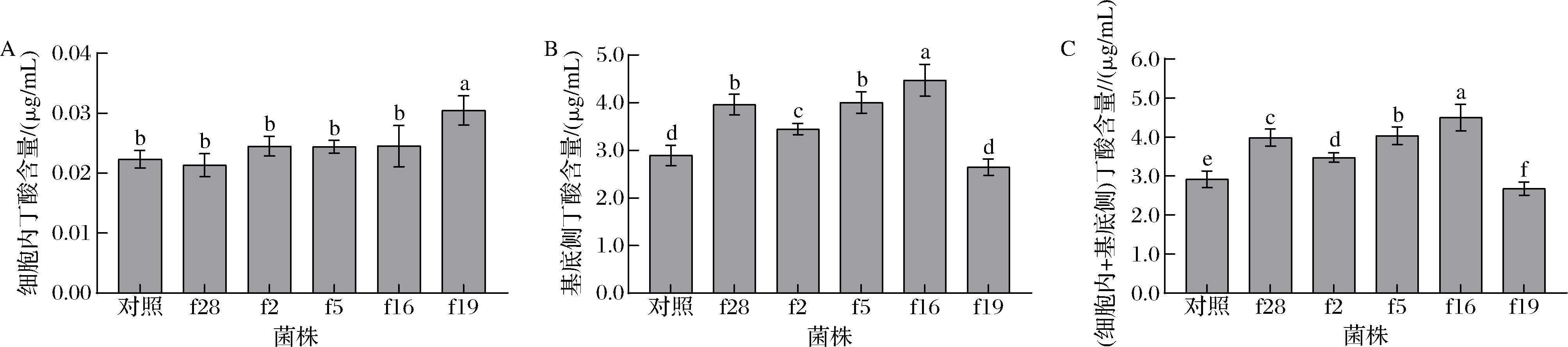
A-细胞吸收丁酸;B-细胞转运丁酸;C-细胞吸收和转运丁酸
图8 植物乳杆菌对肠上皮Caco-2细胞吸收丁酸的影响
Fig.8 Effect of L.plantarum on the absorption of butyric acid by intestinal epithelial Caco-2 cells
2.3 植物乳杆菌对Caco-2细胞转运体表达的调控
将菌株分别接入含有 SCFAs mix的肠道吸收SCFAs模型中,以未接菌为对照,培养3 h后收集细胞,检测细胞中MCT1、SMCT1及NHE3的蛋白和基因的表达水平,结果见图9~图11。
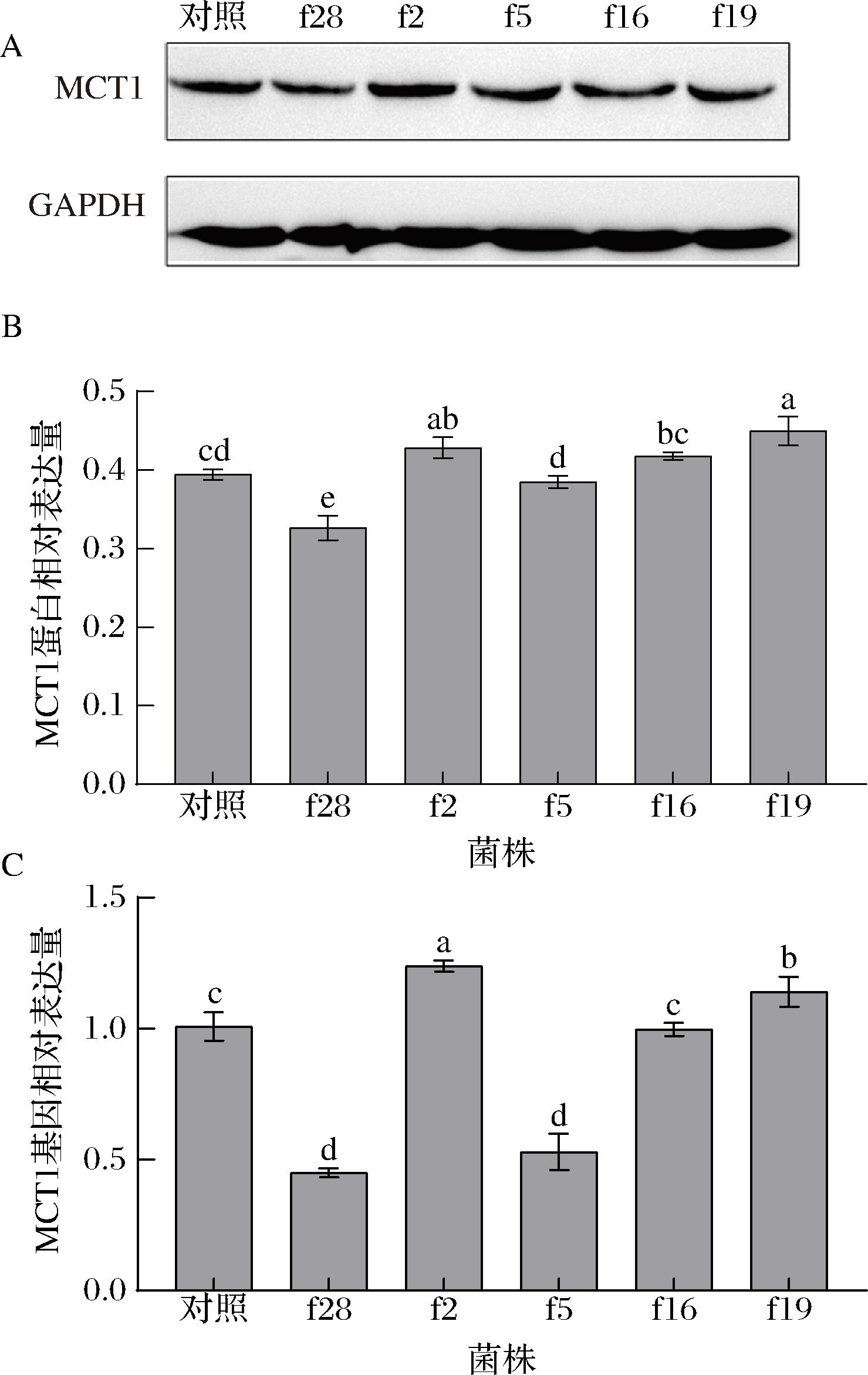
A-MCT1蛋白western blot条带图;B-肠上皮Caco-2细胞中MCT1蛋白表达水平;C-肠上皮Caco-2细胞中MCT1基因表达水平
图9 植物乳杆菌对肠上皮Caco-2细胞转运体MCT1表达水平的调控
Fig.9 Regulation of L.plantarum on the expression of MCT1 transporter in intestinal epithelial Caco-2 cells
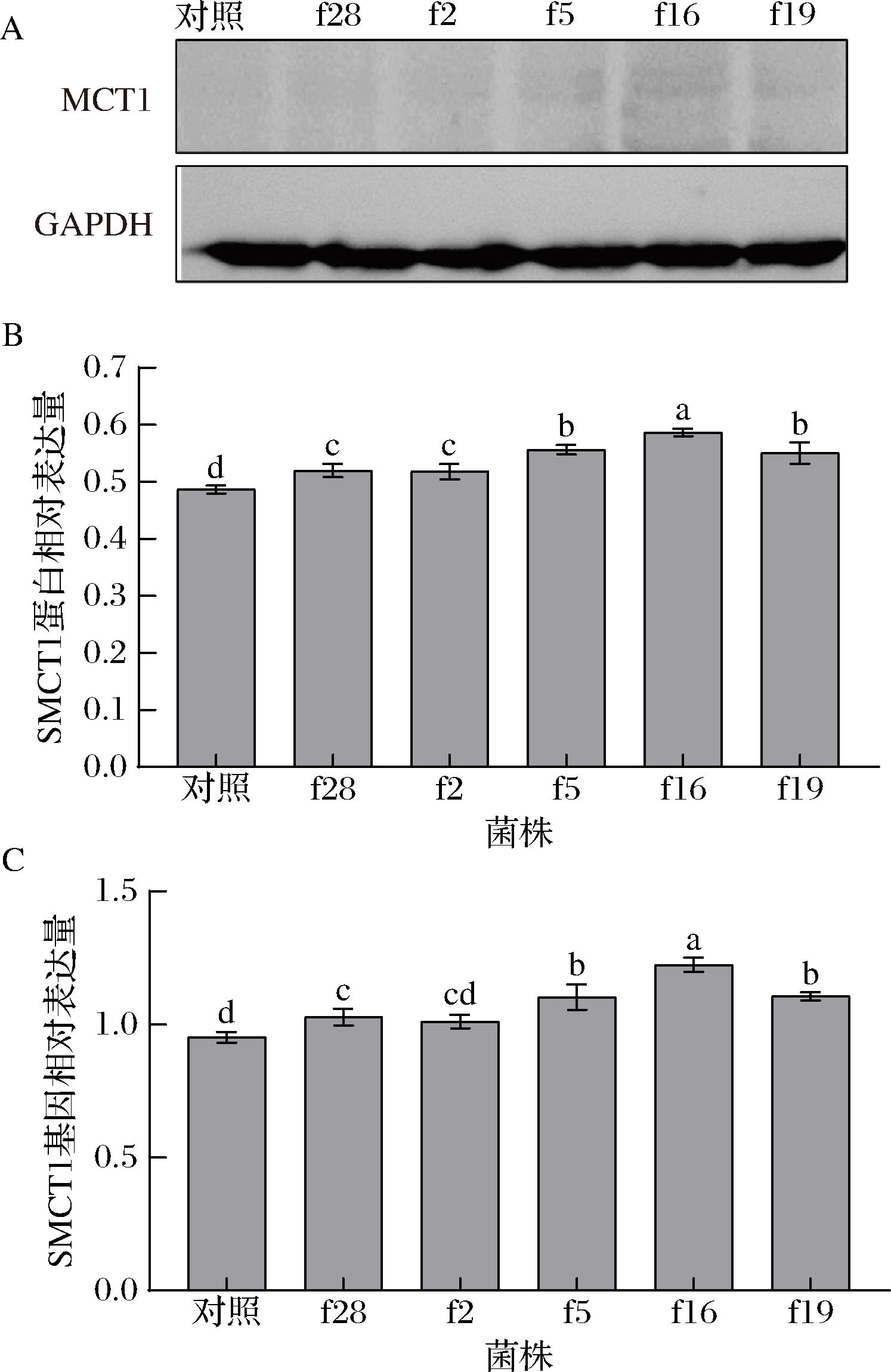
A-SMCT1蛋白western blot条带图;B-肠上皮Caco-2细胞中SMCT1蛋白表达水平;C-肠上皮Caco-2细胞中SMCT1基因表达水平
图10 植物乳杆菌对肠上皮Caco-2细胞转运体SMCT1表达水平的调控
Fig.10 Regulation of L.plantarum on the expression of SMCT1 transporter in intestinal epithelial Caco-2 cells
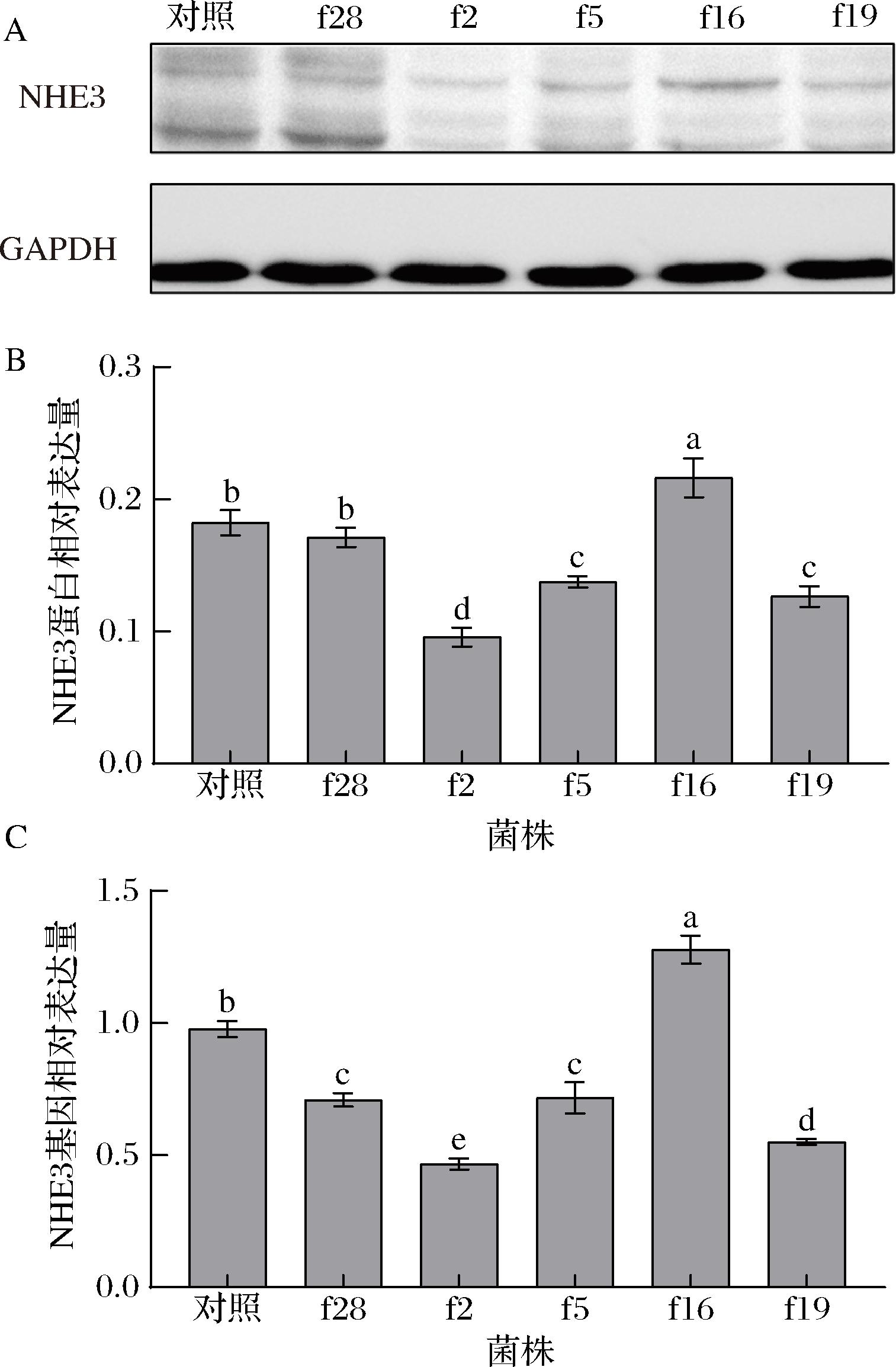
A-NHE3蛋白western blot条带图;B-肠上皮Caco-2细胞中NHE3蛋白表达水平;C-肠上皮Caco-2细胞中NHE3基因表达水平
图11 植物乳杆菌对肠上皮Caco-2细胞转运体NHE3表达水平的调控
Fig.11 Regulation of L.plantarum on the expression of NHE3 transporter in intestinal epithelial Caco-2 cells
由图9可知,菌株f2和f19干预后,细胞MCT1的蛋白和基因表达水平显著高于对照组(P<0.05),而菌株f28干预的细胞则显著低于对照组(P<0.05);由图10可知,菌株f28、f5、f16及f19干预的细胞SMCT1的蛋白和基因表达水平显著高于对照组(P<0.05);由图11可知,菌株f16干预的细胞NHE3的蛋白和基因表达水平显著高于对照组(P<0.05),f2、f5和f19干预的细胞则显著低于对照组(P<0.05),菌株f28对细胞的NHE3蛋白表达水平无显著性影响(P>0.05),但显著下调了其基因的表达(P<0.05)。
菌株f28、f2、f5及f16均显著上调或下调了细胞中2种SCFAs转运体的表达,而菌株f19则显著上调或下调了3种SCFAs转运体的表达,表明菌株f19调控细胞SCFAs转运体的表达的效果较好于其他菌株。
3 结论与讨论
TEER是电离子经细胞旁的间隙流动而形成,反映了细胞间的紧密性与细胞单层的完整性,TEER值越高说明细胞单层的通透性越低,也越致密[26];而当TEER值>250 Ω·cm2时,细胞就已经形成了致密的单层[27],本文建立的细胞单层在第13天达到了1 647.33 Ω·cm2,并且第21天变化较小;因此,建立的细胞单层模型具有良好的致密性。苯酚红为分子量较大的水溶性物质,难以跨细胞通道转运,其Papp能较好地反映肠上皮Caco-2细胞间的空隙及其连接程度[28];当苯酚红的Papp值越低,说明细胞间的空隙就越小,细胞单层的紧密性和连接程度就越高[29];本文建立的细胞单层的苯酚红Papp为0.22×10-6 cm/s,低于1×10-6 cm/s,也进一步表明建立的模型具有良好的致密性和完整性。综上可以表明,细胞单层的TEER值与苯酚红的Papp值均能反映肠上皮Caco-2细胞间的空隙程度,TEER值越高,Papp值越低,其致密性和完整性就越好,也越有利于SCFAs吸收试验的进行。
通过CCK-8细胞毒性试验发现,当肠道吸收模型中的SCFAs mix浓度为5.0 mmol/L时,肠上皮Caco-2细胞的存活率与0、4.0、4.5 mmol/L无显著性差异(P>0.05),并显著高于其他浓度(P<0.05);表明4.0、4.5及5.0 mmol/L 的SCFAs混合物对细胞没有毒性;虽然5.0 mmol/L时的细胞存活率与4.0和4.5 mmol/L差异不显著(P>0.05),但是更能促进细胞的增殖;由此选择5.0 mmol/L作为模型中SCFAs混合物的添加量。因此,肠道吸收混合SCFAs模型的最佳培养条件为:消化后的肠上皮Caco-2细胞以1.3×105 cell/mL接种至Transwell板中,置于37 ℃、5% CO2的培养箱中培养,前7 d每隔两天更换培养液,7 d后每天更换培养液;培养21 d后,加入SCFAs混合物(乙酸∶丙酸∶丁酸=3∶1∶1,摩尔比),使得培养液中的浓度为5.0 mmol/L;至此,成功建立了肠道吸收混合SCFAs模型。
菌株f2和f19显著上调了肠上皮Caco-2细胞中MCT1的蛋白和基因表达水平(P<0.05),而MCT1表达水平的上调有助于细胞吸收乙酸[30],表明菌株f2和f19能够通过上调MCT1的表达水平促进肠道对乙酸的吸收。菌株f28、f5、f16及f19显著上调了肠上皮Caco-2细胞的SMCT1蛋白和基因的表达水平(P<0.05),而SMCT1表达水平的上调能够促进细胞对丙酸的吸收[6];因此,菌株f28、f5、f16及f19通过上调细胞SMCT1的表达水平促进了细胞对丙酸的吸收。菌株f16 显著上调了细胞中NHE3的蛋白和基因表达水平(P<0.05),f19则起到显著下调作用(P<0.05),而细胞中NHE3的活性与其吸收丁酸存在功能性偶联关系[31],表明菌株f16 和f19可能分别通过显著上调和下调NHE3的蛋白和基因表达来促进和抑制细胞对丁酸的吸收。BORTHAKUR等[18]研究发现L.plantarum ATCC 14917可以通过调控肠上皮细胞SMCT1的表达来促进细胞对丁酸的吸收,ANOOP等[20]研究则发现L.acidophilus ATCC 4357能够通过调控肠上皮细胞MCT1的表达来促进细胞对丁酸的吸收;表明不同乳杆菌可能通过上调不同SCFAs转运体的表达来促进细胞对不同SCFAs的吸收。
现有研究[18,20]表明,乳杆菌能够通过调控单个SCFAs转运体的表达来促进细胞对单个SCFAs的吸收,但对于同一株乳杆菌是否能够同时调控多个SCFAs 转运体的表达,并促进细胞对多个SCFAs的吸收,以及同一株乳杆菌是否能既上调细胞SCFAs转运体的表达,也能下调细胞SCFAs转运体的表达,目前相关报道较少;本文的研究则表明,同一株植物乳杆菌可以同时调控多个SCFAs转运体的表达,也能够同时促进细胞吸收多个SCFAs,且同一株植物乳杆菌既能上调细胞SCFAs转运体的表达,也能下调细胞SCFAs转运体的表达,对细胞吸收SCFAs既有促进作用,也有抑制作用;虽然菌株f2和f5也显著下调了细胞中NHE3的蛋白和基因的表达水平(P<0.05),但其并未抑制细胞对SCFAs的吸收,可能是菌株f2和f5对细胞吸收SCFAs的调控涉及到多个SCFAs转运体,具体的作用机制还需深入研究。
本文研究还发现,植物乳杆菌f5、f28和f2显著促进了肠道对乙酸、丙酸和丁酸的吸收(P<0.05);而植物乳杆菌f16显著促进了肠道对丙酸、丁酸的吸收,但显著抑制了肠道对乙酸的吸收(P<0.05);植物乳杆菌f19则显著促进了肠道对乙酸和丙酸的吸收(P<0.05),但显著抑制肠道对丁酸的吸收(P<0.05);表明不同植物乳杆菌菌株调控肠道吸收SCFAs具有差异性。
BORTHAKUR等[32]研究发现,乳酸菌的表面蛋白可以通过调控Caco-2细胞的腺瘤下调因子(down regulated in adenoma,DRA)等转运体表达来促进细胞对Cl-的吸收;HU等[33]的研究进一步表明,这些表面蛋白可通过与Caco-2细胞膜蛋白互作来增强细胞DRA、SMCT1等转运体的表达,进而促进肠道对Ca2+的吸收。而植物乳杆菌能够分泌Cbp、Msa等多种起黏附作用的蛋白至其细胞表面,通过C端的LPXTG结构域与肠上皮细胞膜上的甘露糖残基相结合而发生蛋白互作[34-35];前期研究还发现,筛选获得的5株植物乳杆菌对肠上皮Caco-2细胞吸收丙酸和丁酸具有良好的促进作用,且促吸收作用与其黏附作用密切相关[19]。因此,推测植物乳杆菌可能通过其表面起黏附作用的蛋白来调控细胞SCFAs转运体表达,进而发挥其对细胞吸收SCFAs的促进作用;而菌株表面起黏附作用的不同蛋白可能是其调控肠道吸收SCFAs具有菌株差异性的重要因素。
试验的植物乳杆菌菌株能够通过调节肠上皮Caco-2细胞的SCFAs转运体表达来调控肠道对SCFAs的吸收,而表面起黏附作用的蛋白可能是其调控具有菌株差异性的重要因素;试验的菌株不仅能够促进细胞对SCFAs的吸收,也能够抑制细胞对SCFAs的吸收,表明试验的植物乳杆菌可作为调控机体肠道吸收SCFAs的潜在益生菌,从而为以肠道SCFAs为靶点的相关功能益生菌及其制品的开发应用提供理论依据。
[1] ALEXANDER C,SWANSON K S,FAHEY G C,et al.Perspective:Physiologic importance of short-chain fatty acids from nondigestible carbohydrate fermentation[J].Advances in Nutrition,2019,10(4):576-589.
[2] W ODARCZYK J,P
ODARCZYK J,P OSKA M,P
OSKA M,P OSKI K,et al.The role of short-chain fatty acids in inflammatory bowel diseases and colorectal cancer[J].Postepy Biochemii,2021,67(3):223-230.
OSKI K,et al.The role of short-chain fatty acids in inflammatory bowel diseases and colorectal cancer[J].Postepy Biochemii,2021,67(3):223-230.
[3] LI X,SHIMIZU Y,KIMURA I.Gut microbial metabolite short-chain fatty acids and obesity[J].Bioscience of Microbiota,Food and Health,2017,36(4):135-140.
[4] FERN NDEZ J,REDONDO-BLANCO S,GUTIÉRREZ-DEL-R
NDEZ J,REDONDO-BLANCO S,GUTIÉRREZ-DEL-R O I,et al.Colon microbiota fermentation of dietary prebiotics towards short-chain fatty acids and their roles as anti-inflammatory and antitumour agents:A review[J].Journal of Functional Foods,2016,25:511-522.
O I,et al.Colon microbiota fermentation of dietary prebiotics towards short-chain fatty acids and their roles as anti-inflammatory and antitumour agents:A review[J].Journal of Functional Foods,2016,25:511-522.
[5] MA J Y,PIAO X S,MAHFUZ S,et al.The interaction among gut microbes,the intestinal barrier and short chain fatty acids[J].Animal Nutrition (Zhongguo Xu Mu Shou Yi Xue Hui),2021,9:159-174.
[6] DALILE B,VAN OUDENHOVE L,VERVLIET B,et al.The role of short-chain fatty acids in microbiota-gut-brain communication[J].Nature Reviews.Gastroenterology &Hepatology,2019,16(8):461-478.
[7] HUR K Y,LEE M S.Gut microbiota and metabolic disorders[J].Diabetes &Metabolism Journal,2015,39(3):198-203.
[8] BLOEMEN J G,VENEMA K,VAN DE POLL M C,et al.Short chain fatty acids exchange across the gut and liver in humans measured at surgery[J].Clinical Nutrition,2009,28(6):657-661.
[9] MODESTO A,CAMERON N R,VARGHESE C,et al.Meta-analysis of the composition of human intestinal gases[J].Digestive Diseases and Sciences,2022,67(8):3842-3859.
[10] YANG T,RICHARDS E M,PEPINE C J,et al.The gut microbiota and the brain-gut-kidney axis in hypertension and chronic kidney disease[J].Nature Reviews Nephrology,2018,14:442-456.
[11] SUN Y Y,JING D D.Relationship between Helicobacter pylori infection and gastrointestinal microecology[J].World Chinese Journal of Digestology,2020,28(24):1261-1265.
[12] GOPAL E,FEI Y J,SUGAWARA M,et al.Expression of slc5a8 in kidney and its role in Na(+)-coupled transport of lactate[J].The Journal of Biological Chemistry,2004,279(43):44522-44532.
[13] BORTHAKUR A,GILL R K,HODGES K,et al.Enteropathogenic Escherichia coli inhibits butyrate uptake in Caco-2 cells by altering the apical membrane MCT1 level[J].American Journal of Physiology.Gastrointestinal and Liver Physiology,2006,290(1):G30-G35.
[14] GILL R K,BORTHAKUR A,HODGES K,et al.Mechanism underlying inhibition of intestinal apical Cl/OH exchange following infection with enteropathogenic E. coli[J].The Journal of Clinical Investigation,2007,117(2):428-437.
[15] PENG L Y,HE Z J,CHEN W,et al.Effects of butyrate on intestinal barrier function in a Caco-2 cell monolayer model of intestinal barrier[J].Pediatric Research,2007,61(1):37-41.
[16] OVERBY H B,FERGUSON J F.Gut Microbiota-Derived Short-Chain Fatty Acids Facilitate Microbiota:Host Cross talk and Modulate Obesity and Hypertension[J].Current Hypertension Reports,2021,23(2):8.
[17] ZHANG J,ZHAO X,JIANG Y Y,et al.Antioxidant status and gut microbiota change in an aging mouse model as influenced by exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibetan kefir[J].Journal of Dairy Science,2017,100(8):6025-6041.
[18] BORTHAKUR A,ANBAZHAGAN A N,KUMAR A,et al.The probiotic Lactobacillus plantarum counteracts TNF-{alpha}-induced downregulation of SMCT1 expression and function[J].American Journal of Physiology.Gastrointestinal and Liver Physiology,2010,299(4):G928-G934.
[19] CHEN D W,CHEN C M,QU H X,et al.Screening of Lactobacillus strains that enhance SCFA uptake in intestinal epithelial cells[J].European Food Research and Technology,2021,247(5):1049-1060.
[20] KUMAR A,ALREFAI W A,BORTHAKUR A,et al.Lactobacillus acidophilus counteracts enteropathogenic E. coli-induced inhibition of butyrate uptake in intestinal epithelial cells[J].American Journal of Physiology.Gastrointestinal and Liver Physiology,2015,309(7):G602-G607.
[21] NASIRI G,AZIMIRAD M,GOUDARZI H,et al.The inhibitory effects of live and UV-killed Akkermansia muciniphila and its derivatives on cytotoxicity and inflammatory response induced by Clostridioides difficile RT001 in vitro[J].International Microbiology,2024,27(2):393-409.
[22] 范晨雨.促肠上皮细胞吸收短链脂肪酸乳酸菌的筛选及其作用机制[D].扬州:扬州大学,2020.FAN C Y.Screening and mechanism of lactic acid bacteria promoting intestinal epithelial cells to absorb short-chain fatty acids[D].Yangzhou:Yangzhou University,2020.
[23] STERLING D,ALVAREZ B V,CASEY J R.The extracellular component of a transport metabolon.Extracellular loop 4 of the human AE1 ![]() exchanger binds carbonic anhydrase IV[J].The Journal of Biological Chemistry,2002,277(28):25239-25246.
exchanger binds carbonic anhydrase IV[J].The Journal of Biological Chemistry,2002,277(28):25239-25246.
[24] NOACH A B J,KUROSAKI Y,BLOM-ROOSEMALEN M C M,et al.Cell-polarity dependent effect of chelation on the paracellular permeability of confluent caco-2 cell monolayers[J].International Journal of Pharmaceutics,1993,90(3):229-237.
[25] MING X,THAKKER D R.Role of basolateral efflux transporter MRP4 in the intestinal absorption of the antiviral drug adefovir dipivoxil[J].Biochemical Pharmacology,2010,79(3):455-462.
[26] 周慧敏.利用Caco-2细胞模型研究肠道可吸收乳清肽的结构特征[D].南京:南京师范大学,2015.ZHOU H M.Study on structural characteristics of intestinal absorbable whey peptide by Caco-2 cell model[D].Nanjing:Nanjing Normal University,2015.
[27] SANGSAWAD P,ROYTRAKUL S,CHOOWONGKOMON K,et al.Transepithelial transport across Caco-2 cell monolayers of angiotensin converting enzyme (ACE) inhibitory peptides derived from simulated in vitro gastrointestinal digestion of cooked chicken muscles[J].Food Chemistry,2018,251:77-85.
[28] 关溯,赵立子,陈杰,等.Caco-2细胞模型的建立及意义[J].山东医药,2005,45(26):1-3.GUAN S,ZHAO L Z,CHEN J,et al.Establishment and value of Caco-2 cell model[J].Shandong Medical Journal,2005,45(26):1-3.
[29] YEE S.In vitro permeability across Caco-2 cells (colonic) can predict in vivo (small intestinal) absorption in man:Fact or myth[J].Pharmaceutical Research,1997,14(6):763-766.
[30] LI M H,LONG X,WAN H J,et al.Monocarboxylate transporter 1 promotes proliferation and invasion of renal cancer cells by mediating acetate transport[J].Cell Biology International,2021,45(6):1278-1287.
[31] 林华林,秦颖超,周加义,等.丁酸梭菌及其代谢产物对畜禽肠道健康影响的研究进展[J].饲料工业,2019,40(6):7-12.LIN H L,QIN Y C,ZHOU J Y,et al.Research progress on the effects of Clostridium butyricum and its metabolites on intestinal health of livestock[J].Feed Industry,2019,40(6):7-12.
[32] BORTHAKUR A,GILL R K,TYAGI S,et al.The probiotic Lactobacillus acidophilus stimulates chloride/hydroxyl exchange activity in human intestinal epithelial cells[J].The Journal of Nutrition,2008,138(7):1355-1359.
[33] HU J,MA L B,NIE Y F,et al.A microbiota-derived bacteriocin targets the host to confer diarrhea resistance in early-weaned piglets[J].Cell Host &Microbe,2018,24(6):817-832.
[34] MUSCARIELLO L,DE SIENA B,MARASCO R.Lactobacillus cell surface proteins involved in interaction with mucus and extracellular matrix components[J].Current Microbiology,2020,77(12):3831-3841.
[35] HOLST B,GLENTING J,HOLMSTRØM K,et al.Molecular switch controlling expression of the mannose-specific adhesin,msa,in Lactobacillus plantarum[J].Applied and Environmental Microbiology,2019,85(10):e02954-e02918.