肌原纤维蛋白(myofibrillar protein,MP)是肌肉含量最高蛋白质,约为50%~55%,包括肌球蛋白、肌动蛋白等[1],具有良好的乳化性、凝胶性和保水性能。MP热诱导凝胶为肉制品提供了理想的质地、持水性、感官等品质,凝胶化过程包括MP分子的结构展开以暴露内部的疏水结构域和其他官能团,并伴随蛋白质-蛋白质交联和进一步聚集,构建捕获水和固定脂肪球的高黏弹性凝胶网络[2]。影响MP热诱导凝胶的因素众多,包括温度、压力、蛋白质氧化等,其中温度起着关键作用,原因在于肌球蛋白变性温度大约在40~55 ℃,肌动蛋白变性温度大约在70~85 ℃[3],在适宜温度下能获得理想凝胶;而过高温度(超过80 ℃)会使MP分子过度聚集从而导致凝胶质构恶化[4],特别是100 ℃以上的高温使凝胶无规则卷曲发生破坏,蛋白重链消失,网状结构孔隙变大,骨架变得脆弱[5];高压能促进蛋白质的变性和解聚,增强了凝胶体系中的持水力,压力过高则会破坏凝胶网络[6];高温有氧条件下,MP凝胶疏水氨基酸侧链修饰,羰基含量升高,氧化度越高,热致凝胶的持水力越差[7-8]。
真空低温烹饪(sous-vide cooking,SVC)是一种在相对较低的温度下精确控温的真空烹饪技术,既能保障微生物安全性又避免了肌肉蛋白过度变性,可以极大保留食物原有风味、质地和营养成分[9]。BECKER等[10]发现在53 ℃或58 ℃(20 h)烹饪的猪肉相比180 ℃(50 min)具有更高的嫩度和多汁性。RASINSKA等[11]研究结果显示相比煮制、烘烤,真空烹饪的兔肉蒸煮损失和脂质氧化最低。冯秋凤等[12]研究表明真空低温蒸煮能提高鲟鱼的凝胶性并延长保质期。目前真空低温烹饪的研究主要集中在肉制品品质、风味、营养及保质期等方面,而有关SVC对蛋白凝胶变化及机理的影响从而反映到肉制品品质研究还比较匮乏。
因此,本研究在课题组前期研究基础上[13],以鸭肉肌原纤维蛋白为原料,采用SVC技术制备凝胶,探究60、65、70、75、80 ℃的SVC温度对MP凝胶特性和结构的影响,为SVC加工工艺技术的品质形成机理和肉制品的开发提供理论指导。
1 材料与方法
1.1 材料与试剂
鸭胸肉(贮藏至冰箱-18 ℃),张鸭子食品有限公司;高温蒸煮袋(PA+RCPP,10 cm×15 cm,食品级),石家庄喜龙包装有限公司;牛血清蛋白(生化试剂)、2.5%戊二醛固定液、磷酸氢二钠、磷酸二氢钠,上海麦克林生化科技有限公司;叔丁醇、氯化钠、氯化镁、无水乙醇,成都市科隆化学品有限公司;乙二胺四乙酸,北京索莱宝科技有限公司;尿素,上海迈瑞尔生化科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
XHF-DY高速分散器,宁波新芝生物科技股份有限公司;TGL-16医用冷冻离心机,四川蜀科仪器有限公司;A101色差仪,美国科诺工业有限公司;TA.XT Plus质构仪,英国Stable Micro System公司;Spectrum 100红外光谱仪,美国Perkin-Elmer公司;Phenom Pro扫描电镜,荷兰Phenom World公司;HH-6数显恒温搅拌水浴锅,上海力辰邦西仪器科技有限公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取及浓度的测定
鸭胸肉完全解冻后去除表面脂肪及筋膜等,切成小块绞肉机绞碎,参考吴佳等[14]的方法提取肌原纤维蛋白。将得到的MP置于冰箱4 ℃保存,在48 h内用完。将提取的MP溶解于20 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl,pH 7.0)中,匀浆机混合均匀后,双缩脲法测定蛋白含量。
1.3.2 肌原纤维蛋白凝胶的制备
用20 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl,pH 7.0)配制蛋白质量浓度为40 mg/mL。定量称取MP装入耐热真空蒸煮袋中并真空包装(真空度-0.1 MPa,真空时间30 s),并通过物理挤压的方式调整MP形状为均匀方形,所有样品大小保持一致。预先设置水浴锅温度,待水浴温度达到所设温度且维持恒定,此时水浴升温速率为0 ℃/min,在60、65、70、75、80 ℃的恒温水浴中真空低温煮制凝胶105 min模拟真空低温技术工艺。以未真空包装100 ℃煮制凝胶30 min模拟传统高温加工方式作为对照组。煮制结束后冰水浴放置30 min,于4 ℃冰箱冷藏待用。
1.3.3 凝胶白度的测定
参考NIU等[15]的方法。测定鸭肉MP凝胶的L*(亮度)、a*(红度)和b*(黄度)值。凝胶白度值(W)的计算如公式(1)所示:
(1)
1.3.4 凝胶质构的测定
参考张建华等[16]的方法略作修改。选择P/0.5探头,TPA模式,测试条件:测前2 mm/s、测中l mm/s、测后1 mm/s、触发力5 g、时间间隔5 s,形变40%。
1.3.5 凝胶蒸煮损失率的测定
根据1.3.2节操作测定蒸煮损失率。加热煮制MP前蒸煮袋的重量记为W(g),蒸煮袋和MP的总重量记为W1(g),加热后除去水分的总重量记为W2(g),凝胶蒸煮损失率的计算如公式(2)所示:
蒸煮损失率![]()
(2)
1.3.6 凝胶持水性的测定
离心管的重量记为M1(g),将凝胶称重到离心管中,总重量记为M2(g),离心(4 ℃,8 000 r/min,10 min),滤纸除去多余水分的总重量记为M3(g),凝胶的持水性的计算如公式(3)所示:
持水性![]()
(3)
1.3.7 凝胶相对化学作用力的测定
参考赵磊等[17]的方法测定,准确称量1.0 g蛋白凝胶样品分别与9 mL S1(0.05 mol/L NaCl)、S2(0.6 mol/L NaCl)、S3(0.6 mol/L NaCl,1.5 mol/L尿素)、S4(0.6 mol/L NaCl,8 mol/L尿素)溶液混合,高速均质3 min,离心15 min,用上清液的蛋白质含量差表示离子键(S2-S1)、疏水相互作用(S3-S2)、氢键(S4-S3)的相对含量大小。
1.3.8 凝胶微观结构的测定
参考XIA等[8]的方法测定,略作修改。MP凝胶(1.0 cm×1.0 cm×0.5 cm)在2.5%戊二醛固定液中浸泡48 h后,磷酸缓冲液冲洗3次,不同体积浓度乙醇溶液梯度脱水30 min,再用叔丁醇置换后冷冻干燥,扫描电子显微镜观察MP凝胶的微观结构。
1.3.9 凝胶二级结构的测定
参考DU等[18]的方法。MP凝胶冷冻干燥后研磨成均匀无颗粒粉末,傅里叶红外光谱仪在4 000~400 cm-1下扫描测定。使用OMNIC 9和Peakfit 4.12对蛋白质红外光谱进行分析处理。
1.4 数据处理与分析
独立实验重复3次,用平均值±标准差表示。采用Excel和Origin整理数据、图像处理,SPSS进行显著性分析(P<0.05),Duncan检验比较均值。
2 结果与分析
2.1 SVC温度对MP凝胶白度的影响
MP色泽在热加工过程中会发生变化[19]。由图1可知,SVC条件的MP凝胶白度值显著高于对照组(P<0.05);但60~75 ℃的SVC条件的MP凝胶白度值变化不显著(P>0.05),80 ℃显著下降(P<0.05)。原因在于高温会增加蛋白质变性程度,使凝胶亮度L*和黄度b*值增大、红度a*值减小[20-21];MP凝胶经高温加热(80 ℃),失去更多的水分,透明度可能降低,反射光减弱,从而导致白度值降低[22]。本研究说明SVC技术可以使MP凝胶的白度值显著升高。
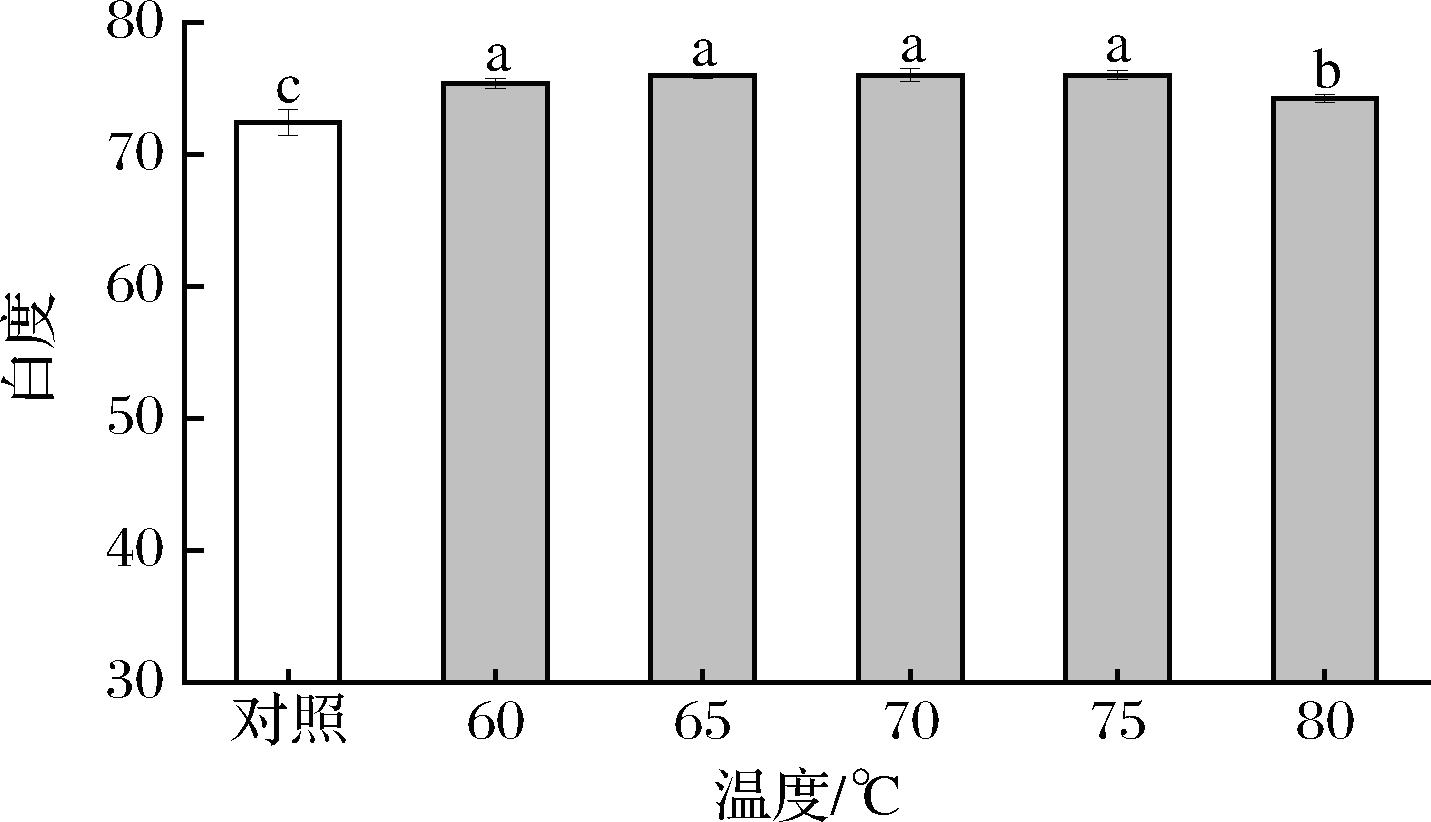
图1 真空低温烹饪温度对MP凝胶白度的影响
Fig.1 Effect of sous-vide cooking temperatures on the whiteness of MP gel
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 SVC温度对MP凝胶蒸煮损失率的影响
蒸煮损失率是评价MP凝胶稳定性的重要参数,并间接反映了凝胶的致密性和吸水性[23]。由图2可知,SVC条件下凝胶蒸煮损失率(13.52%)显著低于对照组(23.11%)(P<0.05);随着SVC温度的升高,MP凝胶的蒸煮损失率呈上升的趋势,在SVC温度为65~75 ℃变化不显著,逐渐增加(P>0.05),而SVC温度80 ℃的蒸煮损失率显著大于SVC温度60 ℃(P<0.05)。分析其原因可能是高温(80 ℃以上)会诱导蛋白质过度变性,破坏了凝胶紧密的网络结构,导致蒸煮损失率增加。此外,对照组的蒸煮损失率高,推测对照处于易氧化的环境,MP可能发生氧化使MP分子间的交联聚集加剧,造成MP蒸煮损失的增加[24]。MP蒸煮损失可以反映加工肉制品的损失,在对鸭肉[25]、牛肉[26]等研究中同样发现,蒸煮损失随加热温度增加而增加,而蒸煮损失的增加会提高加工成本且不利于最佳凝胶状态的形成和肉制品的品质。本实验说明SVC技术可以有效降低MP凝胶蒸煮损失,对凝胶结构的形成具有积极的影响。
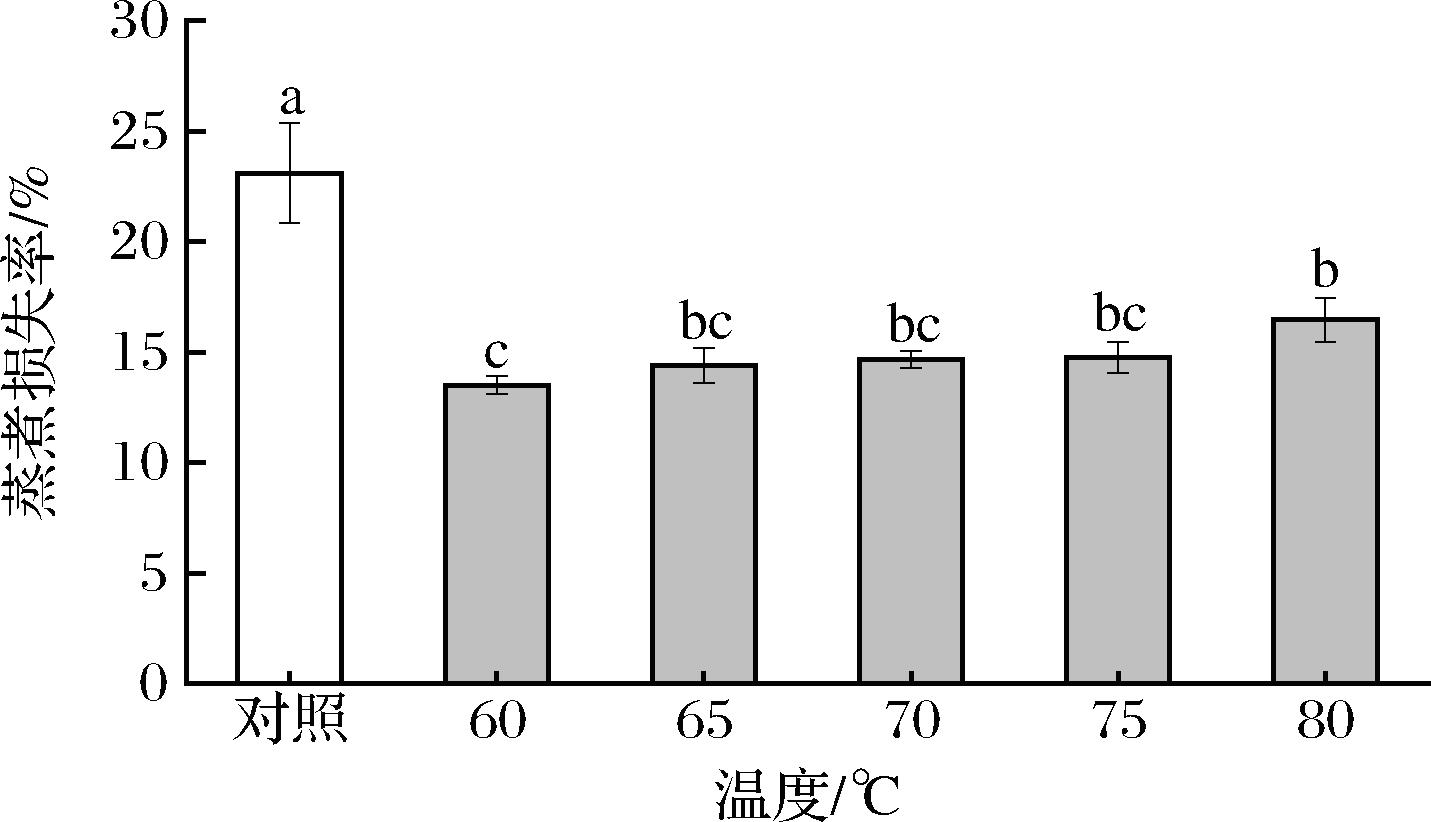
图2 真空低温烹饪温度对MP凝胶蒸煮损失率的影响
Fig.2 Effects of sous-vide cooking temperatures on cooking loss rate of MP gel
2.3 SVC温度对MP凝胶持水力的影响
持水性表征了蛋白质凝胶或基于蛋白质食物在凝胶网络结构中保持滞留水的能力[27],而肉制品的品质如质地、色泽、嫩度等均受到持水力的显著影响[28]。如图3所示,SVC条件的MP凝胶持水性显著高于对照组(P<0.05);随着SVC温度的上升,MP凝胶持水性先增加,然后显著下降(P<0.05)。SVC工艺的持水力的增加表明低温加热有利于MP凝胶中水分子的包封作用。SVC温度(70 ℃)的MP凝胶持水力最高(84.12%),可能是MP在70 ℃时彻底变性,肌球蛋白尾部-尾部充分结合,蛋白之间相互作用形成良好的三维网状结构[29],并且较高的持水性更有利于水-蛋白质相互作用。温度进一步升高(75~80 ℃),MP持水力显著降低,可能是加热使凝胶结构被破坏,氨基酸侧链基团和肽键断裂导致MP凝胶中结合水转变成自由水从而被离心出去[30]。实验组显著高于对照组其原因可能是MP分子与水分子之间的相互作用较强,有利于在凝胶形成过程中结合更多的水,这在凝胶微观结构中也可以看出;此外,对照高温可能导致MP急剧发生变性,快速收缩失水并发生水分蒸发。总之,SVC工艺技术可以提高MP凝胶强度,较高的凝胶强度可能有助于形成更致密的凝胶网络结构,从而束缚更多的水[31]。SHAN等[32]在研究温度和磷酸盐对鸡胸肌原纤维蛋白的影响时,通过低场核磁共振得出低温加热比磷酸盐更有利水分的保留,这与本实验研究结果类似。
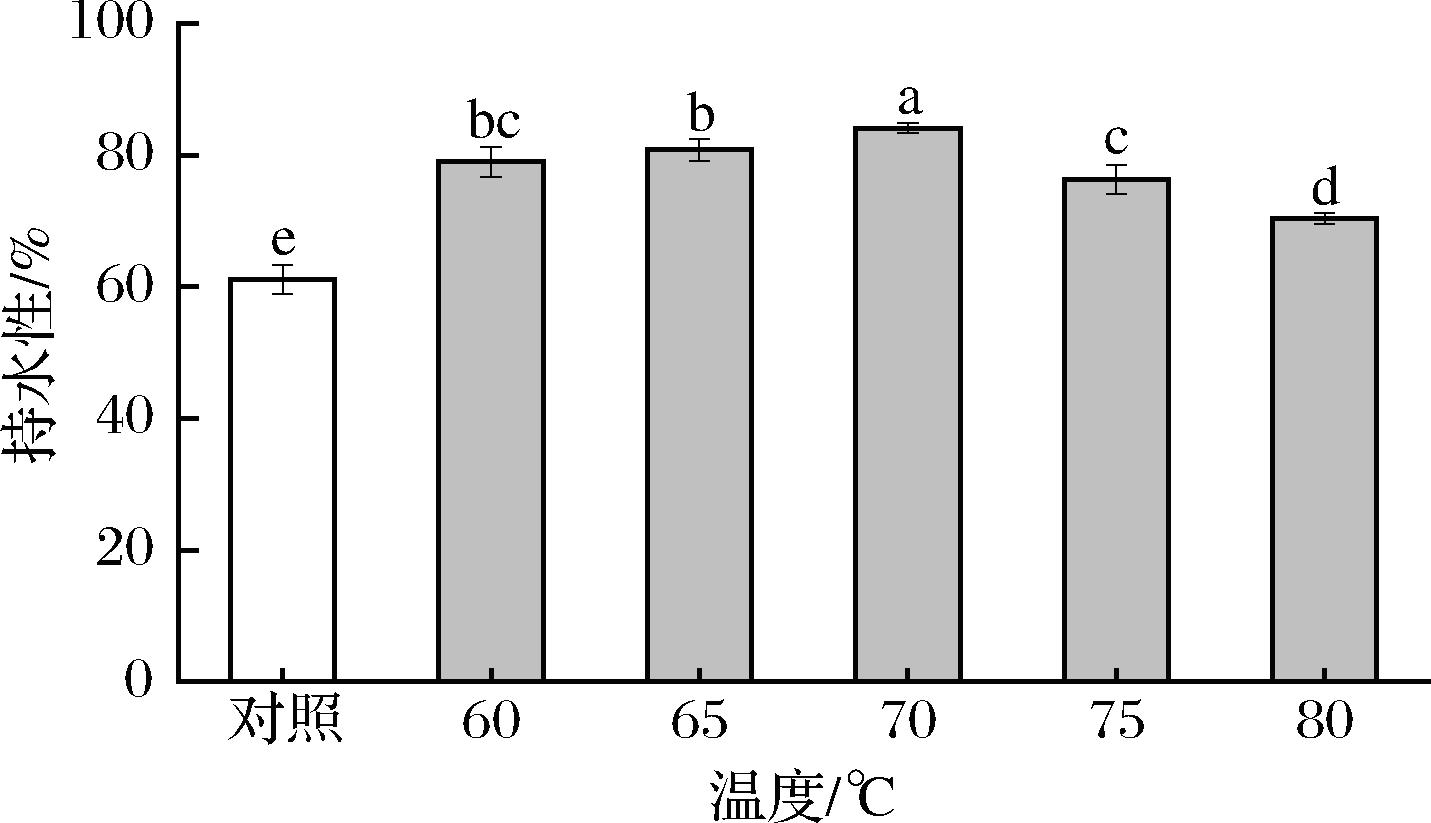
图3 真空低温烹饪温度对MP凝胶持水力的影响
Fig.3 Effect of sous-vide cooking temperatures on water holding capacity of MP gel
2.4 SVC温度对MP凝胶质构的影响
加热诱导肌原纤维蛋白凝胶化对于食品获得理想的感官和质地特性具有重要意义。SVC温度对MP凝胶的质地性质如表1所示,SVC组的硬度、胶黏性、咀嚼性显著低于对照组(P<0.05),弹性显著高于对照(P<0.05);随着SVC加热温度的升高,凝胶硬度、胶黏性、咀嚼性显示出先增后减的趋势,其中弹性变化不显著(P>0.05)。结果表明,MP凝胶在高温加热比SVC温度具有更刚性低弹性的结构,可能是高于蛋白变性温度的长时间加热导致更多蛋白过度变性和分子间结合从而形成更紧凑致密的网络结构,这与微观结构所呈现的变化一致。低温加热形成的凝胶硬度较低弹性更高,可能是肌球蛋白在55 ℃发生变性,而肌动蛋白在70 ℃才开始发生分子交联作用形成凝胶[33],此时蛋白质适度变性聚集,MP结构变化形成不可逆凝胶,低温凝胶网络结构虽不太致密但更有弹性,且疏水相互作用力、氢键显著增强,因此,MP凝胶硬度、弹性、胶黏性、咀嚼性与SVC温度(60~70 ℃)呈正相关。在SVC 70 ℃下MP凝胶硬度(99.392 g)、弹性(0.948 8)、胶黏性(47.650)和咀嚼性(45.282)达到最大,此时凝胶结构达到最佳状态,谭青玲等[13]研究也表明70 ℃卤制的鸭肉品质达到最佳。当SVC温度超过70 ℃,MP凝胶硬度、弹性、胶黏性和咀嚼性均有所下降,可能是长时间高温加热破坏了蛋白质结构,导致蛋白质过度变性后聚合不充分[30]。如上所述,SVC温度加热的MP凝胶比传统对照加更柔软、更有弹性,可以推测低温真空烹饪技术更能够保持肉制品的嫩度,具有更好的口感,更符合现代人们的要求。
表1 真空低温烹饪温度对MP凝胶质构的影响
Table 1 Effect of sous-vide cooking temperatures on texture of MP gel
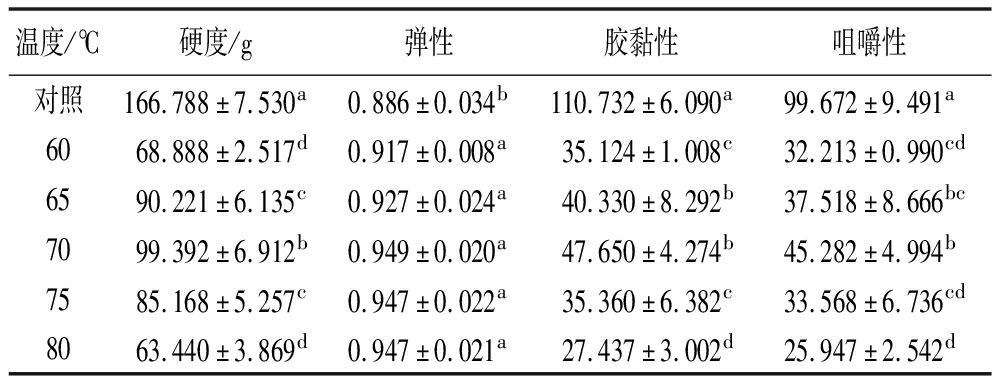
温度/℃硬度/g弹性胶黏性咀嚼性对照166.788±7.530a0.886±0.034b110.732±6.090a99.672±9.491a6068.888±2.517d0.917±0.008a35.124±1.008c32.213±0.990cd6590.221±6.135c0.927±0.024a40.330±8.292b37.518±8.666bc7099.392±6.912b0.949±0.020a47.650±4.274b45.282±4.994b7585.168±5.257c0.947±0.022a35.360±6.382c33.568±6.736cd8063.440±3.869d0.947±0.021a27.437±3.002d25.947±2.542d
注:表中同列不同小写字母表示显著性差异(P<0.05)(下同)。
2.5 SVC温度对MP凝胶相对化学作用力的影响
在热诱导MP变性形成凝胶的过程中,蛋白质-蛋白质相互作用是通过化学作用力发生的,并维持空间结构的稳态,其包括离子键、氢键、疏水相互作用[34]。由图4可知,SVC温度的MP凝胶疏水相互作用相对大小显著高于对照(P<0.05),离子键和氢键略微高于对照(P>0.05);随着SVC温度的升高,离子键、氢键、均略微下降且在60~80 ℃差异不显著(P>0.05),疏水相互作用60~75 ℃差异不显著(P>0.05),在80 ℃显著下降(P<0.05)。其中,MP凝胶的疏水相互作用相对大小远远大于氢键和离子键,其次是氢键,最后是离子键,这说明疏水相互作用在维持MP凝胶网络结构稳定中起主要作用,虽然离子键和氢键几乎不参与凝胶的形成,但它们在稳定蛋白质构象方面起着重要作用,从而间接影响其凝胶性质[35]。由于蛋白变性在60~75 ℃,当凝胶在高温环境中,可能更多的巯基暴露出来交联形成大的聚集体,不利于化学作用力的形成,从而影响质构特性和凝胶网络结构的稳定[36]。本研究说明SVC技术有助于诱导蛋白质分子链的展开,增强蛋白质分子间的疏水相互作用,从而形成更好的三维MP凝胶网络。
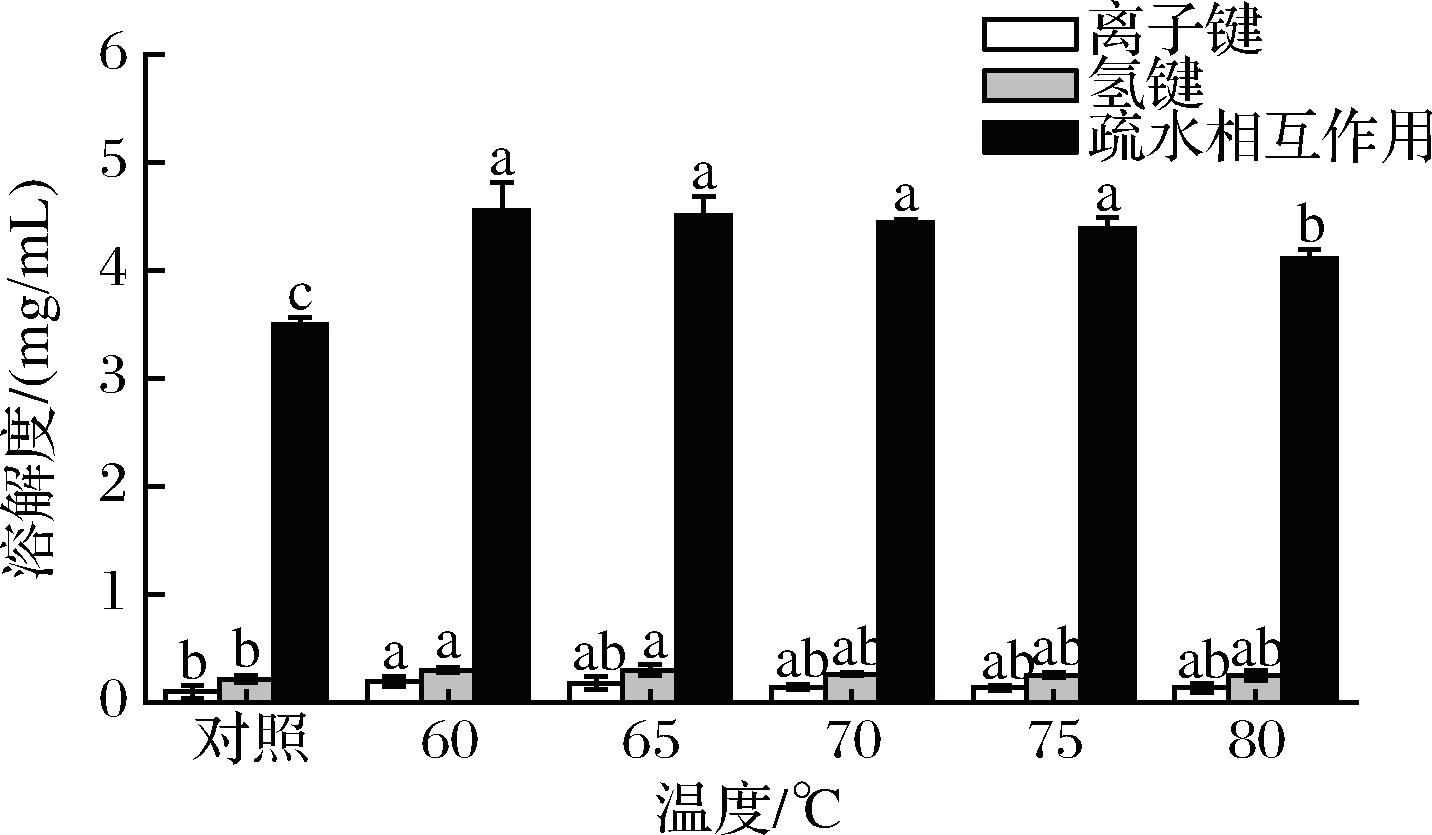
图4 真空低温烹饪温度对 MP 凝胶相对化学作用力的影响
Fig.4 Effect of sous-vide cooking temperatures on relative chemical force of MP gel
2.6 SVC温度对MP凝胶二级结构的影响
傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)是用来检测分析蛋白质二级结构的有效手段。由图5可知,SVC温度升高使MP凝胶在3 260 cm-1附近的吸收峰发生红移,是因为—OH、N—H伸缩振动以及在分子之间生成了更多的氢键[37];在2 920 cm-1附近有吸收是由C—H拉伸振动引起的,表明蛋白质在加热过程中氢键发生变化[38]。SVC低温加热使1 520 cm-1附近的吸收峰轻微蓝移,而对照在1 518 cm-1处表现出强烈的吸收,为蛋白C—N伸缩振动与N—H弯曲振动[37],这表明不同程度的温度引起蛋白质结构发生不同改变,导致红外吸收光谱有所差异。
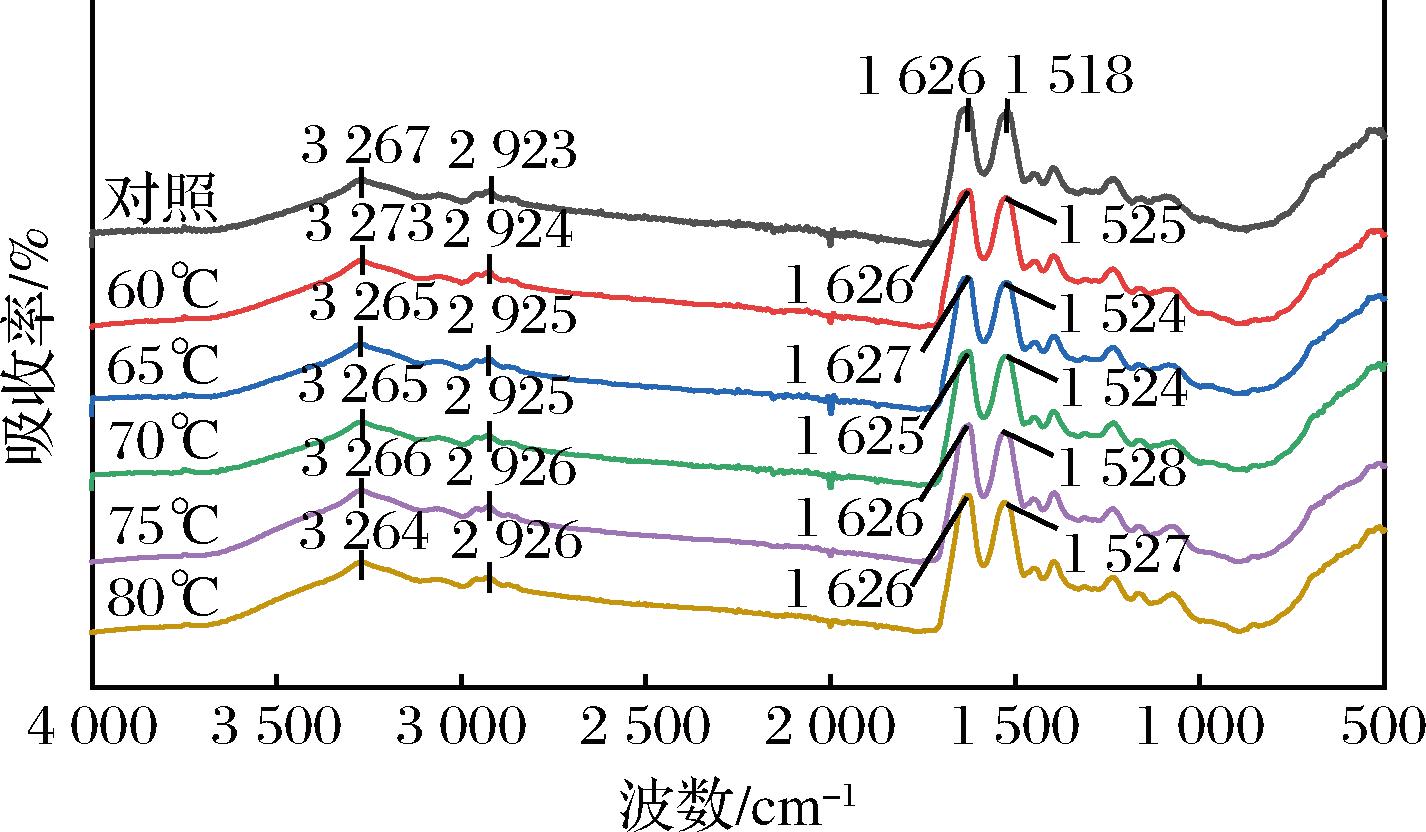
图5 真空低温烹饪温度对MP凝胶的红外光谱图
Fig.5 FTIR spectrum of MP gel tripe at sous-vide cooking temperatures
蛋白质的酰胺Ⅰ带(1 600~1 700 cm-1)具有高灵敏性,其中包括α-螺旋、β-折叠、β-转角和无规则卷曲,通过傅里叶去卷积和酰胺Ⅰ带可定量分析MP二级结构[39],如表2所示。SVC温度的α-螺旋、β-折叠、β-转角与对照组存在显著差异(P<0.05),而无规则卷曲含量未发生显著变化(P>0.05),其含量维持在17%左右;随着SVC温度的升高,α-螺旋和β-转角的比例逐渐降低,同时β-折叠比例显著升高(P<0.05),和刘芙蓉等[40]研究结果变化趋势一致。这表明加热温度使α-螺旋、β-转角结构发生去折叠,蛋白质链展开,内部基团显现,二级结构中α-螺旋、β-转角逐渐转变为β-折叠[41]。β-折叠与氢键有关,加热时凝胶网络的构建也与β-折叠结构形成密切相关,此外α-螺旋减少和β-折叠增加与水分增加相关,这与持水性的结果一致[8,42]。LIU等[35]研究也发现β-折叠含量与蛋白质的凝胶性能呈正相关。而对照组α-螺旋含量较高,β-折叠含量较低,这表明过高的加热温度导致蛋白质变性,可能伴随着羰基和氨基之间氢键的断裂,并生成无序的构象和聚集从而不利于凝胶结构的形成。这在CHOI等[43]的研究中也可证明当含有较高的α-螺旋和较低的β-折叠时,蛋白质的凝胶化和持水能力较低。这说明SVC技术可改变MP二级结构,即SVC可能是通过使α-螺旋构象向β-折叠构象转变,从而影响MP凝胶性能。
表2 真空低温烹饪温度对 MP 凝胶二级结构的影响
Table 2 Effects of sous-vide cooking temperatures on secondary structure of MP gel
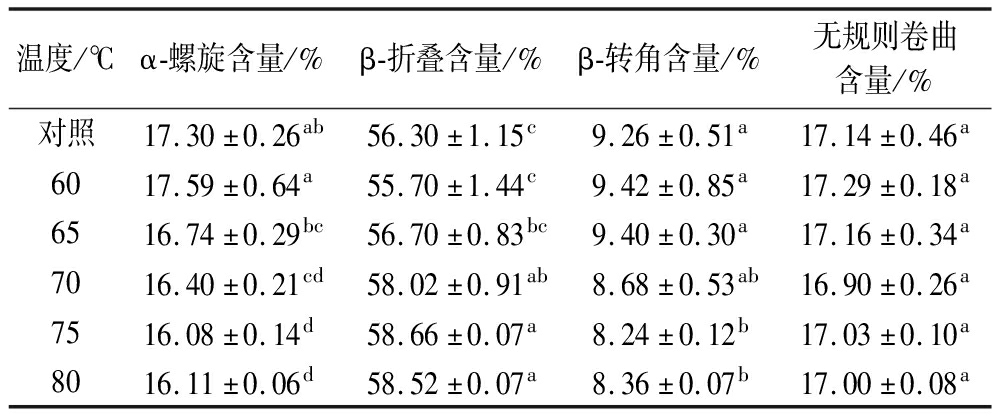
温度/℃α-螺旋含量/%β-折叠含量/%β-转角含量/%无规则卷曲含量/%对照17.30±0.26ab56.30±1.15c9.26±0.51a17.14±0.46a6017.59±0.64a55.70±1.44c9.42±0.85a17.29±0.18a6516.74±0.29bc56.70±0.83bc9.40±0.30a17.16±0.34a7016.40±0.21cd58.02±0.91ab8.68±0.53ab16.90±0.26a7516.08±0.14d58.66±0.07a8.24±0.12b17.03±0.10a8016.11±0.06d58.52±0.07a8.36±0.07b17.00±0.08a
2.7 SVC温度对MP凝胶微观结构的影响
扫描电子显微镜(scanning electron microscope,SEM)图像描绘了蛋白质聚集体的白色区域,而黑色区域代表凝胶网络中的水孔和通道[44]。由图6可知,低温(小于70 ℃)加热MP凝胶通过SEM可见具有相当开放和多孔的蛋白质网络结构。随着SVC温度的升高,MP开始形成质地均匀、有规则的网状结构,凝胶孔径逐渐变小,且网状结构变得更加清晰、有规则,SVC温度为70 ℃时,MP凝胶网络更均匀、更致密,蛋白质之间充分作用对应着更高的持水性和硬度,这与质构和持水力的变化规律一致。随着SVC温度的进一步升高,凝胶的质地变得紧实,但是出现明显的断裂,凝胶的孔径明显增大,形状也逐渐不规则,网络结构中的孔隙和通道为水分子的自由移动提供了更多的空间,导致凝胶持水性的降低。此外,对照组的微观结构也有明显的堆积感、粗糙感,肌纤维结构不清晰,可能是温度过高使蛋白质过度变性,导致凝胶网络结构中出现大的蛋白质聚集体和裂缝[45]。说明适当的SVC温度处理可以形成更加质密的凝胶结构。微观结构进一步解释了在热诱导凝胶形成过程中,SVC温度组的持水性高于对照组,微观结构的变化与凝胶保水性的变化趋势相同,凝胶孔径的大小与保水性呈负相关[17]。

a-对照组的MP凝胶微观结构;b~f-经过60、65、70、75、80 ℃ SVC温度处理的MP凝胶通过扫描电镜放大10 000倍微观结构
图6 真空低温烹饪温度对MP凝胶微观结构的影响
Fig.6 Effect of sous-vide cooking temperatures on microstructure of MP gel
3 结论
本研究说明较低温度的SVC技术能显著提高MP凝胶的性能。相比常规高温加热,SVC技术制备凝胶的持水力、白度和弹性更高,蒸煮损失率和硬度更小;在60~80 ℃ SVC条件的MP凝胶硬度、弹性先升高后降低,在70 ℃达到最大值。70 ℃时网络结构最为清晰质密并形成稳定的凝胶体系,主要原因在于,疏水相互作用、氢键、离子键作用力升高,α-螺旋和β-转角向β-折叠大量转变,肌原纤维蛋白相互作用充分变性,蛋白凝胶体系处于最佳状态。此研究为SVC技术在低温肉制品和凝胶制品中的应用提供一定的理论指导,SVC技术有望提高肉制品的持水性、弹性等,可为食品工业加工提供新的思考方向。
[1] XU B,HE W J,YI Y,et al.The impacting mechanism of β-sanshool in Zanthoxylum bungeanum Maxim on the structure of myofibrillar protein in duck meat[J].LWT,2023,182:114838.
[2] WANG Q L,GU C,WEI R R,et al.Enhanced gelling properties of myofibrillar protein by ultrasound-assisted thermal-induced gelation process:Give an insight into the mechanism[J].Ultrasonics Sonochemistry,2023,94:106349.
[3] 陈美玉.基于水分迁移及肌原纤维蛋白特性研究真空低温加热对牛肉品质的影响[D].杭州:浙江大学,2021.CHEN M Y.Effect of water migration and the structural change of myofibril proteins on beef quality during sous-vide cooking[D].Zhejiang:Zhejiang University,2021.
[4] CHEN B,ZHOU K,WANG Y,et al.Insight into the mechanism of textural deterioration of myofibrillar protein gels at high temperature conditions[J].Food Chemistry,2020,330:127186.
[5] ZHANG L L,XUE Y,XU J,et al.Effects of high-temperature treatment (≥100 ℃) on Alaska Pollock (Theragra chalcogramma) surimi gels[J].Journal of Food Engineering,2013,115(1):115-120.
[6] LIU Q Y,LIN Z Q,CHEN X M,et al.Characterization of structures and gel properties of ultra-high-pressure treated-myofibrillar protein extracted from mud carp (Cirrhinus molitorella) and quality characteristics of heat-induced sausage products[J].LWT,2022,165:113691.
[7] CHEN H,ZHAO G M,YU X L,et al.Exploring in vitro gastrointestinal digestion of myofibrillar proteins at different heating temperatures[J].Food Chemistry,2023,414:135694.
[8] XIA T L,XU Y J,ZHANG Y L,et al.Effect of oxidation on the process of thermal gelation of chicken breast myofibrillar protein[J].Food Chemistry,2022,384:132368.
[9] CHIAN F M,KAUR L,ASTRUC T,et al.Shockwave processing of beef brisket in conjunction with sous vide cooking:Effects on protein structural characteristics and muscle microstructure[J].Food Chemistry,2021,343:128500.
[10] BECKER A,BOULAABA A,PINGEN S,et al.Low temperature cooking of pork meat—Physicochemical and sensory aspects[J].Meat Science,2016,118:82-88.
[11] RASINSKA E,RUTKOWSKA J,CZARNIECKA-SKUBINA E,et al.Effects of cooking methods on changes in fatty acids contents,lipid oxidation and volatile compounds of rabbit meat[J].LWT,2019,110:64-70.
[12] 冯秋凤,高瑞昌,赵元晖,等.真空低温蒸煮技术对鲟鱼鱼堡冷藏品质的影响[J].中国食品学报,2020,20(7):134-142.FENG Q F,GAO R C,ZHAO Y H,et al.The effect of sous vide on the cold storage quality of sturgeon fish steak[J].Journal of Chinese Institute of Food Science and Technology,2020,20(7):134-142.
[13] 谭青玲,夏杨毅,叶柯,等.基于模糊数学感官评价方法的真空低温烹饪卤鸭工艺优化[J].食品研究与开发,2023,44(10):162-169.TAN Q L,XIA Y Y,YE K,et.al.Optimization of sous-vide cooking process of brined duck based on fuzzy mathematical sensory evaluation[J].Food Research and Development,2023,44(10):162-169.
[14] 吴佳,赵鸾,魏娜,等.动态高压微射流处理对低盐肌原纤维蛋白溶解度和结构的影响[J].食品与发酵工业,2022,48(11):129-135.WU J,ZHAO L,WEI N,et al.Effect of dynamic high-pressure microfluidization treatment on the solubility and structure of myofibril protein in low-salted system[J].Food and Fermentation Industries,2022,48(11):129-135.
[15] NIU H L,XIA X F,WANG C,et al.Thermal stability and gel quality of myofibrillar protein as affected by soy protein isolates subjected to an acidic pH and mild heating[J].Food Chemistry,2018,242:188-195.
[16] 张建华,夏杨毅.氧化条件下HL-低钠盐对鹅肉肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业,2020,46(10):166-172.ZHANG J H,XIA Y Y.Effect of HL-low sodium salt on the gel properties of goose meat myofibrillar protein under oxidative conditions[J].Food and Fermentation Industries,2020,46(10):166-172.
[17] 赵磊,夏杨毅,姬雯馨.剪切稀化效应对肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业,2022,48(16):216-222.ZHAO L,XIA Y Y,JI W X,et al.Effects of shear-thinning on gel properties of myofibrillar protein[J].Food and Fermentation Industries,2022,48(16):216-222.
[18] DU X,ZHAO M N,PAN N,et al.Tracking aggregation behaviour and gel properties induced by structural alterations in myofibrillar protein in mirror carp (Cyprinus carpio) under the synergistic effects of pH and heating[J].Food Chemistry,2021,362:130222.
[19] SHIE J S,PARK J W.Physical characteristics of surimi seafood as affected by thermal processing conditions[J].Journal of Food Science,1999,64(2):287-290.
[20] 孔保华,王宇,夏秀芳,等.加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J].食品科学,2011,32(5):50-54.KONG B H,WANG Y,XIA X F,et al.Influence of heating temperature on gel properties of porcine myofibrillar protein[J].Food Science,2011,32(5):50-54.
[21] AKAMITTATH J G,BREKKE C J,SCHANUS E G.Lipid oxidation and color stability in restructured meat systems during frozen storage[J].Journal of Food Science,1990,55(6):1513-1517.
[22] 王立健,罗程,潘雪峰,等.纤维素替代淀粉对肌原纤维蛋白凝胶特性的影响[J].中国农业科学,2022,55(11):2227-2238.WANG L J,LUO C,PAN X F,et al.Effects of cellulose replacing starch on the gel properties of myofibrillar protein[J].Scientia Agricultura Sinica,2022,55(11):2227-2238.
[23] 刘欣,姜鹏飞,傅宝尚,等.高压均质化改性竹笋膳食纤维对虾糜凝胶特性及化学作用力的影响[J/OL].食品科学,2023.https://kns.cnki.net/kcms2/detail/11.2206.TS.20230726.1431.046.html.LIU X,JIANG P F,FU B S,et al.Effects of high-pressure homogenization modified bamboo shoot dietary fiber on the gelation properties and chemical forces of shrimp surimi[J/OL].Food Science,2023.https://kns.cnki.net/kcms2/detail/11.2206.TS.20230726.1431.046.html.
[24] 李保玲,李颖,朱振宝,等.氧化亚油酸对肌原纤维蛋白胶凝行为及热诱导凝胶体外消化率的影响[J].食品与发酵工业,2021,47(19):111-119.LI B L,LI Y,ZHU Z B,et al.Effect of oxidized linoleic acid on gelling behavior of myofibrillar protein and in vitro digestibility of the heat-induced gel[J].Food and Fermentation Industries,2021,47(19):111-119.
[25] CHANG Y S,CHEN J W,WU Y H S,et al.A possible systematic culinary approach for spent duck meat:Sous-vide cuisine and its optimal cooking condition[J].Poultry Science,2023,102(6):102636.
[26] ISMAIL I,HWANG Y H,JOO S T.Interventions of two-stage thermal sous-vide cooking on the toughness of beef semitendinosus[J].Meat Science,2019,157:107882.
[27] JOERES E,DRUSCH S,TÖPFL S,et al.Ohmic vs.conventional heating:Influence of moderate electric fields on properties of potato protein isolate gels[J].Innovative Food Science &Emerging Technologies,2023,85:103333.
[28] HUFF-LONERGAN E,LONERGAN S M.Mechanisms of water-holding capacity of meat:The role of postmortem biochemical and structural changes[J].Meat Science,2005,71(1):194-204.
[29] 王宇.不同温度处理及添加物对猪肉肌原纤维蛋白功能性的影响[D].哈尔滨:东北农业大学,2010.WANG Y.Effects of different temperature treatments and additives on the functionality of pork myofibrillar protein[D].Harbin:Northeast Agricultural University,2010.
[30] 李苓,杨明柳,周迎芹,等.加热温度对鳜鱼肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业,2023,49(19):242-248.LI L,YANG M L,ZHOU Y Q,et al.Effects of heating temperature on the gel properties of mandarin fish (Siniperca chuatsi) myofibrillar protein[J].Food and Fermentation Industries,2023,49(19):242-248.
[31] WANG L M,WANG X,MA J,et al.Effects of radio frequency heating on water distribution and structural properties of grass carp myofibrillar protein gel[J].Food Chemistry,2021,343:128557.
[32] SHAN L Y,LI Y,WANG Q M,et al.Profiles of gelling characteristics of myofibrillar proteins extracted from chicken breast:Effects of temperatures and phosphates[J].LWT,2020,129:109525.
[33] 李超,徐为民,王道营,等.加热过程中肉嫩度变化的研究[J].食品科学,2009,30(11):262-265.LI C,XU W M,WANG D Y,et al.Heat induced change of meat tenderness[J].Food Science,2009,30(11):262-265.
[34] CAO H W,FAN D M,JIAO X D,et al.Effects of microwave combined with conduction heating on surimi quality and morphology[J].Journal of Food Engineering,2018,228:1-11.
[35] LIU R,ZHAO S M,XIE B J,et al.Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J].Food Hydrocolloids,2011,25(5):898-906.
[36] 韩宗元,邵俊花,潘燕墨,等.蛋白质适度加工:热聚集与凝胶品质阐述以及过度聚集的调控对策[J].食品科学,2023,44(9):177-184.HAN Z Y,SHAO J H,PAN Y M,et al.Moderate protein processing:Elucidation of thermal aggregation and gel quality and regulatory strategies for excessive aggregation[J].Food Science,2023,44(9):177-184.
[37] 万红兵.高熟度牛肉嫩度特异性及其肌原纤维蛋白结构变化机制研究[D].北京:中国农业科学院,2020.WAN H B.Study on tenderness specificity of high-cooked beef and its myofibrillar protein structure change mechanism[D].Beijing:Chinese Academy of Agricultural Sciences,2020.
[38] EISSA A S,PUHL C,KADLA J F,et al.Enzymatic cross-linking of β-lactoglobulin:Conformational properties using FTIR spectroscopy[J].Biomacromolecules,2006,7(6):1707-1713.
[39] BIAN C H,YU H J,YANG K,et al.Effects of single-,dual-,and multi-frequency ultrasound-assisted freezing on the muscle quality and myofibrillar protein structure in large yellow croaker (Larimichthys crocea)[J].Food Chemistry:X,2022,15:100362.
[40] 刘芙蓉,王雨生,李鹏,等.热诱导温度与pH值对乳清浓缩蛋白凝胶结构和性质的影响[J].食品科学,2022,43(20):125-134.LIU F R,WANG Y S,LI P,et al.Effect of heating temperature and pH on the structure and properties of whey protein concentrate gels[J].Food Science,2022,43(20):125-134.
[41] JIN D L,WEI J L,HE F Y,et al.Effect of tea polyphenols on sturgeon myofibrillar protein structure in the in vitro anti-glycation model mediated by low temperature vacuum heating[J].Food Chemistry,2023,407:135133.
[42] HERRERO A M.Raman spectroscopy a promising technique for quality assessment of meat and fish:A review[J].Food Chemistry,2008,107(4):1642-1651.
[43] CHOI S M,MA C Y.Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy[J].Food Chemistry,2007,102(1):150-160.
[44] ZHUANG X B,HAN M Y,JIANG X P,et al.The effects of insoluble dietary fiber on myofibrillar protein gelation:Microstructure and molecular conformations[J].Food Chemistry,2019,275:770-777.
[45] WU D,GUO J J,WANG X,et al.The direct current magnetic field improved the water retention of low-salt myofibrillar protein gel under low temperature condition[J].LWT,2021,151:112034.