钙是人体必需的矿物质元素,与生命维持和物质代谢密切相关,缺钙严重影响人体的健康[1-3]。第三次营养调查结果显示,我国人群钙摄入量普遍较低,缺钙现象普遍,青少年和中老年群体尤为突出。由于我国膳食结构的不合理性,且饮食中摄入的钙会与食物中的膳食纤维等物质结合,从而影响人体对钙的吸收,人体只从食物中摄取钙不能达到补钙的目的[4]。有研究表明,儿童与青少年时期补充足量的钙有助于骨密度增长[5],更年期妇女及老人摄入足量的钙将会减缓骨量流失,降低患骨质疏松的风险[6]。因此,选择合适的钙制剂进行补充,是较优的补钙途径。
生蚝在我国的产量和消费量都很大,是重要的经济贝类[7]。生蚝壳作为生蚝加工的副产物,大部分被直接丢弃,对环境产生较大影响,生蚝壳的再利用特别是高值化利用对资源利用和环境保护有重要性和必要性[8]。生蚝壳中碳酸钙的含量大于90%,是良好的钙源,以生蚝壳为原料制备生物钙逐渐引起人们的重视[9]。目前市场上传统的钙制剂吸收率低,溶解率低,部分有机钙毒性较高,氨基酸螯合钙是一种新型的营养强化剂[10-11]。氨基酸鳌合钙吸收率高副作用小,生物利用率高,有同时补充钙元素和氨基酸的优点,是一种较理想的钙营养强化剂。因此,低成本、工业化制备氨基酸鳌合钙具有很强的实用价值和广阔的市场前景[12]。近年来,关于氨基酸螯合钙的研究主要集中在工艺,部分研究利用高蛋白质下脚料酶解得到复合氨基酸再将其与钙源进行螯合制备复合氨基酸螯合钙,此种方法有制备成本较高、氨基酸种类不明等缺点。其次主要有单一氨基酸螯合钙的制备,多选用天冬氨酸、甘氨酸、谷氨酸等氨基酸;如王真等[13]利用太平洋牡蛎壳制备L-天冬氨酸螯合钙并对其进行表征分析;王家明等[14]利用牡蛎壳制备谷氨酸螯合钙,过多摄入单一氨基酸可能对人体有一定的副作用,而复合氨基酸可以较好避免[4]。钙元素和必需氨基酸都是人体必需的物质,复合必需氨基酸螯合钙同时满足了补钙和补充必需氨基酸的需求,但目前利用必需氨基酸制备复合氨基酸螯合钙的研究较少。
本实验以生蚝壳为钙源,选用8种必需氨基酸与钙溶液进行螯合,选出螯合率最高的2种氨基酸进行等比例复合,得到氨基酸螯合钙的最佳螯合条件,为复合必需氨基酸螯合钙的研究和生蚝壳的再利用提供理论参考。
1 材料与方法
1.1 材料与试剂
生蚝壳:广东省潮州市饶平县海山镇海岸沿线。
实验过程所用的氨基酸均购于上海源叶生物科技有限公司;胰蛋白酶、胃蛋白酶,合肥千盛生物科技公司;盐酸,深圳博林达有限公司;硫化钠、乙二胺四乙酸二钠、钙羧酸、氢氧化钾,天津市大茂化学试剂厂;柠檬酸钠、柠檬酸,天津市百世化工有限公司;乳酸,天津市致远化学试剂有限公司;冰乙酸,天津市北联精细化学品开发有限公司(均为分析纯)。
1.2 仪器与设备
数显恒温水浴锅、真空泵、旋转蒸发器、集热式恒温加热磁力搅拌器、旋转蒸发仪、冷冻干燥机,上海力辰邦西仪器科技有限公司;电子分析天平,华志福建电子科技有限公司;离心机,湖南湘仪实验室仪器开发有限公司;pH计,上海精密科学仪器有限公司;紫外可见光分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 蚝壳粉酸解制备可溶性钙
1.3.1.1 样品的制备
将废弃蚝壳清洗后除去表面杂物,用超声机清洗机清洗后烘干,用锤子敲碎成小块后,用粉碎机粉碎后过100目筛得到生蚝壳粉[13]。
1.3.1.2 水解酸种类的选择
称取0.1 g蚝壳粉,分别加入到2 mL的2 mol/L盐酸、乳酸、醋酸、柠檬酸溶液中,加入8 mL的蒸馏水,在水浴50 ℃的条件下水解30 min,测各酸水解液中可溶性钙的含量[15]。测定方法采用GB 5009.92—2016《食品中钙的测定》EDTA滴定法。
1.3.1.3 蚝壳粉酸水解单因素试验
参照杜冰等[15]的方法,以盐酸体积、盐酸浓度、水解时间、水解温度4个因素进行单因素试验。称取0.1 g蚝壳粉,通过固定其他因素,依次研究盐酸体积(1、2、3、4、5 mL)、盐酸浓度(0.5、1.0、1.5、2.0 mol/L)、水解时间(10、15、20、25、30 min)、水解温度(30、40、50、60、70、80 ℃)对可溶性钙得率的影响。
1.3.1.4 正交优化蚝壳粉酸水解试验
在单因素试验的基础上,以可溶性钙得率为指标,选取盐酸体积、盐酸浓度、水解时间和水解温度4因素,进行L9(34)正交试验,因素水平见表1。
表1 酸水解正交试验因素水平表
Table 1 Factor level table for acid hydrolysis orthogonal experiments
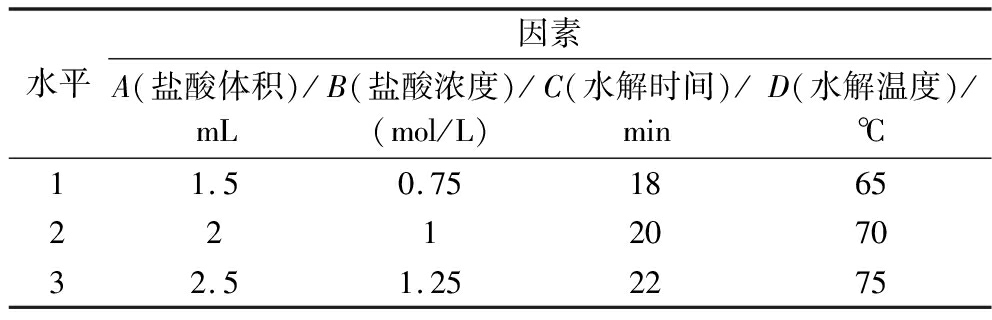
水平因素A(盐酸体积)/mLB(盐酸浓度)/(mol/L)C(水解时间)/minD(水解温度)/℃11.50.751865221207032.51.252275
1.3.1.5 最优酸解工艺验证
在正交试验确定的最优酸解条件下进行3次平行实验,以可溶性钙得率为指标,验证最优酸解条件下的可溶性钙得率。
1.3.2 氨基酸螯合钙的制备工艺优化
1.3.2.1 必需氨基酸的筛选
将最佳酸解条件下得到的蚝壳粉酸水解液分别与赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸进行螯合,找出螯合率最高的2种氨基酸以1∶1的比例进行复合。
分别移取0.10 mol/L赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸溶液30 mL于烧杯中,再加入最佳酸解条件下得到的蚝壳溶液30 mL,于水浴锅中加热至60 ℃,滴加2.0 mol/L HCl调至溶液pH=6,恒温搅拌30 min,浓缩后加入无水乙醇沉淀氨基酸螯合钙,离心后取上清液,测定上清液中的游离钙含量并测定螯合率,如公式(1)所示:
螯合率![]()
(1)
[:W1,反应体系中钙的含量,mg/g;W2,反应后体系中钙的含量,mg/g。
1.3.2.2 单因素试验
以体积比、温度、pH值、反应时间4个因素进行单因素设计试验[16]。选取温度为60 ℃、pH值为6、反应时间为30 min的条件下,进行体积比因素研究,体积比(氨基酸:酶解液)选取3∶1、2∶1、1∶1、1∶2、1∶3;选取pH值为6、体积比为1∶1、反应时间为30 min的条件下,进行温度因素的研究,温度选取30、40、50、60、70、80 ℃;选取温度为60 ℃、体积比为1∶1、反应时间为30 min的条件下,进行pH值因素的研究,pH值选取5、6、7、8、9;选取温度为60 ℃、体积比为1∶1、pH值为6的条件下进行反应时间因素的研究,选取反应时间为20、30、40、50 min,研究各因素对螯合率的影响。
1.3.2.3 正交优化复合氨基酸螯合试验
在单因素试验的基础上,以螯合率为指标,用上述筛选比例的复合氨基酸与体积比、温度、时间、pH值4个单因素,进行L9(34)正交试验(表2),确定最适宜的螯合工艺条件。
表2 复合氨基酸螯合钙的螯合正交试验因素水平表
Table 2 Factor level table for chelation orthogonal test of calcium chelated with complex amino acids

水平因素A(体积比)B(温度)/℃C(时间)/minD(pH值)15∶265357.522∶17040833∶175458.5
1.3.2.4 最优螯合工艺验证
在正交试验确定的最优螯合工艺条件下进行3次平行实验,以螯合率为指标,验证最优螯合条件下的螯合率。
1.3.3 氨基酸螯合钙的紫外扫描分析
参照胡振珠[16]的方法,取复合氨基酸鳌合钙溶解于水中,取质量浓度为2.5 mg/mL的样品在190~400 nm的波长进行扫描,得到紫外可见光谱图。同时对质量浓度为2.5 mg/mL的复合氨基酸进行扫描。
1.3 数据处理
实验结果采用Origin 2018和SPSS 26.0数据分析软件进行相关统计分析,作图采用Origin 2018软件。
2 结果与分析
2.1 蚝壳粉酸解制备可溶性钙
2.1.1 水解酸种类的选择
不同酸溶液对蚝壳粉的溶解情况如图1所示,盐酸的可溶性钙得率为214.13 mg/g,醋酸的可溶性钙得率为165.74 mg/g,乳酸的可溶性钙得率为155.61 mg/g,柠檬酸的可溶性钙得率为114.20 mg/g,盐酸对蚝壳粉中钙离子的溶出效果最好,其次为醋酸和乳酸,柠檬酸的效果最差。因此,选取盐酸为制备可溶性钙的酸。

图1 不同酸对可溶性钙得率的影响
Fig.1 Effect of different acids on the yield of soluble calcium
注:不同小写字母表示显著性差异(P<0.05)(下同)。
2.1.2 蚝壳粉酸水解单因素试验
以生蚝壳粉为钙源制备可溶性钙的单因素试验结果如图2所示。由图2-A可知,随着盐酸体积的增加,可溶性钙得率逐渐增加,体积为2 mL时的可溶性钙得率相比于体积为1 mL时的可溶性钙得率明显上升(P<0.05),在2~5 mL的体积内可溶性钙得率的变化不明显(P>0.05),但与1 mL的体积相比,其可溶性钙得率均显著提高,因此,确定2 mL是最佳溶解体积。由图2-B可知,随着盐酸浓度的增加,可溶性钙得率逐渐上升。盐酸浓度为1 mol/L的可溶性钙得率明显高于盐酸浓度为0.5 mol/L的可溶性钙得率(P>0.05),在浓度为1~2 mol/L的浓度内,可溶性钙得率的变化不明显(P<0.05),但与0.5 mol/L的浓度相比,其可溶性钙得率均显著提高,因此,确定1 mol/L是最佳溶解盐酸浓度。由图2-C可知,随着水解时间的延长,可溶性钙得率越来越高,水解时间为20 min时所得的可溶性钙得率明显高于水解时间为10 min和15 min(P<0.05),当时间延长到25 min和30 min时,可溶性钙得率没有明显升高(P>0.05),因此水解的最佳时间是20 min。由图2-D可知,随着水解温度的升高,可溶性钙得率逐渐升高,当温度为70 ℃时,可溶性钙得率明显较温度为30、40、50、60 ℃时高,有明显的区别(P<0.05),当温度提高到80 ℃时,可溶性钙得率并没有明显的提升(P>0.05),出于节约能源和经济考虑,70 ℃为最佳的水解温度。
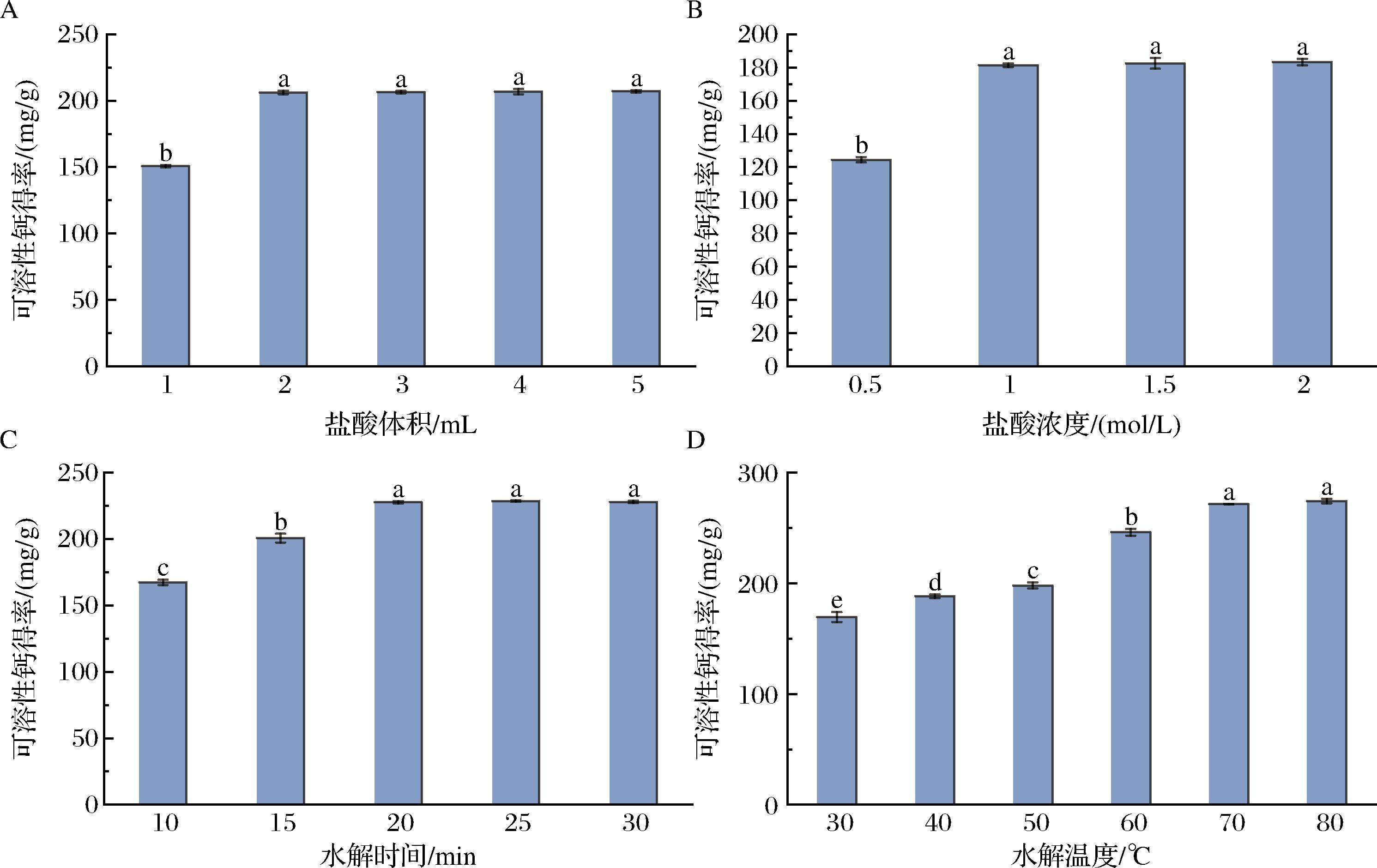
A-盐酸体积;B-盐酸浓度;C-水解时间;D-水解温度
图2 酸解条件对可溶性钙得率的影响
Fig.2 Effect of acidolysis conditions on the yield of soluble calcium
2.1.3 蚝壳粉酸水解正交试验结果
由表3极差分析可得,因素的主次顺序为B>A>C>D,盐酸浓度和盐酸体积对可溶性钙的溶出率影响是最显著的,水解时间和水解温度对可溶性钙得率的影响不太显著。因素水平最佳组合为A3B3C3D2。所以,蚝壳粉的最佳水解条件为:0.1 mg生蚝壳粉加入2.5 mL 1.25 mol/L的盐酸溶液在70 ℃的条件下水解22 min。
表3 蚝壳粉酸水解制备可溶性钙正交试验结果
Table 3 Results of orthogonal experiments on the preparation of soluble calcium by acid hydrolysis of oyster shell powder

试验号因素盐酸体积盐酸浓度水解时间水解温度可溶性钙得率/(mg/g)11.50.751865184.0321.512070240.4131.51.252275248.18420.752075230.935212265254.79621.251870261.0172.50.752270254.1382.511875252.8292.51.252065273.86k1224.21223.03232.62237.56k2248.91249.34248.40251.85k3260.27261.02252.37243.98极差36.0637.9919.7514.29
2.1.4 最优酸解工艺验证
将正交试验得到的最优酸解组合A3B3C3D2(即盐酸体积为2.5 mL、盐酸浓度为1.25 mol/L、酸解温度为70 ℃、酸解时间为22 min)进行验证试验,所得可溶性钙得率为291.63 mg/g,达到了预期效果。
2.2 氨基酸螯合钙的制备工艺优化
2.2.1 必需氨基酸的筛选
8种必需氨基酸和蚝壳粉酸解液的螯合情况如图3所示,其中缬氨酸的螯合率最高,为58.48%,其次为苏氨酸,螯合率为49.94%。其余6种氨基酸的螯合率均低于40%,缬氨酸和苏氨酸是螯合率最高的氨基酸。有研究表明,赖氨酸螯合钙极易溶于水,后续提取工艺难度高;而亮氨酸螯合钙、异亮氨酸螯合钙较难溶于水,当温度达到50 ℃时都无法完全溶解,会给人体带来吸收的负担;苯丙氨酸螯合钙在室温下易潮解,不适宜做成钙片[17];综合考虑螯合率和其他因素,选择缬氨酸和苏氨酸为本次实验的复合氨基酸来源。
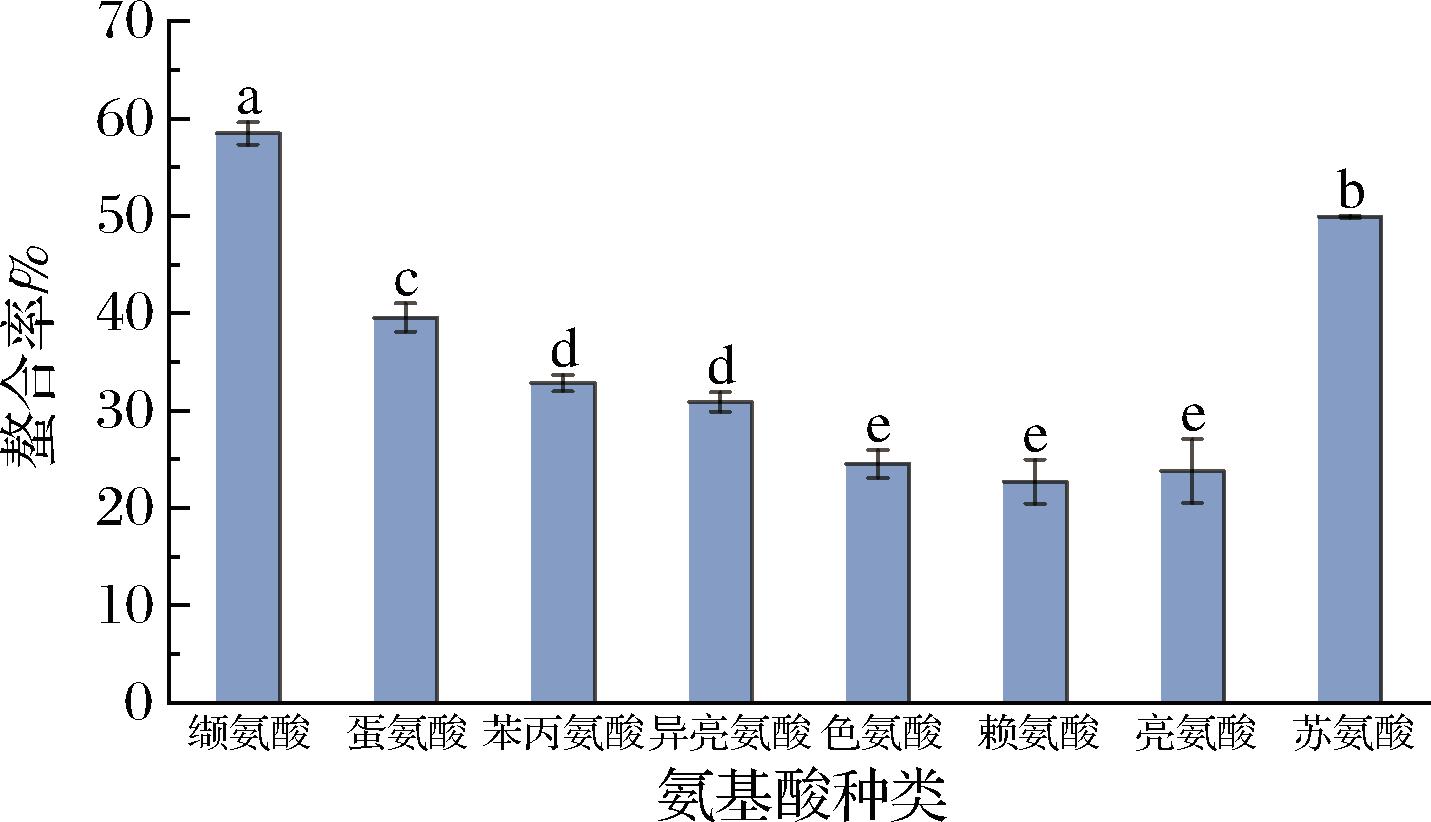
图3 不同必需氨基酸与酸解液的螯合情况
Fig.3 Chelation of different essential amino acids with acid solution
2.2.2 单因素试验结果
体积比(氨基酸∶酶解液)对螯合率的影响如图4-A所示,随着体积比的降低,螯合率先增加后降低,体积比为2∶1时,螯合率最高,随着体积比继续降低,螯合率降低。这是因为Ca2+可以与多个配体氨基酸结合,体积比较低时,Ca2+不足,螯合反应不完全,造成螯合率偏低[13]。如图4-B所示,随着温度的升高,螯合率先逐渐上升,在70 ℃时螯合率达到最高,当温度继续上升时,螯合率有所下降。温度升高,加快了螯合反应的速率,当温度过高时,可能导致复合氨基酸螯合钙降解[11]。如图4-C所示。随着pH值的升高,螯合率先增加后下降,pH值为8时,螯合率最高。当pH值较低时,游离H+较多,影响氨基酸与Ca2+螯合,螯合率降低[13];当pH值过高时,羟基参与争夺金属离子,可能影响螯合反应[11]。如图4-D所示,随着反应时间的延长,螯合率先增加后下降,反应时间为40 min时,螯合率最高。许先猛等[18]的研究表明,温度的升高会加快反应速率,螯合率增加,温度过高不利于螯合反应的发生,同时会造成能源的浪费,因此,40 min是最佳的反应时间。
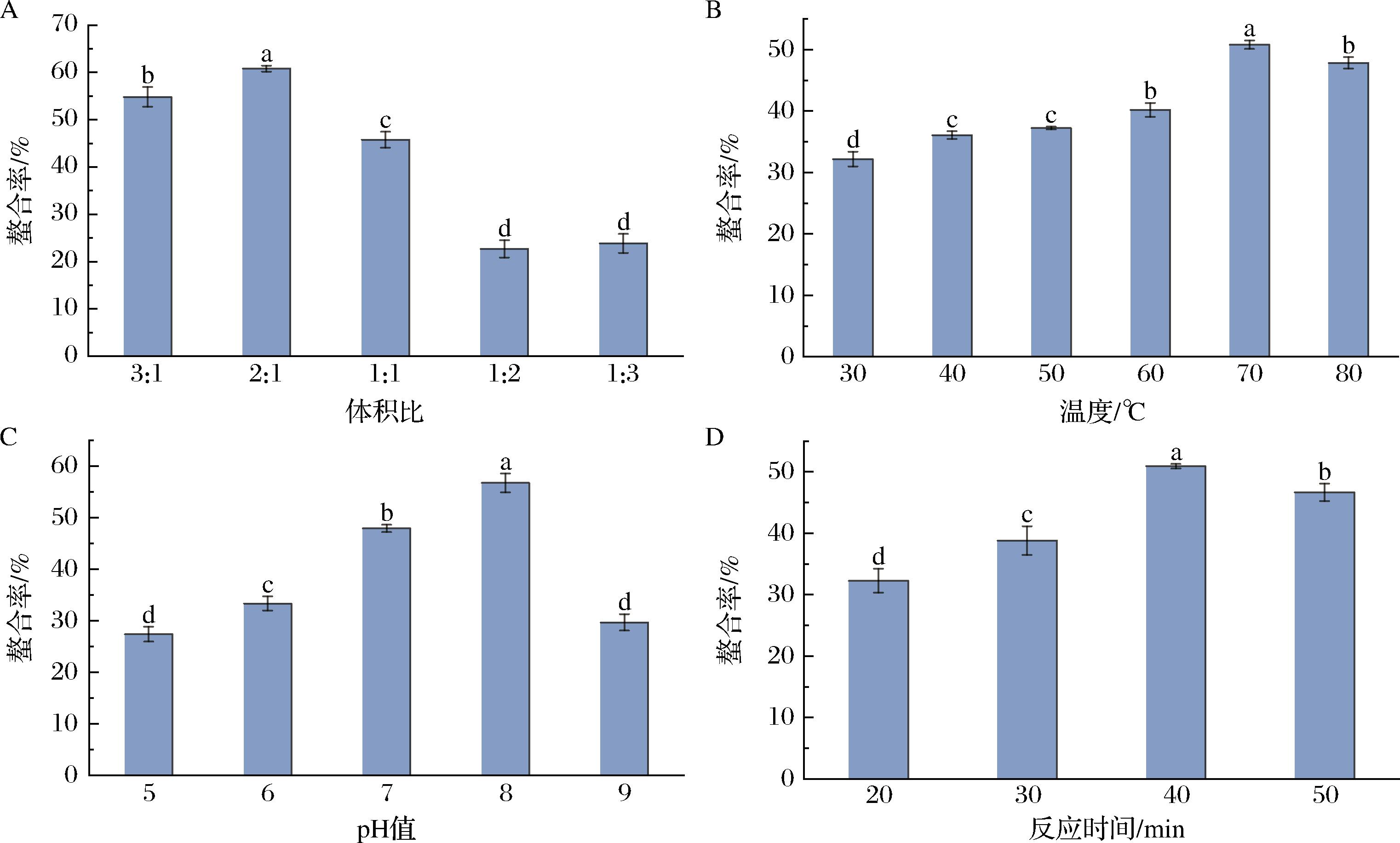
A-体积比;B-温度;C-pH值;D-反应时间
图4 螯合条件对螯合率的影响
Fig.4 Effect of chelation conditions on chelation rate
2.2.3 正交优化复合氨基酸螯合试验
由表4极差分析结果可得,各因素对氨基酸螯合钙螯合率的影响大小为体积比>温度>pH值>反应时间,氨基酸螯合钙螯合的最优螯合条件组合为A1B3C2D3,即体积比为5∶2,温度为75 ℃,pH值为8,反应时间为45 min。
表4 正交优化复合氨基酸螯合试验结果
Table 4 Orthogonal optimisation of complex amino acid chelation experimental results
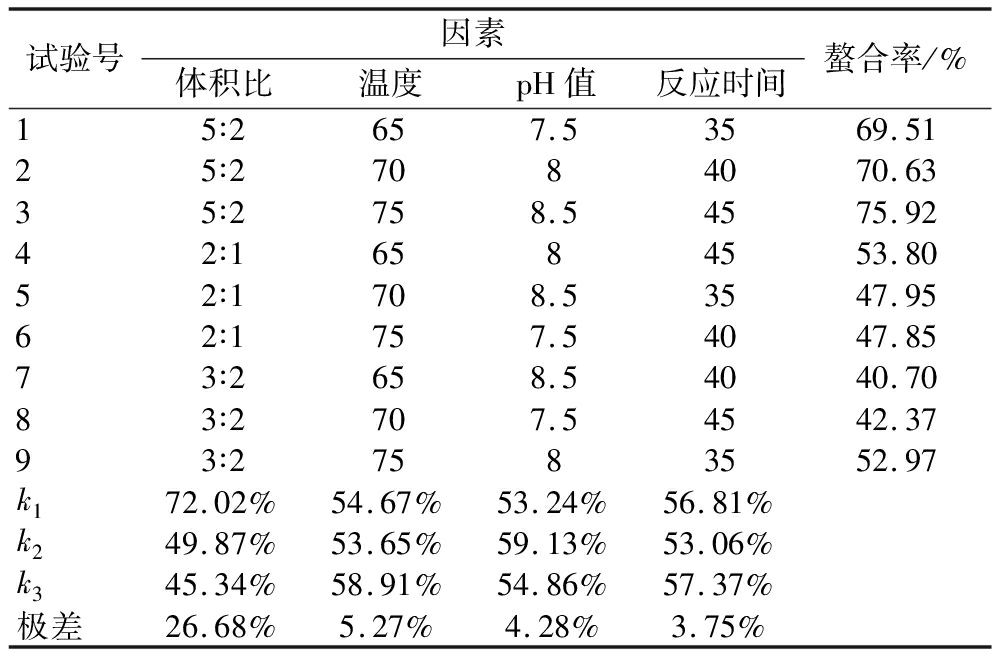
试验号因素体积比温度pH值反应时间螯合率/%15∶2657.53569.5125∶27084070.6335∶2758.54575.9242∶16584553.8052∶1708.53547.9562∶1757.54047.8573∶2658.54040.7083∶2707.54542.3793∶27583552.97k172.02%54.67%53.24%56.81%k249.87%53.65%59.13%53.06%k345.34%58.91%54.86%57.37%极差26.68%5.27%4.28%3.75%
2.2.4 最优螯合条件验证实验
将正交试验得到的最优螯合条件A1B3C2D3(即体积比为5∶2,温度为75 ℃,pH值为8,反应时间为45 min)进行验证实验,最终螯合率为80.85%,达到了预期效果。
2.3 紫外光谱图分析
由图5可知,复合氨基酸和复合氨基酸螯合钙的图谱在190~220 nm发生了明显的变化,复合氨基酸的吸收峰在201 nm处,在螯合反应过后,吸收峰移动到了196 nm处,复合氨基酸螯合钙的吸收峰和复合氨基酸的吸收峰明显不同,发生了移动,这可能是氨基酸与钙离子的螯合作用改变了原有的物质结构,钙离子的加入导致了电荷迁移、配位场跃迁[16]。
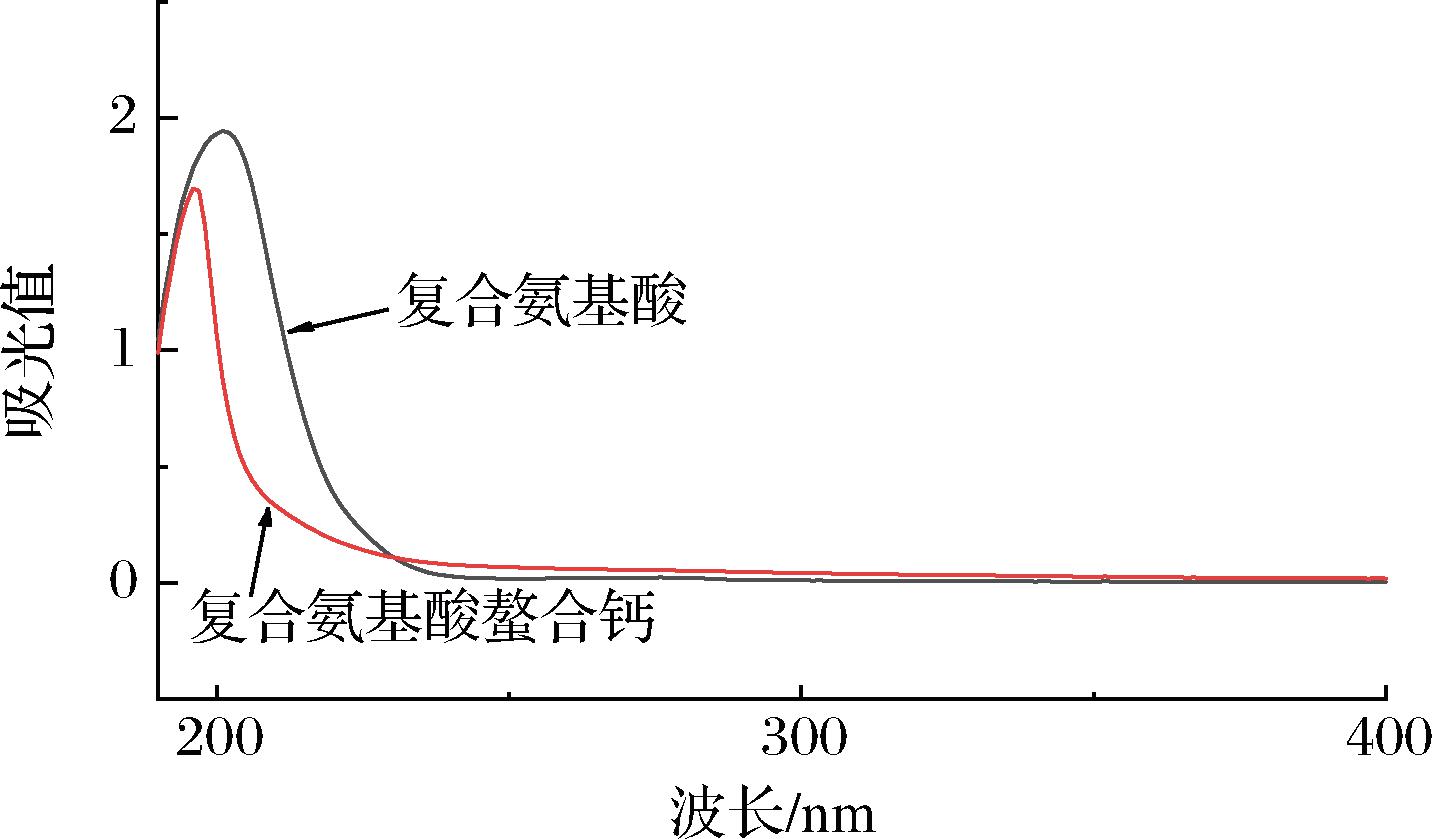
图5 复合氨基酸与复合氨基酸螯合钙的紫外-可见光谱图
Fig.5 UV-Vis spectra of complex amino acids and complex amino acid chelated calcium
3 结论与讨论
综上所述,生蚝壳是一种良好的钙源,本研究以蚝壳粉为钙源,利用酸水解法制备可溶性钙,得出最佳的酸解工艺条件是0.1 g生蚝壳粉加入2.5 mL浓度为1.25 mol/L的盐酸,酸解时间为22 min,温度为70 ℃,在此条件下,可溶性钙得率为291.63 mg/g。所得可溶性钙溶液与8种必需氨基酸螯合,选出螯合率最高的缬氨酸和苏氨酸进行等比例复合,制备复合必需氨基酸螯合钙,得到最佳的螯合工艺为:复合氨基酸与酸解液的体积比为5∶2,在温度75 ℃、pH值为8的条件下反应45 min,此条件下最佳的螯合率为80.85%。本研究为生蚝产业下脚料的高值化利用和钙营养强化剂提供了新的研究思路。后续将进一步研究复合必需氨基酸的结构表征,理化性质和生物可利用性等。
[1] TEEGARDEN D.Calcium intake and reduction in weight or fat mass[J].The Journal of Nutrition,2003,133(1):249S-251S.
[2] LIU S M,SONG Y Q,FORD E S,et al.Dietary calcium,vitamin D,and the prevalence of metabolic syndrome in middle-aged and older U.S.women[J].Diabetes Care,2005,28(12):2 926-2 932.
[3] DE ASSUMPÇ O D,DIAS M R M G,DE AZEVEDO BARROS M B,et al.Calcium intake by adolescents:A population-based health survey[J].Jornal De Pediatria,2016,92(3):251-259.
O D,DIAS M R M G,DE AZEVEDO BARROS M B,et al.Calcium intake by adolescents:A population-based health survey[J].Jornal De Pediatria,2016,92(3):251-259.
[4] 邓锦红,谢翔宇,钟泳,等.以贝壳粉为钙源的复合氨基酸螯合钙制备工艺优化[J].食品研究与开发,2023,44(8):125-130.DENG J H,XIE X Y,ZHONG Y,et al.Preparation technology of compound amino acids chelated calcium with shell powder as calcium source[J].Food Research and Development,2023,44(8):125-130.
[5] 孙晓红,詹国瑛,孙建琴,等.补钙对大鼠峰值骨量形成和预防骨质疏松的作用[J].营养学报,2001,23(1):40-43.SUN X H,ZHAN G Y,SUN J Q,et al.Effect of increasing calcium intake on the formation of peak bone mass and the prevention of postmenopausal osteoporosis in female rats[J].Acta Nutrimenta Sinica,2001,23(1):40-43.
[6] 王珊珊,李八方,周德庆,等.鳕鱼骨活性钙的正交试验优化及其生物利用度分析[J].食品科学,2015,36(20):13-18.WANG S S,LI B F,ZHOU D Q,et al.Optimization of preparation process for active calcium from cod bone by orthogonal array experiments and its oral bioavailability in vivo[J].Food Science,2015,36(20):13-18.
[7] 国家贝类产业技术体系.中国牡蛎产业发展报告[J].中国水产,2021(6):20-31.National shellfish industry technology system.Report on the development of oyster industry in China[J].China Aquaculture,2021(6):20-31.
[8] 赵强,魏祥玲,孙建安,等.牡蛎资源的综合开发利用研究进展[J].中国食品添加剂,2021,32(7):150-159.ZHAO Q,WEI X L,SUN J A,et al.Research progress on comprehensive utilization of oyster resources[J].China Food Additives,2021,32(7):150-159.
[9] YAO Z T,XIA M S,LI H Y,et al.Bivalve shell:Not an abundant useless waste but a functional and versatile biomaterial[J].Critical Reviews in Environmental Science and Technology,2014,44(22):2502-2530.
[10] 郑清,王玉琴.利用文蛤壳制备复合氨基酸螯合钙[J].安徽化工,2009,35(1):25-28.ZHENG Q,WANG Y Q.Preparation of composite amino acids calcium copper from shell of Meretrix meretrix Linnaeus[J].Anhui Chemical Industry,2009,35(1):25-28.
[11] 胡文翠,代朋,李山,等.复合氨基酸钙的制备工艺研究[J].食品工业,2016,37(6):137-141.HU W C,DAI P,LI S,et al.Study on processing of compound amino acid chelated calcium[J].The Food Industry,2016,37(6):137-141.
[12] 段惠敏,李淑芳,郭光美,等.补钙与钙营养强化剂CCM[J].食品科技,2002,27(1):64-65;61.DUAN H M,LI S F,GUO G M,et al.Calcium supplement and CCM as calcium fortifier[J].Food Science and Technology,2002,27(1):64-65;61.
[13] 王真,姜岁岁,张帆,等.太平洋牡蛎壳制备L-天冬氨酸螯合钙的工艺优化及表征[J].食品科学,2020,41(10):238-245.WANG Z,JIANG S S,ZHANG F,et al.Optimized preparation and characterization of calcium-chelating L-aspartate with Pacific oyster(Crassostrea gigas) shells as calcium source[J].Food Science,2020,41(10):238-245.
[14] 王家明,魏玉西,殷邦忠,等.以牡蛎壳为钙源的谷氨酸螯合钙制备工艺研究[J].中国海洋药物,2010,29(2):22-26.WANG J M,WEI Y X,YIN B Z,et al.Study on the technology of glutamic acid chelated calcium prepared with oyster shell as calcium source[J].Chinese Journal of Marine Drugs,2010,29(2):22-26.
[15] 杜冰,蔡巽楷,谢伊澄,等.蛋壳粉制备氨基酸螯合钙工艺优化[J].食品工业科技,2011,32(4):287-289;292.DU B,CAI X K,XIE Y C,et al.Study on preparation technology of calcium amino acid chelate from eggshell power[J].Science and Technology of Food Industry,2011,32(4):287-289;292.
[16] 胡振珠.复合氨基酸螯合钙的制备工艺及其抗氧化特性研究[D].上海:上海海洋大学,2011.HU Z Z.Study on preparation technology and antioxidant properties of compound amino acid chelated calcium[D].Shanghai:Shanghai Ocean University,2011.
[17] 郭团玉,缪雄平,李碧全,等.以鲍鱼壳为钙源制备复合氨基酸螯合钙[J].宁德师范学院学报(自然科学版),2020,32(2):183-187.GUO T Y,MIAO X P,LI B Q,et al.Preparation of combined amino acid chelating with calcium from abalone shell[J].Journal of Ningde Normal University (Natural Science),2020,32(2):183-187.
[18] 许先猛,张增帅,郭俊花,等.鸡蛋壳赖氨酸螯合钙的制备及其结构表征[J].现代食品科技,2020,36(8):80-85;109.XU X M,ZHANG Z S,GUO J H,et al.Preparation and characterization calcium-lysine chelate from eggshells[J].Modern Food Science and Technology,2020,36(8):80-85;109.