幽门螺杆菌(Helicobacter pylori)是慢性胃炎、消化性溃疡和胃癌的主要病因,感染了全球约50%的人口,还与多种胃肠道外疾病密切相关[1-4]。最近调查结果显示,我国总体家庭感染率为71.21%,明显高于个体感染率40.66%(成人感染率为43.45%,18岁以下感染率为20.55%)[5]。研究表明,幽门感染是胃癌最主要的可控危险因素[6],根除幽门螺杆菌是降低胃癌发生的直接手段。目前根除幽门螺杆菌的治疗手段有很多种,包括标准三联疗法(质子泵抑制剂+2种抗生素)、铋剂四联疗法(质子泵抑制剂+铋剂+2种抗生素)等抗生素疗法,虽然这些疗法提供了较高的根除率,如铋剂四联疗法根除率可达到90%以上[7],但随着细菌对抗生素的耐药性日益增加,以及患者在服药过程中存在的诸多不良反应,导致根除率越来越低。因此,在抗生素疗法之外,从天然产物(如天然植物、微生物次生代谢产物、海洋生物)中寻找具有一定抗菌活性、几无耐药性和较少不良反应的安全有效的健康产品成为该领域研究热点之一。
葡萄(Vitis vinifera)属于葡萄科,是传统的可食用水果,葡萄皮和葡萄籽通常富含多酚,尤其是其中的原花青素具备多种功效[8],有研究表明富含原花青素的葡萄籽能够抑制幽门螺杆菌的生长[9],此外,原花青素还被证明可抑制幽门螺杆菌脲酶活性[10]。
岩藻多糖是褐藻(Phaeophyta)中的主要多糖之一,含高含量的岩藻糖和硫酸盐,具有很强的抗癌、抗病毒、抗病原体黏附和抗感染活性。有研究表明,岩藻多糖可以阻止幽门螺杆菌附着于胃上皮细胞[11],可有效抑制幽门螺杆菌感染。此外岩藻多糖还被证明能够通过下调丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子κB(nuclear factor kappa-B,NF-κB)介导的信号通路来抑制促炎细胞因子的产生[12-13]。
本课题组制备了葡萄籽提取物和岩藻多糖的组合物,发现该组合具有一定的体外抗幽门螺杆菌活性。为更深入探索其作用机制,本研究以该组合物为实验材料,以幽门螺杆菌标准菌株ATCC 700392为实验菌株,探索该组合物的体外抑菌能力及可能的作用机制,为葡萄籽岩藻多糖组合物在抗幽门产品中的开发和利用提供实验支撑。
1 材料与方法
1.1 材料与试剂
幽门螺杆菌标准菌株ATCC 700392,美国菌种保藏中心;葡萄籽提取物、95%原花青素,桂林莱茵生物科技股份有限公司;岩藻多糖(总糖50%,岩藻糖15%,硫酸基20%),山东洁晶集团股份有限公司。
哥伦比亚琼脂、脑心浸出液肉汤,英国OXIOD公司;无菌脱纤维绵羊血,广州鸿泉生物科技有限公司;胎牛血清,中国ExCell Bio公司;DMSO,上海百赛生物科技有限公司;2.5%戊二醛,revicebio公司;PureLinkTM RNA小提试剂盒,美国Thermo公司;2-巯基乙醇,美国Sigma-Aldrich公司;PrimeScriptTM RT Master Mix逆转录试剂盒、Tli RNaseH Plus荧光定量PCR试剂盒,日本Takara公司;DEPC水,中国生工生物工程(上海)股份有限公司。
1.2 仪器与设备
CB170三气培养箱,德国Binder公司;WD-940SF脱色摇床,北京六一公司;DW-HL100超低温冰箱,中科美菱公司;HV-50高压蒸汽灭菌锅,日本Hirayama公司;CHEK plus麦氏浊度计,法国BioMerieux公司;Z216MK冷冻离心机,德国HERMLE公司;CLARIOstar多功能酶标仪,德国BMG LABTECH公司;KQ-400KDE超声波清洗器,江苏昆山公司;Sigma500扫描电镜,德国ZEISS公司;TDZ5-WS台式低速离心机,湖南平凡科技有限公司;NanoDrop 2000核酸蛋白定量仪,美国Thermo Fisher公司;T-Gradient PCR仪,德国Biometra公司;Applied BiosystemsTM 7500 Fast实时荧光定量PCR仪,美国Thermo Fisher公司。
1.3 实验方法
1.3.1 培养基配制
血平板配制:称取哥伦比亚琼脂基础3.9 g至100 mL蒸馏水中,振荡混匀,121 ℃高压灭菌20 min,冷却到55 ℃,加入5%无菌脱纤维绵羊血混匀,趁热倒制,生物安全柜内静置干燥过夜,2周内用完。
脑心浸出液(brain heart infusion,BHI)配制:称取脑心浸出液粉末3.7 g至100 mL蒸馏水中,振荡混匀,121 ℃高压灭菌20 min,放4 ℃冰箱保存,2周内用完。
1.3.2 细菌的复苏与传代
从超低温冰箱取出冻存菌株,自然融化后,吸取100 μL均匀涂布于哥伦比亚血平板,置三气培养箱中,37 ℃、微需氧条件(5% O2、10% CO2、85% N2)倒置培养48~72 h。菌株长满血平板表面时可进行传代,用润湿的无菌棉签从血平板上刮取菌苔,混悬于无菌PBS中制成菌液;吸取100 μL菌液均匀涂布于新的哥伦比亚血平板上,置三气培养箱中,微需氧条件倒置培养48~72 h。
1.3.3 最小抑菌浓度MIC测定
微量肉汤稀释法[14]:按照葡萄籽∶岩藻多糖(93∶10)的质量比混合后配制成样品,样品用BHI超声溶解、涡旋混匀,12 000 r/min离心3 min,用0.22 μm滤膜过滤,配制9、6、3、1.5、1、0.75 g/L等多个质量浓度梯度,将上述配制好的药液吸取50 μL加入96孔板,每个药物浓度至少设置3个复孔,设置阴性对照孔(只含有药物、不接种菌株)、生长对照孔(不含任何药物、只接种菌株)。从培养箱取出菌株,润湿的灭菌棉签刮取菌苔至PBS中,用含20%(体积分数)胎牛血清(fetal bovine serum,FBS)的BHI调节菌悬液浊度为1 McF,稀释10倍接种于上述含药96孔板中(最终在96孔板中的菌悬液浊度约为1×106 CFU/mL),立即将96孔板置于培养箱,37 ℃、微需氧条件、150 r/min振荡培养72 h后取出观察结果。当生长对照呈现纽扣状或明显浑浊时结果才可用,肉眼从下往上观察,细菌浑浊度明显降低时的药物浓度即为最小抑菌浓度(minimum inhibitory concentration,MIC)。
1.3.4 时间-抑菌曲线测定
按二倍稀释法分别配制浓度为1/4MIC、1/2MIC、MIC的样品含药肉汤,不含药肉汤作为生长对照组。从培养箱取出菌株,用湿润的灭菌棉签刮下细菌至PBS中,如MIC方法所述调节菌悬液浊度,按照菌悬液∶含药肉汤/不含药肉汤=1∶1(体积比),每孔2 mL接种于6孔板,放置于三气培养箱中,37 ℃、微需氧环境、150 r/min振荡培养,在0、8、12、24、36、48、72 h吸取100 μL测量OD600nm吸光度值,吸光度值越大则代表细菌数量越多。
1.3.5 基因表达变化
取1 McF浊度菌ATCC 700392,培养至生长对数期,取1 mL菌液加至含药或不含药的培养基中,孵育24 h,离心收集菌体,采用RNA提取试剂盒提取RNA,使用NanoDrop 2000测定RNA的浓度,通过使用PrimeScriptTM RT试剂盒逆转录、SYBR® Premix Ex TaqTM II试剂盒进行实时荧光定量,PCR引物信息如表1所示。结果以16S基因进行归一化,用2-ΔΔCT法计算相对表达量。
表1 PCR引物信息
Table 1 PCR primer information

基因名称正向引物反向引物16SCGATGGATGCTAGTTGTTGGAGGTCCCCGTCTATTCCTTTGAGTTflaBCGCGCACGCAATTAGACATCGCACTCTCTTCAGCAAAATCflgKGGCTCGTTTGACTTAATCGCTTACGGCTTGGATAATATCGTTCATGGTVacACTGGAGCCGGGAGGAAAGGGCGCCATCATAAAGAGAAATTTbabATGCTCAGGGCAAGGGAATAAATCGTGGTGGTTACGCTTTTGalpAGCACGATCGGTAGCCAGACTACACATTCCCCGCATTCAAGureBTAACTTCACCCACACGACCCATCCGCTTCCACTAACCCCACTAureICCCCTGTAGAAGGTGCTGAAGCCGCATACAAGTAGGTGAAAC
1.3.6 扫描电子显微镜(scanning electron microscope,SEM)观察菌体形态
如1.3.5节所述液体培养菌并收集菌体,PBS洗涤2次,加2.5%戊二醛电镜固定液,4 ℃过夜固定。30%、50%、70%、80%、95%(体积分数)乙醇系列脱水,叔丁醇浸泡置换,干燥,贴台、喷金后用于扫描电镜观察[14]。
1.4 数据处理
Graphpad Prism 8.0.2软件用于数据分析,数据以平均值±标准差(mean±SD)表示,采用t检验进行对照组和样品组的组间比较,P<0.05代表存在统计学差异。
2 结果与分析
2.1 最小抑菌浓度和时间-抑菌曲线
在体外抗菌试验中,MIC越小,说明抗菌活性越强;相反,MIC越大,说明抗菌活性越小。葡萄籽岩藻多糖组合物在体外对标准幽门螺杆菌菌株ATCC 700392的MIC为1.5 g/L。通过测定菌液OD600nm,绘制组合物的时间-抑菌曲线,由图1可知,组合物在0.375 g/L时就能抑制ATCC 700392菌株生长,对ATCC 700392菌株的抑制活性呈现剂量依赖,浓度越大抑制效果越明显,当组合物浓度为MIC时,可完全抑制幽门螺杆菌的生长。
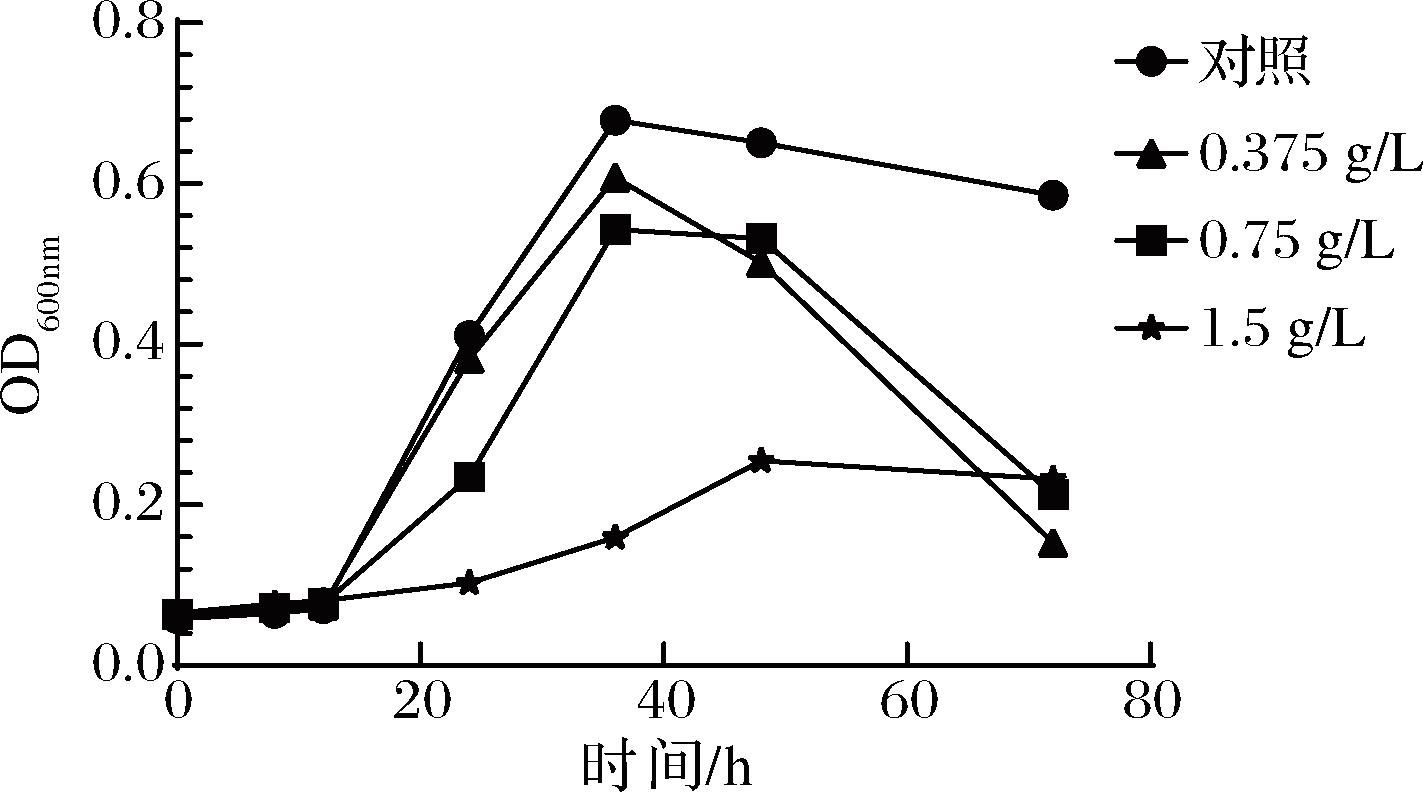
图1 葡萄籽岩藻多糖组合物的时间-抑菌曲线
Fig.1 Time-inhibition curve of the combination of grape seed extract and fucoidan
2.2 葡萄籽岩藻多糖组合物对幽门螺杆菌毒力基因表达的影响
通过实时荧光定量(real-time fluorescence quantitative PCR,RT-qPCR)实验,检测葡萄籽岩藻多糖组合物在1/2 MIC浓度下对幽门螺杆菌毒力基因表达的影响,结果如图2所示。组合物能显著降低ureI[15]、alpA和babA[16]基因的表达,这些基因与幽门螺杆菌的脲酶和黏附能力有关。同时也能降低flaB[17]和flgK[18]的表达,这些基因与幽门螺杆菌的鞭毛形成和运动有关。VacA是幽门螺杆菌重要的毒力基因,组合物能显著降低VacA的表达。
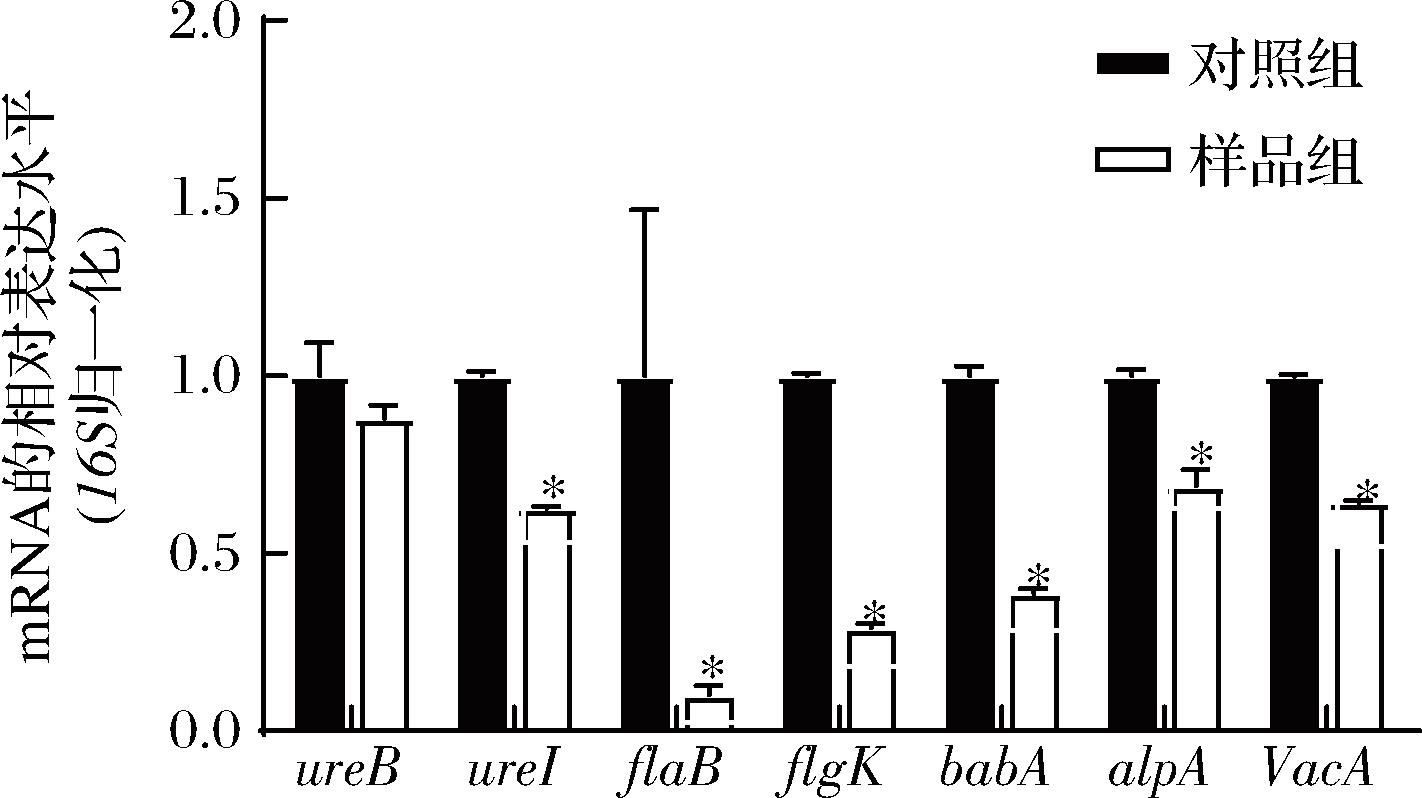
图2 葡萄籽岩藻多糖组合物对幽门螺杆菌毒力基因表达的影响
Fig.2 Effects of grape seed extract and fucoidan combination on the expression of virulence genes of H.pylori
注:统计分析为样品处理后与对照组的差异,*表示P≤0.05。
2.3 扫描电镜
通过扫描电子显微镜观察了整个幽门螺杆菌细胞的形态。图3-a和图3-b为生长对照组,图3-c和图3-d为葡萄籽岩藻多糖组合物处理ATCC 700392菌株24 h后的形态SEM图。对照细胞呈现规则形状,表面均匀。葡萄籽岩藻多糖组合物给药(1/2MIC)24 h后,菌体表面出现破损,菌体凹陷萎缩,呈现出明显的菌体形态遭到破坏。

a、b-生长对照组;c、d-葡萄籽岩藻多糖组合物处理组
图3 葡萄籽岩藻多糖组合物对幽门螺杆菌形态的影响
Fig.3 Effects of grape seed extract and fucoidan combination on the morphology of H.pylori
3 结论
幽门螺杆菌进入胃后,借助其脲酶活性中和不利的酸性环境。随后,细胞利用其鞭毛介导的运动向胃上皮移动。幽门螺杆菌黏附素进一步与宿主细胞受体相互作用,导致成功定植和持续感染。成功定殖后,幽门螺杆菌产生多种效应蛋白/毒素,对宿主组织造成损害[19]。
综上可知葡萄籽岩藻多糖组合物具有明显抑制幽门螺杆菌生长的作用,说明该组合物确实可对幽门螺杆菌的生长造成明显影响。进一步的作用机制研究表明,该组合物有可能通过多种途径和机制抑制幽门螺杆菌的活性,如通过扫描电镜发现组合物会破坏幽门螺杆菌正常的形态,而幽门螺杆菌的形态变化是抗菌药物的功能特征之一,细胞壁和细胞膜可以维持细菌的正常形态并控制细胞功能。通过RT-qPCR实验,发现组合物能显著降低ureI基因的表达,ureI为幽门螺杆菌脲酶特有的基因,编码脲酶特异通道蛋白,主要作用是摄取体外的尿素,使其进入幽门螺杆菌内部与脲酶进行反应产生氨和二氧化碳[20],在酸性胃表面的幽门螺杆菌定植中起着重要作用;组合物同时也能显著降低alpA、babA基因的表达,AlpA和AlpB由高度同源的基因alpA和alpB编码,alpA、alpB主要与宿主的黏连蛋白层结合介导细菌与胃黏膜组织的黏附,当alpA和alpB缺失情况下,可以减少幽门螺杆菌在动物的定植量[21]。幽门螺杆菌与胃上皮表面存在的聚糖表位的黏附是成功定植的关键步骤,定植和感染所必需的主要黏附素有血型抗原结合黏附素(BabA),它介导与岩藻糖基化H1型和Lewis B聚糖的相互作用[22]。这些基因与幽门螺杆菌的黏附能力有关。
此外,组合物能显著降低flaB和flgK的表达,这些基因与幽门螺杆菌的鞭毛形成和运动有关,flaB被认为是幽门螺杆菌完全运动的必要基因[23]。有关鞭毛钩相关蛋白FIgK的研究认为,其不仅能参与鞭毛钩蛋白的结构组装,同时也能参与形成鞭毛的抗原性[24]。组合物还能降低VacA的表达,VacA是幽门螺杆菌重要的毒力基因,VacA蛋白主要诱导胃上皮细胞内体空泡的产生,促进细胞凋亡,并在体外抑制T细胞增殖。这些特征与显著的胃黏膜损伤和免疫失调有关,这两者都可能导致胃癌[25]。
之前关于葡萄籽提取物和岩藻多糖在抗幽相关机制研究主要集中在抑制脲酶和抗黏附相关作用,未关注到抑制鞭毛机制的作用,本研究发现该组合物可以抑制鞭毛相关基因表达,但不足的是未能进行运动能力相关试验,后续实验室计划就这一机制做出更多的探索。
通过以上研究,本研究发现葡萄籽岩藻多糖组合物在体外确对幽门螺杆菌标准菌株ATCC 700392有一定的抗菌活性,其作用机制可能是通过抑制脲酶、抑制鞭毛相关的运动能力、抗黏附、破坏细菌形态等起到抑制幽门螺杆菌定殖的作用。该研究可为葡萄籽岩藻多糖组合物的营养健康产品开发和应用提供实验支持。
[1] MALFERTHEINER P,MEGRAUD F,O′MORAIN C A,et al.Management of Helicobacter pylori infection-the Maastricht V/florence consensus report[J].Gut,2017,66(1):6-30.
[2] SUGANO K,TACK J,KUIPERS E J,et al.Kyoto global consensus report on Helicobacter pylori gastritis[J].Gut,2015,64(9):1353-1367.
[3] EL-SERAG H B,KAO J Y,KANWAL F,et al.Houston consensus conference on testing for Helicobacter pylori infection in the United States[J].Clinical Gastroenterology and Hepatology,2018,16(7):992-1002.
[4] WONG B C Y,LAM S K,WONG W M,et al.Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China:A randomized controlled trial[J].JAMA,2004,291(2):187-194.
[5] ZHOU X Z,LYU N H,ZHU H Y,et al.Large-scale,national,family-based epidemiological study on Helicobacter pylori infection in China:The time to change practice for related disease prevention[J].Gut,2023,72(5):855-869.
[6] 中华医学会消化病学分会幽门螺杆菌学组.第六次全国幽门螺杆菌感染处理共识报告(非根除治疗部分)[J].胃肠病学,2022,27(5):289-304.Helicobacter pylori Study Group,Chinese Society of Gastroenterology,Chinese Medical Association.Sixth Chinese national consensus report on the management of Helicobacter pylori infection (treatment excluded)[J].Chinese Journal of Gastroenterology,2022,27(5):289-304.
[7] ![]() M I,JAGUSZTYN-KRYNICKA E K.Helicobacter pylori treatment in the post-antibiotics era-searching for new drug targets[J].Applied Microbiology and Biotechnology,2020,104(23):9891-9905.
M I,JAGUSZTYN-KRYNICKA E K.Helicobacter pylori treatment in the post-antibiotics era-searching for new drug targets[J].Applied Microbiology and Biotechnology,2020,104(23):9891-9905.
[8] GUPTA M,DEY S,MARBANIANG D,et al.Grape seed extract:Having a potential health benefits[J].Journal of Food Science and Technology,2020:57(4):1205-1215.
[9] SILVAN J M,GUTIÉRREZ-DOCIO A,MORENO-FERNANDEZ S,et al.Procyanidin-rich extract from grape seeds as a putative tool against Helicobacter pylori[J].Foods,2020,9(10):1370.
[10] ![]() P,KHAZNEH E,
P,KHAZNEH E,![]() M,et al.Antiurease activity of plants growing in the Czech Republic[J].Natural Product Research,2014,28(12):868-873.
M,et al.Antiurease activity of plants growing in the Czech Republic[J].Natural Product Research,2014,28(12):868-873.
[11] CHUA E G,VERBRUGGHE P,PERKINS T T,et al.Fucoidans disrupt adherence of Helicobacter pylori to AGS cells in vitro[J].Evidence-Based Complementary and Alternative Medicine,2015,2015:120981.
[12] APOSTOLOVA E,LUKOVA P,BALDZHIEVA A,et al.Immunomodulatory and anti-inflammatory effects of fucoidan:A review[J].Polymers,2020,12(10):2338.
[13] NI L Y,WANG L,FU X T,et al.In vitro and in vivo anti-inflammatory activities of a fucose-rich fucoidan isolated from Saccharina japonica[J].International Journal of Biological Macromolecules,2020,156:717-729.
[14] SHEN X,ZHANG W J,PENG C,et al.In vitro anti-bacterial activity and network pharmacology analysis of Sanguisorba officinalis L. against Helicobacter pylori infection[J].Chinese Medicine,2021,16(1):33.
[15] YAN J H,PENG C,CHEN P T,et al.In-vitro anti-Helicobacter pylori activity and preliminary mechanism of action of Canarium album Raeusch.fruit extracts[J].Journal of Ethnopharmacology,2022,283:114578.
[16] 张姝,罗昭逊,莫非,等.头花蓼对幽门螺杆菌粘附定植的影响[J].中国人兽共患病学报,2016,32(8):734-740.ZHANG S,LUO Z X,MO F,et al.Influence of Polygonum capitatum on the adherency and colonization of Helicobacter pylori[J].Chinese Journal of Zoonoses,2016,32(8):734-740.
[17] XU Y F,LIAN D W,CHEN Y Q,et al.In vitro and in vivo antibacterial activities of patchouli alcohol,a naturally occurring tricyclic sesquiterpene,against Helicobacter pylori infection[J].Antimicrobial Agents and Chemotherapy,2017,61(6):e00122-17.
[18] YANG H,HUANG X X,ZHANG X C,et al.AI-2 induces urease expression through downregulation of orphan response regulator HP1021 in Helicobacter pylori[J].Frontiers in Medicine,2022,9:790994.
[19] SHARNDAMA H C,MBA I E.Helicobacter pylori:An up-to-date overview on the virulence and pathogenesis mechanisms[J].Brazilian Journal of Microbiology,2022,53(1):33-50.
[20] 许艺飞.广藿香醇抗幽门螺杆菌作用及其机制研究[D].广州:广州中医药大学,2016.XU Y F.Anti-Helicobacter pylori effect and mechanism of patchouli alcohol[D].Guangzhou:Guangzhou University of Chinese Medicine,2016.
[21] SENKOVICH O A,YIN J,EKSHYYAN V,et al.Helicobacter pylori AlpA and AlpB bind host laminin and influence gastric inflammation in gerbils[J].Infection and Immunity,2011,79(8):3106-3116.
[22] MATOS R,AMORIM I,MAGALH ES A,et al.Adhesion of Helicobacter species to the human gastric mucosa:A deep look into glycans role[J].Frontiers in Molecular Biosciences,2021,8:656439.
ES A,et al.Adhesion of Helicobacter species to the human gastric mucosa:A deep look into glycans role[J].Frontiers in Molecular Biosciences,2021,8:656439.
[23] JOSENHANS C,LABIGNE A,SUERBAUM S.Comparative ultrastructural and functional studies of Helicobacter pylori and Helicobacter mustelae flagellin mutants:Both flagellin subunits,FlaA and FlaB,are necessary for full motility in Helicobacter species[J].Journal of Bacteriology,1995,177(11):3010-3020.
[24] 罗微,王倩,陈铁龙.幽门螺杆菌鞭毛研究概述[J].中国病原生物学杂志,2015,10(9):852-857.LUO W,WANG Q,CHEN T L.Advances in the study of Helicobacter pylori flagella[J].Journal of Pathogen Biology,2015,10(9):852-857.
[25] PALFRAMAN S L,KWOK T,GABRIEL K.Vacuolating cytotoxin A (VacA),a key toxin for Helicobacter pylori pathogenesis[J].Frontiers in Cellular and Infection Microbiology,2012,2:92.