黄曲霉毒素M1 (aflatoxin M1,AFM1)是哺乳动物食用了受黄曲霉毒素B1 (AFB1)污染的饲料后在其肝脏被转化而来的羟基化代谢产物,具有毒性及强致癌性,已被国际癌症研究组织列为 I 类致癌化合物[1]。另外,AFM1在巴氏杀菌等高温甚至超高温加热工艺条件下也难以消除,AFM1在乳及乳制品中的污染情况时有发生。XIONG等[2]调查发现我国中东部地区酸奶和牛奶中AFM1的阳性率较高,其中2~3岁的儿童AFM1暴露风险最高。XU等[3]发现西北地区乳品中AFM1含量较高。在非洲、欧洲及南亚等部分地区的生鲜乳中,AFM1仍具有较高污染量,这对消费者的健康产生了潜在的危害[4]。为此,国内外针对乳及乳产品中的AFM1制定了严格的标准。GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定乳及婴幼儿乳粉中AFM1的最大限量为0.5 μg/kg。欧盟规定乳及乳产品中的AFM1不得超过0.05 μg/kg,且在黄油中不得超过0.02 μg/kg,婴幼儿乳品中不得超过0.025 μg/kg[5]。澳大利亚规定巴氏杀菌婴幼儿牛奶中AFM1不得超过0.01 μg/kg[6]。因此,开发高灵敏度、高特异性的AFM1的快速检测技术具有重要的意义。
目前,AFM1的快速检测方法有酶联免疫法[7]、电化学免疫法[8]等,这些方法是依据抗原-抗体特异性反应实现对AFM1识别,但是存在抗体制备复杂、稳定性差等问题。适配体是一种单链的寡核苷酸序列,以其低成本、强特异性的特点受到研究者的关注[9-11]。AHMADI等[12]首次采用金纳米颗粒(gold nanorods,AuNPs)与还原氧化石墨烯纳米材料修饰的石墨电极作为工作电极,结合电化学阻抗技术构建了无标记电化学适配体传感器,从而实现对AFM1的快速灵敏特异性检测。GUO等[13]将AFM1适配体固定在磁性纳米颗粒Fe3O4上,并与二茂铁(ferrocence,Fc)修饰的互补链杂交,当溶液添加AFM1后,其与适配体结合,互补链释放至上清液中,然后将其滴在原位生长共价有机骨架(covalent organic frameworks,COFs)的玻碳电极上,以差分脉冲伏安法测定Fc的信号变化,从而实现对AFM1的定量检测。KORDASHT等[14]首次合成了氨基功能化的树状纤维纳米二氧化硅(KCC-1-nPr-NH2)和壳聚糖负载的纳米金(AuNPs-CS),将其沉积在玻碳电极表面,然后将甲苯胺蓝标记的 AFM1适配体固定在AuNPs-CS上,基于此构建特异性检测AFM1的电化学适配体传感器。
适配体直接固定在电极表面可能会导致其折叠成非特异性结构,从而影响适配体对目标物特异性识别作用[15]。通过电极表面修饰,能够有效解决此问题。二硫化钼(MoS2)是一种稳定的新型无机石墨烯类似物,由于其超薄平面结构中电子/空穴的限制,使其对环境的变化高度敏感,在构建生物传感界面方面具有优势[16]。因此,本研究基于Au-MoS2复合材料构建能够高灵敏度、特异性检测AFM1的电化学适配体传感器。
1 材料与方法
1.1 材料与试剂
AFM1、AFM2、AFB1、AFG1、AFG2标准品,新加坡 Pribolab 公司;二硫化钼,重庆市钛新化工有限公司;三氯化金溶液,上海阿拉丁生化科技有限公司;适配体序列(5′-SH-ACTGCTAGAGATTTTCCACAT-Fc-3′),上海生工生物工程有限公司;铁氰化钾,上海麦克林生化科技有限公司;6-巯基乙醇(6-mercaptoethanol,MCH),上海阿达玛斯试剂有限公司。N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF),成都市科龙化工试剂厂;磷酸三氯乙酯(trichloroethyl phosphate,TCEP),上海阿拉丁有限公司;Tris-HCl,上海生工生物工程有限公司。
1.2 仪器与设备
Gemini-SEM300扫描电子品微镜,德国蔡司公司;KO3200DB超声波清洗器,昆山市超声仪器有限公司;氮吹仪,常州朗越仪器制造有限公司;冷冻高速离心机,赛默飞世尔科技公司;电化学工作站CHI600E、三电极系统,上海辰华仪器有限公司。
1.3 实验方法
1.3.1 玻碳电极的预处理
在氧化铝水浆中对玻碳电极进行打磨 5 min,并使用无水乙醇及纯水低频超声清洗至表面光滑洁净,干燥后待用。后对玻碳电极进行电化学抛光,即采用0.1 V/s的扫描速度、-0.2~+1.6 V的扫描电位在0.5 mmol/L的H2SO4对电极进行扫描,并在其曲线稳定后再次用无水乙醇及纯水低频超声洗净,氮吹干燥后备用。
1.3.2 MoS2修饰电极研究
精确称取 MoS2粉末于10 mL DMF 中振荡混匀,并超声5 h后得到均匀的 MoS2悬浮液,分别将3 μL质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL的MoS2悬浮液均匀滴涂到玻碳电极表面,室温下干燥,将电极浸在电解液中,电解液为含 0.1 mol/L KCl 的5.0 mmol/L {[Fe(CN)6]3-/4-}溶液。并采用循环伏安法(cyclic voltammetry,CV)和电化学阻抗法(elecctrochemical impedance spectroscopy,EIS)进行扫描。
1.3.3 金沉积条件的研究
使用0.1 mol/L KCl溶液对氯金酸溶液进行稀释,超声后得到不同浓度(10、12、14、16、18 mmol/L)的氯金酸溶液,将滴涂有3.0 mg/mL MoS2的电极浸入此溶液中进行电沉积,并探究沉积电位(-0.15、-0.2、-0.25、-0.3、-0.35 V)、沉积时间(360、420、480、540、600 s)及氯金酸浓度在传感器构建过程中电极导电性能的影响。最后同样将Au-MoS2复合纳米材料修饰的电极浸入1.3.2节中的电解液,采用CV和EIS研究电极的导电性能。
1.3.4 构建基于Au-MoS2复合纳米材料的电化学适配体传感器
1.38 μL适配体溶液(10 μmol/L)与1.38 μL TCEP (1 mmol/L)溶液混合孵化1.5 h,然后用包含不同浓度 Na+与 Mg2+(0.005、0.01、0.05、0.10、0.20 mol/L)的Tris-HCl溶液(pH=7.4)稀释得到一定浓度的适配体溶液(0.1、0.3、0.5、0.7、0.9 mmol/L)。将适配体溶液滴加到Au-MoS2电极表面,隔夜处理,使适配体通过Au-S固定到电极表面。用Tris-HCl冲洗电极,干燥后采用1 mmol/L的MCH溶液封闭电极表面未结合的位点,再次冲洗干燥后成功构建电化学适配体传感平台。然后与0.5 μg/L的AFM1混合分别孵育一定时间(0.5、1、1.5、2、2.5 h)后,通过方波伏安法(square wave voltammetry,SWV)测得电流信号,以ΔI的变化确定最佳条件。构建传感器平台的每个步骤都采用CV和EIS表征。
1.3.5 电化学适配体传感器的方法学评价
将一定浓度AFM1滴涂在电极表面,通过基于Au-MoS2复合纳米材料构建的电化学适配体传感器,采用SWV监测电流信号,实现对AFM1的定量检测并确定其线性范围及检出限。将0.5 μg/L的AFM1、AFM2、AFB1、AFG1、AFG2及含有AFM1的混和毒素与传感器平台孵育,用SWV检测其电信号,从而对其选择性进行评价。
1.4 数据统计与分析
数据的整理通过Microsoft Office Excel 2019进行,并分别采用SPSS 27.0及Origin 2021进行分析与绘图。
2 结果与分析
2.1 基于Au-MoS2纳米复合材料构建的电化学适配体传感器的检测原理
该传感器的具体检测原理如图1所示。构建基于Au-MoS2纳米复合材料的电化学适配体传感器对AFM1进行检测。分别采用滴涂法和电沉积法将MoS2和纳米金颗粒修饰在玻碳电极表面,从而制备得到 Au-MoS2复合材料修饰的电极。用二茂铁(—Fc)和巯基(—SH)分别修饰适配体的3′段和5′段,适配体通过Au—S固定在复合材料修饰的电极表面,用MCH溶液封闭电极表面多余的电位,避免其他物质引起的非特异性吸附。当体系中存在AFM1时,适配体识别AFM1并产生一定构象变化,导致电子在电极表面的传递速度降低,即Fc信号减弱,进而实现对目标物定量检测。
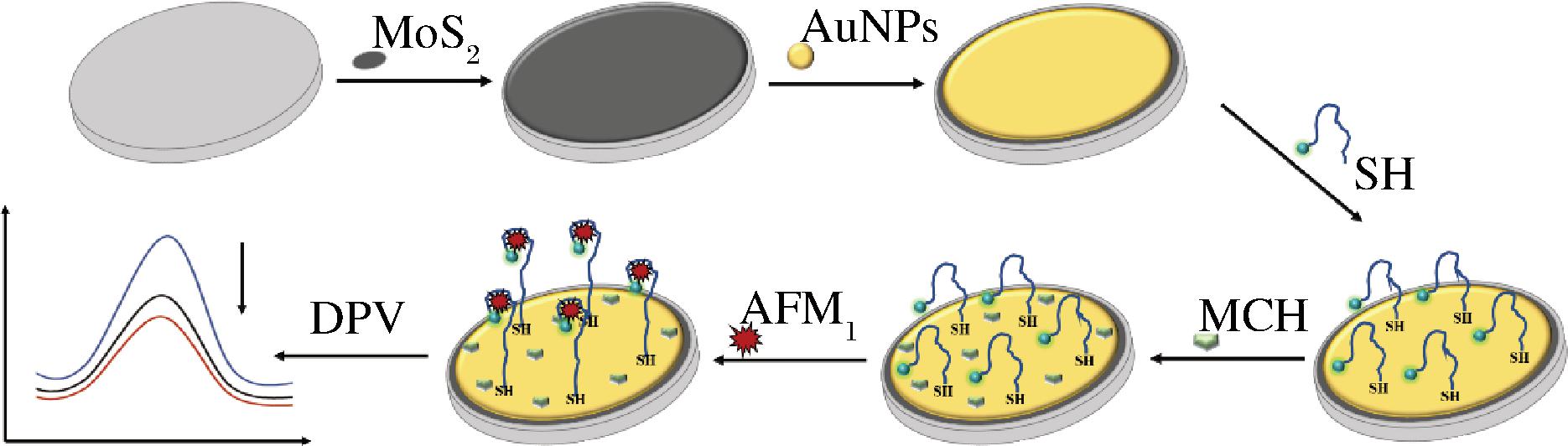
图1 基于Au-MoS2纳米复合材料构建的电化学适配体传感器的检测原理
Fig.1 Detection principle of electrochemical aptamer sensor based on Au-MoS2 nanocomposites
2.2 MoS2修饰电极研究
采用5.0 mmol/L {[Fe(CN)6]3-/4-}(含0.1 mol/L KCl)为电解液,并通过CV及EIS研究MoS2修饰电极的情况。在玻碳电极上滴加MoS2悬浊液,于室温下干燥,可观察到其表面产生明显的灰色薄膜。CV结果如图2-A所示,随着MoS2浓度的增加,电流峰值先增大后减小。说明一定浓度MoS2滴涂在电极表面之后,电子在电极表面的传递速率加快。但随着MoS2浓度的增加,其导电性能逐渐下降。这是因为过量的MoS2在电极表面不均匀分布,导致了偏聚现象[17-18]。电极上的反应由电荷传递和扩散过程共同控制,传递过程控制高频区得到一个半圆图形,扩散过程控制低频区得到一条45 °的直线,由此构成奈奎斯特曲线,高频区半圆的直径表示电子转移阻抗,即电子转移能力的大小[12]。从EIS图(图2-B) 可以看出,随着MoS2质量浓度的增加,电阻呈现先减小后增大,当MoS2滴涂浓度达到3 mg/mL,电荷转移电阻值最小。因此,选择3 mg/mL为MoS2修饰电极的最佳质量浓度。
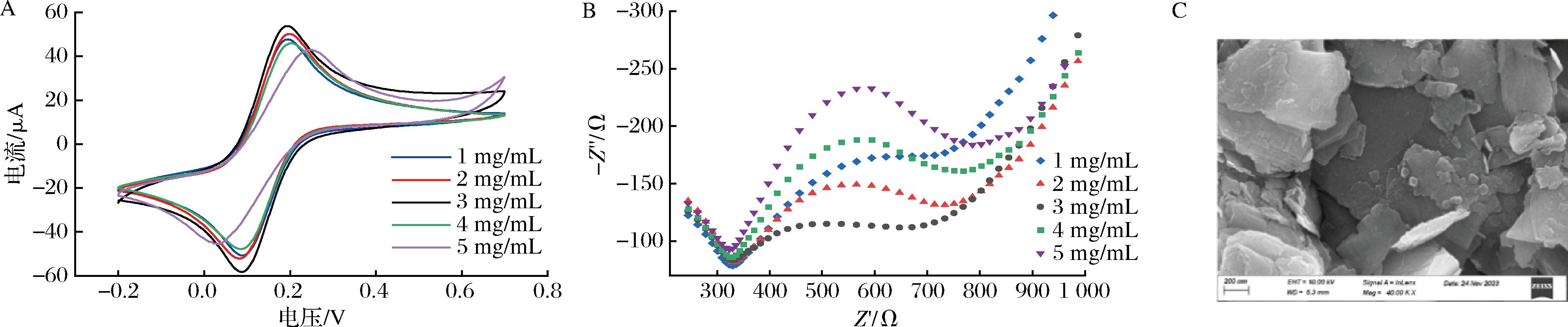
A-CV表征;B-EIS表征;C-SEM表征
图2 不同浓度MoS2修饰电极的CV、EIS和SEM表征
Fig.2 Characterization of CV,EIS,and SEM of MoS2 modified electrodes at different concentrations
利用扫描电子显微镜 (scanning electron microscope,SEM)对电极表面情况进行观察。图2-C为滴涂3 mg/mL MoS2溶液后的玻碳电极,可以发现MoS2成功修饰在玻碳电极表面,并由于其特殊的结构可能使电极比表面积增加,稳定性增强。
2.3 金沉积条件研究
沉积电位、沉积时间及氯金酸浓度是影响纳米金在玻碳电极表面沉积效果的几个关键因素。随着沉积电位的增加,与此对应的电流强度呈现先增大后减小的趋势。因此,如图3-A和3-B所示,沉积电位达到-0.2 V时电子在电极表面的传递速度最大。如图3-C和3-D所示,沉积电压为-0.2 V时,研究沉积时间(360、420、480、540、600 s)对电子传递效率的影响。研究发现,随着沉积电位的增加,其电流强度同样呈现先增大后减小的趋势,与此对应的电阻先减小后增大,说明电子在电极表面的传递速度随沉积时间延长先加快后减小,那么采用480 s进行金沉积时电极的导电性能最优异。这可能是由于随着时间的推移,金纳米晶核总数目不断地增加,金纳米晶体的生长过程中有新的晶核产生,新晶核的产生可能会破坏原有的纳米颗粒结构[19]。由图3-E和3-F可知,氯金酸浓度增加,电流峰值逐渐增大,其电荷转移电阻先增大后减小,在沉积浓度为14 mmol/L时,氧化还原峰最大,同时电荷转移电阻最小,说明电极的导电性最佳。此时,推测AuNPs呈相对均匀的球状形貌,继续增加到更大浓度时,球状结构被破坏[20-21]。因此,氯金酸的最佳浓度为14 mmol/L时。综上所述,当沉积电位为-0.2V,沉积时间为480 s,氯金酸浓度为14 mmol/L时,所获得复合材料修饰电极的导电性能最为优异。对该条件下复合材料修饰电极的表面情况,利用SEM进行观察,如图4可知金纳米颗粒成功沉积在MoS2薄膜上。

A、B-不同沉积电位修饰电极的CV和EIS表征;C、D-不同沉积时间修饰电极的CV和EIS表征;E、F-不同氯金酸浓度修饰电极的CV和EIS表征
图3 不同金沉积条件修饰电极的CV和EIS表征
Fig.3 CV and EIS characterization of modified electrodes under different gold deposition conditions
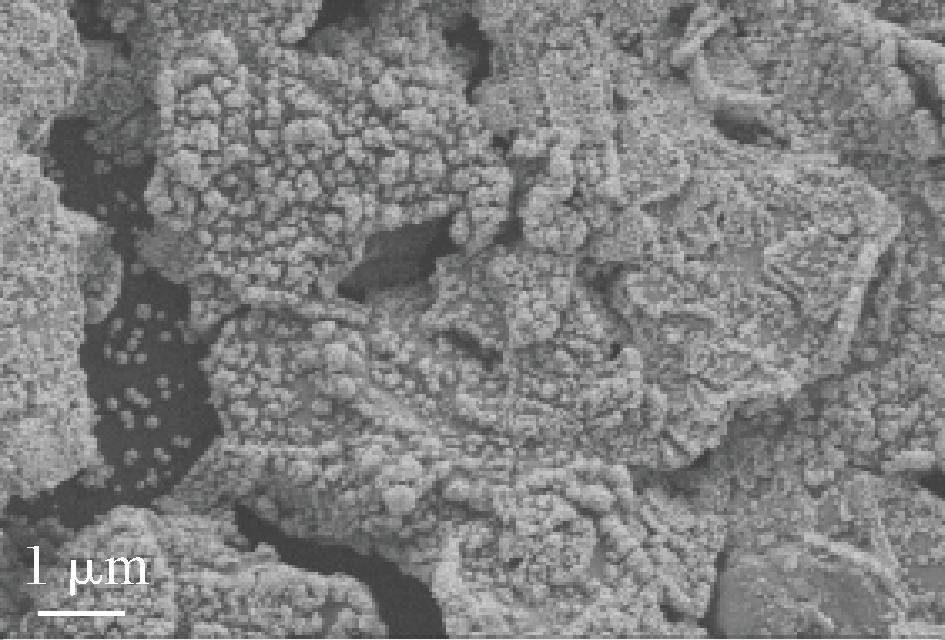
图4 最优金沉积条件下的电极SEM图
Fig.4 SEM image of the electrode under optimal gold deposition conditions
2.4 基于Au-MoS2复合纳米材料的电化学适配体传感器的构建过程
采用CV和EIS对电化学适配体传感器的构建进行监测,由CV表征可知,该电化学适配体传感器能够有效识别AFM1,EIS进一步证明了传感器的成功构建。如图5-A所示,未经修饰的玻碳电极氧化还原电流峰值较高,这是由于光滑的表面使得电子在电极表面传递速度快,但在修饰有Au-MoS2后电极的氧化还原电流峰值增大,即电极导电性继续增强。然后将AFM1的适配体固定在Au-MoS2复合纳米材料修饰的电极表面后,可以观察到,峰值电流降低,这可能是由于适配体使电子在电极表面的传递受到了阻碍。体系中存在目标物AFM1时,适配体识别AFM1并形成特定构象,进一步阻碍了电极表面电子的传递。传感器构建过程中的EIS表征如图5-B所示,未修饰任何物质的玻碳电极半圆直径较小,修饰Au-MoS2复合纳米材料后的电极表面电子转移速度加快,直径减小。进一步在Au-MoS2复合纳米材料表面固定适配体后直径增加,体系中存在AFM1时适配体构象发生改变,电子传递进一步减慢。传感器构建过程中CV和EIS表征的结果均证明了该电化学适配体传感器的成功构建。
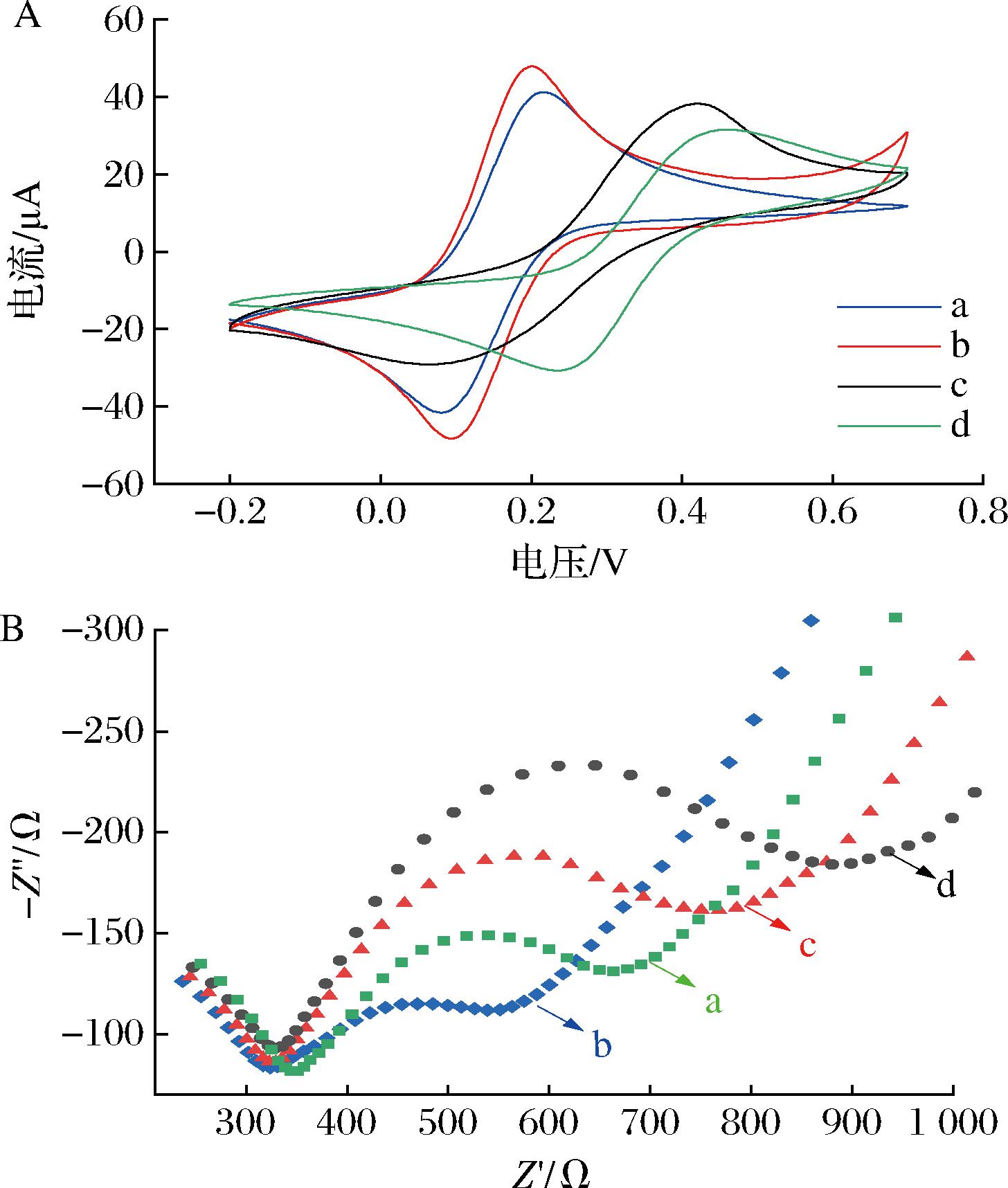
A-CV表征(a-GCE;b-GCE/Au-MoS2;c-GCE/Au-MoS2/Apt;d-GCE/Au-MoS2/Apt/AFM1);B-EIS表征
图5 基于Au-MoS2复合纳米材料构建电化学适配体传感器的CV和EIS表征
Fig.5 CV and EIS characterization of electrochemical aptamer sensors based on Au-MoS2 composite nanomaterials
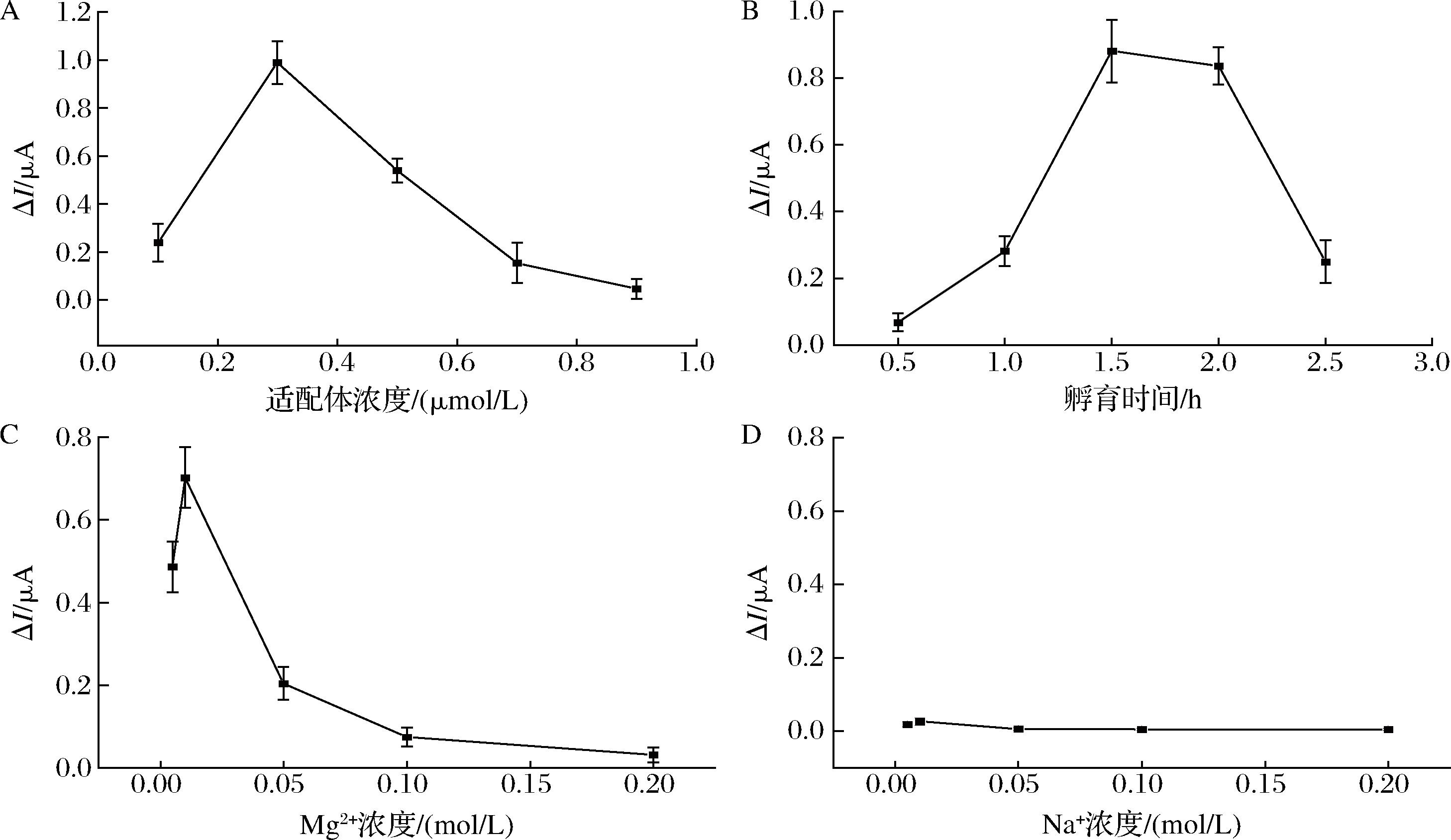
A-适配体浓度对传感器构建的影响;B-孵育时间对传感器构建的影响;C-Mg2+对传感器构建的影响;D-Na+对传感器构建的影响
图6 电化学适配体传感器构建条件的研究
Fig.6 Research on the construction conditions of electrochemical aptamer sensors
2.5 电化学适配体传感器构建条件的研究
以电化学传感器识别目标物AFM1前后Fc特征电信号的差异(ΔI)作为纵坐标,分别探究适配体浓度、孵育时间以及Mg2+和Na+浓度对适配体识别AFM1灵敏度的影响。由图6-A可知,适配体浓度增加至0.3 μmol/L时,ΔI达到最大值,这可能是由于较低浓度的适配体不能识别完全体系内AFM1,而较高浓度的适配体会导致识别AFM1的灵敏度降低。孵育时间研究的结果(如图6-B)表明,随着孵育时间的延长ΔI逐渐增大,在1.5 h时达到最大值,说明孵育1.5 h后,适配体就已经可以完全识别AFM1,并形成相对稳定的构象。随着时间进一步延长,ΔI开始下降,因此,最佳孵育时间为1.5 h。由图6-C和图6-D可知,离子的种类及其浓度对适配体识别AFM1的效果也有较大的影响,随着Mg2+浓度增大,ΔI先增大后减小,可以观察到Mg2+浓度为0.01 mol/L时,ΔI达到最大,而Na+并未对适配体的识别效果产生较大影响,说明适配体识别AFM1时构象变化在一定浓度Mg2+存在下更加灵敏,但过高的离子浓度可能会使适配体无法形成特定构象。后续采用0.3 μmol/L适配体,1.5 h孵育时间,0.01 mol/L Mg2+进行实验。
2.6 传感器方法学研究
2.6.1 线性范围和检出限
研究该传感器的传感性能,由图7-A可知,随着AFM1浓度的增加,响应信号(即电流强度)逐渐降低。这是由于被Fc修饰的适配体在特异性识别 AFM1后,其构象发生改变,从而使得电流信号减弱。图7-B表明,目标物质量浓度在0.015~0.8 μg/L时,响应的电流值与其呈线性关系,其检出限为0.014 μg/L。与已有文献报道的其他AFM1检测方法相比(表1),本文所述的电化学传感器检测AFM1的效果更优。
表1 基于Au-MoS2复合纳米材料的电化学适配体传感器与文献方法对比
Table 1 Comparison of electrochemical aptamer sensors based on Au-MoS2 composite nanomaterials with literature methods

传感器类型线性范围/(μg/L)检出限/(μg/L)电化学免疫传感器[22]0.02~10.01电化学发光传感器[23]5~1500.01荧光适配体传感器[24]1~1000.5电化学发光传感器[25]0.5~800.15电化学适配体传感器0.015~0.80.014

A、B-不同AFM1浓度下传感器的线性范围;C-传感器对不同毒素的抗干扰能力研究
图7 传感器方法学研究
Fig.7 Sensor methodology research
2.6.2 选择性
以AFM1、AFM2、AFB1、AFG1、AFG2和含有AFM1及上述毒素的混合毒素作为干扰,探究基于Au-MoS2复合纳米材料构建的电化学适配体传感器的选择性。如图7-C所示,与AFM1相比,由其他毒素引起的电流强度变化较小。但混合毒素中含有目标物AFM1时,与含有相同浓度的AFM1的样品所引起的信号变化同样显著。说明该传感器对AFM1具有较好的选择性,能够避免在检测时受到其他结构相似的毒素的干扰。
3 结论
本研究构建基于Au-MoS2复合材料的电化学传感器检AFM1。在最优条件,MoS2的质量浓度为3.0 mg/mL,沉积电位为-0.2 V,沉积时间为480 s,氯化金浓度为14 mmol/L 时,Au-MoS2复合材料修饰的电极性能最佳。适配体为0.3 μmol/L,Mg2+的浓度为0.01 mol/L,孵育时间为1.5 h时,Fc的响应电流信号最佳。在上述条件下,该电化学适配体传感器的线性范围为0.015~0.8 μg/L,检出限为0.014 μg/L,具有良好的特异性。说明该传感器在AFM1检测中具有较强的实用性与良好的应用前景。
[1] MIN L,FINK-GREMMELS J,LI D G,et al.An overview of aflatoxin B1 biotransformation and aflatoxin M1 secretion in lactating dairy cows[J].Animal Nutrition (Zhongguo Xu Mu Shou Yi Xue Hui),2021,7(1):42-48.
[2] XIONG J L,WEN D F,ZHOU H L,et al.Occurrence of aflatoxin M1 in yogurt and milk in central-eastern China and the risk of exposure in milk consumers[J].Food Control,2022,137:108928.
[3] XU N N,XIAO Y P,XIE Q G,et al.Occurrence of aflatoxin B1 in total mixed rations and aflatoxin M1 in raw and commercial dairy milk in Northern China during winter season[J].Food Control,2021,124:107916.
[4] MIN L,LI D G,TONG X,et al.The challenges of global occurrence of aflatoxin M1 contamination and the reduction of aflatoxin M1 in milk over the past decade[J].Food Control,2020,117:107352.
[5] CORDEIRO F,BAER I,ROBOUCH P,et al.Setting maximum limits for trace elements in baby food in European legislation:The outcome of International Measurement Evaluation Programme®-33[J].Food Additives &Contaminants.Part A,Chemistry,Analysis,Control,Exposure &Risk Assessment,2013,30(4):678-686.
[6] IQBAL S Z,JINAP S,PIROUZ A A,et al.Aflatoxin M1 in milk and dairy products,occurrence and recent challenges:A review[J].Trends in Food Science &Technology,2015,46(1):110-119.
[7] PECORELLI I,GUARDUCCI N,VON HOLST C,et al.Critical comparison of analytical performances of two immunoassay methods for rapid detection of aflatoxin M1 in milk[J].Toxins,2020,12(4):270.
[8] TANG X Q,CATANANTE G,HUANG X R,et al.Screen-printed electrochemical immunosensor based on a novel nanobody for analyzing aflatoxin M1 in milk[J].Food Chemistry,2022,383:132598.
[9] 王嫦嫦,马良,刘微,等.基于先进材料的适配体传感器在真菌毒素快速检测中的研究进展[J].食品科学,2020,41(3):305-313.WANG C C,MA L,LIU W,et al.Advances in aptasensors based on smart materials for rapid detection of mycotoxins[J].Food Science,2020,41(3):305-313.
[10] 郭歌,王田林,李天歌,等.适配体传感器检测黄曲霉毒素的研究进展[J].食品与发酵工业,2024,50(6):323-331.GUO G,WANG T,LI T,et al.Research progress of aptasensors for the detection of aflatoxins[J].Food and Fermentation Industry:1-9.
[11] RHOUATI A,CATANANTE G,NUNES G,et al.Label-free aptasensors for the detection of mycotoxins[J].Sensors,2016,16(12):2178.
[12] AHMADI S F,HOJJATOLESLAMY M,KIANI H,et al.Monitoring of Aflatoxin M1 in milk using a novel electrochemicalaptasensorbased on reduced graphene oxide and gold nanoparticles[J].Food Chemistry,2022,373(Pt A):131321.
[13] GUO L L,WANG Y Y,PANG Y H,et al.In situ growth of covalent organic frameworks TpBD on electrode for electrochemical determination of aflatoxin M1[J].Journal of Electroanalytical Chemistry,2021,881:114931.
[14] KORDASHT H K,HASANZADEH M.Specific monitoring of aflatoxin M1 in real samples using aptamer binding to DNFS based on turn-on method:A novel biosensor[J].Journal of Molecular Recognition:JMR,2020,33(6):e2832.
[15] DANESH N M,BOSTAN H B,ABNOUS K,et al.Ultrasensitive detection of aflatoxin B1 and its major metabolite aflatoxin M1 using aptasensors:A review[J].TrAC Trends in Analytical Chemistry,2018,99:117-128.
[16] QIN Z Y,ZHANG J W,LI S.Molybdenum disulfide as tunable electrochemical and optical biosensing platforms for cancer biomarker detection:A review[J].Biosensors,2023,13(9):848.
[17] MATTE H S,GOMATHI A,MANNA A K,et al.MoS2 and WS2 analogues of graphene[J].Angewandte Chemie (International Ed.in English),2010,49(24):4059-4062.
[18] 冯夏明.二维二硫化钼/聚合物纳米复合材料的制备及其力学、热学和燃烧性能的研究[D].北京:中国科学技术大学,2017.FENG X.Preparation of two-dimensional molybdenum disulfide/polymer nanocomposites on their mechanical,thermal and combustion properties[D].Beijing:University of Science and Technology of China,2017.
[19] 刘光欣.基于氯化胆碱的离子液体中电沉积金的工艺与机理研究[D].哈尔滨:哈尔滨工业大学,2014.LIU G X.Study on process and mechanism of electrodeposition of gold in Ionic liquids based on choline chloride[D].Harbin:Harbin Institute of Technology,2014.
[20] HU Y J,JIN J,WU P,et al.Graphene-gold nanostructure composites fabricated by electrodeposition and their electrocatalytic activity toward the oxygen reduction and glucose oxidation[J].Electrochimica Acta,2010,56(1):491-500.
[21] SUN Y K,ZANGARI G.Streamlined derivations and explanations of the scharifker-hills model[J].ECS Meeting Abstracts,2022,MA2022-01(23):1204.
[22] ABERA B D,FALCO A,IBBA P,et al.Development of flexible dispense-printed electrochemical immunosensor for aflatoxin M1 detection in milk[J].Sensors,2019,19(18):3912.
[23] KHOSHFETRAT S M,SEYED DORRAJI P,SHAYAN M,et al.Smartphone-based electrochemiluminescence for visual simultaneous detection of RASSF1A and SLC5A8 tumor suppressor gene methylation in thyroid cancer patient plasma[J].Analytical Chemistry,2022,94(22):8005-8013.
[24] QIAO Q Q,GUO X D,WEN F,et al.Aptamer-based fluorescence quenching approach for detection of aflatoxin M1 in milk[J].Frontiers in Chemistry,2021,9:653869.
[25] PANG Y H,GUO L L,SHEN X F,et al.Rolling circle amplified DNA zyme followed with covalent organic frameworks:Cascade signal amplification of electrochemical ELISA for alfatoxin M1 sensing[J].Electrochimica Acta,2020,341:136055.