枇杷(Eriobotrya japonica Lindl)属蔷薇科枇杷属,原产于我国东南部[1-2],是我国著名的特产经济果树,具有悠久的栽培历史。枇杷富含多种营养元素,且具有润肺通气和祛痰止咳等功效[3-4]。枇杷不仅可以鲜食,还被加工成罐头、花茶、饮料、酒等。福建、四川、江苏等省是我国主要枇杷栽培地区。枇杷花期通常在秋季或是初冬,果实在春季至初夏成熟,在生长过程中易受到病虫害的侵袭,主要病虫害有炭疽病、灰霉病、叶斑病、枇杷黄毛虫、苹掌舟蛾、梨小食心虫、木虱、桃蛀螟、介壳虫、螨类等,为害枝干的有天牛类害虫[5-6]。
枇杷在我国属于小宗作物,我国小宗作物是指特色蔬菜、水果、谷物、食用菌、中药材等种植面积小,但区域特色明显,可用防治药剂不完善的特色小作物[7]。小作物通常具有种植面积小、总产量低、膳食摄入少或病虫害发生频率低的特点。因此,在这些作物上登记农药的成本相对较高,造成农药生产企业不愿在这些作物上登记农药产品。目前枇杷上登记的农药有甲氨基阿维菌素苯甲酸盐、高效氯氟氰菊酯、嘧菌酯、井冈霉素、丙环唑、苯醚甲环唑、多菌灵、戊唑醇、喹啉酮、异菌脲、氟吡菌酰胺、肟菌酯,以及氯吡脲、矿物油等[8]。枇杷生产中存在登记农药不能满足生产实际的产业问题。
氟吡菌酰胺是拜耳作物科学公司开发的琥珀酸脱氢酶抑制剂类(succinate dehydrogenase inhibitor,SDHI)杀菌、杀线虫剂,除用于果树、蔬菜及大田等作物上的斑点落叶病、叶斑病、灰霉病、白粉病等的防控外,还登记在多种作物上用于防治多种线虫。肟菌酯具有高效、广谱、保护、治疗、内吸活性、耐雨水冲刷、持效期长等特性,除对白粉病、叶斑病有特效外,对锈病、霜霉病、立枯病等有良好的活性。
农药残留联席会议(FAO/WHO joint meeting on pesticide residues,JMPR)规定氟吡菌酰胺残留物为氟吡菌酰胺[9],肟菌酯残留物为肟菌酯和肟菌酸之和,以肟菌酯表示[10]。在GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》中,规定了肟菌酯在枇杷中的最大残留限量(maximum residue limit,MRL)为0.7 mg/kg。目前氟吡菌酰胺在我国登记作物有:洋葱、番茄、辣椒、黄瓜、柑橘、苹果、梨、葡萄、草莓、枇杷、西瓜等[8],但尚未制定氟吡菌酰胺在枇杷上的MRL。
目前对于氟吡菌酰胺和肟菌酯研究主要集中在检测方法、残留分析和消解行为方面。在检测方法方面,有高效液相色谱法[11-12]、超高效液相色谱串联质谱法[13-14]、气相色谱和气相色谱质谱联用法[15-16];在残留分析和消解行为方面,有氟吡菌酰胺在菜豆、蔬菜、草莓、烟草和生姜等中的残留消解动态研究[13,17-20],肟菌酯在芒果、番茄、桃和马铃薯等作物上的残留降解研究[21-24]。氟吡菌酰胺在菜豆上的原始沉积量为0.248 mg/kg,半衰期为2.9 d[13];在草莓中的原始沉积量为0.34~0.37 mg/kg,半衰期为7.2~8.2 d[18];在鲜烟叶中的原始沉积量为13 mg/kg[19]。肟菌酯在马铃薯植株上的原始沉积量为0.79~3.29 mg/kg[24]。有关氟吡菌酰胺和肟菌酯及它们的代谢物在枇杷上的残留行为研究鲜见报道。
本文以枇杷为研究对象,采用超高效液相色谱-串联质谱法检测了氟吡菌酰胺和肟菌酯在枇杷中的残留行为和消解动态,对其进行膳食风险评估,并提出安全合理的使用建议。研究结果可为氟吡菌酰胺在枇杷上MRL的制定提供数据参考,对于加快推进特色小宗作物用药登记,强化农药监管,保障农产品质量安全具有重要意义。
1 材料与方法
1.1 材料与试剂
氟吡菌酰胺(纯度99.2%)、肟菌酯(纯度99.5%),Chem Service公司;代谢物2-(三氟甲基)苯甲酰胺[2-(trifluoromethyl)benzamide,BZM](纯度99.4%)、43%(500 g/L)氟吡菌酰胺·肟菌酯悬浮剂,拜耳公司;肟菌酸(纯度98.0%),FUJIFILM Wako Pure Chemical Corporation生产;乙腈、甲醇、乙酸乙酯(色谱纯),美国Sigma Aldrich公司;氯化钠(分析纯),广州化学试剂厂;水为二次蒸馏水;氨基固相萃取小柱:6 mL(1 000 mg),Agilent Technologies。
1.2 仪器与设备
超高效液相色谱质谱联用仪(质谱为Agilent 6450,液相为Agilent 1200),安捷伦公司;GTR22-1离心机,北京时代北利离心机有限公司;XW-80A涡旋仪,上海精科有限公司;ULTRA-TURRAXT 25匀浆机,德国IKA公司;HY-5回旋式振荡器,天津市津腾实验设备有限公司;SHANGPING FA2004分析天平、SHIMADZU TXB622L电子天平,岛津公司。
1.3 田间试验和样品采集
田间试验于2019年于广东、福建、四川、云南、湖南、浙江等六地枇杷产区开展。43%(500 g/L)氟吡菌酰胺·肟菌酯悬浮剂防治枇杷枝枯病,施用剂量:333 mg/kg;施药方法:叶面喷雾;施药次数:2次,施药间隔为10~15 d,安全间隔期28 d。施药器具:电动背负式喷雾器。
最终残留量试验设置6个试验点:每个试验点设置1个处理小区和1个对照小区,每小区不应少于4棵。以333 mg/kg的剂量施药2次。末次施药后28、35 d采样。对照小区,采集对照样品。
残留消解动态,分别在广东、福建、四川三地进行。残留消解试验在最终残留试验小区中开展,没有额外设置试验小区,每个试验点在末次施药后:2 h、1、7、28、35 d采样。
样品采集:随机在果树的不同方向及不同部位采集枇杷个体12个(至少2 kg),处理小区每次采集2个独立样品,样本在采集后8 h内运回实验室。实验室样品制备:取田间样品,计个数和称量后,取出果核并称重,将全果样品直接切碎,混匀,四分法缩分,分取150 g样品2份,装入样品容器中,贴好标签,贮存于-20 ℃冰箱待分析。
1.4 实验方法
1.4.1 样品前处理
称取枇杷样品10.00 g(精确至0.01 g)于100 mL离心管中,加入20.00 mL乙腈,于匀浆机以1 000 r/min,匀质1 min,加入4.0 g氯化钠,剧烈振动2 min;3 800 r/min离心5 min,吸取上清液2.00 mL于离心管中,于40 ℃氮吹仪中吹至近干,用2.00 mL乙酸乙酯溶解,待净化。
取氨基固相萃取柱,顶端加1.5 cm厚的无水硫酸钠层,用4.00 mL乙腈/乙酸乙酯(3∶1,体积比)预淋,将上述浓缩物移入固相萃取小柱中,用25 mL溶液[V(乙腈)∶V(乙酸乙酯)=3∶1]洗脱,收集冼脱液于离心瓶中,减压浓缩至少许,用氮气吹干,2.00 mL甲醇定容,过0.22 μm滤膜,供超高效液相色谱串联质谱仪测定。
1.4.2 溶剂标准工作液和基质标准溶液的配制
氟吡菌酰胺、BZM、肟菌酯、肟菌酸的标准母液:分别称取氟吡菌酰胺、BZM、肟菌酯、肟菌酸标准品10.00 mg于10 mL容量瓶中,用甲醇定容,摇匀,配制成1 000 mg/L标准母液,置于4 ℃冰箱中待用。
氟吡菌酰胺、BZM、肟菌酯、肟菌酸的工作溶液:各取1 mL 1 000 mg/L氟吡菌酰胺、BZM、肟菌酯、肟菌酸的标准母液,甲醇定容至10 mL,配制成100 mg/L的混合标准溶液,用乙腈将混合标准溶液逐级稀释配成1、0.5、0.1、0.05、0.01、0.005 mg/L系列标准溶液,现配现用。
氟吡菌酰胺、BZM、肟菌酯、肟菌酸的基质溶液:各取1 mL 1000 mg/L氟吡菌酰胺、BZM、肟菌酯、肟菌酸的标准母液,甲醇定容至10 mL,配制成100 mg/L的混合标准溶液,用枇杷基质空白对照液逐级稀释,配制成1、0.5、0.1、0.05、0.01、0.005 mg/L的系列基质匹配标准溶液,现配现用。
基质效应计算如公式(1)所示,当ME为正值时,表示存在基质增强效应,基质可提高目标物效应;ME为负值时,表示存在基质抑制效应,基质可降低目标物效应;ME=0时,表示不存在基质效应。
(1)
[mmatrix为基质匹配标准曲线的斜率,msolvent为纯溶剂标准曲线的斜率。
1.4.3 仪器条件
色谱条件:安捷伦XDB-C18(100 mm×4.6 mm×1.8 μm);柱箱温度:35 ℃;流动相:V(乙腈)∶V(水)=60∶40;流速:0.3 mL/min;进样量:1 μL。
质谱条件:离子源温度350 ℃,毛细管电压4 000 V,干燥气温度300 ℃,干燥气流速11 mL/min,雾化气压力103 kPa,反应气为氮气;其他质谱参数见表1。
表1 MRM监测条件参数
Table 1 MS parameters for the detection of fluopyram,BZM,trifloxystrobin,and trifloxystrobin acid
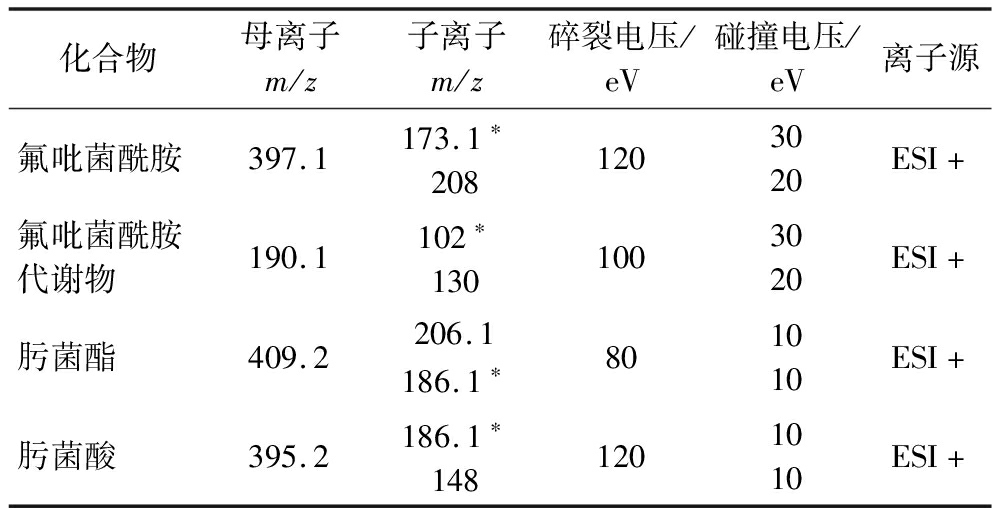
化合物母离子m/z子离子m/z碎裂电压/eV碰撞电压/eV离子源氟吡菌酰胺397.1173.1∗2081203020ESI+氟吡菌酰胺代谢物190.1102∗1301003020ESI+肟菌酯409.2206.1186.1∗801010ESI+肟菌酸395.2186.1∗1481201010ESI+
注:“*”代表定量离子,“+”代表正离子模式。
1.4.4 降解动态方程
按一级动力学反应方程拟合氟吡菌酰胺、肟菌酯在枇杷上的残留降解动态,按公式(2)拟合消解曲线,按公式(3)计算消解半衰期:
Ct=Ce-Kt
(2)
(3)
[:Ct为时间t(d或h)时的残留量,mg/kg;Ce为施药后的初始沉积量,mg/kg;K为消解系数;t为施药后时间(采样距施药间隔),d或h;t1/2为半衰期,d。
1.4.5 膳食风险评估
依据《中国不同人群消费膳食分组食谱》,结合残留化学评估推荐的规范残留试验中值和已制定的最大残留限量(maximum residue limit,MRL),计算该农药的国家估算每日摄入量(national estimated daily intake,NEDI),通过与毒理学评估推荐的每日允许摄入量(acceptable daily intake,ADI)进行比较,计算风险概率(risk quotient,RQ),NEDI和RQ的计算分别如公式(4)、公式(5)所示:
NEDI=∑(STMR×Fi)
(4)
(5)
[:STMR为农药在某种作物中的残留中值,mg/kg;Fi为一般人群对该作物的消费量,kg;bw为我国的人均体重,kg;RQ为风险商,可评估化学组分对人类健康产生有害影响的潜在风险性;ADI为农药每日允许摄入量,mg/kg bw。氟吡菌酰胺的ADI为0.01 mg/kg bw[9],肟菌酯的ADI为0.04 mg/kg bw[10]。
依据《食品中农药残留风险评估指南》在计算NEDI时,如果没有合适的STMR值,可直接采用相应的MRL值代替。当RQ>100%时,认为该农药残留对一般人群健康存在不可接受的慢性风险。
2 结果与分析
2.1 方法验证
按1.4.3节仪器条件测定,氟吡菌酰胺、BZM、肟菌酯、肟菌酸以各自溶剂标准溶液和基质标准溶液质量浓度与检测离子峰面积作标准曲线。
如表2所示,氟吡菌酰胺、BZM、肟菌酯、肟菌酸的峰面积与质量浓度间呈良好的线性关系。氟吡菌酰胺和肟菌酯及它们的代谢物在枇杷上的基质效应在-11.6%~13.3%,>-20%且<20%,故基质效应可忽略,用溶剂标准曲线进行校正。
表2 氟吡菌酰胺、BZM、肟菌酯、肟菌酸线性方程和基质效应
Table 2 Linear equation and matrix effects of fluopyram,BZM,trifloxystrobin,and trifloxystrobin acid
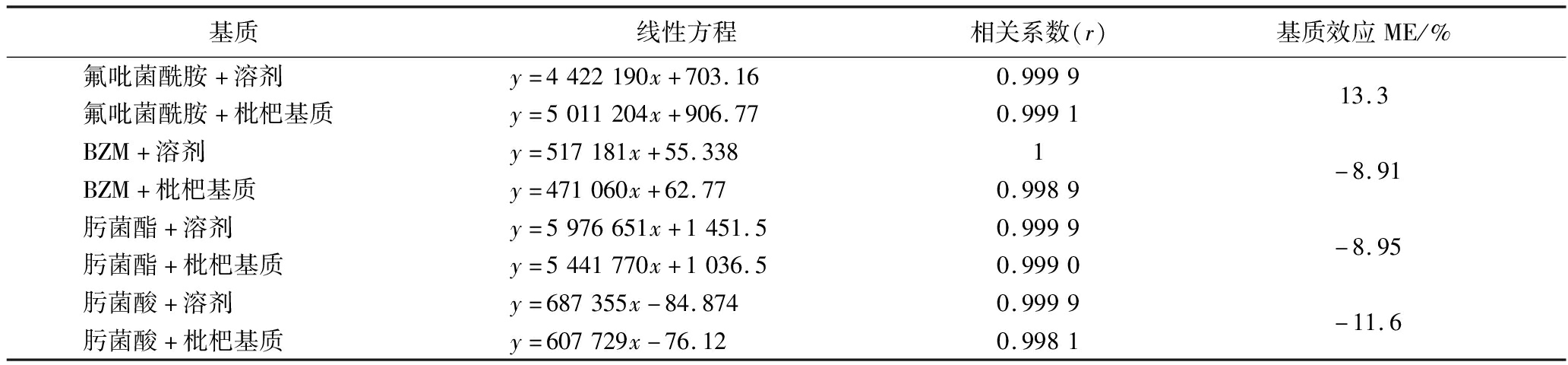
基质线性方程相关系数(r)基质效应ME/%氟吡菌酰胺+溶剂y=4422190x+703.160.999913.3氟吡菌酰胺+枇杷基质y=5011204x+906.770.9991BZM+溶剂y=517181x+55.3381-8.91BZM+枇杷基质y=471060x+62.770.9989肟菌酯+溶剂y=5976651x+1451.50.9999-8.95肟菌酯+枇杷基质y=5441770x+1036.50.9990肟菌酸+溶剂y=687355x-84.8740.9999-11.6肟菌酸+枇杷基质y=607729x-76.120.9981
根据欧盟文件SANTE/11813/2017规定,当最小添加水平回收率满足70%~120%及相对标准偏差(relative standard deviation,RSD)≤20%时,定量限(limit of quantitation,LOQ)可以为最小添加水平[25]。氟吡菌酰胺、BZM、肟菌酯、肟菌酸在枇杷中的LOQ均为0.01 mg/kg。
在空白枇杷中添加3档浓度的氟吡菌酰胺、BZM、肟菌酯、肟菌酸混合标准溶液,每档重复5次,结果见表3。
表3 氟吡菌酰胺、BZM、肟菌酯、肟菌酸在枇杷中的添加回收率及相对标准偏差(n=5) 单位:%
Table 3 Average recovery,relative standard deviation of fluopyram,BZM,trifloxystrobin,and trifloxystrobin acid in loquat (n=5)
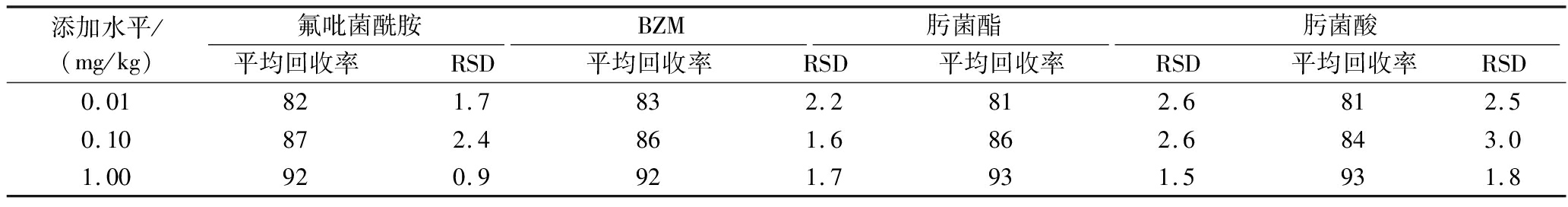
添加水平/(mg/kg)氟吡菌酰胺BZM肟菌酯肟菌酸平均回收率RSD平均回收率RSD平均回收率RSD平均回收率RSD0.01821.7832.2812.6812.50.10872.4861.6862.6843.01.00920.9921.7931.5931.8
氟吡菌酰胺回收率为82%~92%,RSD为0.9%~2.4%;BZM回收率为83%~92%,RSD为1.6%~2.2%;肟菌酯回收率为81%~93%,RSD为1.5%~2.6%;肟菌酸回收率为81%~93%,RSD为1.8%~3.0%。
2.2 降解动态
施药2 h后,氟吡菌酰胺在广东、福建、四川三地枇杷上的的初始沉积量为0.25~0.36 mg/kg,施药后28 d时残留量为0.01~0.03 mg/kg,与文献报道的氟吡菌酰胺在菜豆和草莓中的原始沉积量(0.25~0.37 mg/kg)相当[13,18],氟吡菌酰胺在枇杷上使用28 d消解率达到90%,均未获得消解趋势。施药2 h后,肟菌酯(总量)在广东、福建、四川三地枇杷上的初始沉积量为0.26~0.36 mg/kg,低于其在马铃薯植株上的原始沉积量[24],施药后28 d时残留量为0.02~0.04 mg/kg,消解率达85%,均未获得消解趋势。氟吡菌酰胺和肟菌酯在不同作物上由于作物种类、作物生长稀释作用、环境条件等不同导致其原始沉积量不同。
2.3 最终残留
由表4可知,28 d时枇杷中氟吡菌酰胺和BZM的残留量分别为<0.01~0.03 mg/kg、<0.01~0.01 mg/kg,肟菌酸和肟菌酯残留量分别为<0.01~0.01 mg/kg、0.01~0.02 mg/kg;35 d时枇杷中氟吡菌酰胺和BZM的残留量分别为<0.01~0.03 mg/kg、<0.01~0.01 mg/kg,肟菌酸和肟菌酯残留量分别为<0.01 mg/kg、0.01~0.01 mg/kg。
表4 氟吡菌酰胺、BZM、肟菌酯、肟菌酸在枇杷中的最终残留量 单位:mg/kg
Table 4 Final residues of fluopyram,BZM,trifloxystrobin,and trifloxystrobin acid in loquat
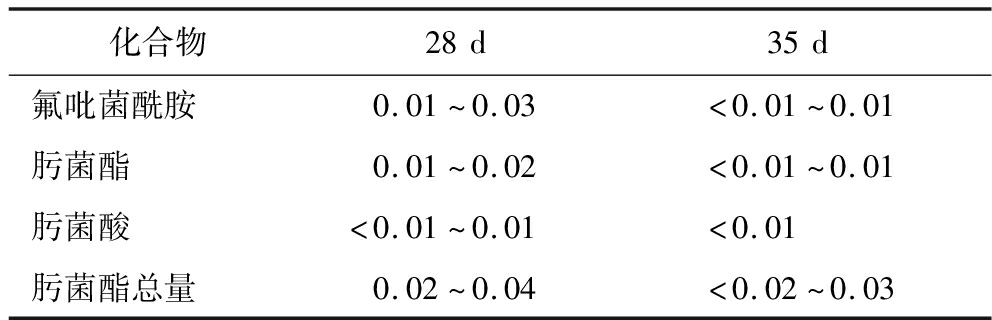
化合物28d35d氟吡菌酰胺0.01~0.03<0.01~0.01肟菌酯0.01~0.02<0.01~0.01肟菌酸<0.01~0.01<0.01肟菌酯总量0.02~0.04<0.02~0.03
表5 氟吡菌酰胺的慢性膳食风险
Table 5 The chronic dietary risk assessment of fluopyram
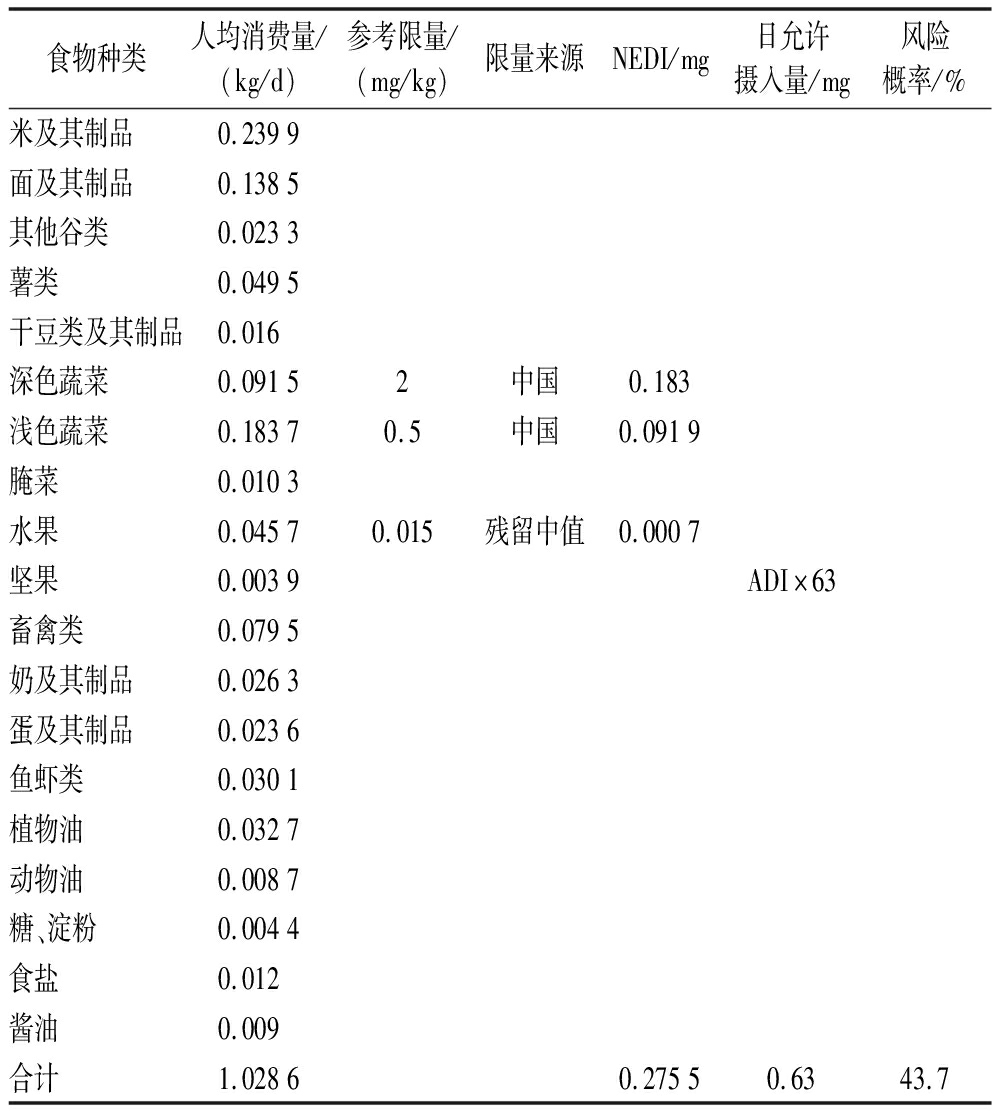
食物种类人均消费量/(kg/d)参考限量/(mg/kg)限量来源NEDI/mg日允许摄入量/mg风险概率/%米及其制品0.2399面及其制品0.1385其他谷类0.0233薯类0.0495干豆类及其制品0.016深色蔬菜0.09152中国0.183浅色蔬菜0.18370.5中国0.0919腌菜0.0103水果0.04570.015残留中值0.0007坚果0.0039ADI×63畜禽类0.0795奶及其制品0.0263蛋及其制品0.0236鱼虾类0.0301植物油0.0327动物油0.0087糖、淀粉0.0044食盐0.012酱油0.009合计1.02860.27550.6343.7
2.4 膳食评估
JMPR规定氟吡菌酰胺的ADI值为0.01 mg/kg bw[9]。目前氟吡菌酰胺在我国登记作物有:洋葱、番茄、辣椒、黄瓜、柑橘、苹果、梨、葡萄、草莓、枇杷、西瓜,但我国尚未制定其在枇杷上的限量标准,根据枇杷中氟吡菌酰胺的残留中值0.015 mg/kg,计算得出的RQ为43.7%。由此可见,按照推荐剂量在枇杷上使用氟吡菌酰胺,不会对一般人群造成不可接受的慢性膳食风险。
我国已制定肟菌酯在枇杷中的限量,在制定限量时已做过相应的评估,因此本文没有对肟菌酯进行膳食风险评估。
3 结论与讨论
本研究建立了以乙腈作为提取溶剂,氨基固相萃取SPE柱净化,应用UPLC-MS/MS检测枇杷中的氟吡菌酰胺及BZM、肟菌酯及肟菌酸残留量的方法,结果表明,该方法准确度和灵敏度良好,可满足试验农药残留检测分析要求。氟吡菌酰胺和肟菌酯施用后,消解较快,施用后28 d后,氟吡菌酰胺残留量为<0.01~0.03 mg/kg,肟菌酯的残留量为<0.02~0.04 mg/kg,其中肟菌酯的残留量低于我国规定枇杷上的最大残留限量0.7 mg/kg,枇杷中氟吡菌酰胺的膳食暴露风险在可接受范围内。目前我国尚未制定氟吡菌酰胺在枇杷上的最大残留限量标准。本研究明确了氟吡菌酰胺、肟菌酯在枇杷上的消解和最终残留水平,同时进行了慢性膳食风险评估,为该农药在我国枇杷上的登记、使用提供了技术和数据支撑。
[1] 李怡诺,王洋,赵小娜,等.7个产区大五星枇杷果实品质差异研究[J].西北农林科技大学学报(自然科学版),2023,51(12):29-38.LI Y N,WANG Y,ZHAO X N,et al.Differences in fruit quality of Dawuxing loquat from seven production regions[J].Journal of Northwest A &F University (Natural Science Edition),2023,51(12):29-38.
[2] 蒋际谋,陈秀萍,邓朝军,等.我国枇杷产业优劣势分析与发展对策[J].中国园艺文摘,2018,34(4):46-48;68.JIANG J M,CHEN X P,DENG C J,et al.Analysis and development strategy of the advantages and disadvantages of loquat industry in China[J].Chinese Horticulture Abstracts,2018,34(4):46-48;68.
[3] WANG L,SHAO S,MADEBO M P,et al.Effect of nano-SiO2 packing on postharvest quality and antixidant capacity of loquat fruit under ambient temperature storage[J].Food Chemistry,2020,315:126295.
[4] ZHANG W N,ZHAO X Y,SUN C D,et al.Phenolic composition from different loquat (Eriobotrya japonica Lindl.) cultivars grown in China and their antioxidant properties[J].Molecules,2015,20(1):542-555.
[5] 王慧颖,李振斌,吴彤林.枇杷病虫害发生规律及防治技术浅析[J].南方农业,2019,13(27):9;17.WANG H Y,LI Z B,WU T L.Analysis on occurrence regularity and control techniques of loquat diseases and pests[J].South China Agriculture,2019,13(27):9;17.
[6] 刘彬.枇杷病虫害的发生特点及综合防治技术[J].现代农业科技,2019(9):110;114.LIU B.Occurrence characteristics and integrated control techniques of loquat diseases and insect pests[J].Modern Agricultural Sciences and Technology,2019(9):110;114.
[7] 宋稳成,单炜力,潘灿平,等.小作物用农药登记管理研究[J].中国农学通报,2010,26(2):212-215.SONG W C,SHAN W L,PAN C P,et al.Studies on pesticide registration and administration on minor crops[J].Chinese Agricultural Science Bulletin,2010,26(2):212-215.
[8] 中国农药信息网.数据库/农药登记数据[DB/OL].[2023-09-06].http://www.icama.org.cn/hysj/index.jhtml.Chinese Pesticide Information Network.Database/Pesticide Registration Data[DB/OL].[2023-09-06].http://www.icama.org.cn/hysj/index.jhtml.
[9] Food and Agriculture Organization of the United Nations.Fluopyram[DB/OL].[2023-08-09].https://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Evaluation10/Fluopyram.pdf.
[10] Food and Agriculture Organization of the United Nations.Trifloxystrobin[DB/OL].[2023-08-09].https://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Evaluation04/TRIFLOXYSTROBIN.pdf.
[11] 王思威,常虹,王潇楠,等.43%氟吡菌酰胺·肟菌酯悬浮剂的HPLC分析[J].农药科学与管理,2022,43(1):36-42.WANG S W,CHANG H,WANG X N,et al.Analytical method of fluopyram·trifloxystrobin 43% SC by HPLC[J].Pesticide Science and Administration,2022,43(1):36-42.
[12] 吴珉,党璐,陈国珍,等.高效液相色谱法测定40%苯醚甲环唑·肟菌酯水分散粒剂[J].农药,2023,62(8):579-581.WU M,DANG L,CHEN G Z,et al.Determination of difenoconazole·trifloxystrobin 40% water dispersible granule by high performance liquid chromatography[J].Agrochemicals,2023,62(8):579-581.
[13] 李凯龙,姚燕霞,姜锦林,等.UPLC-MS/MS检测氟吡菌酰胺在菜豆中的残留及消解动态[J].湖南农业科学,2022(11):84-87.LI K L,YAO Y X,JIANG J L,et al.Residue and dissipation dynamic of fluopyram in kidney beans determined by UPLC-MS/MS[J].Hunan Agricultural Sciences,2022(11):84-87.
[14] 段劲生,朱玉杰,孙海滨,等.超高效液相色谱-串联质谱法测定稻田中肟菌酯及其代谢物的残留[J].中国农学通报,2017,33(35):57-62.DUAN J S,ZHU Y J,SUN H B,et al.Trifloxystrobin and its metabolite residue in paddy field:Measured by ultra efficient liquid chromatography with tandem mass spectrometry[J].Chinese Agricultural Science Bulletin,2017,33(35):57-62.
[15] 孙雪梅,孙财远,包兴涛,等.通过GC和GC-MS方法测定氟吡菌酰胺蔬菜中残留量[J].农药,2017,56(5):364-366;376.SUN X M,SUN C Y,BAO X T,et al.Determination of fluopyram residues in vegetables by GC and GC-MS[J].Agrochemicals,2017,56(5):364-366;376.
[16] 陈浩,焦婵媛,杨帅杰.气相色谱质谱法测定芹菜中肟菌酯含量不确定度评定[J].广州化工,2020,48(10):110-112.CHEN H,JIAO C Y,YANG S J.Evaluation of uncertainty in the determination of oximectin in celery by GC-MS[J].Guangzhou Chemical Industry,2020,48(10):110-112.
[17] 陈丽霞,许丽建,陈歆,等.超高效液相色谱-串联质谱法同时测定蔬菜中阿维菌素和氟吡菌酰胺的残留[J].热带作物学报,2021,42(1):254-259.CHEN L X,XU L J,CHEN X,et al.Determination of abamectin and fluopyram residues in vegetables using ultra-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Tropical Crops,2021,42(1):254-259.
[18] 贾春虹,吴俊学,赵尔成,等.超高效液相色谱-串联质谱检测草莓中氟吡菌酰胺和嘧霉胺的残留与消解[J].农药,2021,60(1):42-45.JIA C H,WU J X,ZHAO E C,et al.Determination and dissipation of fluopyram and pyrimethanil in strawberry using UPLC-MS/MS[J].Agrochemicals,2021,60(1):42-45.
[19] 谭菲菲,高政绪,高强,等.氟吡菌酰胺及其代谢物在烟草种植和加工过程中的降解特征[J].中国烟草科学,2021,42(5):69-74.TAN F F,GAO Z X,GAO Q,et al.Residue degradation of fluopyram and its metabolites during tobacco planting and processing[J].Chinese Tobacco Science,2021,42(5):69-74.
[20] 马新刚,郭连军,于志波,等.基于残留和膳食风险评估的氟吡菌酰胺和噻唑膦在生姜中的安全性评价[J].农药,2023,62(8):594-598.MA X G,GUO L J,YU Z B,et al.Safety evaluation of fluopyram and fosthiazate in ginger based on residue and dietary risk assessment[J].Agrochemicals,2023,62(8):594-598.
[21] 范金平,张盈,魏进,等.QuEChERS-超高效液相色谱-串联质谱法同时测定芒果中氟吡菌酰胺、肟菌酯及其代谢物残留量[J].农药,2020,59(7):516-522.FAN J P,ZHANG Y,WEI J,et al.Determination of fluopyram,trifloxystrobin and its metabolite in mango by QuEChERS-UHPLC-MS/MS[J].Agrochemicals,2020,59(7):516-522.
[22] 李若同,胡继业.QuEChERS-高效液相色谱-串联质谱法检测吡噻菌胺、肟菌酯及代谢物在番茄中的残留及长期膳食风险评估[J].农药学学报,2022,24(3):572-580.LI R T,HU J Y.Residue and chronic dietary risk assessment of penthiopyrad,trifloxystrobin and their metabolites in tomato by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Pesticide Science,2022,24(3):572-580.
[23] 周娟,许海康,马婧玮,等.UPLC-MS/MS法同时测定桃中氟吡菌酰胺和肟菌酯及其代谢产物[J].分析试验室,2023,42(7):917-922.ZHOU J,XU H K,MA J W,et al.Simultaneous determination of fluopyram and trifloxystrobin in peaches and their metabolites by UPLC-MS/MS[J].Chinese Journal of Analysis Laboratory,2023,42(7):917-922.
[24] 石凯威,赵婷婷,朱宇珂,等.肟菌酯和戊唑醇在马铃薯种植体系中的沉积和降解行为[J].农药,2021,60(4):277-281.SHI K W,ZHAO T T,ZHU Y K,et al.The deposition and dissipation of trifloxystrobin and tebuconazole in potato filed[J].Agrochemicals,2021,60(4):277-281.
[25] Directorate General for Health and Food Safety[C].Guidance document on analytical quality control and method validation procedures for pesticide residues analysis in food and feed.European Commission,2017.