蜂王浆是工蜂上颚腺和咽下腺共同分泌的,主要用于饲喂蜂王和蜂幼虫的乳白色、淡黄色或浅橙色浆状物质[1]。蜂王浆不仅对蜜蜂的级型分化起决定性作用,还具有维持人体健康的生物学活性,比如抗炎[2-3]、抗菌[4-5]、抗病毒[6-7]、抗衰老[8]、抗肿瘤[9-10]和抗氧化[11]等。我国是世界蜂王浆生产量和出口量最高的国家。世界上约有90%以上的蜂王浆产自中国[12]。2021年,我国的新鲜蜂王浆和王浆粉出口量分别为683 t和195 t,且近年来蜂王浆出口量仍呈现出逐年上升的趋势[13]。随着蜂王浆在医药、食品、化妆品等多个领域的拓展应用,使得蜂王浆研究得到广泛关注[12,14]。
蜂王浆具有维持人体健康的生物学活性主要得益于其活性成分,包括蛋白质、脂肪酸、氨基酸和维生素等[14-15]。然而,新鲜蜂王浆对温度和时间的变化极为敏感,在贮存不当的情况下,蜂王浆的活性成分含量下降,蜂王浆的新鲜度降低,导致整体品质下降[16]。因此,蜂王浆新鲜度是衡量其品质的重要指标。现行的国家标准GB 9697—2008《中华人民共和国国家标准 蜂王浆》中,仅对水分、蛋白质、总糖、灰分和酸度等常规化指标进行了规定,以10-羟基-2-癸烯酸[(E)-10-hydroxydec-2-enoic acid,10-HDA]含量作为蜂王浆品质的主要评价指标。但研究证明,10-HDA结构非常稳定,其含量几乎不随贮存温度升高和时间的延长而减少[17],无法体现蜂王浆的新鲜度,不能全面地评价蜂王浆的品质。因此,寻找可以准确反映新鲜度的指标对于蜂王浆的质量控制尤为重要。
自20世纪80年代以来,各国学者针对蜂王浆新鲜度进行了大量研究,提出了王浆主蛋白(major royal jelly proteins,MRJPs)[18-21]、美拉德反应产物[22-26]、超氧化物歧化酶(superoxide dismutase,SOD)[27]、葡萄糖氧化酶(glucose oxidase,GOD)[18-19,28]、三磷酸腺苷(adenosine triphosphate,ATP)[29]和游离氨基酸(free amino acids,FAA)[30]等可能作为蜂王浆新鲜度的评价指标(图1和表1),这些检测方法各有优劣,其中MRJPs和糠氨酸含量是最受关注的检测指标,但目前还不是国际公认的蜂王浆新鲜度评价指标。因此,找到一种能如实反映蜂王浆新鲜度的评价指标及其检测方法,完善蜂王浆质量评价体系,对于促进蜂王浆产业的发展具有重要意义。本文从蜂王浆的成分展开讨论,对蜂王浆新鲜度的评价指标及其检测方法进行综述。
表1 蜂王浆新鲜度潜在检测指标及其检测技术
Table 1 Potential detection indicators and techniques of royal jelly freshness

指标类型潜在检测指标检测技术变化规律参考文献蛋白质MRJP1MRJP4MRJP1-3酰胺Ⅰ带(1700~1600cm-1)ELISA法UPLC-MS/MS法胶体金免疫法UPLC-TQMS法FTIR法在室温及以上温度,总体蛋白质含量逐渐下降MRJP1具有高耐热性,在较高温度条件下(≥37℃)含量随贮存时间延长而降低MRJP4含量对温度敏感,在4℃条件下逐渐降解,16周时完全降解[1,19,21,31-36]美拉德反应产物糠氨酸5-HMFCMLHPLC法RP-IPCLC-MS法RP-HPLC法HPLC法ELISA法糠氨酸含量在4℃及以下条件缓慢增加,室温及以上温度条件增加迅速5-HMF含量在4℃下无法检出,在室温及以上条件,逐渐增加CML含量在室温条件下逐渐增加[23,25,37-40]ATP及其代谢产物F值UPLC法F值在4℃条件下开始下降,室温以上温度迅速下降[29]氨基酸类游离氨基酸GC-MS法无规律变化[30,41]游离谷氨酰胺UPLC法在室温下含量总体呈下降趋势酶类产物SOD活力GOD活力邻苯三酚法黄嘌呤氧化酶法过氧化物酶活力偶联测试法SOD活力对温度敏感,在4℃下迅速下降,8d后活力全部丧失GOD活力在室温条件下逐渐下降,55d丧失97.48%活力[27-28,42]其他色度分光度计法比色法室温下贮存2个月时其颜色变化达到峰值[16,43]黏度黏度计初始黏度为2060cP,室温下贮存1个月时超过检测上限(5000cP)[16]维生素B5HPLC法维生素B5对温度较为敏感,在10℃条件下含量逐渐减少,21d时减少77.2%[44]
注:UPLC-MS/MS:超高效液相色谱-串联质谱技术(ultra performance liquid chromatography-tandem mass spectrometry);FTIR:傅里叶变换红外光谱(Fourier transform infrared spectrometer);CML:羧甲基赖氨酸(Nε-carboxymethyl lysine);UPLC-TQMS:超高效液相色谱-三重四级杆串联质谱仪(ultra performance liquid chromatography-triple quadrupole tandem mass spectrometry);RP-IPC:反相离子对色谱法(reversed-phase ion pair chromatography);RT-HPLC:反相高效液相色谱法(reversed-phase high performance liquid chromatography);5-HMF:5-羟甲基糠醛(5-hydroxymethylfurfural)。
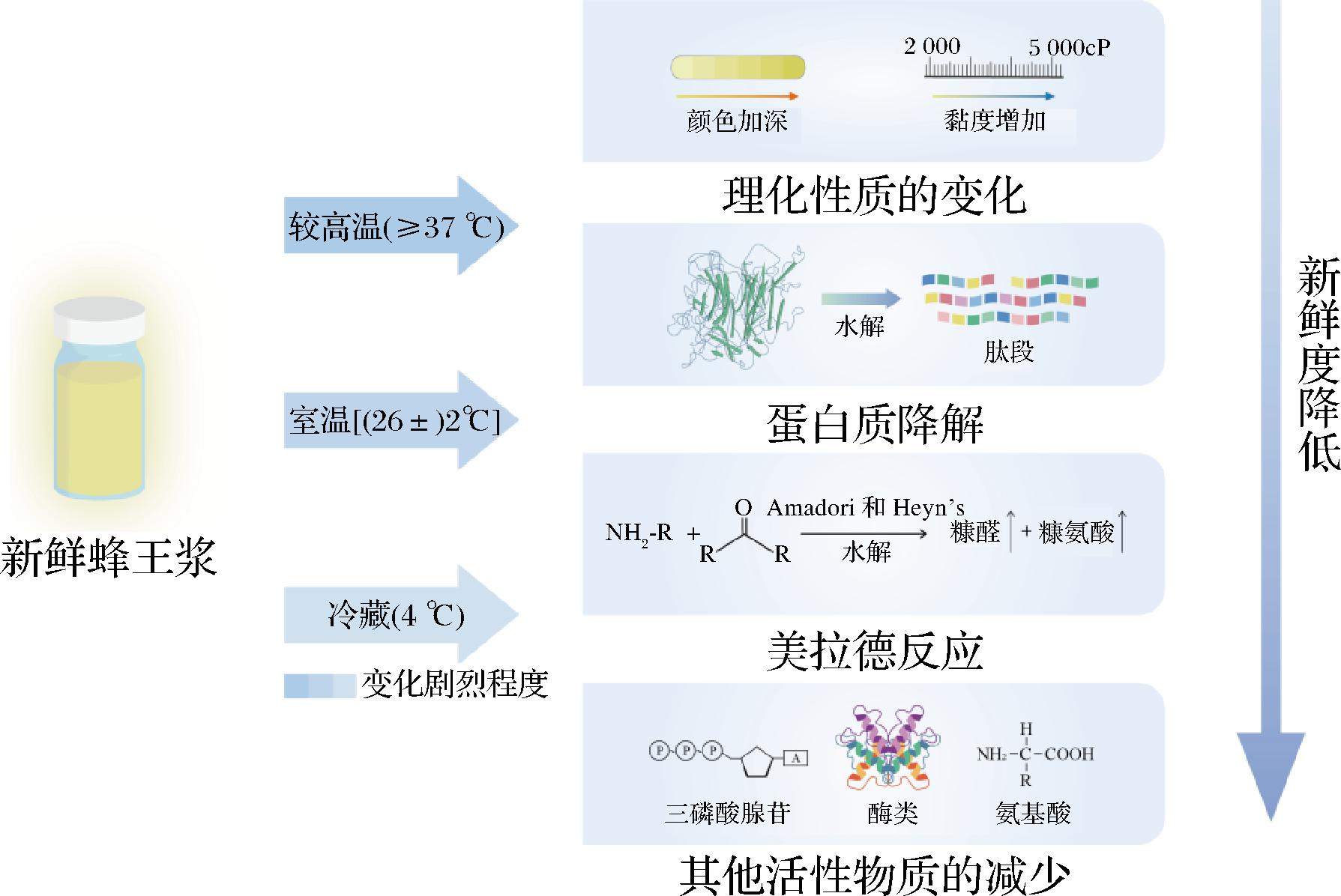
图1 蜂王浆贮存过程中理化性质和化学成分的变化
Fig.1 Changes of physicochemical properties and chemical composition in royal jelly during storage
1 蜂王浆新鲜度的潜在评价指标
1.1 总蛋白质
蛋白质是蜂王浆中含量最高的活性成分,在蜂王浆中的含量约为12%~15%,约占干物质含量50%[33]。其中,MRJPs占蜂王浆可溶性蛋白质的82%~90%[35],包括9种可溶性蛋白质(MRJP1~MRJP9)[45],是蜂王浆发挥生理学功能的主要物质基础。
为实现从整体层面评价蜂王浆品质,吴黎明等[32]采用FTIR光谱法,分析了在-18、4、16 和 28 ℃条件下贮存1、7、17、28、38 和 60 天蜂王浆样品的红外光谱图,对其峰位、峰形、谱图相关系数和相对峰强度进行研究。发现随着贮存时间延长和温度升高,红外光谱中酰胺Ⅰ 带(1 700~1 600 cm-1)波段的相关系数逐渐变小,I1 647/I1 541、I1 647/I1 409、I1 647/I1 247和I1 647/I1 054的相对峰强度呈线性降低。因此建立了以酰胺Ⅰ带区间相关系数和相对峰强度为指标的蜂王浆新鲜度评价方法。进一步分析蛋白质的二级结构,发现随着贮存时间延长和温度升高,蛋白质的α-螺旋相对含量显著减少,而β-折叠相对含量显著增加。表明对蜂王浆中蛋白质的二级结构进行宏观评价和进行半定量分析,也可以作为蜂王浆新鲜度评价的参考依据[46]。此外,吴亚君等[36]验证了毛细凝胶电泳技术在蜂王浆新鲜度研究领域的适用性,采用该技术对-20 ℃和4 ℃条件下贮存了15、30、45、60、75和90 d的蜂王浆样品中的水溶性蛋白进行了分离测定,检测到了19个蛋白峰。并发现在该运行条件下的6、9、13、18号蛋白峰面积随贮存温度升高和时间的延长呈现出规律性的下降。结合全组分蛋白质分析,选择了6号峰(10 kDa)和18号峰(50~100 kDa)作为蜂王浆新鲜度的指示峰,该指标能够体现蜂王浆在-20 ℃ 和4 ℃条件下贮存6个月内的新鲜度。并且,采用毛细管凝胶电泳技术检测蜂王浆水溶性蛋白含量,具有操作简单,快速等特点。以上研究表明,蜂王浆蛋白质中酰胺Ⅰ带特征波段的相关系数、4个相对峰强度(I1 647/I1 541、I1 647/I1 409、I1 647/I1 247和I1 647/I1 054)和2个蜂王浆蛋白特征峰具有成为新鲜度指标的潜力(图2)。
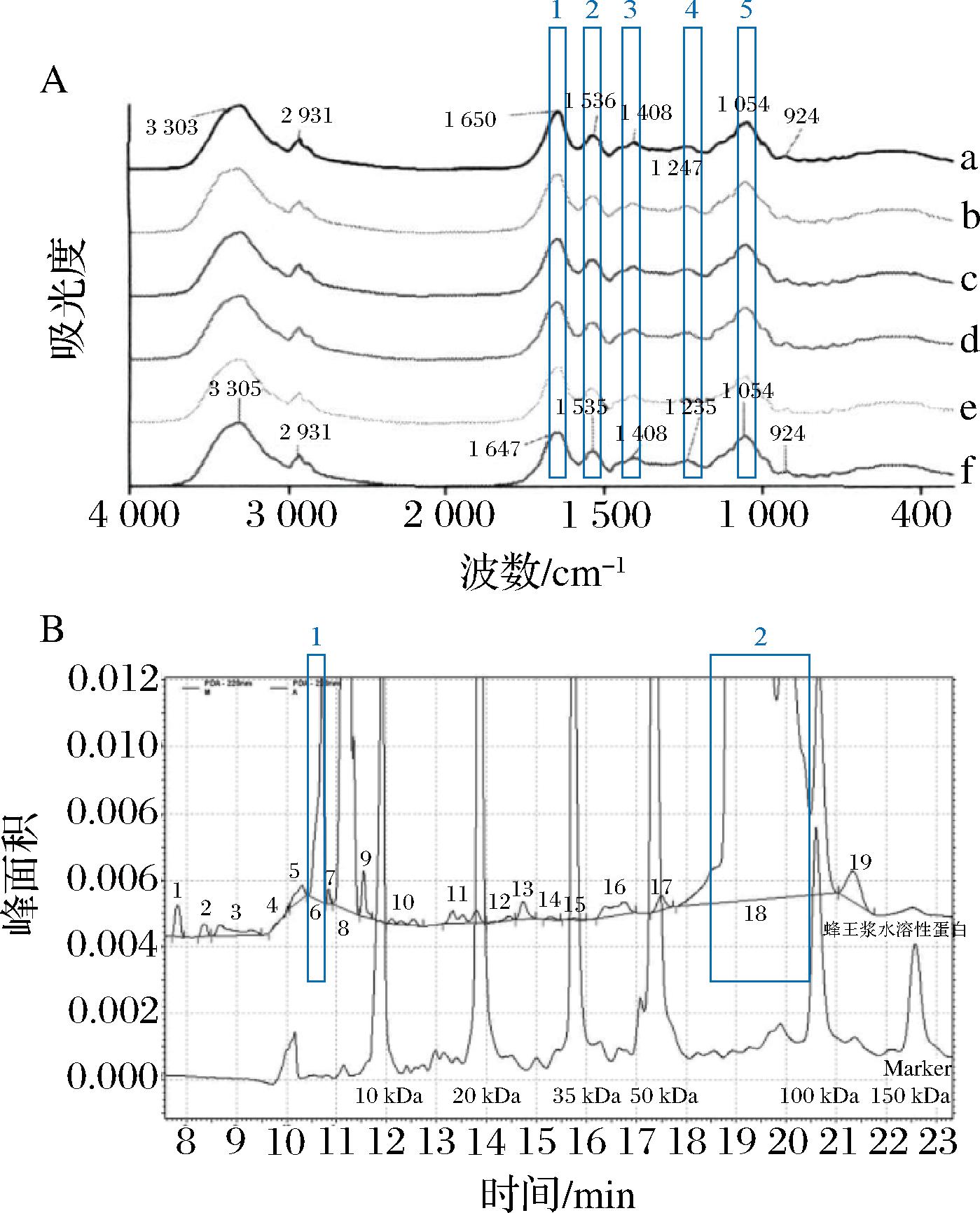
A-在28 ℃贮存不同时间后的FTIR图谱[35];B-毛细管电泳图谱[36]
图2 蜂王浆总蛋白质图谱
Fig.2 The royal jelly protein
1.2 王浆主蛋白
在蜂王浆的贮存过程中,蛋白质含量发生了较大变化,推测这是由于某一特定蛋白质组分含量变化引起的,所以蜂王浆中蛋白质组分一直都是新鲜度研究中重点关注的对象[47]。因此,蜂王浆中单一组分作为新鲜度检测指标,是否能够相对精确的评价蜂王浆品质,是蜂王浆新鲜度研究的热点之一[35]。
MRJP1,MRJP4和MRJP5的含量对贮存温度和时间的变化极为敏感,随着贮存温度的升高和贮存时间的延长,这3种蛋白的含量逐渐下降[18],因此常被认为是标志蜂王浆新鲜度的潜在指标。KAMAKURA等[21]将蜂王浆分别在4 ℃或40 ℃条件下贮存1、2和7 d,通过非变性聚丙酰胺凝胶电泳技术发现了一种分子质量为57 kDa的糖蛋白,随着温度升高和时间的延长,57 kDa糖蛋白在蜂王浆中的含量逐渐减少。将在4 ℃或40 ℃条件下贮存7 d的蜂王浆样品,进一步结合HPLC分析,发现在40 ℃条件下,57 kDa蛋白的含量显著降低。结合2次分析结果,推测57 kDa蛋白可以作为蜂王浆新鲜度的评价指标,并证明57 kDa蛋白即MRJP1的单体形式。然后,将新鲜蜂王浆、40 ℃存放7 d的蜂王浆和纯化后的MRJP1蛋白加入到大鼠肝细胞培养基中,发现新鲜蜂王浆和MRJP1蛋白可以促进大鼠肝细胞增殖,而40 ℃存放7 d的蜂王浆促进细胞增殖的功能消失,表明MRJP1对肝细胞的保护功能具有决定性的影响[20]。进一步研究发现MRJP1对蜜蜂的级型分化具有重要影响,如40 ℃存放7 d的蜂王浆中,MRJP1含量下降,失去了增加体型、促进卵巢生长和缩短发育时间等功能[1],表明MRJP1在维持蜂王浆促进干细胞增殖和级型分化功能方面具有重要作用,且与蜂王浆新鲜度有密切联系。
为探究蜂王浆贮存过程中MRJPs家族的含量变化,将新鲜蜂王浆贮存在-20 ℃,4 ℃和室温条件下80 d,通过二维凝胶电泳技术(2D-PAGE)分析,发现在4 ℃和室温条件下无法检测到MRJP4和MRJP5。因此,认为MRJP4和MRJP5对贮存温度变化敏感,是潜在的新鲜度标志[19]。通过进一步延长蜂王浆样品的贮存周期,检测在-20 ℃、4 ℃和室温条件下贮存了一年的蜂王浆蛋白含量变化。2D-PAGE结果证实了MRJP5的蛋白丰度随温度升高而降低的结论。凝胶过滤色谱分析技术分析发现MRJP5存在于新鲜和-20 ℃贮存条件下的蜂王浆样品中,4 ℃和室温条件下的蜂王浆样品中此蛋白已消失[18]。
在明晰了不同温度对MRJPs家族含量变化的影响后,HU等[33]监测了蜂王浆样品在-20 ℃、4 ℃、室温和37 ℃条件下贮存24周过程中MRJPs蛋白含量及其抑菌活性的变化规律。研究涉及了蜂王浆贮存的12个重要时间节点:1、3、5、7、10 d和2、3、4、6、8、16、24周,蛋白质免疫印迹实验结果显示,MRJP3,MRJP4和MRJP5在蜂王浆中的含量均随贮存时间的延长而降低,在37 ℃条件下,MRJP4的含量显著下降;蜂王浆样品的抑菌活性随着贮存温度升高和时间的延长而下降,贮存温度为37 ℃时,可显著影响其抑菌性,MRJP4在贮存过程中的含量变化与蜂王浆样品抑菌活性变化具有较强的相关性。以上结果表明MRJP4和MRJP5蛋白含量对贮存温度的变化较为敏感。因此,建议将MRJP4和MRJP5作为蜂王浆新鲜度的潜在指标。
1.3 美拉德反应产物
美拉德反应是食品在贮存或加工过程中,其中的氨基化合物与含羰基化合物之间产生的复杂反应[48],该反应主要可分为3个阶段,即初级阶段,中级阶段和高级阶段。在初级阶段,氨基化合物中的游离氨基与羰基化合物的游离羰基产生羟醛缩合反应,生成Schiff 碱,该物质经环化产生N-取代糖基胺。随后,N-取代糖基胺在醛糖或酮糖存在条件下分别产生Amadori和Heyn′s重排产物。中级阶段,Amadori和Heyn′s重排产物降解产生α-二羰基,并引发一系列连续或平行反应得到多种产物,如糠氨酸、HMF、二乙酰、乙酸和丙酮醛等。在反应的高级阶段中,中级阶段的产物经环化,脱水和缩合等多种反应,最终形成复杂的挥发性化合物(如吡呤,吡嗪类化合物)和类黑色素[49]。其产物含量被广泛于应用评价牛奶、鸡蛋、乳制品等食品的新鲜程度[50]。新鲜蜂王浆中富含蛋白质、氨基酸和糖类化合物,易于发生美拉德反应,且贮存时间延长和温度升高会加剧美拉德反应的程度,导致蜂王浆营养价值降低。因此,美拉德反应的产物含量被视作是评价蜂王浆质量的指标之一[51]。
1.3.1 糠氨酸
糠氨酸是美拉德反应的初级产物Amadori化合物的酸性水解产物[52],该阶段的反应即使在低温条件下也会产生,是加工食品中最常用的美拉德早期反应标志物之一[53]。国际标准化组织在2016年颁布的蜂王浆国际标准(ISO 12824:2016)中,将糠氨酸的含量纳入质量评价指标之一,但对具体的标准还没有相关规定。
在探究不同贮存条件下蜂王浆蛋白质成分变化时,CHEN等[16]提出蜂王浆在贮藏过程中产生了美拉德反应,导致蜂王浆颜色褐变,整体品质下降。但并没有深入研究美拉德反应过程中产生的物质。此后,为了验证糠氨酸作为蜂王浆新鲜度评价指标的可行性,将商品蜂王浆和新鲜蜂王浆在4 ℃和室温下条件下分别贮存3、6和10个月后进行糠氨酸含量分析。HPLC分析发现,样品经4 ℃条件下贮存10个月后,糠氨酸含量增加得很少,而室温条件下贮存10个月的蜂王浆样品中糠氨酸含量的增加非常显著。新鲜蜂王浆中糠氨酸的含量很低,但随着贮存时间延长和温度的升高,样品中糠氨酸的含量随之增加[26]。将大批量蜂王浆(55种法国蜂王浆和27种商品蜂王浆),贮存在-18 ℃和2~5 ℃条件下9个月后,检测糠氨酸含量,发现在-18 ℃条件下贮存9个月的蜂王浆样品中,糠氨酸的含量保持稳定。在2~5 ℃条件下贮存9个月的蜂王浆样品中糠氨酸的含量比新鲜蜂王浆有轻微增加。而在商品蜂王浆中糠氨酸的含量显著高于新鲜蜂王浆。因此,糠氨酸含量是评价室温贮存条件下蜂王浆新鲜度的良好指标。
1.3.2 5-羟基糠醛
5-HMF是美拉德反应的另一产物,是美拉德反应的中级和高级阶段的标志物[54],食物中过量的5-HMF 可能对人体造成负面影响[55],如对眼睛、上呼吸道和皮肤有潜在刺激性作用,并具有一定的肝毒性和肾毒性[56]。5-HMF的含量一般用于评价食物贮存过程中热处理的严重程度[57],且5-HMF的检测技术在蜂蜜质量评价的研究中已有比较成熟的应用[58],但与蜂王浆相关的研究相对较少。
通过对5-HMF作为蜂王浆新鲜度指标的适用性进行研究,采用先期建立的RP-HPLC法[39]监测了-18、4和25 ℃条件下贮存9个月内的蜂王浆样品中的5-HMF含量变化过程。发现在9个月的周期内,-18 ℃和4 ℃条件下贮存的蜂王浆样品的5-HMF含量非常低,无法用该方法检测到。而在25 ℃条件下贮存的蜂王样品内,其5-HMF的含量随时间的延长呈指数性的增长[24]。这一结论支持了他们的设想,5-HMF含量是判断合格的蜂王浆新鲜度指标。此外,采用HPLC法对室温、4、-20和-80 ℃条件下贮存15、45、65和80 d的蜂王浆样品中的5-HMF含量变化进行分析,结果表明,新鲜蜂王浆中无法检测出5-HMF,但在80 d的周期内,所有温度条件下均检出了5-HMF,其含量随着贮存温度升高和时间延长逐渐增加,且贮存温度越高,增速越快[22]。同年,魏月等[23]对于-18、4、16 ℃和 25 ℃条件下贮存1、3、6、9和12 个月的蜂王浆样品中糠醛类物质含量的变化进行研究,得出了相似的结论,认为5-HMF含量是一种可靠的蜂王浆新鲜度评级指标,并设定5-HMF检出量为150 μg/kg 为蜂王浆新鲜度的阈值。
1.3.3 Nε-羧甲基赖氨酸
CML是美拉德反应晚期糖基化终产物的标志物之一,此产物在食品中的过量积累通常会导致食品质量的变化。过量的CML可导致糖尿病、尿毒症和阿尔兹海默症等疾病的发生,对人体健康造成影响[40]。
为研究蜂王浆贮存过程中涉及的非酶褐变现象,QIAO等[40]使用CML的ELISA试剂盒对在室温条件(约25 ℃)下贮存了1、2、3、4、5和6个月的蜂王浆样品中CML的含量进行了测定。结果显示,新鲜蜂王浆中含有少量CML(约50 ng/g),室温贮存6个月期间,CML含量持续增加,并在6个月时达到新鲜蜂王浆的7倍(约350 ng/g),说明蜂王浆中CML的含量与其新鲜度有关。目前,食品中CML含量的检测通常使用商用的ELISA试剂盒,该方法具有操作简单、灵敏度高和特异性强等优点,因此建议将CML作为蜂王浆新鲜度的潜在指标。
1.4 三磷酸腺苷
ATP是细胞中的一种高能磷酸化合物,在机体内起到辅酶的作用,其降解程度被定义为K值,K值在数值上等于HxR,Hx之和与ATP、ADP、AMP、IMP、HxR与Hx之和的比值[59]。K值作为一种新鲜度评价指标被广泛地应用于海鲜[60]以及鸡肉产品[61]的研究中。
WU等[29]建立了一种以F值为评价标准的蜂王浆新鲜度评价体系。F值的定义为Ao、Ai、HxR和Hx之和与ATP、ADP、AMP、IMP、HxR、Hx、Ao和Ai之和的比值。实验采用HPLC法测定了在-18、4 ℃和室温条件下贮存了0、7、14、21、28、35、42、57和98 d时,蜂王浆样品中糠氨酸的含量及8种ATP相关化合物的含量。结果显示,在-18 ℃条件下贮存时,样品中8种化合物的含量没有明显变化,即F值无明显变化。在4 ℃贮存条件下,样品中ATP代谢产物的含量随贮存时间延长而增加,F值随之降低。在室温贮存条件下,样品中ATP代谢产物含量增加的速率显著高于4 ℃,F值降低速度更快。对比相同温度下蜂王浆F值与糠氨酸含量的相关曲线,2个指标显示出良好的线性关系,说明F值能够反映样品中糠氨酸的含量,因此其能够作为蜂王浆新鲜度指标。规定F值=20%为蜂王浆新鲜度的阈值,若F值>20%则认为蜂王浆不新鲜。
1.5 游离氨基酸
新鲜蜂王浆中有20种以上的游离氨基酸成分,其中脯氨酸、赖氨酸、谷氨酸、苯丙氨酸、天冬氨酸和丝氨酸的含量较为丰富,是蜂王浆的重要组成部分[62-63]。随着蜂王浆贮存时间延长和温度的升高,游离氨基酸含量发生变化,但不同氨基酸含量变化的程度不同[15]。
为了研究游离氨基酸在蜂王浆贮存过程中的变化与蜂王浆新鲜度的相关性,将在室温和4 ℃条件下贮存了3、6和10个月的蜂王浆样品,采用GC-MS分析了游离氨基酸的含量,发现在4 ℃条件下,样品中游离氨基酸的含量保持恒定。在室温条件下贮存3个月时,脯氨酸和赖氨酸含量上升,6个月和10个月时下降。根据这些实验结果可以判断出,蜂王浆贮存过程中游离氨基酸的含量变化不稳定,因此不是合适的蜂王浆新鲜度指标[30]。进一步采用UPLC测定在-18、4和25 ℃条件下贮存了1、3、6和10个月的蜂王浆样品,26种游离氨基酸的含量结果表明,大部分游离氨基酸的含量(主要为脯氨酸,谷氨酰胺和赖氨酸)在贮存过程中没有发生显著变化,但游离谷氨酰胺和总蛋氨酸含量持续下降,其可能具有作为评价蜂王浆新鲜度指标的潜力[41]。
1.6 酶类物质
1.6.1 葡萄糖氧化酶
GOD是一种重要的氧化还原酶,在生物体内催化葡萄糖转化为葡萄糖酸,同时催化NADP转化为NADPH[64],具有抗氧化和抗菌活性[65]。将在27~30、0~5、-18和-33 ℃条件下贮存了8、17、35和55 d的蜂王浆,采用过氧化物酶活力偶联测试法检测GOD的活力。发现随着贮存时间的延长,样品中GOD的活力随之下降。但在-18 ℃和-33 ℃条件下,GOD活力下降速度比较缓慢,0~5 ℃条件下相对更快,在贮存55 d后GOD活力下降了38.54%。但27~30 ℃条件下下降速度很快,并在贮存55 d后GOD活力下降了97.48%[28]。进一步将蜂王浆在冷藏条件(4 ℃)贮存1年后,GOD活力显著下降,而在冷冻条件下(-18 ℃)变化不明显[66]。因此,认为GOD活力可以作为蜂王浆在冷藏或冷冻条件下长期贮存的新鲜度评价指标,并指出蜂王浆更适合在冷冻条件下贮存。
1.6.2 超氧化物歧化酶
SOD是一种能够催化生物体内氧自由基清除反应的金属酶[67],是蜂王浆中重要的具有抗氧化活性的成分[68],也是蜂王浆具有医疗保健功能的证明。袁耀东等[69]首次报道了蜂王浆中含有SOD。此后,陆续有学者对蜂王浆中SOD活力进行研究。采用邻苯三酚法测定冷冻条件下蜂王浆中SOD活力,发现SOD活力在6 d的时间内持续下降,于第6天完全消失[42]。采用黄嘌呤氧化酶法测定在4 ℃和25 ℃条件下贮存了2、4、6和8 d的蜂王浆中SOD的相对酶活力。结果显示,在4 ℃条件下贮存8 d时,样品蜂王浆中SOD的相对酶活力接近于0%。在25 ℃条件下贮存4 d时,样品蜂王浆中SOD的相对酶活力接近于0%。表明SOD对环境条件的变化非常敏感,随着贮存时间延长和温度的升高,蜂王浆中SOD的相对酶活力逐渐下降,且下降速率非常快。在SOD完全失活的情况下,蜂王浆中的许多活性成分并未完全失活[27]。因此,SOD活力不适合用于评价长期贮存条件下的蜂王浆品质,但似乎可以作为一个短期评价指标。
1.6.3 过氧化物酶与谷胱甘肽转移酶
过氧化物酶(peroxidase,PRDX)是一类具有去除过氧化物功能的酶,其广泛分布在生物体内,可维持细胞内活性氧稳态,参与了生物体内对炎症,癌变等过程的细胞保护[70]。谷胱甘肽转移酶(glutathione S-transferase,GST S1)是生物体内负责调节应激诱导信号通路的一类关键抗氧化酶,其生物学功能复杂并具有多面性,对维持细胞稳态有重要意义[71]。蛋白质组学技术的出现,使得新鲜蜂王浆中的PRDX和GST S1出现在大众视野。通过2D-PAGE结合凝胶色谱分析了贮存过程中蜂王浆中蛋白组分的变化,发现在新鲜蜂王浆中能够检测到PRDX和GST S1的斑点。在-20 ℃条件下贮存一年后,PRDX和GST S1的含量变化不明显。在4 ℃条件下,PRDX和GST S1的含量显著低于-20 ℃条件下。而在室温条件下,已经不能检测到PRDX和GST S1的斑点[18]。因此,表明PRDX和GST S1可能作为蜂王浆新鲜度评价的参考。
1.7 其他指标
1.7.1 黏度和色度
新鲜蜂王浆的黏度约为2 060 cP,呈乳白色、淡黄色或浅橙色,将新鲜蜂王浆置于-20、4 ℃和室温条件下,分别贮存1、3、5和7个月后,随着贮存时间的延长,蜂王浆的黏度也随之增加。在-20 ℃条件下蜂王浆黏度变化不明显,在贮存7个月时黏度为2 300 cP。在4 ℃条件下,蜂王浆黏度增加速度比较缓慢,在贮存7个月时黏度为3 630 cP。但在室温条件下,蜂王浆黏度的增加速度非常快,以至于在贮存一个月后,样品蜂王浆的黏度就超过了黏度计的检测上限(5 000 cP)。表明蜂王浆的黏度是标注蜂王浆贮存稳定性的一个敏感指标。同时,随着贮存时间的延长,蜂王浆颜色逐渐加深。吸光度检测结果显示,在-20 ℃和4 ℃条件,蜂王浆的颜色变化不明显。但在室温条件下,蜂王浆的颜色迅速加深,并在贮存2个月时接近峰值。同样在室温条件下,将蜂王浆样品与三氯乙酸混合,去除掉样品中的蛋白质后,样品吸光度下降到接近零,表明蜂王浆色度的变化与蛋白质组分变化有紧密的联系,可能与蜂王浆的新鲜度有关[43]。基于此现象,ZHENG等[43]在蜂王浆中加入盐酸产生显色反应,且不同贮存条件下保存的蜂王浆产生显色反应的结果不同,进而建立了一种比色法检测蜂王浆新鲜度的的方法。在室温下贮存一周以后的蜂王浆,其显色反应的结果与新鲜蜂王浆显著不同,通过色度计检测其透光率,得到的数值可以用于区分不同新鲜度的蜂王浆。但蜂王浆在这个过程中产生的化学反应尚未可知,可能与色氨酸的参与有关。盐酸显色法具有操作简单、成本低廉、反应迅速等优点。
1.7.2 维生素B5
维生素B5是蜂王浆中含量最丰富的维生素,是蜂王浆抗衰老功能的主要活性因子[8]。PEARSON等[72]首次报道了维生素B5在蜂王浆中的含量。罗才琼等[73]发现蜂王浆中维生素B5保存率随贮存时间延长而降低。将蜂王浆在10 ℃条件下贮存 21 d后,期间采用HPLC方法测定蜂王浆样品中维生素B5的含量。发现随着贮存时间的延长,蜂王浆样品中的维生素B5含量由约2.2 mg/100 g降至0.5 mg/100 g。因此,在短期贮存时间内,维生素B5保存率可以用于评价蜂王浆的新鲜度,且规定阈值为70%~75%,若蜂王浆中的维生素B5保存率低于70%~75%,则该蜂王浆不新鲜[44]。
1.7.3 挥发性物质
蜂王浆中含有丰富的挥发性物质,各种挥发性物质在贮存过程中的含量变化共同促进了蜂王浆的风味变化,进而影响了蜂王浆的品质。ISIDOROV等[74]通过顶空固相微萃取气相色谱-质谱技术(headspace solid-phase micro-extraction gas chromatography-mass spectrometry,HS-SPME-GC/MS),首次在蜂王浆中鉴定出25种挥发性物质,包括酸类,酮类和酯类等。
通过HS-SPME-GC/MS技术结合电子舌和电子鼻技术对导致蜂王浆风味变化的影响因素进行分析,在蜂王浆样品中鉴定出共37种挥发性化合物,并测定了样品在4 ℃和25 ℃条件下贮存了7、14、21和30 d 后挥发性化合物的含量变化。其中,辛酸在所有的挥发性化合物中含量最高,在4 ℃和25 ℃贮存21 d后辛酸含量分别比对照组增加了14%和17.5%,达44.10%和47.61%。而另一种化合物2-庚酮在样品中的含量表现为下降趋势,在4 ℃和25 ℃贮存21 d 后其含量比对照组分别降低了了10%和12%,达9.98%和7.74%。其余挥发性物质如醛类、酚类的含量也随着贮存时间延长和温度的升高而逐渐下降[75]。另外,蜂王浆中还存在许多含量较低的挥发性物质,由于技术限制,无法定量,要进一步阐明某种挥发性物质对蜂王浆风味变化的贡献,还需要对不同挥发性物质的阈值进行更深入的研究。通过衰减全反射傅里叶变换中红外光谱技术(attenuated total reflection Fourier transform mid-infrared spectroscopy,ATR-FT-MIR)对在冷冻和28 ℃(环境温度)条件下存放30 d的蜂王浆样品中的成分变化进行分析,图谱结果显示,在28 ℃条件下贮存的蜂王浆样品中,酚类化合物(波段1 600~1 500 cm-1)的含量显著下降[76]。总的来说,蜂王浆的贮存温度和时间是影响其挥发性物质含量的重要因素,这一发现可能对蜂王浆新鲜度研究具有一定指示意义。
2 蜂王浆新鲜度潜在指标的检测方法
2.1 王浆主蛋白
MRJP1、MRJP4和MRJP5被认为是蜂王浆新鲜度的潜在指标,许多研究者试图建立准确度高、可操作性强的检测方法,主要包括ELISA、UPLC-MS/MS、UPLC-TQMS和胶体金法。
MRJP1被广泛认为是蜂王浆新鲜度的良好指标,通过蛋白序列中的特异性肽段构建针对MRJP1的ELISA检测方法具有重要的实践意义。通过对比MRJP1-9的423个氨基酸序列,在MRJP1的氨基酸序列上找到了4个高特异性的肽段序列,用于培育anti-SP-MRJP1抗体,这种抗体具有高灵敏度,能与蜂王浆中MRJP1特异性结合,与B LIKOV
LIKOV 等[77]提出的r-MRJP1抗体相比,表现出了更高的结合活性。利用该抗体进行ELISA实验可以准确检测出MRJP1在蜂王浆贮存过程中的降解情况。SDS-PAGE和ELISA实验结果均显示,在40 ℃贮存条件下,蜂王浆样品中的MRJP1含量随贮存时间延长而线性降低,验证了该ELISA方法用于测量MRJP1含量的可靠性[31]。此外,LIN等[32]建立了基于特征性多肽和同位素标记的内标肽的UPLC-MS/MS方法用于检测蜂王浆中的MRJP1。对蜂王浆样品做胰蛋白酶处理,并对处理得到的多肽片段进行稳定性、分子量和含量分析,筛选出3条符合条件的多肽。进一步分析,筛选出1条信号强度最高的特征性多肽可用于标志MRJP1。该方法选择了C13和N15标记的特征性多肽作为内标,能够降低LC-MS/MS分析过程中的电离效率变异性。使用该方法定量检测蜂王浆中的MRJP1具有高灵敏度,高精密度和高回收率等优点。
等[77]提出的r-MRJP1抗体相比,表现出了更高的结合活性。利用该抗体进行ELISA实验可以准确检测出MRJP1在蜂王浆贮存过程中的降解情况。SDS-PAGE和ELISA实验结果均显示,在40 ℃贮存条件下,蜂王浆样品中的MRJP1含量随贮存时间延长而线性降低,验证了该ELISA方法用于测量MRJP1含量的可靠性[31]。此外,LIN等[32]建立了基于特征性多肽和同位素标记的内标肽的UPLC-MS/MS方法用于检测蜂王浆中的MRJP1。对蜂王浆样品做胰蛋白酶处理,并对处理得到的多肽片段进行稳定性、分子量和含量分析,筛选出3条符合条件的多肽。进一步分析,筛选出1条信号强度最高的特征性多肽可用于标志MRJP1。该方法选择了C13和N15标记的特征性多肽作为内标,能够降低LC-MS/MS分析过程中的电离效率变异性。使用该方法定量检测蜂王浆中的MRJP1具有高灵敏度,高精密度和高回收率等优点。
MRJP1-3是MRJPs家族中含量最高,性质最稳定的成分,采用UPLC-TQMS技术对蜂王浆中的MRJPs多肽进行定量分析,检测到69条多肽片段。通过对比69条多肽片段所需的酶解时间、酶解后稳定性以及质谱检测响应值,从中筛选出稳定性,易酶解性和特异性较好的3条多肽片段作为MRJP1-3标志性多肽,使用UPLC-TQMS作为检测手段测定其在蜂王浆中的含量。此检测方法采用C18 蛋白分析柱(2.1 mm×100 mm,1.7 μm),以0.1%甲酸溶液为A相,0.1%甲酸-乙腈溶液作为B相。采用配备电喷雾离子源的Xevo-TQD三重四极杆质谱仪进行数据采集。该方法特异性高,能够精确检测蜂王浆新鲜度[34]。
以MRJP4作为蜂王浆潜在新鲜度指标,Hu等[33]制备了MRJP4的高特异性高克隆抗体8C9,建立了一种胶体金法试剂盒用于检测蜂王浆中的MRJP4。该方法使用的胶体金免疫检测条由含有检测线(T线)和对照线(C线)的硝化纤维膜、金胶体垫、样品垫、吸收垫和衬底板构成。其中T线由单克隆抗体8C9构成,C线由山羊抗鼠IgG抗体构成。将稀释后的蜂王浆样品液滴入试剂盒中,若溶液中含有一定量的MRJP4,则T线呈现出紫红色。这种方法能够直观判断出蜂王浆的新鲜度情况,具有样品用量少、操作简单、检测迅速和成本低等特点。
2.2 糠氨酸
糠氨酸是受到广泛关注的蜂王浆新鲜度评价指标之一,其检测技术的应用为糠氨酸作为检测指标提供了坚实的理论基础[26]。现有检测糠氨酸的方法主要为LC-MS。WYTRYCHOWSKI等[25]开发了LC-MS技术检测糠氨酸的方法,质谱分析对糠氨酸具有较强的针对性,可以避免蜂王浆中糠氨酸的基质干扰,因此省略了传统HPLC分析所需的固相萃取纯化这一前处理步骤,缩短了样品前处理所需要的时间。该方法的检出限低,灵敏度高,适用于蜂王浆中糠氨酸的检测。通过RP-IPC测定蜂王浆中糠氨酸含量,使用浓度为10.6 mol/L的盐酸对蜂王浆样品进行处理,结果的平均回收率为96.64%。采用Atlantis C18(4.6 mm×250 mm,5 μm)色谱柱对样品液进行洗脱和分离,从进样到完成分析的时间仅为10 min。该方法相对简单,快速,重复性好,这一将RP-IPC运用在蜂王浆上的策略,可为检测蜂王浆中的糠氨酸含量提供新思路[38]。
2.3 5-羟基糠醛
在较早的蜂王浆与5-HMF相关研究中,5-HMF是影响蜂王浆品质的一种重要指标,主要的检测方法为HPLC技术。为了全面评价蜂王浆品质,吴黎明等[37]建立了用HPLC技术测定蜂王浆中5-HMF含量的方法。为了排除蛋白质对糠氨酸检测的干扰,选择乙酸锌和亚铁氰化钾溶液作为蛋白质沉淀剂,该法选择的沉淀剂可以减少蛋白沉淀过程中的糠氨酸降解,具有较高回收率(87.2%~93.1%)。CIULU等[39]建立了一种通过RP-HPLC技术测定蜂王浆样品中HMF含量的方法,该法参考了CH VEZ-SERV
VEZ-SERV N等[78]提出的用于检测牛奶中HMF含量的方法。在样品预处理阶段,改变了原方法在去除蛋白质干扰时三氯乙酸的使用量,并省略了草酸处理。该法的检出限低,回收率高(98±2)%,线性度良好(R2=0.999 9)。使用该法检测了25个分别贮存在4 ℃、室温条件下以及新鲜蜂王浆样品中的5-HMF含量。结果显示,25 ℃下贮存的蜂王浆中5-HMF含量最高,而新鲜蜂王浆和4 ℃下贮存的蜂王浆中5-HMF含量均低于最低检出限,无法检出。因此,该方法仅适用于测定室温贮存条件下蜂王浆中HMF的含量变化。
N等[78]提出的用于检测牛奶中HMF含量的方法。在样品预处理阶段,改变了原方法在去除蛋白质干扰时三氯乙酸的使用量,并省略了草酸处理。该法的检出限低,回收率高(98±2)%,线性度良好(R2=0.999 9)。使用该法检测了25个分别贮存在4 ℃、室温条件下以及新鲜蜂王浆样品中的5-HMF含量。结果显示,25 ℃下贮存的蜂王浆中5-HMF含量最高,而新鲜蜂王浆和4 ℃下贮存的蜂王浆中5-HMF含量均低于最低检出限,无法检出。因此,该方法仅适用于测定室温贮存条件下蜂王浆中HMF的含量变化。
3 总结与展望
蜂王浆新鲜度是衡量蜂王浆品质的重要指标,但现行的蜂王浆国家标准缺乏蜂王浆新鲜度的评价指标,无法全面评价蜂王浆品质。因此,蜂王浆新鲜度的深入研究对推动蜂王浆品质评价体系的完善,促进蜂产品行业健康发展具有重要的意义。
合适的蜂王浆新鲜度评价指标应满足以下几个条件:a)评价指标在蜂王浆中的含量和活性,与贮存温度及贮存时间有合适的相关度;b)评价指标不因蜂王浆产地、季节和蜂群等的变化而有显著变化,在新鲜蜂王浆样品中的含量有较好的稳定性;c)检测方法尽量简单易行[79]。
蜂王浆评价指标及其检测方法的研究可尝试在以下几个方面突破:a)单一指标用于评价食品质量具有局限性,要想全面评价蜂王浆新鲜度,可尝试建立多元化指标的评价方法。b)美拉德反应产物如糠氨酸、5-HMF和CML的含量作为食品加工的评价指标,已被广泛地应用于该领域的研究。其中,糠氨酸含量已被蜂王浆国际标准(ISO 12824:2016)纳入质量评价指标之一,但其作为蜂王浆新鲜度的潜在评价指标尚未有具体的标准,需要进一步研究。c)王浆主蛋白是蜂王浆中最受关注的活性成分,也是研究最为广泛的成分,其作为蜂王浆新鲜度的检测指标具有较大优势,但现有的研究大多只关注王浆主蛋白的含量变化,而未能阐明其在贮存过程中的活性及降解产物的变化情况,以及引起王浆主蛋白变化的结构和功能机制并不明确。因此,系统阐明蜂王浆在贮存过程中的变化规律,在找到可以准确反映新鲜度评价指标的基础上阐明其形成机制,将为蜂王浆新鲜度评价提供坚实的理论基础。
[1] KAMAKURA M.Royalactin induces queen differentiation in honeybees[J].Nature,2011,473(7348):478-483.
[2] KUREK-G RECKA A,G
RECKA A,G RECKI M,RZEPECKA-STOJKO A,et al.Bee products in dermatology and skin care[J].Molecules,2020,25(3):556.
RECKI M,RZEPECKA-STOJKO A,et al.Bee products in dermatology and skin care[J].Molecules,2020,25(3):556.
[3] KOSEDAG M,GULABOGLU M.Pollen and bee bread expressed highest anti-inflammatory activities among bee products in chronic inflammation:An experimental study with cotton pellet granuloma in rats[J].Inflammopharmacology,2023,31(4):1967-1975.
[4] SCHUH C M A P,AGUAYO S,ZAVALA G,et al.Exosome-like vesicles in Apis mellifera bee pollen,honey and royal jelly contribute to their antibacterial and pro-regenerative activity[J].Journal of Experimental Biology,2019,222(Pt 20):jeb208702.
[5] PARK M J,KIM B Y,PARK H G,et al.Major royal jelly protein 2 acts as an antimicrobial agent and antioxidant in royal jelly[J].Journal of Asia-Pacific Entomology,2019,22(3):684-689.
[6] LIMA W G,BRITO J C M,DA CRUZ NIZER W S.Bee products as a source of promising therapeutic and chemoprophylaxis strategies against COVID-19 (SARS-CoV-2)[J].Phytotherapy Research,2021,35(2):743-750.
[7] ASMA S T,BOBI O,BONTA V,et al.General nutritional profile of bee products and their potential antiviral properties against mammalian viruses[J].Nutrients,2022,14(17):3579.
O,BONTA V,et al.General nutritional profile of bee products and their potential antiviral properties against mammalian viruses[J].Nutrients,2022,14(17):3579.
[8] KUNUGI H,MOHAMMED ALI A.Royal jelly and its components promote healthy aging and longevity:From animal models to humans[J].International Journal of Molecular Sciences,2019,20(19):4662.
[9] SAAD AL SHEHRI Z,ALANAZI A D,ALNOMASY S F.Anti-cancer effects of queen bee acid (10-hydroxy-2-decenoic acid) and its cellular mechanisms against human hepatoma cells[J].Molecules,2023,28(4):1972.
[10] ABU-SERIE M M,HABASHY N H.Suppressing crucial oncogenes of leukemia initiator cells by major royal jelly protein 2 for mediating apoptosis in myeloid and lymphoid leukemia cells[J].Food &Function,2022,13(17):8951-8966.
[11] BOTEZAN S,BACI G M,BAGAMERI L,et al.Current status of the bioactive properties of royal jelly:A comprehensive review with a focus on its anticancer,anti-inflammatory,and antioxidant effects[J].Molecules,2023,28(3):1510.
[12] HOSSEN M S,NAHAR T,GAN S H,et al.Bioinformatics and therapeutic insights on proteins in royal jelly[J].Current Proteomics,2019,16(2):84-101.
[13] 海关统计数据在线查询平台.[EB/OL].[2023-10-17].http://stats.customs.gov.cn.
[14] 刘一冰,吴德群,蔺哲广,等.蜂王浆生物学功能研究进展[J].畜牧兽医学报,2021,52(6):1498-1510.LIU Y B,WU D Q,LIN Z G,et al.Review on biological function of royal jelly[J].Acta Veterinaria et Zootechnica Sinica,2021,52(6):1498-1510.
[15] MAGHSOUDLOU A,MAHOONAK A S,MOHEBODINI H,et al.Royal jelly:Chemistry,storage and bioactivities[J].Journal of Apicultural Science,2019,63(1):17-40.
[16] CHEN C,CHEN S Y.Changes in protein components and storage stability of Royal Jelly under various conditions[J].Food Chemistry,1995,54(2):195-200.
[17] HU F L,B LIKOV
LIKOV K,CASABIANCA H,et al.Standard methods for Apis mellifera royal jelly research[J].Journal of Apicultural Research,2019,58(2):1-68.
K,CASABIANCA H,et al.Standard methods for Apis mellifera royal jelly research[J].Journal of Apicultural Research,2019,58(2):1-68.
[18] LI J K,FENG M,ZHANG L,et al.Proteomics analysis of major royal jelly protein changes under different storage conditions[J].Journal of Proteome Research,2008,7(8):3339-3353.
[19] LI J K,WANG T,PENG W J.Comparative analysis of the effects of different storage conditions on major royal jelly proteins[J].Journal of Apicultural Research,2007,46(2):73-80.
[20] KAMAKURA M,SUENOBU N,FUKUSHIMA M.Fifty-seven-kDa protein in royal jelly enhances proliferation of primary cultured rat hepatocytes and increases albumin production in the absence of serum[J].Biochemical and Biophysical Research Communications,2001,282(4):865-874.
[21] KAMAKURA M,FUKUDA T,FUKUSHIMA M,et al.Storage-dependent degradation of 57-kDa protein in royal jelly:A possible marker for freshness[J].Bioscience,Biotechnology,and Biochemistry,2001,65(2):277-284.
[22] 王露露,董蕊,范超,等.蜂王浆在贮藏过程中5-羟甲基糠醛、10-羟基-2-癸烯酸及精氨酸双糖苷含量的变化[J].食品科学,2016,37(2):271-275.WANG L L,DONG R,FAN C,et al.Changes in the contents of 5-HMF,10-HDA and AFG in royal jelly during storage[J].Food Science,2016,37(2):271-275.
[23] 魏月,陈芳,薛晓锋,等.蜂王浆贮存过程中糠醛类物质含量的变化[J].中国食品学报,2016,16(10):222-227.WEI Y,CHEN F,XUE X F,et al.The change of furfu ral compounds contents of royal jelly during storage[J].Journal of Chinese Institute of Food Science and Technology,2016,16(10):222-227.
[24] CIULU M,FLORIS I,NURCHI V M,et al.A possible freshness marker for royal jelly:Formation of 5-hydroxymethyl-2-furaldehyde as a function of storage temperature and time[J].Journal of Agricultural and Food Chemistry,2015,63(16):4190-4195.
[25] WYTRYCHOWSKI M,PAÏSSÉ J O,CASABIANCA H,et al.Assessment of royal jelly freshness by HILIC LC-MS determination of furosine[J].Industrial Crops and Products,2014,62:313-317.
[26] MARCONI E,CABONI M F,MESSIA M C,et al.Furosine:A suitable marker for assessing the freshness of royal jelly[J].Journal of Agricultural and Food Chemistry,2002,50(10):2825-2829.
[27] 杨焱,胡九菊,李林霖,等.蜂王浆中超氧化物歧化酶的活性测定与应用[J].食品研究与开发,2022,43(1):180-185.YANG Y,HU J J,LI L L,et al.Determination of superoxide dismutase activity and its application in royal jelly[J].Food Research and Development,2022,43(1):180-185.
[28] 吴粹文,张复兴.贮存温度和时间对蜂王浆中葡萄糖氧化酶(GOD)活性影响的研究[J].中国养蜂,1990,41(5):4-6.WU C W,ZHANG F X.Effects of storage temperature and time on the activity of glucose oxidase (GOD) in royal jelly[J].Apiculture of China,1990,41(5):4-6.
[29] WU L M,WEI Y,DU B,et al.Freshness determination of royal jelly by analyzing decomposition products of adenosine triphosphate[J].LWT-Food Science and Technology,2015,63(1):504-510.
[30] BOSELLI E,CABONI M F,SABATINI A G,et al.Determination and changes of free amino acidsin royal jelly during storage[J].Apidologie,2003,34(2):129-137.
[31] SHEN L R,WANG Y R,ZHAI L,et al.Determination of royal jelly freshness by ELISA with a highly specific anti-apalbumin 1,major royal jelly protein 1 antibody[J].Journal of Zhejiang University.Science.B,2015,16(2):155-166.
[32] LIN N,CHEN S,ZHANG H,et al.Quantification of major royal jelly protein 1 in fresh royal jelly by ultraperformance liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,2018,66(5):1270-1278.
[33] HU H,WEI Q,SUN Z,et al.Development of a freshness assay for royal jelly based on the temperature-and time-dependent changes of antimicrobial effectiveness and proteome dynamics of royal jelly proteins[J].J Agric Food Chemistry,2021,69(36):10731-1740.
[34] 陈勇,江唯健,王加俊,等.超高效液相色谱-串联质谱法定量检测蜂王浆主蛋白1~3[J].浙江大学学报(农业与生命科学版),2022,48(6):776-786.CHEN Y,JIANG W J,WANG J J,et al.Quantitative detection of major royal jelly proteins 1-3 by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Zhejiang University (Agriculture and Life Sciences),2022,48(6):776-786.
[35] 吴黎明,周群,赵静,等.FTIR光谱法整体评价蜂王浆新鲜度的研究[J].光谱学与光谱分析,2009,29(12):3236-3240.WU L M,ZHOU Q,ZHAO J,et al.Research on overall assessment of royal jelly freshness by FTIR spectroscopy[J].Spectroscopy and Spectral Analysis,2009,29(12):3236-3240.
[36] 吴亚君,刘鸣畅,赵方圆,等.采用毛细管凝胶电泳技术检测蜂王浆新鲜度[J].食品与发酵工业,2013,39(4):161-166.WU Y J,LIU M C,ZHAO F Y,et al.The detection of royal jelly freshness by capillary gel electrophoresis[J].Food and Fermentation Industries,2013,39(4):161-166.
[37] 吴黎明,田文礼,薛晓锋,等.高效液相色谱法测定蜂王浆中羟甲基糠醛含量[J].食品科学,2008,29(3):412-414.WU L M,TIAN W L,XUE X F,et al.Determination of hydroxymethylfurfural contents in royal jelly by high performance liquid chromatography[J].Food Science,2008,29(3):412-414.
[38] 周骁,薛晓锋,吴黎明,等.反相离子对色谱法测定蜂王浆中糠氨酸的含量[J].食品科学,2008,29(5):370-372.ZHOU X,XUE X F,WU L M,et al.Determination of furosine in royal jelly by ion-pair reversed phase liquid chromatography[J].Food Science,2008,29(5):370-372.
[39] CIULU M,FARRE R,FLORIS I,et al.Determination of 5-hydroxymethyl-2-furaldehyde in royal jelly by a rapid reversed phase HPLC method[J].Analytical Methods,2013,5(19):5010-5013.
[40] QIAO J T,WANG X Y,LIU L Q,et al.Nonenzymatic browning and protein aggregation in royal jelly during room-temperature storage[J].Journal of Agricultural and Food Chemistry,2018,66(8):1881-1888.
[41] WU L M,ZHOU J H,XUE X F,et al.Fast determination of 26 amino acids and their content changes in royal jelly during storage using ultra-performance liquid chromatography[J].Journal of Food Composition and Analysis,2009,22(3):242-249.
[42] 张映,姜玉锁,牛建英.蜂王浆中超氧化物歧化酶活力测定[J].山西农业大学学报,1996,16(3):267-268; 324-325.ZHANG Y,JIANG Y S,NIU J Y.Activity test on sod in fresh royal jelly[J].Journal of Shanxi Agricultural University,1996,16(3):267-268; 324-325.
[43] ZHENG H Q,WEI W T,WU L M,et al.Fast determination of royal jelly freshness by a chromogenic reaction[J].Journal of Food Science,2012,77(6):S247-S252.
[44] 易倩,俞彦波,罗雪雅,等.蜂王浆色泽与新鲜度关联研究[J].食品工业科技,2011,32(11):171-173.YI Q,YU Y B,LUO X Y,et al.Study on the association of color and freshness of royal jelly[J].Science and Technology of Food Industry,2011,32(11):171-173.
[45] TIAN W L,LI M,GUO H Y,et al.Architecture of the native major royal jelly protein 1 oligomer[J].Nature Communications,2018,9(1):3373.
[46] 吴黎明.蜂王浆新鲜度指标和评价方法研究[D].杭州:浙江大学,2008:110-125.WU L M.Study on the freshness index and evaluation method of royal jelly[D].Hangzhou:Zhejiang University,2008:110-125.
[47] 郭城,吴卫成,谌迪,等.基于ATR-FTIR结合CARS算法测定蜂王浆中水溶性蛋白质和总糖含量[J].中国食品学报,2021,21(11):183-190.GUO C,WU W C,CHEN D,et al.Determination of water-soluble protein and total sugar in royal jelly based on attenuated total reflection mid-infrared spectroscopy and CARS algorithm[J].Journal of Chinese Institute of Food Science and Technology,2021,21(11):183-190.
[48] SUNDS A V,RAUH V M,SØRENSEN J,et al.Maillard reaction progress in UHT milk during storage at different temperature levels and cycles[J].International Dairy Journal,2018,77:56-64.
[49] SHAKOOR A,ZHANG C P,XIE J C,et al.Maillard reaction chemistry in formation of critical intermediates and flavour compounds and their antioxidant properties[J].Food Chemistry,2022,393:133416.
[50] ERBERSDOBLER H F,SOMOZA V.Forty years of furosine-forty years of using Maillard reaction products as indicators of the nutritional quality of foods[J].Molecular Nutrition &Food Research,2007,51(4):423-430.
[51] 刘娟,高铁俊,董捷,等.蜂王浆室温储存过程中的褐变产物[J].食品科学,2012,33(6):238-241.LIU J,GAO T J,DONG J,et al.Browning products of royal jelly during storage at room temperature[J].Food Science,2012,33(6):238-241.
[52] GÖKMEN V,SERPEN A,MORALES F J.Determination of furosine in thermally processed foods by hydrophilic interaction liquid chromatography[J].Journal of AOAC International,2009,92(5):1460-1463.
[53] AALAEI K,RAYNER M,SJÖHOLM I.Chemical methods and techniques to monitor early Maillard reaction in milk products; A review[J].Critical Reviews in Food Science and Nutrition,2019,59(12):1829-1839.
[54] ALTUNAY N.Experimental design of magnetic ionic liquid ultrasound-assisted dispersive liquid-liquid microextraction for the determination of 5-HMF in honey samples[J].Journal of Food Composition and Analysis,2022,114:104817.
[55] 朱秀清,雷文华,黄雨洋,等.5-羟甲基糠醛在食品中的变化及其安全性研究进展[J].食品安全质量检测学报,2022,13(15):4983-4991.ZHU X Q,LEI W H,HUANG Y Y,et al.Research progress in changes of 5-hydroxymethylfurfural in food and its safety[J].Journal of Food Safety &Quality,2022,13(15):4983-4991.
[56] LEE C H,CHEN K T,LIN J A,et al.Recent advances in processing technology to reduce 5-hydroxymethylfurfural in foods[J].Trends in Food Science &Technology,2019,93:271-280.
[57] SABATER C,MONTILLA A,OVEJERO A,et al.Furosine and HMF determination in prebiotic-supplemented infant formula from Spanish market[J].Journal of Food Composition and Analysis,2018,66:65-73.
[58] BESIR A,YAZICI F,MORTAS M,et al.A novel spectrophotometric method based on Seliwanoff test to determine 5-(hydroxymethyl) furfural (HMF) in honey:Development,in house validation and application[J].LWT,2021,139:110602.
[59] HONG H,REGENSTEIN J M,LUO Y K.The importance of ATP-related compounds for the freshness and flavor of post-mortem fish and shellfish muscle:A review[J].Critical Reviews in Food Science and Nutrition,2017,57(9):1787-1798.
[60] CAMACHO C,CORREIA T,TEIXEIRA B,et al.Nucleotides and free amino acids in sea urchin Paracentrotus lividus gonads:Contributions for freshness and overall taste[J].Food Chemistry,2023,404:134505.
[61] XU N,ZENG X M,LI L Y,et al.Effects of post-mortem aging process on characteristic water-soluble taste-active precursors in yellow-feathered broilers[J].Food Science and Human Wellness,2023,12(1):242-253.
[62] COLLAZO N,CARPENA M,NU EZ-ESTEVEZ B,et al.Health promoting properties of bee royal jelly:Food of the Queens[J].Nutrients,2021,13(2):543.
EZ-ESTEVEZ B,et al.Health promoting properties of bee royal jelly:Food of the Queens[J].Nutrients,2021,13(2):543.
[63] GIAMPIERI F,QUILES J L,CIANCIOSI D,et al.Bee products:An emblematic example of underutilized sources of bioactive compounds[J].Journal of Agricultural and Food Chemistry,2022,70(23):6833-6848.
[64] BAUER J A,Z MOCK
MOCK M,MAJT
M,MAJT N J,et al.Glucose oxidase,an enzyme “ferrari”:Its structure,function,production and properties in the light of various industrial and biotechnological applications[J].Biomolecules,2022,12(3):472.
N J,et al.Glucose oxidase,an enzyme “ferrari”:Its structure,function,production and properties in the light of various industrial and biotechnological applications[J].Biomolecules,2022,12(3):472.
[65] KHATAMI S H,VAKILI O,AHMADI N,et al.Glucose oxidase:Applications,sources,and recombinant production[J].Biotechnology and Applied Biochemistry,2022,69(3):939-950.
[66] SAGONA S,COPPOLA F,GIANNACCINI G,et al.Impact of different storage temperature on the enzymatic activity of Apis mellifera royal jelly[J].Foods,2022,11(20):3165.
[67] KETTLE A J,ASHBY L V,WINTERBOURN C C,et al.Superoxide:The enigmatic chemical chameleon in neutrophil biology[J].Immunological Reviews,2023,314(1):181-196.
[68] ASADI N,KHERADMAND A,GHOLAMI M,et al.Effect of royal jelly on testicular antioxidant enzymes activity,MDA level and spermatogenesis in rat experimental Varicocele model[J].Tissue and Cell,2019,57:70-77.
[69] 袁耀东,何薇莉,陈黎红,等.鲜王浆中超氧化物歧化酶的初步研究[J].中国养蜂,1993,44(5):3-5.YUAN Y D,HE W L,CHEN L H,et al.Preliminary study on SOD(superoxide dismutase)in fresh royal jelly[J].Apiculture of China,1993,44(5):3-5.
[70] LEE Y J.Knockout mouse models for peroxiredoxins[J].Antioxidants,2020,9(2):182.
[71] SINGH R R,REINDL K M.Glutathione S-transferases in cancer[J].Antioxidants,2021,10(5):701.
[72] PEARSON P B,BURGIN C J.The pantothenic acid content of royal jelly[J].Experimental Biology and Medicine,1941,48(2):415-417.
[73] 周才琼,罗雪雅.蜂王浆新鲜度指标筛选及新鲜度的评判[J].食品与发酵工业,2010,36(3):129-132; 140.ZHOU C Q,LUO X Y.Study on freshness index of royal jelly[J].Food and Fermentation Industries,2010,36(3):129-132; 140.
[74] ISIDOROV V A,BAKIER S,GRZECH I.Gas chromatographic-mass spectrometric investigation of volatile and extractable compounds of crude royal jelly[J].Journal of Chromatography B,2012,885:109-116.
[75] CHEN L L,NING F J,ZHAO L,et al.Quality assessment of royal jelly based on physicochemical properties and flavor profiles using HS-SPME-GC/MS combined with electronic nose and electronic tongue analyses[J].Food Chemistry,2023,403:134392.
[76] CHEN D,LU W J,YE Q,et al.HS-GC-IMS and ATR-FT-MIR analysis reveal the differences in volatile compounds,proteins,and polyphenols of royal jelly[J].Advances in Materials Science and Engineering,2022,2022:3223558.
[77] B LIKOV
LIKOV K,SIM
K,SIM TH J.New criterion for evaluation of honey:Quantification of royal jelly protein apalbumin 1 in honey by ELISA[J].Journal of Agricultural and Food Chemistry,2010,58(15):8776-8781.
TH J.New criterion for evaluation of honey:Quantification of royal jelly protein apalbumin 1 in honey by ELISA[J].Journal of Agricultural and Food Chemistry,2010,58(15):8776-8781.
[78] CH VEZ-SERV
VEZ-SERV N J L,CASTELLOTE A I,L
N J L,CASTELLOTE A I,L PEZ-SABATER M C.Evolution of potential and free furfural compounds in milk-based infant formula during storage[J].Food Research International,2006,39(5):536-543.
PEZ-SABATER M C.Evolution of potential and free furfural compounds in milk-based infant formula during storage[J].Food Research International,2006,39(5):536-543.
[79] 郑火青,胡福良,李英华.蜂王浆新鲜度指标的研究进展[J].中国养蜂,2005,56(11):30-31.ZHENG H Q,HU F L,LI Y H.The recent advances in quality index of freshness of royal jelly[J].Apiculture of China,2005,56(11):30-31.