病原微生物种类繁多,在自然界中分布广泛,对人畜有致病性,对人类健康和经济发展造成了巨大威胁。在食品领域,病原微生物是引发食源性疾病的重要诱因,食源性致病菌所导致的食物中毒和食源性疾病是全球食品安全面临的重要挑战,而化学合成的抗菌剂具有潜在的致癌性、致畸性等风险,解决病原微生物造成的食品安全问题是当前重要的研究方向之一。在临床治疗中,抗生素具有快速高效抑杀病原微生物的优势而被广泛应用于各种细菌感染性疾病,但随着抗生素的不合理使用,致病菌的耐药性愈发严重[1]。致病菌耐药性是一种全球性威胁,关系到人类健康和环境安全,全球每年约70万人死于致病菌耐药,若不采取有效措施,预计至2050年将造成约1 000 万人死亡[2]。减少合成抗菌剂、抗生素的使用,应用天然抗菌物质替代合成抗菌剂已迫在眉睫,安全、高效天然抗菌剂的开发显得尤为重要。
目前,植物提取物因其天然、安全、副作用少而被逐渐应用于食品、制药、化工等行业。植物中具有抗菌活性的化合物大多是植物次生代谢产物[3],最丰富的种类包括多糖、酚类、生物碱、萜类等,其化学结构多样,可以通过多种途径发挥抗菌作用,主要抗菌机理包括破坏细胞结构、调控基因表达、抑制细菌代谢活动、改变细胞膜电位等。当前国内外关于植物抗菌物质的研究多集中在物质的抗菌活性方面,但植物抗菌物质种类繁多,机理复杂多样,对于植物抗菌成分构效关系和抗菌机理的研究缺乏系统整理。本文通过对植物中抗菌物质的种类、构效关系、作用机理等方面进行综述,揭示其作用途径,为抗菌剂开发提供参考,为其在食品、医疗、化工中的应用提供理论依据及研究思路。
1 植物中天然抗菌成分种类
1.1 多糖
植物多糖可以从不同类型的植物中提取,如草药、草本植物、木本植物、灌木等,是由一种或几种单糖以一定比例聚合而成的多聚糖,具有免疫调节、抗肿瘤、抗病毒、降血糖、降血脂等生物活性[4]。多糖来源广泛,不同来源的多糖抗菌活性和抗菌谱差异大。例如,草药多糖对革兰氏阳性菌和革兰氏阴性菌均有抗菌活性,而对革兰氏阴性菌的抗菌活性往往比革兰氏阳性菌强。植物多糖抗菌的主要机制是对细菌细胞膜进行吸附而改变细胞膜通透性及阻断细菌必需营养物质进入细胞。天然植物多糖安全、经济、易于获取,可以制备性质稳定的天然抗菌剂。
1.2 多酚
多酚是苯环上连有多个酚羟基的化合物,如黄酮类、单宁类和香豆素类等,由于其结构复杂多样而具有多种生物活性,如抗氧化、抗菌、抗炎等。植物多酚在种子植物中含量丰富,广泛存在于植物的皮、叶、花、根和果实中。多酚在植物中起着重要作用,是保护植物免受寄生虫和病原菌等外来入侵和伤害的重要物质基础[5]。植物多酚化合物抗菌的主要机制是通过破坏细胞壁、细胞膜和影响能量代谢抑制细菌生长。目前,大量研究表明植物多酚的抑菌活性突出且具有较好的安全性,能够作为一种良好的天然保鲜剂,已广泛应用于食品生产贮存保鲜[6]。
1.3 生物碱
天然生物碱是一类具有重要生物活性的碱性含氮有机化合物,根据其不同的化学结构,可分为异喹啉、吡咯、吡啶、喹啉、吲哚等十余种,多数生物碱具有抗癌、抗病毒、抗炎和抗菌等功效作用[7]。生物碱是植物天然成分中抗菌活性最强的物质之一,其复杂的化学结构使抗菌活性呈现更多的可能性,许多生物碱在药物临床实践中获得了较好的疗效,如麻醉镇痛剂、抗癌药物、抗菌药物等。然而,大部分阳离子生物碱如小檗碱、棕榈碱,口服递送受到阻碍,泵介导外排导致其抗菌活性不能完全施展,抗菌效果减弱[8]。天然生物碱抗菌主要机制包括破坏细菌细胞膜,影响DNA合成、转录及表达,并抑制蛋白质合成,对各种细菌包括耐甲氧西林金黄色葡萄球菌均具有潜在抗菌活性。
1.4 萜类
萜类是在精油中发现的主要成分,由异戊二烯或异戊烷单元缩合形成,大多是多环结构[9],大多不溶于水而亲脂性较好。萜类在植物中是从甲羟戊酸或磷酸脱氧纤维素通过甲基赤藓糖醇4-磷酸途径反应而成,此类化合物广泛存在于植物界、昆虫、真菌、海洋生物中,具有抗病毒、抗肿瘤、抗炎、抗菌作用[10]。萜类化合物主要抑菌机制是通过疏水作用破坏细菌细胞膜或与蛋白质结合,影响代谢抑制细菌生长。与其他植物源抗菌成分相比,萜类物质对真菌有更强的抑菌活性。天然萜类化合物具有低毒、抗菌谱广、耐药性低等优点,目前在食品、保健产品、化妆品中均有应用,能起到明显的抗菌效果,但其难溶于水及有特异性气味的特性是目前抗菌应用需要解决的问题。
1.5 其他
抗菌肽是从植物、动物以及微生物中分离得到具有抗菌活性的小分子多肽。抗菌肽具有广泛的抗菌谱,其抗菌机制主要通过带正电荷的抗菌肽直接与带负电荷的细菌细胞膜在静电作用下结合,使膜穿孔造成细菌死亡。部分抗菌肽还具有抑制细胞壁、DNA、RNA和蛋白质合成的胞内损伤作用机制[11]。多肽中氨基酸组成是影响其抗菌活性的重要因素,但对于多肽的构效关系缺乏深入研究,在本文不再对多肽进行过多介绍。脂肪族化合物多存在于植物精油中,具有一定的抗菌活性[12]。它们以直链或带有各种单键或双键的支链化合物的形式存在,这些高度亲脂性的化合物通过破坏细菌膜来发挥作用。除此之外,具有抗菌活性的植物代谢产物还包括神经酰胺类、有机硫及其衍生物、甾体类等。
2 植物中抗菌物质结构与活性的关系
通过植物抗菌物质化学结构与活性关系的研究,可以实现观察物质化学基团的种类、位置和数量来预测其抗菌活性,亦可用于结构修饰以改善化合物的性质或活性。这些研究不仅有助于了解生物活性分子的结构特征,还有助于先导化合物的新抗菌剂的发现。但值得注意的是,对选定的微生物进行抗菌测试时,相同或非常相似基本骨架上的不同结构存在结构与活性的可比性,但差异大的骨架构效活性难以比较。
2.1 多糖
多糖的结构特征包括其分子量、单糖组成、分支性质和修饰性质等。多糖是植物源抗菌物质中分子质量最大的种类之一,分子质量4.95×103~8.70×106 Da。有研究认为植物多糖分子质量越小,其抑菌活性越强,但仅依据多糖分子质量大小不能判断抑菌活性强弱。例如,南瓜多糖分子质量为2.10×104 Da,其对大肠杆菌的最低抑菌浓度(minimum inhibitory concentration,MIC)为15.6 mg/mL[13]。人参多糖分子质量为3.69×105 Da,对大肠杆菌的MIC仅为0.025 mg/mL[14],人参多糖比南瓜多糖分子质量大,但人参多糖抗菌活性较高。
植物多糖的抑菌活性还受单糖组成、多糖支链和糖醛酸含量等的影响。多糖一般由多种单糖组成,最丰富的单糖包括果糖、葡萄糖、鼠李糖和半乳糖。有研究表明,分析植物多糖单糖组成发现鼠李糖含量的增加,可以提高多糖的抗菌性。HAN等[15]通过增加纸莎草果多糖中糖醛酸和鼠李糖的含量,发现对大肠杆菌、铜绿假单胞菌、枯草芽孢杆菌和金黄色葡萄球菌的抗菌活性得到显著提升。植物多糖亦可通过化学修饰使多糖带电、增加支链数量,提高其对细胞壁的吸附性,改变多糖的抑菌活性。例如,硫酸盐多糖的抗菌作用可能归因于带负电荷的硫酸盐多糖与阳离子营养物质之间的相互作用,从而降低细菌对营养物质的利用[16]。
2.2 多酚化合物
多酚类化合物羟基的位置和数量对细菌产生的毒性有决定性作用,许多研究表明羟基化程度越高的酚类化合物抑制作用越强,并且香叶基也被发现是与抗菌活性相关的重要基团,而糖基化似乎增加了多酚的疏水性而不利于抗菌。研究表明,含有邻苯三酚结构的多酚类化合物比含有1,2-二羟基苯基的化合物对放线菌的生长具有更强的抑制作用,邻苯三酚能够快速而有力地形成非共价相互作用,如氢键和疏水相互作用[17]。研究表明,没食子酸甲酯比没食子酸具有更好的抑菌活性,且随着烷基链长度的增加而降低[18],但需要注意的是,在其他细菌中观察到了不同的变化趋势。
如图1,多数黄酮衍生物是具有2-苯基色原酮(C6—C3—C6)骨架的母体化合物,黄酮的抗菌活性与甲氧基和羟基的数量和位置直接相关,其活性强弱是疏水性和电荷间相互作用决定的。槲皮素和木犀草素相比,C环C3位的羟基增加了抗菌性,一般来说羟基增加了亲水性不利于抑菌,但在C3位置电荷的强弱对抑菌效果的影响更大。而多甲氧基黄酮则提高了细菌细胞膜流通性,提高了其抑菌活性。相反,异黄酮在A环上连一个糖苷键后,提高了异黄酮的亲水性,抑菌活性显著下降[19]。此外,研究发现类异戊二烯衍生物的侧链长度似乎对粪肠杆菌的抗菌活性很重要。苦果素A的活性相对较弱,其与苦果素B的区别仅在于异戊二烯侧链与香叶基侧链[20]。
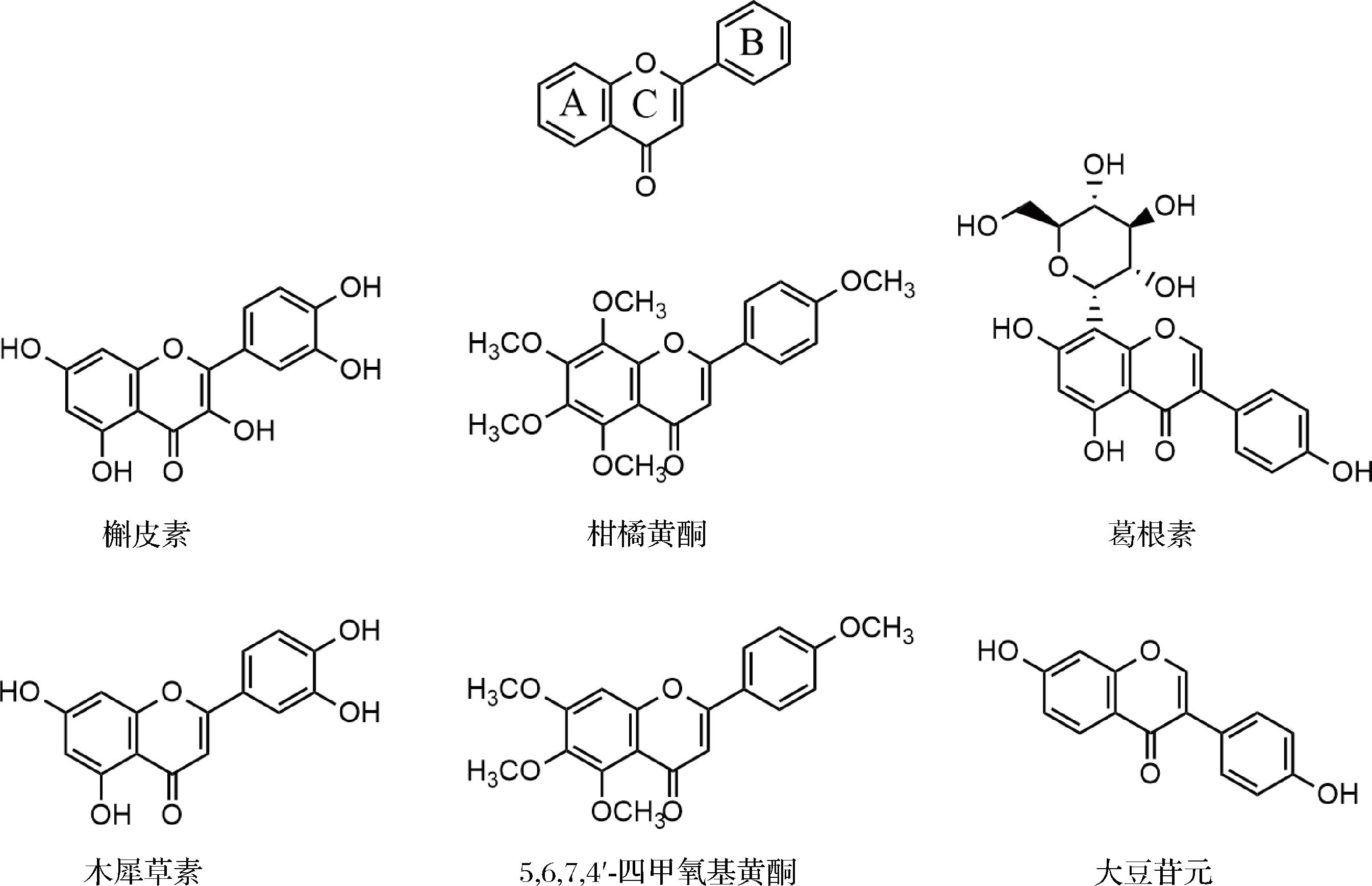
图1 类黄酮化合物的结构图
Fig.1 Structure of flavonoid compounds
2.3 生物碱
生物碱是低分子量的含氮化合物,与其他植物抗菌物质相比具有更多的骨架结构和官能团,导致其抗菌构效关系复杂。部分生物碱结构含有氮原子的杂环,含有正氮离子带有正电性,易发生亲电反应进而对细菌结构发起攻击,通常正氮离子被氢还原后,其抗菌活性下降,而被甲基取代则相反,但这一规律并不在所有骨架都成立,需根据其基本骨架取代基的不同特性而具体分析。生物碱影响着细菌不同的代谢系统,抗菌机制复杂,目前很多研究发现其作用构效机制可能是通过插入核酸抑制DNA合成和修复[21]。
血根碱由于其季氮、多环和平面结构,可与多种生物分子、受体、酶中的氨基酸亲核基团和阴离子基团发生反应,并具有很强的DNA插入活性。ANJANEYULU等[22]提出高亲脂性的8-羟基喹啉可以穿透细菌细胞膜从而攻击细胞内重要成分。游离配体或带电荷的8-羟基喹啉金属配合物能结合细菌酶上的金属结合位点,阻断金属辅因子的结合,从而产生抗菌作用。
如图2,小檗碱是一种从黄连中分离的季铵生物碱,由苯基四氢异喹啉体系的四环骨架组成,带有正电性可以使细胞膜的通透性增加,并且正电荷有利于其在细菌细胞中的积累,从而增强了抗菌活性。以小檗碱、四氢小檗碱和N-甲基四氢小檗碱为例,其在相同位置有相同的取代基,但骨架略有不同,小檗碱被氢化生成四氢小檗碱后显著降低了对大肠杆菌和猪霍乱链球菌的活性,并导致对金黄色葡萄球菌和鸡链球菌的活性完全丧失。当四氢小檗碱被甲基化得到N-甲基四氢小檗碱时,对金黄色葡萄球菌和鸡链球菌的活性恢复,而据报道对大肠杆菌和猪霍乱链球菌的活性没有变化,具体活性比较如表1所示[23]。虽然甲基化的增效非常明显,但不同种类的生物碱甲基化对不同的细菌并不一定均活性增加。
表1 生物碱对不同细菌的MIC
Table 1 MIC of alkaloids against various bacterial strains
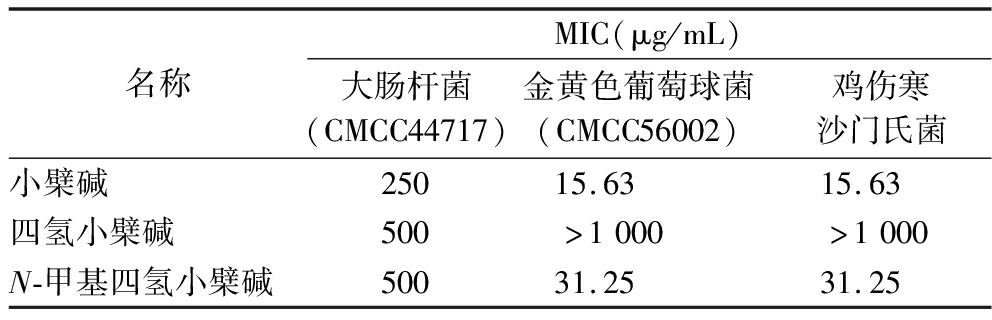
名称MIC(μg/mL)大肠杆菌(CMCC44717)金黄色葡萄球菌(CMCC56002)鸡伤寒沙门氏菌小檗碱25015.6315.63四氢小檗碱500>1000>1000N-甲基四氢小檗碱50031.2531.25
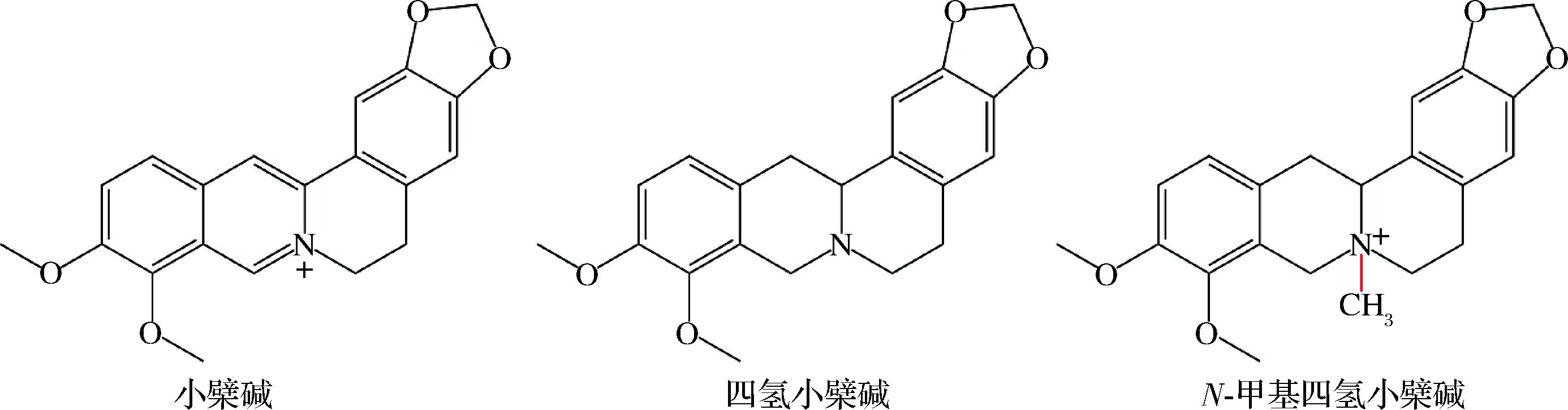
图2 以小檗碱为基本骨架的化合物结构图
Fig.2 Structural diagram of compounds based on berberine alkaloid scaffold
2.4 萜类
萜类分子结构包含异戊二烯单元的碳骨架,可以重新排列成环状结构。异戊二烯单元的数量主要负责萜烯的结构多样性,半萜由一个异戊二烯单元(C5)组成,以此类推两个异戊二烯单元组成单萜,单萜是精油的主要成分(90%)。通常成环的单萜比无环的活性强,不同取代基对萜类化合物抗菌活性产生不同的影响,甲氧基、亚甲基、氯离子和羧酸基团对抗菌活性起到重要作用,烯烃、醛基等不饱和基团的存在对抗菌活性也有显著影响,而糖基化则抑制了抗菌活性。
JURKANINOV 等[24]发现,松香烷型二萜sincoetsin C其骨架上的羟基糖基化后使原有的抗菌活性减弱,而C7位和C16位的甲氧基化作用增强了抗菌活性,C13位的取代基对抗菌活性也有影响。
等[24]发现,松香烷型二萜sincoetsin C其骨架上的羟基糖基化后使原有的抗菌活性减弱,而C7位和C16位的甲氧基化作用增强了抗菌活性,C13位的取代基对抗菌活性也有影响。
研究表明,鼠尾草酸中C12位的羟基是活性所必需的,C20位的甲基化降低了对粪肠球菌和耐甲氧西林金黄色葡萄球菌的MIC[25]。黄脂酸甲基化后的MIC值高一个数量级,说明了具有单一氢键供体基团的二萜比具有2个氢键供体基团的二萜具有更强的抗菌活性[26]。熊果酸C3位乙酰化后得到的熊果酸醋酸酯具有较高的抑菌活性[27]。在熊果酸C1和C2位置引入2个羟基,在C17位置引入1个甲酯,得到1α,2β,3β-三羟基熊果酸-12-烯-28-酸甲酯,对金黄色葡萄球菌和枯草芽孢杆菌具有较好的生长抑制活性[28]。在C28位上加入异丙基或正丁基链导致衍生物能够通过抑制外排泵逆转对多药耐药大肠杆菌的耐药性[29]。
3 植物源抗菌物质抑菌机理
3.1 破坏细胞结构
3.1.1 细胞壁与细胞膜
细菌的细胞壁与细胞膜是其能抵御外界恶劣环境的重要结构。通常植物抗菌物质可与细菌细胞膜直接作用,而高浓度植物抗菌物质造成的恶劣环境如极端pH、高渗透压等可改变细菌细胞膜的通透性,改变膜电位甚至使细胞壁、细胞膜破裂,导致细胞质泄漏、信息传递功能阻断,从而使细菌死亡。
植物抗菌物质可能通过静电吸附和疏水作用与细胞膜相互作用,或直接通过细胞膜上糖蛋白受体相互作用。例如,分子质量大的抗菌多糖直接黏附在细菌上,断绝了细菌必需营养素,使细菌缺营养而死。一般来说,细胞表面呈负电性,如生物碱呈正电性的可以吸附在壁上,导致细胞膜去极化。呈电负性的抗菌物质可以通过攻击蛋白质受体或离子转运通道蛋白,从而促使细胞死亡,而疏水性强的抗菌物质如黄酮、精油通过疏水作用直接破坏磷脂双分子层。SHEN等[30]提出苦参黄酮直接与金黄色葡萄球菌细胞壁的肽聚糖结合,破坏细胞壁结构从而杀死细菌。
3.1.2 细胞内的靶点
大分子物质如多糖可以被细胞壁和细胞膜阻挡在外,但小分子物质如萜类、生物碱等可以进入细胞内对细胞内的物质发起攻击,导致细菌部分结构受损,细胞内的靶点包括线粒体、内质网、细胞核和DNA等,这些靶点的受损影响细菌正常代谢,导致细菌生长受到抑制,具体如图3与表2所示。
表2 植物源抗菌物质的主要靶点及作用机理
Table 2 Main targets and inter action mechanisms of plant-derived antimicrobial substances

植物源抗菌物质种类主要靶点主要作用机理参考文献多糖 细胞壁、细胞膜改变细胞膜通透性、改变细胞膜极性、抑制物质进出细胞使细菌缺营养而死亡[16]多酚化合物细胞壁、细胞膜、能量代谢途经、遗传物质合成途经抑制DNA合成、转录及调控基因表达、抑制细胞壁合成、导致细菌代谢紊乱、抑制群体感应系统等[30,33]生物碱 各种细胞器、能量代谢途经、遗传物质合成途经插入或与核酸碱基堆积形成氢键导致DNA无法正常表达、正氮离子攻击导致各种细胞器损伤、使细菌代谢紊乱等[21-22]萜类 细胞壁、细胞膜、能量代谢途经疏水作用使细胞膜破裂、使细菌代谢紊乱等[24-26]
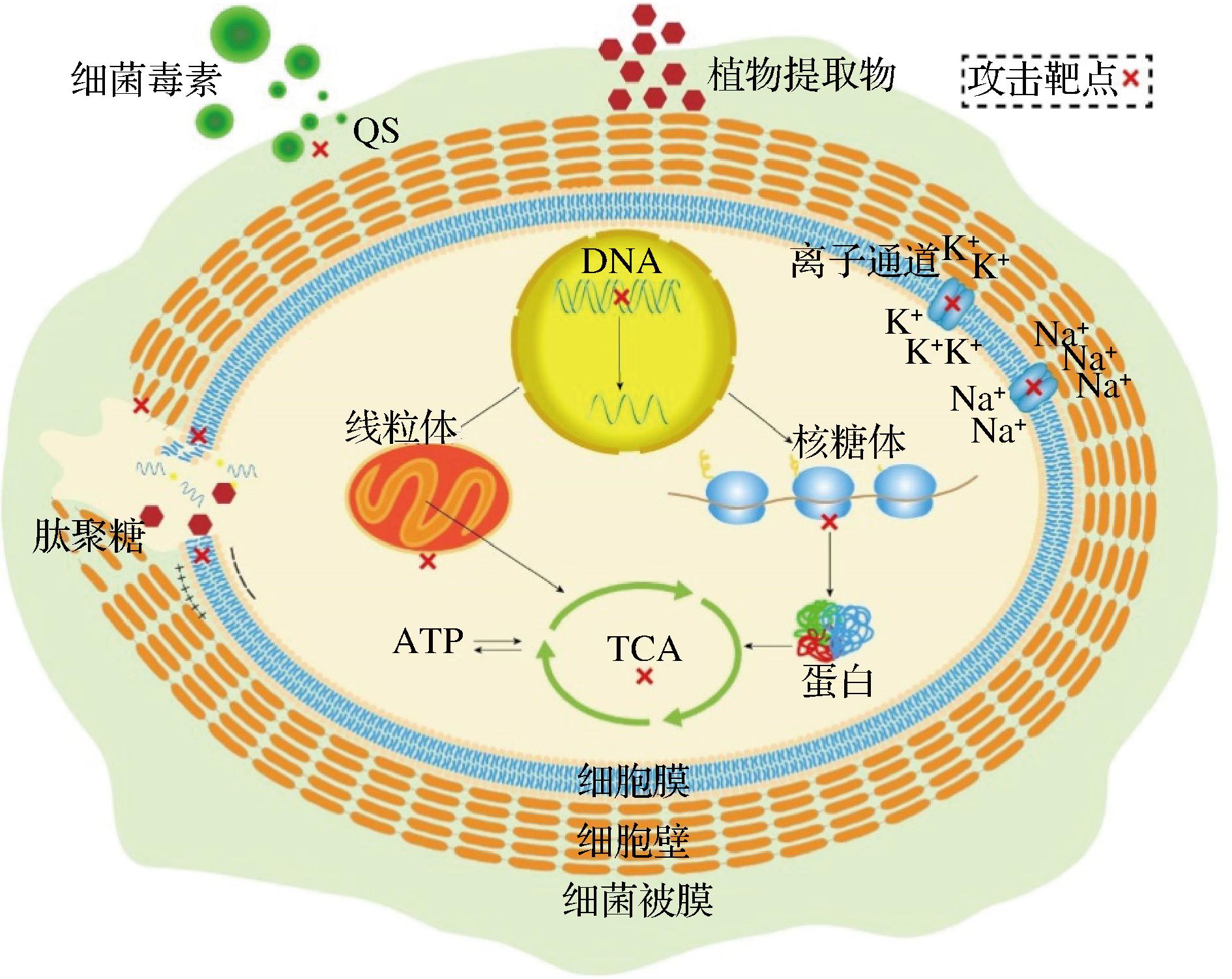
图3 植物提取物的抗菌机理图
Fig.3 Antibacterial mechanism of plant extracts
WANG等[31]发现五倍子和丁香提取物可引起茄根核菌线粒体、内质网和细胞核等细胞器的降解。橙花醇和厚朴酚可破坏线粒体膜电位并诱导其去极化,进一步导致线粒体结构和功能异常,从而抑制三磷酸腺苷(adenosine triphosphate,ATP)的生成[32]。从黄芩和苦苣子中提取的黄芩素可直接作用于DNA,可能通过插入或与核酸碱基堆积形成氢键,导致DNA断裂和细胞死亡[33]。核糖体失活蛋白如balsamin、bouganin和ɑ-momorcharin,可使核糖体失活,抑制细胞内蛋白质合成[34]。
3.2 代谢途经紊乱
3.2.1 能量代谢受阻
植物抗菌物质可以通过抑制酶活性或破坏酶结构、阻断电子传送系统,导致细菌代谢受阻而使细菌生长受到抑制。三羧酸循环(tricarboxylic acid cycle,TCA)是生物体内新陈代谢和能量代谢的核心途径,产生ATP等物质来调节细胞的代谢活动。苹果酸脱氢酶(malate dehydrogenase,MDH)催化苹果酸和草酰乙酸之间的转化。琥珀酸脱氢酶(succinate dehydrogenase,SDH)催化琥珀酸转化为戊酸,同时将黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)转化为FADH2,而FADH2是反应链中的电子供体。研究表明,芳樟醇对SDH活性有负面影响,并干扰与TCA循环和氧化磷酸化途径相关的反应[35]。
WENG等[36]从山胡椒属乌药中提取的多糖不仅导致细菌糖酵解和TCA循环途径中果糖-1,6-二磷酸和柠檬酸水平的上调,还导致草酰乙酸和1,3-二磷酸甘油酸水平的下调进而导致TCA循环受阻,限制电子输运和ATP合成。HAN等[37]通过酶组学推测,柠檬烯通过降低关键酶活性,包括ATP酶、SDH、MDH、蛋白激酶(protcin kinases,PK)等,从而影响呼吸功能和能量水平。研究表明,黑胡椒氯仿提取物可以抑制细菌的电子传递系统,导致ATP合成减少,活性氧物质含量增加[38]。
3.2.2 抑制细胞结构合成
细胞中的各个结构都起着不可或缺的作用,都为细菌的正常生长起重要作用,而植物抗菌物质可以通过调控基因表达,使细菌细胞结构合成受阻,导致细胞结构不完整,失去其原本该起的作用,细菌则不能正常生长繁殖。例如,通过对细胞壁、核糖体、DNA等物质的合成基因进行调控,导致合成受阻。
3.2.2.1 细胞壁
肽聚糖是细菌细胞壁的重要组成成分,参与肽聚糖生物合成的基因mur Z、sgt B和fmt A。mur A和mur都编码UDP-N-乙酰葡糖胺烯醇丙酮酰转移酶,它们催化肽聚糖生物合成的第一个关键步骤。氨酰-tRNA是细胞壁的重要组成部分,可以赋予细菌细胞壁的强度和形态。研究表明,玫瑰花精油使氨酰-RNA生物合成中间体,包括L-甘氨酸、L-苯丙氨酸、L-蛋氨酸和L-谷氨酸含量发生了显著变化,影响了氨基酸正常代谢,并使细胞壁和细胞膜结构破坏[39]。
3.2.2.2 核糖体
BAI等[40]基于DEGs数据和GO富集分析,发现了莽草酸和奎宁酸诱导了大量核糖体相关基因的差异表达,包括30S小亚基的基因,如rpsF、rpsR、rpsL;50S大亚基的如rplA、rplJ、rpl。这两种有机酸在蛋白质翻译过程中调节与核糖体酶相关的基因,如nrdI、pyrE、rnc。
3.2.2.3 蛋白质
丝状温度敏感蛋白Z(filamentous temperature-sensitive protein Z,FtsZ)对细菌的正常繁殖起重要作用,控制着细菌分裂过程,包括隔膜与环状结构的形成。研究发现[41],小檗碱、吲哚类生物碱等能够抑制大肠杆菌FtsZ的合成,从而抑制胞质分裂而抑制细菌分裂。
3.2.2.4 DNA
植物源抗菌物质可作用于核酸的复制、转录、合成所需要的酶,导致基因表达过程受阻。DNA拓扑异构酶、DNA旋转酶是细菌核酸合成过程中需要的重要酶。研究发现,黄酮类化合物如芹菜素、槲皮素对DNA旋转酶有显著的抑制作用导致DNA无法正常合成[42]。
3.2.3 破坏群体感应系统
细菌生物被膜是由细菌群落分泌能够包裹自身的胞外基质与细菌结合形成的复杂聚合体。而群体感应系统(quorum sensing system,QS)存在生物被膜中,细菌可通过释放的信号分子来交流,从而改变胞内遗传物质的表达,调节细菌的生长代谢,并导致细菌毒力、耐药性的变化等。简而言之,QS为细菌提高了耐药性,而植物抗菌物质可以通过竞争受体、降解信号分子、阻碍信号分子合成、阻碍信号分子与受体结合等方式,破坏QS使药物发挥更强的有效活性,提高抗菌活性。
CHEN等[43]通过蛋白免疫印迹和qRT-PCR发现,32 μg/mL和64 μg/mL黄芩素下调群体感应系统调节因子agrA、RNAⅢ和sarA以及ica的表达,抑制了群体感应系统,破坏生物膜,减少葡萄球菌肠毒素A和α-溶血素的产生。GOPU等[44]报道,槲皮素可以作为一种竞争性抑制剂,向LasR受体途径发送信号化合物,并可作为一种基于QS的新型抗菌/抗生物膜药物。含量为80 μg/mL的槲皮素显著降低了铜绿假单胞菌QS,如生物膜和胞外多糖生成。
3.2.4 促进细胞凋亡
植物抗菌物质可通过调控细菌凋亡相关基因的异常表达,导致细菌凋亡。TocL、DinF、Pal、MtgA和NagA是与凋亡相关的基因,DinF也是一种与稳态或应激反应机制相关的基因。当细胞被氧化应激破坏时,DinF的上调是细胞生存机制的证据。Pal、MtgA和NagA的表达与细胞壁生物合成有关[45]。REN等[46]通过从新疆酿酒葡萄中提取的紫檀芪处理金黄色葡萄球菌后,结果显示紫檀芪浓度为128 μg/mL对金黄色葡萄球菌起明显的抑制作用,并且处理后的凋亡基因均有不同程度的表达。
4 植物源抗菌物质在食品中的应用
目前,植物源抗菌物质在食品中的应用被广泛研究,越来越多天然物质被研究发现在食品应用中具有保鲜效果,甚至效果比传统防腐剂更好,具有安全、经济、性质稳定等特点。植物源抗菌物质种类繁多,应根据食品的种类不同,选择相应特性的抗菌物质并通过适合的施加方式进行使用。植物源抗菌物质通过与食品加工工艺联合使用,可以提高靶向致病性细菌的致死率,其在食品中的抗菌活性也可以通过与其他试剂如表面活性剂、抗氧化剂、生物活性纳米颗粒结合等方式而得到增强。
4.1 固态食品中的应用
肉制品、果蔬等食品由于其形状不规则,通常通过表面涂膜、喷淋等方式使用抗菌物质在食物表面均匀地进行防腐处理。可食性涂膜的主要成分有多糖、脂质、蛋白等,也可添加交联剂、抗菌剂等增强保鲜效果。MANJUNATH等[47]发现,黑胡椒油树脂卡拉胶食用薄膜可以阻止细菌的生长,从而延长牛排的货架期,并改善DPPH自由基清除活性和颜色特征。SOUSA等[48]发现,添加0.8%(质量分数)丁香精油使原本没有抗菌性的木薯淀粉膜表现出优异的抗真菌活性,能够使香蕉的保质期延长。
4.2 半固态、液态食品中的应用
半固态食品如米糊、果泥,液态食品如果汁、乳制品等,介质相对均匀,对于植物抗菌物质的选择应考虑体系的脂溶性和水溶性。MOON等[49]发现,通过添加少量香芹酚或百里酚(0.25、0.5、1 mmol/L,最终质量浓度<0.015 7%),通过协同作用使酱油的抗菌活性显着增加,在10 min内明显降低酱油体系细菌总数,并在14 d后未检测到含有大肠杆菌、鼠伤寒沙门氏菌、单核增生李斯特菌。研究发现,紫杉叶素对大肠杆菌MIC和MBC分别为1.11、2.22 mg/mL,而金黄色葡萄球菌分别为0.56、1.11 mg/mL,在牛奶贮存过程中,15、30 mg/mL紫杉叶素通过抑制细菌增殖,显著延缓牛奶酸度的增加和乳糖的损失[50]。
5 结论与展望
目前,随着植物源抗菌物质的深入研究,越来越多植物源活性物质被发现具有抗菌功效,可作为传统化学抗菌剂的替代品,在绿色防治病原微生物方面显示出巨大的潜力。植物源抗菌物质其种类丰富,结构复杂,抑菌作用机理复杂多样,对于特定的推论不一定对所有类型的微生物都有效。细菌和真菌种类之间,甚至同一种类之间都会有差异,特别是基于它们的表面特性、外排泵或一般的抗性机制。在选取强抗菌活性植物源抗菌物质作为抗菌剂的同时,也应该考虑到其某些不良物理化学性质,例如低化学稳定性、刺激性气味和毒性,可通过物理包埋、添加表面活性剂、抗氧化剂等方法解决。总的来说,植物源抗菌物质作为抗菌剂具有很好的潜力,在未来可以根据其来源的广度、抗菌谱和抗菌活性等因素考虑发明新一代的抗菌剂,在食品、制药、化工等方面具有广阔的应用前景。
[1] 杨艳辉,谭继平,张芬,等.烧伤科患者耐甲氧西林金黄色葡萄球菌医院感染危险因素及其耐药性[J].中华医院感染学杂志,2023,33(12):1847-1850.YANG Y H,TAN J P,ZHANG F,et al.Risk factors for nosocomial methicillin-resistant Staphylococcus aureus infection in burn department and their drug resistance[J].Chinese Journal of Nosocomiology,2023,33(12):1847-1850.
[2] KONG Q D,YANG Y S.Recent advances in antibacterial agents[J].Bioorganic &Medicinal Chemistry Letters,2021,35:127799.
[3] SHAHRAJABIAN M H,SUN W L,CHENG Q.The importance of flavonoids and phytochemicals of medicinal plants with antiviral activities[J].Mini-Reviews in Organic Chemistry,2022,19(3):293-318.
[4] JIN M,SHI J L,ZHU W Z,et al.Polysaccharide-based biomaterials in tissue engineering:A review[J].Tissue Engineering.Part B,Reviews,2021,27(6):604-626.
[5] ABBASZADEH H,KEIKHAEI B,MOTTAGHI S.A review of molecular mechanisms involved in anticancer and antiangiogenic effects of natural polyphenolic compounds[J].Phytotherapy Research,2019,33(8):2002-2014.
[6] 张杰,党斌,杨希娟.植物多酚的生理活性、抑菌机理及其在食品保鲜中的应用研究进展[J].食品工业科技,2022,43(24):460-468.ZHANG J,DANG B,YANG X J.Research progress on physiological activity,antibacterial mechanism of plant polyphenols and its application in food preservation[J].Science and Technology of Food Industry,2022,43(24):460-468.
[7] LI D D,YU P,XIAO W,et al.Berberine:A promising natural isoquinoline alkaloid for the development of hypolipidemic drugs[J].Current Topics in Medicinal Chemistry,2020,20(28):2634-2647.
[8] L PEZ Y,TATO M,GARGALLO-VIOLA D,et al.Comparative activity of ozenoxacin and other quinolones in Staphylococcus aureus strains overexpressing the efflux pump-encoding genes mepA and norA[J].International Journal of Antimicrobial Agents,2020,56(3):106082.
PEZ Y,TATO M,GARGALLO-VIOLA D,et al.Comparative activity of ozenoxacin and other quinolones in Staphylococcus aureus strains overexpressing the efflux pump-encoding genes mepA and norA[J].International Journal of Antimicrobial Agents,2020,56(3):106082.
[9] HARISH KUMAR G,CHANDRA MOHAN K V P,JAGANNADHA RAO A,et al.Nimbolide a limonoid from Azadirachta indica inhibits proliferation and induces apoptosis of human choriocarcinoma (BeWo) cells[J].Investigational New Drugs,2009,27(3):246-252.
[10] 黄金迪.小桐子二萜的分离鉴定及其抗肿瘤和抗炎活性研究[D].泉州:华侨大学,2020.HUANG J D.Isolation,identification and anti-tumor and anti-inflammatory activity of diterpenoids from Jatropha Curcas[D].Quanzhou:Huaqiao University,2020.
[11] WANG G S.The antimicrobial peptide database provides a platform for decoding the design principles of naturally occurring antimicrobial peptides[J].Protein Science,2020,29(1):8-18.
[12] FUJITA K I,CHAVASIRI W,KUBO I.Anti-Salmonella activity of volatile compounds of Vietnam coriander[J].Phytotherapy Research,2015,29(7):1081-1087.
[13] WANG L B,LIU F C,WANG A X,et al.Purification,characterization and bioactivity determination of a novel polysaccharide from pumpkin (Cucurbita moschata) seeds[J].Food Hydrocolloids,2017,66:357-364.
[14] ZHAO J L,ZHANG M P,ZHOU H L.Microwave-assisted extraction,purification,partial characterization,and bioactivity of polysaccharides from Panax ginseng[J].Molecules,2019,24(8):1605.
[15] HAN Q H,WU Z L,HUANG B,et al.Extraction,antioxidant and antibacterial activities of Broussonetia papyrifera fruits polysaccharides[J].International Journal of Biological Macromolecules,2016,92:116-124.
[16] SHAO L L,XU J,SHI M J,et al.Preparation,antioxidant and antimicrobial evaluation of hydroxamated degraded polysaccharides from Enteromorpha prolifera[J].Food Chemistry,2017,237:481-487.
[17] SCALBERT A.Antimicrobial properties of tannins[J].Phytochemistry,1991,30(12):3875-3883.
[18] OOSHIRO A,KAJI M,KATOH Y,et al.Antibacterial activity of alkyl gallates and related compounds against Ralstonia solanacearum[J].Journal of Pesticide Science,2011,36(2):240-242.
[19] WU T,HE M Y,ZANG X X,et al.A structure-activity relationship study of flavonoids as inhibitors of E.coli by membrane interaction effect[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2013,1828(11):2751-2756.
[20] MUHARINI R,D AZ A,EBRAHIM W,et al.Antibacterial and cytotoxic phenolic metabolites from the fruits of Amorpha fruticosa[J].Journal of Natural Products,2017,80(1):169-180.
AZ A,EBRAHIM W,et al.Antibacterial and cytotoxic phenolic metabolites from the fruits of Amorpha fruticosa[J].Journal of Natural Products,2017,80(1):169-180.
[21] WILSON I D,ADLARD E R,COOKE M,et al.Preface[M].Encyclopedia of Separation Science.Amsterdam:Elsevier,2000:viii.
[22] ANJANEYULU Y,RAO R P,SWAMY R Y,et al.In vitro antimicrobial-activity studies on the mixed ligand complexes of Hg(II) with 8-hydroxyquinoline and salicylic acids[J].Proceedings of the Indian Academy of Sciences-Chemical Sciences,1982,91(2):157-163.
[23] CHENG P,WANG B,LIU X B,et al.Facile synthesis of tetrahydroprotoberberine and protoberberine alkaloids from protopines and study on their antibacterial activities[J].Natural Product Research,2014,28(7):413-419.
[24] JURKANINOV S,KUB
S,KUB NOV
NOV R,NEJEZCHLEBOV
R,NEJEZCHLEBOV M,et al.Anti-MRSA activity of abietane diterpenes from Coleus blumei Benth[J].Natural Product Research,2021,35(18):3033-3039.
M,et al.Anti-MRSA activity of abietane diterpenes from Coleus blumei Benth[J].Natural Product Research,2021,35(18):3033-3039.
[25] ![]() S,DUSSORT P,PIERRE F.Carnosic acid[J].Phytochemistry,2015,115:9-19.
S,DUSSORT P,PIERRE F.Carnosic acid[J].Phytochemistry,2015,115:9-19.
[26] SOUZA A B,MARTINS C H G,SOUZA M G M,et al.Antimicrobial activity of terpenoids from Copaifera langsdorffii Desf.against cariogenic bacteria[J].Phytotherapy Research,2011,25(2):215-220.
[27] FADIPE V O,MONGALO N I,OPOKU A R,et al.Isolation of anti-mycobacterial compounds from Curtisia dentata (Burm.f.) C.A.Sm (Curtisiaceae)[J].BMC Complementary and Alternative Medicine,2017,17(1):306.
[28] HUANG L R,LUO H,LI Q J,et al.Pentacyclic triterpene derivatives possessing polyhydroxyl ring A inhibit Gram-positive bacteria growth by regulating metabolism and virulence genes expression[J].European Journal of Medicinal Chemistry,2015,95:64-75.
[29] DWIVEDI G R,MAURYA A,YADAV D K,et al.Drug resistance reversal potential of ursolic acid derivatives against nalidixic acid-and multidrug-resistant Escherichia coli[J].Chemical Biology &Drug Design,2015,86(3):272-283.
[30] SHEN F G,TANG X D,WANG Y,et al.Phenotype and expression profile analysis of Staphylococcus aureus biofilms and planktonic cells in response to licochalcone A[J].Applied Microbiology and Biotechnology,2015,99(1):359-373.
[31] WANG Y H.Traditional uses,chemical constituents,pharmacological activities,and toxicological effects of Dendrobium leaves:A review[J].Journal of Ethnopharmacology,2021,270:113851.
[32] LI X Z,LIU M,HUANG T G,et al.Antifungal effect of nerol via transcriptome analysis and cell growth repression in sweet potato spoilage fungi Ceratocystis fimbriata[J].Postharvest Biology and Technology,2021,171:111343.
[33] DA X,NISHIYAMA Y,TIE D,et al.Antifungal activity and mechanism of action of Ou-gon (Scutellaria root extract) components against pathogenic fungi[J].Scientific Reports,2019,9(1):1683.
[34] 徐克凡.三角梅核糖体失活蛋白(bouganin)多态性组织品种差异研究[D].厦门:厦门大学,2018.XU K F.Study on bouganin polymorphism difference among different tissues and varieties[D].Xiamen:Xiamen University,2018.
[35] GAO L Y,CHEN H M,CHEN W X,et al.Linalool against Hafnia alvei,its antibacterial mechanism revealed by metabolomic analyses[J].Food Bioscience,2023,51:102316.
[36] WENG M F,YOU S M,LUO J W,et al.Antibacterial mechanism of polysaccharides from the leaves of Lindera aggregata (Sims) Kosterm.by metabolomics based on HPLC/MS[J].International Journal of Biological Macromolecules,2022,221:303-313.
[37] HAN Y J,CHEN W X,SUN Z C.Antimicrobial activity and mechanism of limonene against Staphylococcus aureus[J].Journal of Food Safety,2021,41(5):e12918.
[38] ZOU L,HU Y Y,CHEN W X.Antibacterial mechanism and activities of black pepper chloroform extract[J].Journal of Food Science and Technology,2015,52(12):8196-8203.
[39] YUAN Y H,LIU L X,GUO L,et al.Antibacterial mechanism of rose essential oil against Pseudomonas putida isolated from white Hypsizygus marmoreus at cellular and metabolic levels[J].Industrial Crops and Products,2023,196:116523.
[40] BAI J R,WU Y P,BU Q,et al.Comparative study on antibacterial mechanism of shikimic acid and quinic acid against Staphylococcus aureus through transcriptomic and metabolomic approaches[J].LWT,2022,153:112441.
[41] 梁树梅,杨莉莉,刘华伟,等.耐甲氧西林金黄色葡萄球菌ftsZ基因高效反义肽核酸序列筛选及其体外抗菌活性观察[J].中国抗生素杂志,2020,45(9):867-872.LIANG S M,YANG L L,LIU H W,et al.Screening of highly effective antisense peptide nucleic acids targeting the ftsZ gene of methicillin-resistant Staphylococcus aureus and evaluate its antibacterial activity in vitro[J].Chinese Journal of Antibiotics,2020,45(9):867-872.
[42] PLAPER A,GOLOB M,HAFNER I,et al.Characterization of quercetin binding site on DNA gyrase[J].Biochemical and Biophysical Research Communications,2003,306(2):530-536.
[43] CHEN Y,LIU T J,WANG K,et al.Baicalein inhibits Staphylococcus aureus biofilm formation and the quorum sensing system in vitro[J].PLoS One,2016,11(4):e0153468.
[44] GOPU V,MEENA C K,SHETTY P H.Quercetin influences quorum sensing in food borne bacteria:in-vitro and in-silico evidence[J].PLoS One,2015,10(8):e0134684.
[45] SUN D D,ZHANG W W,MOU Z P,et al.Transcriptome analysis reveals silver nanoparticle-decorated quercetin antibacterial molecular mechanism[J].ACS Applied Materials &Interfaces,2017,9(11):10047-10060.
[46] REN X Y,AN P P,ZHAI X,et al.The antibacterial mechanism of pterostilbene derived from Xinjiang wine grape:A novel apoptosis inducer in Staphyloccocus aureus and Escherichia coli[J].LWT,2019,101:100-106.
[47] MANJUNATH N,NAYAR R,AKKARA S S,et al.Effect of carrageenan edible film with oleoresins of Piper nigrum (black pepper) on quality of buffalo meat steaks[J].The Pharma Innovation,2019,8:397-400.
[48] SOUSA H A D,DE OLIVEIRA J G,EGEA M B,et al.Active film incorporated with clove essential oil on storage of banana varieties[J].Nutrition &Food Science,2019,49(5):911-924.
[49] MOON H,RHEE M S.Synergism between carvacrol or thymol increases the antimicrobial efficacy of soy sauce with no sensory impact[J].International Journal of Food Microbiology,2016,217:35-41.
[50] YANG D,ZHU R,XU H X,et al.Antibacterial mechanism of taxifolin and its application in milk preservation[J].Food Bioscience,2023,53:102811.