展青霉素(patulin,PAT)又名棒曲霉素,是一种主要由扩展青霉(Penicillium expansum)等真菌产生的真菌毒素[1-3]。PAT易溶于水、化学性质稳定,毒性强,长期食用可致畸、致癌和致肺水肿等[4]。PAT常污染水果及其制品,尤其是苹果,会引起苹果由外到内的腐烂,造成巨大的经济损失[5-6]。目前世界各国已意识到PAT带来的经济损失和其对人类健康存在的潜在威胁[7],因此制定了相关限量标准来限定苹果制品如苹果汁中PAT的含量,并探究PAT的高效脱毒方法。然而传统的物理、化学和生物脱毒法都存在一定的局限性,如会吸附果汁中的营养物质、影响食品的感官品质和理化指标、有安全风险等。光催化降解技术因其具有降解效率高、操作简单、对食品品质影响小、环境友好等优点成为了近年来PAT降解研究的热点。本文就PAT的理化性质、生物合成、污染现状、危害和防控手段等方面做了详细介绍,重点综述了光催化法及其降解苹果汁中PAT的研究进展,以期为光催化降解技术在解决苹果汁中PAT的污染问题提供理论参考。
1 PAT概述
1.1 理化性质
PAT属于酮类,其化学名称为4-羟基-4氢-呋喃(3,2碳)骈吡喃-2(6氢)酮,分子式为C7H6O4,分子量为154.12,化学结构如图1所示。PAT易溶于水、氯仿、丙酮、乙醇及乙酸乙酯等有机溶剂,微溶于乙醚、苯,不溶于石油醚,可溶于极性溶剂[8]。PAT在酸性环境中(pH 3.5~5.5)非常稳定,即使在超过100 ℃高温环境下仍稳定存在,但在碱性环境中不稳定,结构易被破坏[9]。
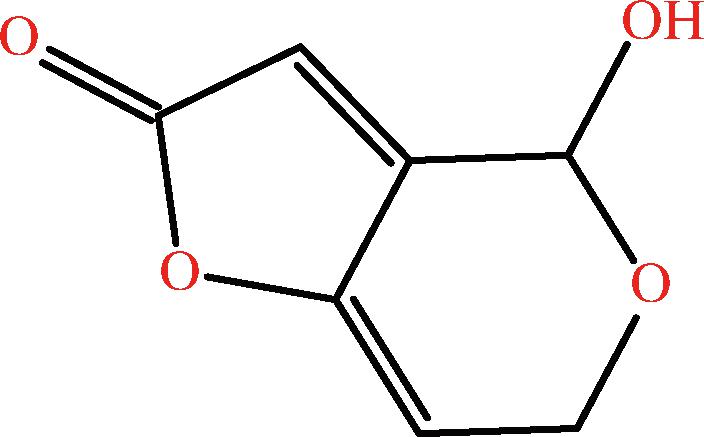
图1 PAT的化学结构式
Fig.1 Chemical structural formula of PAT
1.2 生物合成
PAT主要来源于曲霉属和青霉属的真菌,如壳青霉、展青霉、扩展青霉等[10-11]。水果在加工、运输、储存时,若因外界环境因素导致其表面被霉菌污染,同时环境达到了菌株产毒的最佳条件,这些菌株就会合成PAT。在CHEN等[12]研究基础上总结了PAT生物合成通路,具体合成过程见图2。乙酰辅酶A→6-甲基水杨酸→间甲酚→间羟基苯甲醇→龙胆醇→2,5二羟基苯甲醛→异环氧化物→叶点霉素→新霉素→5-(2-羟基亚乙基)-4-(羟基甲基)-2(5氢)-呋喃酮→PAT。目前已经鉴定了PAT合成通路中与前体转化相关的多种特异性酶的活性。LYNEN等[13]研究PAT生物合成时发现,PAT合成通路中第一步的6-甲基水杨酸合酶来自灰黄青霉(Penicillium griseofulvum)。随后,LIGHT等[14]纯化并表征了6-甲基水杨酸脱羧酶,其在PAT合成通路第二步中的作用是将6-甲基水杨酸转化为间甲酚。将间甲酚转化为羟基化衍生物的两种羟化酶的活性是由两种不同的细胞色素P450酶负责的。一种细胞色素P450将间甲酚转化为间羟基苯甲醇,另一种细胞色素P450将间羟基苯甲醇转化为龙胆醇,且研究证明基因pat H是龙胆醇的生物合成通路中两种细胞色素P450的合成的编码基因[15]。龙胆醇转化为PAT的大多数催化步骤尚未确定出特定的代谢基因,因此PAT的生物合成途径中只有少数基因的功能得到了验证,所以要阐明PAT完整的生物合成通路,还需要更多深入的研究。
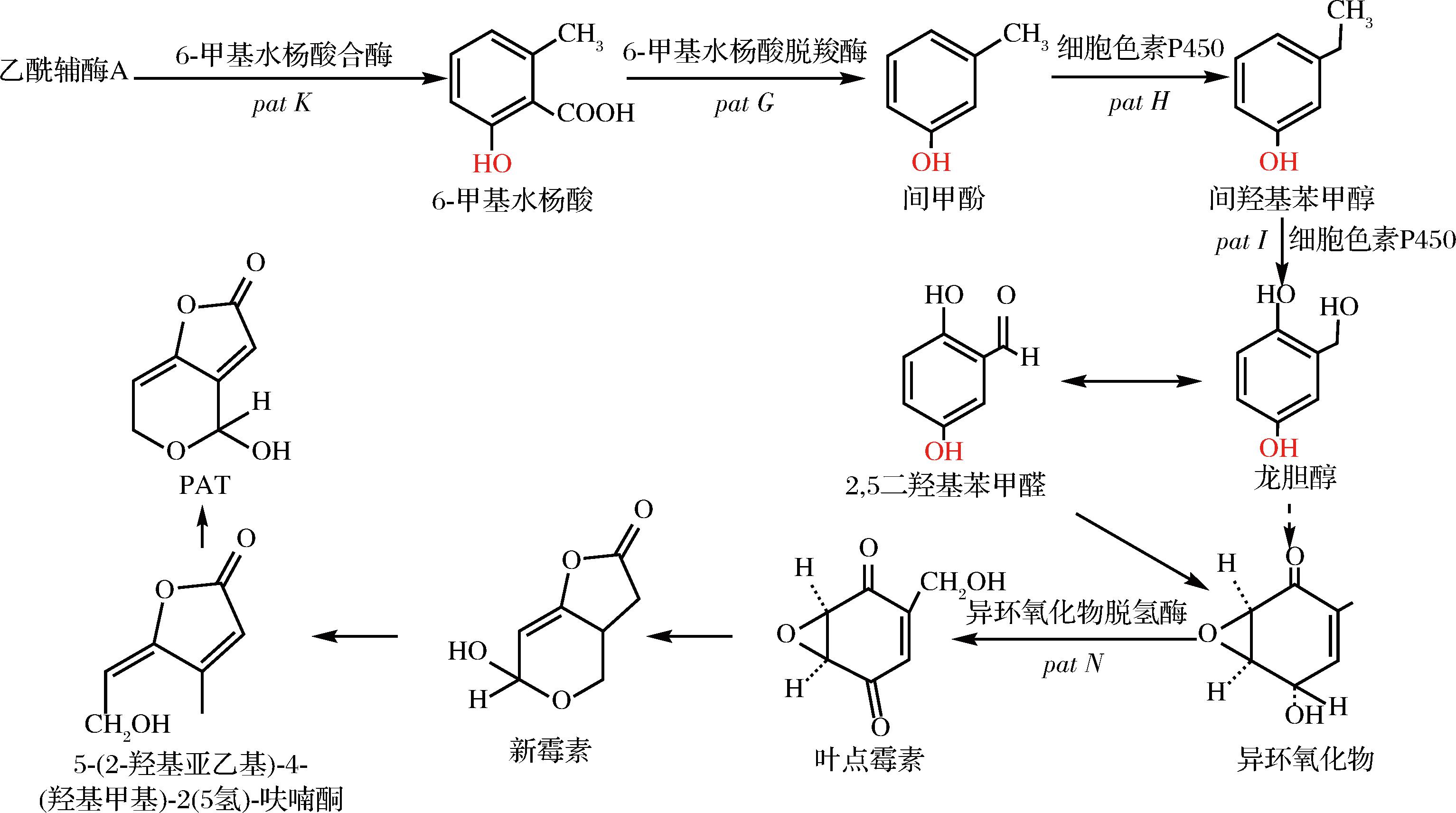
图2 PAT的生物合成通路
Fig.2 The biosynthetic pathway of PAT
1.3 危害
研究表明,PAT的主要危害在于当机体摄入一定量的PAT时,PAT会对机体产生急性毒性、慢性毒性以及细胞毒性[16]。急性病症的主要表现有抽搐、呼吸困难、水肿、胃肠道紊乱、溃疡和呕吐等;慢性病症的主要表现有致突变性、神经毒性、致畸性、遗传毒性和致癌性等;细胞毒性主要体现在改变细胞膜的通透性、抑制蛋白或DNA合成、转录中断等。SMITH等[6]发现将老鼠胚胎置于浓度为47~55 μmol/L的PAT环境下,老鼠胚胎中核酸、蛋白质、体细胞数等显著降低;当PAT浓度增加至62 μmol/L时,胚胎将在40 h内死亡。DICKENS等[17]发现大白鼠皮下注射PAT后,注射部位诱发肿瘤,验证了PAT的致癌性,随后相继发现了PAT的致畸性和致突变性。KHAN等[8]等研究发现PAT可以破坏细胞的完整性,导致细胞内钾离子外流,影响细胞生长状态以及细胞内物质的合成。
1.4 污染和限量
PAT在腐烂的苹果、山楂、杏、李、桃、梨、葡萄等水果中均有发现,尤其是苹果[18]。在苹果腐烂处,PAT含量最高可达1 000 μg/kg[19],由于PAT的水溶性,其容易在侵染部位积累并扩散至未表现病变的果肉中,导致苹果及其制品中PAT污染问题普遍存在。1978年,抽样检测芬兰的166份苹果制品时发现20%~40%的样品产生PAT,其中进口产品中PAT的检出含量为50~690 μg/L[20]。1984年从佐治亚州采集的5份消过毒的苹果汁中均检出PAT,含量在244~3 990 μg/L,平均含量1 902 μg/L[21]。ZOUAOUI等[22]随机抽取检测突尼斯的214份苹果汁样品,发现50%苹果汁样品存在PAT污染,污染范围为2~889 μg/L,其中22%样品PAT含量超标。我国对各地水果制品中PAT的污染情况进行过调查,结果显示:76.9%水果制品的原汁、原酱等半成品也均检出PAT,含量在18~953 μg/kg[23]。因此,多国和组织设定了PAT的限量标准。世界卫生组织(World Health Organization,WHO)规定成人果汁中PAT的浓度限量为50 μg/kg,婴儿果汁为10 μg/kg[24];欧盟规定果汁及其它苹果制品中PAT的最大含量≤50 μg/kg,婴幼儿及儿童食用苹果汁或苹果制品中PAT的含量≤10 μg/kg;中国同样规定苹果及其制品中PAT的最高限量为50 μg/kg[25]。为保障食品安全和人民身体健康,减少经济损失,研究PAT的防控手段十分重要。
1.5 防控手段
PAT的脱毒被认为是食品工业中的挑战。目前,PAT的防控手段主要包括物理法(吸附澄清法、非热加工技术等)、化学法(化学物质添加法、臭氧化等)、生物法(生物吸附法和生物降解法)[26-27]和光催化法(光催化降解技术)[28]。每种方法的优缺点见表1。与物理法、化学法、生物法相比,光催化法降解PAT具有操作简单、重复性好、无毒、安全、绿色、高效、经济、对食品品质影响小等优点,成为了近年脱除食品中PAT的研究热点[29-30]。
表1 物理法、化学法、生物法脱除PAT的原理及其优缺点
Table 1 Principles and advantages and disadvantages of physical,chemical and biological methods for removing PAT
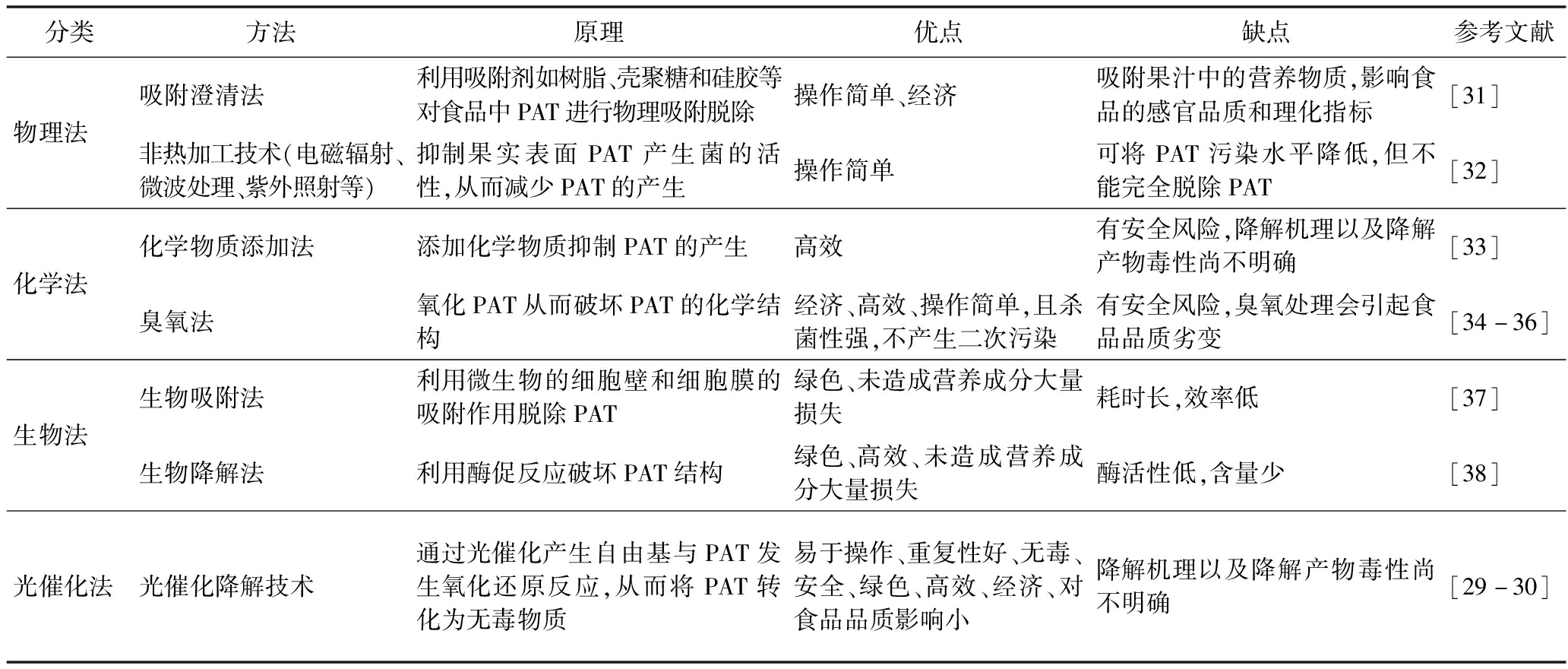
分类方法原理优点缺点参考文献物理法吸附澄清法利用吸附剂如树脂、壳聚糖和硅胶等对食品中PAT进行物理吸附脱除操作简单、经济吸附果汁中的营养物质,影响食品的感官品质和理化指标[31]非热加工技术(电磁辐射、微波处理、紫外照射等)抑制果实表面PAT产生菌的活性,从而减少PAT的产生操作简单可将PAT污染水平降低,但不能完全脱除PAT[32]化学法化学物质添加法添加化学物质抑制PAT的产生高效有安全风险,降解机理以及降解产物毒性尚不明确[33]臭氧法氧化PAT从而破坏PAT的化学结构经济、高效、操作简单,且杀菌性强,不产生二次污染有安全风险,臭氧处理会引起食品品质劣变[34-36]生物法生物吸附法利用微生物的细胞壁和细胞膜的吸附作用脱除PAT绿色、未造成营养成分大量损失耗时长,效率低[37]生物降解法利用酶促反应破坏PAT结构绿色、高效、未造成营养成分大量损失酶活性低,含量少[38]光催化法光催化降解技术通过光催化产生自由基与PAT发生氧化还原反应,从而将PAT转化为无毒物质易于操作、重复性好、无毒、安全、绿色、高效、经济、对食品品质影响小降解机理以及降解产物毒性尚不明确[29-30]
2 光催化降解技术
2.1 光催化降解技术介绍
1976年,CAREY等[39]利用TiO2悬浮液成功光催化降解废水中的多氯联苯,自此利用光催化法降解有机污染物成为研究热点。光催化降解技术是光催化剂受特定波长的光激活以发生化学反应的过程,该过程中催化剂表面产生的羟自由基(·OH)、超氧阴离子自由基![]() 和空穴(h+)等活性物质可与有机污染物反应,从而实现对污染物的脱除。具体反应机理如图3所示。以催化剂TiO2为例,在光照下,光子激发TiO2的带隙,在TiO2表面产生带正电荷的空穴(h+)和带负电荷的电子(e-),价带(valence band,VB)的e-向导带(conduction band,CB)移动,从而产生电子-空穴对(e--h+)[40]。e--h+的主要作用有:CB的e-可以和空气中的O2反应转化成
和空穴(h+)等活性物质可与有机污染物反应,从而实现对污染物的脱除。具体反应机理如图3所示。以催化剂TiO2为例,在光照下,光子激发TiO2的带隙,在TiO2表面产生带正电荷的空穴(h+)和带负电荷的电子(e-),价带(valence band,VB)的e-向导带(conduction band,CB)移动,从而产生电子-空穴对(e--h+)[40]。e--h+的主要作用有:CB的e-可以和空气中的O2反应转化成![]() 和H2O[公式(1)],生成OH-和HOO·[公式(2)],HOO·分解成H2O2和O2[公式(3)],H2O2又可以和e-反应生成·OH和OH-[公式(4)],VB的h+可以和TiO2表面的OH-和H2O氧化生成·OH[公式(5)],此过程中产生的自由基(h+、·OH、
和H2O[公式(1)],生成OH-和HOO·[公式(2)],HOO·分解成H2O2和O2[公式(3)],H2O2又可以和e-反应生成·OH和OH-[公式(4)],VB的h+可以和TiO2表面的OH-和H2O氧化生成·OH[公式(5)],此过程中产生的自由基(h+、·OH、![]() 具有强氧化性,可与底物中污染物反应,破坏它们的结构,使其发生裂解,最终降解为小分子物质、CO2和H2O。
具有强氧化性,可与底物中污染物反应,破坏它们的结构,使其发生裂解,最终降解为小分子物质、CO2和H2O。
e-+O2→·O2-+H2O
(1)
(2)
2HOO·→H2O2+O2
(3)
H2O2+e-→·OH+OH-
(4)
h++OH-/H2O→·OH
(5)
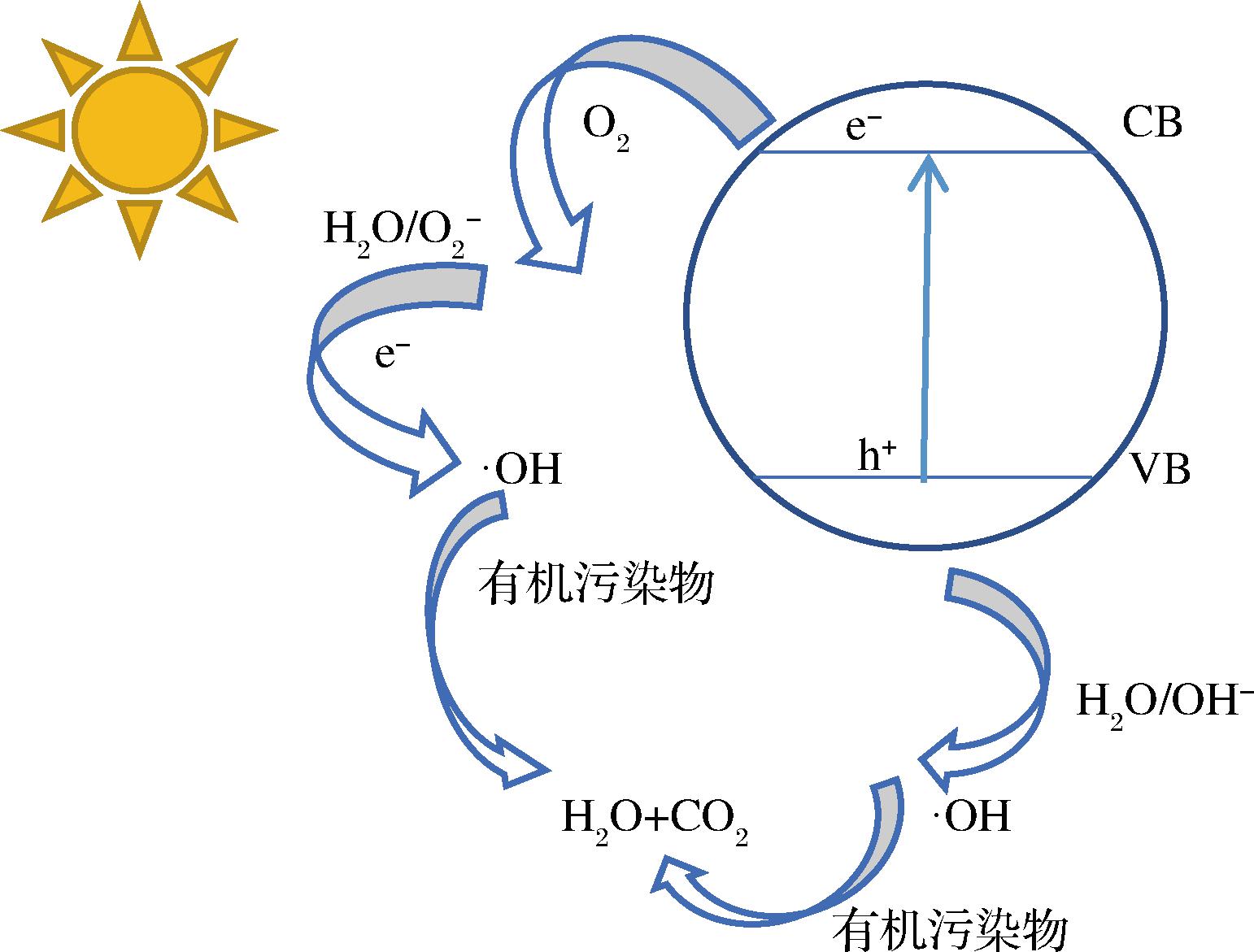
图3 光催化降解有机污染物的反应机理
Fig.3 Reaction mechanism of photocatalytic degradation of organic pollutants
2.2 光催化降解真菌毒素的应用研究现状
随着光催化降解技术在去除农残等有机污染物上的成功应用以及人们对真菌毒素引起的食品安全问题的日益重视,国内外研究人员开始将该技术应用到真菌毒素的有效去除上[41],目前研究较多的是AFB1(aflatoxin B1,AFB1)和DON(deoxynivalenol,DON)。BAI等[30]通过一步水热策略合成了具有高光催化活性的石墨烯/ZnO杂化物,实现了DON在紫外光照射下的高效降解,30 min内降解率约99%。WANG等[42]基于水热策略制备的一种新的树枝状α-Fe2O3光催化剂,可见光照射下2 h内可降解90.3%的DON。MAO等[43]开发的新型纳米复合材料,在可见光照射下可增强对AFB1的光催化降解率。SAMIRA等[44]在紫外光下使用纳米金属氧化物对水溶液和豆奶中的AFB1进行光催化降解,60 min可完全脱除10 μg/L的AFB1。SUN等[45]研究发现,活性炭负载TiO2催化剂(AC/TiO2),在紫外-可见光照射下,对AFB1的降解效率可达98%。
此外,光催化降解技术也被应用到PAT的脱除上,目前光催化降解PAT的研究大多在苹果汁中进行[46]。RODR GUEZ-BENCOMO等[24]在苹果汁中添加谷胱甘肽(GSH)后,通过应用脉冲光处理可以诱导GSH-PAT加合物的形成,降解过程中亚铁离子作为PAT与GSH之间反应的催化剂,可成功降解苹果汁中的PAT。LU等[47]利用紫外光照射下光催化降解模拟苹果汁中的PAT时发现,1 000 mg/L的自制纳米管可在25 min内完全降解模拟苹果汁中1 000 μg/L的PAT。因此,光催化降解PAT具有较大的研究潜力,下面将从影响因素、降解机理、降解动力学和苹果汁品质的变化四个方面系统阐述光催化降解PAT的研究,为进一步完善和发展光催化技术在脱除PAT方面的应用提供理论指导。
GUEZ-BENCOMO等[24]在苹果汁中添加谷胱甘肽(GSH)后,通过应用脉冲光处理可以诱导GSH-PAT加合物的形成,降解过程中亚铁离子作为PAT与GSH之间反应的催化剂,可成功降解苹果汁中的PAT。LU等[47]利用紫外光照射下光催化降解模拟苹果汁中的PAT时发现,1 000 mg/L的自制纳米管可在25 min内完全降解模拟苹果汁中1 000 μg/L的PAT。因此,光催化降解PAT具有较大的研究潜力,下面将从影响因素、降解机理、降解动力学和苹果汁品质的变化四个方面系统阐述光催化降解PAT的研究,为进一步完善和发展光催化技术在脱除PAT方面的应用提供理论指导。
3 光催化降解展青霉素的研究
3.1 影响因素
光催化降解率是光催化反应的主要评价指标之一。在光催化降解PAT的研究中,影响其降解率的因素有很多,如催化剂种类、催化剂用量、PAT初始浓度、光强和波长、pH、温度等。
3.1.1 催化剂种类
催化剂在光催化降解PAT中发挥着重要作用,合适的光催化材料是高效降解PAT的关键。催化剂的选择应以提高反应速率和保持性能稳定为前提。常用的催化剂有二元光催化纳米材料(TiO2、SiO2、Fe2O3、ZnO、CuO等)、三元光催化纳米材料(SrTiO3、CuGaS2、LiTaO3、NaTaO3等)、多组分纳米复合光催化剂(Gr/ZnO、UCNP@TiO2、MGO/TiO2、ZnO-Ag/MWCNT等)以及一些新型材料石墨烯、氧化石墨烯等。目最常用的催化剂是TiO2,但它自身存在一些缺点,如可见光响应率差、自身粉末状难以与基材分离等。因此,有必要对TiO2进行修饰和优化。岳志鹏等[48]利用水热法制备的TiO2纳米管可在25 min内完全降解模拟果汁中初始浓度为1 000 μg/L的PAT,比纯TiO2少用时15 min。LU等[47]通过水热法结合煅烧处理制备得到TiO2纳米管,用以光催化降解模拟果汁中的PAT。结果表明,TiO2纳米管在450、550、650 ℃ 下煅烧后都可在25 min内完全降解模拟果汁中的PAT,而TiO2纳米管、750 ℃下煅烧的TiO2纳米管和纯TiO2的降解率分别为78.60%、88.67%和95.34%,这表明适当的高温煅烧有利于提高TiO2纳米管的光催化活性。黄彩平[49]构建了一种新的氮掺杂壳聚糖-TiO2纳米颗粒作为光催化剂并探讨其对苹果汁中PAT的降解效果时发现,使用纳米TiO2颗粒和氮掺杂壳聚糖-TiO2纳米颗粒作为光催化剂,在紫外辐照下,50 min时PAT降解率分别为77%和100%,氮掺杂壳聚糖-TiO2纳米颗粒相对于TiO2具有增强的光催化降解PAT的活性。综上开发性能优异的光催化材料以解决更大范围食品中PAT的污染问题是未来光催化降解PAT的必要步骤[50]。
3.1.2 催化剂用量
催化剂用量会影响PAT的光催化降解率。岳志鹏等[48]研究TiO2纳米管光催化降解PAT时发现,当TiO2纳米管的投加量为100 mg/L时,光催化降解PAT的效果较差;当TiO2纳米管的投加量从100 mg/L增加到500 mg/L时,PAT的光催化降解率增大;当TiO2纳米管的投加量从500 mg/L增加到1 000 mg/L时,PAT的光催化降解率无明显变化。LU等[47]研究自制纳米管对模拟果汁中PAT的光催化降解时发现将催化剂量从100 mg/L增加到500 mg/L时提高了降解率,但随着投加量增加到1 000 mg/L,降解率下降。黄彩平[49]研究氮掺杂壳聚糖-TiO2纳米颗粒光催化降解苹果汁中PAT时发现当氮掺杂壳聚糖-TiO2纳米颗粒添加量从0.25 g/kg增加到1 g/kg时,PAT的光催化降解率逐渐增大;当添加量为1.0 g/kg时,PAT可在50 min内被完全降解;当添加量从1 g/kg 增加到2.5 g/kg时,PAT的光催化降解率降低。这可能是因为在反应过程中随着催化剂添加量的增加,会增大催化剂的总表面积,进而催化剂表面的活性位点数量也会增加,在紫外光照射下体系中产生可以与底物中PAT发生反应的h+、·OH和![]() 等系列活性氧化物质,从而提高PAT的光催化降解率[51]。可当催化剂添加量提高到超过最佳浓度时降解率不再增加,这是因为过多的催化剂会造成光的透射率降低或者发生光散射现象,导致紫外光的有效剂量降低,且过多催化剂会发生团聚现象,从而降低PAT的光催化降解率。所以进行光催化降解反应时有必要选择一个最佳的催化剂用量[52-53]。
等系列活性氧化物质,从而提高PAT的光催化降解率[51]。可当催化剂添加量提高到超过最佳浓度时降解率不再增加,这是因为过多的催化剂会造成光的透射率降低或者发生光散射现象,导致紫外光的有效剂量降低,且过多催化剂会发生团聚现象,从而降低PAT的光催化降解率。所以进行光催化降解反应时有必要选择一个最佳的催化剂用量[52-53]。
3.1.3 PAT初始浓度
PAT初始浓度也是影响光催化降解率的因素之一。楚璇[54]用紫外光对PAT进行光催化降解时发现,当PAT初始浓度在25~200 μg/L时,PAT降解率逐渐增大;PAT初始浓度在200 μg/L时降解率达到最大;PAT初始浓度在200~250 μg/L时,PAT降解率略有降低。黄彩平[49]研究氮掺杂壳聚糖-TiO2纳米颗粒光催化降解苹果汁中PAT时发现,PAT初始浓度为250~500 μg/kg时,PAT的光催化降解率逐渐增大,PAT在50 min内能被完全降解,当PAT初始浓度继续增加时,PAT在50 min内不能被完全降解。这可能是因为随着PAT初始浓度的增加,在紫外光激发下光催化剂产生的活性物质与PAT反应,实现对PAT的降解;当PAT初始浓度超过一定程度时,体系中的活性物质逐渐被消耗,不足以完全降解PAT[55]。因此,为了实现对PAT的高效降解,应选择适量的催化剂光催化降解不同初始浓度的PAT。
3.1.4 光强和波长
光催化降解率受光强的影响较大。LU等[47]研究自制纳米管对模拟苹果汁中PAT的光催化降解效果时发现紫外光强度是影响PAT降解速率的主要因素,当紫外灯功率从7 W增加到21 W时,改善了光催化降解速率,这与岳志鹏在研究紫外灯功率对PAT降解效果时结论一致[48]。黄彩平[49]研究发现,紫外光下当紫外功率从2 W增加到6 W时,氮掺杂壳聚糖-TiO2纳米颗粒对PAT的光催化降解率显著增大;当紫外功率从6 W增加到10 W时,PAT的光催化降解率变化不大。因此光强在一定范围内对催化效率有提高作用。在低光强度下,有限的光子能量激发产生有限的自由基;随着光强度的增加,催化剂表面被激发产生丰富的e--h+,进而产生更多的自由基。随着自由基的增加,底物分子与活性自由基之间的反应变得剧烈,底物分子被氧化的可能性增加,最终表现为光催化降解率的提高。然而,当光强超过最佳范围时,它不再是光催化降解率的限制因素,而且光强度过大时,光照温度升高会导致e--h+复合,使光催化降解率降低[56]。
除了光强,波长也是光催化降解率的影响因素[57]。目前对PAT的光催化降解大多使用的是紫外光。紫外光波长范围是200~400 nm,不同波长的紫外光照射也会影响PAT的降解率。楚璇[54]采用2种 波长的紫外光对PAT进行光催化降解时发现,10 min照射后,254 nm紫外光下PAT降解率是55.28%,365 nm紫外光下PAT几乎无降解,降解率仅为1.71%。ZHONG等[58]研究PAT在不同紫外线波长下的降解动力学时,发现在3种紫外光波长(222、254、282 nm)以及这些波长的组合下,光催化降解可减少苹果汁中90%的PAT,比单一一种紫外光照射下的降解率高,由此可见,使用最佳光照强度和波长是保证PAT光催化降解率的重要手段。
3.1.5 pH
光催化降解率受pH的影响较大。在光催化降解反应中,溶液体系的pH可影响催化剂表面电荷,从而影响体系中的氧化还原反应速率[59]。LU等[47]研究自制纳米管对模拟果汁中PAT时发现反应体系的pH值是影响PAT降解速率的主要因素,随着pH从3增加到5,降解速率也显著增加。IBARZ等[60]研究在200~350 nm光照下PAT的降解率时得出结论,该反应在酸性pH值(pH=4)比中性值(pH=7)表现出更快的反应速率。一般来说,溶液中·OH的数量随着pH值的增加而增加,从而提高了PAT的光催化降解速率,但过高的pH值又会增大材料表面的电荷斥力,减少吸附底物的量,对光降解速率产生不利影响[55]。因此,适宜的pH范围对光催化降解PAT有积极的作用。
3.1.6 温度
温度会影响PAT的光催化降解率。岳志鹏等[48]研究苹果汁中PAT紫外降解时设置了3个温度梯度(4、20、40 ℃),结果显示当反应温度从4 ℃ 增加到20 ℃时,PAT的光催化降解率增大;当反应温度从20 ℃增加到40 ℃时,PAT的光催化降解率变化不大。黄彩平[49]研究氮掺杂壳聚糖-TiO2纳米颗粒光催化降解苹果汁中的PAT时发现,反应温度从4 ℃增加到25 ℃时,PAT光催化降解率逐渐增大;反应温度从25 ℃增加到35 ℃时,PAT光催化降解率变化不明显。LU等[47]研究不同反应条件下自制纳米管对模拟苹果汁中PAT的光催化降解时也发现,反应温度从20 ℃升至40 ℃比体系温度从4 ℃升至20 ℃时,PAT的光催化降解率更缓慢。这可能因为,随着温度的升高,光催化剂在紫外光照射下产生的活性物质在较高温度下活性更高,温度升高增加了活性物质与体系中PAT的碰撞频率,从而提高了PAT的光催化降解率[38];但当温度再继续增大时,光催化剂降解PAT的反应对反应温度依赖性不强,同时当反应温度过高时还会影响果汁的品质,易造成果汁营养损失、风味劣变等。因此适宜的温度同样可以提高PAT的光催化降解率。
3.2 降解机理
随着光催化降解技术在脱除果汁中PAT的普及,对降解后的产物的分析成为了研究者目前关注的重点。黄彩平[49]开展活性捕获剂实验时发现·OH是氮掺杂壳聚糖-TiO2光催化降解PAT过程中起主要作用的活性物质。光催化降解PAT不是直接将PAT矿化为CO2和H2O,而是产生了2种新的降解产物,其分子组成分别为C7H6O5和C5H6O4。降解机理是PAT的六元内酯环被·OH自由基破坏,六元内酯环打开并加上一分子水生成C7H6O5,随后被进一步氧化裂解为小分子有机酸,并最终氧化为CO2和H2O。HU等[61]在此研究基础上借助分子模拟计算进一步验证了在模拟果汁环境中![]() 是光催化降解PAT的主要活性物质,并推测了可能的降解途径:PAT的内酯键最先被攻击降解为C7H8O5,之后C7H8O5被氧化为C7H7O9,C7H7O9极不稳定,继续被降解为C5H8O3和C4H8O3,这两个中间产物进一步被降解为乙酸乙酯、丙三醇、3-戊醇-2,4-二酮和二甘醇酸;此外,C7H8O5也可直接被降解为乙醛酸和草酸;最终这些小分子酸、醇、酯等物质在光催化过程中被完全分解为CO2和H2O。YANG等[62]考察了以Fe/Zn金属有机骨架为前驱体制备的一种碳磁性杂化复合材料,在光催化降解PAT时发现,·OH和
是光催化降解PAT的主要活性物质,并推测了可能的降解途径:PAT的内酯键最先被攻击降解为C7H8O5,之后C7H8O5被氧化为C7H7O9,C7H7O9极不稳定,继续被降解为C5H8O3和C4H8O3,这两个中间产物进一步被降解为乙酸乙酯、丙三醇、3-戊醇-2,4-二酮和二甘醇酸;此外,C7H8O5也可直接被降解为乙醛酸和草酸;最终这些小分子酸、醇、酯等物质在光催化过程中被完全分解为CO2和H2O。YANG等[62]考察了以Fe/Zn金属有机骨架为前驱体制备的一种碳磁性杂化复合材料,在光催化降解PAT时发现,·OH和![]() 是光降解过程中的主要活性自由基。CHANDRA等[63]表明,254 nm的紫外光下可有效地降解苹果汁中的PAT,然而,紫外降解产物尚未确定,分解途径仍不清楚。目前对降解产物的研究不足,大多仅分析出实验过程中活性自由基的作用,未来需继续探索PAT的光催化降解产物及其毒性。
是光降解过程中的主要活性自由基。CHANDRA等[63]表明,254 nm的紫外光下可有效地降解苹果汁中的PAT,然而,紫外降解产物尚未确定,分解途径仍不清楚。目前对降解产物的研究不足,大多仅分析出实验过程中活性自由基的作用,未来需继续探索PAT的光催化降解产物及其毒性。
3.3 降解动力学
光催化降解PAT的过程一般都遵循一级动力学Langmuir-Hinshelwood模型,简称L-H模型[公式(6)]。
(6)
[:θ,反应物在催化剂表面的吸附率,%;k,理论一级速率常数,mg/μL;K,表面吸附平衡常数,mg/μL;C,溶液中反应物的质量浓度,μg/mL。
当吸附分子在催化剂表面吸附浓度很低或吸附很弱时,即KC<<1,公式(6)可简化为:
(7)
将公式(7)积分可得:
ln(C0/Ct)=kKt=k·t
(8)
[:C0,毒素初始质量浓度,μg/mL;Ct,t min的毒素质量浓度,μg/mL;t,反应时间,min。
当吸附分子在催化剂表面吸附很强时,即KC>>1,公式(6)可简化为:
r=k·θ=k
(9)
在IBARZ等[60]之前的研究中,PAT可以被紫外光光催化降解,该降解反应遵循一级动力学Langmuir-Hinshelwood模型,降解过程中拟合出的一级动力学常数表明,温度越高,数值越高,该模型与实验数据相匹配,拟合效果非常好。LU等[47]研究自制纳米管对模拟拟果汁中PAT的光催化降解时也发现该反应符合一级动力学Langmuir-Hinshelwood模型。同样BAI等[30]通过紫外线照射也成功降解PAT,并比较了在苹果汁和苹果酒2种基质中的动力学模型,结果显示都非常符合一级动力学Langmuir-Hinshelwood模型,但在苹果汁中的降解动力学常数比在苹果酒中的大5.5倍左右。
3.4 苹果汁品质的变化
果汁的色泽、口感、香气和营养成分等会直接影响果汁的价值。现有的脱除PAT方法大多会影响果汁的感官、理化指标等,引起果汁品质劣变,降低果汁商品价值,造成巨大损失[44]。但IBARZ等[60]研究紫外光照射对果汁的影响时,没有观察到pH值、可溶性固形物含量、甲醛指数、总酚和糖的变化,唯一改变的是维生素C含量。楚璇[54]采用紫外光对苹果汁中PAT进行光催化降解时发现,紫外辐照对苹果汁的密度、浊度、pH、总酸度、可溶性固形物含量、还原糖含量均无显著影响;而苹果汁透光率在紫外辐照15 min后显著变化,苹果汁色泽在紫外辐照15 min后显著变化;苹果汁维生素C含量在紫外辐照10 min后显著变化;黄彩平[49]通过分析光催化降解PAT过程中苹果汁感官指标、理化指标、营养功能指标的变化时发现,氮掺杂壳聚糖-TiO2纳米颗粒光催化降解PAT时可以减少苹果汁的褐变,并使苹果汁的颜色向有利方向变化,同时反应前后苹果汁的滋味无明显变化,但苹果汁的香气发生了改变;反应后苹果汁中的可溶性固形物含量以及浊度显著增加,pH和可滴定酸含量无显著变化;反应后苹果汁中还原糖和维生素C的含量无显著变化,总黄酮含量显著增加,但总酚含量显著下降。相对于常规处理的果汁,紫外光照射可从处理过的苹果汁和苹果酒中去除90%以上的PAT,但不能忽视维生素C和其他光敏物质损失的风险。因此对光催化降解后苹果汁品质的评价也十分重要。
4 小结
本研究介绍PAT的理化性质、生物合成、危害和污染现状时表明PAT主要污染于水果及其制品,尤其是苹果。当机体摄入一定量的PAT时,会对机体产生毒性影响。而PAT的化学性质稳定,常规的物理、化学、生物手段难以将其从水果及其制品中脱除。光催化降解技术因其高效、易于操作、重复性好、无毒、经济等优点成为了近年降解PAT的研究热点。但光催化降解技术中用到的光催化剂在PAT污染控制方面的应用尚处于起步阶段,现有合成的大多数光催化剂都是难以回收的粉末,而在实际食品基质中应用时应当考虑光催化材料的回收以及粉末光催化剂在回收过程中的损失对人类或动物细胞产生的毒性作用,这些未知的后果可能会限制其在食品安全领域的广泛应用。因此,需要开发具有良好生物相容性和无毒的新型纳米材料,以有效、安全地控制PAT的污染。此外,现有研究主要关注降解率,未来还应更多探索光催化降解PAT的作用机制,进行动物实验或体外细胞实验等评估降解产物毒性,关注光催化降解中间产物等是否对食品质量和人体健康存在潜在影响以及评价光催化降解处理前后食品关键性质量指标的变化情况,如感官指标、理化指标等,保障食品本身的安全健康、营养价值、风味口感、货架期等。
[1] GARNIER L,VALENCE F,PAWTOWSKI A,et al.Diversity of spoilage fungi associated with various French dairy products[J].International Journal of Food Microbiology,2017,241:191-197.
[2] OROIAN M,AMARIEI S,GUTT G.Patulin in apple juices from the Romanian market[J].Food Additives &Contaminants:Part B,2014,7(2):147-150.
[3] LI X J,LI H M,LI X M,et al.Determination of trace patulin in apple-based food matrices[J].Food Chemistry,2017,233:290-301.
[4] DIAO E J,WANG J S,LI X Y,et al.Effects of ozone processing on patulin,phenolic compounds and organic acids in apple juice[J].Journal of Food Science and Technology,2019,56(2):957-965.
[5] 王利平,王丽霞,刘保友,等.苹果及其制品中展青霉素研究进展[J].落叶果树,2022,54(3):39-43.WANG L P,WANG L X,LIU B Y,et al.Research progress on patulin in apple and its products[J].Deciduous Fruits,2022,54(3):39-43.
[6] SMITH E E,DUFFUS E A,SMALL M H.Effects of patulin on postimplantation rat embryos[J].Archives of Environmental Contamination and Toxicology,1993,25(2):267-270.
[7] 郭彩霞,张生万,李美萍.苹果及其制品中展青霉素生物防治研究进展[J].食品科学,2015,36(7):283-288.GUO C X,ZHANG S W,LI M P.Recent progress in research biological control of patulin contamination in apple and its products[J].Food Science,2015,36(7):283-288.
[8] KHAN R,BEN AISSA S,SHERAZI T A,et al.Development of an impedimetric aptasensor for label free detection of patulin in apple juice[J].Molecules,2019,24(6):1017.
[9] 张欣怡,王威浩,邓丽莉,等.水果及其制品中展青霉素的研究进展[J].食品工业科技,2017,38(11):379-384.ZHANG X Y,WANG W H,DENG L L,et al.Research progress in patulin of fruits and its products[J].Science and Technology of Food Industry,2017,38(11):379-384.
[10] LUO Y,LIU X J,LI J K.Updating techniques on controlling mycotoxins-A review[J].Food Control,2018,89:123-132.
[11] QIU Y,ZHANG Y X,WEI J P,et al.Thiol-functionalized inactivated yeast embedded in agar aerogel for highly efficient adsorption of patulin in apple juice[J].Journal of Hazardous Materials,2020,388:121802.
[12] CHEN Y,ZHANG Z Q,LI B Q,et al.PeMetR-mediated sulfur assimilation is essential for virulence and patulin biosynthesis in Penicillium expansum[J].Environmental Microbiology,2021,23(9):5555-5568.
[13] LYNEN F,TADA M.Die biochemischen grundlagen der “Polyacetat-regel”[J].Angewandte Chemie,1961,73(15):513-519.
[14] LIGHT R J.6-Methylsalicylic acid decarboxylase from Penicillium patulum[J].Biochimica et Biophysica Acta (BBA)-Enzymology,1969,191(2):430-438.
[15] ARTIGOT M P,LOISEAU N,LAFFITTE J,et al.Molecular cloning and functional characterization of two CYP619 cytochrome P450s involved in biosynthesis of patulin in Aspergillus clavatus[J].Microbiology,2009,155(Pt 5):1738-1747.
[16] JAYASHREE G V,KRUPASHREE K,RACHITHA P,et al.Patulin induced oxidative stress mediated apoptotic damage in mice,and its modulation by green tea leaves[J].Journal of Clinical and Experimental Hepatology,2017,7(2):127-134.
[17] DICKENS F,JONES H E.Carcinogenic activity of a series of reactive lactones and related substances[J].British Journal of Cancer,1961,15(1):85-100.
[18] ZHU Y,KOUTCHMA T,WARRINER K,et al.Reduction of patulin in apple juice products by UV light of different wavelengths in the UVC range[J].Journal of Food Protection,2014,77(6):963-971.
[19] HASAN H A H.Patulin and aflatoxin in brown rot lesion of apple fruits and their regulation[J].World Journal of Microbiology and Biotechnology,2000,16(7):607-612.
[20] LINDROTH S,NISKANEN A.Comparison of potential patulin hazard in home-made and commercial apple products[J].Journal of Food Science,1978,43(2):446-448.
[21] HARRISON M.Presence and stability of patulin in apple products:A review[J].Journal of Food Safety,1988,9:147-153.
[22] ZOUAOUI N,SBAII N,BACHA H,et al.Occurrence of patulin in various fruit juice marketed in Tunisia[J].Food Control,2015,51:356-360.
[23] 杨其亚,张红印,庞水秀,等.拮抗酵母菌控制水果及其制品中展青霉素研究进展[J].食品科学,2012,33(7):350-353.YANG Q Y,ZHANG H Y,PANG S X,et al.Research progress of patulin in fruits and fruit products with antagonistic yeast[J].Food Science,2012,33(7):350-353.
[24] RODR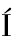 GUEZ-BENCOMO J J,SANCHIS V,VI
GUEZ-BENCOMO J J,SANCHIS V,VI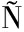 AS I,et al.Formation of patulin-glutathione conjugates induced by pulsed light:A tentative strategy for patulin degradation in apple juices[J].Food Chemistry,2020,315:126283.
AS I,et al.Formation of patulin-glutathione conjugates induced by pulsed light:A tentative strategy for patulin degradation in apple juices[J].Food Chemistry,2020,315:126283.
[25] 薛华丽,毕阳,宗元元,等.果蔬及其制品中真菌毒素的污染与检测研究进展[J].食品科学,2016,37(23):285-290.XUE H L,BI Y,ZONG Y Y,et al.Progress in mycotoxins contamination and detection in fruits and vegetables and their processed products[J].Food Science,2016,37(23):285-290.
[26] PANKAJ S K,SHI H,KEENER K M.A review of novel physical and chemical decontamination technologies for aflatoxin in food[J].Trends in Food Science &Technology,2018,71:73-83.
[27] PAIMARD G,MOHAMMADI R,BAHRAMI R,et al.Detoxification of patulin from juice simulator and apple juice via cross-linked Se-chitosan/L-cysteine nanoparticles[J].LWT,2021,143:111146.
[28] ZHANG Z,ZENG C,PENG B Z.Adsorption properties of magnetic carbon nanotubes for patulin removal from aqueous solution systems[J].Food Control,2019,102:1-10.
[29] JANEKBARY K K,GILANI N,PIRBAZARI A E.One-step fabrication of Ag/RGO doped TiO2 nanotubes during anodization process with high photocatalytic performance[J].Journal of Porous Materials,2020,27(6):1809-1822.
[30] BAI X J,SUN C P,LIU D,et al.Photocatalytic degradation of deoxynivalenol using graphene/ZnO hybrids in aqueous suspension[J].Applied Catalysis B:Environmental,2017,204:11-20.
[31] 王岚,刘娜,余佃贞,等.食品中展青霉素脱除方法研究进展[J].中国食品卫生杂志,2019,31(6):597-601.WANG L,LIU N,YU (D/T)Z,et al.Advances on the clearance and detoxification of patulin in foods[J].Chinese Journal of Food Hygiene,2019,31(6):597-601.
[32] DENG L Z,TAO Y,MUJUMDAR A S,et al.Recent advances in non-thermal decontamination technologies for microorganisms and mycotoxins in low-moisture foods[J].Trends in Food Science &Technology,2020,106:104-112.
[33] YAZICI S,VELIOGLU Y S.Effect of thiamine hydrochloride,pyridoxine hydrochloride and calcium-d-pantothenate on the patulin content of apple juice concentrate[J].Die Nahrung,2002,46(4):256-257.
[34] MILLER F A,SILVA C L M,BRAND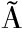 O T R S.A review on ozone-based treatments for fruit and vegetables preservation[J].Food Engineering Reviews,2013,5(2):77-106.
O T R S.A review on ozone-based treatments for fruit and vegetables preservation[J].Food Engineering Reviews,2013,5(2):77-106.
[35] LIU B,GE N,PENG B Z,et al.Kinetic and isotherm studies on the adsorption of tenuazonic acid from fruit juice using inactivated LAB[J].Journal of Food Engineering,2018,224:45-52.
[36] CHEN Y X,YANG J L,ZENG L X,et al.Recent progress on the removal of antibiotic pollutants using photocatalytic oxidation process[J].Critical Reviews in Environmental Science and Technology,2022,52(8):1401-1448.
[37] GUO C X,YUE T L,YUAN Y H,et al.Biosorption of patulin from apple juice by caustic treated waste cider yeast biomass[J].Food Control,2013,32(1):99-104.
[38] HATAB S,YUE T,MOHAMAD O.Removal of patulin from apple juice using inactivated lactic acid bacteria[J].Journal of Applied Microbiology,2012,112(5):892-899.
[39] CAREY J H,LAWRENCE J,TOSINE H M.Photodechlorination of PCB’s in the presence of titanium dioxide in aqueous suspensions[J].Bulletin of Environmental Contamination and Toxicology,1976,16(6):697-701.
[40] LI N,LI Y M,LI W J,et al.One-step hydrothermal synthesis of TiO2@MoO3 core-shell nanomaterial:Microstructure,growth mechanism,and improved photochromic property[J].The Journal of Physical Chemistry C,2016,120(6):3341-3349.
[41] 施晶晶,刘宽博,王永伟,等.光催化技术降解粮油中真菌毒素的研究进展[J].粮油食品科技,2021,29(2):66-70.SHI J J,LIU K B,WANG Y W,et al.Recent advances in mycotoxin degradation by photocatalytic technology in grain and oil[J].Science and Technology of Cereals,Oils and Foods,2021,29(2):66-70.
[42] WANG H T,MAO J,ZHANG Z W,et al.Photocatalytic degradation of deoxynivalenol over dendritic-like α-Fe2O3 under visible light irradiation[J].Toxins,2019,11(2):105.
[43] MAO J,LI P W,WANG J M,et al.Insights into photocatalytic inactivation mechanism of the hypertoxic site in aflatoxin B1 over clew-like WO3 decorated with CdS nanoparticles[J].Applied Catalysis B:Environmental,2019,248:477-486.
[44] RAESI S,MOHAMMADI R,KHAMMAR Z,et al.Photocatalytic detoxification of aflatoxin B1 in an aqueous solution and soymilk using nano metal oxides under UV light:Kinetic and isotherm models[J].LWT,2022,154:112638.
[45] SUN S M,ZHAO R,XIE Y L,et al.Photocatalytic degradation of aflatoxin B1 by activated carbon supported TiO2 catalyst[J].Food Control,2019,100:183-188.
[46] TIKEKAR R V,ANANTHESWARAN R C,LABORDE L F.Patulin degradation in a model apple juice system and in apple juice during ultraviolet processing[J].Journal of Food Processing and Preservation,2014,38(3):924-934.
[47] LU X J,YUE Z P,PENG B Z.Preparation of TiO2-nanotube-based photocatalysts and degradation kinetics of patulin in simulated juice[J].Journal of Food Engineering,2022,323:110992.
[48] 岳志鹏,黄彩平,张菡,等.二氧化钛纳米管光催化降解苹果汁中展青霉素的工艺优化[J].食品工业科技,2020,41(17):212-218.YUE Z P,HUANG C P,ZHANG H,et al.Process optimization on photocatalytic degradation of patulin in apple juice by titanium dioxide nanotubes[J].Science and Technology of Food Industry,2020,41(17):212-218.
[49] 黄彩平.氮掺杂壳聚糖-TiO2纳米颗粒光催化降解苹果汁中的展青霉素及其安全性评价[D].武汉:华中农业大学,2021:19.HUANG C P.Photocatalytic degradation of patulin in apple juice by nitrogen-doped chitosan-TiO2 nanoparticles and its safety evaluation[D].Wuhan:Huazhong Agricultural University,2021:19.
[50] 娄秀萍,黄晴雯,范楷,等.基于半导体材料的光催化降解真菌毒素研究进展[J].食品科学,2023,44(17):294-304.LOU X P,HUANG Q W,FAN K,et al.Research progress on photocatalytic degradation of mycotoxins based on semiconductor materials[J].Food Science,2023,44(17):294-304.
[51] ABDEL-KHALEK A A,MAHMOUD S A,ZAKI A H.Visible light assisted photocatalytic degradation of crystal violet,bromophenol blue and eosin Y dyes using AgBr-ZnO nanocomposite[J].Environmental Nanotechnology,Monitoring &Management,2018,9:164-173.
[52] ABDEL-MAKSOUD Y,IMAM E,RAMADAN A.TiO2 solar photocatalytic reactor systems:Selection of reactor design for scale-up and commercialization—Analytical review[J].Catalysts,2016,6(9):138.
[53] GIMÉNEZ J,CURC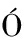 D,QUERAL M A.Photocatalytic treatment of phenol and 2,4-dichlorophenol in a solar plant in the way to scaling-up[J].Catalysis Today,1999,54(2-3):229-243.
D,QUERAL M A.Photocatalytic treatment of phenol and 2,4-dichlorophenol in a solar plant in the way to scaling-up[J].Catalysis Today,1999,54(2-3):229-243.
[54] 楚璇.苹果汁中棒曲霉素紫外降解及安全性评价[D].泰安:山东农业大学,2017:21.CHU X.Ultraviolet degradation and safety evaluation of patulin in apple juice[D].Taian:Shandong Agricultural University,2017:21.
[55] 马亚云,龙海涛,杜明远,等.辉光放电等离子体对葡萄汁中棒曲霉素的降解作用[J].生物技术进展,2019,9(2):191-199.MA Y Y,LONG H T,DU M Y,et al.Degradation of patulin in grape juice by glow discharge plasma[J].Current Biotechnology,2019,9(2):191-199.
[56] 刘满顺.展青霉素高效吸附剂的设计合成及其性能评价[D].杨凌:西北农林科技大学,2021.LIU M S.Design,synthesis and performance evaluation of patulin high-efficiency adsorbent[D].Yangling:Northwest A &F University,2021.
[57] JIA G Z,WANG G X,ZHANG Y,et al.Effects of light intensity and H2O2 on photocatalytic degradation of phenol in wastewater using TiO2/ACF[C].2010 International Conference on Digital Manufacturing &Automation.IEEE,2010:623-626.
[58] ZHONG L,CARERE J,LU Z X,et al.Patulin in apples and apple-based food products:The burdens and the mitigation strategies[J].Toxins,2018,10(11):475.
[59] KOE W S,LEE J W,CHONG W C,et al.An overview of photocatalytic degradation:Photocatalysts,mechanisms,and development of photocatalytic membrane[J].Environmental Science and Pollution Research International,2020,27(3):2522-2565.
[60] IBARZ R,GARV N A,FALGUERA V,et al.Modelling of patulin photo-degradation by a UV multi-wavelength emitting lamp[J].Food Research International,2014,66:158-166.
N A,FALGUERA V,et al.Modelling of patulin photo-degradation by a UV multi-wavelength emitting lamp[J].Food Research International,2014,66:158-166.
[61] HU C,HUANG C P,PENG B Z.Study on the mechanism of photocatalytic degradation of patulin in simulated apple juice[J].Food Chemistry,2023,426:136592.
[62] YANG X B,PAN J J,HU J P,et al.MOF-derived La-ZnFe2O4@Fe3O4@carbon magnetic hybrid composite as a highly efficient and recyclable photocatalyst for mycotoxins degradation[J].Chemical Engineering Journal,2023,467:143381.
[63] CHANDRA S,PATRAS A,POKHAREL B,et al.Patulin degradation and cytotoxicity evaluation of UV irradiated apple juice using human peripheral blood mononuclear cells[J].Journal of Food Process Engineering,2017,40(6):e12586.