可得然胶(curdlan)是由微生物发酵产生的一种胞外无分支均一的β-1,3-葡聚糖,由于具有在加热条件下形成凝胶的独特性质,故又称作热凝胶[1]。可得然胶属于β-1,3-葡聚糖家族中较为特殊的一种,其分子结构如图1所示。一般情况下,每个curdlan分子由300~500个葡萄糖残基组成,分子式为(C6H10O5)n,n> 250[2]。添加量一般在0.1%~4%,广泛应用于食品加工、养殖业、油田三次采油、生物制药、医药中间体、日化等领域,是目前国内高端食品制造业中不可替代的优质原辅料。
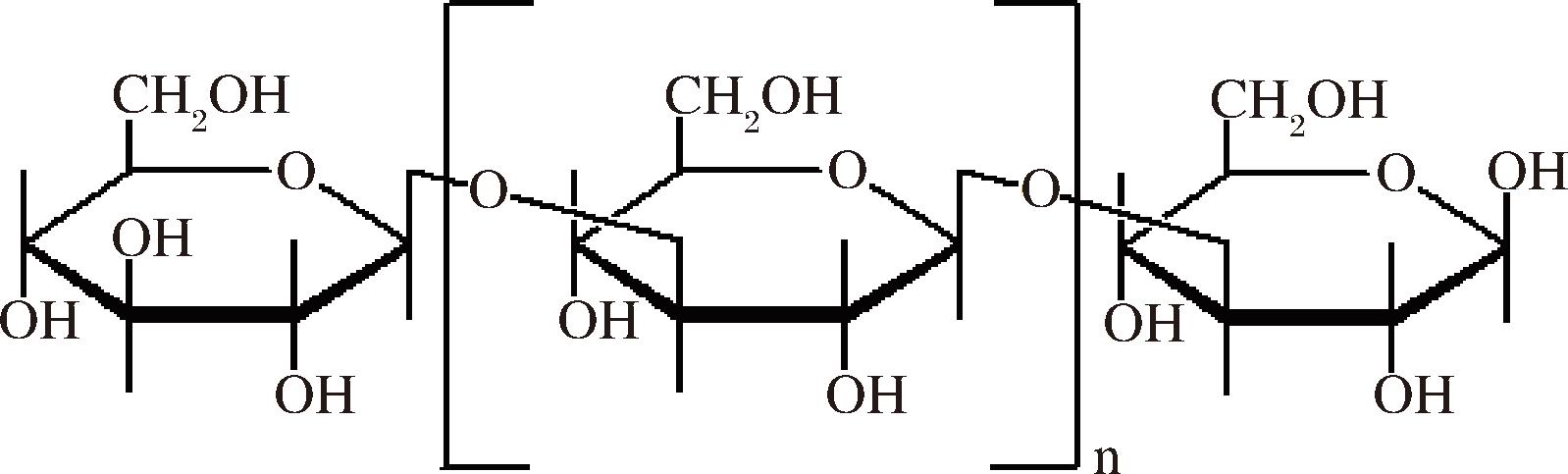
图1 可得然胶分子结构
Fig.1 Molecular structure of curdlan
可得然胶的水悬液在不同温度条件下可形成结构、性质不同的低强度热可逆凝胶或高强度热不可逆凝胶[3],在应用时主要应用其高强度热不可逆凝胶的特性[4]。可得然胶是由TOKUYA等[5]在1966年首次发现并报道,并于1996年被美国FDA批准可作为食品添加剂应用,中国于2006年批准其作为新型食品添加剂,且允许的使用范围逐年扩展[6]。目前报道的可得然胶生物合成菌种一般有农杆菌[7]、根瘤菌[8]、粪肠杆菌[9]及芽孢杆菌[10]等,其中已实现工业化大规模生产的一般为农杆菌(Agrobacterium sp.) ATCC31749。国内对于可得然胶发酵生产的研究起步较晚,但发展迅速,近十年来在高产菌种选育与改造[11-13]、高产控制策略[14-16]、分离提取技术[17]等各方面报道了诸多创新研究成果,为微生物多糖可得然胶产业的发展提供了助力,但目前可得然胶凝胶强度低[18],产业发展迟缓等一系列瓶颈难题。农杆菌中的β-1,3-葡聚糖酶基因exoK对可得然胶的分子质量和凝胶强度具有影响,故可以通过同源重组的方法对该基因进行突变,以获得高凝胶强度的可得然胶。基于上述问题,本研究在现有工业化生产菌株与培养基的基础上,通过对可得然胶的生产菌株exoK基因进行突变并对其培养基进行理性深度优化,显著提高可得然胶的发酵产率、凝胶强度及生产效率,希望能对国内可得然胶生产企业在发酵生产技术的改善和提高以及生产成本的降低提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂菌株与质粒
实验菌株与质粒见表1。
表1 实验菌株与质粒
Table 1 Experimental strain and plasmid

菌株或质粒基因型/表型来源菌株Agrobacteriumsp.ATCC31749curdlan本实验室保存At-ΔexoKgeneexoKdeficientstrain本研究构建LQC22G(At-ΔexoK)highsugarfermentation本研究构建DH5αsupE44,DlacU169(φ80lacZDM15)hsdR17,recA1,endA1,gyrA96,thi-1,relA1,λ-北京全式金生物技术公司质粒pk18mobsacBsuicidevector,KanR本实验室保存pk18mobsacB-ΔexoKpk18mobsacBderivativecarryingΔexoK,KanR本研究构建引物exoK-FATGTTGCGAACAAACGGAATexoKexoK-RTTAGTTGAGGGCGCAGGCGAexoKexoK-F1AACAGCTATGACATGATTACGAATTCCGACAGAGGTGAACCAATGAK-FexoK-R1TAGGTGAAGAAGGCGGGCCTTGGCCTCCTCGAAACCK-FexoK-F2CGAGGAGGCCAAGGCCCGCCTTCTTCACCTATATCK-RexoK-R2TTGCATGCCTGCAGGTCGACTCTAGAGGGCGTTTTGCGGGATTTTCK-R
1.1.2 实验试剂
蔗糖、磷酸二氢钾、磷酸氢二铵、碳酸钙、硫酸镁、氯化钠,分析纯,天津科密欧化学试剂有限公司;蛋白胨,生化试剂,南通东海龙生生物制品有限公司;牛肉膏,生化试剂,北京奥博星生物科技有限公司;玉米浆,生化试剂,安琪酵母股份有限公司;无水乙醇,分析纯,国药集团化学试剂有限公司;二甲基亚砜(色谱纯),上海麦克林生化科技有限公司;卡那霉素、T4连接酶,宝日医生物技术(北京)有限公司;Fastpfu Mix DNA Polymerase,北京全式金生物技术股份有限公司;限制性内切酶,赛默飞世尔科技(美国);细菌基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒、质粒小提试剂盒、DNA产物纯化试剂盒,天根生化科技(北京)有限公司。
1.1.3 培养基
种子培养基(g/L):蔗糖20.0;玉米浆粉1.5;磷酸氢二铵5.0;磷酸二氢钾1.5;硫酸镁1.0;碳酸钙3.0;pH 7.0。培养条件:30 ℃,摇瓶培养,转速300 r/min,培养18~20 h。
在ZHANG等[19]发酵培养基基础上,本实验室对培养基进行优化,得到基础发酵培养基(g/L):蔗糖50.0;玉米浆粉1.0;磷酸氢二铵4.0;磷酸二氢钾2.0;硫酸镁2.0;碳酸钙2.0;pH 7.0。培养条件:500 mL三角瓶发酵培养液100 mL,接种量10%,摇床振荡培养,30 ℃,转速300 r/min,培养96 h。
LB培养基(g/L):胰蛋白胨10;酵母浸出物5;氯化钠10;pH 7.0;固体LB培养基加入琼脂粉15。以上培养基灭菌条件均为:121 ℃灭菌20 min。
1.2 仪器与设备
5804R冷冻离心机,美国艾本德公司;DW-86L416G超低温冰箱,青岛海尔公司;CF9.9恒温摇床,上海智城分析仪器制造有限公司;HCB-900V洁净工作台,上海甄明科学仪器有限公司;PHS-25数字式酸度计,大龙兴创实验仪器(北京)有限公司;PCR扩增仪,德国耶拿分析仪器股份公司;电泳仪,北京六一生物科技有限公司;凝胶成像仪,上海勤翔科学仪器有限公司;MicroPulser电穿孔仪,Bio-Rad伯乐公司(美国);CT3 1500质构仪,美国博勒飞公司;1260 Infinity II GPC/SEC,德国安捷伦科技公司。
1.3 实验方法
1.3.1 exoK基因片段的克隆及测序
通过NCBI网站查阅到农杆菌β-1,3-葡聚糖酶基因exoK基因序列,通过GeneTool软件设计得到exoK基因的PCR引物,以exoK-F/R为引物,基因组DNA为模板,使用Fastpfu DNA Polymerase高保真DNA聚合酶进行PCR扩增,得到exoK基因。送至北京擎科生物科技股份有限公司对exoK基因进行测序。
1.3.2 自杀重组质粒pk18mobsacB-ΔexoK的构建
敲除质粒是由敲除片段与线性化pK18mobsacB载体连接构成。根据exoK基因测序结果设计引物exoK-F1/exoK-R1和exoK-F2/exoK-R2,以农杆菌基因组DNA为模板,分别扩增exoK基因上下游同源臂序列,exoK基因上游同源臂序列273 bp,下游同源臂序列270 bp,敲除片段总长度为543 bp,以exoK-F1和exoK-R2为引物通过overlap PCR连接exoK基因上下游同源臂片段,切胶回收得到exoK敲除片段,于-20 ℃冰箱保存。转接pk18mobsacB质粒保藏菌于含有卡那霉素的LB液体培养基中,在37 ℃,200 r/min条件下过夜培养,提取质粒,用EcoRⅠ和XbaⅠ两种限制酶于37 ℃下进行酶切,切胶回收得到线性化pK18mobsacB载体。用T4连接酶将线性化pK18mobsacB载体与exoK敲除片段进行连接并通过化学转化法转入DH5α感受态细胞中,涂布含有卡那霉素的LB固体培养基,于37 ℃ LB过夜培养,挑取单克隆并进行PCR验证,将验证成功的转化子转接至含有卡那霉素的LB液体培养基中过夜培养,提质粒进行酶切验证并测序,所有验证通过后得到构建成功的pk18mobsacB-ΔexoK敲除质粒。连接体系如表2所示。
表2 连接体系
Table 2 Connection system

组分体积/μLΔexoK片段3pk18mobsacB线性化载体2T4连接酶5
1.3.3 Agrobacterium sp.ATCC31749 exoK基因缺陷株的构建
转接含有pk18mobsacB-ΔexoK敲除质粒的菌株于含有卡那霉素的LB液体培养基中,37 ℃,220 r/min振荡培养16 h后,提取质粒并对其进行浓度测定。将Agrobacterium sp.ATCC 31749转接于LB液体培养基中,培养至OD值0.6~0.8,取1 mL加入无菌5 mL管中,9 000 r/min离心1 min,去上清液;以水为电转缓冲液,取1 mL电转缓冲液重悬菌体,9 000 r/min离心1 min,去上清液,重复3次,用50 μL电转缓冲液重悬菌体,加入1 000 ng质粒,1.5 kV电击转化,30 ℃复苏2 h,涂布含有卡那霉素的LB平板30 ℃培养箱培养48 h。选取筛选成功的单交换菌落接种于LB液体培养基中,将菌液稀释后涂布添加200 g/L蔗糖的LB固体培养基,30 ℃培养48 h。挑取转化子培养后取菌液以exoK-F1和exoK-R2为引物进行菌落PCR验证。
1.3.4 发酵培养单因素试验
以农杆菌At-ΔexoK为试验菌株,基于基础发酵培养基,研究培养基碳源蔗糖添加量(50、75、100、125、150 g/L);在蔗糖添加量为100 g/L时,无机氮源:磷酸氢二铵的添加量(3、4、5、6、7 g/L);玉米浆粉添加量(0.5、1.0、1.5、2.0、2.5 g/L);无机盐:碳酸钙的添加量(0.4、0.8、1.2、1.6、2.0 g/L);磷酸二氢钾添加量(2、3、4、5、6 g/L);硫酸镁添加量(0.5、1、2、3、4 g/L);培养时间(72、96、120、144 h)对耐高糖菌株可得然胶产率的影响。
1.3.5 Plackett-Burman实验
在单因素试验的基础上,进行Plackett-Burman实验设计如表3所示,分别以蔗糖、磷酸氢二铵、碳酸钙、玉米浆粉、磷酸二氢钾、硫酸镁、发酵时间7因素为因变量,以多糖产率为响应值,筛选对可得然胶生物合成影响较为显著的因素,按照表3设计变量的水平。
表3 Plackett-Burman实验因素与水平
Table 3 Factors and levels of Plackett-Burman tests design
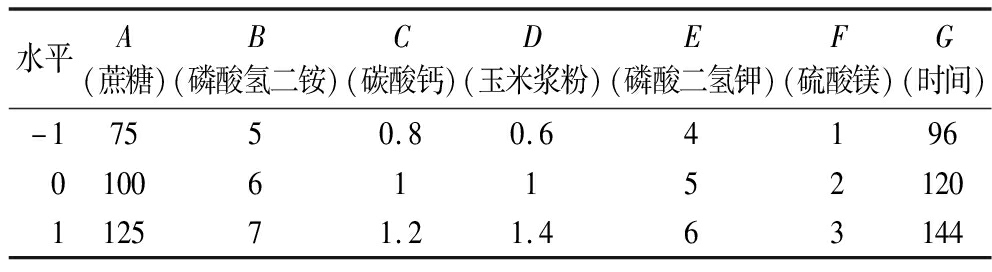
水平A(蔗糖)B(磷酸氢二铵)C(碳酸钙)D(玉米浆粉)E(磷酸二氢钾)F(硫酸镁)G(时间)-17550.80.64196010061152120112571.21.463144
1.3.6 最陡爬坡实验
根据Plackett-Burman实验结果,增加单因素试验,将显著影响因子向最优方向调整,设计更加合理。
1.3.7 发酵条件优化响应面实验
基于最陡爬坡实验结果,以A(蔗糖)、B(磷酸氢二铵)、C(碳酸钙)、D(磷酸二氢钾)为评价因素,以微生物多糖产率(Y)为响应值,通过Design Expert 12软件进行Box-Behnken实验设计(表4)。根据响应面实验结果得出最佳发酵条件,进行摇瓶发酵培养,确定优化结果。
表4 培养基配方优化Box-Behnken实验设计因素及水平
Table 4 Factors and levels of Box-Behnken experiments design for culture conditions optimization

水平A(蔗糖)B(磷酸氢二铵)C(碳酸钙)D(磷酸二氢钾)-11105.50.94.5012061511306.51.15.5
1.3.8 分析方法
1.3.8.1 发酵粗产率测定
可得然胶发酵产率采用重量分析法测定[20]。量取一定体积(V,mL)发酵液5 000 r/min离心5 min,去上清液,沉淀加入2倍体积95%乙醇搅拌混合均匀使多糖充分脱水;再次5 000 r/min离心5 min,去上清液,沉淀再次加入2倍体积95%乙醇搅拌混合均匀,5 000 r/min离心5 min,去上清液,沉淀在60 ℃条件下真空干燥至恒重,所得粗多糖的质量(m,g)。可得然胶产率的计算如公式(1)所示,碳源转化率的计算如公式(2)所示:
可得然胶产率![]()
(1)
碳源转化率![]()
(2)
1.3.8.2 凝胶强度的测定
称取0.2 g粗提得到的产物用10 mL去离子水溶解于试管中,水浴加热到90 ℃以上持续10 min,自来水冷却30 min获得均匀的凝胶。采用TA的压缩模式。使用CT3 1500质构仪测定可得然胶的凝胶强度。探针模型为TA35,测试速度为4 mm/min,返回速度270 mm/min,触发点负载5 g,压缩行程为10 mm,模式为压力。可得然胶凝胶强度的计算如公式(3)所示:
可得然胶凝胶强度![]()
(3)
1.3.8.3 分子质量的测定
使用GPC法测定可得然胶的分子质量,用二甲基亚砜配制质量浓度为5 mg/mL的可得然胶溶液,水浴加热溶解,使用0.22 μm膜过滤以制备样品。使用Agilent 1260 Infinity II GPC/SEC系统测定分子质量,色谱柱PL Polargel-M 7.5 mm×50 mm和PL Polargel-M 7.5 mm×50 mm串联,配有示差折射检测器。流速1 mL/min,柱温45 ℃,流动相为色谱纯DMSO。
1.4 数据处理与分析
采用Design Expert 12和IBM SPSS Statistics 25进行数据处理与分析,采用Origin 2021绘图。
2 结果与分析
2.1 目的基因的鉴定与测序
对Agrobacterium sp.ATCC31749基因组进行PCR得到目的基因ΔexoK,exoK基因大小约为900 bp。图2中电泳的结果也显示与预期片段大小一致,测序大小为870 bp。
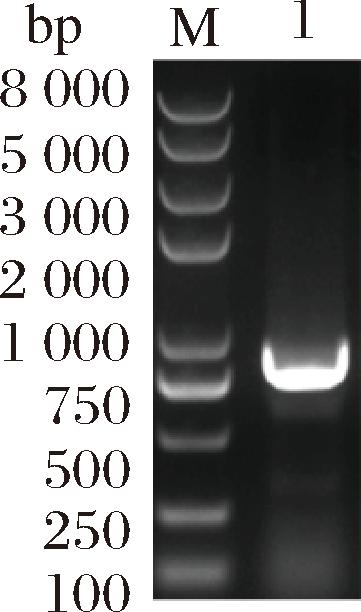
M-DNA marker;1-目的基因条带
图2 目的基因的PCR验证
Fig.2 PCR verification of the target gene
2.2 敲除载体的构建及鉴定
以菌株基因组DNA为模板分别使用对应的引物PCR扩增得到exoK基因的上下游同源臂片段,通过overlap RCR进行连接,构建敲除片段。用T4连接酶将线性化pK18mobsacB载体与exoK敲除片段进行连接,挑取转化子进行PCR和酶切验证,结果如图3所示,表明敲除质粒pk18mobsacB-ΔexoK构建成功。
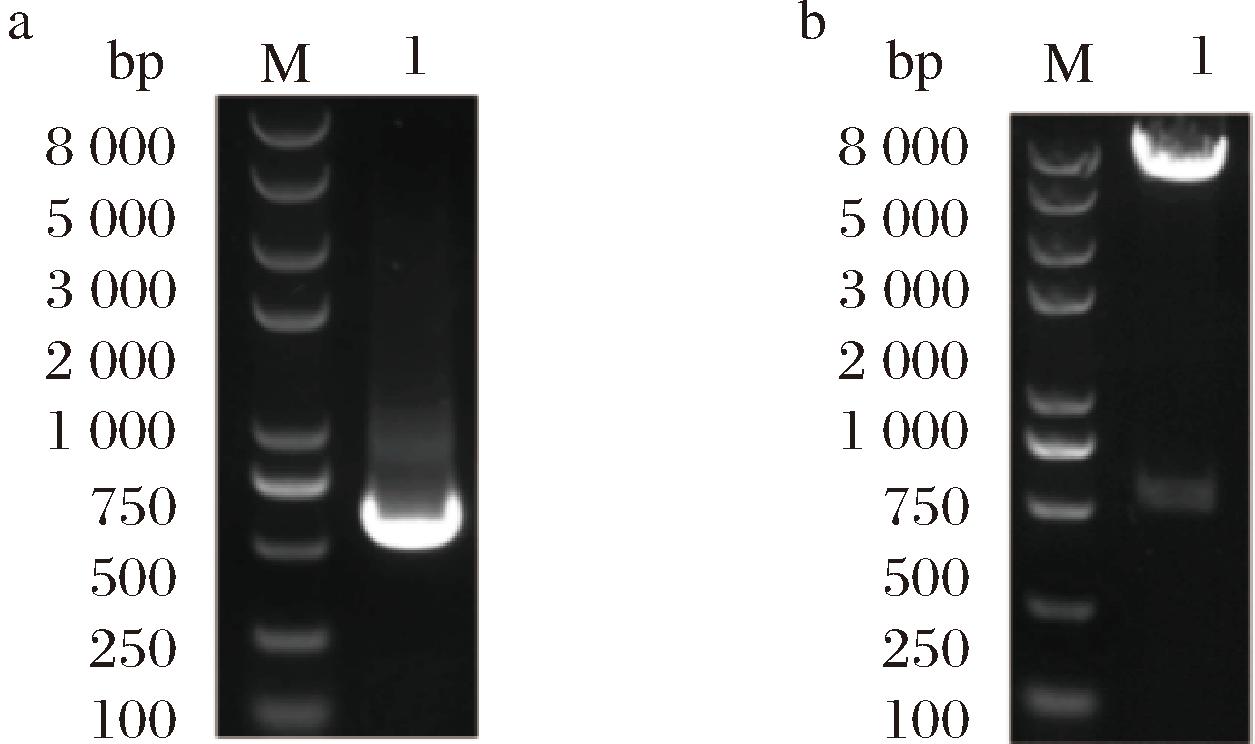
a-质粒pk18mobsacB-ΔexoK的PCR结果;b-质粒pk18mobsacB-ΔexoK酶切验证M-DNA Marker;1-目的基因条带
图3 质粒pk18mobsacB-ΔexoK验证
Fig.3 Validation of plasmid pk18mobsacB-ΔexoK
2.3 exoK基因缺失突变菌株的获得
将构建好的质粒电击转化至菌株Agrobacterium sp.ATCC31749中,涂布于含有卡那霉素的LB平板30 ℃培养箱培养48 h。挑取转化子先进行过夜培养后,提取质粒进行PCR验证,图4-A中出现2条条带,长条带位于750~1 000 bp,图4-A中的短带代表敲除片段,图中大小约为500 bp的短带代表敲除片段。将筛选成功的单交换菌落接种于LB液体培养基中传代培养,将菌液稀释涂布于添加200 g/L蔗糖的LB固体培养基,30 ℃培养,挑取转化子进行液培,取菌液以exoK-F1和exoK-R2为引物进行菌落PCR验证,结果如图4-B所示,exoK基因已被替换截短,PCR只扩增出大小约为500 bp的短片段,这说明exoK 基因失活的At-ΔexoK已成功获得,exoK的基因也从原来870 bp截短为500 bp左右,获得exoK基因失活的菌株,编号At-ΔexoK。

a-敲除载体导入ATCC 31749菌株中鉴定pk18mobsacB-ΔexoK导入ATCC 31749菌株鉴定(M-DNA Marker,1-目的基因条带);b-exoK基因失活菌株PCR鉴定已构建(M-DNA Marker,1-阳性对照,2泳道-阴性对照,3、5泳道-假阳性菌株,4泳道-目的基因ΔexoK条带)完成的At-ΔexoK菌株鉴定
图4 菌落PCR鉴定
Fig.4 Results of colony PCR
2.4 农杆菌ATCC31749野生型和ΔexoK突变株的发酵特性比较
在基础发酵培养基情况下通过摇瓶发酵实验,分析比较了ΔexoK突变株相对于野生菌株在微生物多糖产率和凝胶强度之间的差别,结果如表5所示。
表5 野生菌株与ΔexoK 突变株生长特性的比较
Table 5 Comparison of growth characteristics between wild type strain and ΔexoK mutant
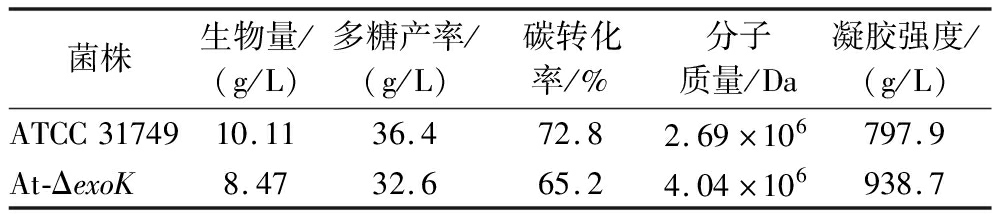
菌株生物量/(g/L)多糖产率/(g/L)碳转化率/%分子质量/Da凝胶强度/(g/L)ATCC3174910.1136.472.82.69×106797.9At-ΔexoK8.4732.665.24.04×106938.7
2.5 耐高糖菌株的筛选
通过实验可知At-ΔexoK菌株的凝胶强度增强,但存在产率低的问题,故将exoK基因缺失菌株进行耐高糖实验筛选,耐高糖菌株筛选实验结果如图5所示,随着蔗糖含量的增加,可得然胶产率显著提高,但当蔗糖含量增加至200 g/L后,可得然胶合成量急剧降低,可能是由于糖含量过高导致菌株代谢异常,基于上述试验结果后续试验发酵培养基蔗糖含量最高选择150 g/L,产率增加了55.7%。故选择1号菌株为目标菌株,命名为LQC22G。
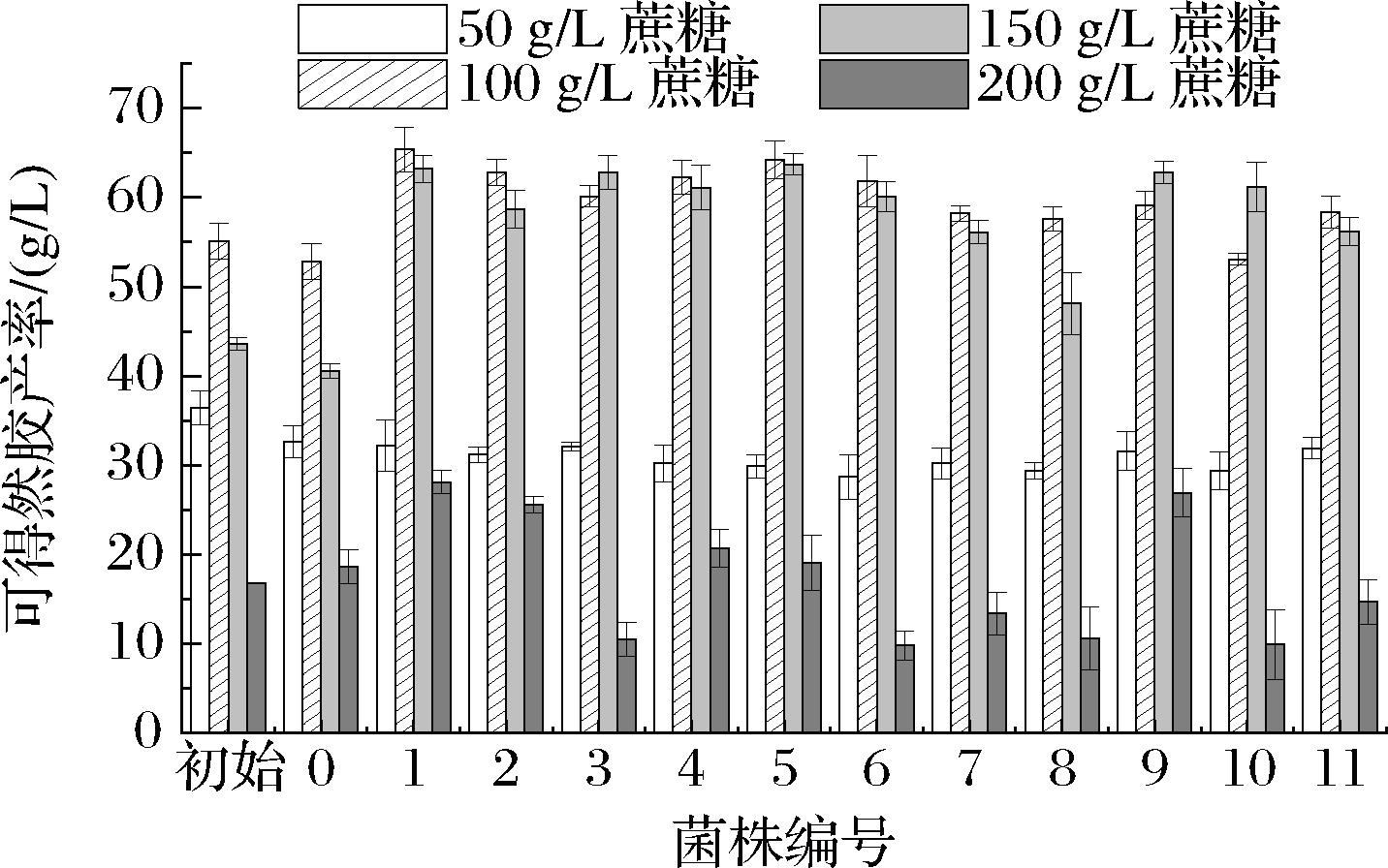
图5 不同菌株高糖发酵试验
Fig.5 High sugar fermentation test of different strains
2.6 单因素试验结果
有研究表明,不同的碳源(蔗糖、葡萄糖、麦芽糖、果糖和甘露醇)对菌株ATCC31749产生多糖产率的影响,多糖产率为(38.59±0.50) g/L,发酵96 h后,蔗糖促进了多糖产率的增加[19]。为提高多糖的产率,需要降低无机盐在培养基中的添加量,碳酸钙添加量对多糖产率有明显影响。YU等[20]的实验得出的结论去除碳酸钙并加入低聚磷酸盐时,发酵液的pH值和多糖产率显著下降的结果相似,这可能是因为在合成过程中,无机盐对细菌胞外多糖的代谢途径中酶的活性产生了影响[21]。因此,建议优化培养基中无机盐的添加量,以达到最佳的多糖产率[22]。大量研究表明可得然胶的生物合成是生长非耦联型,即微生物在生长至一定时期后经显著的代谢转变后大量合成多糖,触发上述代谢转变的条件是限氮培养,因此氮源含量对于可得然胶的高效生物合成至关重要[23]。在限氮的条件下,发酵培养120 h,磷酸盐质量浓度为5 g/L时,多糖产率达到65 g/L[24]。YU等[20]研究证实,添加低聚磷酸盐到发酵培养基中可以促进多糖产率的增加。故在不改变初始发酵培养基中其他成分含量的基础上,以筛选获得耐高糖菌株LQC22G为发酵菌株,通过单因素试验研究培养基中添加量对微生物多糖产率的影响,具体情况如图6所示。由图6可知,单因素条件下,最适添加量为100 g/L、磷酸氢二铵5.0 g/L、玉米浆1.0 g/L、碳酸钙1.2 g/L、硫酸镁2.0 g/L、培养时间120 h。

a-蔗糖添加量;b-磷酸二氢钾添加量;c-玉米浆添加量;d-碳酸钙添加量;e-硫酸镁添加量;f-培养时间
图6 不同培养条件下对可得然胶产率的影响
Fig.6 Effects of different culture conditions on the yield of curdlan
2.7 Plackett-Burman实验
为了快速有效的筛选获得影响可得然胶产量的主要因素,在单因素试验研究结果的基础上,设计了7因素Plackett-Burman实验,7个因素分别为A(蔗糖)、B(磷酸氢二铵)、C(碳酸钙)、D(玉米浆粉)、E(磷酸二氢钾)、F(硫酸镁)、G(时间)。实验结果如表6所示。
表6 Plackett-Burman实验设计及结果
Table 6 Design and results of Plackett-Burman test

实验号A(蔗糖)/(g/L)B(磷酸氢二铵)/(g/L)C(碳酸钙)/(g/L)D(玉米浆粉)/(g/L)E(磷酸二氢钾)/(g/L)F(硫酸镁)/(g/L)G(时间)/h(多糖产率)/(g/L)175.05.01.20.66.03.09648.19±1.26275.07.00.81.46.01.014418.62±1.213125.07.00.80.64.03.0969.86±0.42475.05.00.81.44.03.014412.82±0.915125.05.01.21.44.03.014456.58±1.016125.05.01.21.46.01.09656.82±0.927125.07.00.81.46.03.09617.44±1.438100.06.01.01.05.02.012069.79±2.239100.06.01.01.05.02.012068.53±1.2710100.06.01.01.05.02.012071.07±1.081175.07.01.21.44.01.09640.73±0.341275.07.01.20.66.03.014435.16±1.5113125.07.01.20.64.01.014444.78±1.4314125.05.00.80.66.01.014430.75±1.071575.05.00.80.64.01.0967.22±0.81
采用Design Expert 12软件对各试验因素做主效应分析,显著性分析结果见表7。由表6和表7可以得到,对多糖产率的影响从大到小的顺序依次是:C(碳酸钙)>A(蔗糖)>B(磷酸氢二铵)>E(磷酸二氢钾)>D(玉米浆粉)>F(硫酸镁)>G(时间),其中的磷酸氢二铵为负效应,选择B(磷酸氢二铵)、C(碳酸钙)、E(磷酸二氢钾)、A(蔗糖)进行接下来的最陡爬坡实验和响应面优化实验。
表7 Plackett-Burman实验方差分析结果
Table 7 Variance analysis results of Plackett-Burman test

来源平方和自由度均方F值P值模型3498.907237.63224.410.0002∗∗A237.631174.80183.550.0080∗B174.801102.0832.030.0155∗∗C2864.43161.6515.23<0.0001∗D61.65130.0811.2020.1789E102.08128.216.540.0430∗F30.081237.633.950.2144G28.211174.801.930.2274
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
2.8 最陡爬坡实验
基于单因素和PB实验的结果,设计了最陡爬坡实验,保持发酵培养基其他因素不变。由表8可知,第4组实验条件下,多糖产率最高,选择第4组作为后续响应面法进一步优化的设计中心点。
表8 最陡爬坡实验设计及结果
Table 8 Design and results of the steepest climbing test
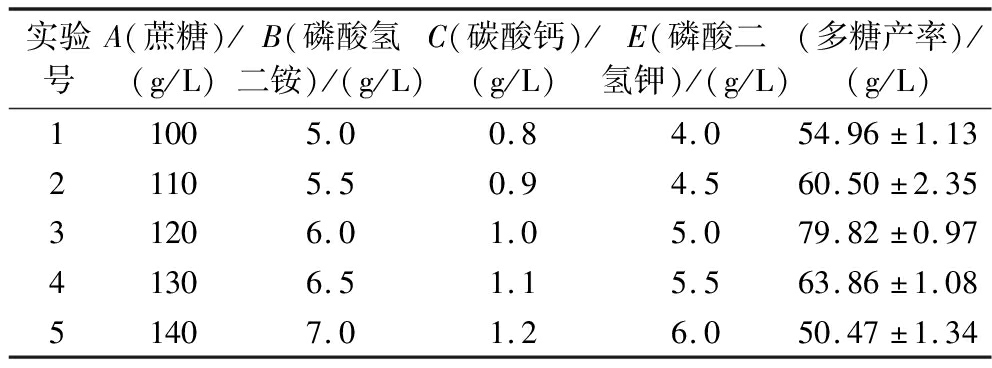
实验号A(蔗糖)/(g/L)B(磷酸氢二铵)/(g/L)C(碳酸钙)/(g/L)E(磷酸二氢钾)/(g/L)(多糖产率)/(g/L)11005.00.84.054.96±1.1321105.50.94.560.50±2.3531206.01.05.079.82±0.9741306.51.15.563.86±1.0851407.01.26.050.47±1.34
2.9 响应面法优化
在上述实验的基础上,以多糖产率(Y)为响应值,以蔗糖(A)、磷酸氢二铵(B)、碳酸钙(C)及磷酸二氢钾(D)的添加量为自变量,利用Design Expert 12.0软件进行4因素3水平响应面试验设计,结果见表9,方差分析见表10。
表9 Box-Behnken实验设计及结果
Table 9 Design and results of Box-Behnken test
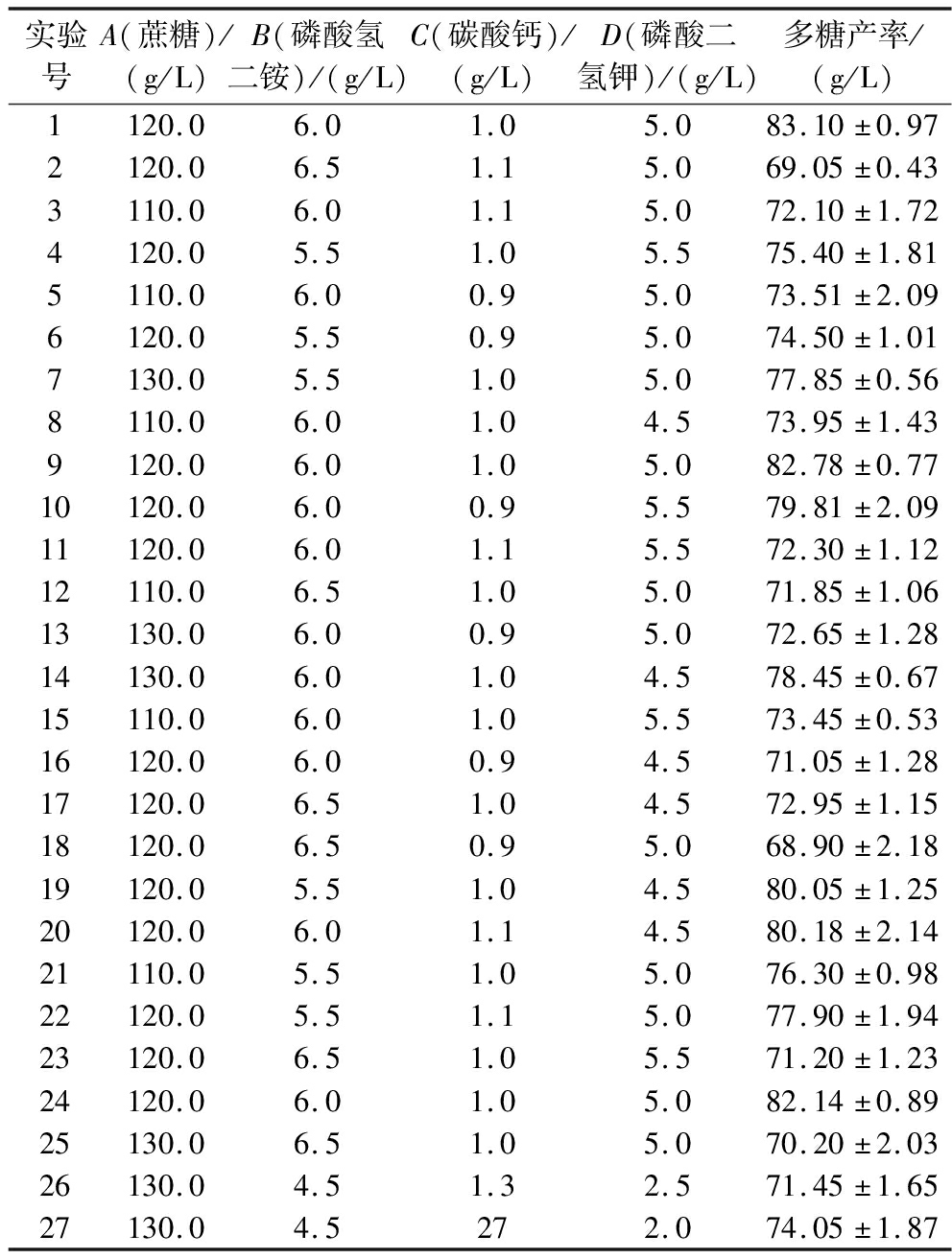
实验号A(蔗糖)/(g/L)B(磷酸氢二铵)/(g/L)C(碳酸钙)/(g/L)D(磷酸二氢钾)/(g/L)多糖产率/(g/L)1120.06.01.05.083.10±0.972120.06.51.15.069.05±0.433110.06.01.15.072.10±1.724120.05.51.05.575.40±1.815110.06.00.95.073.51±2.096120.05.50.95.074.50±1.017130.05.51.05.077.85±0.568110.06.01.04.573.95±1.439120.06.01.05.082.78±0.7710120.06.00.95.579.81±2.0911120.06.01.15.572.30±1.1212110.06.51.05.071.85±1.0613130.06.00.95.072.65±1.2814130.06.01.04.578.45±0.6715110.06.01.05.573.45±0.5316120.06.00.94.571.05±1.2817120.06.51.04.572.95±1.1518120.06.50.95.068.90±2.1819120.05.51.04.580.05±1.2520120.06.01.14.580.18±2.1421110.05.51.05.076.30±0.9822120.05.51.15.077.90±1.9423120.06.51.05.571.20±1.2324120.06.01.05.082.14±0.8925130.06.51.05.070.20±2.0326130.04.51.32.571.45±1.6527130.04.5272.074.05±1.87
表10 回归模型方差分析
Table 10 Variance analysis of regression model
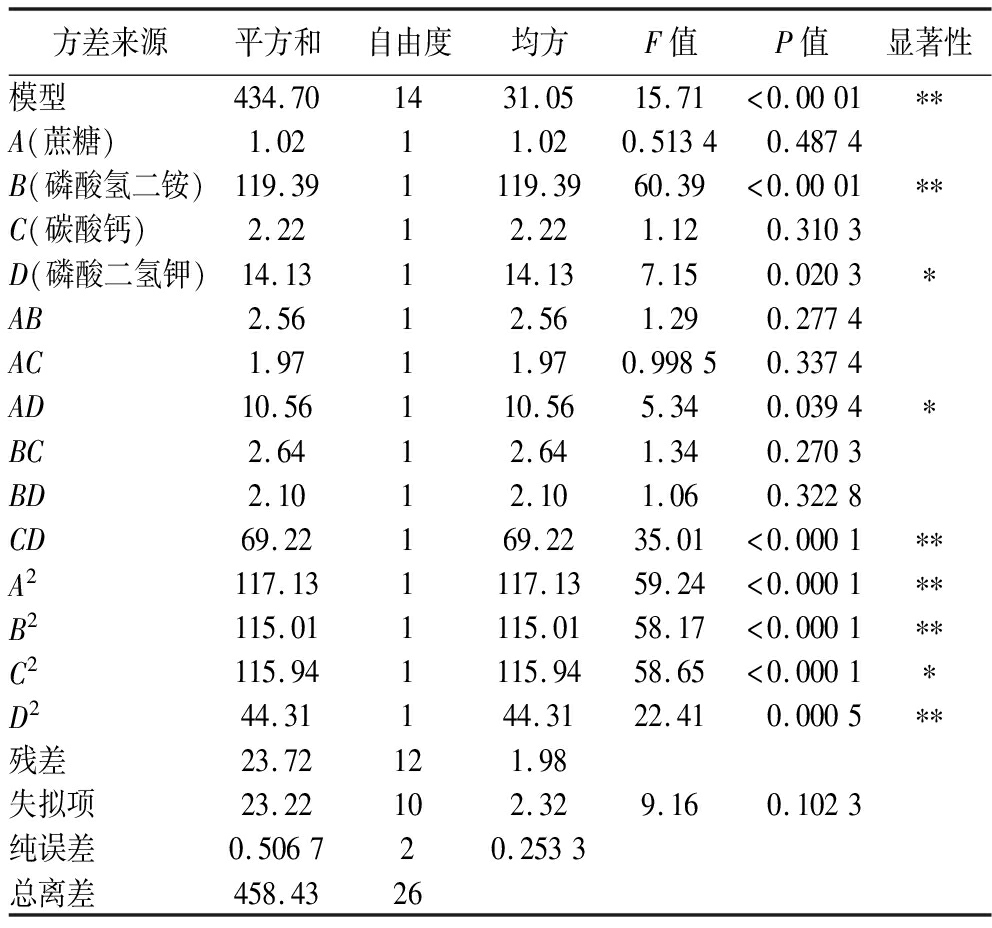
方差来源平方和自由度均方F值P值显著性模型434.701431.0515.71<0.0001∗∗A(蔗糖)1.0211.020.51340.4874B(磷酸氢二铵)119.391119.3960.39<0.0001∗∗C(碳酸钙)2.2212.221.120.3103D(磷酸二氢钾)14.13114.137.150.0203∗AB2.5612.561.290.2774AC1.9711.970.99850.3374AD10.56110.565.340.0394∗BC2.6412.641.340.2703BD2.1012.101.060.3228CD69.22169.2235.01<0.0001∗∗A2117.131117.1359.24<0.0001∗∗B2115.011115.0158.17<0.0001∗∗C2115.941115.9458.65<0.0001∗D244.31144.3122.410.0005∗∗残差23.72121.98失拟项23.22102.329.160.1023纯误差0.506720.2533总离差458.4326
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
采用Design Expert 12软件对表9的数据进行拟合分析,得到多糖产率(Y)为对蔗糖添加量(A)、磷酸氢二铵添加量(B),碳酸钙添加量(C),磷酸二氢钾添加量(D)的多元二次回归方程如下,多糖产率=82.57+0.290 8A-3.15B+0.430 0C-1.08D-0.800 0AB+0.702 5AC-1.63AD-0.812 5BC+0.725 0BD-4.16CD-4.69A2-4.64B2-4.66C2-2.88D2。
由表10可知,回归模型P<0.01,说明此回归模型极其显著;失拟项P=0.102 3>0.05,不显著,说明该模型具有较高可靠性,回归模型决定系数R2=0.948 2,调整系数R2=0.887 9,说明该方程可较好的预测实验结果,因此可以利用该方程预测以上4种因素对多糖产率的影响。由F值可知,影响多糖产率因素从大到小的顺序是:B(磷酸氢二铵)>D(磷酸二氢钾)>C(碳酸钙)>A(蔗糖)。各因素间交互作用对多糖产率的响应面及等高线见图7。由图7可知,各因素间交互作用对结果影响的响应面的等高线接近椭圆形,说明之间存在一定交互作用[25]。其中AD、CD两者交互作用响应面较为陡峭,等高线椭圆程度较为明显,对多糖产率的影响显著(P<0.05)。

a-蔗糖与磷酸氢二铵的影响;b-蔗糖与碳酸钙的影响;c-蔗糖与磷酸二氢钾的影响;d-磷酸氢二铵与碳酸钙的影响;e-磷酸氢二铵与磷酸二氢钾的影响;f-碳酸钙与磷酸二氢钾的影响
图7 各因素交互作用对可得然胶产率影响的响应曲面及等高线
Fig.7 The response surface and contour lines of the effects of the interaction between various factors on the yield of curdlan
通过Design Expert软件得到可得然胶发酵培养基组分最佳配方为:蔗糖122.008 g/L,磷酸氢二铵5.767 g/L,碳酸钙1.048 g/L磷酸二氢钾4.681 g/L,在此条件下,多糖产率的预测值为83.567 g/L。考虑到实验的实际操作可行性,将可得然胶发酵培养基组分的最佳配方调整为蔗糖122.0 g/L、磷酸氢二铵5.8 g/L、碳酸钙1.0 g/L、磷酸二氢钾4.7 g/L、在该优化条件下进行摇瓶实验,实验重复3次,多糖产率实际值为(83.17±0.25) g/L,与预测值基本一致,故该模型可行。经一系列培养基优化,使微生物多糖可得然胶的发酵产率提高了27.2%,效果显著,而与出发菌株采用基础发酵培养基的发酵产率(33.4±0.3) g/L比较,产率则提高了155%,显著提高了可得然胶的发酵生产效率。
3 结论与讨论
本研究构建了exoK基因缺失菌株At-ΔexoK,At-ΔexoK菌株发酵72 h后可得然胶产率达到(32.6±1.8) g/L,比原始菌株降低了10.4%,说明该基因缺失对生物多糖合成有影响;At-ΔexoK菌株生产的可得然胶凝胶强度938.7 g/L显著高于菌株ATCC31749生产的可得然胶凝胶强度797.9 g/L,增加了17.6%,分子质量由2.64×106 Da增加到4.04×106 Da,增加了53%,说明内源性β-1,3-葡聚糖基因的缺失可以提高可得然胶的凝胶强度和分子质量。以菌株At-ΔexoK出发菌株选育了一株耐高糖LQC22G菌株,使发酵培养基蔗糖添加量由50 g/L提高至150 g/L,多糖产率则提高了近1倍。在可得然胶原发酵培养基的基础上,经单因素与PB试验筛选出4个显著性影响因素:蔗糖、磷酸氢二铵、碳酸钙及磷酸二氢钾,而后通过最陡爬坡与响应面进一步优化得菌株最佳发酵培养基为:蔗糖122.0 g/L、磷酸氢二铵5.8 g/L、碳酸钙1.0 g/L、磷酸二氢钾4.7 g/L、玉米浆粉1.0 g/L、硫酸镁2.0 g/L。利用上述优化的发酵培养基进行发酵,可得然胶产率可达(83.17±0.25) g/L,比培养基优化前产率提高了27.2%,与出发菌株采用基础发酵培养基的发酵产率更是提高了155%,显著提高了可得然胶的发酵生产效率,本研究基本实现高凝胶强度高产率可得然胶的目标,为后续在工业化生产中应用提供了良好的基础,但产物凝胶强度增加有限,仅对exoK基因功能做了初步探究,在基因方面需进一步深入研究以得到高凝胶强度高产率的可得然胶。
[1] 刘咏梅,孙俞典.可得然胶在食品加工领域的应用前景[J].广东蚕业,2019,53(9):71-72.LIU Y M,SUN Y D.Application prospect of Kederan gum in food processing[J].Guangdong Canye,2019,53(9):71-72.
[2] HUNDSCHELL C S,WAGEMANS A M.Rheology of common uncharged exopolysaccharides for food applications[J].Current Opinion in Food Science,2019,27:1-7.
[3] GIEROBA B,SROKA-BARTNICKA A,KAZIMIERCZAK P,et al.Effect of gelation temperature on the molecular structure and physicochemical properties of the curdlan matrix:Spectroscopic and microscopic analyses[J].International Journal of Molecular Sciences,2020,21(17):E6154.
[4] CHAUDHARII V,BUTTAR H S,BAGWE-PARAB S,et al.Therapeutic and industrial applications of curdlan with overview on its recent patents[J].Frontiers in Nutrition,2021,8:646988.
[5] HARADA T.Succinoglucan 10C3:A new acidic polysaccharide of Alcaligenes faecalis var.myxogenes[J].Archives of Biochemistry and Biophysics,1965,112(1):65-69.
[6] 张钊瑞,张晨,李大鹏.微生物多糖的结构与应用研究进展[J].食品研究与开发,2021,42(1):182-192.ZHANG Z R,ZHANG C,LI D P.Advances in structure and application of microbial polysaccharides[J].Food Research and Development,2021,42(1):182-192.
[7] WAN J,WANG Y F,JIANG D M,et al.Effects of carbon sources on production and properties of curdlan using Agrobaterium sp.DH-2[J].Preparative Biochemistry &Biotechnology,2020,50(9):857-864.
[8] BEN SALAH R,JAOUADI B,BOUAZIZ A,et al.Fermentation of date palm juice by curdlan gum production from Rhizobium radiobacter ATCC 6466TM:Purification,rheological and physico-chemical characterization[J].LWT-Food Science and Technology,2011,44(4):1026-1034.
[9] WU J R,ZHAN X B,LIU H,et al.Enhanced production of curdlan by Alcaligenes faecalis by selective feeding with ammonia water during the cell growth phase of fermentation[J].Chinese Journal of Biotechnology,2008,24(6):1035-1039.
[10] PRAKASH S,RAJESWARI K,DIVYA P,et al.Optimization and production of curdlan gum using Bacillus cereus PR3 isolated from rhizosphere of leguminous plant[J].Preparative Biochemistry &Biotechnology,2018,48(5):408-418.
[11] YU X Q,ZHANG C,YANG L P,et al.CrdR function in a curdlan-producing Agrobacterium sp.ATCC31749 strain[J].BMC Microbiology,2015,15(1):25.
[12] GAO H L,XIE F R,ZHANG W,et al.Characterization and improvement of curdlan produced by a high-yield mutant of Agrobacterium sp.ATCC 31749 based on whole-genome analysis[J].Carbohydrate Polymers,2020,245:116486.
[13] 王萧玉竹,董晋军,许国超,等.可得然胶生产菌种的筛选及发酵条件优化[J].食品与生物技术学报,2018,37(7):732-738.WANG X Y Z,DONG J J,XU G C,et al.Isolation of a curdlan-producing bacterium and optimization of fermentation medium[J].Journal of Food Science and Biotechnology,2018,37(7):732-738.
[14] LIANG Y,ZHU L,DING H,et al.Enhanced production of curdlan by coupled fermentation system of Agrobacterium sp.ATCC 31749 and Trichoderma harzianum GIM 3.442[J].Carbohydrate Polymers,2017,157:1687-1694.
[15] SAUDAGAR P S,SINGHAL R S.Fermentative production of curdlan[J].Applied Biochemistry and Biotechnology,2004,118(1-3):21-31.
[16] LIANG Y,ZHU L,GAO M J,et al.Influence of Tween-80 on the production and structure of water-insoluble curdlan from Agrobacterium sp.[J].International Journal of Biological Macromolecules,2018,106:611-619.
[17] YANG M,ZHU Y,LI Y M,et al.Production and optimization of curdlan produced by Pseudomonas sp.QL212[J].International Journal of Biological Macromolecules,2016,89:25-34.
[18] 汪利文.一种新型热凝胶提取工艺及其产品性能研究[D].无锡:江南大学,2019.WANG L W.Study on extraction process and properties of a new thermal gel[D].Wuxi:Jiangnan University,2019.
[19] ZHANG Q,SUN J Y,WANG Z J,et al.Kinetic analysis of curdlan production by Alcaligenes faecalis with maltose,sucrose,glucose and fructose as carbon sources[J].Bioresource Technology,2018,259:319-324.
[20] YU L J,WU J R,LIU J,et al.Enhanced curdlan production in Agrobacterium sp.ATCC 31749 by addition of low-polyphosphates[J].Biotechnology and Bioprocess Engineering,2011,16(1):34-41.
[21] MOHSIN A,SUN J Y,KHAN I M,et al.Sustainable biosynthesis of curdlan from orange waste by using Alcaligenes faecalis:A systematically modeled approach[J].Carbohydrate Polymers,2019,205:626-635.
[22] WEST T P.Production of the polysaccharide curdlan by Agrobacterium species on processing coproducts and plant lignocellulosic hydrolysates[J].Fermentation,2020,6(1):16.
[23] WU D,LI A,MA F,et al.Genetic control and regulatory mechanisms of succinoglycan and curdlan biosynthesis in genus Agrobacterium[J].Applied Microbiology and Biotechnology,2016,100(14):6183-6192.
[24] KIM M K,LEE I Y,LEE J H,et al.Residual phosphate concentration under nitrogen-limiting conditions regulates curdlan production in Agrobacterium species[J].Journal of Industrial Microbiology and Biotechnology,2000,25(4):180-183.
[25] 刘晓霞.土壤杆菌产可得然胶发酵工艺优化及其性质的研究[D].上海:华东师范大学,2017.LIU X X.The Research of fermentation process optimization and properties of curdlan by Agrobacterium sp.[D].Shanghai:East China Normal University,2017.