蛋白酶是一类广泛应用于水解蛋白质肽键的酶,是工业酶中非常重要的一种,其销量至少占全球酶市场的1/4[1]。根据作用pH的范围不同,蛋白酶可分为酸性蛋白酶、中性蛋白酶和碱性蛋白酶。其中碱性蛋白酶最适pH主要集中在9~11,被广泛应用于洗涤、皮革、医疗以及食品加工等多个行业。由于碱性蛋白酶在工业上的应用场景日益增加,且存在国外专利保护等原因,研究开发满足不同需求场景的碱性蛋白酶生产菌株是非常重要的[2-6]。
芽孢杆菌具有较好的蛋白酶耐受性和完善的载体/宿主系统,在蛋白表达方面具有独特优势。其中枯草芽孢杆菌(Bacillus subtilis)因其不产内毒素、安全高效、生长周期短、易于操作等特点广泛应用于淀粉酶、脂肪酶、纤维素酶等酶类的生产。然而,B.subtilis表达近缘物种蛋白的能力较强,但其远缘蛋白的表达受到限制,产量往往下降至几毫克甚至微克每升[7]。在枯草芽孢杆菌中优化信号肽和启动子等表达元件是一种重要的提高胞外蛋白质表达效率的方法。周勇等[8]通过对信号肽phoD进行改造,将氨基酸序列“DRRKF”中的D或F突变为R,使脂肪酶酶活大大提高。由于目前对信号肽与蛋白质适配机制尚未明确,所以信号肽文库筛选依然是确定最佳信号肽的最好方法[9-10]。GUAN等[11]通过对启动子PsrfA进行-10、-35区域上的结构突变,成功使表达强度提高至原来的2倍。
近年来,不同应用场景下碱性蛋白酶的相关研究一直备受关注。本文选取B.subtilis WB600为宿主,重组表达A.alcalophilus所编码具有嗜碱耐盐特性的碱性蛋白酶,尝试通过筛选信号肽文库和构建双元启动子来提高碱性蛋白酶表达量,并适配合理的工业培养基进行发酵,为该碱性蛋白酶的生产应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
Escherichia coil DH5α用于载体构建和扩增,武汉易白生物技术有限公司;B.subtilis WB600用于目的基因表达;表达质粒pBE-S,宝生物工程大连有限公司;A.alcalophilus 所编码蛋白酶(Apralc)的氨基酸序列由数据库检索获得(GenBank No.ACR24262.1);蛋白酶编码基因apralc,启动子序列(PBamy、Pylb、P43、PSpoVG、PHapII-Pylb、PBsamy-PBamy)由苏州金唯智生物科技有限公司合成,并分别克隆至pET-28a和pUC18质粒中。
1.1.2 主要试剂及培养基
限制性内切酶Nde Ⅰ、Hind Ⅲ、Eag Ⅰ、Mlu Ⅰ、Sma I,NEB;Plasmid Mini Kit、Gel Extraction Kit,Omega;T4 DNA Ligase,Vazyme;DNA Maker、LA Taq、In-fusion HD Enzyme Premix、SP DNA mixture,Takara;BR Buffer、碳酸钠、福林酚试剂、干酪素、氨苄青霉素、卡那霉素,Coolaber;三氯乙酸,aladdin。
LB培养基和牛奶固体培养基配方详情见参考文献[12]。筛选转化子时,氨苄青霉素与卡那霉素的使用质量浓度分别为100 μg/mL和10 μg/mL。
7种初筛发酵培养基配方如下:
1号培养基(g/L):葡萄糖20、豆粕30、玉米浆5、硫酸铵10、硝酸钠10、磷酸二氢钾1.5、硫酸镁0.5、氯化钙0.5;
2号培养基(g/L)[13]:酵母提取物8.14、豆粕17.53、玉米浆16.18、玉米淀粉10.22、玉米粉11.76、麸皮18.13;
3号培养基(g/L)[14]:木糖80、豆饼粉45、氯化铵3、磷酸盐15 mmol/L(0.1 mol/L磷酸盐母液:0.075 mol/L磷酸氢二钠、0.025 mol/L磷酸二氢钠,分开灭菌)、氯化钙0.2;
4号培养基(g/L)[15]:豆粕36、玉米粉60、磷酸氢二钠4;
5号培养基(g/L)[16]:豆粕40、玉米粉10、葡萄糖4.1、酵母浸粉9.4、氯化钙1.5、氯化钠3(pH值调至7);
6号培养基(g/L)[17]:豆粕30、玉米粉15、酵母浸5、磷酸氢二钠2、磷酸二氢钾0.3、硫酸镁0.5(pH值调至6.5);
7号培养基(g/L)[18]:豆粕30、玉米粉40、麸皮30、磷酸氢二钠4、磷酸二氢钾0.3(pH值调至7)。
1.2 实验方法
1.2.1 apralc基因的克隆转化与表达
根据B.subtilis密码子使用偏好性对A.alcalophilus碱性蛋白酶基因apralc进行优化,基因合成后克隆至质粒pET-28a得到pET-28a-apralc。
将质粒pET-28a-apralc和pBE-S使用限制性内切酶Nde Ⅰ和Hind Ⅲ双酶切,回收获取目的基因片段。将所得片段用T4 DNA Ligase 16 ℃连接6 h后,转化至E.coli DH5α感受态细胞中。使用含氨苄青霉素的LB固体平板筛选转化子,提取质粒命名为pBE-apralc。按照LIU等[19]的电转化方法将pBE-apralc转化至B.subtilis WB600中,获得表达有Apralc的初始枯草芽孢杆菌菌株。
1.2.2 信号肽文库的筛选
使用限制性内切酶Eag Ⅰ和Mlu Ⅰ对质粒pBE-apralc进行双酶切并通过胶回收纯化。得到的质粒片段与含有173种B.subtilis信号肽的SP DNA mixture进行In-fusion克隆。将克隆产物首先转化到E.coli,收集所有转化子抽提质粒。然后使用电转化法,将混合质粒转入B.subtilis WB600。使用牛奶固体培养平板初筛,挑取透明圈大小与菌落大小比值较大的105个菌落。然后接种至LB液体培养基进行摇瓶复筛,测定酶活力大小。从表现出高蛋白酶活力的菌株中提取质粒,测序以确定使蛋白酶分泌增强的信号肽序列。
1.2.3 串联启动子的构建与筛选
将质粒pUC18-PBamy、pUC18-Pylb、pUC18-P43、pUC18-PSpoVG使用Sma I酶切,经回收纯化以获得4种启动子片段PBamy、Pylb、P43、PSpoVG。以1.2.2节筛选出的携带最佳信号肽的质粒pBE-SPYdjM-apralc为模板,使用引物Ps-F/P-R(Ps-F:5′-ACAGAATAGTCTTTTAAGTAAGTCTACTCTG-3′;P-R:5′-GACTCGAAATAACTATTTTCATACAGAA-3′)扩增获得与启动子片段具有同源臂的载体片段。In-fusion克隆将4种启动子片段分别与含有PaprE启动子的载体片段连接,得到含有不同双启动子PBamy-PaprE、Pylb-PaprE、P43-PaprE、PSpoVG-PaprE的表达质粒(图1)。
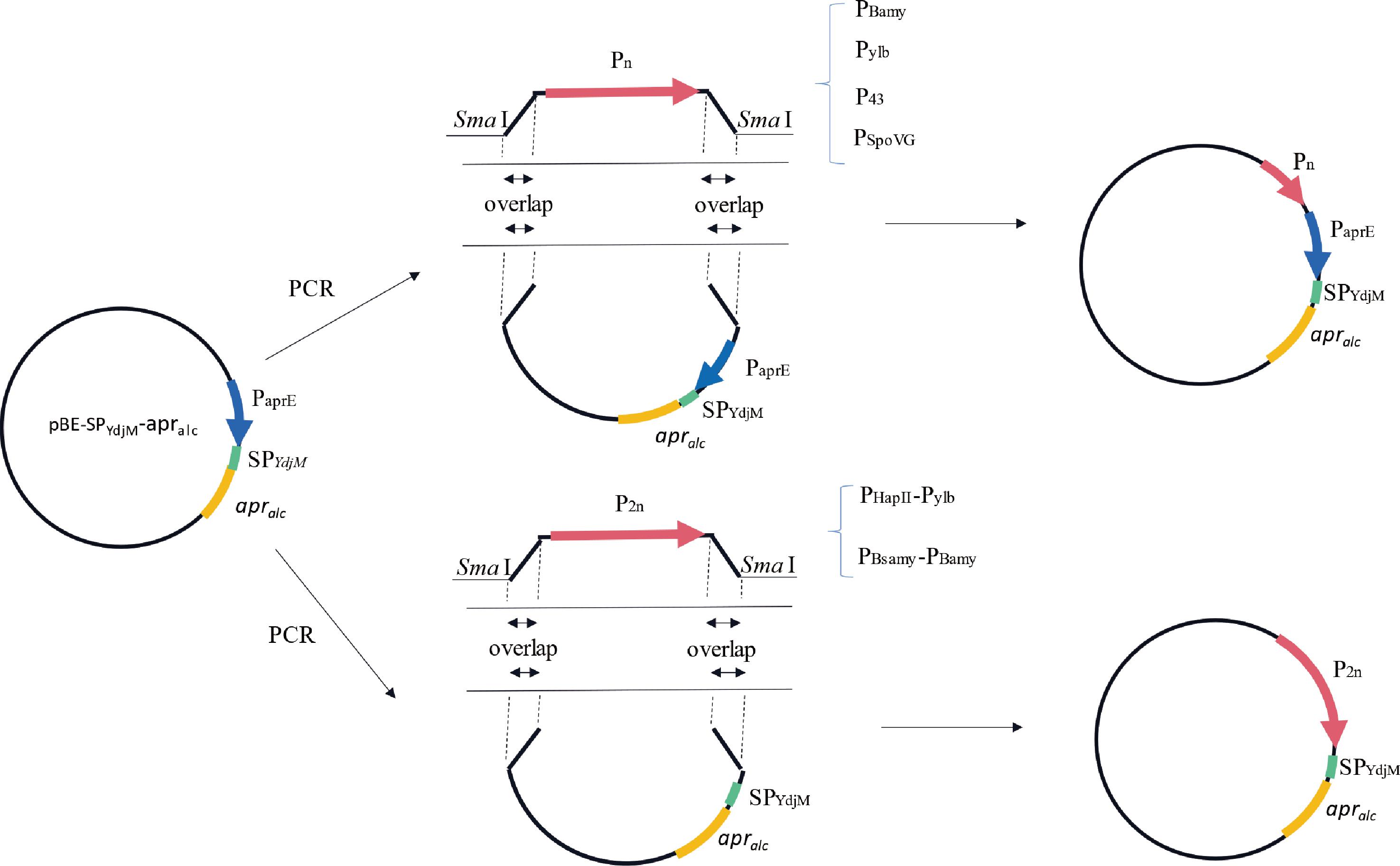
图1 六种包含不同组合启动子的质粒构建流程
Fig.1 Construction procedure of the six plasmids containing different kinds of dual promoters
使用引物Pb-F/P-R(Pb-F:5′-ATAGAGATAAAATCATCTCAAAAAAATG-3′)扩增获得不含原启动子PaprE的质粒片段,分别与双元启动子PHapII-Pylb和PBsamy-PBamy连接,得到由PHapII-Pylb和PBsamy-PBamy启动转录的蛋白酶表达质粒(图1)。
将上述质粒转化至大肠杆菌,测序验证后抽提质粒电转至B.subtilis WB600中。将得到的表达菌株接种于含有卡那霉素的LB培养基中,37 ℃条件下摇瓶发酵,每间隔3 h进行一次取样,测定OD600以表征重组菌株生长状况,并按照1.2.4节的方法测定碱性蛋白酶酶活以确定产酶曲线。
1.2.4 蛋白酶活测定
参照GB/T 23527—2009《蛋白酶制剂》附录B中的福林酚法测定碱性蛋白酶酶活力。一个酶活力单位(U)定义为在50 ℃,pH=11条件下,每分钟催化酪蛋白水解生成1 μg酪氨酸所需的酶量。
1.2.5 酶学性质测定
1.2.5.1 温度及pH对酶活的影响
使用pH值分别为6.0、7.0、8.0、9.0、10.0、11.0、12.0的缓冲液将酶液稀释10倍,50 ℃下测定其酶活。以测得的最高酶活力值作为100%,计算其他pH条件下的相对酶活来测定该蛋白酶的最适反应pH。在同样的pH梯度条件下,将蛋白酶母液孵育1 h后测定酶活力,衡量其在不同pH条件下的酶活稳定性。
在20~90 ℃,以每5 ℃为一个梯度测定发酵液酶活力,以测得的最高酶活力值作为100%,计算其他温度条件下的相对酶活力来测定该蛋白酶的最适反应温度。在同样的温度梯度条件下,将蛋白酶母液孵育1 h后测定酶活力,从而衡量其在不同温度条件下的酶活力稳定性。
1.2.5.2 不同种类化学试剂及盐离子浓度对酶活力的影响
配制含有不同种类化学试剂的缓冲液,包括使反应体系中金属离子终浓度为1 mmol/L的KCl、CaCl2、MgCl2、CoCl2和BaCl2溶液;终质量浓度为25、50、75、100、125、150 g/L的NaCl溶液;终体积分数为0.5%的Tween 80、Triton X-100溶液和终浓度为10 mmol/L的SDS溶液。使用这些含有不同种类化学试剂的缓冲液测定蛋白酶活力,以未经处理酶液的蛋白酶活力为100%,计算其他条件下的相对酶活以研究不同种类的化学试剂对蛋白酶活力的影响。
1.2.6 发酵培养基筛选及发酵罐发酵实验
以上述实验筛选出的携带最佳信号肽和启动子的菌株为发酵菌株,对7种发酵培养基进行筛选,配方见1.1.2节。在37 ℃,200 r/min条件下摇瓶培养,每间隔6 h取样,测定不同培养基的产酶曲线。以酶活力峰值为指标,确定最终发酵培养基配方。
在250 mL摇瓶中,使用100 mL LB培养基过夜培养种子液。将得到的种子培养物以2%的接种量转入5 L发酵罐培养,装液量0.6。在培养过程中,通过控制进气量和搅拌速度使溶解氧量维持在较低水平。罐内pH和温度分别保持在7.0±0.5和37 ℃。当溶氧量开始升高时一次性补加100 mL 60%的葡萄糖溶液。每间隔2 h从发酵罐中取样,按照1.2.4节评估上清液中蛋白酶活力,测定产酶曲线。
2 结果与分析
2.1 apralc基因的克隆表达
apralc基因全长1 071 bp,该基因片段连接至载体pBE-S上得到质粒pBE-S-apralc的大小为6 967 bp。质粒pBE-apralc双酶切验证后,电泳条带大小符合预期。经进一步测序验证后,将质粒pBE-apralc电转化至B.subtilis WB600获得蛋白酶Apralc的初始表达菌株。获得该菌株经LB培养基发酵后的上清液,纯化浓缩后进行SDS-PAGE电泳检测,结果如图2所示,蛋白大小与预期的26.7 kDa相符,说明该基因表达成功。

M-Maker;1-WB600/pBE-apralc发酵上清液
图2 重组菌株胞外蛋白的SDS-PAGE电泳检测
Fig.2 SDS-PAGE analysis of extracellular protein of recombinant strain
2.2 不同信号肽对蛋白酶分泌效率的影响
参照B.subtilis Secretory Protein Expression System产品说明,将构建好的含有不同信号肽的质粒转化至宿主菌时,需至少收集2 000个转化子才能确保173种不同信号肽的插入。本研究从牛奶固体培养基上共获得了2 300个B.subtilis菌落。经初筛后105个菌落展现出了较强的蛋白水解能力。LB培养基液态发酵复筛结果表明,含有不同信号肽的菌株酶活力差异显著(图3),当使用SPYdjm介导时,AprAlc分泌效率最高,达到1 020 U/mL,是信号肽SPaprE所介导分泌效率的13.8倍。信号肽SPYqxI也能促进AprAlc的分泌,使发酵液蛋白酶活提高11.4倍;其次是信号肽SPYkwD和SPAbnAw,均使酶活力提高3倍以上。部分信号肽相关信息如表1所示。
表1 部分使AprAlc分泌效率提高的信号肽相关信息
Table 3 Some efficient signal peptides for AprAlc secretion during signal peptide screening
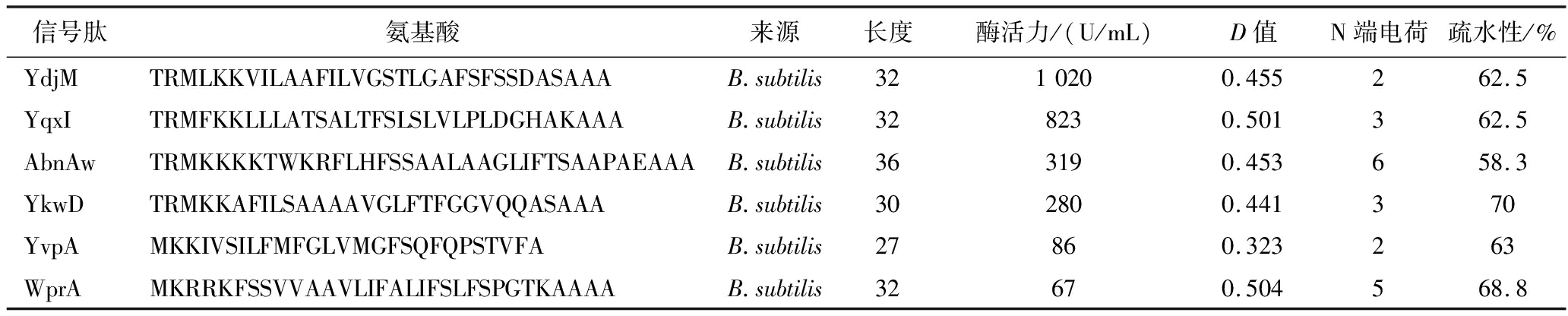
信号肽氨基酸来源长度酶活力/(U/mL)D值N端电荷疏水性/%YdjMTRMLKKVILAAFILVGSTLGAFSFSSDASAAAB.subtilis3210200.455262.5YqxITRMFKKLLLATSALTFSLSLVLPLDGHAKAAAB.subtilis328230.501362.5AbnAwTRMKKKKTWKRFLHFSSAALAAGLIFTSAAPAEAAAB.subtilis363190.453658.3YkwDTRMKKAFILSAAAAVGLFTFGGVQQASAAAB.subtilis302800.441370YvpAMKKIVSILFMFGLVMGFSQFQPSTVFAB.subtilis27860.323263WprAMKRRKFSSVVAAVLIFALIFSLFSPGTKAAAAB.subtilis32670.504568.8
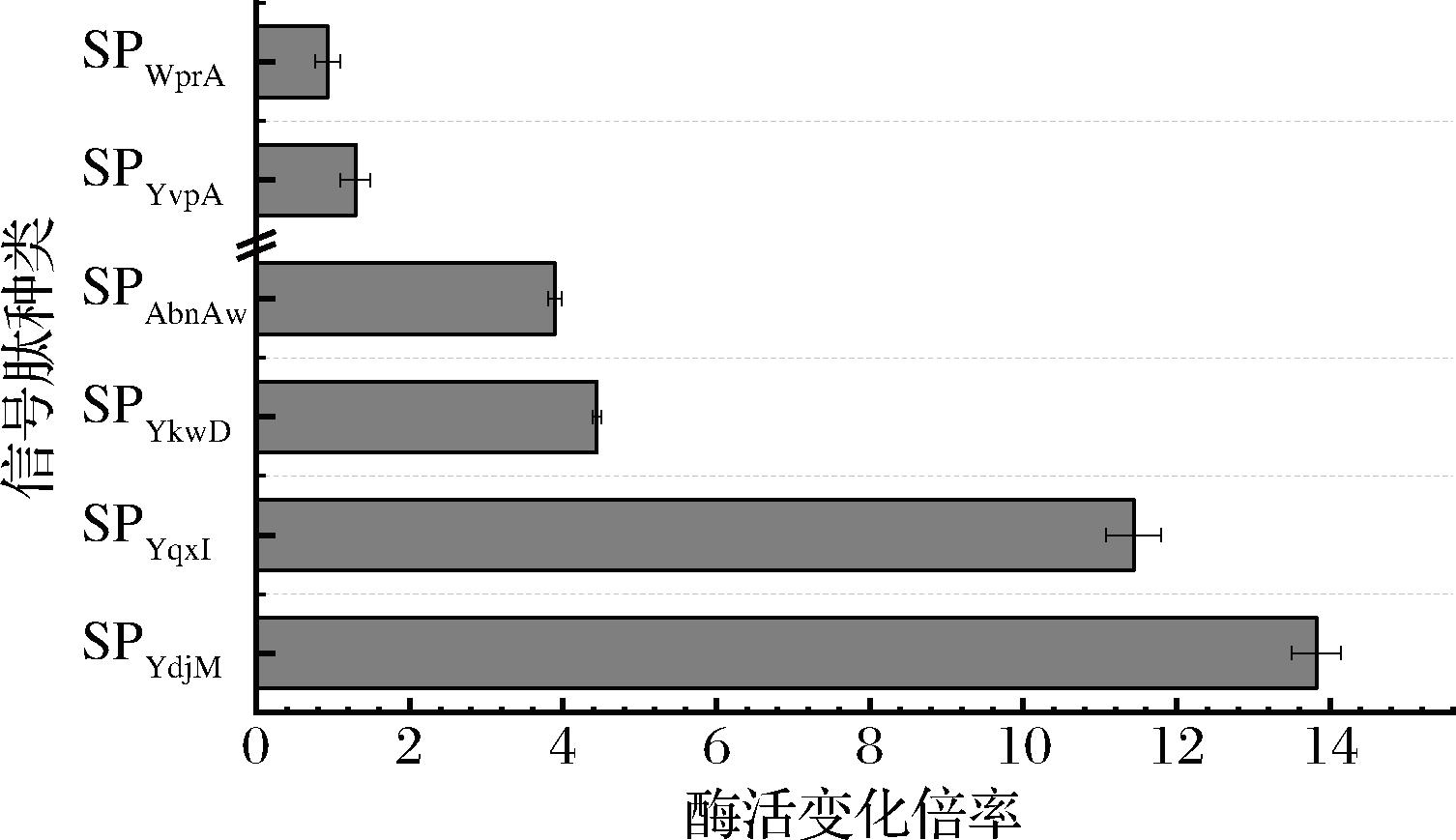
图3 使用不同信号肽重组菌株所产发酵液的蛋白酶活力
Fig.3 The fold change of protease activity detected in the culture supernatant of recombinant strains with different signal peptides
2.3 不同启动子组合对酶活力的影响
将含有6种不同双元启动子的表达质粒电转化至B.subtilis WB600,使用LB培养基37 ℃培养16 h测定发酵上清液中蛋白酶活力(图4-a)。其中,使用PHapII-Pylb双元启动子的菌株酶活最高,上清液中达到1 887 U/mL,是使用PaprE启动子菌株的1.7倍;其次是Pylb-PaprE,可使酶活力提高1.5倍。且启动子PHapII-Pylb相较于其他启动子在指数生长后期表现出明显增强蛋白质表达的作用。同时,并不是所有的双元启动子都可以使蛋白酶表达量提高,PBsamy-PBamy和PSpoVG-PaprE使发酵液中碱性蛋白酶活力几乎下降为0。使用不同启动子重组菌株的生长曲线如图4-b所示,6种菌株都能达到相似的生长水平,这说明外源蛋白酶AprAlc的表达对B.subtilis WB600的生长没有显著影响。
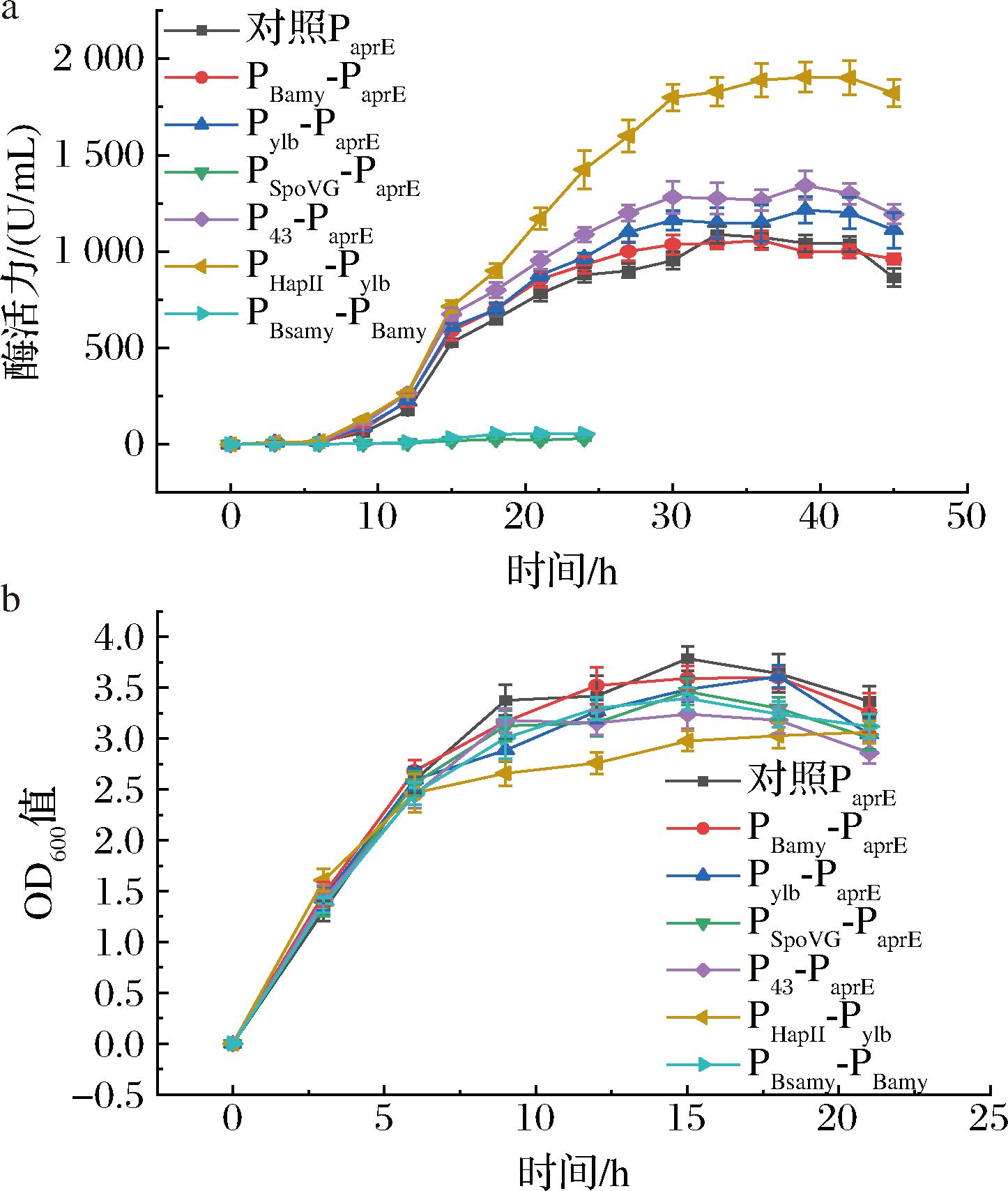
a-酶活力曲线;b-生长曲线
图4 使用不同启动子重组菌株的酶活力及生长曲线
Fig.4 The enzyme activity and growth curve of recombinant strains using different promoters
2.4 酶学性质测定
2.4.1 温度和pH对酶活的影响
如图5-a所示,蛋白酶AprAlc的最适反应pH为11.0,并在pH为8.0~12.0的条件下能保留约40%以上的活性。当pH小于8.0时酶活骤降,表明该酶较适合应用于碱性环境。AprAlc在pH 5.0~10.0孵育1 h后重新在pH=11.0条件下反应,依然观察到超过90%的残留活性,说明该酶具有较好的pH稳定性。
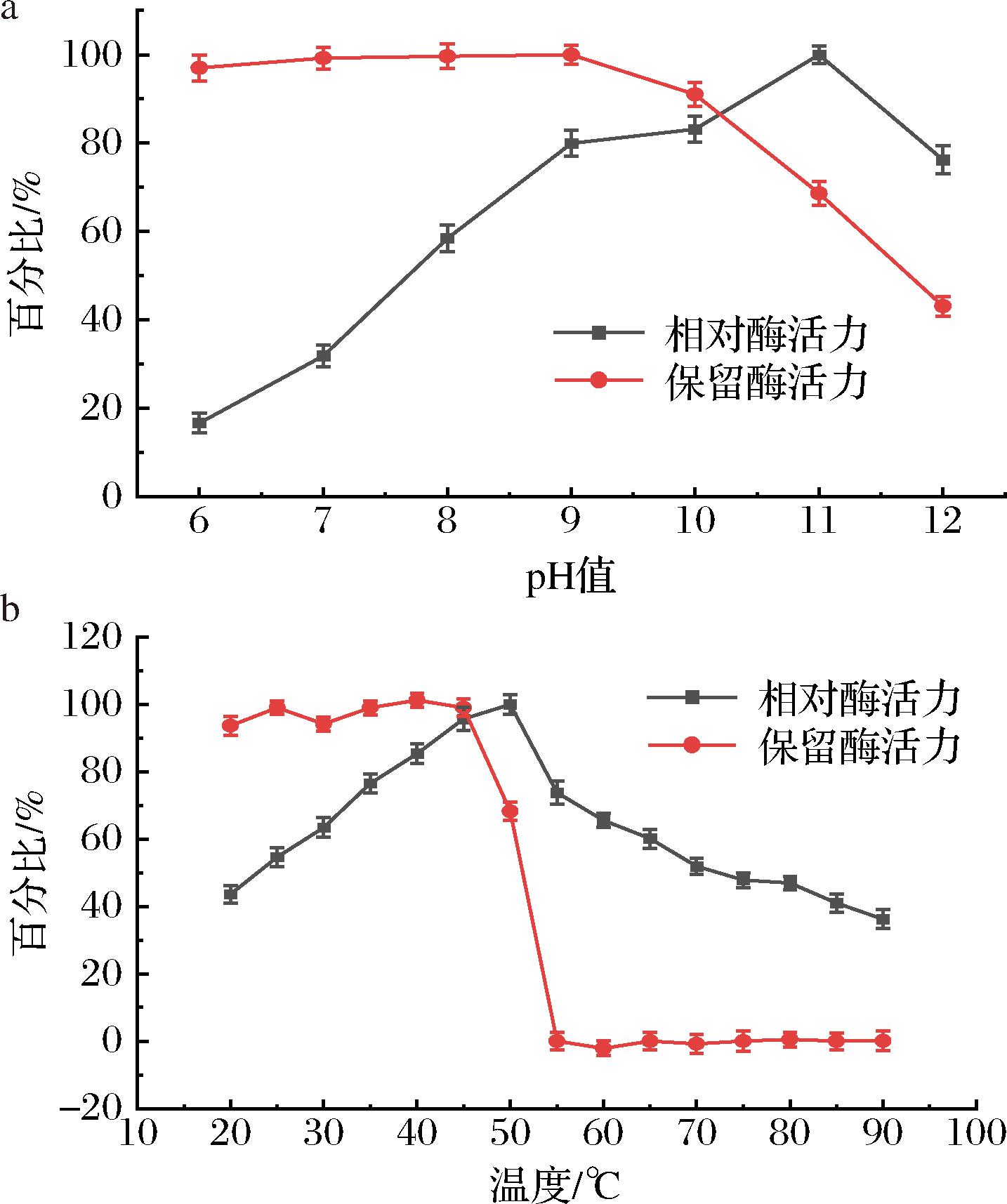
a-pH对酶活力的影响;b-温度对酶活力的影响
图5 温度和 pH 对AprAlc酶活力的影响
Fig.5 Effect of temperature and pH on the protease activity of AprAlc
如图5-b所示,蛋白酶AprAlc的最适反应温度为50 ℃,在温度为20~50 ℃的范围内能保留最大酶活力的40%以上。当温度大于50 ℃后酶活力开始骤降,且在55 ℃预孵育1 h后酶活力基本降低至0。高温使该酶的蛋白质结构遭到破坏,造成酶失活,说明该酶较适合应用于中低温环境。
2.4.2 不同种类化学试剂对酶活的影响
如表2所示,1 mmol/L的K+、Ca2+、Mg2+、Co2+、Ba2+均对AprAlc的酶活力具有不同程度的促进作用,其中K+、Ca2+的促进作用较大,约能提升50%。随着NaCl浓度的增大,蛋白酶酶活下降,但在NaCl浓度为10%的情况下,酶活力可保留50%以上,说明该蛋白酶耐盐性较好。3种表面活性剂中,离子型表面活性剂SDS对AprAlc起到了明显抑制作用,而0.5%的Tween 80和Triton X-100可使蛋白酶活提升约35%。
表2 不同化学试剂对AprAlc酶活的影响
Table 2 Effects of various chemicals on AprAlc activity
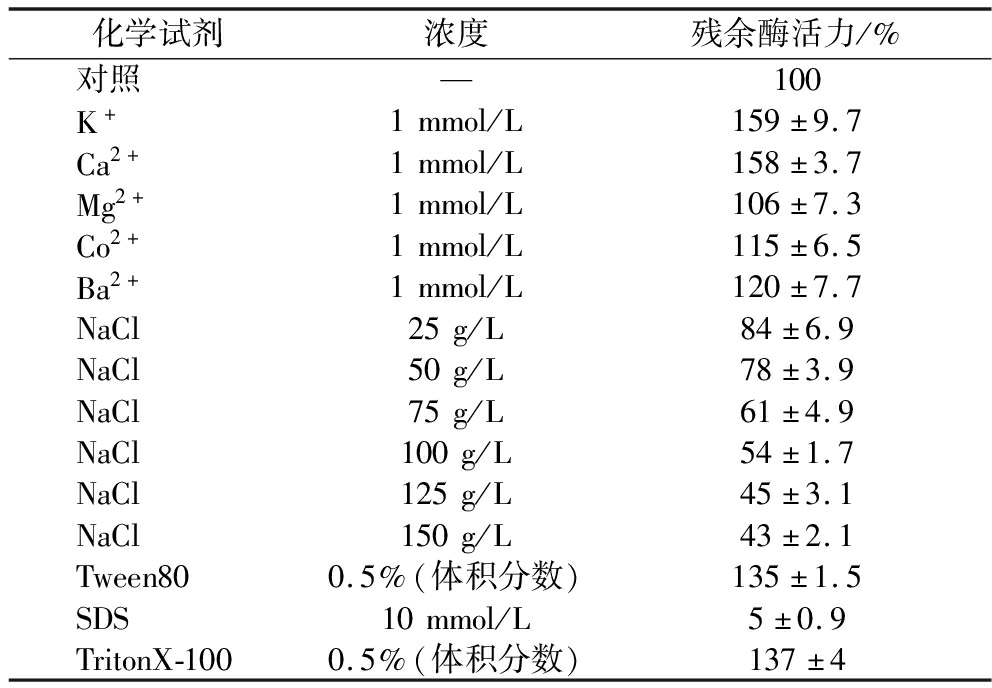
化学试剂浓度残余酶活力/%对照—100K+1mmol/L159±9.7Ca2+1mmol/L158±3.7Mg2+1mmol/L106±7.3Co2+1mmol/L115±6.5Ba2+1mmol/L120±7.7NaCl25g/L84±6.9NaCl50g/L78±3.9NaCl75g/L61±4.9NaCl100g/L54±1.7NaCl125g/L45±3.1NaCl150g/L43±2.1Tween800.5%(体积分数)135±1.5SDS10mmol/L5±0.9TritonX-1000.5%(体积分数)137±4
2.5 发酵培养基筛选及罐内发酵
如图6所示,将重组菌株接种至7种不同的发酵培养基中进行摇瓶发酵。其中使用4号培养基发酵约76 h后,能使AprAlc酶活力达到最大,为18 600 U/mL,约为LB培养基的10倍。使用该培养基进一步在5 L发酵罐中发酵,产酶曲线表明发酵35 h时,发酵上清液蛋白酶活力达到34 050 U/mL,约为摇瓶发酵的1.8倍。
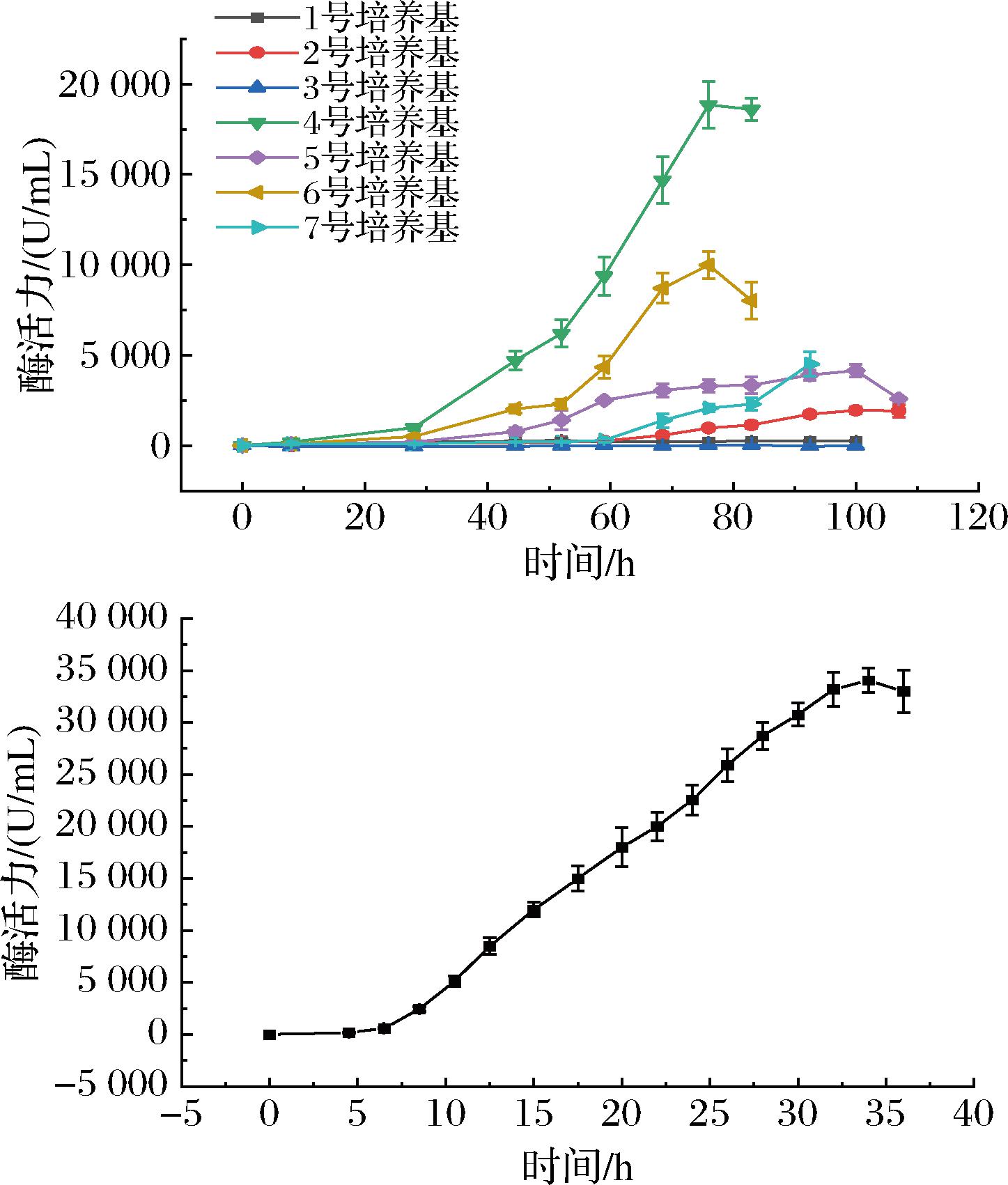
a-在不同发酵培养基中的产酶曲线;b-在5 L发酵罐中的产酶曲线
图6 重组菌株在不同发酵培养基中的产酶曲线及在5 L发酵罐中的产酶曲线
Fig.6 Enzyme production curves of recombinant strains in different fermentation medium and in a 5 L fermenter
3 结论与讨论
信号肽和启动子作为重要的2种表达元件,在蛋白质分泌过程中起着至关重要的作用。同一蛋白质在不同种类表达元件作用下的表达量可能相差甚远,甚至无法表达。因此,筛选合适的信号肽和启动子对于获得高产菌株来说十分必要。本研究以B.subtilis WB600为宿主菌,使用pBE-S质粒为载体,实现了A.alcalophilus来源蛋白酶AprAlc的重组表达。枯草芽孢杆菌主要通过2种途径向培养基中分泌蛋白质[20-22],即一般分泌(Sec)和双精氨酸易位(Tat)途径;约有95%的分泌蛋白经过Sec途径进行分泌。信号肽在这2个分泌过程中发挥着关键作用,其不仅将蛋白质直接靶向Sec或Tat装置,还显著影响分泌效率[23]。本研究所筛选的173种信号肽均属于Sec型信号肽,其中SPYdjm促进AprAlc分泌的效率最高,在LB培养基中酶活达到1 020 U/mL,是信号肽SPAprE的13.8倍。信号肽SPYqxI和SPAbnAw也有较强的促进作用。对SPYdjm、SPYqxI和SPAbnAw的长度、疏水性、和N端电荷进行对比,没有发现明显规律,这也进一步证实信号肽适配规律的复杂性。
使用强而可控的启动子是实现异源蛋白高水平表达的另一重要因素。B.subtilis中存在由不同类型σ因子(σA和σB)所识别的启动子。σA依赖性启动子往往介导看家基因在指数期的高效转录,而σB依赖性启动子在稳定期转录水平较高。基于该原理,构建可以在指数中后期和稳定期高效启动的双元启动子有助于提高外源基因的高效转录。在所构建的6种双元启动系统中,PHapII-Pylb所表现出的转录效率最高,在LB培养基中可以使AprAlc的产量提升1.7倍。Pylb启动子属于σB识别型启动子,能够促进基因从指数后期到稳定期的转录,该启动子已被用于β-半乳糖苷酶、普鲁兰酶和有机磷水解酶的高水平表达。而PHapII是来源于金黄色葡萄球菌的一种强组合型启动子,该类启动子能够维持基因在指数中后期的表达。同样含有Pylb的双启动子Pylb-PaprE却没有表现出如此明显的酶活力增强效果。这可能是与启动子的位置或排列顺序有关。与启动子Pylb-PaprE相比,PHapII-Pylb中的Pylb更靠近目的基因,也可能是因为Pylb和PaprE间存在交互作用影响正常启动功能[24-25]。
在上述表达元件优化的基础上,以豆粕和玉米粉为主要成分的发酵培养基使摇瓶培养的重组菌株产酶量达到18 600 U/mL,而发酵罐中酶产量比摇瓶提升1.83倍,达到34 050 U/mL。下一步可以对菌株的配套发酵工艺进行优化,进一步提升发酵罐中蛋白酶产量,为该酶的生产与应用奠定基础。
[1] JOO H S,KUMAR C G,PARK G C,et al.Oxidant and SDS-stable alkaline protease from Bacillus clausii I-52:Production and some properties[J].Journal of Applied Microbiology,2003,95(2):267-272.
[2] BARZKAR N,HOMAEI A,HEMMATI R,et al.Thermostable marine microbial proteases for industrial applications:Scopes and risks[J].Extremophiles Life Under Extreme Conditions,2018,22(3):335-346.
[3] 袁媛,王蕾,石亚伟.微生物来源碱性蛋白酶活性提高策略的研究进展[J].生物技术通报,2021,37(5):231-236.YUAN Y,WANG L,SHI Y W,et al.Research advances in strategies for improving the activity of microbial-derived alkaline proteases[J].Biotechnology Bulletin,2021,37(5):231-236.
[4] 陈坤,袁飞燕,柴昊男,等.一种高效表达碱性蛋白酶的新型启动子的筛选及研究[J].生物技术通报,2018,34(1):208-214.CHEN K,YUAN F Y,CHAI H N,et al.Screening and study of a new promoter with effective expression of alkaline protease[J].Biotechnology Bulletin,2018,34(1):208-214.
[5] RAO Y,CAI D B,WANG H,et al.Construction and application of a dual promoter system for efficient protein production and metabolic pathway enhancement in Bacillus licheniformis[J].Journal of Biotechnology,2020,312:1-10.
[6] ADINARAYANA K,ELLAIAH P,PRASAD D S.Purification and partial characterization of thermostable serine alkaline protease from a newly isolated Bacillus subtilis PE-11[J].AAPS PharmSciTech,2003,4(4):E56.
[7] WANG Y P,LIU Y H,WANG Z X,et al.Influence of promoter and signal peptide on the expression of pullulanase in Bacillus subtilis[J].Biotechnology Letters,2014,36(9):1783-1789.
[8] 周勇,徐刚,杨立荣,等.信号肽优化在枯草芽孢杆菌体系中对脂肪酶LipS分泌表达的影响[J].中国生物工程杂志,2015,35(9):42-49.ZHOU Y,XU G,YANG L R,et al.Effects of signal peptides′s optimization on the secretion of lipase S in Bacillus subtilis[J].China Biotechnology,2015,35(9):42-49
[9] KHADYE V S,SAWANT S,SHAIKH K,et al.Optimal secretion of thermostable β-glucosidase in Bacillus subtilis by signal peptide optimization[J].Protein Expression and Purification,2021,182:105843.
[10] 王茂军,色依德·斯马依,蔡逸安,等.不同信号肽及其组合对果聚糖蔗糖酶异源表达的影响[J].中国生物工程杂志,2023,43(5):37-44.WANG M J,SIMAYI S,CAI Y A,et al.Effects of different signal peptides and their combinations on heterologous expression of levansucrase[J].China Biotechnology,2023,43(5):37-44.
[11] GUAN C R,CUI W J,CHENG J T,et al.Development of an efficient autoinducible expression system by promoter engineering in Bacillus subtilis[J].Microbial Cell Factories,2016,15:66.
[12] 李怡欣,付刚,马媛媛,等.碱性蛋白酶SubC在枯草芽孢杆菌中的高效异源表达[J].微生物学通报,2021,48(10):3409-3420.LI Y X,FU G,MA Y Y,et al.Efficient heterologous expression of alkaline protease SubC in Bacillus subtilis[J].Microbiology China,2021,48(10):3409-3420.
[13] 陈振民.通过培养基优化和相关基因敲除提高枯草芽胞杆菌的产量[D].武汉:武汉大学,2011.CHEN Z M.Improving the yield of Bacillus subtilis by optimizing culture medium and knocking out related genes[D].Wuhan:Wuhan University,2011.
[14] 黄文晶.高产碱性蛋白酶重组菌及其发酵性能[D].无锡:江南大学,2012.HUANG W J.Recombinant strain with high alkaline protease production and its fermentation performance[D].Wuxi:Jiangnan University,2012.
[15] 李晓林.碱性蛋白酶高产诱变菌株的选育及发酵工艺研究[D].洛阳:河南科技大学,2017.LI X L.Breeding of mutant strain with high alkaline protease production and study on fermentation technology[D].Luoyang:Henan University of Science and Technology,2017.
[16] 陈菲.一株蛋白酶产生菌的鉴定、酶性质研究和表达载体构建[D].郑州:河南工业大学,2018.CHEN F.Identification,characterization and expression vector construction of a protease-producing strain[D].Zhengzhou:Henan University of Technology,2018.
[17] 王茜.中性蛋白酶产生菌AS1.398的诱变育种与发酵工艺研究[D].杭州:浙江工业大学,2016.WANG Q.Study on mutation breeding and fermentation technology of neutral protease producing strain AS1.398[D].Hangzhou:Zhejiang University of Technology,2016.
[18] 王慧.解淀粉芽孢杆菌Bacillus amyloliquefaciens K11高效表达体系的建立及其高效表达元件的优化[D].北京:中国农业科学院,2018.WANG H.Establishment of efficient expression system of Bacillus amyloliquefaciens K11 and optimization of efficient expression elements[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[19] LIU P L,GUO J X,MIAO L H,et al.Enhancing the secretion of a feruloyl esterase in Bacillus subtilis by signal peptide screening and rational design[J].Protein Expression and Purification,2022,200:106165.
[20] SARVAS M,HARWOOD C R,BRON S,et al.Post-translocational folding of secretory proteins in Gram-positive bacteria[J].Biochimica et Biophysica Acta,2004,1694(1-3):311-327.
[21] ZHANG K,SU L Q,WU J.Recent advances in recombinant protein production by Bacillus subtilis[J].Annual Review of Food Science and Technology,2020,11:295-318.
[22] BERKS B C,PALMER T,SARGENT F.The Tat protein translocation pathway and its role in microbial physiology[J].Advances in Microbial Physiology,2003,47:187-254.
[23] MIAO H B,JIANG R,HAN N Y,et al.Enhanced extracellular expression of α-Amylase DL3-4-1 in Bacillus subtilis via systematic screening of optimal signal peptides[J].Process Biochemistry,2021,108:176-184.
[24] ÖZTÜRK S,ERGÜN B G,ÇAL K P.Double promoter expression systems for recombinant protein production by industrial microorganisms[J].Applied Microbiology and Biotechnology,2017,101(20):7459-7475.
K P.Double promoter expression systems for recombinant protein production by industrial microorganisms[J].Applied Microbiology and Biotechnology,2017,101(20):7459-7475.
[25] PHANAKSRI T,LUXANANIL P,PANYIM S,et al.Synergism of regulatory elements in σB-and σA-dependent promoters enhances recombinant protein expression in Bacillus subtilis[J].Journal of Bioscience and Bioengineering,2015,120(4):470-475.