2,3-丁二醇(2,3-butanediol,2,3-BD)是一个典型的大宗化学品,它的主要特性是无色、无味、透明、吸湿,易溶解于水(20 ℃溶解度为500 g/L)、醇、酮和醚中,且有良好的生物降解性。2,3-BD作为一种具有高附加值的物质,被普遍应用在化工、食品、医药、燃料以及航空航天等领域[1]。同时,它可以作为生产溶剂和高附加值产品的中间体,如甲基乙基酮(用于涂料、润滑剂和黏合剂行业)、γ-丁内酯(调味品、清洁溶剂)、1,3-丁二烯(用于合成橡胶)、聚氨酯、乙偶姻和双乙酰(风味增强剂)[2]。
2,3-BD的生产主要有化学法和生物法两大类,目前,制备2,3-BD的最常用方法是化学合成后再提纯,但该方法成本高,工艺复杂,并且化石原料储量日益枯竭。近年来人们对微生物合成2,3-BD越来越关注,利用生物法生产2,3-BD具有原料可再生、绿色环保和价格低廉等优点,同时更为简易的工艺流程降低了其制备生产难度[3]。许多微生物在发酵生产2,3-BD方面有良好的表现,包括革兰氏阴性菌肺炎克雷伯氏菌、产酸克雷伯菌、产气肠杆菌、霍氏肠杆菌、阴沟肠杆菌和粘质沙雷氏菌等[4-6],革兰氏阳性菌枯草芽孢杆菌、地衣芽孢杆菌、解淀粉芽孢杆菌和多粘类芽孢杆菌等[7-8]。大多数微生物最适发酵温度为30~40 ℃,而革兰氏阳性菌芽孢杆菌可以在高温环境(50~60 ℃)条件下进行发酵制备2,3-BD,高温的发酵环境可以降低杂菌污染的风险[9-10]。
微生物发酵生产2,3-BD的效率与产量不仅由菌体自身的遗传特性所决定,还受到外界环境因素(温度、pH和溶解氧)和营养条件(碳源、氮源和金属离子等)的影响。这些因素通过干扰菌体生长繁殖速度以及2,3-BD代谢途径相关关键酶活力,从而导致底物的消耗、2,3-BD的合成和副产物产生等方面发生一系列的变化。例如2,3-BD是典型的微氧代谢产物,高溶氧环境会导致2,3-BD发生逆反应生成前体乙偶姻(acetoin,AC),但过低的溶解氧不利于大多数微生物的生长且偶联副产物有机酸的产生,因此适当的溶氧可以增加2,3-BD的产量[11]。此外,培养基中添加乙酸钠和柠檬酸铵可以促进微生物发酵产2,3-BD[12-13]。作者从福州森林公园温泉底土壤中分离获得1株在高温环境下产2,3-BD的甲基芽孢杆菌,并对其发酵工艺进行了系统优化,以期为生物法高效、安全生产2,3-BD提供更多的菌株选择和发酵工艺。
1 材料与方法
1.1 仪器与材料
1.1.1 试验材料
土壤:从福州贵安温泉世界采集水温长期处于55~65 ℃的水底土壤,挑选10个地点采集水底5~10 cm处的土壤样品作为原材料,筛选高温环境下产2,3-BD的菌株。
1.1.2 仪器与设备
SW-CJ超净工作台,苏净安泰公司;HH-2隔水式恒温水浴锅,鸿科仪器公司;HWS-150恒温培养箱,坤诚科仪公司;SKY-211CW摇床,苏坤公司;BioradPCR仪,伯乐公司;WP-UP-WF-30S微量分析型超纯水机,沃特尔公司;UV-1800PC紫外可见分光光度计,美普达公司;BIOTECH-5BG5 L发酵罐,上海保兴公司;7820A气相色谱仪,Agilent公司。
1.1.3 培养基配方
LB培养基(g/L):酵母粉5.0,蛋白胨10.0,氯化钠5.0,其中固体培养基中添加2%(质量分数)琼脂。
筛选发酵培养基(g/L):葡萄糖60.0、蛋白胨20.0、酵母粉5.0、磷酸二氢钾0.5,pH 7.0。
发酵培养基(g/L):葡萄糖75.0、蛋白胨5.0、酵母粉10.0、磷酸二氢钾0.4、柠檬酸铵3.0、硫酸锰0.1、硫酸镁0.6。
1.2 高温产2,3-BD菌株的筛选
1.2.1 菌株分离
准确称取5.0 g土样加入至50 mL无菌水中,放置于30 ℃、200 r/min摇床中振荡悬浮30 min,随后放入80 ℃恒温水浴锅水浴30 min。水浴结束后静置30 min沉降土壤,使用无菌水梯度稀释上清悬浮液,准确吸取100 μL的10-3~10-7稀释度悬浮液,均匀涂布于LB固体培养基平板上,放入50 ℃恒温培养箱中培养24 h,平板上出现形态各异的单菌落。
1.2.2 菌株筛选
从平板上挑选直径较大的单菌落接种于液体LB培养基,50 ℃、180 r/min摇床振荡培养24 h,吸取1%的菌液转接至筛选发酵培养基,每种菌株各接种3瓶,50 ℃、180 r/min条件下摇床振荡发酵24 h,取1 mL 发酵液放入高速冷冻离心机12 000 r/min离心5 min,取上清液利用VP比色法测定菌液中2,3-BD前体AC的含量。
VP比色法:1.5 mL离心管中分别加入5%(质量分数)氢氧化钠溶液、0.05%(质量分数)的肌酸溶液以及5%(质量分数)甲萘酚溶液各300 μL,混匀后加入300 μL发酵上清液。充分混合均匀后放入30 ℃恒温水浴锅中孵浴60 min,使用紫外分光光度计测定OD520吸光值。
1.2.3 菌株的鉴定
活化分离、筛选获得的菌株,菌体经革兰氏染色后在显微镜视野下观察细胞染色情况与菌株形态;同时,提取基因组DNA,使用正向引物1492R:5′-GGTTACCTTGTTACGACTT-3′和反向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′扩增16S rDNA,引物由生工合成。PCR反应条件:94 ℃预变性5 min,94 ℃ 变性10 s,55 ℃退火30 s,72 ℃延伸90 s,32个循环,最后72 ℃总延伸10 min。PCR产物经琼脂糖凝胶电泳后切胶回收送至公司测序,测序结果放入NCBI数据库进行同源性比对。
1.3 发酵工艺的优化
发酵条件采用以下方式:挑取单菌落接种于30 mL 的LB培养基,50 ℃、180 r/min摇床中振荡培养12 h,按5%(体积分数)接种量转接至发酵培养基,50 ℃、180 r/min条件下发酵24 h,其中250 mL三角瓶装液量为50 mL。针对发酵过程中的外界环境因素、培养基营养条件和金属离子进行单因素优化,并设计正交实验获得最优培养基成分组成,优化过程各个条件下设置3组平行试验。
1.3.1 外界环境因素优化
针对产物(AC+2,3-BD)发酵的外界环境因素包括发酵温度、培养基初始pH值和培养基装液量逐一优化,分别在发酵温度(30、35、40、45、50 ℃)、培养基初始pH值(5.0、6.0、7.0、8.0、9.0)和培养基装液量(10、30、50、70、90 mL)条件下进行发酵,发酵24 h后取样测定菌体浓度和产物(AC+2,3-BD)产量。
1.3.2 培养基营养条件优化
逐一优化培养基中的组成成分包括碳源、氮源、乙酸钠和柠檬酸铵,考察了不同碳源(葡萄糖、蔗糖、木糖、甘油、麦芽糖)、不同氮源(蛋白胨、安琪酵母粉、玉米粉、黄豆粉、硫酸铵、硝酸铵)以及添加乙酸钠(2、5、10、15、20 g/L)和柠檬酸铵(2、5、10、15、20 mmol/L)对菌株生长和发酵产2,3-BD的影响。
1.3.3 金属离子优化
探究发酵培养基中添加不同的金属离子(终浓度为1 mmol/L的Cu2+、Fe2+、Mn2+、Zn+、Mg2+、Fe3+)对菌株生长和发酵产2,3-BD的影响,并进一步优化有益金属离子的添加量。
1.3.4 正交设计
在单因素优化基础上,通过正交设计优化发酵培养基组成,选择包括葡萄糖、蛋白胨、酵母粉、磷酸二氢钾、柠檬酸铵、硫酸锰和硫酸镁共7个营养条件进行正交试验,设计7因素3水平共18组培养基配方。发酵结束后测定产物(AC+2,3-BD)产量,采用Minitab15.0进行数据分析测定结果,确定最优培养基成分组成。
1.4 上罐发酵生产2,3-丁二醇
1.4.1 发酵罐转速优化
基于正交设计试验得到的最优培养基配方进行上罐发酵试验,考察不同转速(100、200、300、400 r/min)对菌株生长和发酵产AC和2,3-BD的影响。其他条件:使用5 L发酵罐,装液量为3 L,发酵温度保持45 ℃,通气量为0.5 g/(L·h)。培养基初始pH为6.0,发酵过程中流加4 mol/L的NaOH溶液维持发酵培养基pH至6.0。每隔4 h取5 mL样品测定菌体浓度、AC和2,3-BD产量。
1.4.2 两阶段分批发酵
根据1.4.1节的试验结果,设计两阶段分批发酵方案,处理一:发酵罐起始转速400 r/min,发酵至第8 h,发酵罐降低至300 r/min;处理二:发酵罐起始转速400 r/min,发酵至第12 h,发酵罐降低至300 r/min。每隔4 h取5 mL样品测定菌体浓度、AC和2,3-BD产量。
1.4.3 脉冲式补料发酵
根据1.4.2节的试验结果,采用较优的两阶段分批发酵方案进行脉冲式补料发酵试验。在补料阶段,当发酵液中葡萄糖残糖量低于10 g/L的时候,补加90 g(终质量浓度为30 g/L)葡萄糖。当耗糖速度低于1 g/(L·h)时结束发酵。发酵过程中每隔5 h取样,测定菌体浓度、发酵液葡萄糖残糖含量、AC和2,3-BD产量。
1.5 定量分析方法
菌体浓度的定量测定:在菌体发酵过程中,对不同的发酵阶段进行取样,ddH2O稀释适当倍数后测定其在600 nm处光吸收值。同时,取梯度OD值的菌液高速离心收集菌体,置于80 ℃烘箱中烘干至恒重,称重后去除离心管的空重即为细胞干重(dry ceu weight,DCW),绘制DCW与OD600的标准曲线。
葡萄糖含量的定量测定:使用葡萄糖检测试剂盒(葡萄糖氧化酶法)测定发酵液中的葡萄糖含量,具体步骤参照试剂盒说明书。
AC和2,3-BD含量的定量测定:称取1.5 g无水碳酸钠于10 mL离心管中,加入2 mL的乙酸乙酯,边漩涡振荡边滴加0.4 mL样品,4 ℃静置2 h充分萃取,8 000 r/min离心8 min后取上清萃取液,使用气相色谱仪Agilent 7820A测定上清萃取液中AC和2,3-BD浓度。测定条件如下:色谱柱采用手性毛细管柱(β-DEXTM 120,30 m×0.25 mm×0.25 μm),柱温箱:50 ℃保留1.5 min;升温速率:8 ℃/min程序升温到140 ℃;进样口温度:215 ℃;检测器温度:245 ℃;以氮气为载气,载气流速1.2 mL/min;分流模式:分流出口流量/柱流量=10∶1;进样量:1 μL。
2 结果与分析
2.1 菌株的筛选和鉴定
采集水温处于55~65 ℃温泉底部的土壤分离高温条件下产2,3-BD的菌株,使用LB固体平板涂布分离,并利用VP试验检测发酵液中其前体AC含量,评估菌株产2,3-BD潜力。VP显色共筛选获得11株具有产2,3-BD潜力的菌株,其中6号菌株AC产量最高,明显高于其他10株菌株(图1-a、图1-b)。6号菌株经革兰氏染色后,在油镜下观察菌株染色情况与外观形态,发现该菌株形态呈长杆状,且酒精洗脱后仍呈紫色,说明该菌为革兰氏阳性杆菌(图1-c);提取细菌基因组DNA作为模板,扩增16S rDNA基因序列,琼脂电泳检测PCR结果,发现1 500 bp位置具有1条单一且清晰的特异性条带(图1-d),条带切胶回收后送至公司测序,测序结果放入NCBI进行BLASTn比对,比对结果发现6号菌株与甲基芽孢杆菌的16S rDNA同源性达到100%。试验利用特定土壤的分离高温条件下产2,3-BD的菌株,最终,获得了一株高温产2,3-BD的甲基芽孢杆菌。
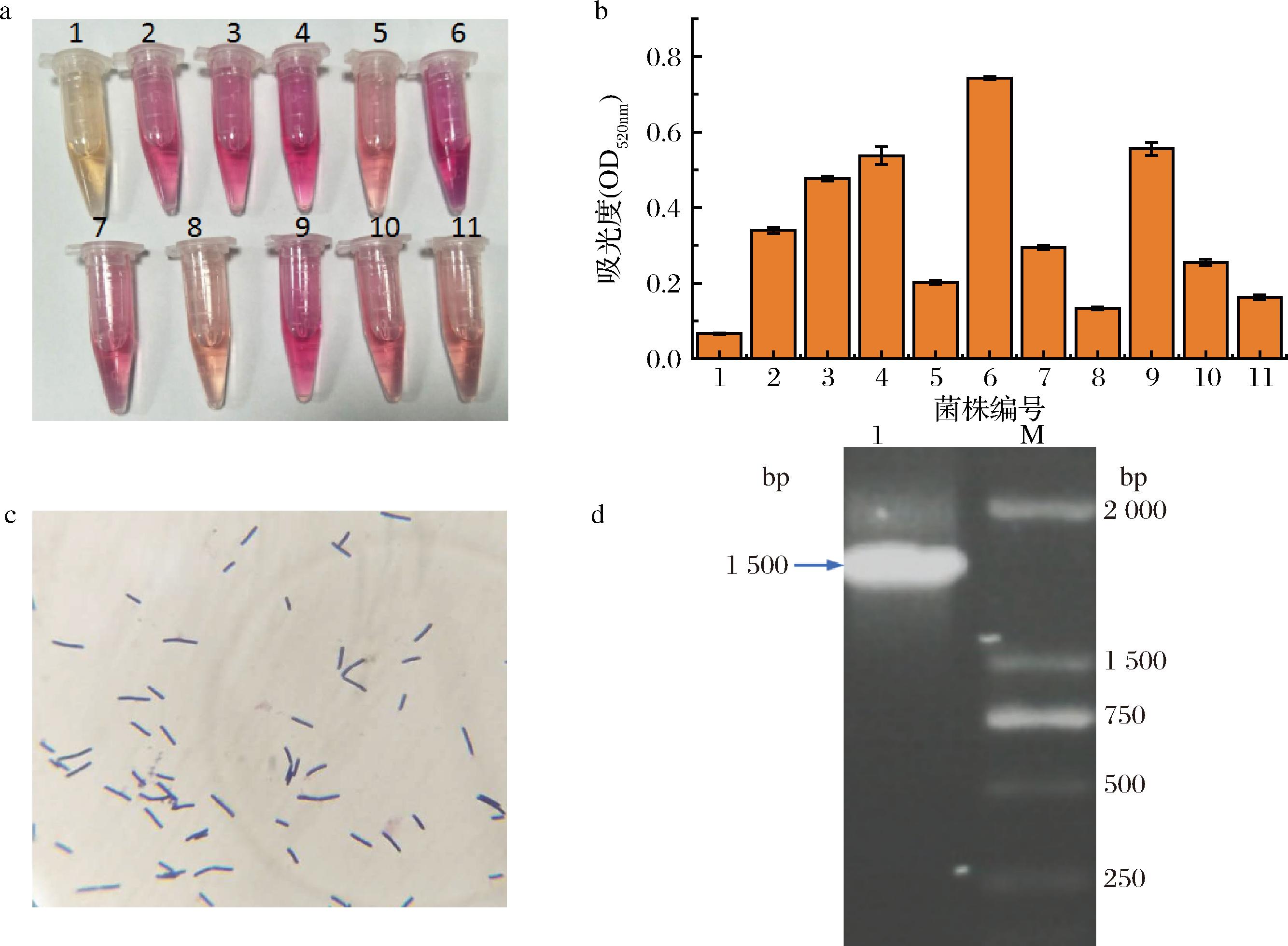
a-候选菌株VP试验(1~11分别为经筛选的候选菌株编号);b-VP试验吸光值;c-6号菌株革兰氏染色;d-6号菌株16S rDNA基因扩增(1~6号基因组DNA,M-2 000 bp DNA Marker)
图1 高温产2,3-丁二醇菌株的筛选与鉴定
Fig.1 Screening and identification a thermophilic strain for 2,3-BD production

a-发酵温度优化;b-发酵培养基初始pH值优化;c-培养基装液量优化
图2 发酵条件优化结果
Fig.2 Optimization results of fermentation condition
2.2 发酵工艺优化
2.2.1 发酵条件优化
试验筛选获得了一株高温发酵产2,3-BD的甲基芽孢杆菌,针对其发酵条件包括发酵温度、发酵液初始pH以及装液量逐一进行优化。发酵温度优化结果如图2-a所示,可以看出随着发酵温度的升高产物(AC+2,3-BD)产量逐渐增加,在45 ℃时达到最高,略高于50 ℃,且糖消耗速度最快,作为最适发酵温度,发酵24 h产物质量浓度达到12.34 g/L,葡萄糖残余2.61 g/L;发酵液初始pH 6.0最有利于甲基芽孢杆菌消耗葡萄糖和积累产物,产物产量达到12.99 g/L,明显高于其他酸碱度条件(图2-b);装液量优化结果如图2-c所示,可以看出甲基芽孢杆菌对葡萄糖的消耗速度随着装液量增加而降低,表明溶氧的增加有助于菌株对葡萄糖的消耗,装液量为30/250 mL最有利于产物积累,发酵24 h产物产量达到16.85 g/L。发酵条件优化结果说明甲基芽孢杆菌的最优发酵条件为温度45 ℃、发酵液初始pH 6.0、装液量30/250 mL。
2.2.2 发酵培养基优化
基于发酵条件优化结果,进一步优化发酵培养基的组成成分(包括碳源、氮源、柠檬酸铵和乙酸钠)。优化结果如图3所示,可以看出不同的碳源对甲基芽孢杆菌发酵产物(AC+2,3-BD)产量具有显著的影响,以葡萄糖作为唯一碳源时产物产量最高,达到20.53 g/L,其次是蔗糖,对木糖、甘油和麦芽糖的利用能力差,产物产量低(图3-a);最优氮源为酵母粉,产物产量达到23.89 g/L,明显高于其他5种氮源(图3-b);添加2 mmol/L的柠檬酸铵可以促进产物积累,产物产量达到26.60 g/L,相对未添加产量提高11.33%,随着柠檬酸铵添加量的继续升高反而抑制产物产量(图3-c);对于乙酸钠,优化结果发现添加乙酸钠不利于甲基芽孢杆菌的生长和产物积累(图3-d)。发酵培养基组成成分优化结果说明甲基芽孢杆菌发酵合成产物的培养基最优碳源为葡萄糖,最优氮源为酵母粉,培养基中添加量2 mmol/L柠檬酸铵。

a-碳源优化;b-氮源优化;c-柠檬酸铵添加量优化;d-乙酸钠添加量优化
图3 发酵培养基优化结果
Fig.3 Optimization results of fermentation medium
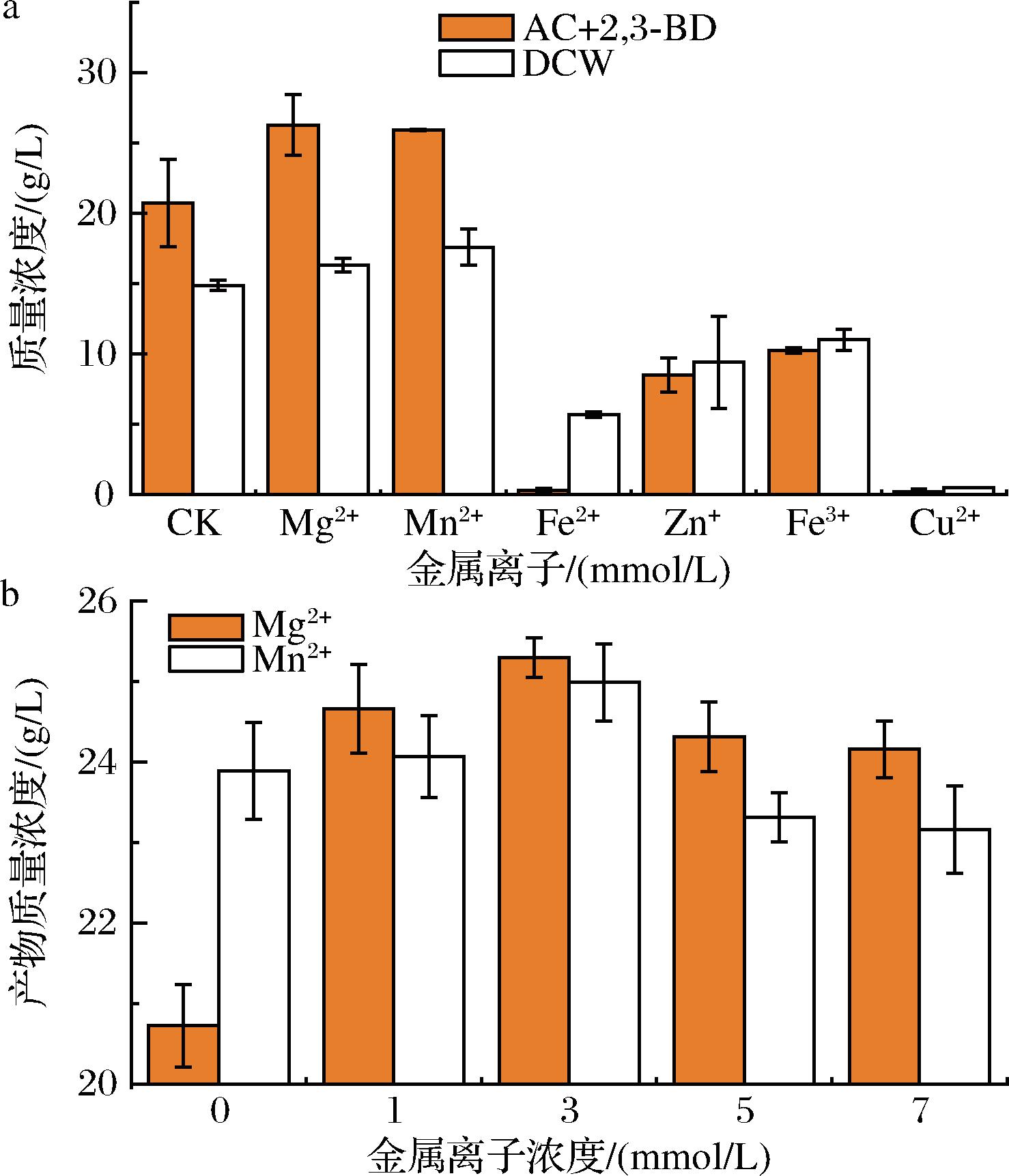
a-金属离子优化;b-有益金属离子添加量优化
图4 金属离子对甲基芽孢杆菌发酵产2,3-BD的影响
Fig.4 Effection of metal ions for 2,3-BD production by Bacillus methylotrophicus
2.2.3 金属离子优化
金属离子通过影响菌丝的生长和代谢途径关键酶活力调控产物的积累,因此,分别考察了添加1 mmol/L Cu2+、Fe2+、Mn2+、Zn+、Mg2+、Fe3+对菌株生长和产物积累的影响。试验结果表明添加1 mmol/L的Mg2+和Mn2+可以促进菌株生长和产物积累,相比对照产物产量分别提高26.72%和25.08%,而Cu2+、Fe2+、Zn+和Fe3+对菌株生长和产物积累具有显著的抑制作用(图4-a);进一步优化Mg2+和Mn2+的添加量,结果如图4-b所示,可以看出1~7 mmol/L的Mg2+和Mn2+可以促进菌株生长和产物积累,其中两者的最佳添加浓度均为3 mmol/L。金属离子优化结果说明发酵培养基中添加3 mmol/L Mg2+和Mn2+可以促进甲基芽孢杆菌的生长与产物积累。
2.2.4 正交优化
基于单因素优化结果,进一步对葡萄糖、安琪酵母粉、磷酸二氢钾、硫酸镁、硫酸锰和柠檬酸铵7个有益因子进行正交优化,使用正交软件设计7因素3水平L18 (37)共18组试验。分别配制18组发酵培养基进行发酵,发酵24 h后取样测定产物(AC+BD)产量,结果如表1所示,可以看出不同组别之间的产物产量差异明显,其中组11产物产量最低,仅为17.22 g/L,而组16最高达到29.88 g/L。正交试验结果进行均值和方差分析,发现7个因素对产物产量的影响强度排序为葡萄糖>Mg2+>Mn2+>磷酸二氢钾>柠檬酸铵>酵母粉>蛋白胨,7个因素最佳的培养基组合为2132313,最优培养基配方为:葡萄糖75 g/L、酵母粉10 g/L、蛋白胨5 g/L、柠檬酸铵3 g/L、磷酸二氢钾0.5 g/L、硫酸镁0.6 g/L、硫酸锰0.1 g/L。试验在单因素优化结果的基础上,设计7因素3水平正交优化发酵培养基配方,对结果进行分析得到最优发酵培养基组成,使用该培养进行发酵,发酵24 h收集样品检测,产物产量达到32.57 g/L。
表1 正交设计L18(37)试验结果 单位:g/L
Table 1 Orthogonal design L18(37) experiment results

试验葡萄糖蛋白胨酵母粉磷酸二氢钾柠檬酸铵硫酸锰硫酸镁AC+2,3-BD160550.210.10.217.32±0.322607.57.50.420.30.419.95±0.2436010100.630.50.619.50±0.56475550.420.50.625.24±0.455757.57.50.630.10.223.24±0.4167510100.210.30.422.89±0.3479057.50.230.30.622.59±0.538907.5100.410.50.220.10±0.239901050.620.10.422.33±0.5110605100.620.30.216.03±0.3811607.550.230.50.417.22±0.441260107.50.410.10.620.87±0.37137557.50.610.50.420.59±0.5714757.5100.220.10.625.65±0.4215751050.430.30.221.08±0.3216905100.430.10.429.88±0.5517907.550.610.30.622.18±0.341890107.50.220.50.219.48±0.53K118.4821.9420.8920.8620.6623.2119.55K223.1221.3921.1222.8621.4520.7922.14K322.7621.0322.3420.6522.2520.3622.67极差(R)4.630.921.452.211.592.8563.13排序1764532
2.3 上罐发酵生产2,3-BD
2.3.1 发酵罐转速
使用正交优化得到的最优培养基放大上罐发酵产2,3-BD,由于溶氧对2,3-BD产量影响明显,因此,对发酵罐转速进行考察,测定100、200、300、400 r/min转速条件下甲基芽孢杆菌发酵效果。结果发现不同转速条件下菌株发酵效果差异极大,提升转速增加发酵液中的溶氧,菌株的生长速度明显加快,同时,葡萄糖的利用速率显著提高以满足菌株生长对营养和能量的需求(图5-a和图5-b)。类似,300、400 r/min转速条件下产物的产量明显高于100、200 r/min,然而这2种转速下AC和2,3-BD的积累情况截然不同。300 r/min条件下产物AC积累速度缓慢,24 h产量仅达到3.07 g/L(图5-c),而代谢产物2,3-BD随着发酵时间的延长快速积累,24 h时产量达到20.49 g/L(图5-d);不同的是,400 r/min条件下的产物AC快速积累,20 h时AC产量最大达到29.78 g/L(图5-c),而产物2,3-BD随着发酵时间的延长则呈先上升后下降趋势,前12 h积累速度快于300 r/min,然后迅速降低,至24 h仅剩下0.61 g/L(图5-d)。上述试验结果说明,提高转速增强溶氧有助于甲基芽孢杆菌的生长,产物AC和2,3-BD发酵前期快速积累,然而,过高的转速会导致2,3-BD逆反应生成AC,一定程度上可能是因为过高的转速导致氧气充足,过多的消耗了还原力NADH,导致细胞内NAD+增加,加速了2,3-BD逆反应转化为AC。因此,控制合适的转速对于2,3-BD的合成至关重要。

a-DCW浓度;b-葡萄糖残糖质量浓度;c-AC质量浓度;d-2,3-BD质量浓度
图5 不同发酵罐转速发酵结果
Fig.5 Fermentation results under different fermenter stirring paddle speeds

a-DCW质量浓度;b-葡萄糖残糖质量浓度;c-AC质量浓度;d-2,3-BD质量浓度
图6 两阶段分批发酵结果
Fig.6 Fermentation results under two-stage batch fermentation conditions
2.3.2 两阶段分批发酵
基于不同发酵罐转速条件下甲基芽孢杆菌生长和产2,3-BD情况,理性设计两阶段发酵策略,先于400 r/min条件下进行发酵,实现菌体的快速生长和产物的快速积累,分别在第8 h(处理一)和12 h(处理二)降低发酵罐转速至300 r/min避免2,3-BD逆反应生成AC。结果如图6所示,可以看出降低发酵罐转速后菌体生长和葡萄糖代谢速度延缓,处理一发酵罐转速降速早于处理二,因此,菌体浓度和葡萄糖消耗速率低于后者(图6-a和图6-b);在代谢产物积累方面,处理一第8 h发酵罐降速后,AC产量降低并维持在低水平,直至16 h产量开始迅速上升,而2,3-BD在发酵罐降速后产量持续升高,直至16 h开始下降,这主要是因为发酵16 h葡萄糖消耗殆尽,通过2,3-BD逆反应为菌体提供能量(图6-b和图6-d)。处理二第12 h发酵罐降速后,AC产量持续积累至20 h达到最大值16.27 g/L,而2,3-BD在发酵罐降速后产量开始缓慢减低(图6-d)。上述结果说明,发酵前期快速搅拌促使菌体快速生长和产物的快速积累,后期降低转速,使得乙偶姻向着生成2,3-BD的方向转化,为了避免副产物AC的过多积累,8 h即需降低转速。
2.3.3 分批补料发酵
根据两阶段分批发酵试验结果,使用处理一方案开展补料发酵,当残糖量<10 g/L的时候,补加90 g使发酵液中葡萄糖浓度提高30 g/L,总发酵时间为50 h,期间共计补料4次,补料间隔逐次递增,底物总质量浓度达到195 g/L。
由图7可以看出,菌株菌体浓度在发酵前期迅速升高,发酵10 h后就进入稳定期,补料期间菌体质量浓度在24~30 g/L轻微波动;产物积累上,AC产量始终维持在低水平状态,而2,3-BD产量随着发酵时间的延长迅速积累,发酵至45 h达到最高值,产量达到73.19 g/L;发酵至45 h时甲基芽孢杆菌共消耗176.20 g/L葡萄糖,2,3-BD转化率达到90.25%(mol/mol)。

图7 葡萄糖分批补料发酵结果
Fig.7 Fermentation results of glucose supplement batch
3 结论与讨论
试验采集温泉底部土壤作为试验材料,经过分离与筛选共获得11株耐高温且发酵产2,3-BD的菌株,通过VP试验比较分析发现6号菌株2,3-BD的前体AC积累量最高,对6号菌株进行分子鉴定和革兰氏染色后显微观察,发现6号菌为革兰氏阳性菌、菌体形态呈长杆状,其16S rDNA与甲基芽孢杆菌的同源性达到100%,甲基芽孢杆菌是一种耐高温、耐干燥的细菌[14]。
以产物(AC+2,3-BD)产量为指标优化甲基芽孢杆菌的发酵工艺,发酵条件优化结果表明其最适发酵条件为发酵温度45 ℃、发酵液初始pH 6.0、装液量30/250 mL;优化培养基组成结果发现甲基芽孢杆菌的最优碳氮源分别为葡萄糖和酵母粉,这与WANG等[15]的研究结果一致,添加2 mmol/L柠檬酸铵可以有效提高产物产量[15],不同的是研究报道添加乙酸可以促进2,3-BD的积累[16-17],而本试验研究结果发现乙酸对产物积累有明显的抑制作用;此外,添加3 mmol/L Mg2+和Mn2+可以明显促进甲基芽孢杆菌的生长与产物的积累,这与WANG等[7]和杨云龙等[18]的研究结果一致;最后,根据单因素优化结果,通过正交优化得到最优发酵培养基,培养基组成:葡萄糖75 g/L、酵母粉10 g/L、蛋白胨5 g/L、柠檬酸铵3 g/L、KH2PO4 0.5 g/L、MgSO4 0.6 g/L、MnSO4 0.1 g/L,在最适发酵条件下,使用该培养基发酵24 h产物产量达到32.57 g/L。
进一步上罐放大发酵生产2,3-BD,单因素优化过程中发现溶氧条件(装液量)对产物产量具有明显的影响,因此,考察了不同发酵罐转速条件下甲基芽孢杆菌的发酵情况。结果发现转速400 r/min最有利于菌株生长和葡萄糖利用,发酵前期2,3-BD积累速度快,但是后期逆反应生产AC,导致副产物的大量积累;转速300 r/min条件下芽孢杆菌发酵产2,3-BD产量最高,同时代谢副产物AC积累量少,然而,发酵前期2,3-BD积累速度明显慢于转速400 r/min,说明甲基芽孢杆菌的发酵需要一定的溶氧,但是2,3-BD属于微氧发酵产物,溶氧过高会导致2,3-BD逆反应生成乙偶姻,杨欢欢等[19]和樊亚超等[20]也得到相同的结论;基于上述结果理性设计两阶段分批发酵策略,处理一(发酵罐起始转速400 r/min,发酵至第8 h发酵罐转速降低至300 r/min)更优利于2,3-BD的积累,发酵16 h时2,3-BD产量达到22.18 g/L,同时仅有少量副产物乙偶姻积累;利用处理一进行分批补料发酵,发酵至45 h达到最高值,2,3-BD产量为73.19 g/L,转化率达到90.25%。
[1] 崔有志,杜丽平,马立娟,等.氧化去木质素玉米芯同步糖化发酵产2,3-丁二醇[J].食品与发酵工业,2016,42(10):8-13.CUI Y Z,Du L P,MA L J,et al.Optimization of 2,3-butanediol production using simultaneous saccharification and fermentation from corncob after delignification by oxidant[J].Food and Fermentation Industries,2016,42(10):8-13.
[2] SONG C W,PARK J M,CHUNG S C,et al.Microbial production of 2,3-butanediol for industrial applications[J].Journal of Industrial Microbiology and Biotechnology,2019,46(11):1583-1601.
[3] 李秀鹏,杨套伟,徐美娟,等.过量表达枯草芽孢杆菌乙偶姻还原酶提高2,3-丁二醇产量[J].食品与生物技术学报,2016,35(3):252-257.LI X P,YANG T W,XU M J,et al.Improved 2,3-butanediol production by overexpressing acetoin reductase in Bacillus subtilis 168[J].Journal of Food Science and Biotechnology,2016,35(3):252-257.
[4] ZHANG L Y,YANG Y L,SUN J A,et al.Microbial production of 2,3-butanediol by a mutagenized strain of Serratia marcescens H30[J].Bioresource Technology,2010,101(6):1961-1967.
[5] MENG W S,ZHANG Y J,CAO M H,et al.Efficient 2,3-butanediol production from whey powder using metabolically engineered Klebsiella oxytoca[J].Microbiou Cell Factories,2020,19(1):162.
[6] 王杰明,卢艳波,杨小雁,等.产2,3-丁二醇霍氏肠杆菌的筛选及其发酵优化[J].食品与发酵工业,2022,48(21):30-35.WANG J M,LU Y B,YANG X Y,et al.Screening of 2,3-butanediol-producing Enterobacter hormaechei and its fermentation optimization[J].Food and Fermentation Industries,2022,48(21):30-35.
[7] WANG D,OH B R,LEE S,et al.Process optimization for mass production of 2,3-butanediol by Bacillus subtilis CS13[J].Biotechnology for Biofuels,2021,14(1):15.
[8] 徐尤勇,高健,徐虹,等.Paenibacillus polymyxa ZJ-9混合发酵菊粉和葡萄糖合成R,R-2,3-丁二醇[J].食品与发酵工业,2015,41(3):8-13.XU Y Y,GAO J,XU H,et al.Production of R,R-2,3-butanediol through mixed fermentation of inulin and glucose by Paenibacillus polymyxa ZJ-9[J].Food and Fermentation Industries,2015,41(3):8-13.
[9] OHAIR J,JIN Q,YU D J,et al.Non-sterile fermentation of food waste using thermophilic and alkaliphilic Bacillus licheniformis YNP5-TSU for 2,3-butanediol production[J].Waste Management,2021,120:248-256.
[10] LI L X,CHEN C,LI K,et al.Efficient simultaneous saccharification and fermentation of inulin to 2,3-butanediol by thermophilic Bacillus licheniformis ATCC 14580[J].Applied and Environmental Microbiology,2014,80(20):6458-6464.
[11] FOLLE A B,DE SOUZA B C,REGINATTO C,et al.Medium composition and aeration to high (R,R)-2,3-butanediol and acetoin production by Paenibacillus polymyxa in fed-batch mode[J].Archives of Microbiology,2023,205(5):171.
[12] MENG W S,ZHANG L J,CAO M H,et al.2,3-Butanediol synthesis from glucose supplies NADH for elimination of toxic acetate produced during overflow metabolism[J].Cell Discovery,2021,7(1):43.
[13] YANG T W,ZHANG X,RAO Z M,et al.Optimization and scale-up of 2,3-butanediol production by Bacillus amyloliquefaciens B10-127[J].World Journal of Microbiology and Biotechnology,2012,28(4):1563-1574.
[14] YU D J,O′HAIR J,POE N,et al.Conversion of food waste into 2,3-butanediol via thermophilic fermentation:Effects of carbohydrate content and nutrient supplementation[J].Foods,2022,11(2):169.
[15] WANG D,KIM H,LEE S,et al.Simultaneous production of poly-γ-glutamic acid and 2,3-butanediol by a newly isolated Bacillus subtilis CS13[J].Applied Microbiology and Biotechnology,2020,104(16):7005-7021.
[16] 司阳,夏黎明.利用玉米秸秆水解液发酵生产2,3-丁二醇[J].食品与发酵工业,2010,36(2):26-29.SI Y,XIA L M.Fermentative production of 2,3-butanediol from corn stover hydrolysate[J].Food and Fermentation Industries,2010,36(2):26-29.
[17] BISWAS R,YAMAOKA M,NAKAYAMA H,et al.Enhanced production of 2,3-butanediol by engineered Bacillus subtilis[J].Applied Microbiology and Biotechnology,2012,94(3):651-658.
[18] 杨云龙,张燎原,孙建安,等.粘质沙雷氏菌利用蔗糖和柠檬酸铵生产2,3-丁二醇的研究[J].化学与生物工程,2009,26(9):41-44.YANG Y L,ZHANG L Y,SUN J A,et al.Study on 2,3-Butanediol production by Serratia marcescens using sucrose and ammonium citrate[J].Chemistry and Bioengineering,2009,26(9):41-44.
[19] 杨欢欢,高健,徐虹,等.利用菊芋菊粉制备R,R-2,3-丁二醇发酵工艺条件的优化[J].食品与发酵工业,2011,37(11):6-10.YANG H H,GAO J,XU H,et al.Optimization of fermentation conditions for R,R-2,3-butanediol production using inulin extract from jerusalem artichoke tubers[J].Food and Fermentation Industries,2011,37(11):6-10.
[20] 樊亚超,张霖,李晓姝,等.Klebsiella pneumoniae CICC10011发酵产2,3-丁二醇的工艺研究[J].中国生物工程杂志,2018,38(2):68-74.FANG Y C,ZHANG L,LI X S,et al.Study on the fermentation of 2,3-butanediol by Klebsiella pneumoniae CICC10011[J].China Biotechnology,2018,38(2):68-74.