高强度运动会导致身体出现明显的疲劳感,长期的高强度运动会引发慢性疲劳,大部分运动员以及体力工作者均深受其害。外周疲劳被定义为由于神经肌肉连接处或远端发生的改变而导致的最大力量的损失[1]。长时间的高强度运动所引发的外周肌肉的疲劳具体表现为骨骼肌功能下降,不能维持预定收缩强度等现象。高强度运动会导致肌肉正常代谢功能的紊乱和肌肉结构的损伤,其能量代谢紊乱表现为肌肉中乳酸的过量堆积[2]以及糖原的过量消耗[3],过度的乳酸堆积会触发系列病理性反应,导致延迟性肌肉酸痛或者非感染性炎症[4],而血清中的肌酸激酶活性和乳酸脱氢酶的活性常被用来反映肌细胞的损伤程度[5]。目前对于这种疲劳感的治疗大多采用睡眠休息为主、膳食药物为辅的方法,市场上较多的产品有药物、功能饮料等,但是这些产品或多或少都会有一些副作用,主要是外源性对抗疲劳所带来的身体变化,存在一定的风险及人群针对性。因此寻求一种可安全有效地缓解由于高强度运动所导致的外周肌肉疲劳的膳食干预方法非常重要。
人体的肠道中含有大量的肠道菌群,肠道菌群与宿主肠道屏障功能、免疫系统发育以及营养代谢关系密切。益生菌被定义为“当摄入足够数量时,给予宿主有益健康作用的活的微生物”,已被证明对肠道菌群具有显著的调节作用。植物乳杆菌作为食品中常用的乳酸菌中的一种,已被证明具有一定的免疫调节、抑制致病菌生长等作用。植物乳杆菌在缓解肌肉损伤方面也有研究。LEE等[6]研究表明,植物乳杆菌HY7715可以有效缓解小鼠的肌肉损伤。因此,植物乳杆菌作为潜在的具有缓解疲劳作用的膳食补充剂,具有很好的研究价值和应用前景。
1 材料与方法
1.1 材料与试剂
植物乳杆菌FSCDJY73L1和FJSWX14L1均保藏于江南大学生物技术中心菌种保藏库。
实验选用32只SPF级雄性ICR小鼠,饲养于江南大学动物实验中心SPF级屏障环境,室温(22±1) ℃,湿度(55±10)%,光照与黑暗各12 h。动物实验方案经江南大学实验伦理委员会批准,审批号:JN.No20201230i0960420[398],所有动物实验操作符合江南大学动物管理与使用委员会的规定(SYXK 2021-0056)和欧盟指导手册(编号:2010/63/EU)。
乳酸脱氢酶(lactic acid dehydrogenase,LDH)试剂盒(微板法)、肌糖原测定试剂盒(比色法)、乳酸测试盒(比色法)和肌酸激酶测定试剂盒(比色法),南京建成生物工程研究所。
1.2 仪器与设备
RP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;Eppendorf 高速冷冻离心机5804R,德国艾本德股份公司;994型Thermo超低温冰箱、酶标仪,美国赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 动物实验方案
适应喂养1周后,将32只ICR雄性小鼠随机分为空白组、模型组、73L1组和14L1组,每组8只。造模期间,对模型组和2组植物乳杆菌干预组进行为期6周的高强度运动造模实验,期间空白组和模型组小鼠每日灌胃200 μL质量浓度为100 g/L的脱脂乳;73L1组和14L1组小鼠每日灌胃200 μL含有1×109 CFU/mL对应植物乳杆菌的上述脱脂乳。从动物入驻开始记录小鼠每周的体重变化。
造模结束后,所有小鼠在水箱进行无负重游泳,游泳30 min后,迅速采用质量浓度为10 g/L的戊巴比妥钠腹腔注射麻醉,取血后辅以断颈处死。血液样本离心15 min(3 500 r/min,4 ℃),取上清液获得血清,-80 ℃冻存;取左腿肌肉组织中腓肠肌、胫骨前肌、股四头肌样本称重,所有组织样本于液氮中速冻并转移于-80 ℃冻存。
1.3.2 高强度运动模型构建
高强度运动模型参照CHEN等[7]的方法并作适当修改。具体方案如下:高强度运动造模共6周;第1周进行无负重适应游泳,周一游泳30 min,周二游泳45 min,周三~周五游泳60 min,周末休息;第2周负重1%(质量分数)的物体(物体/体重),周一~周五游泳60 min,周末休息;第3周~第4周负重2%(质量分数)的物体(物体/体重),周一~周五游泳60 min,周末休息;第5周~第6周负重为3%(质量分数)的物体(物体/体重),周一~周五游泳60 min,周末休息。游泳均在水深30 cm,水温(25±1) ℃的塑料水箱中进行。
1.3.3 小鼠肌肉相关指标测定
将-80 ℃保藏的腓肠肌、股四头肌取出,按照组织与∶生理盐水比为1∶9(g∶mL)=进行匀浆研磨,经过离心后取得上清液,采用南京建成生物工程研究所试剂盒检测腓肠肌样本中的乳酸含量和股四头肌中的糖原含量。
1.3.4 小鼠血清相关指标测定
参照南京建成生物工程研究所试剂盒方法,检测血清样本中肌酸激酶和乳酸脱氢酶的活性。
1.4 数据分析
数据以“均数±标准差”表示,用 GraphPad Prism 9(GraphPad software,California,USA,9.0 版)将实验数据进行正态分布检验,对符合正态分布的数据进行t检验(Student′s t test),P<0.05为差异有统计学意义。各组均与模型组比较分析讨论,*与模型组比较,P<0.05;**与模型组比较,P<0.01;***与模型组比较,P<0.001。
2 结果与分析
2.1 植物乳杆菌对小鼠体重的影响
由图1可知,所有实验组小鼠最终体重均较初始体重有所增加,但与空白组相比,模型组小鼠体重增量显著降低(P<0.05),而植物乳杆菌73L1和植物乳杆菌14L1干预后,虽无显著性,但均在一定程度上减缓了小鼠体重增量降低的趋势。
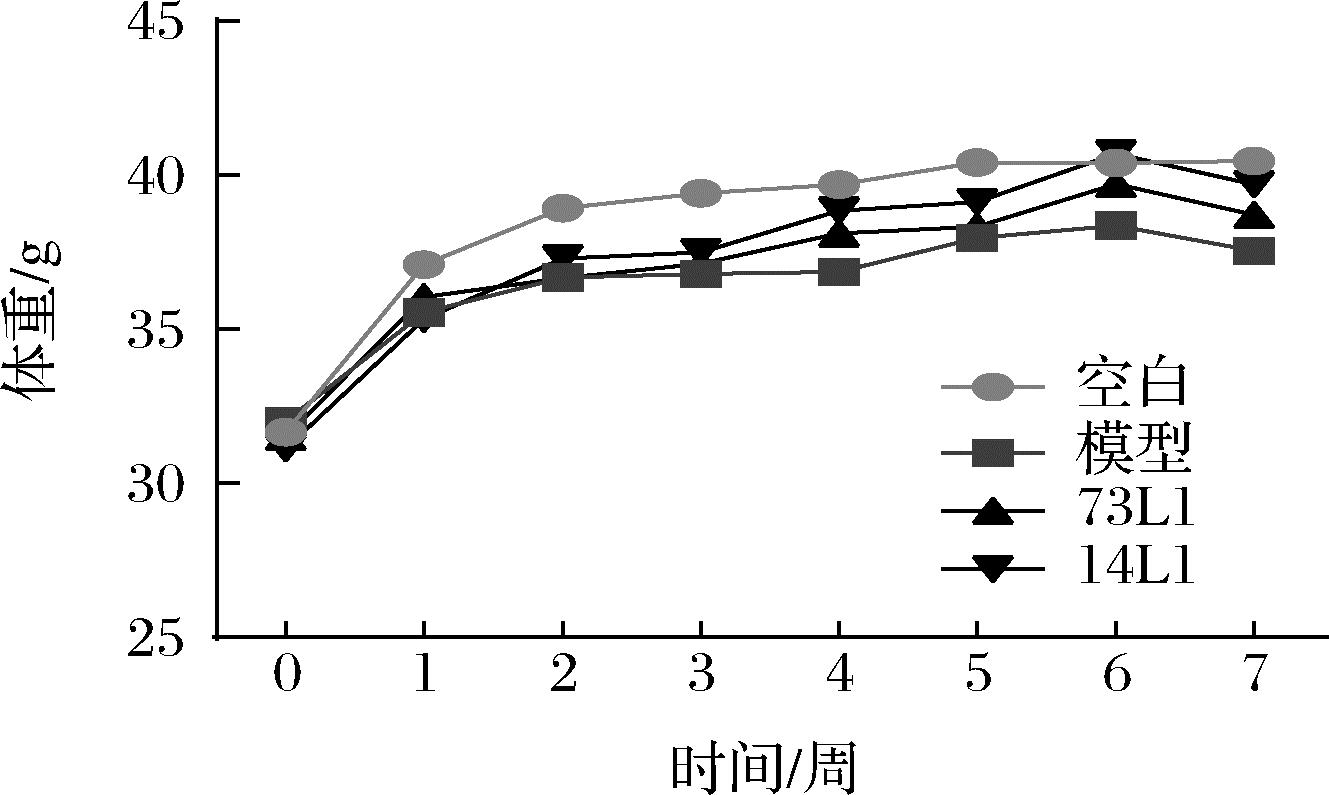
图1 各组小鼠体重变化趋势图
Fig.1 Trend of body weight of mice in each group
2.2 植物乳杆菌73L1对小鼠肌肉含量及结构的影响
由图2-a可知,高强度运动以及植物乳杆菌的干预对于肌肉含量(肌肉/体重)没有显著影响。此外,在高强度运动下,小鼠的腓肠肌质量显著下降(P<0.01),灌胃植物乳杆菌73L1后,小鼠的腓肠肌质量显著增加(P<0.05)(图2-c)。而胫骨前肌(图2-b)和股四头肌(图2-d)的质量均未出现显著变化。这些结果提示了腓肠肌的重要性,腓肠肌富含肌纤维,与运动过程中的能量代谢和氧化应激密切相关。植物乳杆菌73L1可以有效地增加高强度运动下小鼠的腓肠肌质量,改善小鼠由于高强度运动所造成的肌肉结构失调。

a-肌肉占比;b-胫骨前肌;c-腓肠肌;d-股四头肌
图2 植物乳杆菌对高强度运动小鼠肌肉含量及质量的影响
Fig.2 Effects of L.plantarum on the muscle content and mass in mice under high-intensity exercise
注:*表示与模型组比较,P<0.05;**表示与模型组比较,P<0.01。
2.3 植物乳杆菌73L1对小鼠肌肉能量代谢指标的影响
由图3-a可知,与空白组相比,模型组小鼠肌肉中肌乳酸的含量显著增加,而与模型组相比,73L1组小鼠肌肉中肌乳酸的含量显著下降(P<0.05),且低于空白组小鼠。植物乳杆菌14L1干预后,小鼠肌肉中肌乳酸含量下降,但差异不具有统计学意义(P>0.05)。此外,高强度运动下小鼠肌肉中肌糖原的含量显著下降(P<0.05),但植物乳杆菌73L1和植物乳杆菌14L1干预后并未逆转这一变化(图3-b)。这些结果表明植物乳杆菌73L1可以在一定程度上缓解高强度运动导致的乳酸堆积,提高乳酸的循环利用率,缓解高强度运动下小鼠肌肉能量代谢的紊乱。
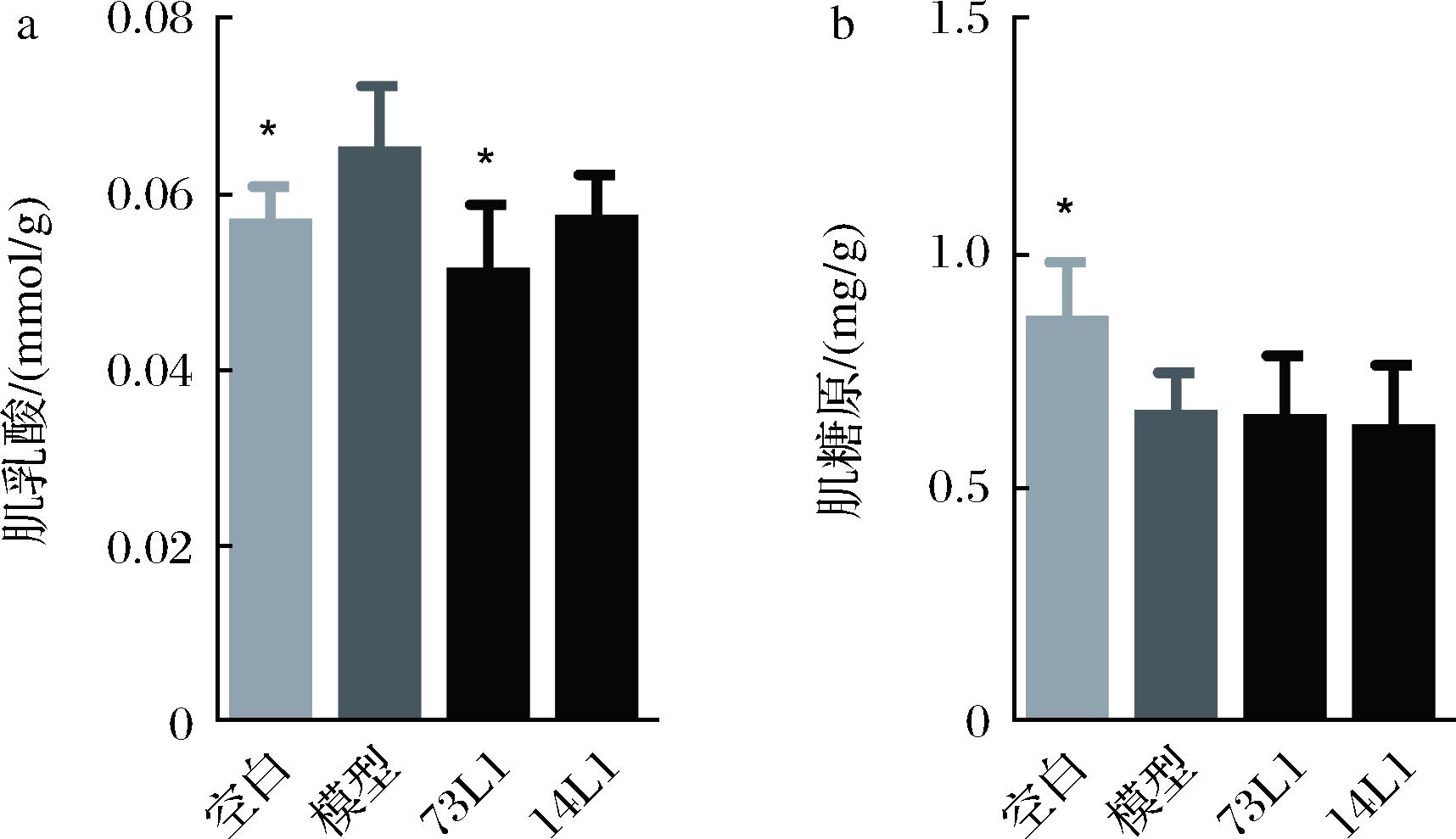
a-肌乳酸;b-肌糖原
图3 植物乳杆菌对高强度运动下小鼠肌肉 能量代谢指标的影响
Fig.3 Effects of L.plantarum on muscle energy metabolism indexes in mice under high-intensity exercise
注:*表示与模型组比较,P<0.05。
2.4 植物乳杆菌73L1对小鼠肌肉损伤指标的影响
由图4-a可知,与空白组相比,模型组小鼠血清中乳酸脱氢酶活性显著上升(P<0.05)。2株植物乳杆菌干预后均能显著降低小鼠血清中乳酸脱氢酶活性,其中,73L1效果更好(P<0.01)。此外,高强度运动下小鼠血清中肌酸激酶活性显著增加(P<0.01),而与模型组相比,73L1组小鼠血清中肌酸激酶活性显著下降(P<0.05)。血清中乳酸脱氢酶和肌酸激酶的活性是检验肌肉损伤的重要指标[5],这表明73L1能够有效地缓解高强度运动后的肌肉损伤,增强肌肉组织的抗压能力。

a-乳酸脱氢酶;b-肌酸激酶
图4 植物乳杆菌对高强度运动小鼠肌肉损伤指标的影响
Fig.4 Effects of L.plantarum on muscle damage indexes in mice under high-intensity exercise
注:*表示与模型组比较,P<0.05;**表示与模型组比较,P<0.01。
2.5 植物乳杆菌73L1对小鼠肠道菌群的影响
2.5.1 小鼠肠道菌群多样性分析
采用evenness指数、Shannon指数和Simpon指数对小鼠肠道菌群α多样性进行评估。与空白组相比,模型组Shannon指数显著上升(P<0.05)(图5-a、图5-b),而evenness指数和Simpon指数虽有一定程度上升,但差异不具有统计学意义(P>0.05)。植物乳杆菌73L1以及14L1对以上3个指数均无显著影响,上述结果表明植物乳杆菌73L1对小鼠肠道菌群α多样性并无显著影响。
通过主坐标分析(principal coordinate analysis,PCoA)对小鼠肠道菌群的β多样性进行分析。如图6所示,高强度运动下小鼠肠道菌群结构发生变化,植物乳杆菌73L1和植物乳杆菌14L1干预后小鼠肠道菌群分布进一步发生变化,但是变化均不显著。这表明,高强度运动以及植物乳杆菌73L1干预对于菌群的β多样性没有显著影响,在人群实验中也出现过类似结论,久坐健康人员菌群与运动人员菌群的β多样性没有显著差异[8]。
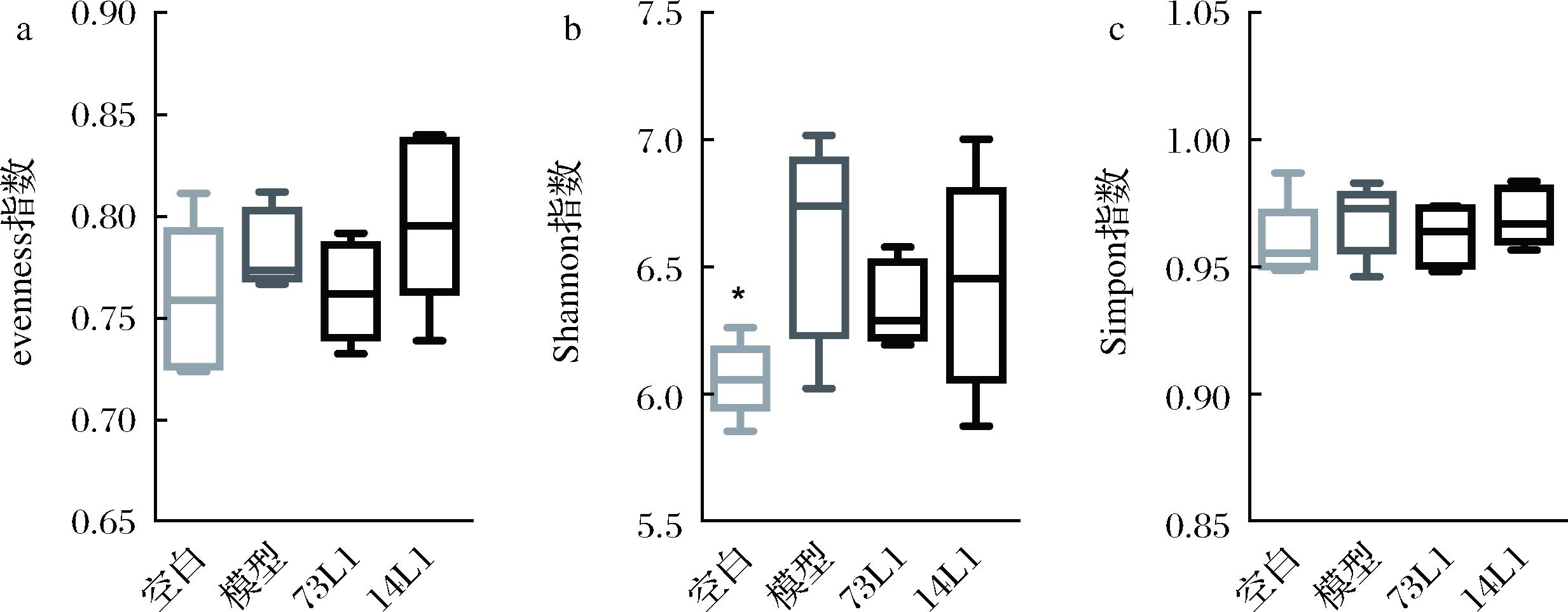
a-evenness指数;b-Shannon指数;c-Simpon指数
图5 植物乳杆菌对高强度运动小鼠肠道菌群α多样性的影响
Fig.5 Effects of L.plantarum on α-diversity of gut microbiota in mice under high-intensity exercise
注:*表示与模型组比较,P<0.05。
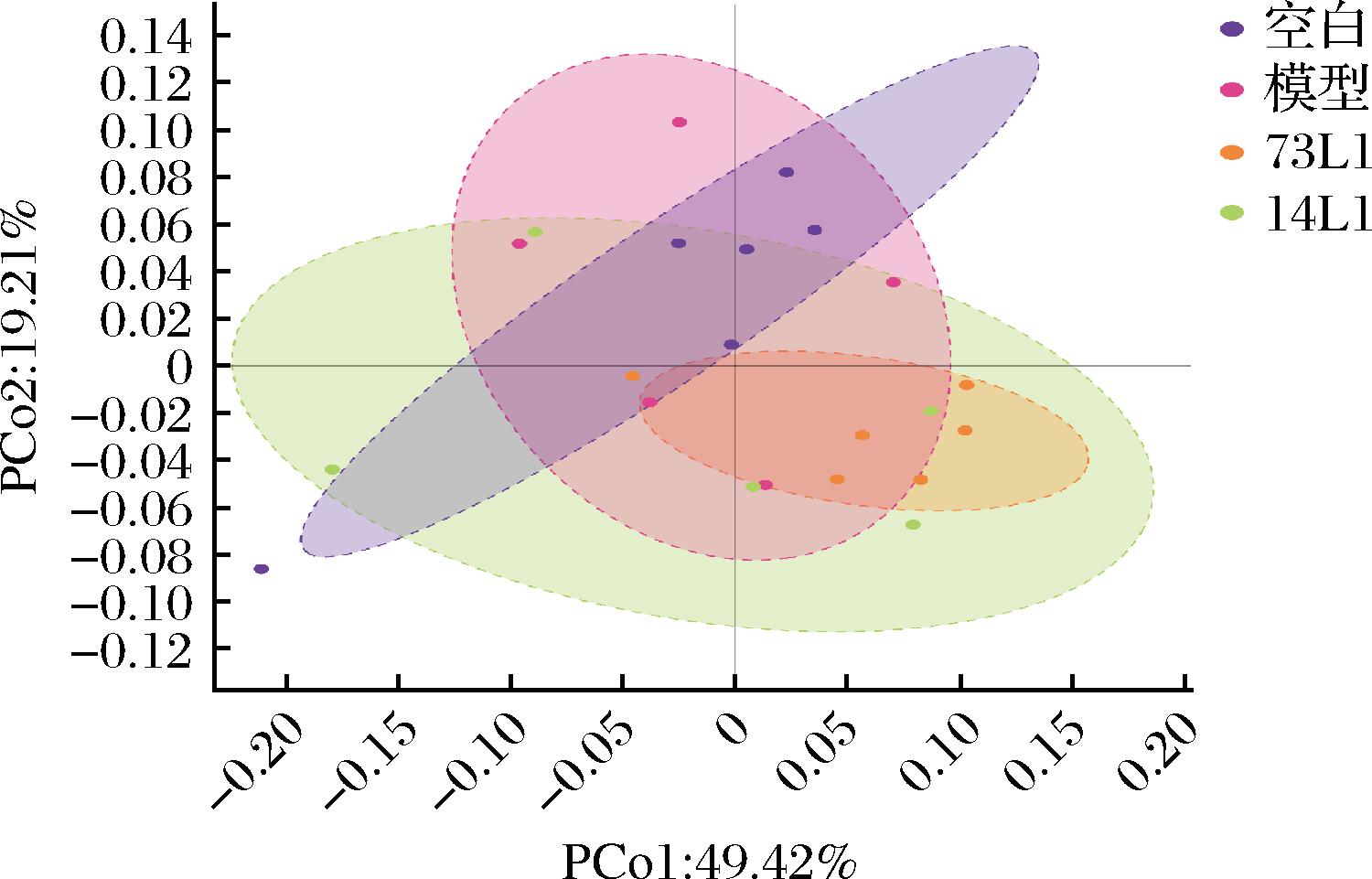
图6 植物乳杆菌对高强度运动小鼠肠道菌群的 β多样性的影响
Fig.6 Effects of L.plantarum on the β-diversity of gut microbiota in mice under high-intensity exercise
2.5.2 小鼠肠道菌群组成分析
各实验组小鼠肠道菌群门水平组成如图7所示。在门水平上,各实验组小鼠的肠道菌群主要由Firmicutes和Bacteroidetes构成。高强度运动下小鼠肠道菌群中的Firmicutes和Bacteroidetes含量均有一定程度上升,但差异不具有显著性(P>0.05)。值得注意的是,植物乳杆菌73L1干预后显著下调了小鼠肠道中Firmicutes含量(P<0.05),这与李楠楠等[9]的实验结果一致。
为了区分植物乳杆菌干预后高强度运动下小鼠肠道菌群中的不同微生物类群,我们进行了LEfSe分析。分类单元与生物标志物分类单元之间的关系(LDA评分>3,P<0.05)显示在一个枝状图中(图8-a)。其中,植物乳杆菌73L1干预后的小鼠肠道中的微生物类群比植物乳杆菌14L1组中的微生物类群更易区分。此外,植物乳杆菌干预后,小鼠肠道菌群属水平发生显著变化(图8-b~图8-g)。与空白组相比,模型组小鼠肠道中Oscillibacter和Candidatus Saccharimonas的相对丰度显著上升(P<0.05);与模型组相比,73L1组小鼠肠道中Oscillibacter(P<0.01)、Mucispirillum(P<0.05)、Stenotrophomonas(P<0.001)和Tyzzerella(P<0.01)相对丰度显著增加,肠道中Candidatus Saccharimonas的相对丰度显著下降(P<0.001)。此外,植物乳杆菌14L1干预后显著下调高强度运动小鼠肠道中Candidatus Saccharimonas(P<0.05)和Ruminococcaceae UCG-005(P<0.05)的相对丰度,显著上调Tyzzerella的相对丰度(P<0.01)。这些结果表明植物乳杆菌的干预显著改变了肠道的内环境,且植物乳杆菌73L1所带来的影响更大。

a-各实验组小鼠肠道菌群门水平组成;b-Bacteroidetes相对丰度;c-Firmicutes相对丰度
图7 植物乳杆菌对高强度运动小鼠肠道菌群门水平的影响
Fig.7 Effects of L.plantarum on the phylum level of gut microbiota in mice under high-intensity exercise
注:*表示与模型组比较,P<0.05。

a-LEfSe分析;b-Oscillibacter相对丰度;c-Candidatus Saccharimonas相对丰度;d-Mucispirillum相对丰度;e-Ruminococcaceae UCG-005相对丰度; f-Stenotrophomonas相对丰度;g-Tyzzerella相对丰度
图8 植物乳杆菌对高强度运动小鼠肠道菌群属水平的影响
Fig.8 Effects of L.plantarum on the genus level of gut microbiota in mice under high-intensity exercise
注:*表示与模型组比较,P<0.05;**表示与模型组比较,P<0.01;***表示与模型组比较,P<0.001。
2.5.3 肠道菌群与肌肉指标相关性分析
如图9所示,通过对各组小鼠肠道微生物与高强度运动下小鼠肌肉/体重、腓肠肌质量、肌肉损伤指标和肌肉能量代谢指标进行相关性分析, Candidatus Saccharimonas的相对丰度与乳酸脱氢酶、肌乳酸和肌糖原含量呈正相关,其中与乳酸脱氢酶活性呈显著正相关(P<0.001)。此外,Ruminococcaceae UCG-005的相对丰度与乳酸脱氢酶活性也呈显著正相关(P<0.05)。而Stenotrophomonas的相对丰度与乳酸脱氢酶活性呈显著负相关(P<0.05)。与此同时,Oscillibacter和Tyzzerella的相对丰度与肌糖原含量呈显著负相关(P<0.05),Mucispirillum的相对丰度与肌酸激酶活性呈显著负相关(P<0.01)。这些结果表明植物乳杆菌可能通过调节肠道菌群进而缓解高强度运动导致的小鼠肌肉损伤及能量代谢失调现象。
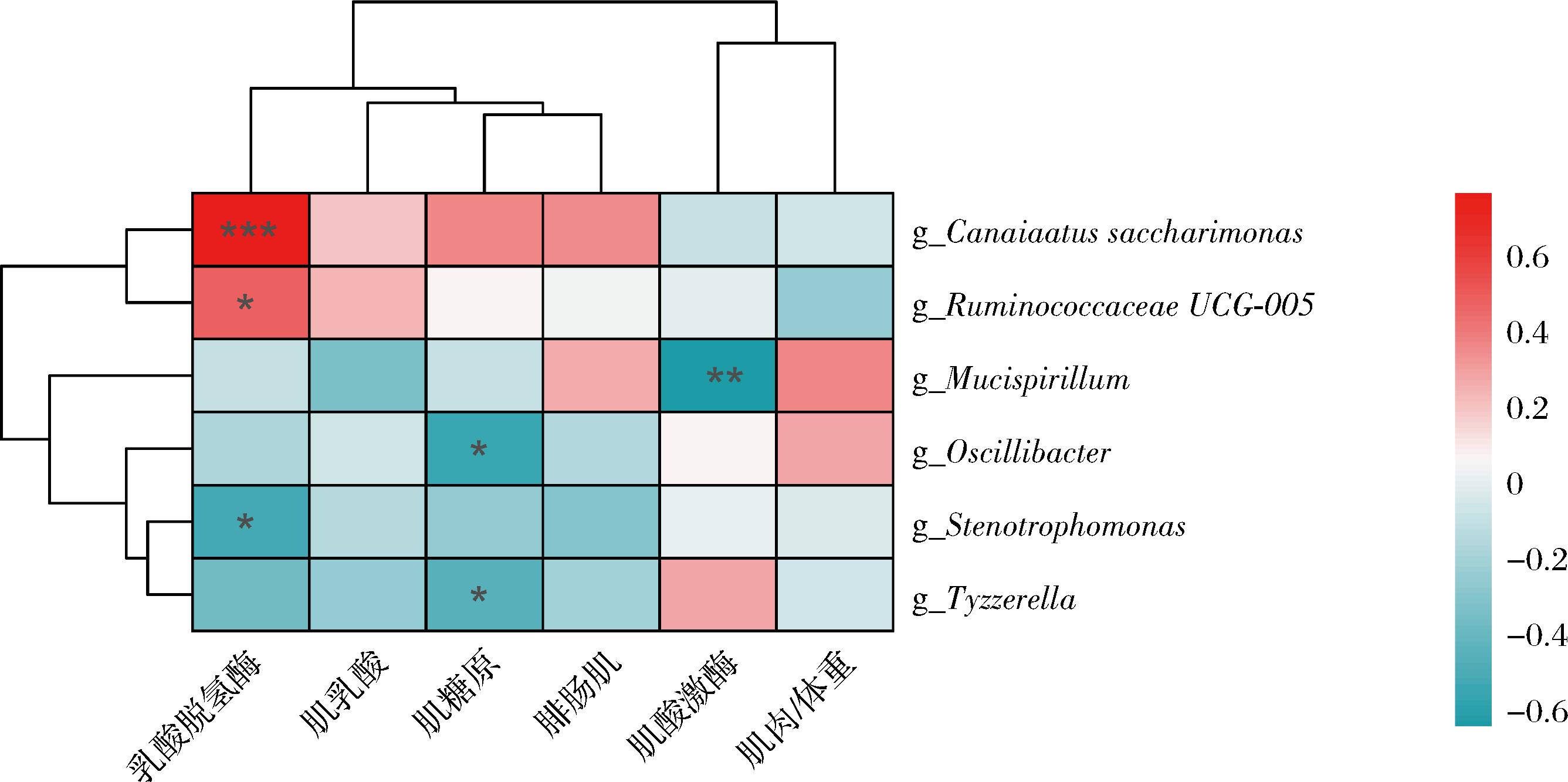
图9 肌肉指标与不同菌属的相关性
Fig.9 Correlation between muscle indexes and different bacteria
注:*表示P<0.05;**表示P<0.01;***表示P<0.001。
3 结论与讨论
已有研究发现,高强度运动下运动员体内肌酸激酶和乳酸脱氢酶(肌肉损伤的标志)活性显著增加,而热灭活乳酸乳球菌JCN5808干预后运动员体内肌酸激酶和乳酸脱氢酶活性显著下降[10]。在本研究中,植物乳杆菌73L1显著降低了高强度运动下小鼠血清中乳酸脱氢酶以及肌酸激酶活性,并且14L1也能降低血清中乳酸脱氢酶的活性,猜测可能是植物乳杆菌对该指标就有一定的缓解作用。肌糖原是肌肉组织中储存能量的主要形式,肌糖原的耗竭可能是导致肌肉疲劳的主要原因[11]。植物乳杆菌干预后,小鼠体内肌糖原含量并未有明显上升,表明植物乳杆菌干预后并未有效缓解小鼠高强度运动后肌肉能源储存降低的情况。过度的乳酸堆积会使得肌肉疲劳,已有研究表明,长双歧杆菌OLP-01可以显著降低急性运动下小鼠血清中的乳酸水平[12]。本研究中,植物乳杆菌73L1干预后也显著降低了小鼠腓肠肌中乳酸含量,同时显著改善了由于运动过度导致的腓肠肌萎缩。
大量研究表明,高强度运动后产生的肌肉疲劳可能与肠道微生物组成的变化有关[13-14],而服用益生菌可以通过调节肠道菌群进而缓解高强度运动导致的肌肉损伤[15-16]。亚麻籽油能够使高强度运动小鼠肠道中原本含量丰富的Oscillibacter的相对丰度进一步提升[17],与此报道相似的是,植物乳杆菌73L1干预后显著增加高强度运动小鼠肠道菌群中Oscillibacter的相对丰度。研究表明,高强度运动会导致肠道屏障损伤[18],而Ruminococcaceae UCG-005与肠道炎症密切相关[19]。在本研究中,植物乳杆菌73L1与14L1干预均能降低小鼠肠道中的Ruminococcaceae UCG-005相对丰度。此外,Candidatus Saccharimonas在此过程中需要重点关注,Candidatus Saccharimonas是条件致病菌,会诱导狼疮等免疫学疾病的发生[20],高强度运动造模显著上调了小鼠肠道中Candidatus Saccharimonas的相对丰度,植物乳杆菌73L1显著逆转了Candidatus Saccharimonas的相对丰度变化,逆转效果优于14L1,并且与血清中乳酸脱氢酶活性显著正相关。因此,植物乳杆菌73L1可能是通过逆转小鼠肠道中的Candidatus Saccharimonas的相对丰度来缓解高强度运动诱导的小鼠肌肉损伤,从而显著降低血清中的乳酸脱氢酶的活性。
综上所述,通过对比植物乳杆菌73L1和植物乳杆菌14L1对高强度运动导致的小鼠肌肉损伤的缓解效果发现,植物乳杆菌73L1在缓解小鼠肌肉损伤表型上比14L1具有更加显著的效果。这与植物乳杆菌73L1能够调节小鼠肠道特定微生物Candidatus Saccharimonas的相对丰度可能是有关的,推测植物乳杆菌73L1可能通过降低肠道致病菌Candidatus Saccharimonas的丰度,缓解腓肠肌高强度运动下的乳酸堆积和肌肉损伤,从而缓解高强度运动造成的外周肌肉疲劳。然而,究竟是何种肠道代谢物在缓解高强度运动诱导的肌肉损伤中发挥了重要作用还有待进一步探究。
[1] TWOMEY R, ABOODARDA S J, KRUGER R, et al.Neuromuscular fatigue during exercise:Methodological considerations, etiology and potential role in chronic fatigue[J].Clinical Neurophysiology, 2017, 47(2):95-110.
[2] PUTNAM R W.The role of lactic acid acid accumulation in muscle fatigue of two species of anurans, Xenopus laevis and Rana pipiens[J].Journal of Experimental Biology, 1979, 82:35-51.
[3] HEARRIS M A, HAMMOND K M, FELL J M, et al.Regulation of muscle glycogen metabolism during exercise:Implications for endurance performance and training adaptations[J].Nutrients, 2018, 10(3):298.
[4] CHEUNG K, HUME P, MAXWELL L.Delayed onset muscle soreness:Treatment strategies and performance factors[J].Sports Medicine, 2003, 33(2):145-164.
[5] 宋卫红, 汤长发, 梁小文, 等.运动性骨骼肌损伤相关指标的实验研究[J].首都体育学院学报, 2011, 23(2):184-187;192.
SONG W H, TANG C F, LIANG X W, et al.Research on related indexes of exercise induced skeletal muscle damage[J].Journal of Capital Institute of Physical Education, 2011, 23(2):184-187;192.
[6] LEE K, KIM J, PARK S D, et al.Lactobacillus plantarum HY7715 ameliorates sarcopenia by improving skeletal muscle mass and function in aged Balb/c mice[J].International Journal of Molecular Sciences, 2021, 22(18):10023.
[7] CHEN W C, HUANG W C, CHIU C C, et al.Whey protein improves exercise performance and biochemical profiles in trained mice[J].Medicine and Science in Sports and Exercise, 2014, 46(8):1517-1524.
[8] JANG L G, CHOI G, KIM S W, et al.The combination of sport and sport-specific diet is associated with characteristics of gut microbiota:An observational study[J].Journal of the International Society of Sports Nutrition, 2019, 16(1):21.
[9] 李楠楠. 口服益生菌对慢性轻度应激致小鼠类焦虑、抑郁行为的干预作用及肠-炎症-脑轴影响的研究[D].沈阳:中国医科大学, 2019.
LI N N.Study on the effect of oral probiotics on the anxiety and depression behaviors of mice induced by chronic mild stress and the effect of entero-inflammatory-brain axis[D].Shenyang:Chinese Medical Sciences University, 2019.
[10] KOMANO Y, SHIMADA K, NAITO H, et al.Efficacy of heat-killed Lactococcus lactis JCM 5805 on immunity and fatigue during consecutive high-intensity exercise in male athletes:A randomized, placebo-controlled, double-blinded trial[J].JJournal of the International Society of Sports Nutrition, 2018, 15(1):39.
[11] ORTENBLAD N, WESTERBLAD H, NIELSEN J.Muscle glycogen stores and fatigue[J].The Journal of Physiology, 2013, 591(18):4405-4413.
[12] LEE M C, HSU Y J, CHUANG H L, et al.In vivo ergogenic properties of the Bifidobacterium longum OLP-01 isolated from a weightlifting gold medalist[J].Nutrients, 2019, 11(9):2003.
[13] FU S K, TSENG W C, TSENG K W, et al.Effect of daily oral Lactobacillus plantarum PS128 on exercise capacity recovery after a half-marathon[J].Nutrients.2021, 13(11):4023.
[14] DONATI Z S, AMATORI S, SISTI D, et al.Nine weeks of high-intensity indoor cycling training induced changes in the microbiota composition in non-athlete healthy male college students[J].Journal of the International Society of Sports Nutrition, 2021, 18:74.
[15] MICHALICKOVA D, KOTUR -STEVULJEVIC J, MILJKOVIC M, et al.Effects of probiotic supple mentation on selected parameters of blood prooxidant-antioxidant balance in elite athletes:A double blind randomized placebo-controlled study[J].Journal of Human Kinetics, 2018, 64:111-122.
[16] WANG Y, WU Y P, WANG Y Y, et al.Antioxidant properties of probiotic bacteria[J].Nutrients, 2017, 9(5):521.
[17] PLISSONNEAU C, CAPEL F, CHASSAING B, et al.High-intensity interval training and alpha-linolenic acid supplementation improve DHA conversion and increase the abundance of gut mucosa-associated oscillospira bacteria[J].Nutrients, 2021, 13(3):788.
[18] 崔竞文. 益生菌转化大豆和鹿血的抗疲劳机制研究[D].长春:吉林大学, 2021.
CUI J W.Anti-fatigue mechanism of probiotics transforming soybean and deer blood[D].Changchun:Jilin University, 2021.
[19] MAILLARD F, VAZEILLE E, SAUVANET P, et al.Preventive effect of spontaneous physical activity on the gut-adipose tissue in a mouse model that mimics crohn′s disease susceptibility[J].Cells, 2019, 8(1):33.
[20] CHEN Y F, HSIEH A H, WANG L C, et al.Fecal microbiota changes in NZB/W F1 mice after induction of lupus disease[J].Scientific Reports, 2021, 11(1):22953.