细菌内毒素是革兰氏阴性菌细胞壁裂解后释放的毒素,又称之为“热原”,其主要成分为脂多糖(lipopolysaccharide,LPS),极微量(1~5 ng/kg体重)进入人体内后可导致炎症、休克、败血症、多器官功能衰竭甚至死亡[1]。因其普遍存在环境中且难以灭活[2],所以高灵敏度的内毒素检测方法是开发生物制药产品的关键。自20世纪80年代初以来,鲎试剂已广泛用于制药工业中细菌内毒素的检测。它的检测原理是鲎试剂中的C因子与内毒素特异性结合,启动级联反应,最终导致凝固素凝胶的形成,通过光度测定法检测[3]。鲎试剂具有简单、快速、灵敏度高等特点[4]。但鲎试剂只能通过收集鲎血淋巴生产,以及近年来的海洋环境恶化、人类肆意捕食[5],导致鲎资源急剧减少,直接从鲎活体分离鲎试剂已经受到了很大的限制[6]。
于是人们开发出不依靠鲎淋巴的新一代检测内毒素的试剂盒——基因重组荧光法[7],采用基因重组技术,在真核细胞表达重组C因子(recombinant factor C,rfc)。C因子是一种丝氨酸蛋白酶原,具有双链结构(图1),内毒素与其重链结合,使轻链发生自剪切[8],从而特异性切割荧光底物。与内毒素结合之后由无活性的蛋白酶原转变成具有生物活性的蛋白酶[9],识别并催化下游荧光底物产生荧光信号,荧光信号的强度和内毒素浓度成正相关,从而定量检测内毒素[10]。基因工程制备具有良好的前景。但由于表达过程中非常容易引入外源LPS,而鲎C因子又对环境中的内毒素极其敏感,这就大大降低了表达出的天然C因子的活性。控制表达环节的内毒素难度大,成本高,导致目前市面上商业化售卖的重组荧光法试剂盒价格非常昂贵,因此构建有效的rfc重组表达体系十分必要。
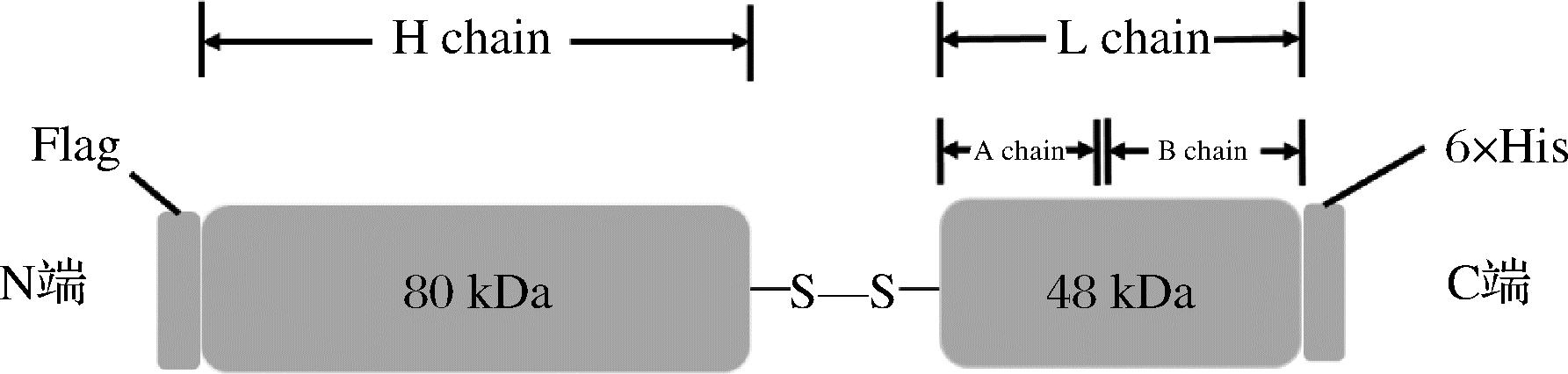
图1 C因子的结构
Fig.1 Structure of factor C
因此本课题组克隆了来源于东方鲎(Tachypleus tridentatus)中C因子的全基因序列[11],首次在人胚胎肾脏细胞Expi293F中进行了重组表达。经检测,rfc在胞外可溶分泌表达,大小与预测一致,初始纯度为48%,经镍柱纯化后的rfc纯度达到98%,得率为56%,相比于SF9细胞,蛋白表达量(19.81 mg/L)提高了113%,大大降低了表达成本。具有与内毒素结合并切割荧光底物的生物学活性。这一表达体系将为重组法试剂盒的开发提供一条崭新的途径,为内毒素检测做出贡献。
1 材料与方法
1.1 菌株、细胞及质粒
大肠杆菌(Escherichia coli) JM108、Expi293F,ThermoFisher;pcDNA3.4为实验室保存。
1.1.1 主要试剂
无内毒素质粒提取试剂盒、琼脂糖纯化试剂盒,康为世纪公司;DNA限制性内切酶、Primer STAR Max DNA聚合酶、Taq DNA聚合酶,Takara公司;MultiF Seamless Assembly Mix,ABclonal公司;蛋白上样缓冲液Loading Buffer、蛋白电泳缓冲液、转膜缓冲液、蛋白Marker、蛋白胶试剂盒、HRP显色液,翌生生物公司;HRP标记6×His标签的单克隆抗体、Flag(DYDKKKK)标签的多克隆抗体、HRP标记的羊抗兔二抗,三鹰生物;蛋白纯化柱(HisTrap excel),cytiva公司;超滤管,Millipore公司;BCA蛋白浓度检测试剂盒,碧云天生物公司;重组C因子内毒素检测试剂盒,Lonza公司;内毒素标准品、无内毒素检查用水,厦门鲎试剂实验厂有限公司;Expifectamine 293转染试剂、Expi293TM表达培养基、补料培养基Expifectamine Transfection Enhancer 1和Transfection Enhancer 2、Opti-Mem无血清培养基,ThermoFisher公司;其余常见试剂均购自国药集团。
1.1.2 培养基
2×YT液体培养基(g/L):蛋白胨16,酵母提取物10,NaCl 5,自然pH;
2×YT固体培养基(g/L):蛋白胨16,酵母提取物10,NaCl 5,琼脂粉15,自然pH。
1.2 实验方法
1.2.1 rfc基因的克隆与载体的构建
根据Uniprot网站(https://beta.uniprot.org/uniprotkb/P28175/entry)注释的rfc的信号肽氨基酸序列,为rfc的前25个氨基酸(MVLASFLVSGLVLGILAQQMRPVQS),猜测此信号肽会影响C因子在Expi293F细胞中的分泌,故使用实验室保存的信号肽序列替换掉原始信号肽。使用表1中的引物rfcF和rfcR,以合成的人源密码子优化后的质粒pTT5-rfc为模板,用高保真DNA聚合酶Primer STAR进行PCR扩增。扩增程序为:98 ℃预变性5 min;98 ℃变性10 s,56 ℃退火15 s,72 ℃延伸30 s,循环35次;72 ℃延伸5 min,扩增后的产物通过琼脂糖核酸电泳检测,并通过胶回收试剂盒纯化回收,获得不带信号肽的rfc片段;以实验室保存的pcDNA3.4载体(含信号肽序列:MGWSCIILFLVATATGVHS)为模板,rfcXF和rfcXR为引物,进行PCR扩增,延伸时间为1 min,其他程序与上述程序一致,扩增后的产物通过琼脂糖核酸电泳检测,并通过胶回收试剂盒纯化回收,获得具有与rfc片段两端有共同20 bp的同源臂的线性化载体。将rfc片段与线性化的载体pcDNA3.4用同源重组酶重组,重组体系为:3 μL片段+2 μL载体+5 μL ABI克隆酶,50 ℃保温40 min。将重组产物全部转化至JM108感受态细胞中,涂板至含有氨苄青霉素的2×YT固体平板,挑取6个转化子为模板,以rfcJF和rfcJR为引物,用Taq DNA聚合酶进行菌落PCR初步验证,挑选2个核酸电泳检测为阳性的转化子,送金唯智公司进行测序,测序正确的菌株转接到2×YT液体培养基(含有氨苄青霉素)过夜培养,按照无内毒素质粒提取说明书提取质粒,得到重组质粒pcDNA3.4-rfc。
表1 本研究使用的引物
Table 1 Primers used in the study
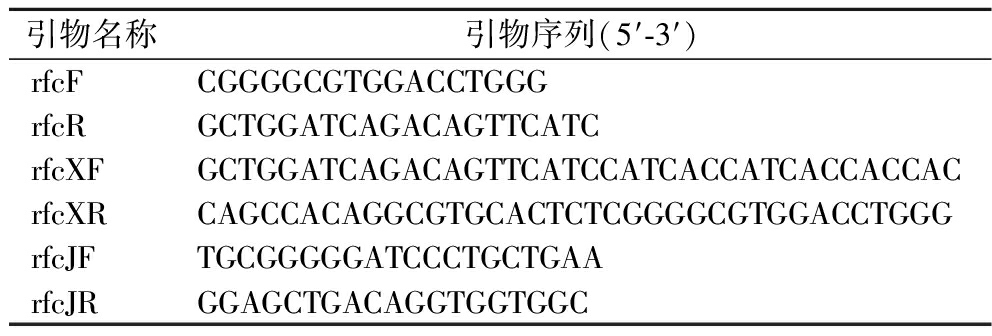
引物名称引物序列(5′-3′)rfcFCGGGGCGTGGACCTGGGrfcRGCTGGATCAGACAGTTCATCrfcXFGCTGGATCAGACAGTTCATCCATCACCATCACCACCACrfcXRCAGCCACAGGCGTGCACTCTCGGGGCGTGGACCTGGGrfcJFTGCGGGGGATCCCTGCTGAArfcJRGGAGCTGACAGGTGGTGGC
1.2.2 细胞转染表达rfc
传代培养并扩增Expi293F细胞,直至细胞密度达到约3~5×106个活细胞/mL,然后转染前1 d将Expi293F细胞接种至2.5~3×106个活细胞每毫升的最终密度,让细胞过夜培养。转染当天测定活细胞密度和存活率,活细胞密度和活细胞百分比应分别为4.5~5.5×106个和≥95%。然后进行转染,将37 ℃温育后的Opti-MEM培养基分别稀释质粒DNA(1.0 μg/mL细胞体积)与转染试剂Expifectamine 293,室温孵育5 min,向稀释后的质粒DNA中加入稀释后的Expifectamine 293试剂,然后通过旋转或倒置混合,室温下孵育复合物10~20 min,将复合物缓慢转移到细胞中,在添加过程中轻轻旋转培养瓶,然后放入培养箱培养,8% CO2,120 r/min,37 ℃,转染18~22 h后添加Transfection Enhancer 1和Transfection Enhancer 2,继续培养5 d。
1.2.3 重组rfc的鉴定与纯化
发酵7 d后将细胞培养液以2 000 r/min,4 ℃离心10 min,取上清液分别进行还原条件下和非还原条件下的SDS-PAGE,然后做Western Blot(WB)检测,重链检测一抗为抗Flag标签(DYKDDDK)兔单克隆抗体,二抗为HRP标记的羊抗兔抗体,轻链检测为HRP标记的抗6×His标签多克隆抗体。纯化采用镍离子亲和层析柱,先用平衡缓冲液平衡5个柱体积(column volume,CV),样品过柱后,用含有20 mmol/L咪唑的洗杂缓冲液冲洗3 CV的杂蛋白,然后用含有500 mmol/L咪唑的洗脱缓冲液洗脱目的蛋白。最后用粒径为30 kDa的超滤管除盐,用不含咪唑的平衡缓冲液反复稀释离心,直至咪唑终浓度小于5 mmol/L。
1.2.4 蛋白含量的测定
蛋白浓度采用BCA蛋白浓度测定试剂盒进行测定,按照说明书步骤配好工作液,加入不同浓度的牛血清白蛋白(bovine serum albumin,BSA)标准品,37 ℃放置30 min,在A562nm下测定吸光值,绘制标准曲线,根据标准曲线计算出纯化后的蛋白浓度。
1.2.5 去除内毒素
按照内毒素去除柱说明书步骤操作,1%(质量分数)的脱氧胆酸钠溶液清洗5个柱体积后,用无内毒素检查用水清洗3个柱体积后,将样品过柱,待流出一个柱体积的液体后,收集蛋白,-20 ℃保存蛋白。
1.2.6 荧光法检测rfc活性
利用动态荧光法检测rfc的活性。首先按照细菌内毒素标准品说明书,将内毒素稀释为1 EU/mL,在96孔板中每孔加入100 μL内毒素(0.5 EU/mL)、50 μL试剂盒中的荧光底物,3个复孔,再分别加入50 μL纯化后的rfc、50 μL试剂盒中的C因子(阳性对照),50 μL Expi293F细胞培养上清液(阴性对照)。设置荧光酶标仪孵育温度37 ℃,激发波长360 nm,发射波长460 nm,分别记录初始时的荧光值与1 h后的荧光值,并计算相对荧光差值(relative fluorescence units,ΔRFU)。
1.2.7 荧光法检测rfc结合内毒素
将内毒素标准品配制为0.25、0.5、1、2、4、10 EU/mL,在96孔板中每孔加入内毒素标准品100 μL(每个浓度3个复孔)、50 μL纯化后的rfc、50 μL荧光底物,阴性对照孔为100 μL的无热原水,按照上述程序记录初始与1 h后的荧光值并计算ΔRFU。
2 结果与分析
2.1 Expi293F细胞表达载体的构建
pcDNA-3.4-rfc质粒经双酶切鉴定正确后(图2),转化至大肠杆菌JM108感受态细胞中,挑取阳性菌落进行菌落PCR验证以及测序正确后,接种到液体培养基2×YT中,37 ℃过夜培养,按照无内毒素质粒提取试剂盒说明书步骤抽提质粒。
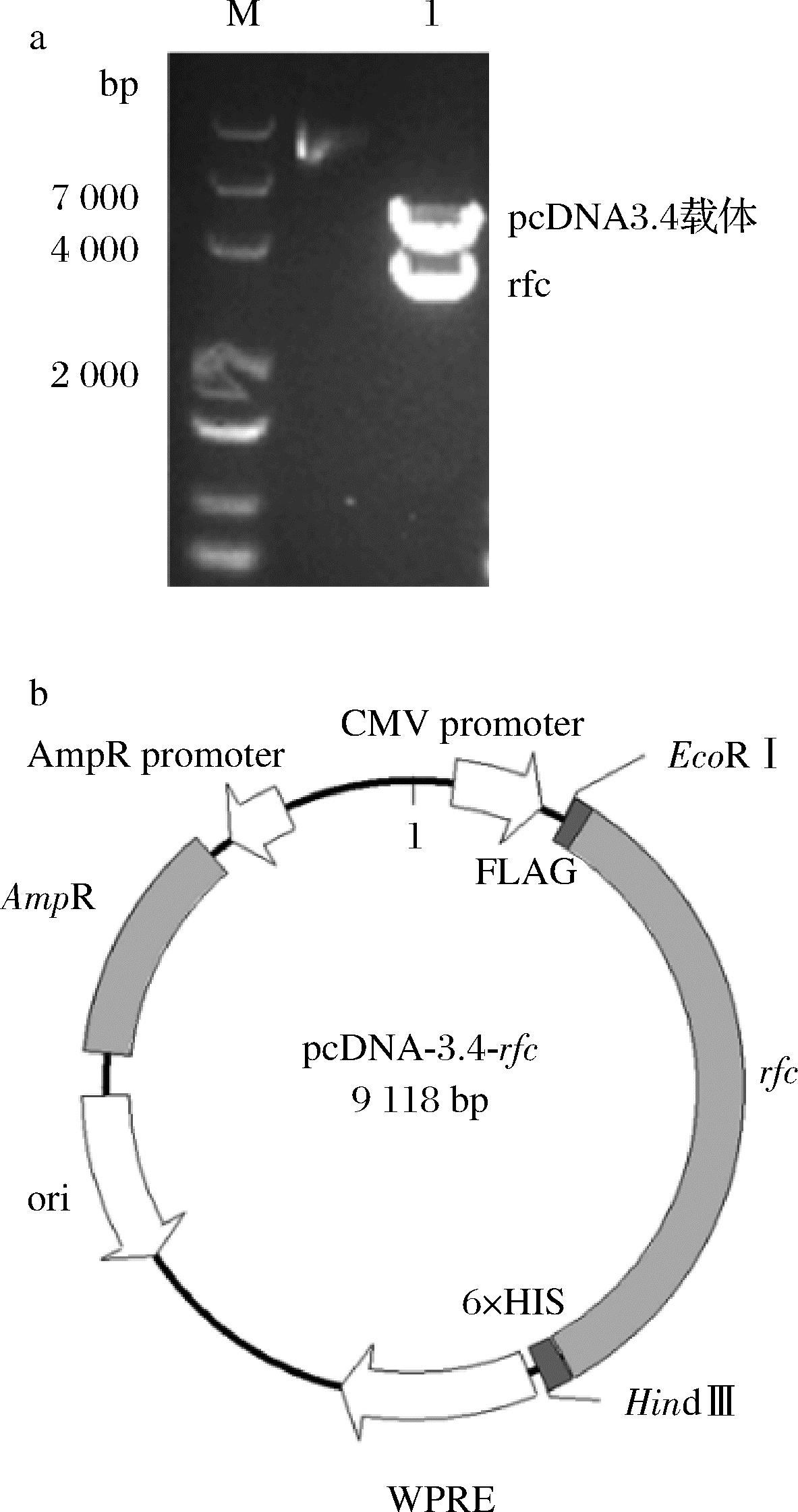
a-pcDNA3.4-rfc质粒双酶切琼脂糖凝胶电泳分析; b-pcDNA3.4-rfc载体图谱
图2 rfc基因的克隆与载体的构建
Fig.2 Cloning and vector construction of rfc
2.2 rfc的表达与纯化
将抽提的质粒pcDNA-3.4-rfc利用脂质体转染法转染至50 mL悬浮细胞Expi293F中,7 d后离心收获培养上清液,WB检测蛋白表达情况。WB结果如图3 所示,培养上清液中的rfc在非还原性条件下,大小为预测全长128 kDa,在还原条件下,rfc因其蛋白结构内含链间二硫键而断开,蛋白重链带Flag标签,WB检测与预测大小80 kDa一致(图3-a),蛋白轻链带6×His标签,WB检测与预测大小48 kDa一致(图3-b),故Expi293F成功表达出结构正确、大小一致的可溶性双链C因子。
SDS-PAGE分析重组表达的rfc上清原液,如图4-a所示,条带用Image J软件进行灰度值分析,原液纯度约为48%。将离心后的上清溶液利用镍柱亲和层析法纯化rfc,SDS-PAGE分析纯化后的蛋白。结果显示如图4-b,得到1 mL纯度大于98%的rfc,纯化得率约为56%。利用BCA蛋白浓度测定试剂盒法测得蛋白质量浓度为959 μg/mL,即在每L Expi293F细胞培养液中可得到重组蛋白rfc 19.18 mg。

a-细胞培养上清液的Western Blot检测(Flag标签); b-细胞培养上清液的Western Blot检测(His标签)
图3 Expi293F细胞中rfc的Western Blot检测
Fig.3 Western Blot detection of rfc expression in Expi293F cells
注:M-蛋白标准分子质量Marker;1-非还原性loading buffer处理的 细胞培养上清液;2-还原性loading buffer处理的细胞培养上清液; 3-非还原性loading buffer处理的细胞培养上清液; 4-还原性loading buffer处理的细胞培养上清液。
2.3 rfc结合内毒素及切割荧光底物活性
用表达纯化后的rfc替代重组荧光检测内毒素试剂盒中的C因子,在外加0.5 EU/mL内毒素以及荧光底物后,37 ℃孵育1 h,激发360 nm,发射460 nm检测初始荧光与结束荧光值,计算相对荧光差值。结果如图5所示,Expi293F重组表达的rfc被内毒素激活,与荧光底物反应,1 h后的相对荧光差值比Lonza试剂盒中的rfc高了4倍以上。
但与不同浓度内毒素(0.25、0.5、1、2、4、10 EU/mL)反应时,结果却显示荧光差值不与内毒素浓度成线性关系(图6),在不外加内毒素的情况下,仍与荧光底物反应,推测是表达过程和纯化过程引入的内毒素使得rfc全部被提前激活,而不存在酶原形式的rfc。将纯化后的rfc经过内毒素去除柱后,蛋白经检测全部挂在柱子上,流穿液中无rfc蛋白(数据未显示)。因内毒素去除柱的原理是利用介质多聚赖氨酸吸附内毒素,而不直接吸附蛋白,但rfc被吸附在去除柱上则证明内毒素与rfc以特异性亲和力连接着,一旦结合,后期极难分开,故后续需在GMP条件或者GLP下进行rfc的表达与纯化制备。
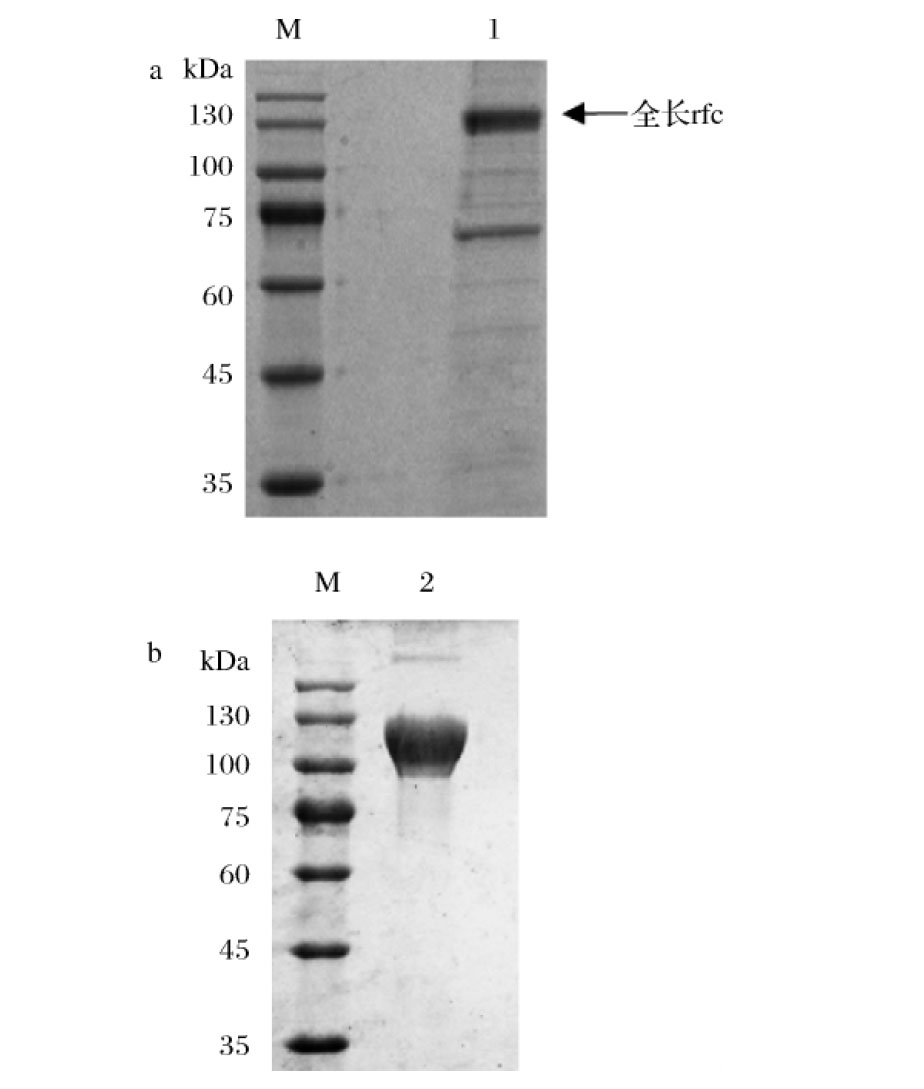
a-细胞培养上清液的SDS-PAGE检测;b-纯化后的SDS-PAGE检测
图4 rfc的表达与纯化
Fig.4 Expression and purification of rfc
注:M-蛋白标准分子质量Marker;1-非还原性loading buffer处理的 细胞培养上清液;2-非还原性loading buffer处理纯化后的rfc。
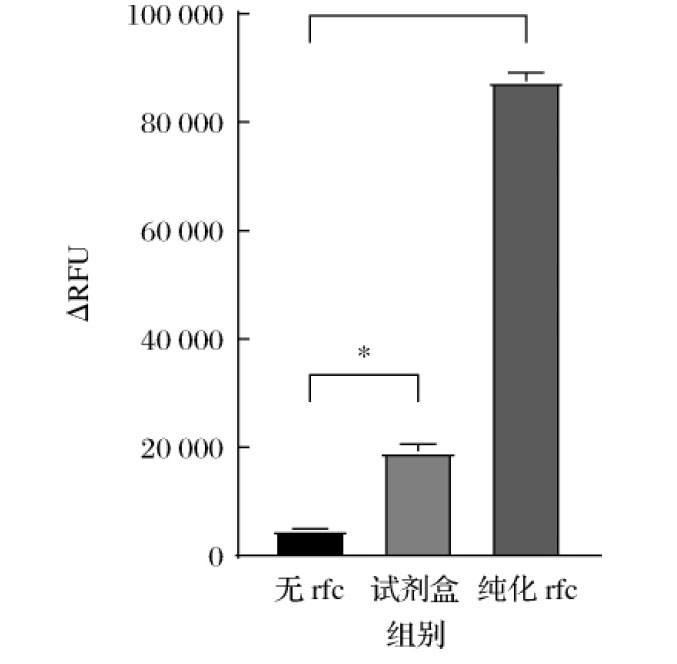
图5 rfc结合内毒素切割荧光底物
Fig.5 rfc combined with endotoxin to cut fluorescent substrate
注:*代表差异显著(P<0.05)(下同)。
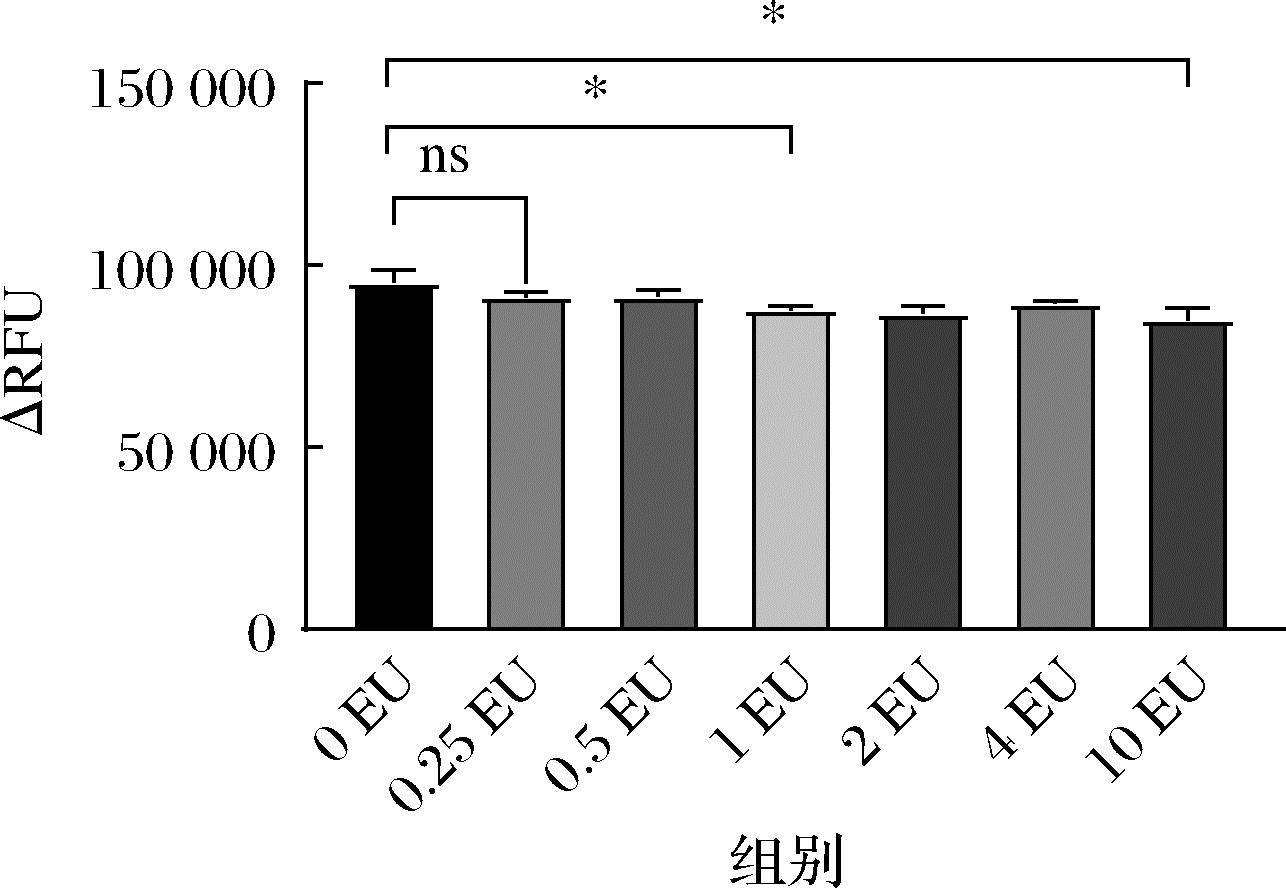
图6 rfc外加不同浓度内毒素的荧光反应
Fig.6 Fluorescence reaction of rfc with different concentrations of endotoxin
注:ns代表差异不显著。
3 结论与讨论
细菌内毒素能引起人体许多疾病,甚至死亡。开发灵敏度高、特异性强的内毒素检测试剂盒对制药行业至关重要。传统鲎试剂法依赖鲎血淋巴细胞,而因为环境的恶化以及人类的肆意捕食,导致鲎的数量急剧下降[12]。2021年2月5日,中国鲎及圆尾鲎正式被列为国家二级保护动物,所以鲎试剂来源将会受到极大限制。其次鲎试剂法中的G因子会受到(1-3)β-D-葡聚糖激活从而干扰原级联反应[13],导致假阳性的可能。于是人们开发出重组荧光法,利用分子生物学工具克隆出了C因子,重组表达的rfc以高亲和力结合内毒素,激活后的rfc特异性切割荧光底物,根据标准曲线计算内毒素浓度,该方法具有更少的假阳性、灵敏度更高、检测范围更广等特点[14]。但重组C因子法的应用却进展缓慢,2020年重组 C因子法才被载入欧洲药典、日本药典、美国药典及中国药典,研究人员自1995年以来,已尝试在哺乳动物细胞[15]、酵母[16]、昆虫[17-18]等多种表达系统中表达,一直未获得具有高表达量和完整功能的rfc。目前只有瑞士制药公司Lonza以及国内苏州瑞安公司开发出重组表达rfc体系,但其价格昂贵,因为鲎C因子对痕量内毒素非常敏感,所以在表达过程以及纯化过程中内毒素的控制至关重要,此外鲎C因子结合内毒素后自剪切机制尚不清楚[19-20],这也是后续研究需要注意的地方。在此之前本团队也曾在大肠杆菌BL21(DE3)、毕赤酵母GS115、谷氨酸棒杆菌BZH001中重组表达东方鲎来源的C因子,但遗憾的是,鲎C因子未在大肠杆菌、毕赤酵母、谷氨酸棒杆菌中进行表达,猜测是由于鲎C因子是具有双链结构[21]、多个糖基化位点的大分子蛋白,所以在原核生物以及低等真核生物中无法表达。
本研究首次在人胚胎肾脏细胞Expi293F中成功重组表达rfc,结构与蛋白结构模型一致,具有与内毒素结合并切割荧光底物的生物学活性,比Lonza试剂盒中的rfc具有更高的切割荧光底物的能力。且相比于DING在昆虫细胞SF9中的表达量(9 mg/L)[16],此表达体系的蛋白表达量(19.81 mg/L)提高了113%。本研究所用细胞为Expi293F,相比于未改造驯化的HEK293来说,表现出更快速的细胞生长、更高的培养存活率以及较高的蛋白表达水平。本研究中的表达纯化体系在实验室阶段的成本粗略计算约平均每个检测成本为6.25元(主要为合成培养基价格非常昂贵,工业规模成本则会更低),远低于Lonza试剂盒(单个检测成本41.6元)以及瑞安试剂盒(单个检测成本10.4元)的成本。由于其本底内毒素含量过高,导致大部分rfc提前激活,而表现为相对荧光差值与外加内毒素含量不成线性关系,在蛋白经过内毒素去除柱后,内毒素与吸附柱上的多黏菌素B结合,而又因为绝大部分的rfc与内毒素紧紧结合,导致大部分蛋白也结合在吸附柱上。所以rfc与LPS结合是不可逆的,一旦结合,后期无法去除,因此在生产的过程中需要完全避开内毒素。此方法对于后续开发低成本rfc重组表达体系以及内毒素检测试剂盒具有重要指导意义。
[1] 王娅宁, 高龙.细菌内毒素检查法研究进展[J].现代盐化工, 2019, 46(5):59-60.
WANG Y N, GAO L.Research on progress of bacterial endotoxin test[J].Modern Salt and Chemical Industry, 2019, 46(5):59-60.
[2] MOHAMED H M H, BURROUGHS S, SUMMERVILLE S, et al.Inactivation of bacterial endotoxin in water using a pressurized microfluidic ultra-high temperature (UHT) pasteurizer[J].Journal of Water Process Engineering, 2022, 48:102927.
[3] DING J L, HO B.A new era in pyrogen testing[J].Trends in Biotechnology, 2001, 19(8):277-281.
[4] FENNRICH S, HENNIG U, TOLIASHVILI L, et al.More than 70 years of pyrogen detection:Current state and future perspectives[J].Alternatives to Laboratory Animals, 2016, 44(3):239-253.
[5] 廖永岩, 叶富良.中国鲎资源已告危急[J].中国水产, 2000(10):11-12.
LIAO Y Y, YE F L.China′s horseshoe crab resources are in danger[J].China Fisheries, 2000(10):11-12.
[6] 王影影, 齐兴梅, 刘涛, 等.基于蛋白质反式剪接在大肠杆菌中表达鲎C因子CES多肽[J].基因组学与应用生物学, 2013, 32(6):707-712.
WANG Y Y, QI X M, LIU T, et al Expression of Tachypleus tridentatus factor C recombinant CES peptide using Intein-mediated protein trans-splicing[J].Genomics and Applied Biology, 2013, 32(6):707-712.
[7] DUBCZAK J, REID N, TSUCHIYA M.Evaluation of limulus amebocyte lysate and recombinant endotoxin alternative assays for an assessment of endotoxin detection specificity[J].European Journal of Pharmaceutical Sciences, 2021,159:105716-105721.
[8] 李世崇, 胡显文, 胥照平.鲎C因子的性质、结构、功能及应用[J].中国生物工程杂志, 2003, 23(5):78-81.
LI S C, HU X W, XU Z P.The property, structure, function and application of limulus factor C[J].Progress in Biotechnology, 2003, 23(5):78-81.
[9] BOLDEN J, SMITH K.Application of recombinant factor C reagent for the detection of bacterial endotoxins in pharmaceutical products[J].PDA Journal of Pharmaceutical Science and Technology, 2017, 71(5):405-412.
[10] MIZUMURA H, OGURA N, AKETAGAWA J, et al.Genetic engineering approach to develop next-generation reagents for endotoxin quantification[J].Innate Immunity, 2017, 23(2):136-146.
[11] 王东宁, 刘杰武, 陈琳, 等.东方鲎C因子的分段克隆及表达[J].生物化学与生物物理学报, 2002, 34(1):77-82.
WANG D N, LIU J W, CHEN L, et al.Cloning and expression of Tachypleus tridentatus factor C[J].Acta Biochimica et Biophysica Sinica, 2002, 34(1):77-82.
[12] 梁广耀. 北部湾鲎资源的初步调查[J].广西农业科学, 1985, 16(2):18-20.
LIANG G Y.Preliminary investigation of limulus amebocyte resources in Beibu gulf[J].Journal of Southern Agriculture, 1985, 16(2):18-20.
[13] MUTA T, SEKI N, TAKAKI Y, et al.Horseshoe crab factor G:A new heterodimeric serine protease zymogen sensitive to (1→3)-beta-D-glucan[J].Advances in Experimental Medicine and Biology, 1996(389):79-85.
[14] PIEHLER M, ROEDER R, BLESSING S, et al.Comparison of LAL and rFC assays—participation in a proficiency test program between 2014 and 2019[J].Microorganisms, 2020, 8(3):418-428.
[15] DWARAKANATH R S, HO B, DING J L.Recombinant COS-1 cells express Carcinoscorpius rotundicauda Factor C[J].Biotechnology Letters, 1997, 19(4):357-362.
[16] WANG J, HO B, DING J L.Functional expression of full length Limulus Factor C in stably transformed Sf9 cells[J].Biotechnology Letters, 2001, 23(1):71-76.
[17] ROOPASHREE S D, CHAI C, HO B, et al., Expression of Carcinoscorpius rotundicauda factor C cDNA[J].Biochemistry and Molecular Biology International, 1995, 35(4):841-849.
[18] 张轶岭, 祁静, 张春, 等.昆虫细胞表达鲎C因子内毒素活性检测的研究[J].生物技术, 2017, 27(5):478-483.
ZHANG Y L, QI J, ZHANG C, et al.Endotoxin detection with limulus clotting Factor C expressed by Bac-to-Bac baculovirus expression system[J].Biotechnology, 2017, 27(5):478-483.
[19] KAWABATA S, SHIBATA T.New insights into the hemolymph coagulation cascade of horseshoe crabs initiated by autocatalytic activation of a lipopolysaccharide-sensitive zymogen[J].Developmental &Comparative Immunology, 2022(135):104491.
[20] KOBAYASHI Y, SHIGA T, SHIBATA T, et al.The N-terminal Arg residue is essential for autocatalytic activation of a lipopolysaccharide-responsive protease zymogen[J].Journal of Biological Chemistry, 2014, 289(37):25987-25995.
[21] TOKUNAGA F, MIYATA T, NAKAMURA T, et al.Lipopolysaccharide-sensitive serine-protease zymogen (factor C) of horseshoe crab hemocytes.Identification and alignment of proteolytic fragments produced during the activation show that it is a novel type of serine protease[J].European Journal of Biochemistry, 1987, 67(3):412-416.