豆瓣酱是中国传统发酵调味品,因其独特风味深受消费者喜爱[1]。豆瓣酱的生产方式仍大多采用传统“日晒夜露”发酵工艺,包括霉菌制曲和开放式自然发酵2个步骤,这也是豆瓣酱独特风味形成的关键[2]。然而,这种开放式自然发酵方式依赖当地气候和生产者经验,使得产品质量稳定性较差,且在不同季节酿造得到的豆瓣酱品质之间存在巨大差异[3]。冬季气温较低,微生物的生长和酶水解进程很慢,导致发酵周期较长且风味相对较差;在夏季较高的温度下,豆瓣酱发酵过程中微生物的代谢活动较为旺盛,生产周期更短且产品具有更好的品质,但是却存在易腐败、生物胺含量偏高等问题[4]。由此可见,控制合适的温度对豆瓣酱发酵有重要意义。
近年来研究表明,不同季节豆瓣酱的风味和微生物群落组成存在显著差异[5]。夏季发酵豆瓣酱的挥发性风味物质种类和含量较为丰富,而冬季发酵酱醅的氨基酸态氮含量较高。夏季发酵豆瓣酱中的微生物群落多样性显著高于其他季节,且温度是导致豆瓣酱微生物群落结构与功能季节性差异化分布的关键因素之一[6]。对其他发酵食品而言,以温度为代表的环境因素会塑造其微生物群落结构与功能,进一步影响其产品品质[7]。例如,白酒低温大曲和中温大曲的淀粉酶活性高于高温大曲,且发酵过程中温度的升高降低了与碳水化合物代谢相关的基因表达[8]。在酸菜发酵过程中,发酵温度升高能增加挥发性风味化合物的种类,其中明串珠菌和魏斯氏菌以及乳球菌分别在10~15 ℃和20~25 ℃占主导地位[9]。因此,探究温度对豆瓣酱发酵的影响可进一步明晰豆瓣酱发酵背后的科学机理,可为豆瓣酱现代化发酵过程温度的选择提供参考。
本文设置了2组30 ℃和40 ℃恒温发酵的豆瓣酱样品,跟踪测定了其发酵过程中的理化指标、风味物质、生物胺和微生物群落组成,并与自然发酵样品进行比较,揭示了不同温度下豆瓣酱发酵过程中品质的变化规律。论文结果为豆瓣酱发酵工艺的改良提供了理论和实践基础。
1 材料与方法
1.1 菌株与材料
米曲霉(Aspergillus oryzae)3.042,保藏于本实验室;蚕豆瓣、面粉、食盐,无锡当地超市;NaOH、盐酸、甲醛、硫酸铜、酒石酸钠、三氯乙酸等试剂均为分析纯,上海国药集团;NucleoSpin试剂盒,基因生物技术国际贸易(上海)有限公司。
1.2 仪器与设备
电子天平、pH计,METTLER TOLEDO公司;恒温恒湿培养箱,上海新苗医疗器械制造有限公司;安捷伦1260高效液相色谱质谱联用仪(headspace-solid phase microextraction-gas chromatography-mass spectrometer,HS-SPME-GC-MS),美国安捷伦科技有限公司;磁力搅拌器,上海司乐仪器有限公司;Qubit荧光仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 豆瓣酱发酵样品的设计与制备
将洗净蚕豆瓣与温水浸泡6~8 h,于115 ℃高压处理15 min。冷却后的蚕豆与小麦粉按3∶1(质量比)混合,接种米曲霉3.042孢子悬液,接种量为1×107 CFU/g,在30 ℃、相对湿度90%的培养箱中培养48 h得到成曲。将成曲与盐水按1∶1混合均匀后,平均分装到9个透明塑料小桶(3 L)。将小桶按每组3个分成3个小组,分别命名为自然温度发酵组、30 ℃恒温发酵组和40 ℃恒温发酵组(下称自然发酵组、30 ℃发酵组和40 ℃发酵组)。自然发酵组的发酵条件参照传统发酵,而30 ℃发酵组和40 ℃发酵组分别在30 ℃和40 ℃培养箱中进行。在发酵前7 d每天进行翻酱,而之后每隔7 d进行翻酱,并收集样品以备后续分析。
1.3.2 酱醅理化指标的测定
总酸含量参照GB 12456—2021《食品中总酸的测定pH计电位滴定法》。氨基酸态氮含量参照GB 5009.235—2016《食品中氨基酸态氮的测定 酸度计法》。还原糖含量参照GB 5009.7—2016《食品中还原糖的测定 直接滴定法》。氨基酸含量参照GB 5009.124—2016《食品中氨基酸的测定》。生物胺含量参照GB 5009.208—2016《食品中生物胺的测定 液相色谱法》。
1.3.3 酱醅挥发性风味物质测定
称取2 g研磨均匀的豆瓣酱样品与2 g NaCl和8 mL去离子水混合,并转移到15 mL固相萃取瓶中,同时加入5 μL 2-辛醇溶液作为内标。用顶空固相微萃取-气相色谱-质谱联用法(headspace-solid phase microextraction-gas chromatography-mass spectrometer,HS-SPME-GC-MS)测定发酵第49天后的豆瓣酱样品的挥发性风味物质。样品在55 ℃水浴预热30 min后用SPME纤维吸附挥发物40 min,浓缩的挥发物通过气相色谱仪在250 ℃解吸3 min。挥发性物质的分离在DB-WAX毛细管柱上进行,具体条件如下[10]:
色谱条件:毛细管色谱柱型号DB-WAX(30 mm×0.25 mm,0.25 μm),色谱柱首先在50 ℃保持2 min,然后升温至230 ℃保持12 min,升温速度为5 ℃/min。载气为氦气,流速为1.2 mL/min。
质谱条件:电离源EI,发射流200 μA,驱电压0.5 V,电子能量70 eV,离子能量1.8 eV,离子源温度260 ℃,接口温度250 ℃,探测器电压350 V,扫描范围25~500 amu。
数据处理:未知化合物在NIST和Willey谱库中检索匹配,仅采用匹配度>700的鉴定结果,其相对含量采用面积归一化法进行定量分析[11]。
1.3.4 酱醅微生物群落的扩增子测序
使用NucleoSpin试剂盒提取豆瓣酱酱醅中微生物群落的总DNA,用Qubit荧光仪对DNA进行定量并在1%琼脂糖凝胶上运行一个等分试样检查质量。采用引物341F(5′-ACTCCTACGGGAGGCAGCAG-3′)/806R(5′-GGACTACHVGGGTWTCTAAT-3′)和ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)/ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)分别扩增细菌16S rRNA基因的V3~V4区域和真菌ITS1区域序列[12]。PCR产物经纯化和标记后完成DNA文库构建,然后应用于Illumina Hiseq 2500平台进行测序。DNA文库的测序由武汉华大医学检验所有限公司完成。使用QIIME软件将有效序列聚类为相似度为97%的操作分类单元(operational taxon unit,OTU)[13]。使用Greengenes细菌数据库和UNITE真菌数据库对代表性的OTU序列进行注释。在QIIME中计算出α多样性。
1.4 数据分析
数据统计分析和图形绘制采用Excel软件和Origin 95软件。相关性分析通过R语言中Hmisc和Corrplot包提供的函数计算,结果以图片形式呈现。
2 结果与分析
2.1 温度对豆瓣酱发酵过程理化指标的影响
氨基酸态氮、还原糖含量和总酸含量被认为是评价豆瓣酱品质的主要指标[14]。如图1-A所示,自然发酵组和30 ℃发酵组酱醅的氨基酸氮含量在发酵初期逐渐增加,然后分别稳定在约0.95、0.92 g/100 g。40 ℃发酵组的氨基酸态氮含量在发酵第35天达到最高(1.02 g/100 g),然后下降到约0.80 g/100 g。如图1-B所示,3组酱醅的还原糖含量在发酵过程中均持续上升,最终分别达到11.70、12.10、12.07 g/100 g。如图1-C所示,3组豆瓣酱样品中的总酸含量在发酵过程中持续上升40 ℃发酵组酱醅的总酸浓度(3.36 g/100 g)显著高于30 ℃发酵组(2.46 g/100 g)和自然温度发酵(2.06 g/100 g)。此外,3组酱醅样品的pH值持续下降,其中40 ℃发酵组的pH值最低(图1-D)。氨基酸态氮含量越高标志着豆瓣酱的品质越好,而还原糖在发酵过程中能促进微生物的生长代谢,同时作为美拉德反应底物促进豆瓣酱的色泽和风味化合物形成[15]。总酸浓度高低反应了产酸微生物在发酵过程中的数量以及是否存在杂菌污染等情况[16]。总酸浓度过高说明微生物群落组成可能失衡,进而导致产品质量不达标[17]。由此可见,相对较高温度有利于豆瓣酱中氨基酸态氮和还原糖在发酵前中期的积累,但同时会显著提高酱醅总酸含量。
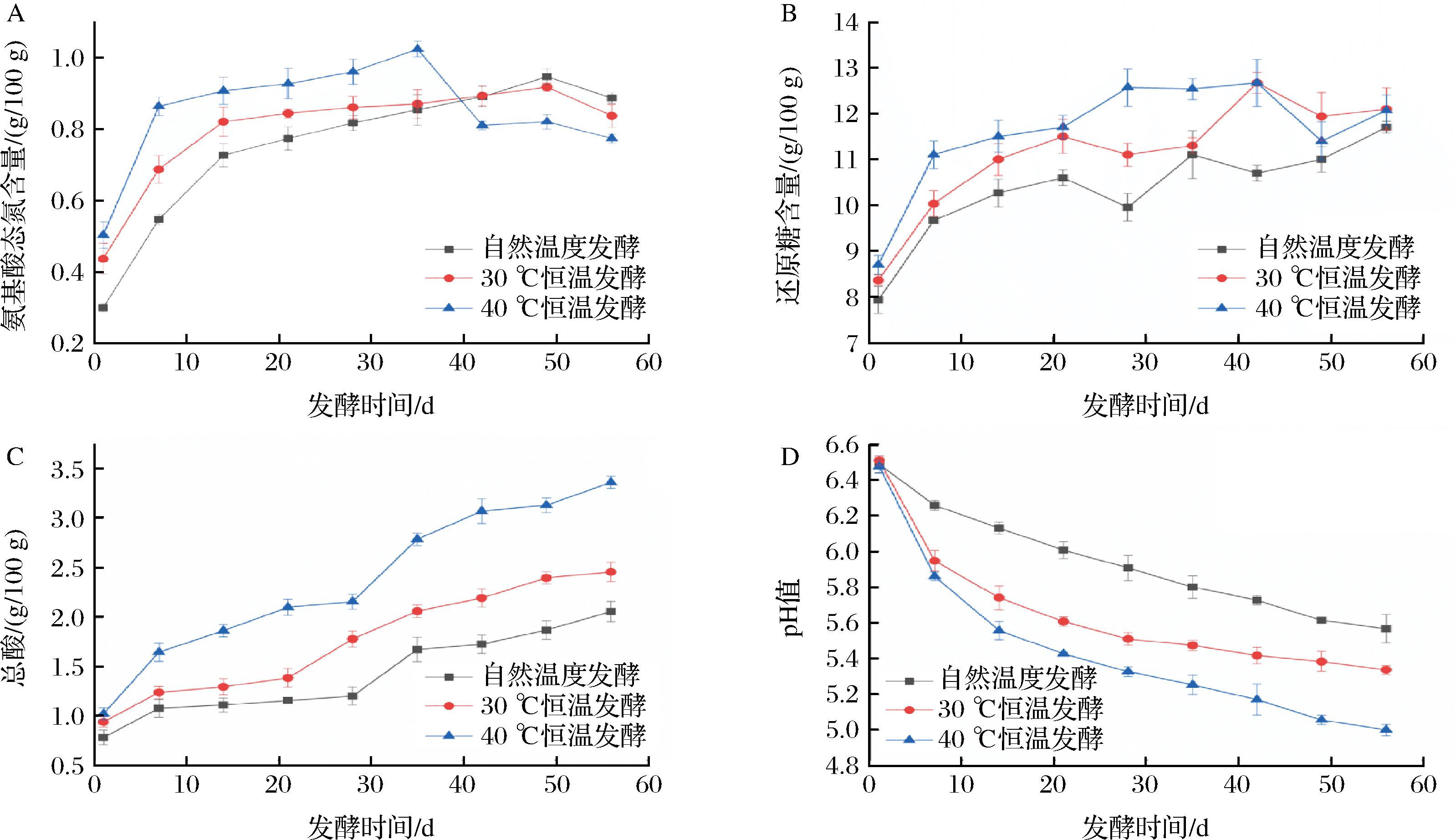
A-氨基酸态氮;B-还原糖;C-总酸;D-pH值
图1 不同温度豆瓣酱发酵过程中氨基酸态氮、还原糖、总酸和pH值的变化
Fig.1 Changes of amino acid nitrogen, reducing sugar, total acid and pH values during broad bean paste fermentation at different temperatures
2.2 温度对豆瓣酱发酵过程中风味物质的影响
2.2.1 温度对酱醅游离氨基酸含量的影响
游离氨基酸是豆瓣酱滋味的重要贡献物质[18]。根据理化指标检测结果,在发酵第7、35、49天豆瓣酱的氨基酸态氮含量有显著变化,因此分析检测了上述豆瓣酱样品的游离氨基酸含量。如图2所示,在发酵过程中自然发酵组和30 ℃发酵组的总游离氨基酸含量均呈现增加趋势,而40 ℃发酵组的游离氨基酸含量先增加后减少,与氨基酸态氮含量变化趋势一致。尽管在发酵前期恒温发酵组的氨基酸总量高于自然发酵组,在发酵结束后自然发酵组的游离氨基酸含量(6.54 g/100 g)高于30 ℃发酵组(5.68 g/100 g)和40 ℃发酵组(4.86 g/100 g)。酱醅氨基酸主要来源于微生物分泌蛋白酶对底物蛋白质的降解,而在发酵过程中其会同时作为氮源和风味前体物质被微生物利用[19]。3种不同发酵温度会导致发酵过程中微生物群落产酶及代谢特征发生变化,最终导致了酱醅中游离氨基酸含量的差异。

图2 不同温度豆瓣酱发酵过程中游离氨基酸的变化
Fig.2 Changes of free amino acids during broad bean paste fermentation at different temperatures
2.2.2 温度对酱醅挥发性风味物质种类及含量的影响
测定了自然发酵组、30 ℃发酵组和40 ℃发酵组所得酱醅的风味物质种类及含量。如图3-A所示,在40 ℃发酵组酱醅中共检出57种挥发性风味物质,略多于自然发酵组(55种)和30 ℃发酵组(56种)。其中,恒温发酵组的酯类和醛类物质多于自然发酵组,而醇类种类更少。如图3-B所示,40 ℃发酵组酱醅的挥发性风味物质含量为25.65 mg/kg,显著高于自然发酵组(16.74 mg/kg)和30 ℃发酵组(20.14 mg/kg)。其中,40 ℃发酵组(9.68、7.34、2.60 mg/kg)和30 ℃发酵组(10.47、3.10、1.79 mg/kg)的醇类、醛类和酯类物质含量显著高于自然发酵组(8.73、0.78、0.69 mg/kg),而其酮类物质(1.03、1.39 mg/kg)含量低于自然发酵组(2.68 mg/kg)。醇类通常呈现出宜人的香气和甜味,是酯化反应的前体且可进一步氧化成醛类和酸类等[20],而酯类不仅可以赋予产品特殊的酯味,还可以掩盖游离氨基脂肪酸所引起的不愉悦味道[21]。恒温发酵过程中,酱醅所处温度较高,其微生物代谢活动较为旺盛,因此产生了更多的挥发性风味物质[22]。
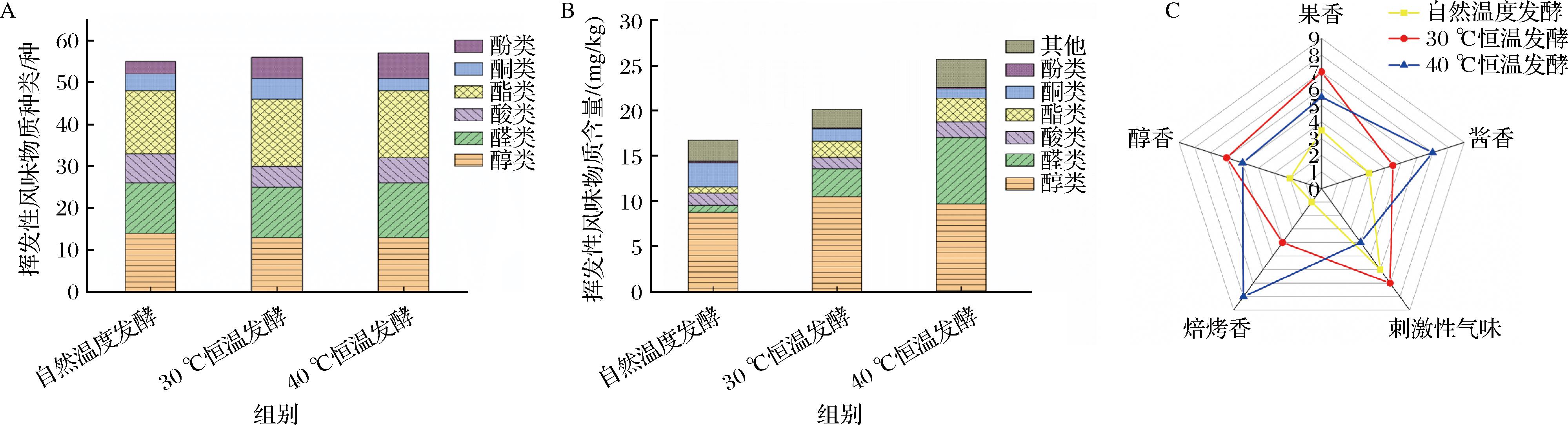
A-挥发性风味物质种类;B-含量;C-风味评价
图3 不同温度发酵后豆瓣酱中挥发性风味物质种类、含量及其风味评价
Fig.3 Categories, concentrations and sensory evaluation of volatile flavor substances in broad bean paste after fermentation at different temperatures
2.2.3 酱醅风味品评
对自然发酵组、30 ℃发酵组和40 ℃发酵组所得酱醅进行风味品评。如图3-C所示,40 ℃发酵组有强烈的酱香(7分)和焙烤香(8分),显著高于自然发酵组(3分、1分)和30 ℃发酵组(4.5分、4分)。30 ℃发酵组的果香和醇香评分(7分和6分)最高,然而其同时具有较高的刺激性气味。上述结果表明,温度对豆瓣酱风味形成有显著影响。恒温发酵能有效提升豆瓣酱中果香、醇香和酱香,赋予豆瓣酱一定的焙烤香气,但是同时会提升刺激性气味的形成。
2.3 温度对豆瓣酱发酵过程中生物胺含量的影响
生物胺是微生物以氨基酸为前体合成的含氮低分子量有机碱,是一种机体必须的内源性组分。但是,过量生物胺的摄入也会造成食物中毒[23]。因此,考察了温度对豆瓣酱生物胺含量的影响。如图4所示,在3组豆瓣酱样品中共检测出8种生物胺(腐胺、苯乙胺、组胺、酪胺、精胺、亚精胺、色胺和尸胺),其中腐胺和苯乙胺含量显著高于其他6种生物胺(P<0.01)。40 ℃发酵组总生物胺浓度在第28天达到最高(76.91 mg/100 g),显著高于自然发酵组和30 ℃发酵组样品总胺最高含量(53.09、55.41 mg/100 g)。发酵结束后,40 ℃发酵组样品的总生物胺浓度为54.10 mg/100 g,依旧高于其他2组(45.22、43.52 mg/100 g)。除尸胺、精胺和亚精胺外,2个恒温发酵组样品的生物胺含量均高于自然发酵组。上述结果表明,温度的提升促进了酱醅中生物胺的形成。
2.4 温度对豆瓣酱发酵过程中微生物群落结构的影响
通过扩增子测序揭示了不同温度对豆瓣酱发酵过程中细菌和真菌群落多样性及其组成的影响。如图5-A所示,豆瓣酱中细菌群落的丰富度Chao1指数在自然发酵组和40 ℃发酵组中先降后升,在30 ℃发酵组中先升后降。细菌群落的Shannon指数在3个发酵组中均呈下降趋势。恒温发酵组的细菌群落丰富度和多样性均低于自然发酵组,可能是由于恒温条件无法满足各种细菌的温度要求,对细菌生长有较大影响。3个发酵组的真菌群落丰富度和多样性无明显差别,且在发酵过程中无明显变化,表明温度对豆瓣酱真菌群落多样性影响较小。
进一步从属水平分析了3个发酵组中微生物群落结构组成。图6为3个发酵组中相对丰度>0.5%的细菌和真菌群落组成。在所有样品细菌群落中,Bacillus属和Staphylococcus属均占据优势地位。除自然发酵组发酵第7天样品外,其余酱醅样品中Bacillus属和Staphylococcus属占细菌总数的相对丰度均>80%,且随发酵温度的升高持续上升。在40 ℃发酵组第49天样品中上述两属的相对丰度综合高达97.10%。40 ℃发酵组在发酵过程中Bacillus属的相对丰度从35.88%上升到89.80%,而Staphylococcus属的相对丰度从51.35%下降到7.30%。30 ℃发酵组中Bacillus属的相对丰度先升后降,而Staphylococcus属的相对丰度先降后升。与恒温发酵组相比,自然发酵组中Staphylococcus属的相对丰度始终低于Bacillus属,可能是由于在30 ℃下Bacillus属比Staphylococcus属有更好的生长能力。此外,在3个组中均发现了Klebsiella属和Salmonella属微生物,但是其相对丰度随发酵温度的升高明显降低。由于Klebsiella属和Salmonella属均为食源性致病菌,提高温度进行发酵能有效抑制上述微生物属在豆瓣酱中的生长,因此更有利于食品安全。分析了3个组的真菌群落结构,发现所有样品中主导真菌均为Aspergillus属,其余真菌属所占相对丰度极低。

A-苯乙胺;B-腐胺;C-组胺;D-酪胺;E-精胺;F-亚精胺;G-色胺;H-尸胺
图4 不同温度豆瓣酱发酵过程中苯乙胺、腐胺、组胺、酪胺、精胺、亚精胺、色胺和尸胺含量的变化
Fig.4 Changes of concentrations of phenylethylamine, putrescine, histamine, tyramine, spermine, spermidine, tryptamine and cadaverine during broad bean paste fermentation at different temperatures
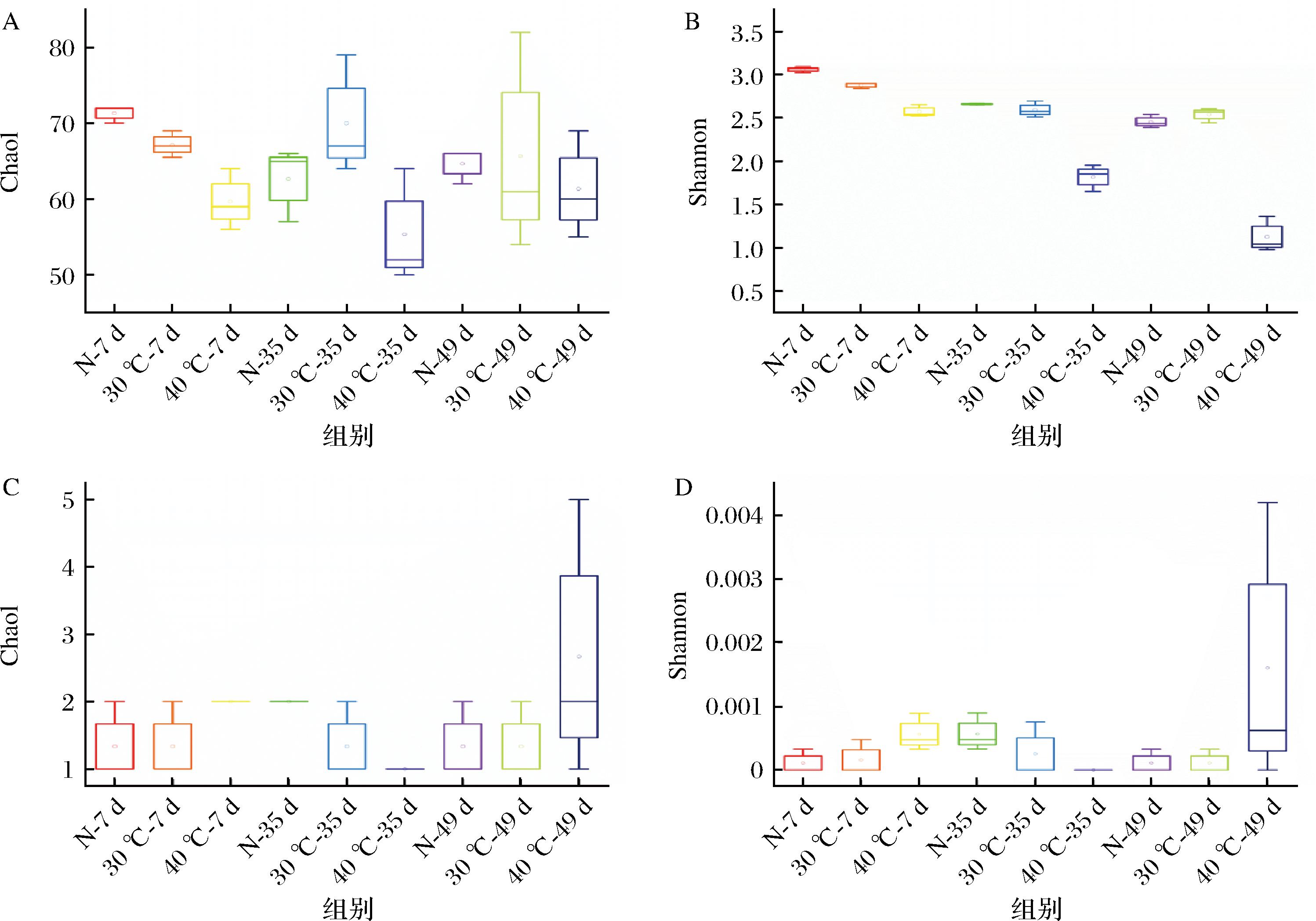
A-细菌Chao1;B-细菌Shannon;C-真菌Chao1;D-真菌Shannon
图5 不同温度发酵过程中细菌和真菌的丰富度和多样性变化
Fig.5 Changes in the evenness and diversity of bacteria and fungi during fermentation at different temperatures

A-细菌;B-真菌群落
图6 不同温度发酵过程中细菌和真菌群落的相对丰度变化
Fig.6 Changes of the relative abundance of bacterial and fungal communities during fermentation at different temperatures
2.5 豆瓣酱微生物与理化指标和风味物质之间的相关性分析
为揭示豆瓣酱微生物群落对酱醅理化指标和风味物质形成的影响,分析了豆瓣酱主要微生物属与相应物质间的相关性。如图7所示,Pantoea属与所有物质间呈显著负相关,而Aspergillus属与总酸、挥发性风味物质和生物胺含量呈负相关。Bacillus属与总酸、挥发性风味物质和生物胺含量呈正相关,而Staphylococcus属与氨基酸态氮、还原糖、总酸、游离氨基酸和生物胺含量均呈正相关。Bacillus属在豆瓣酱发酵过程中促进游离氨基酸和挥发性风味物质的形成,也是生物胺累积的主要微生物[24],而Staphylococcus属能促进氨基酸和酸性物质的产生[25]。温度升高使得豆瓣酱中Bacillus属和Staphylococcus属的相对丰度大幅提高,使得恒温发酵组中总酸、生物胺和挥发性风味物质的含量高于自然发酵组。

图7 豆瓣酱中重要微生物属与理化指标和风味 物质之间的相关性分析
Fig.7 Correlation analysis between key microbial genera and physicochemical parameters and flavor compounds in broad bean paste
3 结论
和自然发酵组相比,30 ℃发酵组和40 ℃发酵组有利于发酵前中期的氨基酸态氮和还原糖的积累,同时会促进酸性物质的形成。此外,更高的发酵温度会产生更高浓度的游离氨基酸和挥发性风味物质,但同时会积累更多生物胺。温度的升高对细菌群落结构影响较大,而对真菌群落结构的影响较小。上述结果说明提高发酵温度可以加快豆瓣酱发酵进程,但是同样也导致部分不利结果,因此后续需进一步考察温度的变化对豆瓣酱发酵的影响。
[1] LI Y, JIAO A Q, LI J P, et al.Effect of extrusion pretreatment on the physical and chemical properties of broad bean and its relationship to koji preparation[J].Food Chemistry, 2019, 286:38-42.
[2] ZHAO S, NIU C T, SUO J Y, et al.Unraveling the mystery of ‘bask in daytime and dewed at night’ technique in doubanjiang (broad bean paste) fermentation[J].LWT, 2021, 149:111723.
[3] DING W W, ZHAO X Y, XIE S, et al.Dynamics and correlation of microbial community and flavor in Pixian Douban fermented with closed process of constant temperature[J].Journal of the Science of Food and Agriculture, 2021, 101(10):4142-4153.
[4] JIA Y, NIU C T, LU Z M, et al.A bottom-up approach to develop a synthetic microbial community model:Application for efficient reduced-salt broad bean paste fermentation[J].Applied and Environmental Microbiology, 2020, 86(12):e00306-20.
[5] 贾云, 钮成拓, 郑飞云,等.传统豆瓣酱微生物群落发酵演替规律及其功能分析[J].微生物学报, 2021, 61(9):2749-2764.
JIA Y, NIU C T, ZHENG F Y, et al.Succession and function analysis of microbial community during traditional broad bean paste fermentation[J].Acta Microbiologica Sinica, 2021, 61(9):2749-2764.
[6] JIA Y, NIU C T, ZHENG F Y, et al.Development of a defined autochthonous starter through dissecting the seasonal microbiome of broad bean paste[J].Food Chemistry, 2021, 357:129625.
[7] LI P, LIN W F, LIU X, et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Frontiers in Microbiology, 2016, 7:1237.
[8] WANG S L, XIONG W, WANG Y Q, et al.Temperature-induced annual variation in microbial community changes and resulting metabolome shifts in a controlled fermentation system[J].mSystems, 2020, 5(4):e00555-20.
[9] WANG D D, CHEN G, TANG Y, et al.Effects of temperature on paocai bacterial succession revealed by culture-dependent and culture-independent methods[J].International Journal of Food Microbiology, 2020, 317:108463.
[10] WANG Z M, LU Z M, YU Y J, et al.Batch-to-batch uniformity of bacterial community succession and flavor formation in the fermentation of Zhenjiang aromatic vinegar[J].Food Microbiology, 2015, 50:64-69.
[11] WU L H, LU Z M, ZHANG X J, et al.Metagenomics reveals flavour metabolic network of cereal vinegar microbiota[J].Food Microbiology, 2017, 62:23-31.
[12] FADROSH D W, MA B, GAJER P, et al.An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J].Microbiome, 2014, 2(1):6.
[13] YANG Y, NIU C T, SHAN W X, et al.Physicochemical, flavor and microbial dynamic changes during low-salt doubanjiang (broad bean paste) fermentation[J].Food Chemistry, 2021, 351:128454.
[14] ZHANG L, XU W Z, YUE P, et al.High occurrence of aflatoxin B1 in Pixian Doubanjiang, a typical condiment in Chinese cuisine[J].Food Control, 2020, 110:107034.
[15] DING W W, YE X Q, ZHAO X Y, et al.Fermentation characteristics of Pixian broad bean paste in closed system of gradient steady-state temperature field[J].Food Chemistry, 2022, 374:131560.
[16] 尤新新. 蚕豆的酿造性能研究[D].广州:华南农业大学, 2016.
YOU X X.Study on brewing performance of broad bean[D].Guangzhou:South China Agricultural University, 2016.
[17] 雷镇欧, 陈水科, 李想.不同发酵温度对牛肝菌豆瓣酱品质变化研究[J].中国调味品, 2019, 44(5):101-103;110.
LEI Z O, CHEN S K, LI X.Study on the effect of different fermentation temperatures on the quality change of broad bean paste with Boletus edulis[J].China Condiment, 2019, 44(5):101-103;110.
[18] 谢思, 赵晓燕, 杨舒郁, 等.郫县豆瓣自然与恒温后熟发酵工艺对比分析[J].食品科学, 2020, 41(10):138-144.
XIE S, ZHAO X Y, YANG S Y, et al.Comparative analysis of natural and thermostatic post-fermentation processes for pixian broad-bean paste[J].Food Science, 2020, 41(10):138-144.
[19] 范林旭, 付建华, 钮成拓, 等.高蛋白酶活力米曲霉BL18在豆瓣酱制曲和发酵中的应用[J].食品与发酵工业, 2022, 48(23):102-110;186.
FAN L X, FU J H, NIU C T, et al.Application of high protease activity Aspergillus oryzae BL18 in koji-making and fermentation of broad bean paste[J].Food and Fermentation Industries, 2022, 48(23):102-110;186.
[20] ZHAO S, NIU C T, YANG X H, et al.Roles of sunlight exposure on chemosensory characteristic of broad bean paste by untargeted profiling of volatile flavors and multivariate statistical analysis[J].Food Chemistry, 2022, 381:132115.
[21] LI X Y, ZHAO C S, ZHENG C, et al.Characteristics of microbial community and aroma compounds in traditional fermentation of Pixian broad bean paste as compared to industrial fermentation[J].International Journal of Food Properties, 2017, 20(S3):S2520-S2531.
[22] LIU Y, ZHANG Y M, SHI Y J, et al.Flavor quality evaluation of Pixian Douban fermented in the closed system of multi-scale temperature and flow fields[J].LWT, 2022, 163:113598.
[23] LIU C F, ZHU T A, SONG H Y, et al.Evaluation and prediction of the biogenic amines in Chinese traditional broad bean paste[J].Journal of Food Science and Technology, 2021, 58(7):2734-2748.
[24] JEON A R, LEE J H, MAH J H.Biogenic amine formation and bacterial contribution in Cheonggukjang, a Korean traditional fermented soybean food[J].LWT, 2018, 92:282-289.
[25] YAO S J, ZHOU R Q, JIN Y, et al.Co-culture with Tetragenococcus halophilus changed the response of Zygosaccharomyces rouxii to salt stress[J].Process Biochemistry, 2020, 95:279-287.