油茶(Camellia oleifera Able)为世界四大木本油料作物[1],我国油茶种植总规模已达446.67万hm2[2]。油茶籽榨油后会产生大量的油茶粕,油茶粕中含有茶皂素、多糖、蛋白质、多酚、黄酮等多种有效成分[3]。目前,大部分油茶粕被用做燃料进行焚烧或者直接废弃,这一优质资源并未得到充分利用[4]。油茶粕中的茶皂素含量为10%~15%[5],茶皂素是一类由有机酸、糖体和皂苷元组成的五环三萜类化合物[6],为优良的天然非离子型表面活性剂[7],具有乳化、分散、去污、发泡、稳泡等多种特性,在日化、医药、农业、环保等多个领域有良好的应用[8],因此,加强对油茶粕的综合利用研究对提高其经济价值有着重大的现实意义。
目前,茶皂素的提取工艺以水提法和醇提法为主。水提法虽然成本较低,但提取率和纯度不高,不易实现工业化生产[9],醇提法在提取过程中消耗大量甲醇、乙醇等有机溶剂,成本高、工艺复杂、设备要求较高[10]。王文杰等[11]采用二次发酵法(先在玉米粉加入复合酶进行酶解,接入酵母菌发酵3~4 d得到玉米醪液,再添加油茶粕后第二次发酵2~3 d)提取茶皂素,茶皂素的提取率达80%左右,且粗提茶皂素纯度为62.37%,此法工艺流程较为复杂繁琐。利用微生物发酵提取植物中的有效成分,同时具有降低原料毒副作用,改善其功效性的作用,本研究采用2种乳杆菌协同发酵促进油茶粕中茶皂素的浸出,建立了一种提取率较高、绿色环保的茶皂素生产新工艺,并将其与传统水提、醇提工艺以及单菌发酵提取进行对比分析,对油茶粕资源开发模式具有一定的参考价值。
1 材料与方法
1.1 材料与试剂
油茶粕(粉碎过60目筛),湖南金昌生物技术有限公司提供;植物乳杆菌(Lactobacillus plantarum, LP)、干酪乳杆菌(Lactobacillus casei, LC),仙农生物科技(上海)有限公司;MRS肉汤、大豆蛋白胨,环凯微生物科技有限公司;葡萄糖、K2HPO4,天津市大茂化学试剂厂;无水乙醇、正丁醇、三氟乙酸(trifluoroacetic acid,TFA)、98%H2SO4、H2O2,广州化学试剂厂;抗坏血酸(维生素C)、考马斯亮蓝、牛血清蛋白,上海阿拉丁生化科技股份有限公司;茶皂素标准品、铁氰化钾、三氯乙酸、DPPH、ABTS,上海麦克林生化科技有限公司。所有试剂均为分析纯。
1.2 仪器与设备
LC-20A高效液相色谱仪,日本岛津;U2910紫外可见分光光度计,日本Hitachi公司;SQ510C高压蒸汽灭菌锅、DP43C真空干燥厢,雅马拓科技贸易有限公司;3k15台式高速冷冻离心机,德国Sigma公司;旋转蒸发仪,德国IKA公司;T15表面张力仪,德国SITA公司;TENSOR27傅里叶红外光谱仪,德国布鲁克公司。
1.3 实验方法
1.3.1 茶皂素的制备
1.3.1.1 发酵法
称取10 g油茶粕,以料液比(1∶10,g∶mL)加入到液态发酵培养基中121 ℃灭菌15 min,冷却至室温后分别接入体积分数为2%的LP、LC、混菌(LP+LC,1∶1)种子液,在37 ℃条件下发酵48 h, 以6 000 r/min转速离心10 min后过0.45 μm滤膜得到LP发酵液、LC发酵液、混菌发酵液。将混菌发酵液与水饱和正丁醇混合静置过夜,将萃取剂60 ℃下减压旋蒸浓缩,真空干燥8 h得到混菌发酵茶皂素。
1.3.1.2 水提法
称取10 g油茶粕和水以料液比1∶10(g∶mL)混合后80 ℃水浴浸提6 h,冷却后以6 000 r/min,离心10 min,上清液过0.45 μm滤膜得到水提液。将水提液与水饱和正丁醇混合静置过夜,将萃取剂60 ℃下减压旋蒸浓缩,回收正丁醇,浓缩液真空干燥8 h得到水提茶皂素。
1.3.1.3 醇提法
称取10 g油茶粕和体积分数为80%的乙醇溶液以料液比1∶10(g∶mL)混合后70 ℃水浴浸提2 h,冷却后6 000 r/min,离心10 min,上清液过0.45 μm滤膜过滤得到醇提液。将醇提液减压旋蒸后,真空干燥8 h得到醇提茶皂素。
1.3.2 提取液成分分析
1.3.2.1 茶皂素的测定
参考江勋等[12]的方法并有所改进,采用高效液相色谱仪测定提取液中茶皂素含量。色谱条件为:COSMOSIL Packed Column C18柱(4.6 mm×150 mm);柱温为30 ℃;紫外检测波长:267 nm;流动相:体积分数为0.1%TFA水溶液和甲醇,V(0.1%TFA)∶V(甲醇)=60∶40;总流速:0.5 mL/min;进样量:5 μL。绘制标准曲线方程为:y=1 656x-35 428,R2=0.999 7,根据标准曲线计算样液中的茶皂素含量。茶皂素的浸出率计算如公式(1)所示:
茶皂素浸出率![]()
(1)
式中:c为提取液中茶皂素的质量浓度,mg/mL;V为提取液的体积,mL;m1为油茶粕添加量,mg。
1.3.2.2 茶皂素纯度、提取率和表面活性指标的计算
茶皂素纯度、提取率的计算如公式(2)~公式(3)所示:
纯度![]()
(2)
提取率![]()
(3)
式中:X为茶皂素纯度,%;Y为茶皂素提取率,%;m1为油茶粕添加量,mg;m2为提取所得茶皂素粗品质量,mg;m3为HPLC测样所用茶皂素样品的质量,mg;c为HPLC测得茶皂素样品质量浓度,mg/mL;V为测样所用溶液体积,mL。
将茶皂素样品配制成2 mg/mL的溶液,在25 ℃下采用铂金环法测定表面张力。分别将茶皂素样品配制为2 mg/mL的磷酸缓冲液(pH=6.2),取25 mL用均质机12 000 r/min高速分散1 min。记录分散结束后的体积为V0,静置30 min后的体积为V1,起泡性和泡沫稳定性的计算如公式(4)~公式(5)[13]所示:
起泡性![]()
(4)
泡沫稳定性![]()
(5)
1.3.2.3 多糖的测定
取2 mL样液,置于具塞试管中,以2 mL的蒸馏水作为空白对照,加入1 mL质量分数为5%苯酚溶液,摇匀,缓慢滴加5 mL浓硫酸摇匀,置于沸水浴中煮沸20 min,取出冷却至室温,在488 nm处测定吸光值[14]。
1.3.2.4 多酚的测定
运用Folin-Ciocalteau法[15]测定提取液中的多酚含量,取样液1 mL加入5 mL体积分数为10%福林酚溶液,反应10 min后加入4 mL质量分数为7.5%Na2CO3溶液,避光反应1 h后在765 nm处测得吸光值。以没食子酸为标准品绘制标准曲线,根据标准曲线计算样液中的多酚含量。
1.3.2.5 黄酮的测定
取待测样液 6 mL于25 mL容量瓶中,加入质量分数为5%亚硝酸钠溶液1 mL,混匀静置5 min后,加入1 mL质量分数为10%硝酸铝溶液,混匀静置5 min后,加入质量分数为4% NaOH溶液10 mL,加水定容,摇匀后放置15 min后在500 nm波长处测定吸光值[16]。
1.3.2.6 蛋白质的测定
采取考马斯亮蓝法[17],取待测溶液1 mL加入5.0 mL考马斯亮蓝G250溶液摇匀,在室温下反应5 min,分光光度计595 nm波长处测定样品组的吸光值,以牛血清蛋白为标准品绘制标准曲线计算样液中蛋白质浓度。
1.3.3 抗氧化能力的测定
将水提、醇提和混菌发酵3种工艺提取得到的茶皂素样品用体积分数为75%乙醇溶液配制成0.25~4 mg/mL质量浓度梯度的溶液,以维生素C为阳性对照,分别测定3种茶皂素对DPPH自由基、ABTS自由基阳离子、羟自由基的清除能力和还原力。
1.3.3.1 DPPH自由基清除率
参考冯燕茹等[18]的方法,取2 mL不同质量浓度茶皂素溶液,加入2 mL 0.2 mmol/L DPPH 乙醇溶液,混匀静置30 min,517 nm测吸光值,按公式(6)计算不同浓度样品的DPPH自由基清除率:
DPPH自由基清除率![]()
(6)
式中:A0,蒸馏水+DPPH的吸光值;A1,样品溶液+DPPH的吸光值;A2,样品溶液+无水乙醇的吸光值。
1.3.3.2 ABTS阳离子自由基清除率
参考肖亨[19]的方法,略作修改,将7 mmol/L的ABTS溶液和2.45 mmol/L的过硫酸钾溶液等体积混合,黑暗中反应12 h,用体积分数为95%乙醇将溶液稀释至734 nm处的吸光值为0.7。取0.4 mL不同质量浓度茶皂素溶液,加入到3 mL稀释后的ABTS混合液中,混匀后室温避光沉淀6 min,然后测量波长为734 nm的反应溶液的吸光值。ABTS阳离子自由基清除率计算如公式(7)所示:
ABTS阳离子自由基清除率![]()
(7)
式中:A0,以95%乙醇代替样液的吸光值;A1,样品反应溶液的吸光值。
1.3.3.3 羟自由基(·OH)清除率
参考杨琦等[20]的方法并稍作修改,取2.0 mL不同质量浓度的茶皂素溶液,依次加入0.5 mL 6 mmol/L的FeSO4溶液和0.5 mL 6 mmol/L的H2O2溶液,充分混匀后于室温下反应10 min,再分别加入0.5 mL 6 mmol/L水杨酸混匀,室温反应30 min,在510 nm处测得吸光值为A1。在上述反应体系中,以无水乙醇代替水杨酸,测定吸光值为A2;以蒸馏水代替样品溶液,测定吸光值为A0。羟自由基清除率计算如公式(8)所示:
羟自由基清除率![]()
(8)
1.3.3.4 还原力
参考SAVI等[21]的方法,略作修改,分别吸取不同质量浓度的茶皂素溶液0.5 mL,加入0.5 mL(0.2 mol/L,pH=6.6)磷酸缓冲液、0.5 mL质量分数为1%铁氰化钾,在50 ℃的水浴锅中加热30 min,冷却后,加入0.5 mL质量分数为10%三氯乙酸,3 000 r/min离心10 min,取上清液1 mL,加入1 mL蒸馏水和0.4 mL质量分数为0.1% FeCl3溶液,静置10 min,静置10 min,以蒸馏水为参比,700 nm下测定吸光值A0,用蒸馏水代替各样品测得吸光值A1,还原力计算如公式(9)所示:
总还原力=A0-A1
(9)
1.3.4 傅里叶红外光谱(Fourier transform infrared spectrometer, FT-IR)分析
在干燥条件下,将茶皂素样品与KBr混合后压片,傅里叶红外光谱仪在4 000~400 cm-1范围内扫描,得到红外光谱图。
2 结果与分析
2.1 提取液成分分析
不同工艺提取液的茶皂素浓度及浸出率如图1所示,其中水提液的质量浓度最低,仅为18.11 mg/mL。混菌发酵液的质量浓度最高,达到21.86 mg/mL,超过醇提液浓度,比水提液浓度高20.77%。LP发酵液与醇提液质量浓度无显著差异,显著高于LC发酵液,而混菌发酵液质量浓度显著优于2种单菌发酵液(P<0.05)。在2种微生物的共同作用下,高效促进茶皂素从植物细胞中释放,提高了浸出率。5种提取液的茶皂素浸出率大小关系为醇提液>混菌发酵液>LP发酵液>LC发酵液>水提液。其中,醇提法浸出率更高的原因是由于醇提工艺更易实现固液分离,所得到的提取液体积多于其他几种工艺。混菌发酵提取液的浸出率相较于水提和单菌种发酵均有明显提升。
不同工艺提取液的其他有效成分含量如表1所示。5种提取液的多糖含量具有显著性差异(P<0.05),其中水提液中多糖含量最高,为(14.66±0.26) mg/mL,醇提液次之,3种发酵液多糖含量相对较低,这是由于微生物发酵过程中消耗一部分多糖作为生长因子。提取液中多酚质量浓度在0.93~1.14 mg/mL,其中醇提液的质量浓度最高,为(1.14±0.02) mg/mL;混菌发酵液浓度高于2种单菌发酵液,与水提液浓度无显著差异。各提取液的黄酮质量浓度为0.85~1.06 mg/mL,其大小关系为醇提液>混菌发酵液>LP发酵液>水提液>LC发酵液;混菌发酵液浓度与醇提液无显著差异,显著高于水提液(P<0.05)。蛋白质浓度受提取工艺的影响较大,水提液蛋白质浓度最高,显著高于其他工艺提取液(P<0.05),醇提液浓度较低是由于蛋白质在乙醇溶液中比较难溶。LC发酵液中蛋白质质量浓度最低,仅为(1.59±0.08) mg/mL。这是由于微生物生长代谢过程中会将一部分植物蛋白作为氮源进行利用。

图1 油茶粕提取液中茶皂素浓度和浸出率
Fig.1 Concentration and leaching rate of tea saponin in extraction solution of Camellia oleifera meal
注:小写字母不同表示茶皂素浓度具有显著差异(P<0.05)。
表1 不同提取液中的有效成分含量
Table 1 Contents of active components in different extraction solutions

组别多糖/(mg/mL)多酚/(mg/mL)黄酮/(mg/mL)蛋白质/(mg/mL)水提液14.66±0.26a1.01±0.04b0.91±0.02b3.06±0.12a醇提液9.73±0.19b1.14±0.02a1.06±0.03a2.19±0.05bLP发酵液8.76±0.24d0.99±0.04b0.93±0.01b2.34±0.06bLC发酵液7.97±0.21e0.93±0.03c0.85±0.01c1.59±0.08c混菌发酵液9.38±0.16c1.04±0.04b1.01±0.02a2.41±0.07b
注:同列数据不同的小写字母表示具有显著差异(P<0.05)。
2.2 茶皂素的纯度、提取率和表面活性指标
水提、醇提和混菌发酵法所提取茶皂素的纯度和提取率及表面活性指标如表2所示。水提法工艺虽然简单、易于操作,但产品纯度不高,为53.2%,且提取率仅有9.60%,不能很好地满足工业使用要求。醇提法的纯度和提取率分别为69.6%、13.44%。混菌发酵茶皂素的纯度和提取率最高,分别为75.2%和14.12%,该方法明显优于水提法。发酵茶皂素具有更强降低溶液表面张力的能力,溶液表面张力为39.2 mN/m。在25 ℃、pH=6.2、质量浓度为2 mg/mL条件下,混菌发酵茶皂素的起泡性和泡沫稳定性最高,分别为128%、96.9%,优于水提茶皂素和醇提茶皂素,具有更好的泡沫性能,说明混菌发酵法所得的茶皂素产品具有更好的表面活性,在日化领域有较好的适用性。
表2 不同茶皂素的纯度、提取率和表面活性指标
Table 2 Purity, extraction rate, and surface activity index of different tea saponin

组别纯度/%提取率/%表面张力/(mN/m)起泡性/%泡沫稳定性/%水提茶皂素53.29.6045.57294.4醇提茶皂素69.613.4441.911296.4混菌发酵茶皂素75.214.1239.212896.9
2.3 抗氧化性分析
水提法、醇提法和混菌发酵法所提取的茶皂素的抗氧化测试结果如图2-a~图2-c所示,在0.25~4 mg/mL内,茶皂素对DPPH自由基、ABTS阳离子自由基和羟自由基的清除率随着样品质量浓度的增加呈现先增加后趋于稳定的趋势。在同一质量浓度下醇提茶皂素的DPPH自由基和ABTS阳离子自由基清除率均高于水提茶皂素和发酵茶皂素,低于维生素C。DPPH自由基清除实验常被用作植物提取物的抗氧化活性评价,由图2-a可知,当质量浓度为1 mg/mL时,三者对DPPH自由基的清除率分别达到了(79.14±0.78)%、(93.42±1.12)%、(88.82±1.68)%,当质量浓度大于1 mg/mL时,三者的清除率逐步趋于稳定,略低于阳性对照维生素C,显示出较强的抗氧化能力。IC50代表达到50%抗氧化效果时的抗氧化剂浓度,其值越低代表抗氧化能力越强。由表3可知,水提、醇提、混菌发酵茶皂素清除DPPH自由基的IC50分别为0.522、0.303、0.373 mg/mL。由图2-b可知,当质量浓度为4 mg/mL时,3种茶皂素清除ABTS阳离子自由基的清除率为(92.99±1.38)%、(99.51±0.25)%、(97.88±0.81)%,该质量浓度下,醇提和混菌发酵茶皂素接近维生素C的抗氧化能力,水提、醇提、混菌发酵茶皂素清除ABTS阳离子自由基的IC50分别为0.620、0.434、0.533 mg/mL。
3种茶皂素对羟自由基具有较强的清除能力,当质量浓度为0.5 mg/mL时,水提、醇提、混菌发酵茶皂素的清除率分别为(57.06±2.14)%、(45.81±2.75)%、(79.5±0.86)%,清除羟自由基的IC50分别为0.373、0.592、0.153 mg/mL。质量浓度为4 mg/mL时,清除率分别达到了(97.75±0.77)%、(87.11±1.25)%、(99.52±0.23)%,该质量浓度下混菌发酵茶皂素的清除率高于另外两者,与维生素C相近。3种茶皂素的还原力测定结果如图2-d所示,在700 nm处,反应体系的吸光值越大代表还原力越强,在0.25~4 mg/mL内,随着质量浓度的提高其还原力也随之增高。在同一质量浓度下,水提茶皂素的还原力最低,混菌发酵茶皂素表现出较强的还原能力,强于醇提茶皂素,低于阳性对照维生素C。
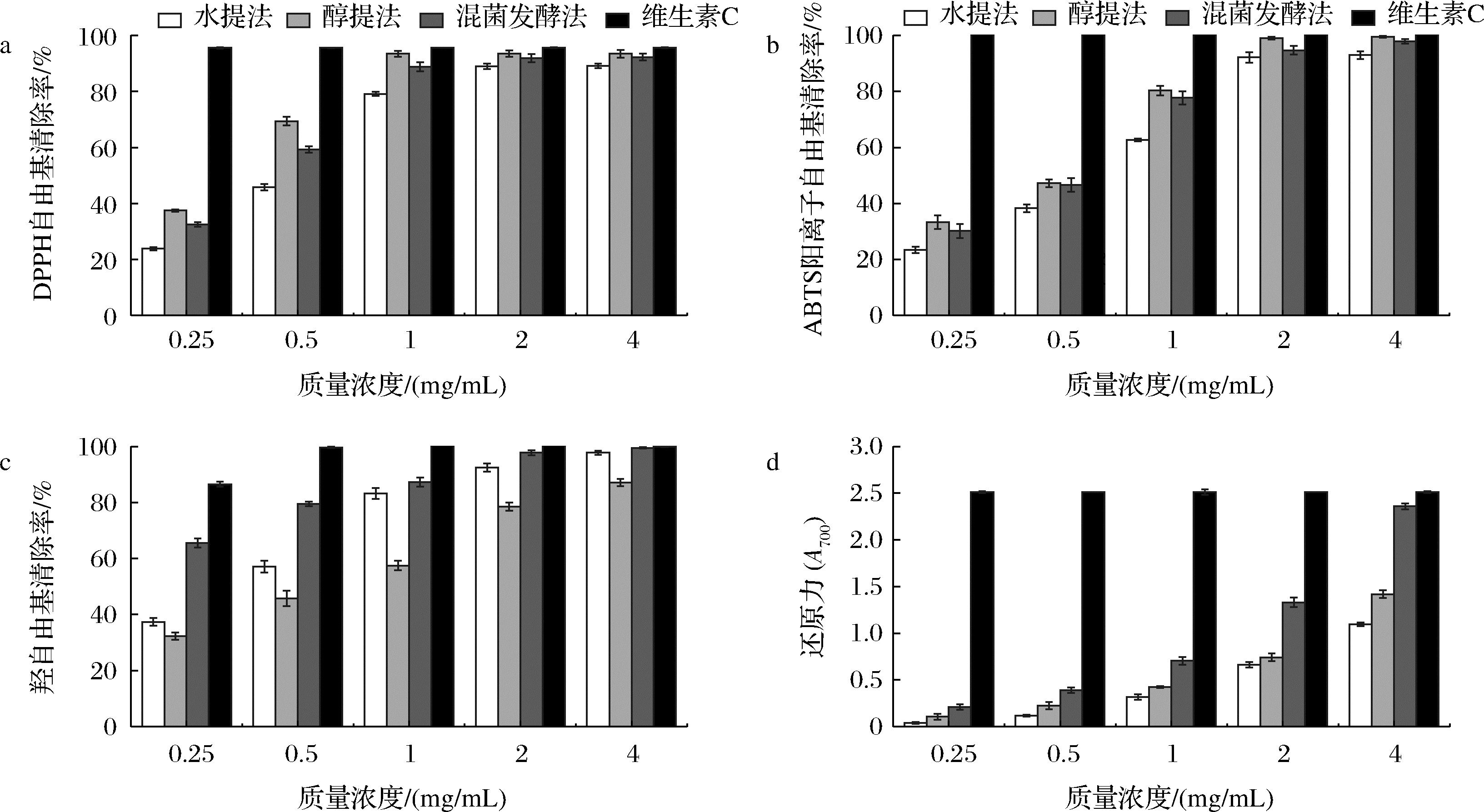
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-羟自由基清除率;d-还原力
图2 不同工艺提取茶皂素的抗氧化活性
Fig.2 Antioxidant activity of tea saponin extracted by different methods
表3 不同茶皂素抗氧化活性的IC50值 单位:mg/mL
Table 3 IC50 value of antioxidant activity of different tea saponins
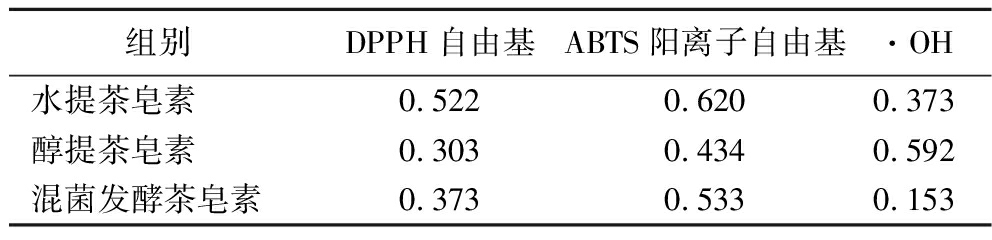
组别DPPH自由基ABTS阳离子自由基·OH水提茶皂素0.5220.6200.373醇提茶皂素0.3030.4340.592混菌发酵茶皂素0.3730.5330.153
2.4 红外光谱分析
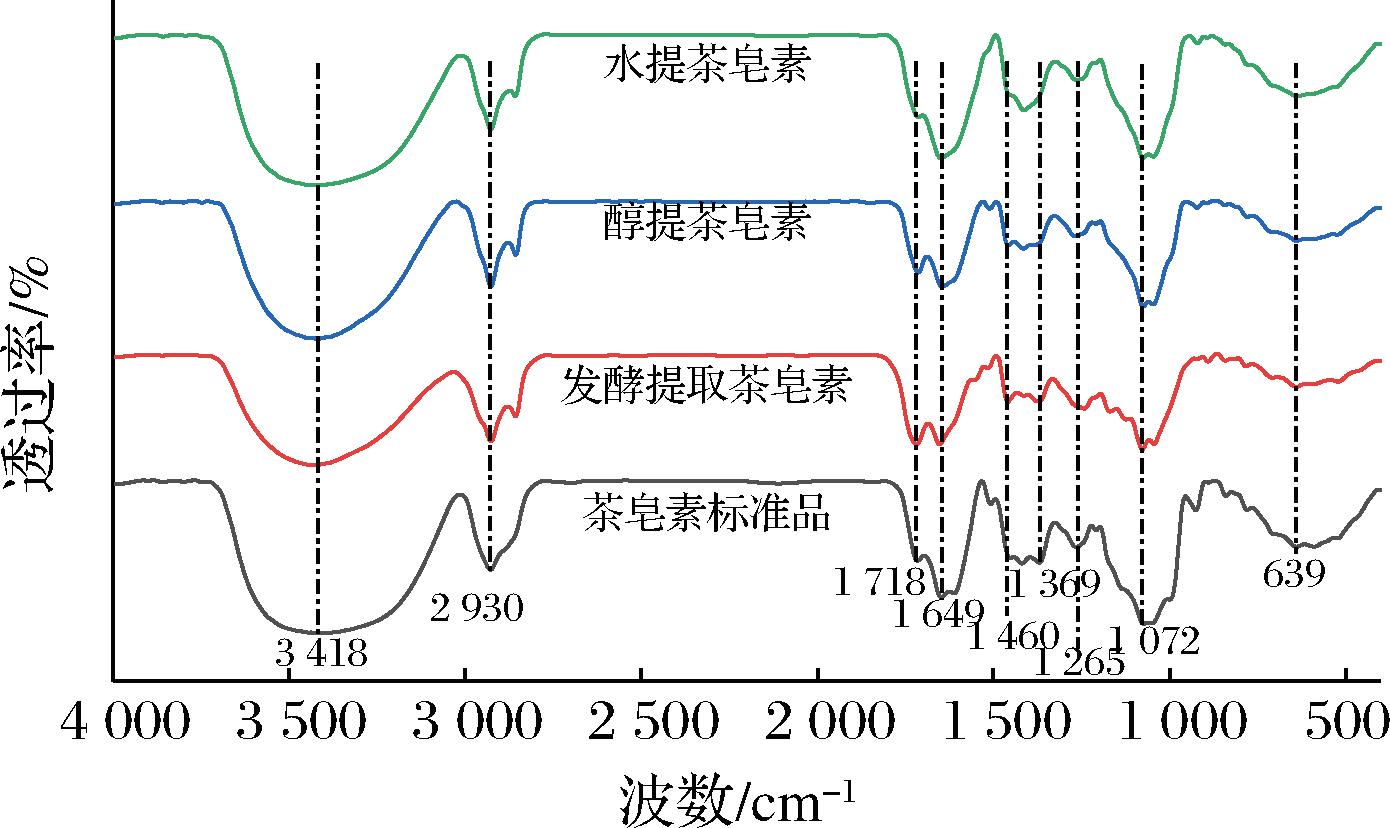
图3 茶皂素的傅里叶红外光谱图
Fig.3 FT-IR spectra of tea saponin
如图3所示,水提、醇提、混菌发酵提取茶皂素样品与标准品的振动红外图谱几近一致,说明提取方式对茶皂素的结构无太大影响。在3 418 cm-1左右处为羟基伸缩振动峰。2 930 cm-1左右为甲基和亚甲基的伸缩振动峰,1 718~1 649 cm-1处有羰基的伸缩振动峰,在1 460 cm-1和1 369 cm-1处分别为-CH-的反对称变形振动峰和对称变形振动峰[22];在1 265 cm-1左右为C—O—H的面内弯曲振动峰,表明茶籽皂素的结构中存在有伯醇[23]。1 072 cm-1处为连接各糖环的C—O—C 键的伸缩振动峰,由分子中三萜环上的C![]() C键所致未饱和的C—H键面外弯曲振动峰可见于639 cm-1处[24]。
C键所致未饱和的C—H键面外弯曲振动峰可见于639 cm-1处[24]。
3 结论
本文采用混菌发酵法提取油茶粕中的茶皂素,与水提、醇提、单菌发酵提取液中主要成分进行对比分析。其中,混菌发酵液中茶皂素质量浓度为(21.86±0.39) mg/mL,比水提法高20.77%,优于醇提液和单菌发酵液。混菌发酵提取的茶皂素样品纯度为75.2%,提取率为14.12%;其表面张力值为39.2 mN/m,起泡性为128%,泡沫稳定性为96.9%,优于水提和醇提茶皂素。混菌发酵茶皂素对于DPPH自由基和ABTS阳离子自由基的清除能力优于水提茶皂素,弱于醇提茶皂素;对羟自由基清除能力和还原力强于另外两者,在4 mg/mL时与维生素C相近。该工艺在双菌种协同作用下促进茶皂素的浸出,提取物具有优异的表面活性和抗氧化活性,提取过程更加高效环保,为茶皂素的工业化提取提供了新的思路。
[1] SHI T, WU G C, JIN Q Z, et al.Camellia oil authentication:A comparative analysis and recent analytical techniques developed for its assessment.A review[J].Trends in Food Science &Technology, 2020, 97:88-99.
[2] 张立伟, 王辽卫.我国油茶产业的发展现状与展望[J].中国油脂, 2021, 46(6):6-9;27.
ZHANG L W, WANG L W.Prospect and development status of oil-tea camellia industry in China[J].China Oils and Fats, 2021, 46(6):6-9;27.
[3] 刘楚岑, 裴小芳, 周文化, 等.油茶饼粕中主要成分及其综合利用研究进展[J].食品与机械, 2020, 36(7):227-232.
LIU C C, PEI X F, ZHOU W H, et al.Research progress on the main components and comprehensive utilization of Camellia oleifera cake[J].Food &Machinery, 2020, 36(7):227-232.
[4] 文超, 钟昌勇, 杨漓, 等.两种油茶品种饼粕含油率的研究[J].轻工科技, 2020, 36(11):11-12.
WEN C, ZHONG C Y, YANG L, et al.Study on oil content of cake of two Camellia oleifera varieties[J].Light Industry Science and Technology, 2020, 36(11):11-12.
[5] 王羚, 方学智, 杜孟浩, 等.超临界CO2萃取对油茶饼中油脂品质及茶皂素理化特性影响的研究[J].中国油脂, 2020, 45(8):109-114.
WANG L, FANG X Z, DU M H, et al.Effects of supercritical CO2 extraction on the quality of oil and physicochemical properties of tea saponin in oil-tea camellia seed cake[J].China Oils and Fats, 2020, 45(8):109-114.
[6] 梅方炜, 胡静, 欧天山, 等.油茶深精加工研究进展[J].粮食与油脂, 2021, 34(11):6-8;40.
MEI F W, HU J, OU T S, et al.Research progress on deep processing of Camellia oleifera Abel[J].Cereals &Oils, 2021, 34(11):6-8;40.
[7] BÖTTCHER S, DRUSCH S.Interfacial properties of saponin extracts and their impact on foam characteristics[J].Food Biophysics, 2016, 11(1):91-100.
[8] 张国运, 曹丽云, 吴建鹏, 等.茶皂素提取工艺及其应用研究进展[J].日用化学工业, 2006, 36(3):174-177.
ZHANG G Y, CAO L Y, WU J P, et al.Research progress on extraction processing and application of tea saponin[J].China Surfactant Detergent &Cosmetics, 2006, 36(3):174-177.
[9] MA L, CHEN Y Z, PENG S F, et al.Study on the extraction of tea saponin from Camellia oleifera cake using water as solvent[J].Agricultural Science &Technology, 2015, 16(5):1078-1080. [10] 岳翠男, 江新凤, 李延升, 等.茶皂素提取技术及生物活性研究进展[J].食品工业科技, 2019, 40(7):326-331.
YUE C N, JIANG X F, LI Y S, et al.Research progress on extraction technology and biological activity of tea sapoin[J].Science and Technology of Food Industry, 2019, 40(7):326-331.
[11] 王文杰, 陈长庚, 张必桦, 等.二次发酵提取茶皂素的方法研究[J].中国农学通报, 2014,30(30):296-301.
WANG W J, CHEN C G, ZHANG B H, et al.Method of abstracting tea-saponin with secondany fermemtation[J].Chinese Agricultural Science Bulletin, 2014,30(30):296-301.
[12] 江勋, 杨学军, 邓小红, 等.油茶籽粉中茶皂素高效液相色谱测定方法研究[J].品牌与标准化, 2022(2):28-31.
JIANG X, YANG X J, DENG X H, et al.Determination of tea saponin in Camellia oleifera seed powder by HPLC[J].Brand &Standardization, 2022(2):28-31.
[13] LI S G, HUANG Y, AN F P, et al.Hydroxyl radical-induced early stage oxidation improves the foaming and emulsifying properties of ovalbumin[J].Poultry Science, 2019, 98(2):1047-1054.
[14] 田漫漫. 油茶饼粕中茶皂素、油茶多酚、油茶多糖连续提取纯化工艺及中试的研究[D].贵阳:贵州大学, 2018.
TIAN M M.Study on continuous extraction, purification and pilot test of tea saponin, Camellia polyphenols, Camellia oleifera polysaccharides of the tea Camellia[D].Guiyang:Guizhou University, 2018.
[15] 梁杏, 陈朝银, 赵声兰, 等.响应面法优化核桃饼粕多酚提取工艺[J].食品科技, 2015, 40(6):241-246.
LIANG X, CHEN C Y, ZHAO S L, et al.Optimization of extraction of the polyphenols from walnut residue by response surface methodology[J].Food Science and Technology, 2015, 40(6):241-246.
[16] 黄冬梅, 饶冬荣.紫外分光光度法测定健儿清解液中总黄酮的含量[J].广东化工, 2021, 48(13):202-203;211.
HUANG D M, RAO D R.The content of total flavonoids in jianer Qingjie solution was determined by ultraviolet spectrophotometry[J].Guangdong Chemical Industry, 2021, 48(13):202-203;211.
[17] 杨静, 白冰, 王宁, 等.考马斯亮蓝法对烟草薄片涂布液中蛋白质含量的测定[J].湖北农业科学, 2017, 56(5):946-947;950.
YANG J, BAI B, WANG N, et al.Determination of protein content in reconstituted tobacco coating liquid by coomassie brilliant blue method[J].Hubei Agricultural Sciences, 2017, 56(5):946-947;950.
[18] 冯燕茹, 刘玮, 杨继国.不同分子量羧甲基茯苓多糖的制备及其抗氧化活性的研究[J].中国食品添加剂, 2019, 30(3):67-74.
FENG Y R, LIU W, YANG J G.Preparation of carboxymethylated pachyman with different molecular weight and study on its antioxidative activity[J].China Food Additives, 2019, 30(3):67-74.
[19] 肖亨. 干燥方式和分子修饰对海蒿子多糖的理化性质和生物活性的影响[D].广州:华南理工大学, 2019.
XIAO H.Effects of drying methods and molecular modifications on the physicochemical properties and biological activities of polysaccharides from Sargassum pallidum[D].Guangzhou:South China University of Technology, 2019.
[20] 杨琦, 谢纯良, 周映君, 等.益生菌发酵蓝莓的体外抗氧化活性分析[J].食品与发酵工业, 2022, 48(9):112-116.
YANG Q, XIE C L, ZHOU Y J, et al.Antioxidant activity in vitro of probiotics fermented blueberry drink[J].Food and Fermentation Industries, 2022, 48(9):112-116.
[21] SAVI A, CALEGARI G C, SANTOS V A Q, et al.Chemical charaterization and antioxidant of polysaccharide extracted from Dioscorea bulbifera[J].Journal of King Saud University Science, 2020, 32(1):636-642.
[22] 王兰. 茶籽粕中茶皂素的提取及性质表征[D].西安:陕西科技大学, 2012.
WANG L.The extraction and properties characterization of tea saponins from the tea seeds[D].Xi′an:Shaanxi University of Science and Technology, 2012.
[23] 於筱岚. 茶叶皂素高效制备及茶皂素在镉污染土壤植物修复中双重作用研究[D].杭州:浙江大学, 2020.
YU X L.Efficient preparation of tea-leaf saponins and the dual role of tea saponins in phytoremediation of cadmium-contaminated soil[D].Hangzhou:Zhejiang University, 2020.
[24] 张雪莉, 洪晨, 马海乐, 等.多模式超声辅助提取茶皂素工艺条件研究[J].中国粮油学报, 2022, 37(5):123-127.
ZHANG X L, HONG C, MA H L, et al.Optimization of ultrasound-assisted extraction and characterization of tea saponin from Camellia oilseed cake[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(5):123-127.