大量研究显示,作为摄入后对宿主具有有益生理效应的活性微生物[1],益生菌主要通过调节肠道菌群,调节脂肪贮存、调节免疫系统、降低血清胆固醇以及延缓肠道衰老的方式发挥其健康益处[2]。国际乳业联合会建议,为保障其健康效益,益生菌产品中活菌的数量应≥106 CFU/g[3]。因此,如何克服食品生产和贮存过程中高温、低pH以及氧气等多种不利因素对益生菌活性的破坏[4-5],是当前益生菌领域研究的热点问题。近年来,科研工作者尝试采用无缝滴丸技术,制备以明胶为外壳的负载益生菌无缝胶囊[6-7],避免菌粉直接暴露于氧气与潮湿环境,使益生菌尽可能保持在休眠状态中,能一定程度提高产品菌活,延长贮藏时间[8]。无缝胶囊滴制、干燥的过程中,由于菌粉的亲水性,芯材中的益生菌会与胶皮中的水分结合而活化,使益生菌在加工和贮藏中的活菌数显著降低。
磷脂包埋是实现益生菌保护的有效手段[9]。磷脂分子能够在自身两亲性作用下,形成亲水头部朝向水相,疏水尾部相互靠近的膜层结构[10],为益生菌提供疏水环境,能够有效避免益生菌失活。有研究将嗜酸乳杆菌和乳酸双歧杆菌包埋于半固体大豆卵磷脂油凝胶乳剂中,发现可以提高其存活率并延迟氧化反应[11]。无缝胶囊的芯液相主要成分为脂质,胶皮相中含有超过80%的水分,采用磷脂在胶皮与芯液之间构筑一层保护膜,有望进一步提高对益生菌活性的保护。此外,本研究前期采用高精同心滴丸技术,成功制备了以椰子油、代可可脂等固态脂质作为芯液基质,实现益生菌与薄荷香精共负载的口腔环境改善型香口丸,但同时也面临固态脂质在口腔的中停留时间长,油腻味重,香口丸口感不佳等缺点。磷脂是具有良好乳化、分散和渗透性能的天然表面活性剂[12],能够加速芯液相中的脂质乳化从而获得更佳的化口感,解决香口丸口感油腻的缺陷。
本研究选用明胶作为壁材相,椰子油作为芯材相,添加不同比例的磷脂作为脂质保护层来制备益生菌香口丸。分析不同磷脂添加量对香口丸外观、直径、质构特性等理化性质的影响;通过对比不同磷脂添加量的样品在加工和贮藏过程中益生菌菌活差异,探究磷脂的加入对益生菌稳定性的影响;通过口腔消化实验,比较磷脂比例对香口丸化口性和菌活稳定性的提升能力,为制备兼具加工贮藏稳定性和优良风味口感的新型益生菌食品提供参考。
1 材料与方法
1.1 材料与试剂
植物乳杆菌P9,江中药业股份有限公司;椰子油,广州中宏生物科技有限公司;甘油,南京科之昕生物科技有限公司;磷脂,爱康精细化工有限公司;明胶,江西福美泰生物技术有限公司;MRS琼脂培养基,北京索莱宝科技有限公司;黏膜蛋白,美国Sigma试剂公司;氯化钠、氯化钾、碳酸氢钠等均为分析级,购自阿拉丁。
1.2 仪器与设备
高精度同心滴丸机,烟台百药泰中药科技有限公司;分散机T18 digita,德国IKA公司;厌氧培养箱YQX-T,美国SHELLAB公司;立式压力蒸汽灭菌锅ZDX-35BI,上海申安医疗器械厂;涡旋振荡器Q-861,美国;数显恒温磁力搅拌水浴锅HH-4,金坛市城西晓阳电子仪器厂;台式pH计827pH,瑞士Metrohm公司。
1.3 益生菌香口丸的制备
1.3.1 胶皮相、芯液相的制备
将一定比例的明胶、甘油溶于去离子水中,于70 ℃水浴锅中加热搅拌2 h至完全溶解,使用超声除泡机除去其中的气泡,制成胶液待用。
将磷脂按照不同质量分数(0%、0.5%、1%、1.5%)分散于椰子油中,于40 ℃水浴下加热搅拌至完全溶解,冷却至37 ℃左右后加入1% (质量分数)的植物乳杆菌菌粉,经分散机5 000 r/min分散2 min,制备成均匀的液态菌油相保温备用。
1.3.2 益生菌香口丸的制备
将胶皮相置于高精同心滴丸设备的储料罐中静置,融化后保温的芯液菌油分批次置于保温物料罐中搅拌保温,调节设备参数:胶液罐温度70~75 ℃,物料罐温度38~40 ℃,滴头温度为55~60 ℃,制冷温度为5~7 ℃,物料经过滴头流出后由脉冲装置快速切割成圆形无缝滴丸,再通过5~7 ℃冷却循环系统对其进行进一步的冷却定型,得到湿丸,将湿丸置于20~25 ℃、相对湿度30%~40%的恒温恒湿环境中干燥5~6 h,最终得到4种磷脂质量分数分别为0%(L0)、0.5%(L1)、1%(L2)、1.5%(L3)的植物乳杆菌香口丸样品。
1.4 理化性质表征
1.4.1 外观
拍照记录干燥前后的益生菌香口丸的外观形态变化。
1.4.2 直径
使用游标卡尺测量随机挑选的50个益生菌香口丸样品的平均直径。
1.4.3 质构特性
使用质构分析仪和P/2圆柱探头(直径2.0 mm)从4种益生菌香口丸的样品中随机选取50颗珠子作为样本,对每颗珠子测试其硬度和弹性。测试前速度为1.5 mm/s,测试中速度1 mm/s,测试后速度为10.0 mm/s,应变量为40%,触发力为2.0 g。
1.5 加工稳定性
益生菌在香口丸滴制的过程中,受环境和设备高温以及胶皮中的水分等不良因素的影响其活性会降低。为了探究磷脂在加工过程中对于益生菌活性的保护作用,以未经过滴头的添加有植物乳杆菌的初始油相作为对照组,分别从4种磷脂质量分数分别为0%、0.5%、1%、1.5%的样品益生菌香口丸中取其芯液油相,使用含5%吐温-80的生理盐水对其进行梯度稀释,接种于MRS琼脂培养基,在37 ℃厌氧培养箱中培养48 h后计算菌落总数。
1.6 贮藏稳定性
分别将4种磷脂质量分数为0%(L0)、0.5%(L1)、1%(L2)、1.5%(L3)的样品益生菌香口丸使用铝箔纸袋密封并放入干燥剂,脱氧剂,置于4 ℃冰箱和模拟室温条件(25 ℃)下贮存12个月,每隔3个月对4种样品分别取样培养,计算样品在贮藏过程中的菌活变化。
1.7 口腔消化特性
1.7.1 模拟口腔消化液(SSF)的配制
分别将氯化钠(1.594 g/L)、硝酸铵(0.328 g/L)、氯化钾(0.202 g/L)、柠檬酸钾(0.308 g/L)、磷酸二氢钾(0.636 g/L)、尿酸二氢钠(0.021 g/L)、尿素(0.198 g/L)、乳酸钠(0.146 g/L)、黏膜蛋白(3 g/L)分别按照添加量要求加入去离子水中,搅拌至完全溶解[13]。
1.7.2 固态脂质层在口腔环境融化情况
将4种磷脂添加量分别为0%(L0)、0.5%(L1)、1%(L2)、1.5%(L3)的益生菌香口丸在进行滴制前单独称取0.5 g芯液相固态脂质,将其分别置于消化瓶中加入20 g口腔消化液中混合并调节pH值至6.8,放入振荡水浴锅中37 ℃条件下100 r/min振荡,分别在0、15 s和完全融化时拍照记录,并记录固态脂质完全融化于口腔消化液中的时长。
1.7.3 模拟口腔消化
分别将4种磷脂质量分数为0%(L0)、0.5%(L1)、1%(L2)、1.5%(L3)的样品益生菌香口丸各取3 g置于消化瓶中,加入20 ml口腔消化液中混合并调节pH值至6.8,放入振荡水浴锅中37 ℃条件下100 r/min消化,至样品完全融化于口腔消化液中。
1.7.4 益生菌香口丸在口腔环境的稳定性
从4种益生菌香口丸消化后对应的消化液中取样,进行梯度稀释后,使用MRS琼脂培养基在37 ℃恒温培养箱中培养48 h后计算菌落总数,根据计算公式计算样品菌活保留率如公式(1)所示:
菌活保留率![]()
(1)
1.8 数据统计与分析
每个实验重复3次,各组数据用SPSS 26软件进行分析,以P<0.05作为差异作为著性判断标准,结果以“平均值±标准差”表示,图表用Origin 2021绘制。
2 结果与分析
2.1 益生菌香口丸的理化性质表征
4种香口丸脂质芯材外观如图1-a所示,随磷脂添加含量的增加,香口丸固态脂质层颜色由白色转变为橙黄色。使用L3芯液滴制的益生菌香口丸样品湿丸和干燥后干丸外观分别如图1-b和图1-c所示,湿丸为外层胶皮包裹内层固态脂质的球状结构,丸体大小均一,颜色均匀干燥后胶皮相透明度提高,丸体结构完整,表面无凹坑。
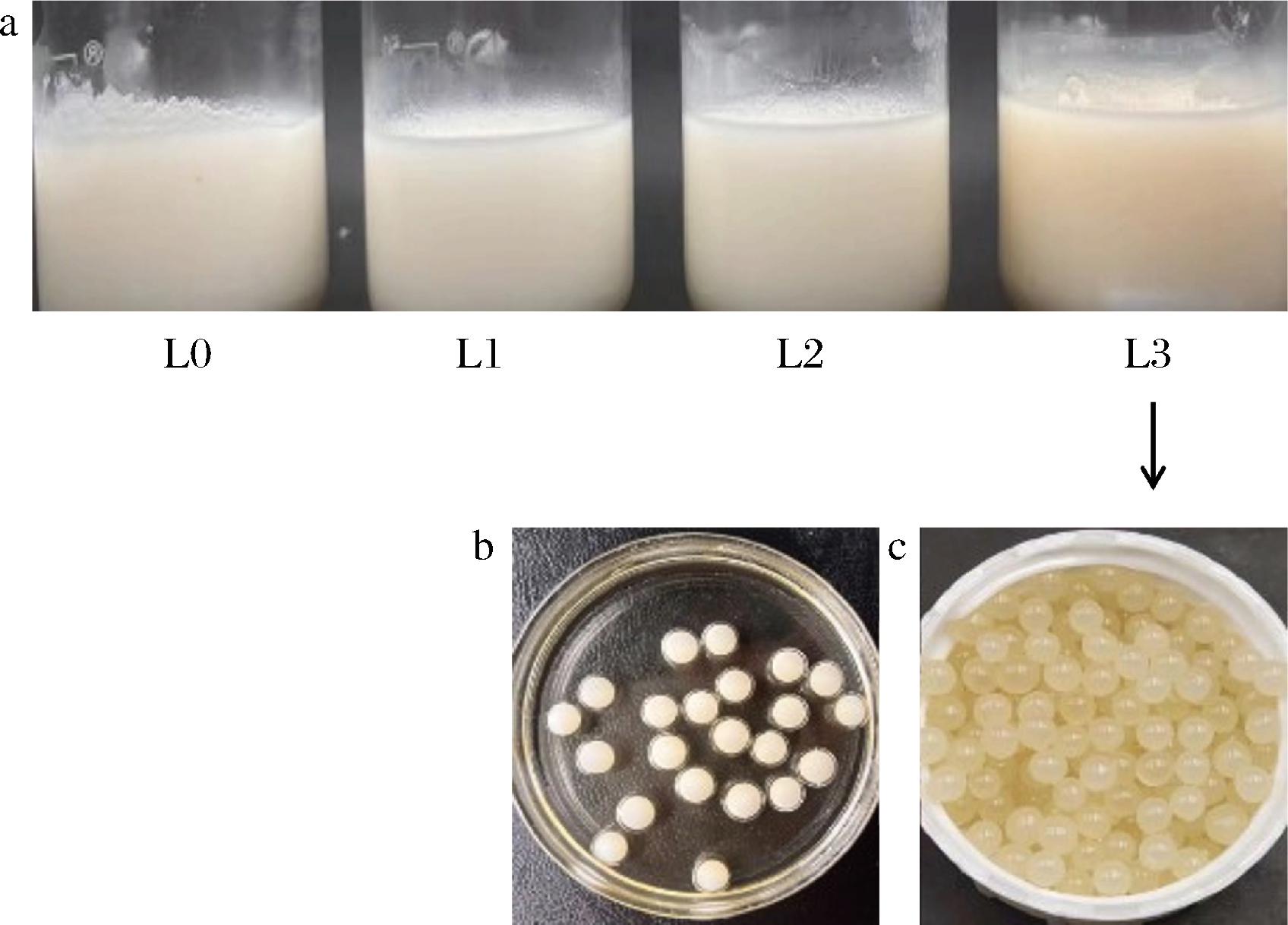
a-固态纸质层;b-湿丸;c-干丸
图1 不同磷脂添加量的脂质芯材及L3的湿丸和 干丸图像
Fig.1 Images of lipid core material with different phospholipid content, L3 wet pills and dry pills
实验测量并记录了每组样品随机选取的50个香口丸样本的直径以及硬度、弹性,结果如表1所示,4种益生菌香口丸样品的平均直径均为6.0 mm,硬度和弹性分别为458.1~488.6 g和42.1%~43.8%,且均无显著性差异(P<0.05)。表明不同含量的磷脂添加,均未对香口丸的尺寸和质构特性产生明显影响,这可能与磷脂在整个体系中所占比例较低有关。
表1 不同磷脂添加量的益生菌香口丸的直径与质构特性
Table 1 The diameter and texture characteristics of probiotic mouth incense pills with different phospholipid content
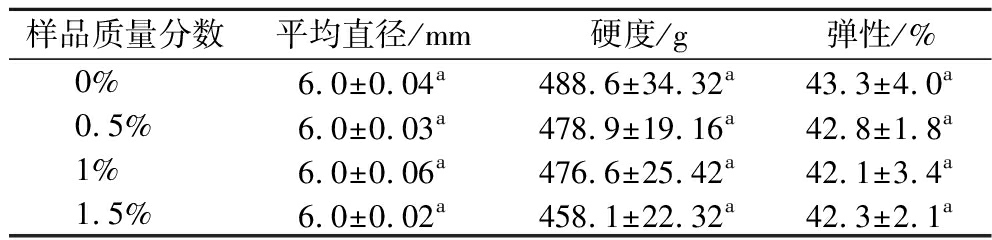
样品质量分数平均直径/mm硬度/g弹性/%0%6.0±0.04a488.6±34.32a43.3±4.0a0.5%6.0±0.03a478.9±19.16a42.8±1.8a1%6.0±0.06a476.6±25.42a42.1±3.4a1.5%6.0±0.02a458.1±22.32a42.3±2.1a
注:不同小写字母表示差异显著(P<0.05)。
2.2 益生菌在加工过程中的稳定性
在加工过程中,芯材经滴头被胶液包裹,再被剪切冷却分割成独立的湿丸,然后在湿度35%环境,温度23 ℃条件下干燥得到成品香口丸。在此过程中,由于益生菌的亲水性,益生菌可能会与胶皮相中的水分结合,并在长时间的干燥过程中导致益生菌失活。而磷脂是具有两亲性极性脂质,能够将益生菌与胶皮相中的水分间隔,一定程度上可以阻止益生菌与胶皮相中的水分直接接触,减少干燥过程中除水对益生菌细胞结构完整性的影响,对益生菌在加工过程中的稳定性起到保护作用[5]。
加工过程中的菌活变化如图2所示,加工之前的各组菌活均为9.34 lg CFU/g左右。经加工(滴制与干燥)后,未添加磷脂组香口丸(L0)平均活菌数降低至8.84 lg CFU/g,菌活损失率超50%。加入磷脂后,香口丸菌活均有不同程度提高,0.5%(质量分数)磷脂组(L1)菌活为9.19 lg CFU/g,1%(质量分数)磷脂组(L2)为9.26 lg CFU/g,1.5%(质量分数)磷脂组(L3)为9.29 lg CFU/g保留率均在60%以上。说明磷脂形成的隔离层有效阻止了胶皮水分与益生菌接触,对香口丸的益生菌加工稳定性具有积极意义。此外,随着磷脂含量的提高,菌活保留率呈先增大后平缓的趋势,说明一定量的磷脂添加对所形成的隔离层致密性与水分隔绝能力具有提升作用,进一步增加磷脂含量,隔离性能则不再变化[14]。
2.3 益生菌香口丸的储藏稳定性
将4种益生菌香口丸样品分别置于4 ℃和常温(25 ℃)下贮藏12个月,每隔3个月测定香口丸的活菌数,其结果如图3、图4所示。
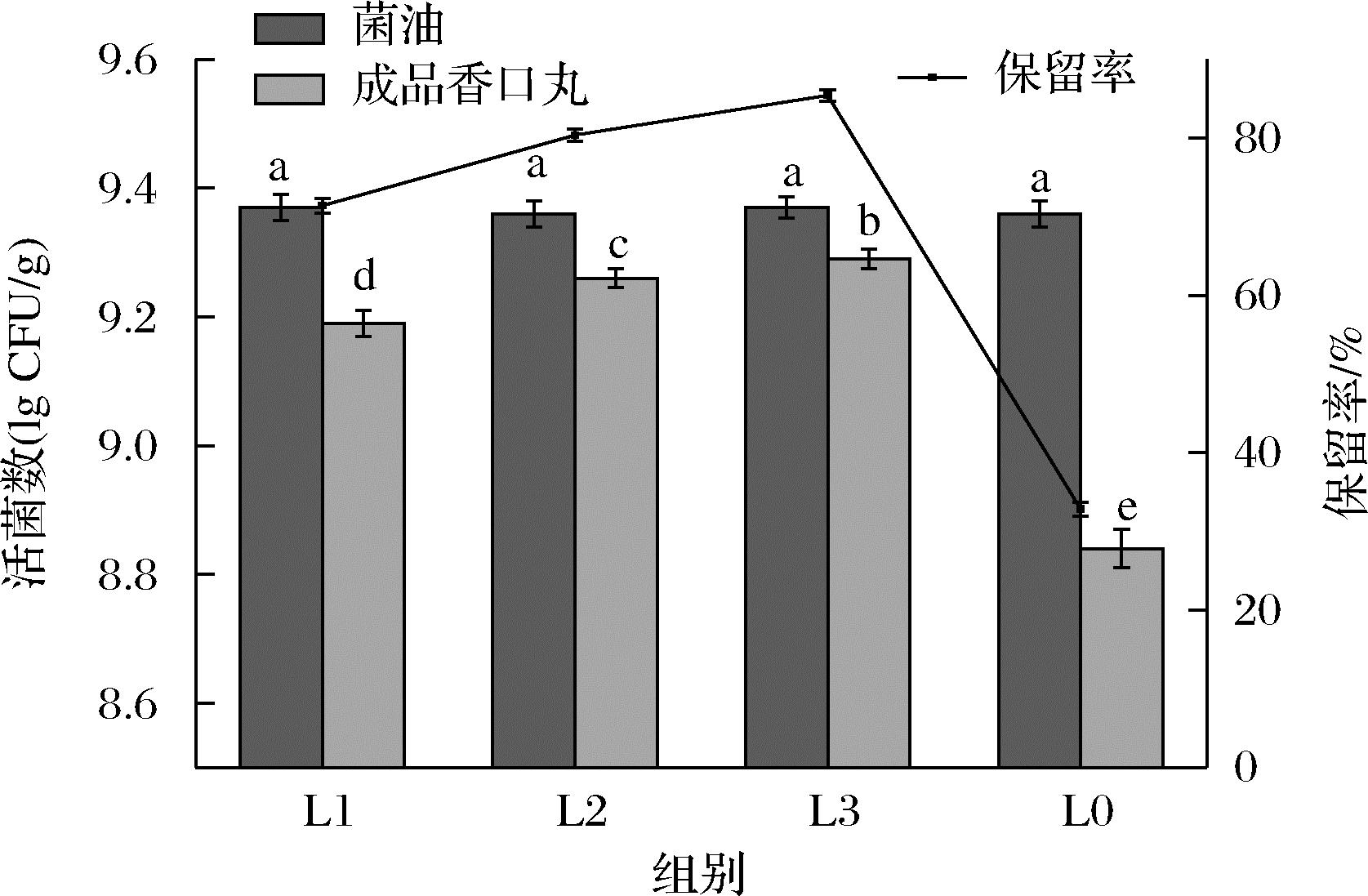
图2 不同磷脂添加量的益生菌香口丸在加工后 平均活菌数量和菌活保留率
Fig.2 The average number and the retention rate of viable bacteria in probiotic mouth incense pills with different phospholipids added after processing
注:不同小写字母表示差异显著(P<0.05),下同。
在4 ℃贮藏12个月后,当磷脂的质量分数分别为0.5%、1%、1.5%时,平均活菌数分别为9.04 lg CFU/g、9.07 lg CFU/g和9.07 lg CFU/g,未添加磷脂的样品为8.70 lg CFU/g, 在4 ℃环境贮藏时由于温度较低抑制了益生菌基础代谢和活化速度[15],从而抑制了益生菌储藏活性的降低,提高了益生菌香口丸的贮藏稳定性,与前人的研究结果一致[16]。
在25 ℃贮藏12个月后,磷脂质量分数分别为0.5%、1%、1.5%的平均活菌数和菌活保留率分别为8.54 lg CFU/g和20.4%、8.67 lg CFU/g和23.4%、8.67 lg CFU/g和23.1%,而不添加磷脂的香口丸样品其活菌数与保留率为8.12 lg CFU/g和16.9%。因此磷脂的添加有利于提高益生菌在25 ℃时的贮藏稳定性。除此之外,磷脂添加量由0.5%提高至1%,益生菌的保留率有明显提高,而磷脂添加量为1%和1.5%的样品菌活保留率差别不大,这可能是由于1%的磷脂已经足够阻隔菌与胶皮接触,此时再增加磷脂的含量作用较小。
在2种贮藏温度下,均可看出磷脂对于益生菌香口丸的贮藏稳定性的保护作用,磷脂的加入可以减缓益生菌活性的降低。之前的研究发现,磷脂培养的益生菌其细胞表面的疏水性会增强[17],磷脂的添加能够有效降低贮藏时“水分”等环境不良因素对益生菌活性的影响,提高益生菌香口丸的贮藏稳定性[18]。
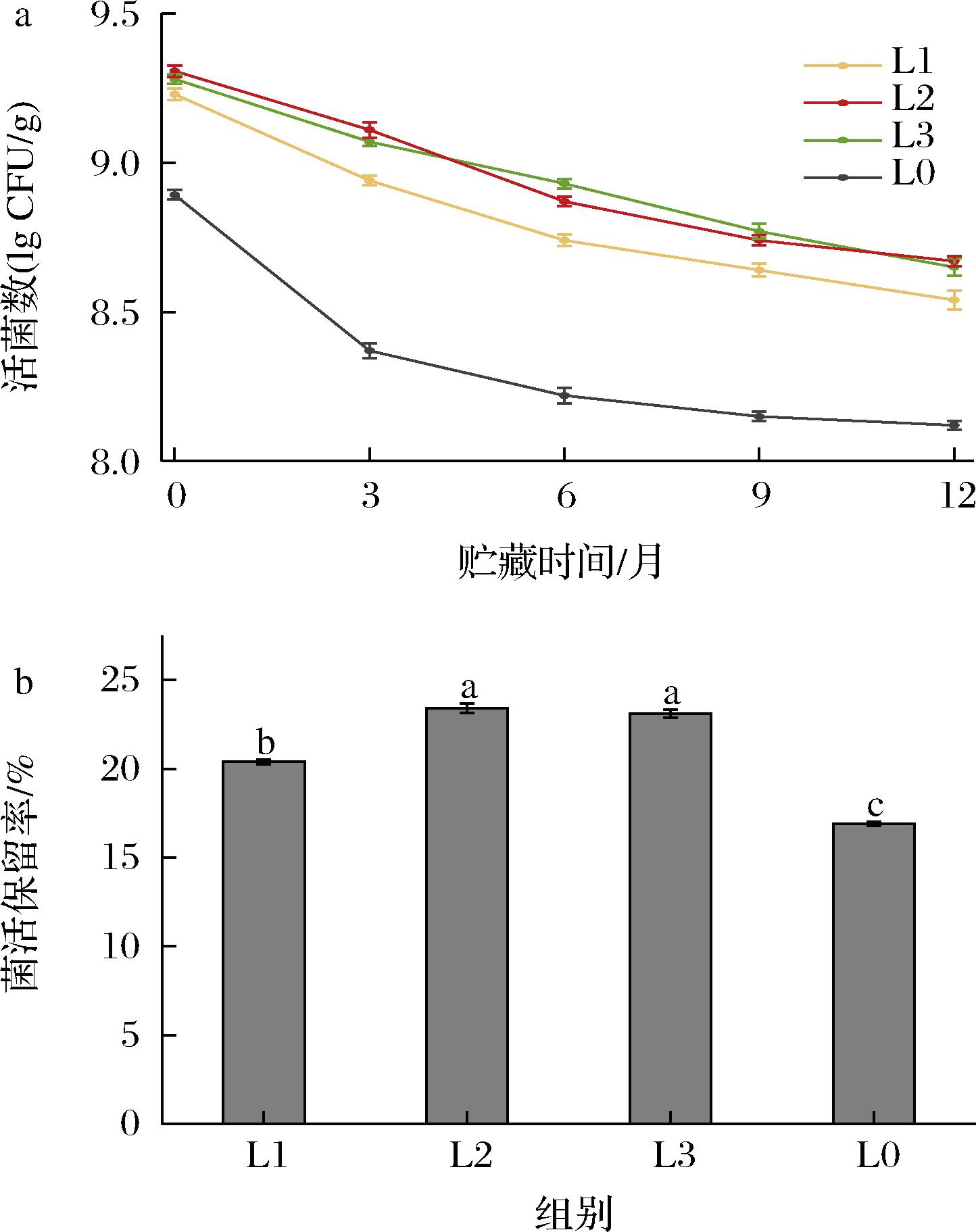
a-活菌数;b-菌活保留率
图3 不同磷脂添加量的益生菌香口丸在25 ℃贮藏 过程中的活菌数量变化和12个月后的活菌保留率
Fig.3 Changes in the number of viable bacteria during storage at 25 ℃ and the retention rate of viable bacteria after 12 months of probiotic mouth incense pills with different phospholipid addition levels
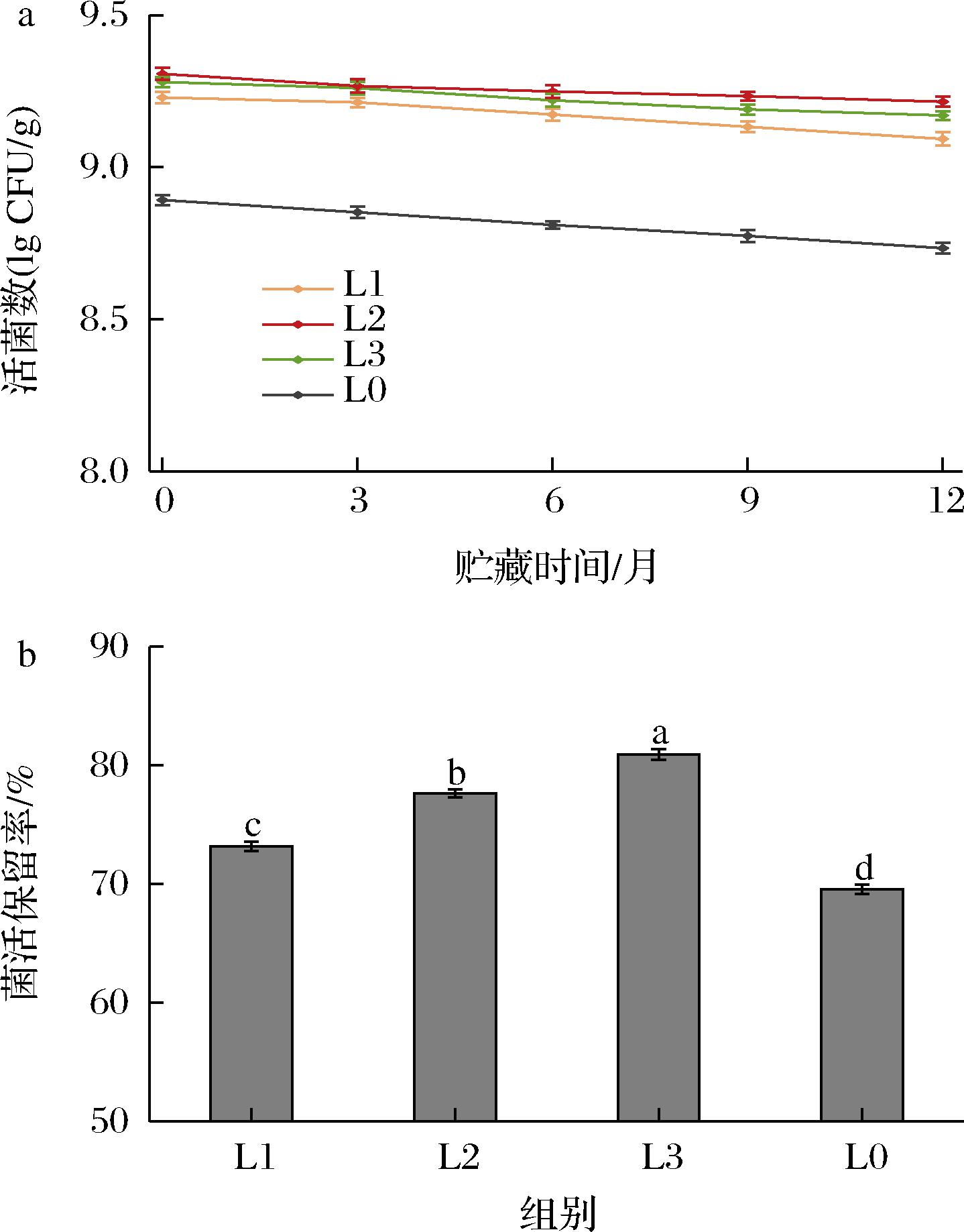
a-活菌数;b-活菌保留率
图4 不同磷脂添加量的益生菌香口丸在4 ℃贮藏过程中的 活菌数量变化和12个月后的活菌保留率
Fig.4 Changes in the number of viable bacteria during storage at 4 ℃ and the retention rate of viable bacteria after 12 months of probiotic mouth incense pills with different phospholipid addition levels
2.4 口腔消化特性
为模拟香口丸外层胶皮咬破后,内部芯材在口腔中的化口过程。将对应的含有不同磷脂含量的固态脂质置于口腔消化液中模拟益生菌香口丸在口腔环境的融化情况。如图5所示,添加磷脂的样品固态脂质芯液融于口腔消化液时,完全融化的溶液呈现乳白色,而未添加磷脂的样品溶液表面存在明显油滴漂浮,说明磷脂的乳化性能够有效减轻固态脂质在口腔中的黏腻口感。图6记录了脂质完全融化所需时间,随着磷脂含量的增加,固态脂质层在口腔环境的融化速度越快,完全融化所需的时间越短,磷脂质量分数为1.5%的样品融化速度最快(<35 s)。推测可能是高含量磷脂的脂质在融化后快速乳化扩散离开,避免了融化油滴对固体脂质融化的阻滞过程,有效提高了脂质的融化速率。更快的融化速率还有利于香精和清凉因子快速扩散,起到更好的香口提神效用。

图5 不同磷脂添加量的益生菌香口丸芯材在口腔 消化液中的融化情况
Fig.5 The melting of probiotic mouth incense pills core material with different phospholipid content in oral digestive fluid
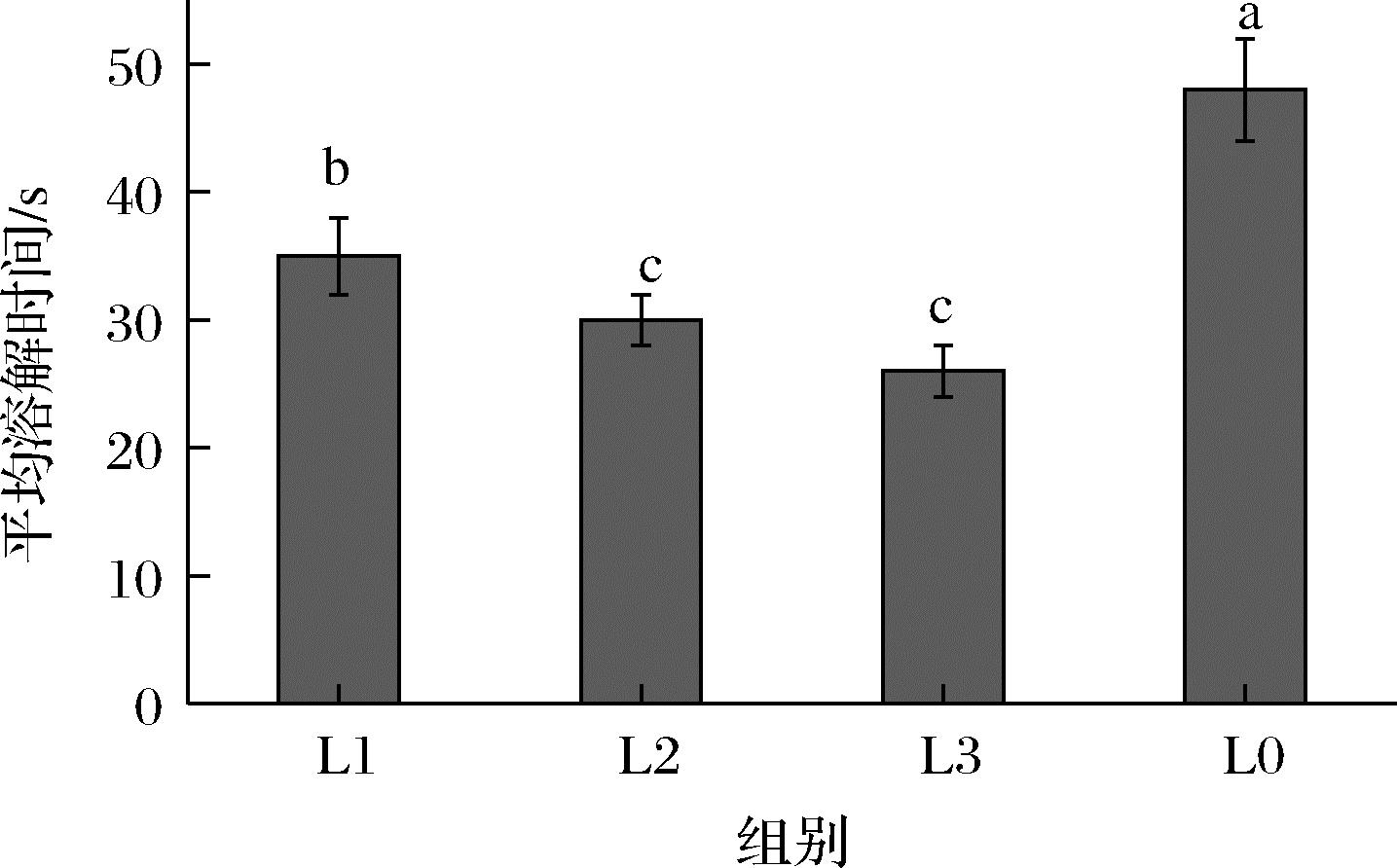
图6 不同磷脂添加量的益生菌香口丸芯材在模拟 口腔消化时完全融化时间
Fig.6 The complete melting time of the core materials of probiotic mouth incense pills with different phospholipid addition amounts during simulated oral digestion
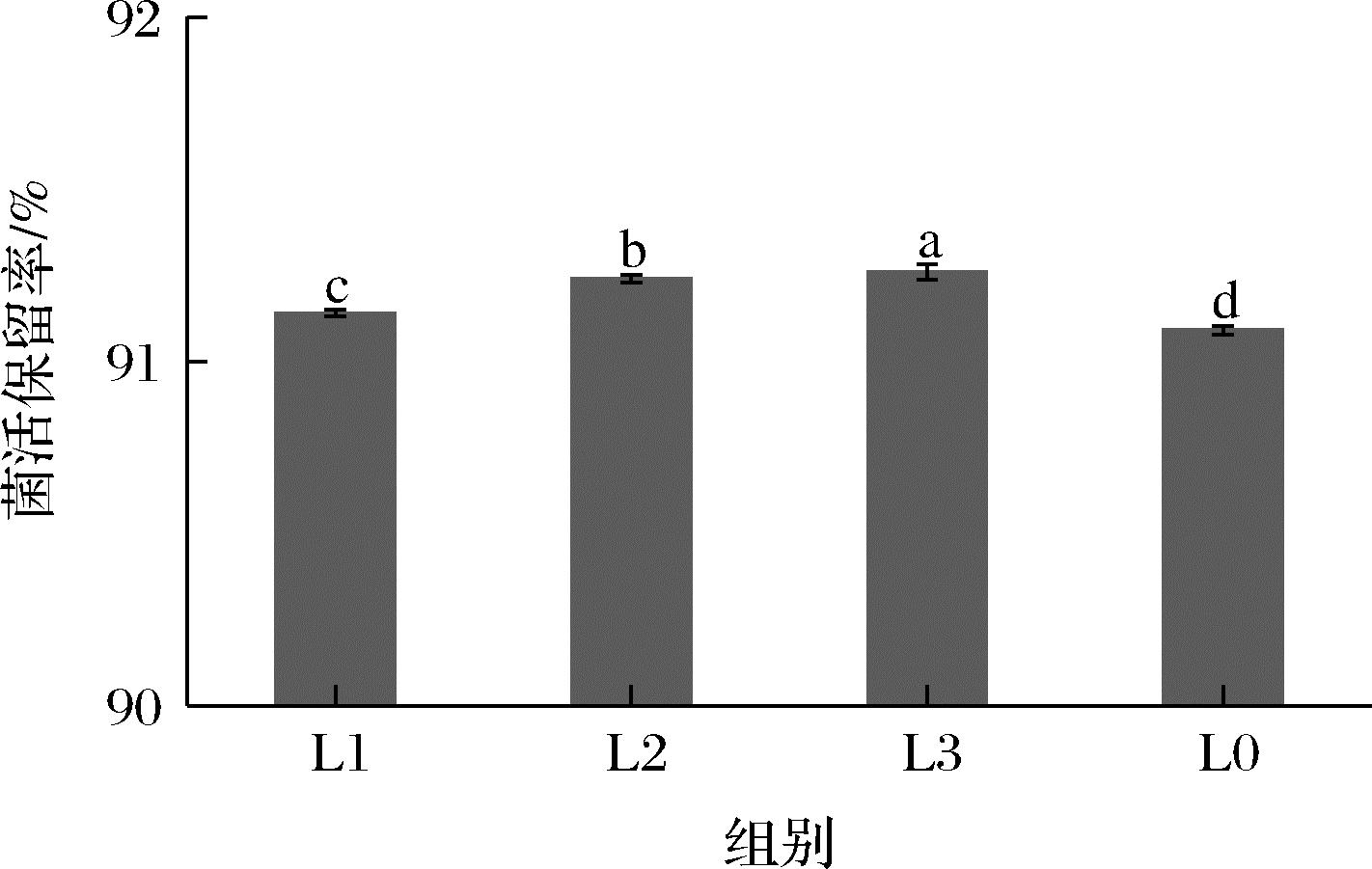
图7 不同磷脂添加量的益生菌香口丸芯材模拟 口腔消化后的活菌保留率
Fig.7 Bacterial retention rate of probiotic mouth incense pills core material with different phospholipids added in simulated oral digestion
3 结论
本研究实验结果显示,磷脂的添加对益生菌香口丸的外观、直径、硬度和弹性几乎未造成影响,有效提高了益生菌在益生菌香口丸加工过程和贮藏阶段的活性和稳定性,同时,磷脂含量越高对益生菌活性的保护效果越明显。除此之外,添加磷脂可以提高固态脂质层在口腔中的融化速度,这可能使益生菌香口丸中的功效因子(益生菌、香味物质及清凉因子等)在口腔中的释放速度加快,且添加磷脂对益生菌在口腔中的菌活保留不会造成不利影响。综上,向益生菌香口丸的芯材中添加磷脂能为改善市面上的益生菌类产品的口感和提高益生菌稳定性的问题提供新的思路。
[1] HUANG R M, FENG K, LI S F, et al. Enhanced survival of probiotics in the electrosprayed microcapsule by addition of fish oil[J]. Journal of Food Engineering, 2021, 307:110650.
[2] LI Q, SHI J L, LIU L, et al. Encapsulation of fruit peel proanthocyanidins in biopolymer microgels: Relationship between structural characteristics and encapsulation/release properties[J]. Food Hydrocolloids, 2021, 117:106693.
[3] CHAMPAGNE C P, ROSS R P, SAARELA M, et al. Recommendations for the viability assessment of probiotics as concentrated cultures and in food matrices[J]. International Journal of Food Microbiology, 2011, 149(3):185-193.
[4] GAO Y X, WANG X, XUE C H, et al. Latest developments in food-grade delivery systems for probiotics: A systematic review[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(20):4371-4388.
[5] MIN M, BUNT C R, MASON S L, et al. Non-dairy probiotic food products: An emerging group of functional foods[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(16):2626-2641.
[6] LI L L, LIU G Q, BOGOJEVIC O, et al. Edible oleogels as solid fat alternatives: Composition and oleogelation mechanism implications[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2077-2104.
[7] NASTARAN K, MEHRDAD N, HADI E M, et al. Microencapsulation of Lacticaseibacillus rhamnosus GG and L. plantarum 299 V by reverse spherification: A promising method to improve the survival of probiotics[J]. Letters in Applied Microbiology, 2023, 76(1).DOI:10.1093/lambio/ovac025.
[8] HUANG X, G NZLE M, ZHANG H, et al. Microencapsulation of probiotic lactobacilli with shellac as moisture barrier and to allow controlled release[J]. Journal of the Science of Food and Agriculture, 2021, 101(2):726-734.
NZLE M, ZHANG H, et al. Microencapsulation of probiotic lactobacilli with shellac as moisture barrier and to allow controlled release[J]. Journal of the Science of Food and Agriculture, 2021, 101(2):726-734.
[9] ALBADRAN H A, CHATZIFRAGKOU A, KHUTORYANSKIY V V, et al. Development of surfactant-coated alginate capsules containing Lactobacillus plantarum[J]. Food Hydrocolloids, 2018, 82:490-499.
[10] ADRIANA R M, DE ASSIS LETICIA M, MARIA I R M, et al. Importance of lecithin for encapsulation processes[J]. African Journal of Food Science, 2014, 8(4):176-183.
[11] ZHUANG X Q, GAUDINO N, CLARK S, et al. Novel lecithin-based oleogels and oleogel emulsions delay lipid oxidation and extend probiotic bacteria survival[J]. LWT, 2021, 136:110353.
[12] CHENG C, PENG S F, LI Z L, et al. Improved bioavailability of curcumin in liposomes prepared using a pH-driven, organic solvent-free, easily scalable process[J]. RSC Advances, 2017, 7(42):25978-25986.
[13] GAO Y, WU X L, MCCLEMENTS D J, et al. Encapsulation of bitter peptides in water-in-oil high internal phase emulsions reduces their bitterness and improves gastrointestinal stability[J]. Food Chemistry, 2022, 386:132787.
[14] PLAZA L G, DIMA P, AUDIN E, et al. Lecithin-Bifidobacterium probiotics interactions: A case study[J]. Food Bioscience, 2023, 51:102268.
[15] Jiang T, Song S, Tao C, Fang S. The Application of cryogenic freeze technique in probiotics production[J]. Food and Fermentation Industries, 2011, 37(7): 157-160.
[16] KHODAEI D, HAMIDI-ESFAHANI Z, LACROIX M. Gelatin and low methoxyl pectin films containing probiotics: Film characterization and cell viability[J]. Food Bioscience, 2020, 36:100660.
[17] HU B, TIAN F, WANG G, et al. Enhancement of bile resistance in Lactobacillus plantarum strains by soy lecithin[J]. Letters in Applied Microbiology, 2015, 61(1):13-19.
[18] MULYANINGSIH R D, NURHIDAYAT N, MANGUNWARDOYO W. Viability microcapsules Lactobacillus plantarum Mar 8 and KMar C2 in chocolate (Theobroma cacao L.) for probiotic purposes[J]. Journal of Physics: Conference Series, 2020, 1567(4):042073.