社会的快速发展,加大了对于各种自然资源的开发和利用,导致了环境污染的不断恶化,给生态环境和人类健康带来了巨大的威胁。其中镉是一种常见的环境重金属污染物,主要来源于矿物开采、化肥生产、冶炼和电镀工业[1]。镉即使在低浓度下也具有毒性,极易通过食物链在人体中积累,其诱导产生的活性氧,可对人体肝肾、大脑功能和中枢神经系统造成严重损害[2]。因此,镉被国际癌症研究机构归类为Ⅰ类致癌物。降低环境中的镉成为了一个亟待解决的问题。
目前,处理重金属镉的方法主要有离子交换、电化学处理和膜过滤等物理和化学方法[3]。然而,这些方法在面对处理低浓度(<100 mg/L)的重金属时存在着成本高,难以操作,效果不佳等问题[4]。生物修复的应用,特别是微生物修复的应用,有效地解决了这些问题。与物理化学方法相比,微生物法具有成本低,易操作等优点;与其他生物修复相比,微生物具有来源广泛,易获得,易培养,生长迅速和适应性强的优势,引起了研究人员的广泛关注[5]。
乳酸菌,作为普遍认为安全的益生菌,在食品工业中有着广泛的应用。越来越多的研究表明许多乳酸菌具有良好的重金属的耐受性和吸附特性,而且相较于其他菌株,乳酸菌更加的安全,对人体无害,因而在生物修复方面展现了巨大的潜力[6]。ZHAI等[7]从33株乳酸菌中筛选出了一株植物乳杆菌CCFM8610,发现其具有较好的镉耐受性和镉结合能力。KIRILLOVA等[8]测定了10株乳酸菌的降镉能力,得到了具有降镉能力的4株植物乳杆菌和3株发酵乳杆菌,其对培养基中的镉有不同程度的降低效果(4%~16%)。陈宇凌等[9]对从四川自制泡菜汁中筛选出的高耐镉绿色魏斯菌ZY-6的吸附特性进行了研究,发现其对镉、铅、铜和锰都有一定的吸附能力。SHU等[10]筛选出一株具有良好镉耐受性和降镉能力(51%)的发酵乳杆菌L19,并将其接种到果汁中,发现其对番茄汁和苹果汁中的镉具有较好的去除效果。由此可见,不同的乳酸菌菌株对于镉的耐受能力和降低能力也有所不同。而且目前对于乳酸菌降重金属的机理仍不完全清楚,不同的菌株降重金属的机制存在差异;一种菌株的降重金属过程可能涉及多种机制。因此,对于具有良好重金属耐受性和降低能力的乳酸菌菌株的发掘和机制的研究仍有很大的前景。
前期在对本实验室保藏的分离自市售发酵食品中的乳酸菌菌株进行耐镉菌的筛选,得到一株在固体培养基上具有良好耐镉能力(1 000 mg/L)的肉葡萄球菌(Staphylococcus carnosus)846。肉葡萄球菌是一种食品级菌株,广泛应用于发酵肉制品中[11]。此次筛选出的肉葡萄球菌846分离自湖南烟熏猪肉,并已通过安全性试验[12]。过往少有关于肉葡萄球菌降Cd2+方面的报道,在此,本研究对该株肉葡萄球菌的降镉特性和降镉机制进行了的探究,以期为乳酸菌处理重金属的应用提供基础理论依据。
1.1.1 试验材料
肉葡萄球菌(Staphylococcus carnosus)846,保藏于西北农林科技大学食品科学与工程学院食品微生物与生物技术实验室。
1.1.2 试验试剂
氯化镉(分析纯),上海麦克林生化科技有限公司;MRS肉汤,北京陆桥技术股份有限公司;溴化钾(色谱纯)、25%戊二醛,天津市科密欧化学试剂有限公司;PBS溶液,厦门海标科技有限公司。
NRY-2102型摇床培养箱,上海南荣实验室设备有限公司;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司;pH计,上海雷磁仪器厂;ZEEnit 700P原子吸收光谱仪,德国耶拿分析仪器股份公司;Nano SEM-450场发射扫描电子显微镜,美国FEI公司;SCIENTZ-12 N/A冷冻干燥机,宁波新芝生物科技股份有限公司;Vertex70傅里叶变换红外光谱,德国Bruker公司。
1.3.1 肉葡萄球菌846降镉特性试验
1.3.1.1 CdCl2母液的制备
准确称取1.631 g CdCl2溶于去离子水中,定容至200 mL,配制成含Cd2+质量浓度为5 000 mg/L的母液,经0.22 μm无菌过滤器过滤,备用。
1.3.1.2 二价镉离子标准曲线的绘制
Cd2+标准曲线的绘制参考雷蕾[13]的方法,并略有改动。将CdCl2母液稀释至50 mg/L的Cd2+溶液,然后再配制成质量浓度分别为0、0.25、0.50、0.75、1.00、1.25 mg/L的标准溶液,利用火焰原子吸收分光光度计(波长:228.8 nm;工作电流:3 mA)分别测定其对应吸光值A,以Cd2+浓度为横坐标,其对应的吸光度值A为纵坐标,绘制Cd2+标准曲线并求出吸光度值与Cd2+浓度关系的一元线性回归方程。
1.3.1.3 肉葡萄球菌846降镉能力的测定
将肉葡萄球菌846进行复壮、活化,扩大培养至对数期中后期,离心收集菌体(5 000×g,10 min,4 ℃),用PBS溶液(0.1 mol/L,pH 7.2)漂洗2次,得到肉葡萄球菌菌体,然后制成10 g/L(干重)的菌悬液,备用。将Cd2+溶液母液稀释至100 mg/L,备用。将菌悬液与Cd2+稀释液混合于150 mL无菌锥形瓶,并调节pH,使其菌体终浓度为1 g/L(干重),Cd2+终质量浓度为50 mg/L,pH为6.0。在振荡培养箱中振荡培养(120 r/min,37 ℃)24 h,离心(5 000×g,10 min,4 ℃)得到上清液,去离子水稀释40倍,使用火焰原子吸收分光光度计,采用与绘制Cd2+标准曲线相同方法测定Cd2+的浓度。Cd2+的降低率(%)和单位质量菌体对Cd2+的降低质量(mg/g)的计算如公式(1)和公式(2)所示:
降低率![]()
(1)
单位菌体降Cd2+量![]()
(2)
式中:C0,Cd2+溶液初始浓度,mg/L;C1,降镉试验后Cd2+的浓度,mg/L;CSt,溶液中肉葡萄球菌的浓度,g/L。
1.3.1.4 不同因素对肉葡萄球菌846降镉能力的影响
a)pH值对肉葡萄球菌846降镉能力的影响:分别将菌悬液与Cd2+溶液母液混合于150 mL锥形瓶,pH分别调节至4.0、5.0、6.0、7.0、8.0,使Cd2+终质量浓度为50 mg/L,菌体干重终浓度为1.0 g/L,37 ℃下振荡培养24 h,测定上清液中Cd2+的浓度。
b)Cd2+浓度对肉葡萄球菌846降镉能力的影响:分别将菌悬液与Cd2+溶液母液混合于150 mL锥形瓶,分别调节Cd2+终浓度为25、50、75、100、125 mg/L,pH为6.0,菌体干重终浓度为1.0 g/L,37 ℃下振荡培养24 h,测定上清液中Cd2+的浓度。
c)菌体浓度对肉葡萄球菌846降镉能力的影响:分别将菌悬液与Cd2+溶液母液混合于150 mL锥形瓶,分别调节菌体干重终浓度为0.5、1.0、1.5、2.0、2.5 g/L,pH为6.0,Cd2+终质量浓度为50 mg/L,37 ℃ 下振荡培养24 h,测定上清液中Cd2+的浓度。
d)其他金属离子对肉葡萄球菌846降镉能力的影响:分别将菌悬液与Cd2+溶液母液混合于150 mL锥形瓶,分别添加相同浓度的其他金属离子Cr6+,Pb2+,Mg2+,Zn2+,pH调节至6.0,使Cd2+终质量浓度为50 mg/L,菌体干重终浓度为1.0 g/L,37 ℃下振荡培养24 h,测定上清液中Cd2+的浓度。
1.3.2 肉葡萄球菌846降镉机制研究
1.3.2.1 扫描电镜及能谱扫描分析
扫描电镜及能谱扫描样品的制备参考张利[14]的方法,略作改动。分别将镉处理(条件同1.3.1.3)和未处理的菌体(Cd2+浓度为0,其他条件同1.3.1.3)离心(5 000×g,10 min,4 ℃),收集菌体。用PBS溶液(0.1 mol/L,pH 7.2)洗涤2次,离心;随后浸渍于2.5%戊二醛中固定,4 ℃下过夜。固定完成后用PBS溶液(0.1 mol/L,pH 7.2)漂洗2次,每次10 min,然后梯度乙醇(30%,50%,70%,80%,90%,100%)脱水,每次10 min。最后得到的菌液滴于硅片,超临界CO2干燥2 h,经喷金后上镜观察,并使用能量色散X射线光谱仪(energy dispersive X-ray spectroscopy, EDX)进行元素分析。
1.3.2.2 傅里叶红外光谱分析
傅里叶红外光谱样品的制备参考刘淼[15]的方法。收集镉处理和未经镉处理的菌体,用PBS溶液(0.1 mol/L,pH 7.2)洗涤2次,经预冻后于冷冻干燥机中冻干(冷阱温度为-80 ℃,24 h),得到菌粉。溴化钾置于干燥箱中100 ℃干燥4 h。将溴化钾和菌粉按照100∶1的质量比混合研磨,进行傅里叶红外光谱分析。
试验均设置3组平行,设置不添加菌株的空白对照组。结果用平均值±标准偏差表示,数据处理采用Minitab 18,图形绘制采用Origin 2022。多批次试验比较一致。
以Cd2+浓度为横坐标,吸光度值A为纵坐标,绘制Cd2+的标准曲线。求得的线性回归方程为:y=0.090 2x-0.000 7,拟合度R2=0.999 7。此标准曲线具有较高的可靠性,符合原子吸收光谱对于标准曲线拟合度的要求。
2.1.1 不同pH值对肉葡萄球菌846降镉能力的影响
肉葡萄球菌846在不同pH值条件下的降镉能力如图1所示。结果显示,pH 5以下,随着pH的升高,该菌株降Cd2+能力不断增强,当pH值为5时达到最大值[(28.823±0.953)%;(14.412±0.476) mg/g];当pH>5时,菌体降Cd2+能力逐步下降。该结果与别人的研究结果相似,乳酸菌的生物吸附能力在pH 2~6时达到最大值[16]。pH是影响微生物处理重金属的重要因素,其不仅影响金属离子的价态,也对细胞表面电荷及官能团有着一定的影响[17]。当pH过低时,溶液中大量的H+会与Cd2+竞争结合位点,从而使部分Cd2+仍存在于溶液中;当pH升高,H+开始减少,Cd2+有更多的机会与菌体结合,使得溶液中的Cd2+减少;而当pH较高时,溶液中的OH-离子浓度增高,竞争性吸附了环境中阳离子,从而减少了菌体对Cd2+的吸附或吸收,从而导致Cd2+降低率和降低量的减少[14]。
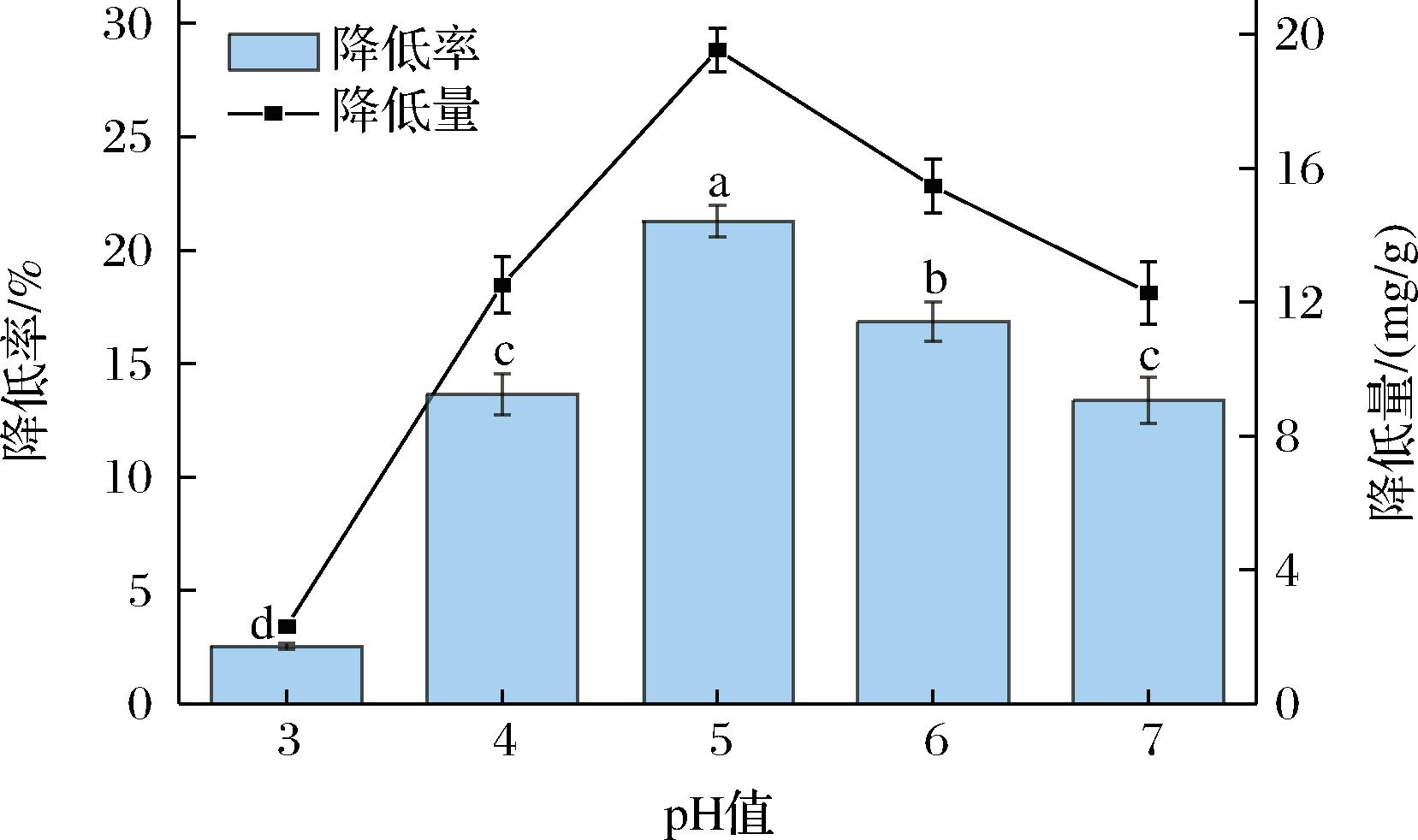
图1 不同pH值对肉葡萄球菌846降Cd2+能力的影响
Fig.1 The effect of pH on the Cd2+-lowering capacity of Staphylococcus carnosus 846
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 不同Cd2+浓度对肉葡萄球菌846降镉能力的影响
当肉葡萄球菌846面对浓度逐渐升高的Cd2+时,其降Cd2+率和降Cd2+量都出现了不同程度的下降,如图2所示。在较低Cd2+浓度时,Cd2+有更多的机会与菌体结合位点结合,此时菌体可以充分地发挥其降金属能力;而当Cd2+逐渐增加时,对细胞的毒性伤害也越大,一些细胞结构被破坏,在菌体数量不变的情况下,金属结合位点可能会减少,进而导致菌体降Cd2+能力的下降。而当Cd2+质量浓度由25 mg/L上升为50 mg/L时,菌体降Cd2+量没有显著变化;高于50 mg/L时,降Cd2+量出现了显著的降低;由此可以推测,在这种条件组合下,肉葡萄球菌846结合位点在Cd2+质量浓度在25~50 mg/L时达到饱和或过饱和,此时降Cd2+量达到最大值(11.412±0.592) mg/g。
2.1.3 不同菌体浓度对肉葡萄球菌846降镉能力的影响
如图3所示,随着菌体浓度增大,肉葡萄球菌846对Cd2+的降低率显著增加,特别是在菌体浓度从0.5 g/L增加到1.5 g/L的过程中,几乎呈线性增加;而后随着菌体浓度的进一步增大,Cd2+降低率的变化率逐渐减小,有着增长平缓的趋势,在菌体浓度为2.5 g/L,对50 mg/L质量浓度Cd2+的降低率达到了(43.870±2.400)%。然而,在整个过程中,肉葡萄球菌846对Cd2+的降低量呈现出了不同的变化:降Cd2+量随菌体浓度的增加而上升,于1 g/L菌体浓度下达到了最大值(11.412±0.592) mg/g,随后在菌体浓度提高为1.5 g/L时,菌体降Cd2+量没有显著增加;当菌体浓度大于1.5 g/L时,降Cd2+量出现了显著性的下降。这些现象可能是因为,随着菌体浓度的增加,与Cd2+结合位点的数量也随之增多,进而表现出了Cd2+降低率和降低量的上升[18];而在菌体浓度进一步加大时,菌体出现吸附聚集,这在一定程度上减少了结合位点,可利用位点达到饱和甚至过饱和,Cd2+降低量开始下降;由于总体菌体数量的增加,Cd2+降低率仍呈现变化幅度减小的上升。
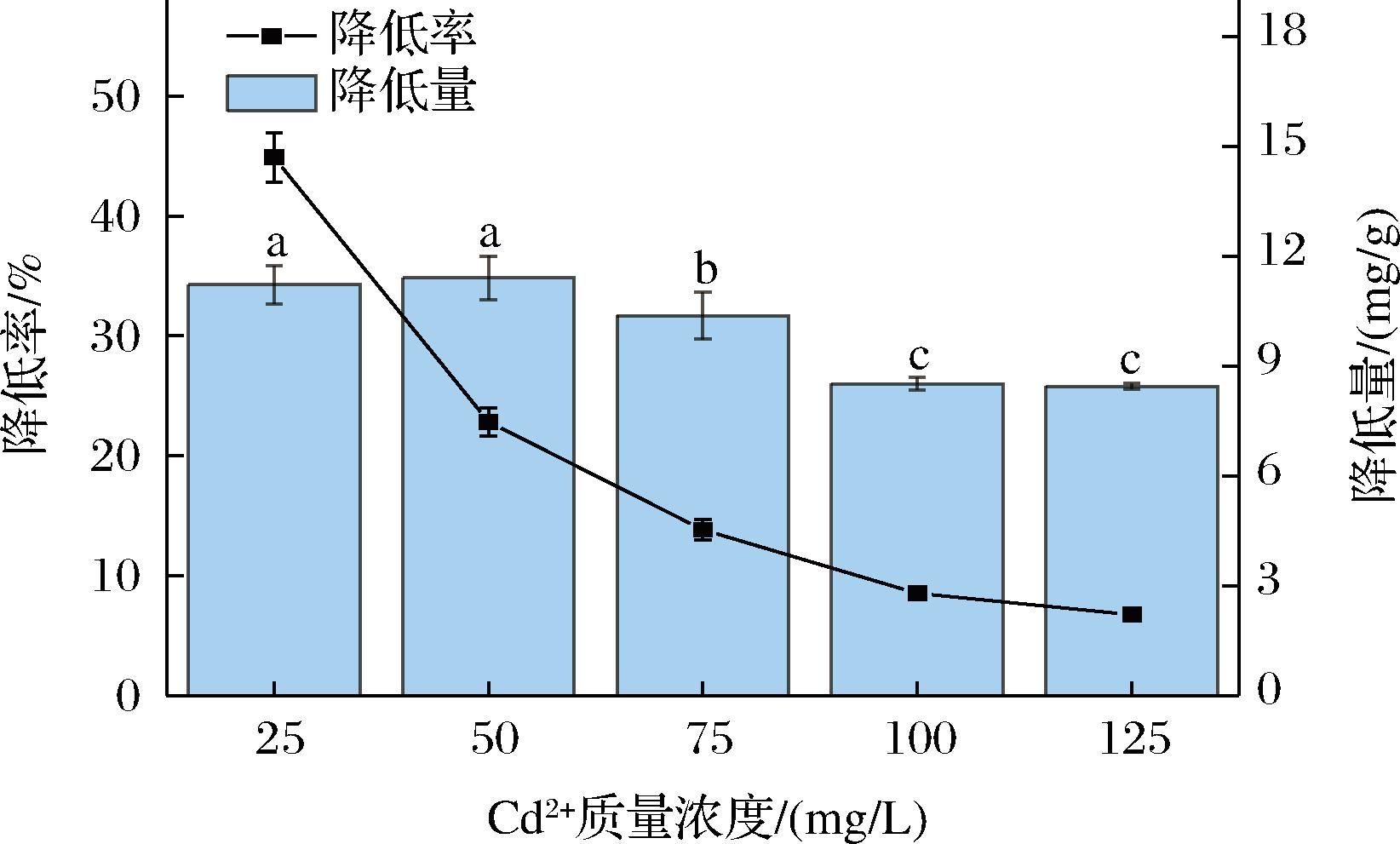
图2 不同Cd2+浓度对肉葡萄球菌846降Cd2+能力的影响
Fig.2 The effect of Cd2+concentration on the Cd2+-lowering capacity of Staphylococcus carnosus 846
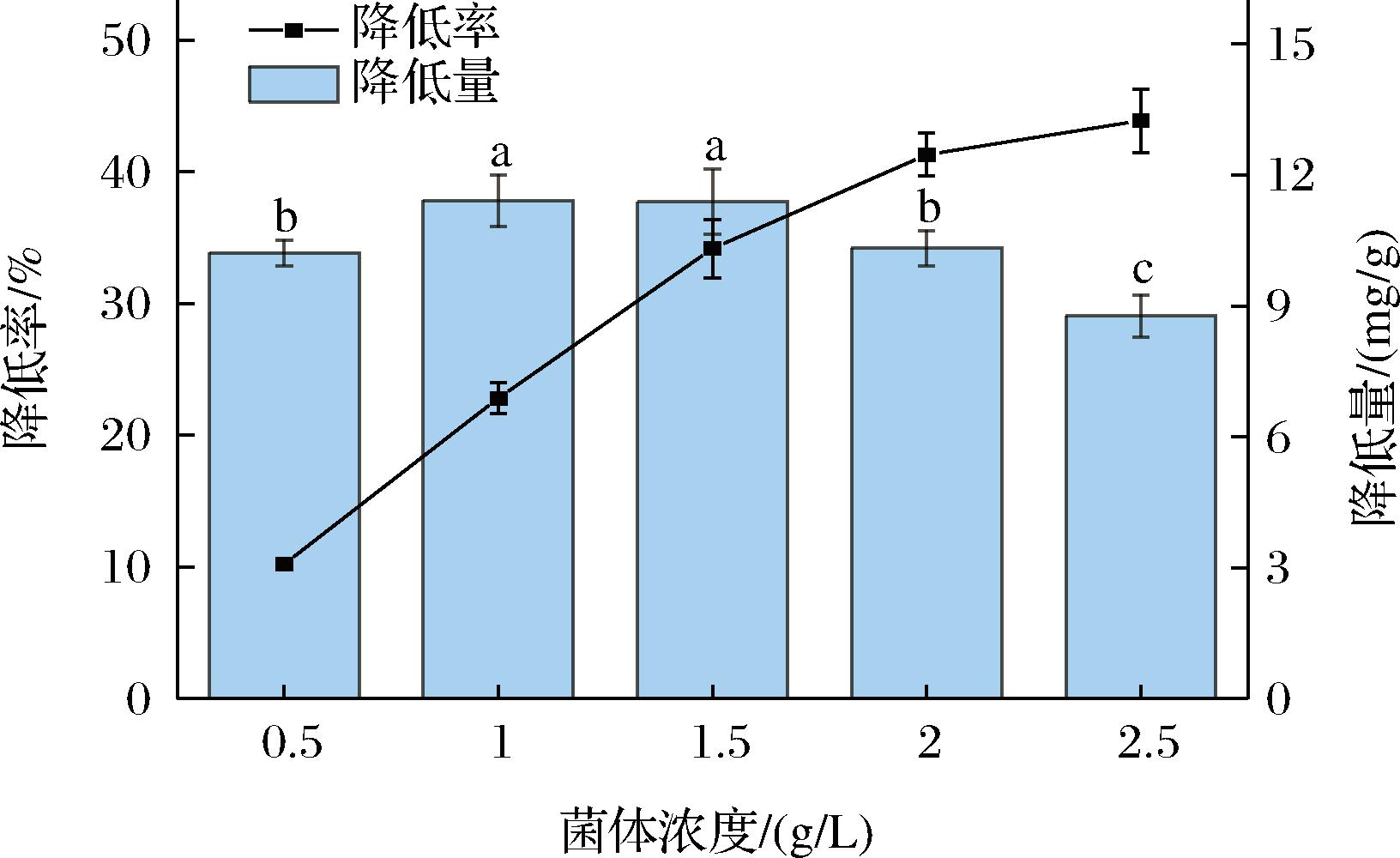
图3 不同菌体浓度对肉葡萄球菌846降Cd2+能力的影响
Fig.3 The effect of cell concentration on the Cd2+-lowering capacity of Staphylococcus carnosus 846
2.1.4 其他金属离子对肉葡萄球菌846降镉能力的影响
在实际环境中,工业废水中往往含有2种或多种金属离子,并且成分复杂。因此测定不同金属离子对菌体降Cd2+能力的影响是有意义的。本试验分别对比了Cr6+、Zn2+、Pb2+和Mg2+ 4种金属离子对肉葡萄球菌846降Cd2+能力的影响(图4)。除Cr6+外,其余金属离子均对菌体降Cd2+率有着不同程度的负面影响。其中,Pb2+对菌体降Cd2+能力的影响最大,使其降Cd2+率显著降至为(13.350±2.320)%,相较只有Cd2+存在时降低了41.509%;而Mg2+虽然对其影响没有显著性差异,但仍下降了9.188%;Zn2+使其下降了16.285%。这可能是因为Zn2+、Pb2+和Mg2+等金属离子与Cd2+在与菌体结合位点结合时形成了竞争关系[19],并且金属离子的结合是有选择性和优先性的[20]。其他金属离子的存在会干扰菌体对特定金属离子的降低效果,这与之前的研究是一致的。YIN等[21]的研究发现植物乳杆菌CCFM8661在单一金属离子体系下的降Pb2+效果要好于二元金属离子体系,并且Fe3+、Ca2+和Mn2+的存在显著降低了菌株降Pb2+能力。然而,在本次试验中,Cr6+的存在却显著地提高了肉葡萄球菌846的降Cd2+能力,使其增加了61.102%。这种现象的出现可能是由于Cr6+的强氧化性,再加上与Cd2+的协同毒性,使细胞死亡,细胞膜通透性改变,使得Cd2+进入细胞内,溶液中Cd2+浓度减小。
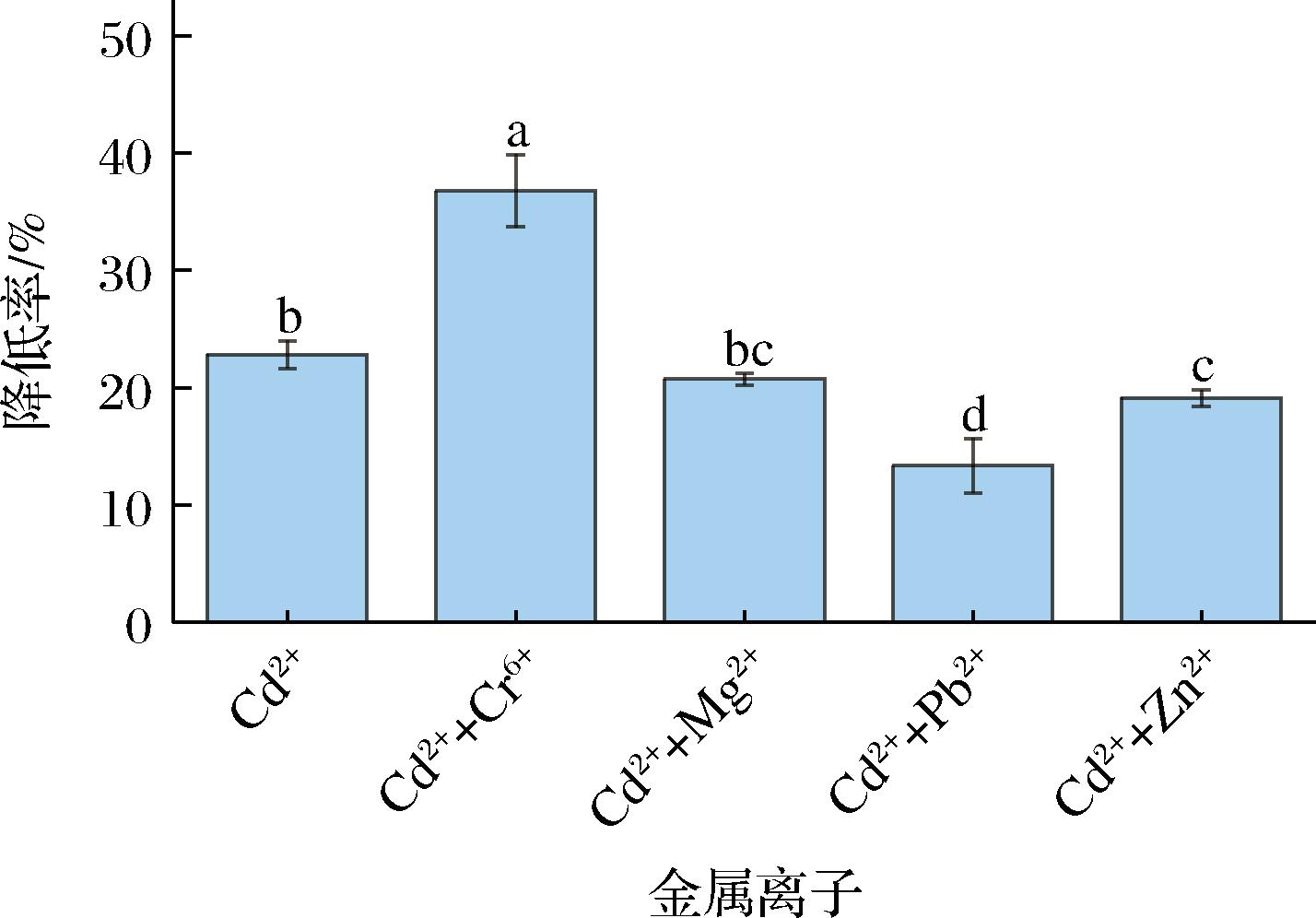
图4 不同金属离子对肉葡萄球菌846降Cd2+能力的影响
Fig.4 The effect of other metal ions on the Cd2+-lowering capacity of Staphylococcus carnosus 846
通过扫描电镜可以直观地看出重金属离子对细胞形态的影响,而能谱可以了解菌体表面和内部的元素分布情况。未经镉处理的肉葡萄球菌846细胞呈杆状,表面光滑,细胞之间较为分散(图5-a);能谱色散检测出了一些构成细胞的元素(图5-b)。而经过降Cd2+试验的细胞表面发生褶皱,变得粗糙,细胞变形,甚至有些细胞发生破裂;细胞表面有颗粒状附着物,并且细胞大量聚集(图5-c);其能谱色散检测出了镉元素的存在(图5-d),这证实了肉葡萄球菌846有着降Cd2+的能力。细胞在受到重金属的压迫时,其形态发生改变,表面变得粗糙,与HUANG等[22]对大肠杆菌、枯草芽孢杆菌和酿酒酵母3种菌株在镉暴露下的试验结果相似,这可能与镉的毒性有关;重金属会改变细胞表面的疏水性和电荷,进而引发结构的改变[23]。而细胞的大量聚集可能是细胞的一种自我保护的机制,减小与重金属的接触面积。细胞表面的颗粒物可能与某些胞外分泌物与镉的结合有关[24]。

a-肉葡萄球菌846对照组SEM;b-肉葡萄球菌846对照组EDS; c-肉葡萄球菌846镉处理组SEM;d-肉葡萄球菌846镉处理组EDS
图5 Cd2+对肉葡萄球菌846作用的扫描电镜图及能谱图
Fig.5 SEM and EDS of Staphylococcus carnosus 846 faced with Cd2+
肉葡萄球菌846细胞壁上的官能团对其降Cd2+发挥着重要的作用。降Cd2+试验前后肉葡萄球菌846中红外傅里叶光谱分析如图6所示。肉葡萄球菌846在降Cd2+试验后,红外光谱峰型几乎没有发生改变,未出现新峰,但有些峰发生了位移。3 296 cm-1处的吸收峰位移至3 298 cm-1,这与细胞表面的—OH与Cd2+发生相互作用有关;脂类—CH2—反对称伸缩振动对应的吸收峰由2 932 cm-1移动到2 934 cm-1,这可能与—CH2—基团与Cd2+发生静电作用有关[25];与蛋白质和多肽的酰胺I基团有关的吸收峰1 657 cm-1和与非对称伸缩振动的—NO2有关的吸收峰1 545 cm-1都没有发生移动;位于1 454 cm-1处的吸收峰位移至1 452 cm-1,这与蛋白质和脂质的CH2/CH3的弯曲振动有关;与C—O键振动的—C—OH基团有关的吸收峰由1 240 cm-1移动到1 238 cm-1;吸收峰1 059 cm-1至1 061 cm-1的移动可能与磷脂中的P![]() O参与了细胞降Cd2+的过程有关。这些结果表明,细胞表面的—OH、—CH2—、CH2/CH3、—C—OH和P
O参与了细胞降Cd2+的过程有关。这些结果表明,细胞表面的—OH、—CH2—、CH2/CH3、—C—OH和P![]() O等基团参与了肉葡萄球菌846的降Cd2+。这些基团与细胞表面的蛋白质和脂类有关。不同的菌株,其降Cd2+过程中表面基团的参与性也有所不同。邵鑫等[26]对植物乳杆菌ATCC 8014的研究发现,
O等基团参与了肉葡萄球菌846的降Cd2+。这些基团与细胞表面的蛋白质和脂类有关。不同的菌株,其降Cd2+过程中表面基团的参与性也有所不同。邵鑫等[26]对植物乳杆菌ATCC 8014的研究发现,![]() 和C—H等基团参与了其降Cd2+过程。总的来说,细胞表面的基团对肉葡萄球菌846降Cd2+发挥了重要的作用。
和C—H等基团参与了其降Cd2+过程。总的来说,细胞表面的基团对肉葡萄球菌846降Cd2+发挥了重要的作用。
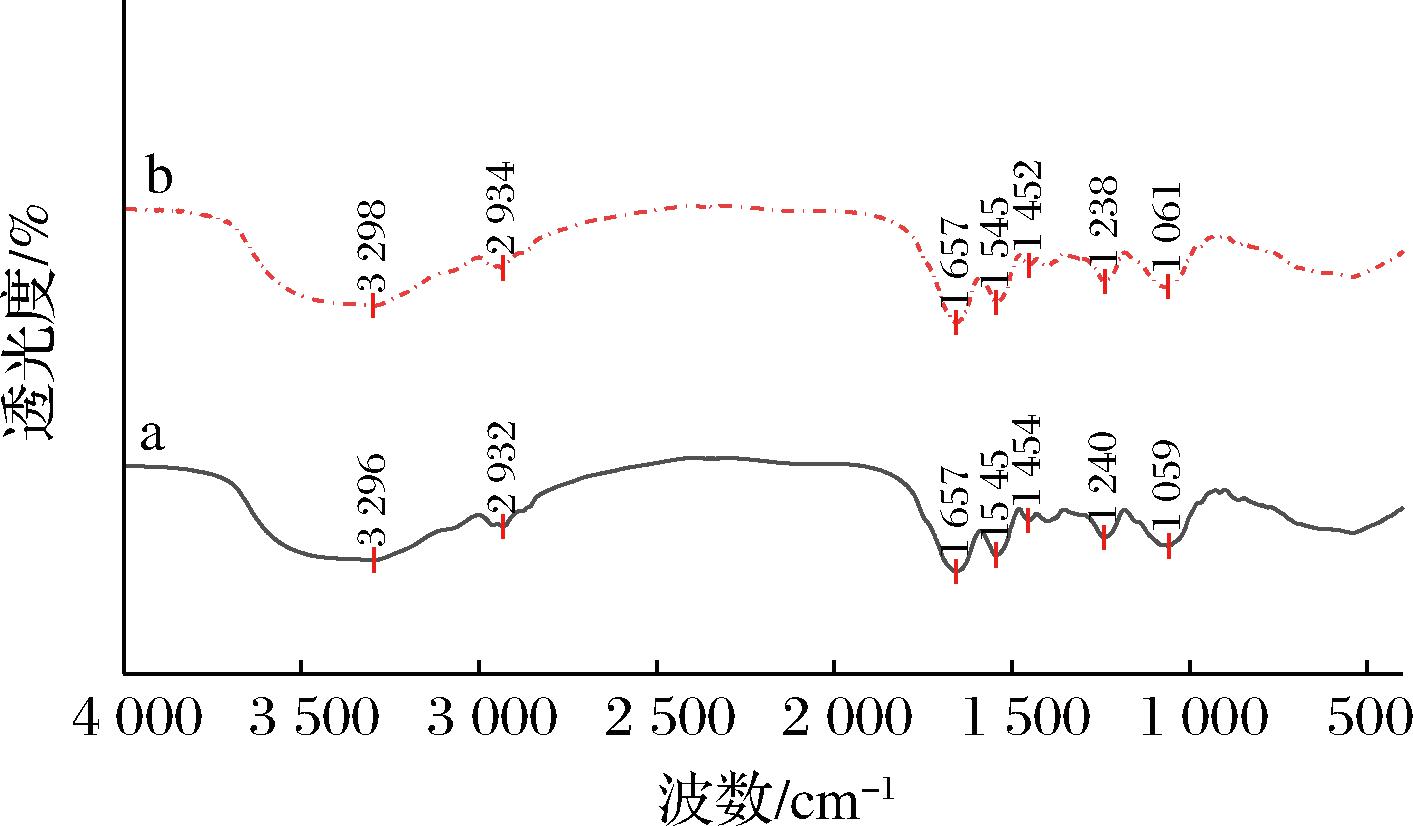
a-对照组;b:处理组
图6 Cd2+处理的肉葡萄球菌846傅里叶光谱图
Fig.6 FTIR spectra of Staphylococcus carnosus 846 with Cd2+
本文对一株具有良好耐镉能力的乳酸菌菌株——肉葡萄球菌846进行了一系列的降Cd2+研究。pH、菌体浓度、重金属浓度和其他共存金属离子都对其降Cd2+能力有着不同的影响,其中,当pH为5,Cd2+质量浓度为50 mg/L和菌体浓度为1 g/L时,菌体的降Cd2+效率达到最大值;而金属离子的共存,大多会降低菌体的降Cd2+效果。SEM-EDS证实了肉葡萄球菌846的降Cd2+作用,以及Cd2+对细胞的毒害作用。傅里叶红外光谱显示细胞表面的—OH、—CH2—、CH2/CH3、—C—OH和P![]() O等基团参与了菌体降Cd2+。本次试验筛选出了一株具有良好耐镉和降镉能力的乳酸菌菌株,为乳酸菌降重金属的开发和利用提供了一定的理论基础。未来还应对乳酸菌降重金属的实际应用进行一系列的研究,以利于实验室向应用的转化。
O等基团参与了菌体降Cd2+。本次试验筛选出了一株具有良好耐镉和降镉能力的乳酸菌菌株,为乳酸菌降重金属的开发和利用提供了一定的理论基础。未来还应对乳酸菌降重金属的实际应用进行一系列的研究,以利于实验室向应用的转化。
[1] 管宇立. 水铁矿及其与腐植酸共沉物对水溶液中镉的吸附作用研究[D].兰州:兰州大学, 2018.
GUAN Y L.Adsorption of cadmium from aqueous solution by ferrihydrite and their coprecipitate with humic acid[D].Lanzhou:Lanzhou University, 2018.
[2] ELKHATIB E, MAHDY A, MAHMOUD A, et al.Efficient removal of Cd (II) from contaminated water and soils using nanoparticles from nitrogen fertilizer industry waste[J].Journal of Environmental Health Science and Engineering, 2019, 17(2):1153-1161.
[3] LI W, CHEN Y Y, WANG T.Cadmium biosorption by lactic acid bacteria Weissella viridescens ZY-6[J].Food Control, 2021, 123:107747.
[4] CUI Z J, ZHANG X, YANG H H, et al.Bioremediation of heavy metal pollution utilizing composite microbial agent of Mucor circinelloides, Actinomucor sp and Mortierella sp.[J].Journal of Environmental Chemical Engineering, 2017, 5(4):3616-3621.
[5] 赵晓峰, 贺银凤, 李畅.1株耐铅乳酸菌的吸附铅特性研究[J].中国食品学报, 2021, 21(1):58-64.
ZHAO X F, HE Y F, LI C.Studies on adsorption characteristics of a lead-tolerant lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(1):58-64.
[6] ABDEL-MEGEED R M.Probiotics:A promising generation of heavy metal detoxification[J].Biological Trace Element Research, 2021, 199(6):2406-2413.
[7] ZHAI Q X, YIN R J, YU L L, et al.Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J].Food Control, 2015, 54:23-30.
[8] KIRILLOVA A V, DANILUSHKINA A A, IRISOV D S, et al.Assessment of resistance and bioremediation ability of Lactobacillus strains to lead and cadmium[J].International Journal of Microbiology, 2017:9869145.
[9] 陈宇凌, 陈银元, 刘安倩, 等.泡菜中高耐镉乳酸菌的选育及吸附特性[J].食品与发酵工业, 2019, 45(14):27-33.
CHEN Y L, CHEN Y Y, LIU A Q, et al.Screening and adsorption capability of cadmium tolerant lactic acid bacteria from pickles[J].Food and Fermentation Industries, 2019, 45(14):27-33.
[10] SHU G W, ZHENG Q Q, CHEN L, et al.Screening and identification of Lactobacillus with potential cadmium removal and its application in fruit and vegetable juices[J].Food Control, 2021, 126:108053.
[11] 安娅. 肉葡萄球菌的异源表达及表面展示应用的研究[D].天津:天津科技大学, 2021.
AN Y.Study on heterologous expression and surface display application of Staphylococcus carnosus[D].Tianjin:Tianjin University of Science and Technology, 2021.
[12] WANG J, WEI X Y, FAN M T.Assessment of antibiotic susceptibility within lactic acid bacteria and coagulase-negative staphylococci isolated from hunan smoked pork, a naturally fermented meat product in China[J].Journal of Food Science, 2018, 83(6):1707-1715.
[13] 雷蕾. 耐Cd2+细菌筛选及其耐Cd2+机理研究[D].西安:西安理工大学, 2021.
LEI L.Screening of Cd2+-resistant bacteria and research on the mechanism of Cd2+ tolerance[D].Xi′an:Xi′an University of Technology, 2021.
[14] 张利. 降铜、铅离子乳酸菌的筛选及机制初探[D].杨凌:西北农林科技大学, 2017.
ZHANG L.Screening of lactic acid bacteria lowering copper and lead and exploring of their mechanism[D].Yangling:Northwest A&F University, 2017.
[15] 刘淼. 乳酸菌吸附重金属镉(II)的能力及机制研究[D].杨凌:西北农林科技大学, 2017.
LIU M.Study on the mechanism of cadmium biosorption by lactic acid bacteria[D].Yangling:Northwest A&F University, 2017.
[16] WIERZBA S.Removal of Cu(Ⅱ) and Pb(Ⅱ) from aqueous solutions by lactic acid bacteria[C].Proceed ECOpole, 2015, 9:505-512.
[17] ALI J, AHMAD S, AHMAD I, et al.Biosorption potential of Bacillus anthracis PM21 for the sequestration of cadmium, chromium, and nickel from contaminated water[J].International Journal of Environmental Science and Technology, 2023, 20(6):6185-6196.
[18] KHAN Z, REHMAN A, HUSSAIN S Z, et al.Cadmium resistance and uptake by bacterium, Salmonella enterica 43C, isolated from industrial effluent[J].AMB Express, 2016, 6(1):54.
[19] TEEMU H, SEPPO S, JUSSI M, et al.Reversible surface binding of cadmium and lead by lactic acid and bifidobacteria[J].International Journal of Food Microbiology, 2008, 125(2):170-175.
[20] ABDOLALI A, NGO H H, GUO W S, et al.Characterization of a multi-metal binding biosorbent:Chemical modification and desorption studies[J].Bioresource Technology, 2015, 193:477-487.
[21] YIN R J, ZHAI Q X, YU L L, et al.The binding characters study of lead removal by Lactobacillus plantarum CCFM8661[J].European Food Research and Technology, 2016, 242(10):1621-1629.
[22] HUANG H J, JIA Q Y, JING W X, et al.Screening strains for microbial biosorption technology of cadmium[J].Chemosphere, 2020, 251:126428.
[23] SHENG Y, WANG Y, YANG X, et al.Cadmium tolerant characteristic of a newly isolated Lactococcus lactis subsp.lactis[J].Environmental Toxicology and Pharmacology, 2016, 48:183-190.
[24] 刘博, 解琳, 李春月, 等.出芽短梗霉菌JB16铅镉吸附特性的研究[J].微生物学报, 2023, 63(1):181-193.
LIU B, XIE L, LI C Y, et al.Adsorption properties of lead and cadmium by Aureobasidium pullulans JB16[J].Acta Microbiologica Sinica, 2023, 63(1):181-193.
[25] 商庆祥, 翟佳琳, 刘秀芳, 等.植物乳杆菌P9对镉和铅的吸附特性及机制研究[J].内蒙古农业大学学报(自然科学版), 2021, 42(6):51-56.
SHANG Q X, ZHAI J L, LIU X F, et al.Studies on adsorption characteristics and mechanism of Lactobacillus plantarum P9 to cadmiumand lead[J].Journal of Inner Mongolia Agricultural University (Natural Science Edition), 2021, 42(6):51-56.
[26] 邵鑫, 孙凯, 熊婧, 等.耐镉乳酸菌对重金属镉的吸附机制[J].食品与发酵工业, 2017, 43(3):48-53;60.
SHAO X, SUN K, XIONG J, et al.The cadmium removal mechanism of Lactobacillus strains[J].Food and Fermentation Industries, 2017, 43(3):48-53;60.