蓝莓富含花青素、多酚等生物活性成分,具有抗氧化、抗癌等健康益处[1-2],可增强免疫系统,并能够预防心血管疾病等。由于蓝莓鲜果不易贮存,经常被加工成果汁及蓝莓酒[3]。蓝莓酒生产中的酒精发酵通常是由酿酒酵母进行的,然而由于对具有特定特征的蓝莓酒的需求不断增加,对其他酵母菌和非酿酒酵母的研究越来越多[4]。蓝莓酒的颜色会受到酵母在发酵过程中产生的乙烯基酚类代谢物的影响,并可能与单体花青素反应,形成高度稳定的吡喃花青素,乙烯基酚吡喃花青素化合物也表现出极大的颜色稳定性[5-6]。
美极梅奇酵母(Metschnikowia pulcherrima)是一种具有优良酿造特性的非酿酒酵母,具有较强的产酯酶及产β-葡萄糖苷酶等的能力[7],有助于风味物质的释放,丰富果酒香气。已有研究表明,与酿酒酵母混合发酵时,还能降低发酵果酒中的乙醇含量[8],影响挥发酸的产生量[9],从而用于低度酒的发酵生产。同时美极梅奇酵母在酒精发酵前期,还表现出天然的抗菌作用,能够控制腐败微生物的生长,提高果酒品质。非酿酒酵母在酿酒过程中能起到积极的作用,并提升果酒花香和果香等感官特性,然而,大多非酿酒酵母无法单独完成酒精发酵,需要酿酒酵母的协同作用[10-11],因此,通过研究美极梅奇酵母与酿酒酵母协同发酵对蓝莓酒的影响,有助于提升蓝莓酒的风味品质。
本研究以蓝莓汁为原料,选用一株商业酿酒酵母K1与一株美极梅奇酵母进行了小型蓝莓酒发酵试验,分别在不同的发酵条件下,探究美极梅奇酵母的参与对蓝莓酒色泽、生物活性成分、抗氧化能力及挥发性成分等的影响。本研究对美极梅奇酵母的菌种选择提供新思路,为混菌发酵在蓝莓酒生产中的应用提供参考,有助于获得高品质蓝莓酒。
1 材料与方法
1.1 材料及试剂
蓝莓浓缩汁,贵州茅台(集团)生态农业产业发展有限公司;美极梅奇酵母,筛选于蓝莓果皮表面,现保藏于实验室菌种保藏库;酿酒酵母K1,法国拉曼集团;酵母粉,蛋白胨,无水葡萄糖,琼脂,无水乙醇,甲酸,甲醇(HPLC),国药集团化学试剂有限公司;YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
超高速冷冻离心机、Trace1310-ISQ L气相色谱-质谱联用仪,赛默飞世尔科技有限公司;SPX-250B-Z恒温培养箱,上海跃进医疗器械厂;UltraScan Pro 1166 高精度分光测色仪,美国Hunterlab公司;ΜV-1600 紫外可见光分光光度计,上海精密科学仪器有限公司;
1.3 实验方法
1.3.1 发酵实验
蓝莓浓缩汁以1∶4的体积比加水稀释,分装于三角瓶中,65 ℃灭菌15 min。将美极梅奇酵母Mp、酿酒酵母K1分别接种于YPD液体培养基中,30 ℃活化培养24 h,再重复活化1次,培养至指数期。将活化好的菌株6 000 r/min离心5 min后收集菌体,经0.9%的生理盐水洗涤2次后接入三角瓶中。美极梅奇酵母的接种量为107 CFU/mL,酿酒酵母的接种量为106 CFU/mL,接种方式分别为顺序接种与同时接种,顺序接种即先接种非酿酒酵母,48 h后再接种酿酒酵母。稀释后的蓝莓果汁为空白对照组(用CK表示)。以美极梅奇酵母和酿酒酵母单独发酵为对照 (其中Sq-Mix表示美极梅奇酵母与酿酒酵母顺序混合发酵,Mix表示美极梅奇酵母与酿酒酵母同时混合发酵,Sc、Mp分别表示酿酒酵母、美极梅奇酵母单独发酵),于20 ℃条件下静置发酵,通过每天测定CO2质量损失监测发酵进程,若连续2 d的质量变化<0.2 g,则认为发酵结束。发酵结束后将酒样10 000 r/min离心10 min,上清液用于后续分析,每个试验重复3次。总糖和酒精度根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定。
1.3.2 色差分析
使用高精度分光测色仪对蓝莓果汁及果酒的各颜色指标进行测定,设置透射模式,读数以色度值L*、a*值和b*值表示,L*代表亮度,越大代表样品越亮;a*值代表绿红颜色的饱和度,负值越小表示越绿,正值越大表示越红;b*值代表蓝黄颜色的饱和度,负值越小表示越蓝,正值越大表示越黄。根据公式(1)计算样品的总色差值ΔE,ΔE数值越大,说明色差越大。
(1)
1.3.3 总花青素及总酚的测定
总花青素的测定参考王行等[12],采用pH示差法。总酚的测定使用福林酚显色法[13]。在96孔板中依次吸取50 μL稀释到适当浓度的待测液,100 μL Folin-Ciocalteu试剂(稀释10倍),随后在30 s至8 min内加入100 μL 87.56 g/L Na2CO3溶液,混合均匀后放置1 h,于750 nm下测定吸光值。以1 mL蓝莓酒样中所含没食子酸毫克数来表示所含总酚的量。标准曲线如图1所示。
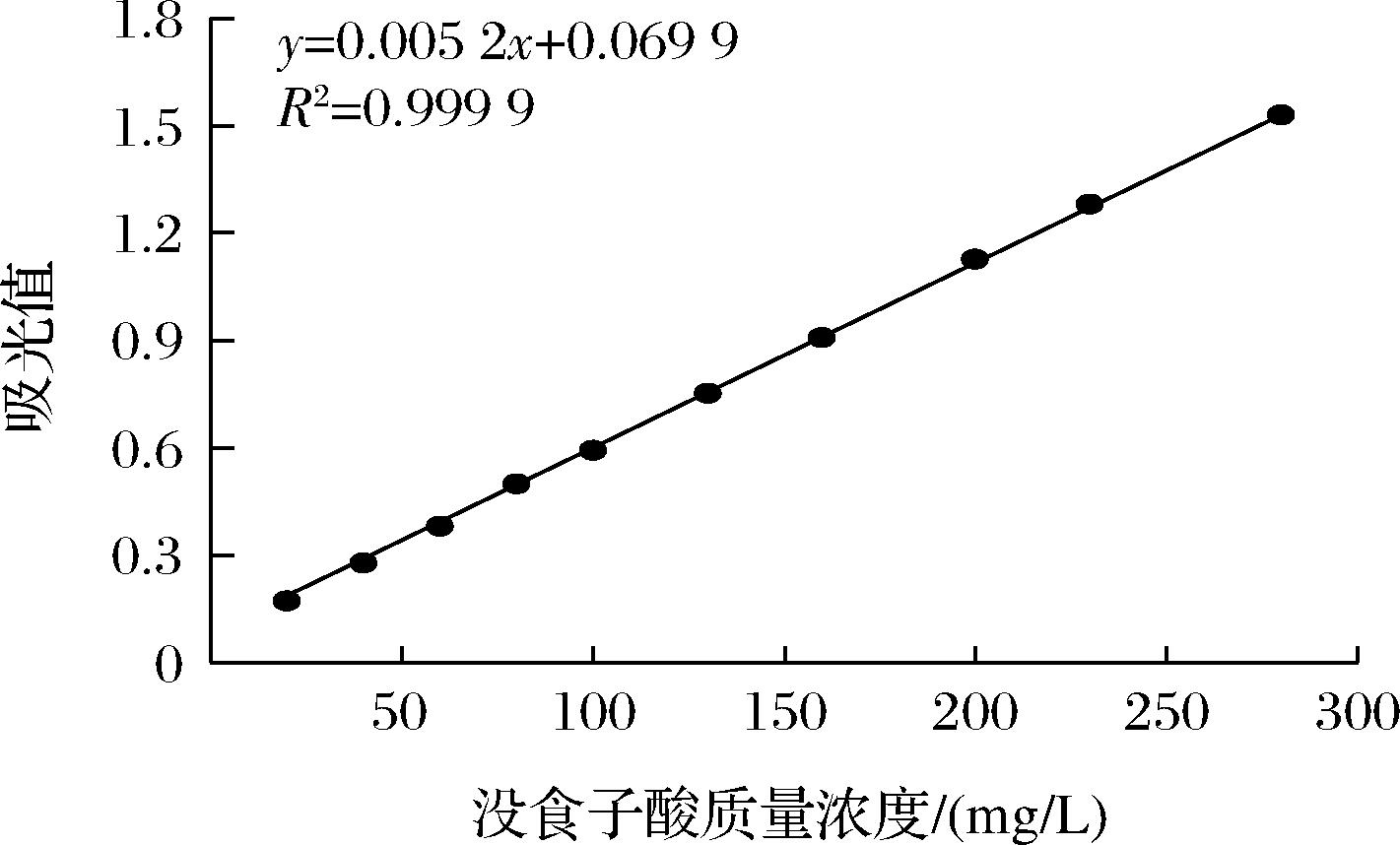
图1 没食子酸标准曲线
Fig.1 Standard curve of gallic acid
1.3.4 体外抗氧化能力测定
1.3.4.1 ABTS阳离子自由基清除率的测定
将88.0 μL K2S2O8(140 mmol/L)溶液和5.0 mL ABTS溶液(7 mmol/L)混合后反应24 h,生成ABTS阳离子自由基,并用无水乙醇稀释至其在734 nm处的吸光值为0.70±0.02。取0.5 mL样品于离心管中,加入4.5 mL ABTS阳离子自由基稀释液,摇匀后在30 ℃下水浴反应6 min,避光,在734 nm处测定吸光度。蓝莓果酒样品的测定值为A1。将无水乙醇代替样品测定值为A0。
根据公式(2)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(2)
1.3.4.2 DPPH自由基清除率的测定
取2 mL待测的蓝莓酒样品,加入2 mL 0.2 mmol/L的DPPH溶液,摇匀后静置20 min。使用无水乙醇调零后,在517 nm处测定吸光度。样品组A1,对照组A2为样品与无水乙醇1∶1(体积比)混合液的吸光度,空白组A0为DPPH溶液与无水乙醇混合液的吸光度。
根据公式(3)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
1.3.4.3 羟自由基清除能力的测定
参照王燕新等[14]的方法,按顺序分别加入2 mL的硫酸亚铁(6 mmol/L)、水杨酸(6 mmol/L)、蓝莓酒待测样品及,再加入过氧化氢溶液(6 mmol/L),在37 ℃下水浴反应1 h,在510 nm处测定其吸光度为A1, 用纯水代替样品且不加过氧化氢溶液,测得底物的吸光度为A2;测定纯水的吸光值为空白对照A0。
根据公式(4)计算羟自由基清除率:
羟自由基清除率![]()
(4)
1.3.5 挥发性成分的测定
参照严红光等[15]的方法,采用顶空固相微萃取-气相色谱-质谱联用技术对蓝莓酒香气成分进行检测。样品处理:分别取蓝莓果汁及发酵后的样品8 mL 置于15 mL顶空瓶中,加入5 μL的2-辛醇内标溶液,使终质量浓度为100 mg/L。挥发性化合物的半定量以各组分相对于内标物2-辛醇的含量计算。GC条件:毛细管柱为DB-WAX UI (30 m×0.25 mm,0.25 μm),载气为氦气,流速为1.2 mL/min。温度由50 ℃在2 min后以3 ℃/min升至145 ℃,在230 ℃保持10 min。MS条件:EI源,离子源温度为260 ℃,MS传输线温度为230 ℃,扫描质量范围为33 m/z至450 m/z。电压70 eV。
1.4 数据处理
在本实验中,所有指标测定均重复3次。柱状图、折线图及聚类热图使用Origin 2021分析绘制。
2 结果与分析
2.1 发酵能力研究
由图2可知,美极梅奇酵母单独发酵组(Mp)发酵速度较慢,且在第10天停止发酵,耗糖量仅49.30 g,释放了5.20 g CO2,说明其发酵能力较弱,不能单独完成酒精发酵。酿酒酵母单独发酵组(Sc)的起酵速度最快,在第9天完成发酵,共释放16.54 g CO2。与Mix组相比,Sq-Mix组的发酵速度减慢,延长了2 d的发酵时间,并减少了2.1 g的CO2释放量,同时降低了0.3%(体积分数)的乙醇含量。已有研究表明[16-17],顺序发酵试验显示出较低的发酵动力学,这是由于美极梅奇酵母具有较低的糖醇转化率导致的,Sq-Mix组中美极梅奇酵母的存在使CO2释放速度较Mix慢少并消耗了部分糖,而酿酒酵母的延迟接种会促进乙醇的进一步减少。发酵结束后,与Sc组相比,Mp组、Mix组及Sq-Mix组的乙醇含量分别降低了5.17%、0.5%、0.8%(均为体积分数),该结果表明,在混合接种方式下能够降低蓝莓酒中的乙醇含量,证实了美极梅奇酵母在降低乙醇含量方面的作用。

a-发酵动力学曲线;b-总糖含量的变化;c-酒精含量
图2 不同发酵组的发酵能力表征
Fig.2 Characterization of fermentation capacity of different fermentation groups
2.2 颜色参数分析
不同发酵组的蓝莓酒颜色的结果如表1所示。Mp组、Sq-Mix组和Mix的色差值与Sc组相比,分别增加了51.09%、18.78%和10.48%,表明添加美极梅奇酵母发酵能够对蓝莓酒的颜色产生积极作用。其中,Mp组的L*值和a*值相比于Sc组分别增加了0.32和2.07,且数值最大,表示Mp组在4个酒样中最亮、颜色最红。一方面,在酿酒过程中,美极梅奇酵母的代谢产物(乙烯基苯酚、丙酮酸、羟基肉桂酸和乙醛)能与花青素相互结合成稳定的色素,从而抵抗色素物质的降解,阻止果酒褐变[18-19]。另一方面,非酿酒酵母在发酵期间能产生较高的乳酸,导致酒样pH值降低[20],增加果酒的红色色调[21]。有研究发现,与酿酒酵母相比,非酿酒酵母参与的混合发酵通常可使果酒的颜色强度增加[22],这与本试验结果一致。
表1 不同发酵方式蓝莓酒色度
Table 1 Chroma of blueberry wine with different fermentation systems

编号L∗a∗b∗ΔECK0.02±0.0050.16±0.0120.04±0.0090.17±0.016Mp0.37±0.0243.09±0.141-1.51±0.0423.46±0.149Sq-Mix0.20±0.0121.89±0.105-1.95±0.0642.72±0.124Mix0.15±0.0111.68±0.012-1.89±0.0852.53±0.085Sc0.05±0.0011.02±0.011-2.05±0.0942.29±0.095
2.3 生物活性成分分析
果酒的颜色取决于其含有的花青素及其衍生产物含量和它们在果酒中的稳定性,4种不同的发酵方式在总酚和总花青素成分间的差异如图3所示。Sc组的总花青素含量及总酚含量分别为(297.80±8.92) mg/L和(4 552.34±30.13) mg/L。而使用美极梅奇酵母单独发酵的Mp组较Sc组的总花青素含量降低了21.64%,总酚含量升高了2.21%。Mp组中总花青素的含量显著低于Sc组,仅为(233.34±7.57) mg/L,总花青素的损失可能是由于该株美极梅奇酵母的细胞壁能够吸附蓝莓中的单体花青素,并随着发酵结束后的离心过程而沉降,从而降低了蓝莓酒中的总花青素。而在发酵过程中,非酿酒酵母较酿酒酵母能产生更多的β-葡萄糖苷酶,该酶能促进酚类化合物的释放[19,23],提高总酚含量。

图3 不同发酵方式蓝莓酒的生物活性成分
Fig.3 Phytochemical composition in blueberry wine with different fermentation methods
2.4 抗氧化能力分析
由图4可知,蓝莓果汁及蓝莓酒都表现出较强的抗氧化能力,有研究表明,花青素、总酚等含量与自由基的清除能力有关[24]。由图4-a中可以看出,Sc组对ABTS阳离子自由基的清除能力最高,较蓝莓果汁提高了10.64%,而相比于Mp组无显著差异。同时,混合发酵组Sp-Mix组及Mix组对ABTS阳离子自由基的清除能力相比于单独发酵组,降低了约4.80%。
DPPH被广泛应用于测定自由基的清除能力。如图4-b所示,Sp-Mix组对DPPH的自由基清除率最低,为50.27%,与Mix组相比,降低了14.22%,表明同时接种混合发酵对蓝莓酒的DPPH自由基清除能力影响较大。而Sc组对DPPH自由基的清除能力最高,为60.72%。从对羟自由基清除能力来说,如图4-c所示,Mix组最好,为56.72%,但与Sq-Mix组合Sc组无显著差异。
综上所述,利用该株美极梅奇酵母单独发酵蓝莓酒时,在ABTS阳离子自由基、DPPH自由基及羟自由基清除能力方面均不如酿酒酵母K1单独发酵,而利用混合发酵方式能够提高DPPH及羟自由基清除能力。
2.5 香气成分分析
挥发性香气成分与蓝莓酒的品质密切相关。通过不同发酵方式发酵后的蓝莓酒香气成分如表2所示。共检测出45种香气物质,分别为22种酯类物质、19种除乙醇外的醇类物质、2种酸类物质、1种醛类物质和1种酮类物质。酯类物质能够为蓝莓酒贡献果香香气。经美极梅奇酵母单独发酵的Mp组中,总酯的相对含量最高,达362.95 mg/L,与Sc组相比,提高了134.63%,并能够显著提高异戊酸乙酯、乙酸乙酯和乙酸异戊酯的含量,分别为蓝莓酒增添水果香和香蕉香味等。同时,Mix组相比于Sc组,产生了较高含量十六烷酸乙酯,达28.50 mg/L,能够为蓝莓酒带来果香及奶油香气,丰富蓝莓酒的香气成分。Mix组与Sc组中的苯乙醇含量较高,分别为51.81 mg/L和53.02 mg/L,分别占其总醇含量的16.54%和24.09%,可为蓝莓酒增添蜂蜜、玫瑰等香气。因此,美极梅奇酵母的参与能够显著改变蓝莓酒的香气成分组成,增加蓝莓酒香气的丰富性及愉悦性。

a-ABTS阳离子自由基清除率;b-DPPH自由基清除率;c-羟自由基清除率
图4 不同发酵方式蓝莓酒的抗氧化能力
Fig.4 Antioxidant capacity in blueberry wine with different fermentation methods
如图5所示,为研究不同发酵方式下蓝莓酒中主要香气成分间的差异,利用Origin软件对5个样品中的香气成分进行热图聚类分析。由美极梅奇酵母单独发酵后主要产生了异戊醇、异戊酸乙酯、乙酸乙酯等物质,这些香气成分主要表现为花香与果香,使蓝莓酒香气更加丰富。而利用商业酿酒酵母单独发酵及混合发酵能够显著增加苯乙醇的含量,能够为蓝莓酒带来丁香花、蜂蜜及玫瑰香气。在同时接种发酵方式下,辛酸乙酯的含量相比于其他组最高,为蓝莓酒增添浓郁的果香。综上,美极梅奇酵母的参与能够改变蓝莓酒的香气成分组成,且在混合发酵时也能够增加更多的果香香气。
表2 不同发酵组蓝莓酒香气成分
Table 2 Aroma components of blueberry wine from different fermentation groups
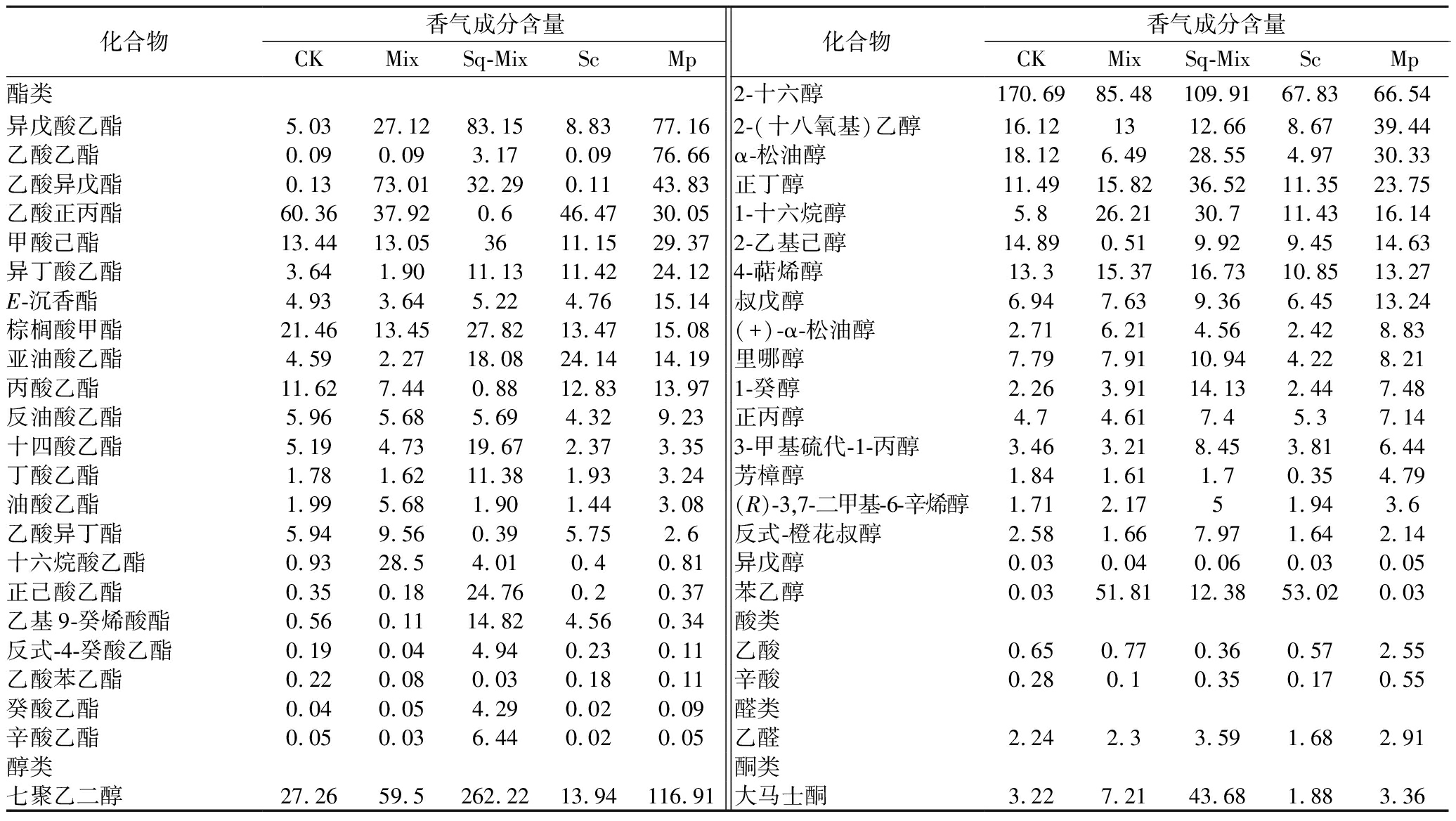
化合物香气成分含量CKMix Sq-MixScMp化合物香气成分含量CKMix Sq-MixScMp酯类2-十六醇170.6985.48109.9167.8366.54异戊酸乙酯5.0327.1283.158.8377.162-(十八氧基)乙醇16.121312.668.6739.44乙酸乙酯0.090.093.170.0976.66α-松油醇18.126.4928.554.9730.33乙酸异戊酯0.1373.0132.290.1143.83正丁醇11.4915.8236.5211.3523.75乙酸正丙酯60.3637.920.646.4730.051-十六烷醇5.826.2130.711.4316.14甲酸己酯13.4413.053611.1529.372-乙基己醇14.890.519.929.4514.63异丁酸乙酯3.641.9011.1311.4224.124-萜烯醇13.315.3716.7310.8513.27E-沉香酯4.933.645.224.7615.14叔戊醇6.947.639.366.4513.24棕榈酸甲酯21.4613.4527.8213.4715.08(+)-α-松油醇2.716.214.562.428.83亚油酸乙酯4.592.2718.0824.1414.19里哪醇7.797.9110.944.228.21丙酸乙酯11.627.440.8812.8313.971-癸醇2.263.9114.132.447.48反油酸乙酯5.965.685.694.329.23正丙醇4.74.617.45.37.14十四酸乙酯5.194.7319.672.373.353-甲基硫代-1-丙醇3.463.218.453.816.44丁酸乙酯1.781.6211.381.933.24芳樟醇1.841.611.70.354.79油酸乙酯1.995.681.901.443.08(R)-3,7-二甲基-6-辛烯醇1.712.1751.943.6乙酸异丁酯5.949.560.395.752.6反式-橙花叔醇2.581.667.971.642.14十六烷酸乙酯0.9328.54.010.40.81异戊醇0.030.040.060.030.05正己酸乙酯0.350.1824.760.20.37苯乙醇0.0351.8112.3853.020.03乙基9-癸烯酸酯0.560.1114.824.560.34酸类反式-4-癸酸乙酯0.190.044.940.230.11乙酸0.650.770.360.572.55乙酸苯乙酯0.220.080.030.180.11辛酸0.280.10.350.170.55癸酸乙酯0.040.054.290.020.09醛类辛酸乙酯0.050.036.440.020.05乙醛2.242.33.591.682.91醇类酮类七聚乙二醇27.2659.5262.2213.94116.91大马士酮3.227.2143.681.883.36
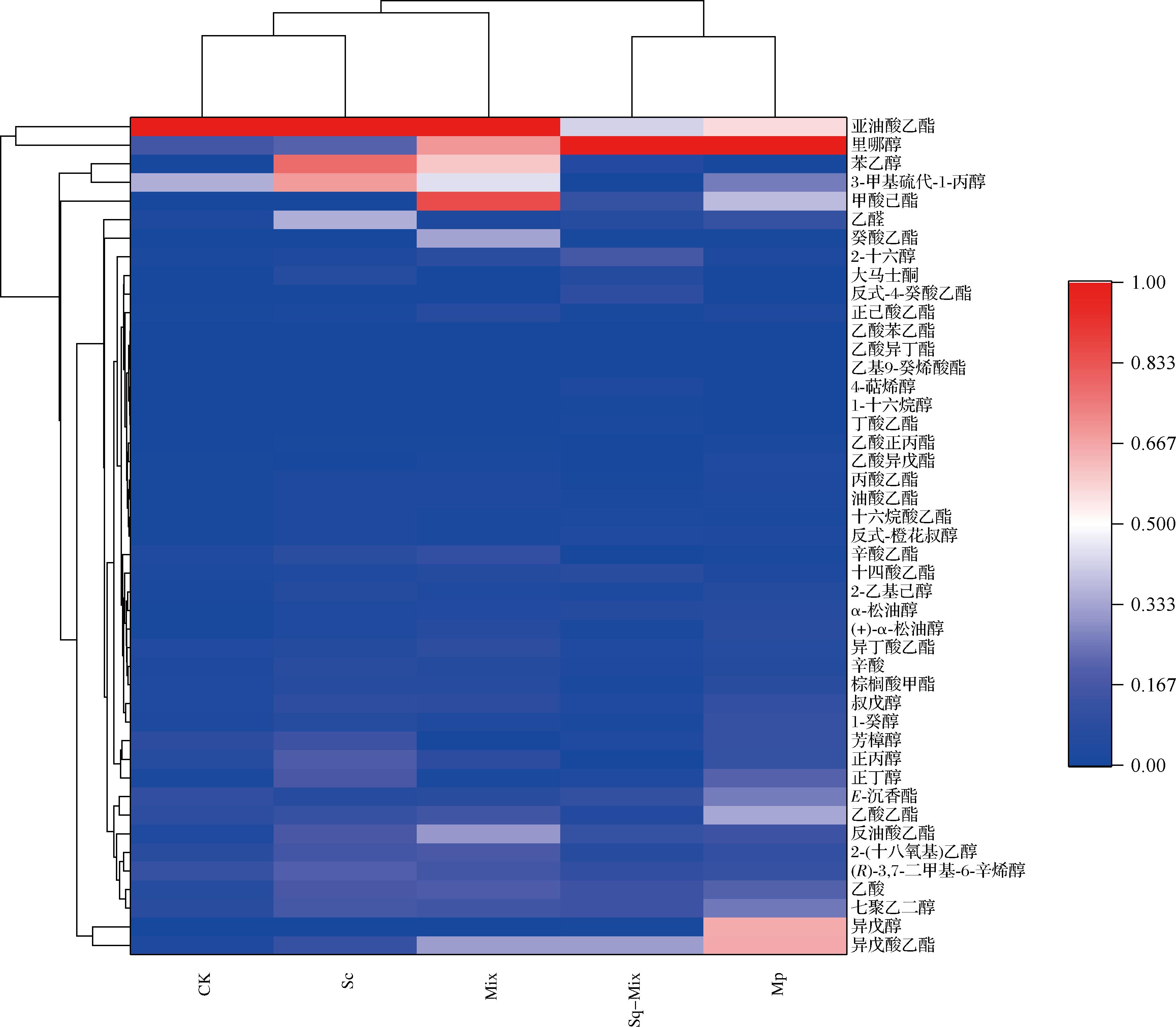
图5 不同发酵组蓝莓酒香气成分聚类分析热图
Fig.5 Clustering analysis heat map of aroma components of blueberry wine in different fermentation group
3 结论
本实验通过比较美极梅奇酵母及商业酿酒酵母以不同接种方式发酵对蓝莓酒的颜色参数、香气成分、抗氧化活性等的影响,发现美极梅奇酵母单独发酵、顺序接种混合发酵及同时接种混合发酵与酿酒酵母单独发酵相比,使蓝莓酒中的乙醇含量分别降低了5.17%、0.8%、0.5%(均为体积分数)。美极梅奇酵母的参与增强了蓝莓酒的颜色强度,并增加了2.21%的总酚含量,同时,提高了134.63%的总酯含量,其中显著提高了异戊酸乙酯、乙酸乙酯和乙酸异戊酯的含量,使蓝莓酒的果香及花香香气更加浓郁。综上,美极梅奇酵母在改善蓝莓酒品质方面具有较好的应用潜力,为生产优质蓝莓酒提供新思路。
[1] WANG C, ZHANG X L, GAO Y, et al.Path analysis of non-enzymatic browning in Dongbei Suancai during storage caused by different fermentation conditions[J].Food Chemistry, 2021, 335:127620.
[2] CORREA-BETANZO J, PADMANABHAN P, CORREDIG M, et al.Complex formation of blueberry (Vaccinium angustifolium) anthocyanins during freeze-drying and its influence on their biological activity[J].Journal of Agricultural and Food Chemistry, 2015, 63(11):2935-2946.
[3] ZHANG L L, WANG W B, YUE X Y, et al.Gallic acid as a copigment enhance anthocyanin stabilities and color characteristics in blueberry juice[J].Journal of Food Science and Technology, 2020, 57(4):1405-1414.
[4] MASNEUF-POMAREDE I, BELY M, MARULLO P, et al.The genetics of non-conventional wine yeasts:Current knowledge and future challenges[J].Frontiers in Microbiology, 2016, 6:1563.
[5] BENITO S, MORATA A, PALOMERO F, et al.Formation of vinylphenolic pyranoanthocyanins by Saccharomyces cerevisiae and Pichia guillermondii in red wines produced following different fermentation strategies[J].Food Chemistry, 2011, 124(1):15-23.
[6] MORATA A, GONZ LEZ C, SU
LEZ C, SU REZ-LEPE J A.Formation of vinylphenolic pyranoanthocyanins by selected yeasts fermenting red grape musts supplemented with hydroxycinnamic acids[J].International Journal of Food Microbiology, 2007, 116(1):144-152.
REZ-LEPE J A.Formation of vinylphenolic pyranoanthocyanins by selected yeasts fermenting red grape musts supplemented with hydroxycinnamic acids[J].International Journal of Food Microbiology, 2007, 116(1):144-152.
[7] PADILLA B, GIL J V, MANZANARES P.Past and future of non-Saccharomyces yeasts:From spoilage microorganisms to biotechnological tools for improving wine aroma complexity[J].Frontiers in Microbiology, 2016, 7:411.
[8] CONTRERAS A, CURTIN C, VARELA C.Yeast population dynamics reveal a potential ‘collaboration’ between Metschnikowia pulcherrima and Saccharomyces uvarum for the production of reduced alcohol wines during Shiraz fermentation[J].Applied Microbiology and Biotechnology, 2015, 99(4):1885-1895.
[9] RUIZ J, BELDA I, BEISERT B, et al.Analytical impact of Metschnikowia pulcherrima in the volatile profile of Verdejo white wines[J].Applied Microbiology and Biotechnology, 2018, 102(19):8501-8509.
[10] DUTRAIVE O, BENITO S, FRITSCH S, et al.Effect of sequential inoculation with non-Saccharomyces and Saccharomyces yeasts on riesling wine chemical composition[J].Fermentation-Basel, 2019, 5(3):79
[11] ANDORR I, BERRADRE M, ROZ
I, BERRADRE M, ROZ S N, et al.Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J].European Food Research and Technology, 2010, 231(2):215-224.
S N, et al.Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J].European Food Research and Technology, 2010, 231(2):215-224.
[12] 王行, 马永昆, 于立志, 等.贮藏条件对超高压处理蓝莓汁酚类物质及抗氧化活性的影响[J].现代食品科技, 2014, 30(1):101-107.
WANG X, MA Y K, YU L Z, et al.Effects of storage condition on phenolics and antioxidant activity of high hydrostatic pressure treated blueberry juice[J].Modern Food Science and Technology, 2014, 30(1):101-107.
[13] S NCHEZ-PAT
NCHEZ-PAT N F, BARROSO E, VAN DE WIELE T, et al.Comparative in vitro fermentations of cranberry and grape seed polyphenols with colonic microbiota[J].Food Chemistry, 2015, 183:273-282.
N F, BARROSO E, VAN DE WIELE T, et al.Comparative in vitro fermentations of cranberry and grape seed polyphenols with colonic microbiota[J].Food Chemistry, 2015, 183:273-282.
[14] 王燕新, 廖圆圆, 郭晓农, 等.枇杷叶多糖提取及其体外抗氧化研究[J].西北民族大学学报(自然科学版), 2019, 40(4):73-77.
WANG Y X, LIAO Y Y, GUO X N, et al.Studies on the extraction of loquat leaves polsaccharides and their loquat leaves polsaccharides in vitro[J].Journal of Northwest Minzu University(Natural Science), 2019, 40(4):73-77.
[15] 严红光, 罗配琴, 林莉, 等.三种蓝莓酿造果酒风味物质成分GC-MS和GC-IMS分析[J].食品与发酵工业, 2023,49(17):283-290.
YAN H G, LUO P Q, LIN L, et al.Volatile component analysis of three varieties of fermented blueberry wine using GC-MS and GC-IMS[J].Food and Fermentation Industries, 2023,49(17):283-290.
[16] CANONICO L, COMITINI F, ORO L, et al.Sequential fermentation with selected immobilized Non-Saccharomyces yeast for reduction of ethanol content in wine[J].Frontiers in Microbiology, 2016, 7:278.
[17] ESCRIBANO R, GONZ LEZ-ARENZANA L, PORTU J, et al.Wine aromatic compound production and fermentative behaviour within different non-Saccharomyces species and clones[J].Journal of Applied Microbiology, 2018, 124(6):1521-1531.
LEZ-ARENZANA L, PORTU J, et al.Wine aromatic compound production and fermentative behaviour within different non-Saccharomyces species and clones[J].Journal of Applied Microbiology, 2018, 124(6):1521-1531.
[18] ![]() J T, BUTINAR L, ALBREHT A, et al.The impact of Saccharomyces and non-Saccharomyces yeasts on wine colour:A laboratory study of vinylphenolic pyranoanthocyanin formation and anthocyanin cell wall adsorption[J].LWT, 2020, 123:109072.
J T, BUTINAR L, ALBREHT A, et al.The impact of Saccharomyces and non-Saccharomyces yeasts on wine colour:A laboratory study of vinylphenolic pyranoanthocyanin formation and anthocyanin cell wall adsorption[J].LWT, 2020, 123:109072.
[19] ZHANG P Z, MA W, MENG Y Q, et al.Wine phenolic profile altered by yeast:Mechanisms and influences[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4):3579-3619.
[20] 梁丽红, 高娉娉, 张馨文, 等.优选本土非酿酒酵母混合发酵在干红葡萄酒中的应用潜力分析[J].食品与发酵工业, 2022, 48(14):118-124;130.
LIANG L H, GAO P P, ZHANG X W, et al.Potential application of mixed fermentation of superior indigenous non-Saccharomyces cerevisiae on dry red wine[J].Food and Fermentation Industries, 2022, 48(14):118-124;130.
[21] BENITO  , CALDER
, CALDER N F, PALOMERO F, et al.Quality and composition of airen wines fermented by sequential inoculation of Lachancea thermotolerans and Saccharomyces cerevisiae[J].Food Technology and Biotechnology, 2016, 54(2):135-144.
N F, PALOMERO F, et al.Quality and composition of airen wines fermented by sequential inoculation of Lachancea thermotolerans and Saccharomyces cerevisiae[J].Food Technology and Biotechnology, 2016, 54(2):135-144.
[22] BENITO  , CALDER
, CALDER N F, PALOMERO F, et al.Combine use of Selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules, 2015, 20(6):9510-9523.
N F, PALOMERO F, et al.Combine use of Selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules, 2015, 20(6):9510-9523.
[23] BARBAGALLO R N, PALMERI R, FABIANO S, et al.Characteristic of β-glucosidase from sicilian blood oranges in relation to anthocyanin degradation[J].Enzyme and Microbial Technology, 2007, 41(5):570-575.
[24] 连悦汝, 甘慧, 孟志云, 等.新型蓝莓花色苷含量测定及抗氧化性能研究[J].食品研究与开发, 2022, 43(7):30-36.
LIAN Y R, GAN H, MENG Z Y, et al.Analysis of anthocyanin components and antioxidant properties of a new species of blueberry[J].Food Research and Development, 2022, 43(7):30-36.