中国是世界上最大的蚕丝生产国,每年有大量的桑蚕蛾产出,其中,每生产100 kg桑蚕茧可得到50~60 kg鲜蚕蛾。蚕蛾是蚕一生中的最后性成熟阶段,此时不再取食、生长,而专事交配、产卵,体内不仅含有雄性激素、蜕皮激素、雌二醇等多种激素类物质,而且积累了大量的营养物质以供繁殖后代[1-2]。蛾体物质作为中医药资源自古就有记载。有研究表明,雄蚕蛾的激素类功能物质,有调节人体内分泌、增强人体免疫力、活血通脉、补肾壮阳、抗氧化、增强记忆力以及改善精子质量与活力等功效;雌蚕蛾的则有调节女性内分泌、促进乳腺和卵巢的再次发育、抗衰老、预防骨质疏松的功能[3-6]。此外,蚕蛾也是营养丰富的食材,我国东北地区素有食用柞蚕蛾的习惯,蚕蛾经过烹调,成了营养丰富的美味佳肴[7]。在蚕蛾营养成分的研究报道中,关于柞蚕蛾的多,关于桑蚕蛾的少[8-9]。在桑蚕蛾研究中,雄蚕蛾的研究报道略多于雌蚕蛾,且主要集中在激素种类、含量、提取方法和功效作用方面[10-11]。雌雄之间、不同时期的蚕蛾营养成分存在差异,本文以广东省主要生产用种9芙蚕蛾为研究对象,检测了雌雄蛾交配产卵前后的基本营养成分、氨基酸和脂肪酸的组成及含量,并且对性别间和不同发育阶段的蚕蛾营养价值进行了系统的科学评价,旨在为推动桑蚕蛾作为新的食品资源的开发利用提供依据,拓展其在产业发展中的新用途。
1 材料与方法
1.1 材料与试剂
交配前后的9芙雌雄蚕蛾,广东省清远市阳山县兴达蚕业有限公司。
氨基酸混标(色谱纯),和光纯药工业株式会社;叔丁基甲醚、正己烷,色谱纯,美国 Merk 公司;氯仿、无水甲醇、无水乙醇、浓盐酸、磷酸、石油醚、碳酸钠、柠檬酸钠、氢氧化钠、盐酸、硫酸铜、硫酸钾、硫酸、硼酸、甲基红指示剂、溴甲酚绿指示剂、盐酸标准滴定溶液等均为市售分析纯试剂。
1.2 仪器与设备
K9840凯氏定氮仪,济南海能仪器股份有限公司;Trace1310 ISQ气相色谱仪质谱仪,美国Thermo;LA8080氨基酸自动分析仪,日本株式会社日立高新技术科学;电热鼓风干燥箱,上海一恒科学仪器有限公司;电子分析天平,上海赛多利斯天平有限公司。
1.3 实验方法
1.3.1 取样和前处理
交配前的蚕蛾取样:蚕蛾羽化后经过2 h取样,雌雄蛾随机各取60只。
交配后的蚕蛾取样:雌雄蛾连续交配5 h后,拆开,取雄蛾60只;雌蛾则让其在黑暗环境中产卵,经过7 h后待腹中卵产出完毕,取雌蛾60只。交配前后雌雄蚕蛾每个样本各取3份。
1.3.2 基本营养成分测定方法
参照文献[12],采用索氏抽提法检测粗脂肪含量,凯氏定氮法测定粗蛋白含量。用烘干恒重法测定蚕蛾含水率,设定干燥温度为80 ℃。
1.3.3 脂肪酸检测
取蚕蛾干粉0.5 g作水解、皂化和脂肪酸甲酯化处理,取上清液100 μL用正己烷定容至1 mL,过0.45 μm滤膜,用气相色谱仪质谱仪按照GB/T 5009.6—2016规定的方法上机检测。
1.3.4 脂肪酸指数计算
参考相关文献[13]计算动脉粥样硬化指数(index of atherogenicity,IA)和血栓形成指数(index of thrombogenicity,IT),计算如公式(1)~公式(2)所示:
(1)
IT=

(2)
式中:C12∶0,月桂酸含量,g/100 g;C14∶0,肉豆蔻酸含量,g/100 g;C16∶0,棕榈酸含量,g/100 g;∑MUFA,总单不饱和脂肪酸(monounsaturatedfatty acid,MUFA)含量,g/100 g;∑PUFA(polyunsaturated fatty acid,PUFA),总多不饱和脂肪酸含量,g/100 g;∑n-6 PUFA,总n-6型多不饱和脂肪酸含量,g/100 g;∑n-3 PUFA,总n-3型多不饱和脂肪酸含量,g/100 g。
1.3.5 氨基酸含量测定
参照GB 5009.124—2016《食品中氨基酸的测定方法》,采用氨基酸全自动分析仪测定蚕蛾的氨基酸含量。
1.3.6 氨基酸营养评价方法
根据联合国粮农组织/世界卫生组织(Food and Agriculture Organization of the United Nations/World Health Organization,FAO/WHO)建议的每克氮氨基酸评分标准模式[14]和鸡蛋蛋白质评分标准模式[15],分别计算各种必需氨基酸的氨基酸评分(amino acidscore,AAS)、化学评分(chemical score,CS)、必需氨基酸指数(essential amino acid index,EAAI)、营养指数(nutrient index,NI)和生物价(biological value,BV)[16]。计算如公式(3)~公式(7)所示:
(3)
(4)
(5)
(6)
BV=1.09×EAAI-11.7
(7)
式中:A,待测样品氨基酸含量;A0,FAO/WHO 评分标准模式同种氨基酸含量;Ae,鸡蛋蛋白质中同种氨基酸含量;s,标准模式中氨基酸含量;Mp,待测样品中蛋白质含量。
1.4 数据分析
试验数据采用SPSS 17.0软件进行统计分析,测定数据以“平均值±标准偏差”表示,P<0.05为差异显著。
2 结果与分析
2.1 交配前后雌雄蚕蛾基本营养成分含量分析
测定交配前后雌雄蛾的水分、粗蛋白和粗脂肪含量,结果见表1。蚕蛾含水率为54.23%~72.27%,交配后雄蛾含水率最低,而交配后雌蛾含水率最高,4种不同类型蚕蛾含水率差异显著(P<0.05)。粗蛋白的含量为16.90%~21.60%。交配前雌蛾的粗蛋白含量显著高于其他蚕蛾(P<0.05),以干物质计为62.07%,比猪肉(24.7%)、鸡蛋(54.7%)、牛肉(40.5%)的含量都高[17]。在粗脂肪含量方面,雄蛾的含量约为雌蛾的3倍;交配前雌蛾的粗脂肪含量最低,以干物质计为20.44%,与大豆(21.8%)相近,低于猪肉(69.9%)、牛肉(56.3%)、鸡肉(44.3%)和鸡蛋(39.9%)的含量;而交配后雄蛾的粗脂肪含量最高,以干物质计为57.77%,仅低于猪肉的含量[17]。从基本营养成分含量看,交配前雌蚕蛾是典型的低脂肪、高蛋白质的优质食品原料;从蚕蛾脂肪开发利用思考,交配后的雄蛾最适合用于油脂的提取和加工。
表1 蚕蛾基本营养成分含量
Table 1 The contents of basic nutrients in silkworm moth

指标交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾含水率/%65.20±1.87b57.97±2.7c72.27±0.75a54.23±0.51d粗蛋白/%21.60±0.60a16.90±0.26b17.43±0.40b17.30±0.77b粗脂肪/%7.11±0.47c21.10±1.10b6.17±0.21c26.46±1.15a
注:交配后雌蛾是指交配产卵后的雌蛾(下同);粗蛋白和粗脂肪含量指的是鲜蚕蛾中的含量;同行数据肩标不同小写字母表示差异显著(P<0.05)(下同)。
2.2 脂肪酸组成、含量和营养价值评价
在4种类型蚕蛾中均鉴定到11种脂肪酸(表2)。包括饱和脂肪酸(saturated fatty acid,SFA)7种、MUFA 2种和PUFA 2种。蚕蛾脂肪酸含量由高到低依次为交配后雄蛾(59.93 g/100 g)、交配前雄蛾(54.88 g/100 g)、交配前雌蛾(22.20 g/100 g)、交配后雌蛾(18.26 g/100 g),雄蛾的脂肪酸含量是雌蛾的2倍以上。4种类型蚕蛾的不饱和脂肪酸含量均很丰富,占总脂肪酸(total fatty acid,∑FA)含量的73.62%以上,含量最高的为交配前雌蛾,高达78.18%,显著高于其他3种蚕蛾(P<0.05)。PUFA占∑FA的37.14%以上,含量最高也是交配前雌蛾,亦显著高于其他3种蚕蛾(P<0.05)。由此可见,交配前雌蛾脂肪酸含量虽然不高,但油脂的品质高。
蚕蛾MUFA中含C16∶1n-7和C18∶1n-9(油酸)2种,占∑FA的29.00%~35.64%,其中油酸占∑MUFA 的96%以上。研究表明,油酸可降低胆固醇水平,预防高血脂,抑制过敏反应,有益人体健康[18]。4种类型蚕蛾油酸含量,交配后雄蛾(21.15 g/100 g)>交配前雄蛾(18.68 g/100 g)>交配后雌蛾(6.51 g/100 g)≈交配前雌蛾(6.44 g/100 g);雄蛾的油酸是雌蛾的2.9 倍以上,而且交配后雄蛾油酸含量显著高于交配前雄蛾(P<0.05)。
蚕蛾PUFA有2种,分别是C18∶2n-6(亚油酸,linoleic acid,LA)和C18∶3n-3(亚麻酸,linolenic acid,ALA),两者合计约占∑FA的37.14%~48.64%。雄蛾ALA和LA含量均为雌蛾的2倍以上。其中ALA含量占∑PUFA的87%左右,占∑FA的33.87%~42.25%,是蚕蛾脂肪酸中含量最高的一种。ALA是人体必需脂肪酸,是磷脂和神经元细胞的重要组成成分,是合成前列腺素的前体物质;具有天然的抗氧化作用,可软化心脑血管,增加血管弹性,预防动脉硬化,降低心血管疾病[19]。蚕蛾ALA含量高低的顺序依次为交配后雄蛾(19.37 g/100 g)、交配前雄蛾(18.77 g/100 g)、交配前雌蛾(9.38 g/100 g)、交配后雌蛾(6.18 g/100 g)。根据文献报道,山桐子油、芝麻油中的不饱和脂肪酸含量最高的是C18∶2(LA)[20-21];沙棘果油、花生油和菜籽油中含量最高的是C18∶1[21-22];鱼(红鳟和大西洋鲑)和禽蛋脂质也是C18∶1含量最高[13,23];蚕蛾油脂则是C18∶3n-3含量最高。因此,蚕蛾油脂有其特色。
世界卫生组织、世界粮农组织和中国营养学会等国际上大多数组织所推荐的人类油脂膳食比值为∑SFA∶∑MUFA∶∑PUFA=1∶1∶1;理想的∑n-3/∑n-6值为1∶3~1∶10[24]。本试验中蚕蛾油脂与推荐的人类油脂膳食比值和∑n-3/∑n-6值之间虽有一些差距,从膳食营养的角度看,虽然不够合理,但不饱和脂肪酸,尤其是ALA的含量高,是一种可供制备特殊功能食品、保健品或药品的优质原料。
表2 蚕蛾脂肪酸组成和含量 单位:g/100 g
Table 2 The composition and content of fatty acids in silkworm moth
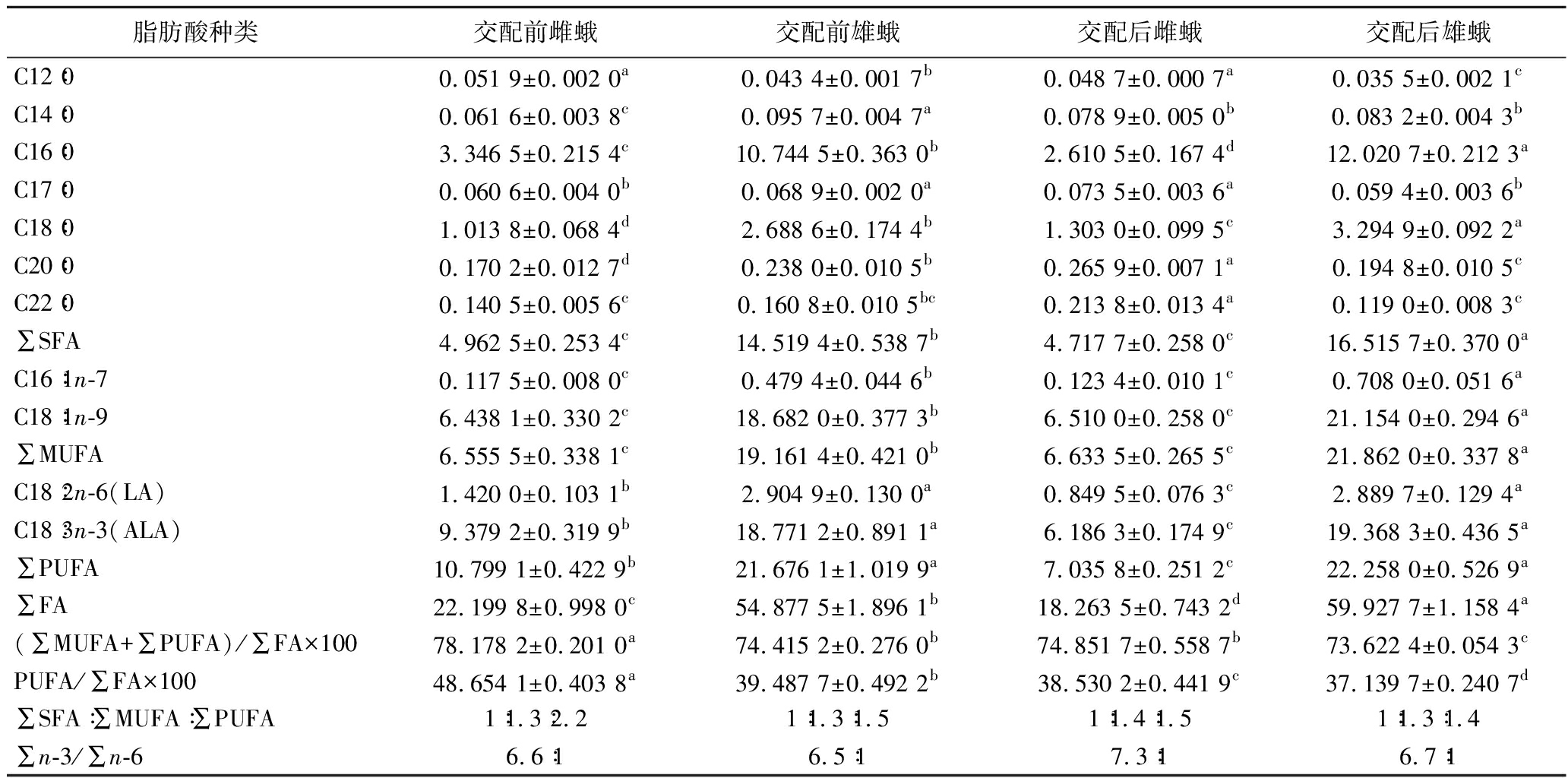
脂肪酸种类交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾C12∶00.051 9±0.002 0a0.043 4±0.001 7b0.048 7±0.000 7a0.035 5±0.002 1cC14∶00.061 6±0.003 8c0.095 7±0.004 7a0.078 9±0.005 0b0.083 2±0.004 3bC16∶03.346 5±0.215 4c10.744 5±0.363 0b2.610 5±0.167 4d12.020 7±0.212 3aC17∶00.060 6±0.004 0b0.068 9±0.002 0a0.073 5±0.003 6a0.059 4±0.003 6bC18∶01.013 8±0.068 4d2.688 6±0.174 4b1.303 0±0.099 5c3.294 9±0.092 2aC20∶00.170 2±0.012 7d0.238 0±0.010 5b0.265 9±0.007 1a0.194 8±0.010 5cC22∶00.140 5±0.005 6c0.160 8±0.010 5bc0.213 8±0.013 4a0.119 0±0.008 3c∑SFA4.962 5±0.253 4c14.519 4±0.538 7b4.717 7±0.258 0c16.515 7±0.370 0aC16∶1n-70.117 5±0.008 0c0.479 4±0.044 6b0.123 4±0.010 1c0.708 0±0.051 6aC18∶1n-96.438 1±0.330 2c18.682 0±0.377 3b6.510 0±0.258 0c21.154 0±0.294 6a∑MUFA6.555 5±0.338 1c19.161 4±0.421 0b6.633 5±0.265 5c21.862 0±0.337 8aC18∶2n-6(LA)1.420 0±0.103 1b2.904 9±0.130 0a0.849 5±0.076 3c2.889 7±0.129 4aC18∶3n-3(ALA)9.379 2±0.319 9b18.771 2±0.891 1a6.186 3±0.174 9c19.368 3±0.436 5a∑PUFA10.799 1±0.422 9b21.676 1±1.019 9a7.035 8±0.251 2c22.258 0±0.526 9a∑FA22.199 8±0.998 0c54.877 5±1.896 1b18.263 5±0.743 2d59.927 7±1.158 4a(∑MUFA+∑PUFA)/∑FA×10078.178 2±0.201 0a74.415 2±0.276 0b74.851 7±0.558 7b73.622 4±0.054 3cPUFA/∑FA×10048.654 1±0.403 8a39.487 7±0.492 2b38.530 2±0.441 9c37.139 7±0.240 7d∑SFA∶∑MUFA∶∑PUFA1∶1.3∶2.21∶1.3∶1.51∶1.4∶1.51∶1.3∶1.4∑n-3/∑n-66.6∶16.5∶17.3∶16.7∶1
脂肪酸IA和IT指数分别是衡量动脉粥样硬化程度和致血栓风险程度的指标,C16∶0和C18∶0是导致动脉粥样硬化和血栓形成的主要脂肪酸[25]。由于蚕蛾油脂中的C16∶0和C18∶0在SFA中的占比较高,因此有必要通过脂肪酸IA和IT指数对其作深入的评价分析。由表3结果可见,蚕蛾脂肪酸IA为0.20~0.28,IT值为0.14~0.22。4种类型蚕蛾的IA值和IT值虽有一些差异,但均低于禽蛋(IA 0.27~0.41、IT 0.83~1.08)[23]和乳羊(IA 1.3~1.7、IT1.7~2.0)[26]的IA和IT,与大西洋鲑(IA 0.23~0.27、IT 0.16~0.18)[13]、大豆油(IA 0.27、IT 0.50)[21]和花生油(IA 0.14、IT 0.20)[21]的相近。这表明蚕蛾油致动脉粥样硬化和致血栓风险程度较小。
表3 蚕蛾脂肪酸IA和IT指数
Table 3 The indexes of IA and IT of fatty acids of silkworm moth

指数交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾IA0.209 9±0.002 7b0.273 6±0.001 6a0.217 6±0.011 0b0.280 8±0.000 7aIT0.136 9±0.002 7d0.200 5±0.003 3b0.177 9±0.007 1c0.218 0±0.000 6a
综合考虑蚕蛾脂肪酸含量和不饱和脂肪酸比例,从提取分离不饱和脂肪酸的角度出发,交配后的雄蛾是最为理想的原料。
2.3 氨基酸组成、含量和营养价值评价
交配前后雌雄蚕蛾检测到17种氨基酸(表4),4种类型的蚕蛾均以谷氨酸含量最高,天冬氨酸、甘氨酸、丙氨酸的含量也较多。研究报道,谷氨酸和天冬氨酸有保护心脏功能;丙氨酸有预防肾结石、防止低血糖发生的作用;甘氨酸则对肾功能有很好的保护作用[27]。4种类型蚕蛾总氨基酸和必需氨基酸含量存在显著差异(P<0.05),两者含量均以交配前雌蛾最高,交配后雄蛾最低。根据FAO/WHO推荐的理想蛋白质标准,除了交配前的雌蛾略低外,其他3种蚕蛾必需氨基酸与非必需氨基酸的比例(essential amino acid/nonessential amino acid,EAA/NEAA)接近60%,必需氨基酸与总氨基酸的比例(essential amino acid/ total amino acids,EAA/TAA)达到或高于35%,属于优质蛋白源。其中EAA/NEAA和EAA/TAA最高的为交配后雄蛾。
表4 蚕蛾氨基酸组成及含量分析 单位:g/100 g
Table 4 The comparison of amino acids composition and content in silkworm moth
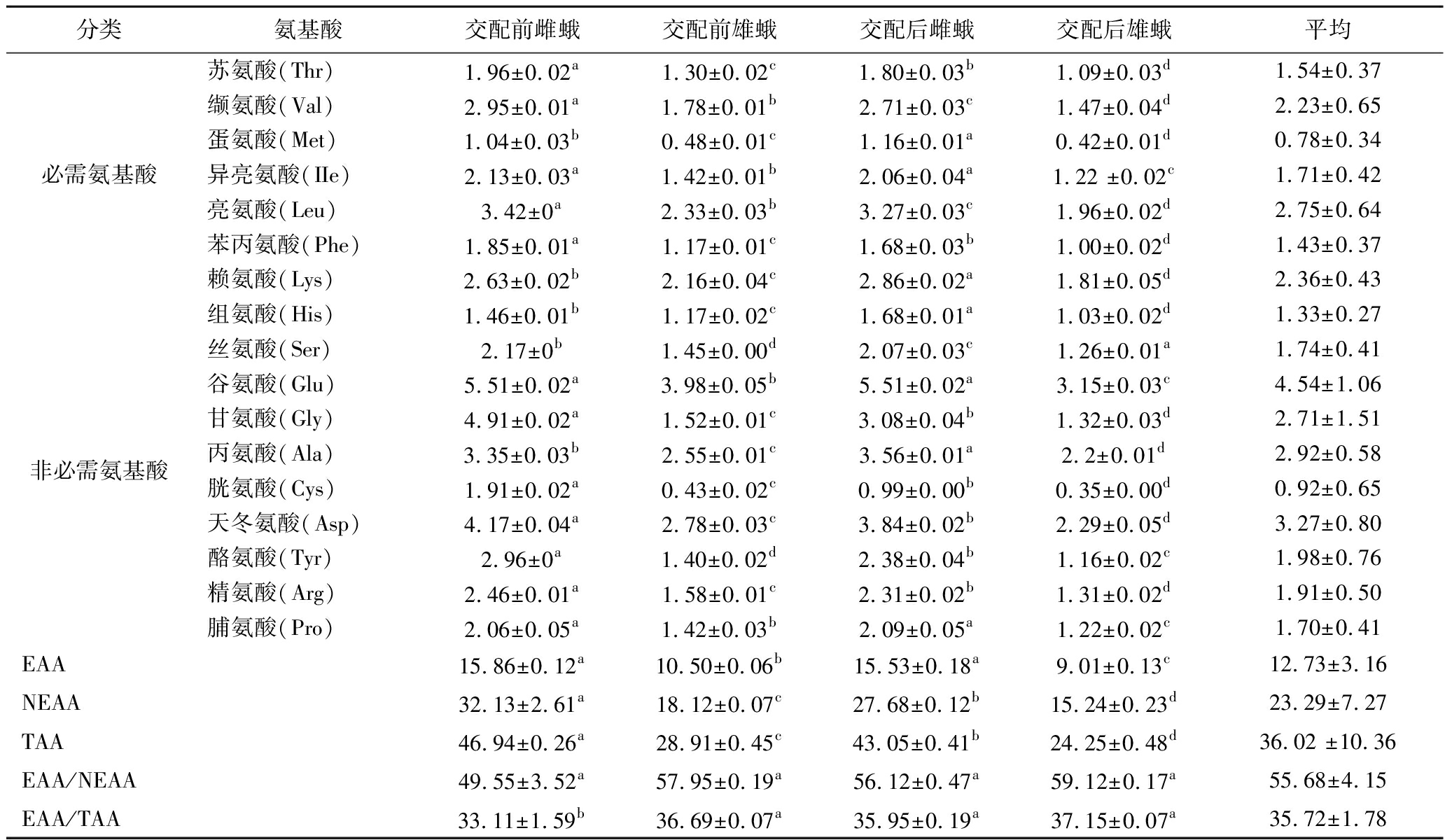
分类氨基酸交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾平均必需氨基酸苏氨酸(Thr)1.96±0.02a1.30±0.02c1.80±0.03b1.09±0.03d1.54±0.37缬氨酸(Val)2.95±0.01a1.78±0.01b2.71±0.03c1.47±0.04d2.23±0.65蛋氨酸(Met)1.04±0.03b0.48±0.01c1.16±0.01a0.42±0.01d0.78±0.34异亮氨酸(IIe)2.13±0.03a1.42±0.01b2.06±0.04a1.22 ±0.02c1.71±0.42亮氨酸(Leu)3.42±0a2.33±0.03b3.27±0.03c1.96±0.02d2.75±0.64苯丙氨酸(Phe)1.85±0.01a1.17±0.01c1.68±0.03b1.00±0.02d1.43±0.37赖氨酸(Lys)2.63±0.02b2.16±0.04c2.86±0.02a1.81±0.05d2.36±0.43非必需氨基酸组氨酸(His)1.46±0.01b1.17±0.02c1.68±0.01a1.03±0.02d1.33±0.27丝氨酸(Ser)2.17±0b1.45±0.00d2.07±0.03c1.26±0.01a1.74±0.41谷氨酸(Glu)5.51±0.02a3.98±0.05b5.51±0.02a3.15±0.03c4.54±1.06甘氨酸(Gly)4.91±0.02a1.52±0.01c3.08±0.04b1.32±0.03d2.71±1.51丙氨酸(Ala)3.35±0.03b2.55±0.01c3.56±0.01a2.2±0.01d2.92±0.58胱氨酸(Cys)1.91±0.02a0.43±0.02c0.99±0.00b0.35±0.00d0.92±0.65天冬氨酸(Asp)4.17±0.04a2.78±0.03c3.84±0.02b2.29±0.05d3.27±0.80酪氨酸(Tyr)2.96±0a1.40±0.02d2.38±0.04b1.16±0.02c1.98±0.76精氨酸(Arg)2.46±0.01a1.58±0.01c2.31±0.02b1.31±0.02d1.91±0.50脯氨酸(Pro)2.06±0.05a1.42±0.03b2.09±0.05a1.22±0.02c1.70±0.41EAA15.86±0.12a10.50±0.06b15.53±0.18a9.01±0.13c12.73±3.16NEAA32.13±2.61a18.12±0.07c27.68±0.12b15.24±0.23d23.29±7.27TAA46.94±0.26a28.91±0.45c43.05±0.41b24.25±0.48d36.02 ±10.36EAA/NEAA49.55±3.52a57.95±0.19a56.12±0.47a59.12±0.17a55.68±4.15EAA/TAA33.11±1.59b36.69±0.07a35.95±0.19a37.15±0.07a35.72±1.78
根据测得的蚕蛾氨基酸含量和FAO/WHO评分标准模式及鸡蛋模式,计算蚕蛾的AAS、CS、EAAI、NI和BV,如表5所示。必需氨基酸组成比例越接近 FAO/WHO模式谱或全鸡蛋模式谱比例,其蛋白的品质越好。交配前雌蛾蛋氨酸+胱氨酸、异亮氨酸、苯丙氨酸+酪氨酸、缬氨酸的含量接近或高于FAO/WHO推荐模式,而交配后雌蛾缬氨酸、亮氨酸、苯丙氨酸+酪氨酸、赖氨酸的含量超过FAO/WHO推荐模式;表明雌蛾氨基酸组成比例较合理。交配前雄蛾只有异亮氨酸和苯丙氨酸+酪氨酸的含量高于FAO/WHO推荐模式,交配后雄蛾氨基酸全部低于FAO/WHO推荐模式。从整体上看,雌蛾的营养高于雄蛾。与鸡蛋模式值相比,4种类型蚕蛾的必需氨基酸组成均未能达到其标准水平。
根据氨基酸评分标准,交配前后雌蛾和交配后雄蛾的第1限制性氨基酸均为苏氨酸,交配前雄蛾的第1限制性氨基酸为蛋氨酸+胱氨酸。雌蛾交配前后的第2限制性氨基酸分别为赖氨酸和异亮氨酸;雄蛾交配前后的第2限制性氨基酸均为亮氨酸。依照化学评分标准,雌蛾的第1限制性氨基酸均为苏氨酸,第2限制性氨基酸为异亮氨酸和缬氨酸;雄蛾的第1限制性氨基酸均为蛋氨酸+胱氨酸,第2限制性氨基酸为苏氨酸和缬氨酸。总体来看,雌蛾蛋白质最主要的限制性氨基酸是苏氨酸,雄蛾最主要的限制性氨基酸是蛋氨酸+胱氨酸。
依据评价模式,EAAI越接近100的样品,与标准氨基酸模式越接近,其相对营养价值越高;NI 是综合考察食物中蛋白质的含量和氨基酸组成的营养指数;BV用于衡量蛋白质被消化后的利用率[28]。由表5可见,交配前雌蛾(99.33)的EAAI明显高于交配后雌蛾(86.87),交配前的雄蛾(87.78)也高于交配后的雄蛾(78.59)。蚕蛾NI 由高到低依次为交配前雌蛾(21.45)、交配后雌蛾(15.14)、交配前雄蛾(14.83)和交配后雄蛾(13.60)。BV由高到低依次为交配前雌蛾(96.57)、交配前雄蛾(83.98)、交配后雌蛾(82.99)、交配后雄蛾(73.96)。由此可见,交配前雌蛾蛋白的营养价值和利用率最优。
表5 不同蚕蛾氨基酸组成评价
Table 5 The evaluation of amino acid composition of silkworm moth
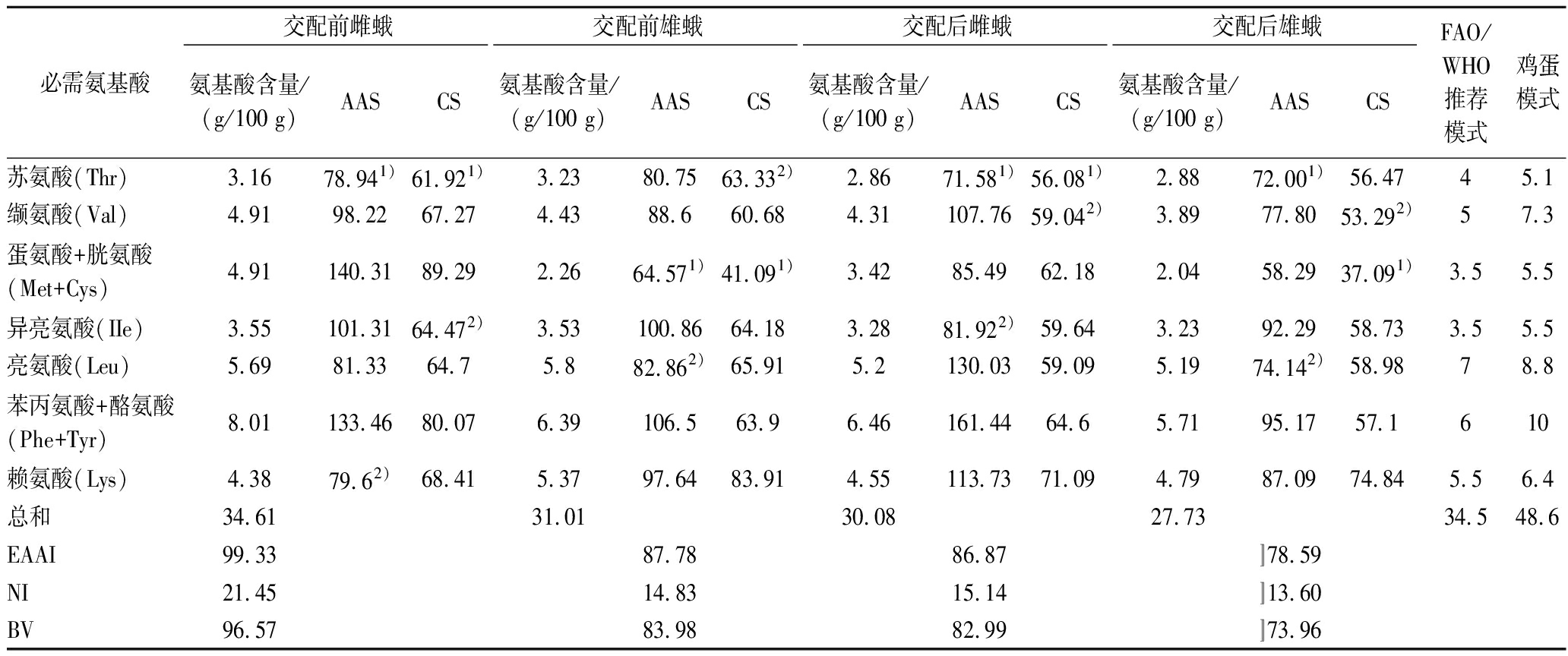
必需氨基酸交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾氨基酸含量/(g/100 g)AASCS氨基酸含量/(g/100 g)AASCS氨基酸含量/(g/100 g)AASCS氨基酸含量/(g/100 g)AASCSFAO/WHO推荐模式鸡蛋模式苏氨酸(Thr)3.1678.941)61.921)3.2380.7563.332)2.8671.581)56.081)2.8872.001)56.4745.1缬氨酸(Val)4.9198.2267.274.4388.660.684.31107.7659.042)3.8977.8053.292)57.3蛋氨酸+胱氨酸(Met+Cys)4.91140.3189.292.2664.571)41.091)3.4285.4962.182.0458.2937.091)3.55.5异亮氨酸(IIe)3.55101.3164.472)3.53100.8664.183.2881.922)59.643.2392.2958.733.55.5亮氨酸(Leu)5.6981.3364.75.882.862)65.915.2130.0359.095.1974.142)58.9878.8苯丙氨酸+酪氨酸(Phe+Tyr)8.01133.4680.076.39106.563.96.46161.4464.65.7195.1757.1610赖氨酸(Lys)4.3879.62)68.415.3797.6483.914.55113.7371.094.7987.0974.845.56.4总和34.6131.0130.0827.7334.548.6EAAI99.3387.7886.87〛78.59NI21.4514.8315.14〛13.60BV96.5783.9882.99〛73.96
注:数据肩标1)表示第1限制性氨基酸,肩标2)表示第2限制性氨基酸。
氨基酸的种类与含量在食物风味方面起着重要的作用。按照氨基酸的味觉强度,可以大致把氨基酸分为鲜味氨基酸(Lys、Glu、Asp)、甜味氨基酸(Gly、Ala、Ser、Thr、Pro、His)、苦味氨基酸(Val、Leu、Ile、Met、Trp、Arg)、芳香族氨基酸(Phe、Tyr、Cys)。本试验品种9芙蚕蛾中的风味氨基酸,经统计计算,结果见表6。蚕蛾的甜味氨基酸含量(33.81%)最高,其次是鲜味氨基酸(28.60%)和苦味氨基酸(26.00%),芳香味氨基酸含量最少(11.59%)。四类氨基酸含量均是雌蛾高于雄蛾,交配前的基本上高于交配后的,且交配前的雌蛾含量显著高于其他3种类型(P<0.05)。由此可见,蚕蛾甜味、鲜味和芳香味氨基酸含量高,适合作为美食的原料。而且交配前雌蛾的甜味氨基酸和芳香味氨基酸明显高于其他类型,所以其味道会香甜些。
表6 蚕蛾味觉氨基酸含量及占比
Table 6 The contents of taste-active amino acids of silkworm moth

呈味氨基酸交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾平均甜味氨基酸/(g/100 g)17.20±2.45a9.36±0.04c14.46±0.06b8.09±0.13c12.28±4.01甜味氨基酸占比/%35.73±3.00a32.70±0.12c33.45±0.10b33.36±0.10b33.81±1.75鲜味氨基酸/(g/100 g)12.17±0.25a8.80±0.03b12.24±0.08a7.25±0.10c10.12±2.26鲜味氨基酸占比/%25.39±1.08c30.75±0.05a28.33±0.05b29.91±0.05a28.60±2.18苦味氨基酸/(g/100 g)11.90±0.09a7.50±0.05c11.43±0.11b6.43±0.11d9.31±2.49苦味氨基酸占比/%24.84±1.20b26.02±0.10a26.44±0.07a26.50±0.05a26.00±0.87芳香味氨基酸/(g/100 g)6.72±0.04a2.96±0.02c5.09±0.06b2.48±0.04d4.31±1.78芳香味氨基酸占比/%14.03±0.75a10.34±0.04c11.77±0.08b10.23±0.13c11.59±1.63
氨基酸的种类和含量对食品的保健价值和药用价值有影响。药效氨基酸(谷氨酸、亮氨酸、甘氨酸、蛋氨酸、异亮氨酸、天冬氨酸和苯丙氨酸)的含量可以作为评价食品保健功效的间接依据;而支链氨基酸(亮氨酸、缬氨酸和异亮氨酸)可促进蛋白质合成和能量平衡,防止心血管疾病的发生[29]。如表7所示,4种类型蚕蛾的药效氨基酸和支链氨基酸含量从高到低顺序均为交配前雌蛾、交配后雌蛾、交配前雄蛾、交配后雄蛾。从药效功能和保健价值来看,交配前雌蛾最理想。
表7 蚕蛾特征氨基酸含量比较
Table 7 The comparison of characteristic amino acid contents in silkworm moth

特征氨基酸交配前雌蛾交配前雄蛾交配后雌蛾交配后雄蛾平均药效氨基酸/(g/100 g)24.16±2.52a13.5 3± 0.05c20.63±0.18b11.34±0.17c17.42±5.53支链氨基酸/(g/100 g)8.47±0.06a5.46±0.04c7.99±0.09b4.69±0.09d6.65±1.68
3 结论
9芙桑蚕蛾的营养成分在雌雄间和不同发育成熟阶段存在差异。交配前雌蛾是典型的低脂肪、高蛋白质的昆虫,是优质蛋白质和优质食品原料;交配后的雄蛾粗脂肪含量高,最适合用于油脂的提取和加工。
蚕蛾油脂含11种脂肪酸,其中有4种不饱和脂肪酸,占总脂肪酸含量的73.62%以上,在不饱和脂肪酸中,含量最高的为ALA。4种蚕蛾中,以交配后的雄蛾粗脂肪含量(24.46%,鲜重)、不饱和脂肪酸含量(44.31 g/100 g)和ALA含量(19.37 g/100 g)最高,其IA和IT指数分别为0.28和0.22,致动脉粥样硬化和致血栓风险程度比大豆油低,是提取不饱和脂肪酸的优质原料。
蚕蛾蛋白含17种氨基酸,总氨基酸和必需脂肪酸含量丰富,甜味氨基酸、鲜味氨基酸占比高。其中交配前的雌蛾蛋白质含量(21.6%,鲜重)、总氨基酸含量(46.94 g/100 g)、必需氨基酸占比(15.86%)、EAAI(99.33)、NI(21.45)和BV(96.57)最高,同时含有丰富的甜味氨基酸、药效氨基酸和支链氨基酸,是理想的动物蛋白资源。
[1] 刘军, 廖森泰, 邹宇晓, 等.家蚕蛹蛾的营养组成评价分析[J].中国粮油学报, 2016, 31(2):122-126.
LIU J, LIAO S T, ZOU Y X, et al.Nutrition composition evaluation and analysis of silkworm (Bombyx mori) pupae and moths[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(2):122-126.
[2] XU P X, HOOPER A M, PICKETT J A, et al.Specificity determinants of the silkworm moth sex pheromone[J].PLoS One, 2012, 7(9):e44190.
[3] 赵珂, 赵玉, 陈少峰, 等.蚕蛾公补合剂对少弱精子症患者精液Wnt/β-catenin信号通路的影响[J].中草药, 2021, 52(5):1419-1422. ZHAO K, ZHAO Y, CHEN S F, et al.Effect of Can′egongbu Mixture on Wnt/β-catenin signaling pathway in patients with oligoazoospermia[J].Chinese Traditional and Herbal Drugs, 2021, 52(5):1419-1422.
[4] 邵耀宁, 梁宝坚, 陈丽仪, 等.蚕蛾公补片治疗肾阳亏虚型阳痿的疗效观察[J].中医临床研究, 2020, 12(10):124-126.
SHAO Y N, LIANG B J, CHEN L Y, et al.Observation on treating impotence of the Shenyang Kuixu type with Can′e Gongbu Pian[J].Clinical Journal of Chinese Medicine, 2020, 12(10):124-126.
[5] 郭艳, 董莹莹, 张海军, 等.雌蚕蛾头粉对低钙饲料联合地塞米松诱导的大鼠骨质疏松症的预防作用[J].蚕业科学, 2019, 45(3):400-406.
GUO Y, DONG Y Y, ZHANG H J, et al.Preventive effect of female silkworm moth head powder on osteoporosis in rat induced by calcium deficient feed and dexamethasone[J].Science of Sericulture,2019, 45(3):400-406.
[6] 都兴范, 孟楠, 李学军, 等.柞蚕雄蛾油的组分及其对小鼠记忆力和抗氧化能力的影响[J].蚕业科学, 2015, 41(4):724-728.
DU X F, MENG N, LI X J, et al.Components of male tussah moth oil and their impacts on memory and antioxidation of mouse[J].Science of Sericulture, 2015, 41(4):724-728.
[7] 黄自然, 李树英.蚕业资源综合利用[M].北京:中国农业出版社, 2013:150-151.
HUANG Z R, LI S Y. Comprehensive Utilization of Sericulture Resources[M]. Beijing: China Agriculture Press, 2013:150-151.
[8] 王林美, 李树英, 岳冬梅.柞蚕蛾营养成分检测与分析[J].蚕业科学, 2014, 40(4):718-723.
WANG L M, LI S Y, YUE D M.Determination and analysis of nutritional ingredients in Antheraea pernyi moth[J].Science of Sericulture, 2014, 40(4):718-723.
[9] 都兴范, 李树英, 李亚洁, 等.柞蚕雄蛾类甾体激素的分析研究[J].辽宁农业科学, 2005(2):44-45.
DU X F, LI S Y, LI Y J, et al.Analysis of steroid hormones in male tussah moth[J].Liaoning Agricultural Science, 2005(2):44-45.
[10] 宋昆, 刘军, 廖森泰, 等.家蚕雄蛾中睾酮和β-蜕皮激素的联合提取及含量测定[J].蚕业科学, 2015, 41(6):1083-1087.
SONG K, LIU J, LIAO S T, et al.Combined extraction and determination of testosterone and β-ecdysone in male silkworm moths[J].Science of Sericulture, 2015, 41(6):1083-1087.
[11] 刘军, 廖森泰, 邹宇晓, 等.雄蚕蛾营养活性成分的提取方法及工艺条件优化[J].蚕业科学, 2013, 39 (1):146-151.
LIU J, LIAO S T, ZOU Y X, et al.Extraction method and process optimization for nutritional active ingredients from male silkworm moths[J].Science of Sericulture, 2013, 39(1):146-151.
[12] 宁正祥. 食品成分分析手册[M].北京:中国轻工业出版社, 1998:72-590.
NING Z X. Food Composition Analysis Manual. Beijing: China Light Industry Publishing House Press, 1998:72-590.
[13] 高岩, 邢丽红, 孙伟红, 等.大西洋鲑和虹鳟不同部位中虾青素和脂肪酸的比较分析[J].食品与发酵工业, 2021, 47(14):235-243.
GAO Y, XING L H, SUN W H, et al.Comparison of astaxanthin and fatty acid in different parts of farmed Salmo salar and Oncorhynchus mykiss[J].Food and Fermentation Industries, 2021, 47(14):235-243.
[14] FAO/WHO/UNU.Protein and amino acid requirements in human nutrition[R].Geneva:Word Health Organization Technical Reprot Series, 2007:150.
[15] 杨月欣, 王光亚, 潘兴昌.中国食物成分表[M].北京:北京大学医学出版社, 2009.
YANG Y X, WANG G Y, PAN X C. Chinese Food Composition Table. Beijing: Peking University Medical Press, 2009.
[16] 李青峰, 王诗琦, 赵贺, 等.不同品种柞蚕蛹营养价值及风味评价[J].食品与发酵工业, 2022, 48(6):110-116.
LI Q F, WANG S Q, ZHAO H, et al.Nutritional value and flavor evaluation of different varieties of tussah pupae[J].Food and Fermentation Industries, 2022, 48(6):110-116.
[17] CHAKRAVORTY J, GHOSH S, JUNG C, et al.Nutritional composition of Chondacris rosea and Brachytrupes orientalis:Two common insects used as food by tribes of Arunachal Pradesh, India[J].Journal of Asia-Pacific Entomology, 2014, 17(3):407-415.
[18] YANG X K, BAI H C, YIN L J, et al.Evaluation of allergenic protein profiles in three Chinese high-oleic acid peanut cultivars using NanoLC-Orbitrap mass spectrometry[J].Food Science and Human Wellness, 2023, 12(3):851-860.
[19] JORIS P J, DRAIJER R,FUCHS D,et al.Effect of α-linolenic acid on vascular function and metabolic risk markers during the fasting and postprandial phase:A randomized placebo-controlled trial in untreated (pre-)hypertensive individuals[J].Clinical Nutrition, 2020, 39(8):2413-2419.
[20] 杨塘榆, 闻乐嫣, 阚建全.采收期对毛叶山桐子油脂肪酸组成的影响[J].食品与发酵工业, 2022, 48(10):183-187.
YANG T Y, WEN L Y, KAN J Q.The effect of harvest time on the fatty acid compositions of I.polycarpa oil[J].Food and Fermentation Industries, 2022, 48(10):183-187.
[21] 张文超, 李会珍, 张志军, 等.8种不同植物油的脂肪酸组成及抗氧化性比较[J].中国油脂, 2021, 46(4):68-71;75.
ZHANG W C, LI H Z, ZHANG Z J, et al.Fatty acid composition and antioxidant properties of eight different vegetable oils[J].China Oils and Fats, 2021, 46(4):68-71;75.
[22] 魏晋梅, 刘彩云, 方彦, 等.沙棘果油脂肪酸与微量元素测定[J].食品与发酵工业, 2021, 47(2):268-273.
WEI J M, LIU C Y, FANG Y, et al.Determination of fatty acid compositions and trace elements in seabuckthorn fruit oil[J].Food and Fermentation Industries, 2021, 47(2):268-273.
[23] 王庆玲, 王宁, 詹萍, 等.禽蛋脂质脂肪酸组成评价及指纹图谱的构建[J].中国食品学报, 2017, 17(12):265-271.
WANG Q L, WANG N, ZHAN P, et al.Construction and evaluation of fingerprint on fatty acids composition of poultry eggs lipids[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(12):265-271.
[24] 蔡妙颜, 李冰, 袁向华.膳食中的脂肪酸平衡[J].粮油食品科技, 2003,11(2):37-39.
CAI M Y, LI B, YUAN X H.Fatty acid equilibrium in diet[J].Science and Technology of Cereals, Oils and Food, 2003,11(2):37-39.
[25] SINANOGLOU V J, STRATI I F, MINIADIS-MEIMAROGLOU S.Lipid, fatty acid and carotenoid content of edible egg yolks from avian species:A comparative study[J].Food Chemistry, 2011, 124(3):971-977.
[26] VACCA G M, CARCANGIU V, DETTORI M L, et al.Productive performance and meat quality of Mouflon×Sarda and Sarda×Sarda suckling lambs[J].Meat Science, 2008, 80(2):326-334.
[27] 朱晓波, 张子荣.氨基酸与疾病[M].石家庄:河北科学技术出版社, 2002.
ZHU X B, ZHANG Z R. Amino Acids and Disease. Shijiazhuang:Hebei Science and Technology Press, 2002.
[28] 陈建超, 葛志豪, 徐丽丽, 等.野生宽鳞多孔菌蛋白质营养分析与评价[J].氨基酸和生物资源, 2016, 38(4):1-4.
CHEN J C, GE Z H, XU L L, et al.Nutritional assessment of protein in wild Polyporus squamosus[J].Amino Acids &Biotic Resources, 2016, 38(4):1-4.
[29] WANG Y Q, HUANG K Y, LIU F C, et al.Association of circulating branched-chain amino acids with risk of cardiovascular disease:A systematic review and meta-analysis[J].Atherosclerosis, 2022, 350:90-96.