很多研究已经证实,小分子的食源性低聚肽具有比整蛋白、氨基酸和分子质量较大的多肽更好的吸收特性,且具有一定的生理功能[1]。小麦肽、大豆肽和豌豆肽分别是以小麦蛋白、大豆分离蛋白、豌豆蛋白为原料经过生物酶水解获得的小分子低聚肽。
不同的实验证实了小麦肽、大豆肽、豌豆肽在运动营养方面都具有积极作用。金振涛等[2]通过高效液相色谱法测定了小麦肽中谷氨酰胺含量达到了(23.54±0.49)%,而谷氨酰胺已被证实能够促进在上骨骼肌的肌纤维中肌结蛋白desmin的合成,具有促进运动性肌肉微损伤的修复作用[3]。潘兴昌等[4]对过度训练的散打运动员进行了小麦肽的干预,发现小麦肽能够通过减轻因运动训练引起的的血睾酮降低和血皮质醇含量增加,有效减轻握力降低、反应时延长和骨骼肌损伤,促进运动性疲劳的恢复,对于过度训练的发生有一定预防作用。其中对于骨骼肌的保护作用,ZHENG等[5]从清除自由基的角度也得到了相似的研究结论。FUSHIKI等[6]证明了大豆肽可以辅助大鼠运动过程中肌肉的增长。魏源[7]通过大鼠实验发现大豆肽能够抑制离心运动引起的骨骼肌组织葡萄糖-6-磷酸脱氢酶酶含量的升高,且比大豆蛋白能够更显著地减轻骨骼肌组织形态学和超微结构的变化[7]。李明亮等[8]也通过小鼠力竭游泳实验发现了大豆肽和小麦肽的复配能够协同增效,能够通过提高小鼠自身的抗氧化能力抑制生物膜的脂质过氧化,来缓解骨骼肌的损伤。豌豆肽是近年来开发的一款新原料肽,在缓解胰岛素抵抗[9]、增强免疫力[10]、抑制ACE酶活性[11-12]等方面均已见报道。豌豆肽来源于豌豆蛋白,豌豆蛋白的氨基酸组成均衡,符合联合国粮农组织和世界卫生组织推荐的标准模式,优于大豆蛋白。因此,豌豆肽对于运动营养理论上也具有积极作用。目前,学界关于豌豆肽对于骨骼肌的作用的研究还鲜见,且多种生物活性肽复合的协同功能也少有研究。
因此,本研究建立TNF-α刺激模型,基于本实验室前期研究已确立的大豆肽+豌豆肽复配比例,探究小麦肽、大豆肽、豌豆肽三者复合物对小鼠骨骼肌成肌细胞C2C12的影响作用,通过肌源调控因子和相关肌球蛋白、泛素连接酶、雷帕霉素靶蛋白与其相关调控因子的表达,结合Akt/mTOR通路初探作用机制。
1 材料与方法
1.1 材料与试剂
小鼠骨骼肌成肌细胞C2C12,中国医学科学院基础医学研究所细胞资源中心;高糖培养基(DMEM),Hyclone公司;胎牛血清(fetal bovine serum, FBS),GIBCO公司;双抗、细胞计数试剂盒(cell counting Kit-8, CCK-8)法检测试剂盒,碧云天生物技术有限公司;肿瘤坏死因子(tumor necrosis factor α, TNF-α),Sigma公司;丝氨酸/苏氨酸激酶(Akt,又称作蛋白激酶B或protein kinase B)磷酸化Akt(p-Akt),哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、磷酸化m-TOR (p-mTOR)、成肌分化抗原(MyoGenic differentiation antigen, MyoD)、肌细胞生成素(MyoGenin, MyoG)、含三方基序63(tripartite motif containing 63 Gene, TRIM63),Proteintech公司;肌球蛋白重链(myosin heavy chain, MyHC)、肌肉萎缩盒F基因(musle atrophy F-box, MAFbx),Santa Cruz Biotechnology, Inc.。小麦肽、大豆肽、豌豆肽,由北京中食海氏生物技术有限公司馈赠。
1.2 仪器与设备
生物安全柜,新加坡ESCO公司;细胞培养箱,Thermo Fisher Scientific公司;荧光酶标仪,美谷分子仪器(上海)有限公司;流式细胞仪,BD C6公司;SDS-PAGE电泳系统,Bio-Rad公司;荧光及化学发光成像系统,上海勤翔科学仪器有限公司。
1.3 实验方法
1.3.1 细胞培养
C2C12细胞培养在含5%(体积分数)CO2的37 ℃恒温培养箱中,生长培养基采用含10%(体积分数)FBS和1%(体积分数)双抗的DMEM高糖培养基。细胞融合达80%左右时用0.25%(体积分数)胰酶进行消化传代,平均2~3 d传代1次。
1.3.2 实验分组
本实验室前期实验已确定大豆肽和豌豆肽的复配剂量为大豆肽∶豌豆肽=2∶1(质量比,下同)。对数期生长的C2C12细胞的实验分组情况如下:对照组,模型组,实验组分为小麦肽组(XM),大豆肽+豌豆肽组(DD+WD),小麦肽∶大豆肽+豌豆肽=1∶1组,小麦肽∶大豆肽+豌豆肽=1∶2组,小麦肽∶大豆肽+豌豆肽=1∶3组,小麦肽∶大豆肽+豌豆肽=3∶1组,小麦肽∶大豆肽+豌豆肽=2∶1组,共9组。
1.3.3 细胞活力检测
C2C12细胞按照1×105/mL的浓度接种于96孔板中,将1.3.2节所述各实验组设置的梯度配比设置质量浓度梯度为0、100、200、400、600、800 μg/mL,与细胞共培养24 h,CCK-8法检测细胞存活率,根据细胞存活率选择最佳处理浓度。
1.3.4 诱导细胞分化
C2C12细胞按照5×105/mL的浓度接种于6孔板中,同时加入完全培养基培养细胞。待细胞培养1 d贴壁后,弃去DMEM完全培养基,加入分化培养基(含2%马血清和1%双抗的DMED高糖培养基),继续培养。
1.3.5 TNF-α刺激模型建立
对照组的细胞不做任何处理,只加入分化培养基;模型组的细胞在分化培养基中含有终质量浓度为25 ng/mL的TNF-α;实验组的细胞在分化培养基中含有终质量浓度为25 ng/mL的TNF-α和对应剂量的肽样品。细胞在上述条件下继续培养4 d,期间每天更换培养基并保证样品相应浓度。
1.3.6 Western Blot
收集6孔板细胞,裂解,提取细胞全蛋白用于Western Blot,分别检测以下蛋白的表达水平:MyHC,MAFbx,TRIM63,MyoD,MyoG,Akt,p-Akt,mTOR,p-mTOR。
1.4 数据处理
采用Origin 2022统计软件对数据进行处理,实验结果以均值±标准误差(Mean±SE)表示。采用Tukey′s Method进行数据分析,各项试验设置3~6次重复。本文图中*代表与对照组相比具有显著性差异(P<0.05),#代表与模型组相比具有显著性差异(P<0.05);**代表与对照组相比差异极显著(P<0.01),##代表与模型组相比差异极显著(P<0.01)。
2 结果与分析
2.1 细胞存活率检测
用CCK-8法检测小麦肽、大豆肽和豌豆肽复配物对C2C12细胞的存活率影响,以确定安全剂量范围。由图1可知,在肽质量浓度为200 μg/mL和400 μg/mL时,肽处理不会对细胞存活率产生显著影响;其余各配比处理组在各浓度时都不会对细胞存活率产生显著影响。本实验后续采取肽的终质量浓度为200 μg/mL。
2.2 MyoD、MyoG和MyHC蛋白表达检测
肌球蛋白重链(MyHC)是肌球蛋白的基本组成单位。MyoD和MyoG属于肌源调控因子,MyoD是肌肉谱系的决定性调控因子,MyoG基因表达可以被MyoD激活,促进肌肉干细胞分化。由图2可知,经TNF-α处理后,C2C12细胞中MyoD、MyoG和MyHC的蛋白表达量相比于对照组出现了不同程度的下降,尤其是肌球蛋白重链MyHC的表达水平与对照组相比显著降低,这与陈靖阳等[13]研究H2O2刺激C2C12细胞产生氧化应激引起的MyoD、MyoG基因表达下降趋势一致;经过肽样品处理后,上述3种蛋白的表达量出现不同程度的升高,其中,XM∶DD+WD=1∶3处理组细胞中3种蛋白的表达量相比于模型组升高最为显著。

a-XM;b-DD+WD;c-XM∶DD+WD=1∶1;d-XM∶DD+WD=1∶2;e-XM∶DD+WD=1∶3;f-XM∶DD+WD=3∶1;g-XM∶DD+WD=2∶1
图1 CCK-8法检测细胞存活率
Fig.1 Cell survival rate measured by CCK-8 assay

a-MyHC;b-MyoD;c-MyoG
图2 MyoD、MyoG和MyHC蛋白条带及灰度分析
Fig.2 Protein band and gray analysis of MyoD、MyoG and MyHC
2.3 TRIM63和MAFbx蛋白表达检测
泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径[14]。蛋白质先被泛素标记,然后被蛋白酶体识别和降解。在几乎所有类型的肌肉萎缩中,2种较重要的E3泛素连接酶:与骨骼肌蛋白降解肌肉相关的MAFbx[15]和参与骨骼肌萎缩的TRIM63(也称为MuRF1)[16]都被诱导高表达。由图3可知,在模型组中,2种蛋白的表达量相比于对照组都显著升高,经过肽样品处理后,2种蛋白的表达水平开始出现下降。其中,以XM∶DD+WD为1∶3和2∶1两个处理组细胞中2种蛋白的表达水平相比于模型组降低最为显著。

a-MAFbx;b-TRIM63
图3 TRIM63和MAFbx蛋白条带及灰度分析
Fig.3 Protein band and gray analysis of TRIM63 and MAFbx
2.4 Akt,p-Akt,mTOR,p-mTOR蛋白表达检测
雷帕霉素靶蛋白mTOR是Akt下游重要底物之一,mTOR主要通过p70 s6k和4E-BP1 2条传导通路调节蛋白的合成和分解,另外,Akt活化后也能抑制糖原合酶激酶3β(GSK3β)的活性,从而增加蛋白质的合成,Akt-mTOR- P70 s6K和Akt-GSK3β通路是协同作用,共同促进肌细胞的肥大效应[17-18]。由图4可以看出,模型组中Akt和mTOR的磷酸化水平相比于对照组显著降低,而经过肽样品处理后2种蛋白的磷酸化水平出现了不同程度的升高,其中,以XM∶DD+WD=1∶3处理组细胞中2种蛋白的磷酸化水平相比于模型组升高最为显著。
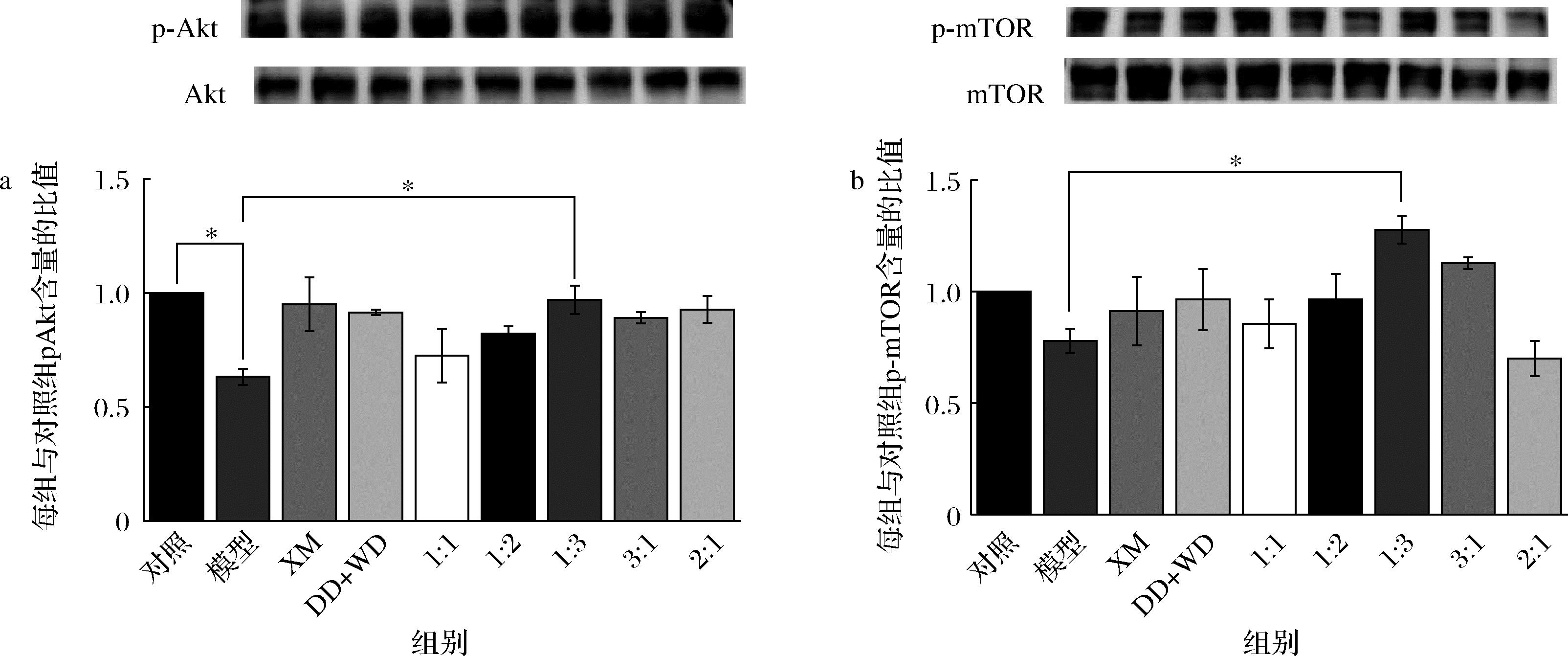
a-Akt及其磷酸化产物;b-mTOR及其磷酸化产物
图4 Akt、mTOR和其磷酸化蛋白条带及灰度分析
Fig.4 Protein band and gray analysis of Akt、mTOR and their phosphorylated form
3 结论
肌肉组织是不能自身形成新纤维的终末分化结构,C2C12细胞是来源于小鼠骨骼肌C2细胞系的细胞株,具有分化能力,因此通常作为成肌细胞增殖和分化的模型[19]。TNF-α是一种促炎症细胞因子,多项研究已发现在一些肌肉萎缩、老年肌少症患者的骨骼肌的表达明显升高,也常被用做肌肉衰减或关节健康研究模型的刺激因子[20-21]。MyoD、MyoG、MyHC、MAFbx、TRIM63与肌肉生长、分化、降解过程密切相关。肌源调控因子MyoD、MyoG和相关肌球蛋白MyHC是肌肉分化的标志基因表达的蛋白,泛素连接酶MAFbx是蛋白降解的关键调节因子,被认为是经典的蛋白降解标志,泛素连接酶TRIM63是TRIM家族蛋白之一,其含量能够反映骨骼肌蛋白质分解机制的泛素蛋白酶体途径表达增多的情况[22-23]。
蛋白的表达过程在RNA表达后经过修饰、折叠、磷酸化等步骤形成具有功能的蛋白质,因此RNA表达水平不等于蛋白表达水平,考察蛋白表达水平的变化能够反应模型及给药后细胞的真实变化。本研究建立了TNF-α刺激C2C12细胞模型,实验表明TNF-α能引起C2C12细胞中肌源调控因子MyoD、MyoG和相关肌球蛋白MyHC的蛋白表达水平下降,也能够引起与肌肉蛋白降解相关的泛素连接酶MAFbx和TRIM63表达升高。小麦肽、大豆肽、豌豆肽均在不同实验中被证实对于肌肉促进、运动营养健康具有积极作用。本研究中,小麦肽与大豆肽+豌豆肽以1∶3的质量比进行复配在几种配比中可以最有效地改善由TNF-α造成的C2C12细胞肌蛋白含量降低,提高C2C12细胞中成肌调节因子和肌肉蛋白的表达水平。
合成代谢是肌肉再生、修复与重塑的基础。影响肌肉健康的关键合成代谢通路是丝氨酸苏氨酸激酶/哺乳动物雷帕霉素靶蛋白(Akt/mTOR)通路,在蛋白翻译(上调翻译起始和核糖体生物发生)中作用关键。本研究发现MyoD、MyoG、MyHC、MAFbx、TRIM63蛋白表达的变化趋势与磷酸化的Akt和mTOR的表达趋势一致,说明小麦肽与大豆肽+豌豆肽改善C2C12细胞肌蛋白表达的作用受到Akt/mTOR通路调节,肽能够降低细胞中E3泛素连接酶的表达和提高Akt/mTOR的蛋白磷酸化水平,从而降低细胞中蛋白降解和促进蛋白合成。
[1] 潘兴昌, 蔡木易.食源性低聚肽与特殊膳食食品的开发[C].中国营养学会第十次全国营养学术会议暨第七届会员代表大会论文摘要汇编.北京:2008.
PAN X C, CAI M Y.Food-derived oligopeptides and the development of special dietary foods[C].Abstracts of the 10th National Nutrition Academic Conference and the 7th Member Congress of the Chinese Nutrition Society.Beijing: 2008.
[2] 金振涛, 马永庆, 刘艳, 等.小麦低聚肽粉中谷氨酰胺含量测定方法及其临床应用前景[J].食品与发酵工业, 2011, 37(11):189-193.
JIN Z T, MA Y Q, LIU Y, et al.Research of the determination method of glutamine content in wheat oligo-peptide products and its clinical application prospect[J].Food and Fermentation Industries, 2011, 37(11):189-193.
[3] 高春刚, 田野.补充谷氨酰胺对运动大鼠骨骼肌desmin表达的影响[J].中国运动医学杂志, 2005, 24(1):34-38.
GAO C G, TIAN Y.The effect of glutamine supplementation on regenerated skeletal muscle fibers of exercised rats[J].Chinese Journal of Sports Medicine, 2005, 24(1):34-38.
[4] 潘兴昌, 胡要娟, 谷瑞增, 等.补充小麦肽对预防散打运动员发生过度训练的作用[J].中国运动医学杂志, 2015, 34(2):170-174.
PAN X C, HU Y J, GU R Z, et al.Preventive effect of wheat peptides supplementation on the occurrence of overtraining in Sanda athletes[J].Chinese Journal of Sports Medicine, 2015, 34(2):170-174.
[5] ZHENG Z Q, YANG X X, LIU J, et al.Effects of wheat peptide supplementation on anti-fatigue and immunoregulation during incremental swimming exercise in rats[J].Royal Society of Chemistry Advances, 2017, 7(69):43345-43355.
[6] FUSHIKI T, MATSUMOTO K, UOHASHI R, et al.Effects of the soybean peptide on an increase in muscle mass during training in mice[J].Report-Soy Protein Research Committee, 1995, 16:1-3.
[7] 魏源. 补充活性肽和人参对离心运动后骨骼肌微损伤及其修复效果的观察研究[D].北京:北京体育大学, 2005.
WEI Y.The observation study on the micro-injury and repair of the skeletal muscle after eccentric exercise and the intervention of active-peptides and ginseng[D].Beijing:Beijing Sport University, 2005.
[8] 李明亮, 尹曼, 凌空, 等.大豆肽和小麦肽抗疲劳功能的实验研究[J].食品科技, 2019, 44(9):303-307.
LI M L, YIN M, LING K, et al.Experimental study on the antifatigue function of soybean peptide and wheat peptide[J].Food Science and Technology, 2019, 44(9):303-307.
[9] 崔欣悦, 张瑞雪, 周明, 等.豌豆肽缓解胰岛素抵抗形成效果探究[J].食品工业科技, 2019, 40(12):145-148.
CUI X Y, ZHANG R X, ZHOU M, et al.Effect of pea oligopeptides on relieving insulin resistance[J].Science and Technology of Food Industry, 2019, 40(12):145-148.
[10] 张敏佳, 刘文颖, 贾福怀, 等.豌豆肽对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].食品与发酵工业, 2018, 44(8):135-140. ZHANG M J, LIU W Y, JIA F H, et al.Effects of pea peptide on immune function in immunosuppressed mice induced by cyclophosphamide[J].Food and Fermentation Industries, 2018, 44(8):135-140.
[11] 朱玲. 酶解豌豆肽的制备及其ACE抑制活性研究[D].郑州:河南工业大学, 2014.
ZHU L.Study on the preparation and ACE inhibitory activity of pea peptides[D].Zhengzhou:Henan University of Technology, 2014.
[12] LIAO W, FAN H B, LIU P, et al.Identification of angiotensin converting enzyme 2 (ACE2) up-regulating peptides from pea protein hydrolysate[J].Journal of Functional Foods, 2019, 60:103395.
[13] 陈靖阳, 徐小艾, 王婉, 等.地鳖肽提取物对H2O2刺激C2C12细胞肌调节因子基因表达的影响[J].中国兽医学报, 2022, 42(3):551-557.
CHEN J Y, XU X A, WANG W, et al.Effects of Eupofyphaga sinensis peptide extracts on expression of myogenic regulatory factor in C2C12 cells stimulated with H2O2[J].Chinese Journal of Veterinary Science, 2022, 42(3):551-557.
[14] SUN-WANG J L, IVANOVA S, ZORZANO A.The dialogue between the ubiquitin-proteasome system and autophagy:Implications in ageing[J].Ageing Research Reviews, 2020, 64:101203.
[15] 徐坤鹏, 姜达.MAFbx和MuRF-1因子在癌性恶病质肌肉萎缩中的作用[J].现代肿瘤医学, 2010, 18(7):1449-1451.
XU K P, JIANG D.Effects of MAFbx and MuRF-1 factors in muscle atrophy in carcinomatous cachexia[J].Journal of Modern Oncology, 2010, 18(7):1 449-1 451.
[16] PERIS-MORENO D, TAILLANDIER D, POLGE C.MuRF1/TRIM63, master regulator of muscle mass[J].International Journal of Molecular Sciences, 2020, 21(18):6663.
[17] BROWN E J, ALBERS M W, SHIN T B, et al.A mammalian protein targeted by G1-arresting rapamycin-receptor complex[J].Nature, 1994, 369(6483):756-758.
[18] LOEWITH R, JACINTO E, WULLSCHLEQER S, et al.Two TOR complexes, only one of which is rapamycin sensitive, have distinct roles in cell growth control[J].Molecular Cell, 2002, 10(3):457-468.
[19] LEE J H, TACHIBANA H, MORINAGA Y, et al.Modulation of proliferation and differentiation of C2C12 skeletal muscle cells by fatty acids[J].Life Sciences, 2009, 84(13-14):415-420.
[20] 于太永. 脂肪细胞因子leptin和TNF-α对猪骨骼肌成肌细胞增殖分化的影响及其机制[D].杨凌:西北农林科技大学, 2008.
YU T Y.Effects of leptin and TNF-α on the porcine myoblast proliferation and differentiation and its moleucular mechanism[D].Yangling:Northwest Agriculture and Forestry University, 2008.
[21] 蒋建平, 侯凡凡, 张训.促炎症细胞因子刺激人类关节滑膜B型细胞表达粘附分子[J].中国免疫学杂志, 2001, 17(2):69-72.
JIANG J P, HOU F F, ZHANG X.Pro-inflammatory cytokines up-regulate expression of adhesion molecules on human type-B synovial cells [J].Chinese Journal of Immunology, 2001, 17(2):69-72.
[22] 周建嫦. 骨骼肌蛋白质分解机制的研究进展[J].国际检验医学杂志, 1998, 19(5):228-231.
ZHOU J C.Research progress of skeletal muscle protein breakdown mechanism[J].International Journal of Laboratory Medicine, 1998, 19(5):228-231.
[23] 杨锐睿, 周越, 安江红, 等.补充海洋肽对大鼠血清CK-MM及骨骼肌泛素连接酶Trim63的影响[J].北京体育大学学报, 2011, 34(5):55-59.
YANG R R, ZHOU Y, AN J H, et al.The effect of suppling marine peptide on ubiquitin ligating enzyme Trim63[J].Journal of Beijing Sport University, 2011, 34(5):55-59.