甘蓝是中国主要的蔬菜种类之一,价格便宜,具有很高的营养价值。随着人们生活节奏的加快以及对健康生活方式的追求,鲜切果蔬越发受到人们的喜爱,并逐渐进入主流果蔬消费市场。但甘蓝经过鲜切处理后易造成机械损伤,导致营养物质的损失和品质的劣变,因此有必要对鲜切甘蓝的保鲜方式进行相关研究。
1-甲基环丙烯(1-methylcyclopropene,1-MCP),能够与果蔬组织中的乙烯受体发生结合,阻碍乙烯与受体的结合,从而抑制乙烯的信号转导。近年来,随着对1-MCP的深入研究发现,1-MCP具有化学性质稳定、无毒、低效、作用效果长久等优点,已越来越受到人们的关注,1-MCP已经被广泛应用在果蔬的贮藏保鲜中,研究表明1-MCP对黄桃[1]、甘蓝[2]等果蔬具有良好的贮藏保鲜效果。生物保鲜剂来源于动植物、微生物中,天然、安全、无毒,具有良好的生物相容性和生物可降解性,对包括腐败微生物在内的多种微生物具有抗菌活性,同时还具有阻隔氧气和微生物、维持水分、护色、抗氧化等作用,且复配生物保鲜剂较单一保鲜剂保鲜效果更好[3]。近年来,国内外关于鲜切蔬菜的贮藏保鲜有大量的研究,主要包括物理保鲜[4]、化学保鲜[5]和生物保鲜[6],尚缺少1-MCP结合生物保鲜剂对鲜切甘蓝营养品质影响方面的研究。
为探究1-MCP结合生物保鲜剂对鲜切甘蓝保鲜效果的影响,本实验以甘蓝为实验材料,用木瓜蛋白酶、菠萝蛋白酶、ε-聚赖氨酸3种生物保鲜剂复配、2 μL/L 1-MCP、2 μL/L 1-MCP+复配生物保鲜3种方式处理鲜切甘蓝。通过测定感官质量、褐变度、色差、营养指标、生理指标、衰老指标及相关酶,分析最适合鲜切甘蓝的保鲜处理方式,以期为鲜切甘蓝保鲜提供技术支撑。
1 材料与方法
1.1 材料与试剂
甘蓝,天津市西青区红旗农贸批发市场。挑选叶片无发黄、无萎蔫、果实形状大小均一、成熟度一致、无病害和无机械损伤的甘蓝为实验材料。
钼酸铵、95%(体积分数)乙醇、无水乙醇、草酸-EDTA、醋酸、三氯乙酸、浓硫酸、2-硫代巴比妥酸、氢氧化钠,天津市江天化工有限公司。真空包装袋 (规格:10 cm×12 cm,厚度:0.08 mm),河北冀利塑业有限公司;ε-聚赖氨酸、木瓜蛋白酶、菠萝蛋白酶、1-MCP,国家农产品保鲜工程技术研究中心(天津)。
1.2 仪器与设备
CheckPoint型便携式气体测定仪,丹麦PBI Dansensor公司;2010 plus型气相色谱仪,日本岛津公司;HWS-250BX型恒温恒湿箱,天津市泰斯特仪器有限公司;ML503/02型电子天平(千分之一),梅特勒-托利多仪器(上海)有限公司;DZ400/2D型真空包装机,上海余特包装机械制造有限公司;SynergyH1型多功能微孔板检测仪,美国 Biotek Instrument 公司;JYL-C50T型料理机,九阳股份有限公司;HH-1型数显恒温水浴锅,金坛市金南仪器制造有限公司;Sigma 3-30k型高速冷冻离心机,德国 SIGMA 离心机有限公司;DDS-307A型电导仪,上海纳诺仪器有限公司;A11 basic型研磨机,IKA 公司。
1.3 实验方法
1.3.1 样品前处理
a)选择大小适中、无病虫害、无机械损伤、无黄化腐烂的甘蓝;
b)随机选取一部分甘蓝装入65 cm×65 cm,厚度为0.04 mm的PE袋中,每袋装入3个甘蓝,用2 μL/L浓度1-MCP进行处理;
c)将未做处理整颗甘蓝用蒸馏水清洗表面,剥去甘蓝外两层叶片,取第3~5层手动切成约1 cm×5 cm厚的切片,将其放入约2 000 mL蒸馏水中浸泡2 min取出,自然晾干后真空包装,放入4 ℃冰箱中贮藏,记为CK;
d)将未做处理整颗甘蓝用蒸馏水清洗表面,剥去甘蓝外2层叶片,取第3~5层手动切成约1 cm×5 cm 厚的切片,将其放入约2 000 mL 0.3%(质量分数)木瓜蛋白酶、0.3%(质量分数)菠萝蛋白酶和0.1%(质量分数)ε-聚赖氨酸复合生物保鲜剂中浸泡2 min取出,自然晾干后真空包装,放入4 ℃冰箱中贮藏,记为F;
e)将1-MCP处理的整颗甘蓝用蒸馏水清洗表面,剥去甘蓝外两层叶片,取第3~5层手动切成约1 cm×5 cm厚的切片,将其放入约2 000 mL蒸馏水中浸泡2 min取出,自然晾干后真空包装,放入4 ℃冰箱中贮藏,记为1-MCP;
f)将1-MCP处理的整颗甘蓝用蒸馏水清洗表面,剥去甘蓝外两层叶片,取第3~5层手动切成约1 cm×5 cm厚的切片,将其放入盛约2 000 mL 0.3%木瓜蛋白酶、0.3%菠萝蛋白酶和0.1% ε-聚赖氨酸复合生物保鲜剂中浸泡2 min取出,自然晾干后真空包装,放入4 ℃冰箱中贮藏,记为1-MCP-F;
g)每隔3 d进行取样测定相关指标,每个处理3次重复实验。
1.3.2 感官质量的测定
参考吴欣蔚[7]的方法稍作修改,选取9名经过培训的感官评定人员对鲜切甘蓝进行评定。从色泽、质地、外形、气味方面进行9分制评分。当感官评分低于5时,蔬菜不具有商品价值,因此,将5分作为考察的终点。鲜切甘蓝总体感官质量评分标准见表1。
表1 鲜切甘蓝总体感官质量评分标准
Table 1 Scoring standard of overall sensory quality of fresh-cut cabbage

分值感官质量商品价值9鲜绿、脆嫩、叶型饱满、清香商品价值极高7绿、比较脆、叶型较饱满、香商品价值较高5黄化10%~30%、变软、叶片稍皱缩、稍有异味商品价值较差3黄化30%~50%、轻度腐烂、叶片皱缩、异味严重无商品价值 1黄化50%以上、严重腐烂、皱缩严重,发臭无商品价值
1.3.3 褐变度的测定
采用林丽莎[8]的方法测定。将甘蓝可食部分混匀后随机取样,各处理重复测定3次,取平均值。
1.3.4 色差的测定
参考纪淑娟等[9]的方法并加以修改。采用色差仪进行测定,每次从各个处理分别取3袋进行测定,每袋上中下均匀打3个点,共9个。
1.3.5 营养指标的测定
1.3.5.1 维生素C含量的测定
采用钼蓝比色法[10]测定,将甘蓝可食部分混匀后随机取样,各处理重复3次,取平均值。
1.3.5.2 还原糖含量的测定
采用3,5-二硝基水杨酸法[11]测定,将甘蓝可食部分混匀后随机取样,各处理重复3次,取平均值。
1.3.5.3 叶绿素含量的测定
采用关文强等[12]的方法,并稍作修改,称取甘蓝2 g,加入15 mL无水乙醇将甘蓝研磨成匀浆,在避光低温处密封浸提24 h。以无水乙醇为实验空白对照,用紫外分光光度计分别在649、665 nm下测定吸光度。
叶绿素a、叶绿素b的含量计算如公式(1)、公式(2)所示:
(1)
(2)
式中:Ca为叶绿素a含量,mg/kg;Cb为叶绿素b含量,mg/kg;m为样品质量,g;D665、D649为665、649 nm下的吸光度值。
1.3.6 生理指标的测定
1.3.6.1 呼吸强度的测定
采用静置法,参照康丹丹[13]的方法,取大小均一的甘蓝内部,放入保鲜盒内,密封静置2 h,用便携式气体测定仪测定盒内O2/CO2含量,各处理重复3次,取平均值。
1.3.6.2 乙烯生成速率的测定
采用静置法,参照张建超等[14]的方法,取甘蓝叶片50 g,置入保鲜盒内,密封静置2 h,用气相色谱仪测定,每个处理重复3次,取平均值。
1.3.7 衰老指标及相关酶的测定
1.3.7.1 相对电导率的测定
处理随机选取10片甘蓝叶片,采用直径为1 cm的打孔器对甘蓝叶片打孔,取5个甘蓝叶片小圆片,置于50 mL三角瓶内,加入25 mL去离子水,立即测得值为P0,10 min后测得值为P1,然后立即在沸水中煮10 min后冷却至室温,测定值为P2。相对电导率R的计算如公式(3)所示:
(3)
1.3.7.2 丙二醛(malondialdehyde,MDA)的测定
采用硫代巴比妥酸法[15]测定。
1.3.7.3 多酚氧化酶(polyphenol oxidase,PPO)的测定
采用邻苯二酚法[16]测定。测定结果以U/g表示,U为每分钟吸光度变化值增加1为1个活性单位。
1.3.7.4 过氧化物酶(peroxidase,POD)的测定
采用愈创木酚法[17]测定。测定结果以U/g表示,U为每分钟吸光度变化值增加1为1个过氧化物活性单位。
1.3.7.5 过氧化氢酶(catalase,CAT)的测定
采用蔡慧[18]的方法测定。测定结果以U/g表示,U为每分钟吸光度变化值减少0.01为1个CAT活性单位。
1.4 数据处理
实验结果每组重复3次平行,实验结果取其平均值。数据采用Excel 2010进行图像绘制及处理,差异显著性分析通过DPS 7.5软件LSD法进行(P<0.05代表差异显著)。
2 结果与分析
2.1 1-MCP结合生物保鲜剂处理对鲜切甘蓝感官品质的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝感官品质的影响如图1、表2所示。随着贮藏期的逐渐延长,各处理组的感官效果均优于CK组。贮藏期6 d前,鲜切甘蓝感官无明显变化;6 d时,CK组和生物保鲜剂处理组均出现轻微黄化现象,CK组略有异味,1-MCP处理组和1-MCP-F处理组鲜切甘蓝之间无明显差异,综合得分分别为7.00和7.37;9 d时,CK组已经失去商品价值,感官品质表现为黄化严重,袋内有叶汁流出,异味严重并出现胀袋现象,生物保鲜剂处理组鲜切甘蓝轻微黄化,略有异味并出现胀袋现象,1-MCP处理组产生轻微黄化现象,1-MCP-F处理组鲜切甘蓝无明显黄化现象,没有异味且未发生胀袋现象,综合得分为7.33,显著(P<0.05)高于CK组和保鲜剂处理组;12 d时,全部处理组均失去商品价值,CK组鲜切甘蓝全部黄化、腐烂,并伴有严重腐败味,感官评分仅为1.93,保鲜剂处理组鲜切甘蓝黄化严重、出现轻微腐烂,产生严重的异味。1-MCP处理组鲜切甘蓝产生黄化现象、胀袋并伴有酸味;1-MCP-F处理组鲜切甘蓝色泽黄化现象相对较轻,质地较脆,有轻微胀袋现象,异味不严重,感官得分显著(P<0.05)高于其他处理组。由此说明1-MCP结合生物保鲜剂处理可以明显保持鲜切甘蓝的感官品质。

图1 不同处理对鲜切甘蓝感官品质的影响
Fig.1 Effects of different treatments on sensory quality of fresh-cut cabbage
表2 鲜切甘蓝感官评分表
Table 2 Sensory scoring table of fresh cut cabbage

处理贮藏时间/d036912CK9.00±0.00a8.50±0.87a6.50±0.86bc4.66±0.33de1.93±0.56fF9.00±0.00a8.75±0.21a6.88±1.08b5.50±0.28cd3.93±0.79e1-MCP9.00±0.00a8.60±0.28a7.00±1.17b6.41±0.27bc4.37±0.37e1-MCP-F9.00±0.00a8.90±0.17a7.37±0.81b7.33±0.40b4.81±0.75de
注:表中不同小写字母代表在5%水平上显著差异(下同)。
2.2 1-MCP结合生物保鲜剂处理对鲜切甘蓝褐变度的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝褐变度的影响见图2。如图2所示,随着贮藏期的逐渐延长,1-MCP-F处理组的褐变度显著低于其他处理组(P<0.05)。3 d时,1-MCP处理组和1-MCP-F处理组的褐变度显著低于CK组和保鲜剂处理组(P<0.05);6~12 d贮藏期间,1-MCP-F处理组的褐变度显著低于CK、保鲜剂处理组和1-MCP处理组(P<0.05);12 d时褐变度由大到小变化情况为:CK>F>1-MCP>1-MCP-F,分别为0.459、0.367、0.356和0.302。综上所述,3种处理方式均能抑制鲜切甘蓝的褐变,其中1-MCP结合生物保鲜剂处理可以较好的抑制鲜切甘蓝褐变。
2.3 1-MCP结合生物保鲜剂处理对鲜切甘蓝色差的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝色差的影响如表3所示。表3测量的L*值表示鲜切甘蓝的明亮度,数值越大颜色越浅色;a*值为负数时代表鲜切甘蓝颜色偏绿,数值越大绿色越浅;b*值变化代表黄蓝方向变化,数值越大代表鲜切甘蓝越黄,也就是鲜切甘蓝黄化越严重;ΔE代表总色差的大小。由表3可知,在整个贮藏期间,L*、a*、b*、ΔE全部呈上升趋势;12 d时,保鲜剂结合1-MCP处理的L*、a*、b*均值显著低于对照,说明该处理的鲜切甘蓝颜色更深;b*值显著低于对照,说明该处理的鲜切甘蓝更绿,黄化程度更小;由此可得出1-MCP结合生物保鲜剂处理可以更好地维持鲜切甘蓝的色泽。
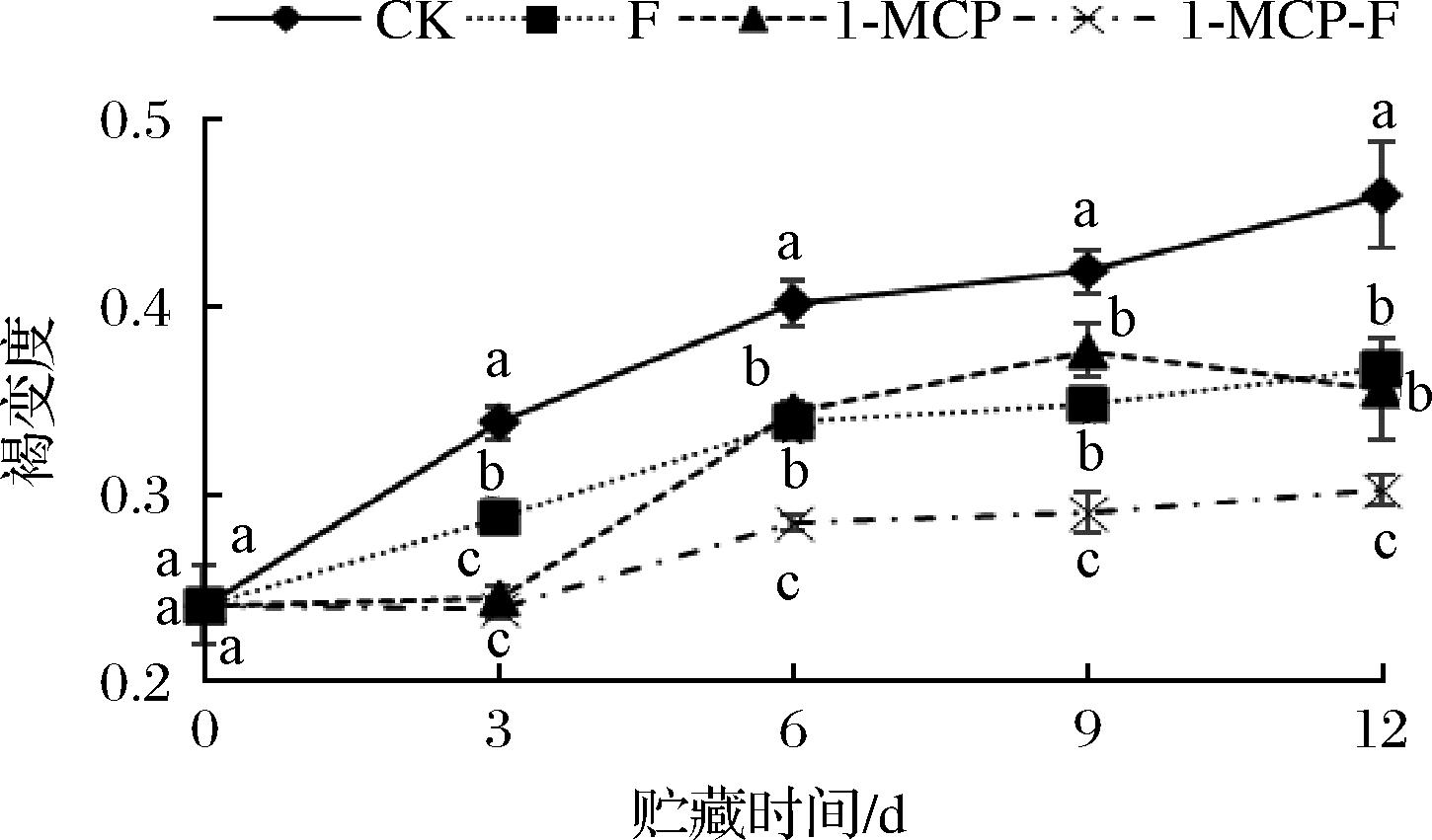
图2 1-MCP结合生物保鲜剂处理对鲜切甘蓝褐变度的影响
Fig.2 Effects of different treatments on sensory quality of fresh-cut cabbage
注:图中不同小写字母代表在5%水平上显著差异(下同)。
表3 1-MCP结合生物保鲜剂处理对鲜切甘蓝色差的影响
Table 3 Effect of 1-MCP combined with biological preservative on color difference of fresh cut cabbage

色差处理组0 d3 d6 d9 d12 dL∗CK43.63±1.79a46.55±2.84a57.66±1.46a61.86±1.45a70.70±0.82aF40.99±0.96b45.72±1.57a51.80±1.10b57.94±1.92b64.38±1.30b1-MCP45.64±0.87a45.73±1.28a50.68±2.10b55.48±1.31b61.06±2.71b1-MCP-F44.69±1.03a45.39±2.30a48.88±1.05b51.89±1.19c53.62±1.60ca∗CK-0.62±0.16a -0.54±0.22a -0.48±0.07a -0.24±0.02b 1.04±0.09bF-1.10±0.16a-0.84±0.20a-0.59±0.10ab0.61±0.08a1.24±0.03a1-MCP-0.83±0.15a-0.79±0.21a-0.84±0.12b-0.43±0.10bc0.09±0.05c1-MCP-F-0.87±0.17a-0.67±0.15a-0.68±0.10ab-0.60±0.07c-0.38±0.05db∗CK16.57±1.25a17.21±1.63a18.61±1.32a28.47±0.82a30.82±1.19aF17.26±0.60a18.80±1.85a19.34±1.60a20.29±1.71b24.01±1.46b1-MCP16.44±1.49a19.82±0.95a20.64±1.51a21.76±2.04b22.73±1.30b1-MCP-F16.13±1.14a17.97±1.54a19.21±1.83a20.53±1.92b21.45±1.28bΔECK 0±0.00a 2.37±0.55a 4.37±2.75ab 2.51±0.86b 2.27±2.69aF0±0.00a2.93±2.28a3.10±1.72b11.49±2.24a10.23±2.37b1-MCP0±0.00a3.46±2.68a5.07±2.97ab8.76±3.64a5.60±2.29b1-MCP-F0±0.00a4.98±3.69a8.31±2.69a3.97±1.6b11.21±4.12a
2.4 1-MCP结合生物保鲜剂处理对鲜切甘蓝营养成分的影响
2.4.1 1-MCP结合生物保鲜剂处理对鲜切甘蓝维生素C含量的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝维生素C含量的影响见图3。由图3可知,整个贮藏期间,各个处理组鲜切甘蓝维生素C含量呈现下降趋势,其中CK组下降最快。3 d时,各组处理之间无明显差别;6~12 d期间1-MCP-F处理组鲜切甘蓝维生素C含量下降缓慢,其含量显著高于其他处理组(P<0.05);12 d时,各处理组鲜切甘蓝维生素C含量大小排序为1-MCP-F>F>1-MCP>CK,其中1-MCP-F处理组鲜切甘蓝维生素C含量最高为43.49 mg/100 g。由此说明,1-MCP结合生物保鲜剂处理可有效延缓鲜切甘蓝维生素C含量的下降。
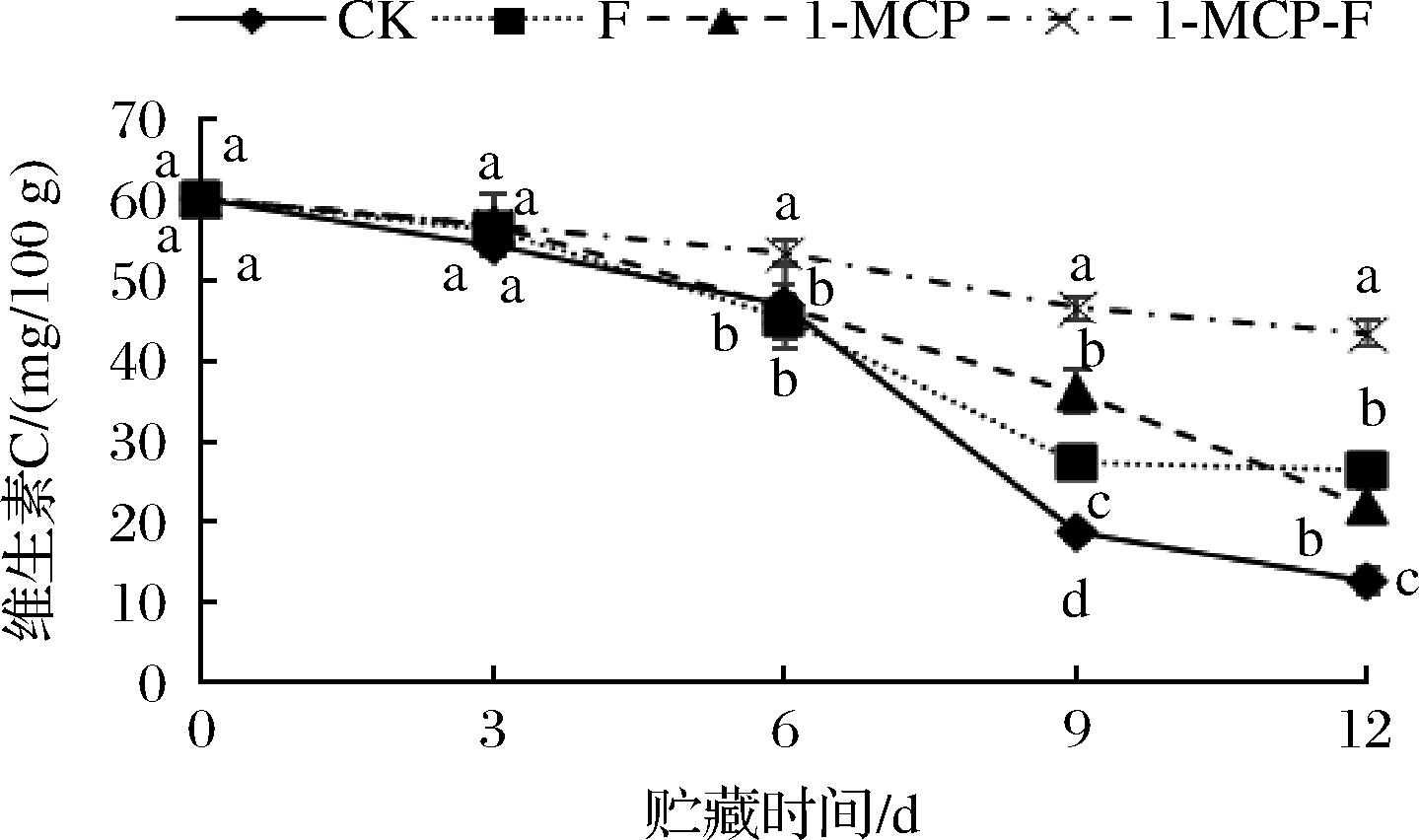
图3 1-MCP结合生物保鲜剂处理对鲜切甘蓝维生素C 含量的影响
Fig.3 Effect of 1-MCP combined with biological preservative on vitamin C content of fresh cut cabbage
2.4.2 1-MCP结合生物保鲜剂处理对鲜切甘蓝还原糖含量的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝还原糖含量的影响如图4所示。在整个贮藏期间鲜切甘蓝还原糖含量总体呈现下降趋势,1-MCP-F处理组鲜切甘蓝还原糖含量显著高于其他处理组(P<0.05)。CK组在贮藏期间还原糖含量下降幅度最大,12 d时CK组还原糖含量最低为17.72 mg/g,仅为初始时的66.94%;1-MCP结合生物保鲜剂处理相比生物保鲜剂处理、1-MCP处理对延缓鲜切甘蓝还原糖含量下降效果更好。

图4 1-MCP结合生物保鲜剂处理对鲜切甘蓝还原糖含量的影响
Fig.4 Effect of 1-MCP combined with biological preservative on reducing sugar content of fresh cut cabbage
2.4.3 1-MCP结合生物保鲜剂处理对鲜切甘蓝叶绿素含量的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝叶绿素含量的影响见图5。如图5-a所示,随着贮藏时间的延长,各处理组鲜切甘蓝叶绿素a含量均呈下降趋势,整个贮藏期间1-MCP-F处理组叶绿素a含量均高于CK、F、1-MCP处理组。12 d时,1-MCP-F组叶绿素a含量为9.35 mg/kg,显著高于CK与保鲜剂组(P<0.05)。图5-b为保鲜期间鲜切甘蓝叶绿素b含量变化情况,随着时间延长,所有处理组叶绿素b含量同样呈下降趋势,其中CK组显著低于其他组(P<0.05);12 d时,CK组叶绿素b含量仅为8.03 mg/kg,保鲜剂、1-MCP、1-MCP-F组叶绿素b含量分别为12.26、17.87、19.01 mg/kg,1-MCP-F处理组叶绿素b含量显著高于CK和F组。

a-叶绿素a;b-叶绿素b
图5 1-MCP结合生物保鲜剂处理对鲜切甘蓝叶绿素 含量的影响
Fig.5 Effect of 1-MCP combined with biological antistaling agent on chlorophyll content of fresh-cut cabbage
2.5 1-MCP结合生物保鲜剂处理对鲜切甘蓝生理指标的影响
2.5.1 1-MCP结合生物保鲜剂处理对甘蓝呼吸强度的影响
1-MCP结合生物保鲜剂处理对甘蓝呼吸强度的影响见图6。由图6可知,各处理组鲜切甘蓝呼吸强度呈先升高后降低的趋势,CK组呼吸强度在贮藏期间始终高于其他处理组。贮藏时间为3 d时,各处理组鲜切甘蓝出现呼吸峰值,CK组鲜切甘蓝呼吸强度为525.42 mg/(kg·h)显著高于其他处理(P<0.05),1-MCP组鲜切甘蓝呼吸强度最低,为337.52 mg/(kg·h);12 d时,CK组鲜切甘蓝呼吸强度急剧升高,显著高于其他处理组(P<0.05),分析原因可能是由于鲜切甘蓝严重腐烂所导致,1-MCP-F组鲜切甘蓝呼吸强度最低,为267.93 mg/(kg·h),但与F、1-MCP处理组无显著差异。
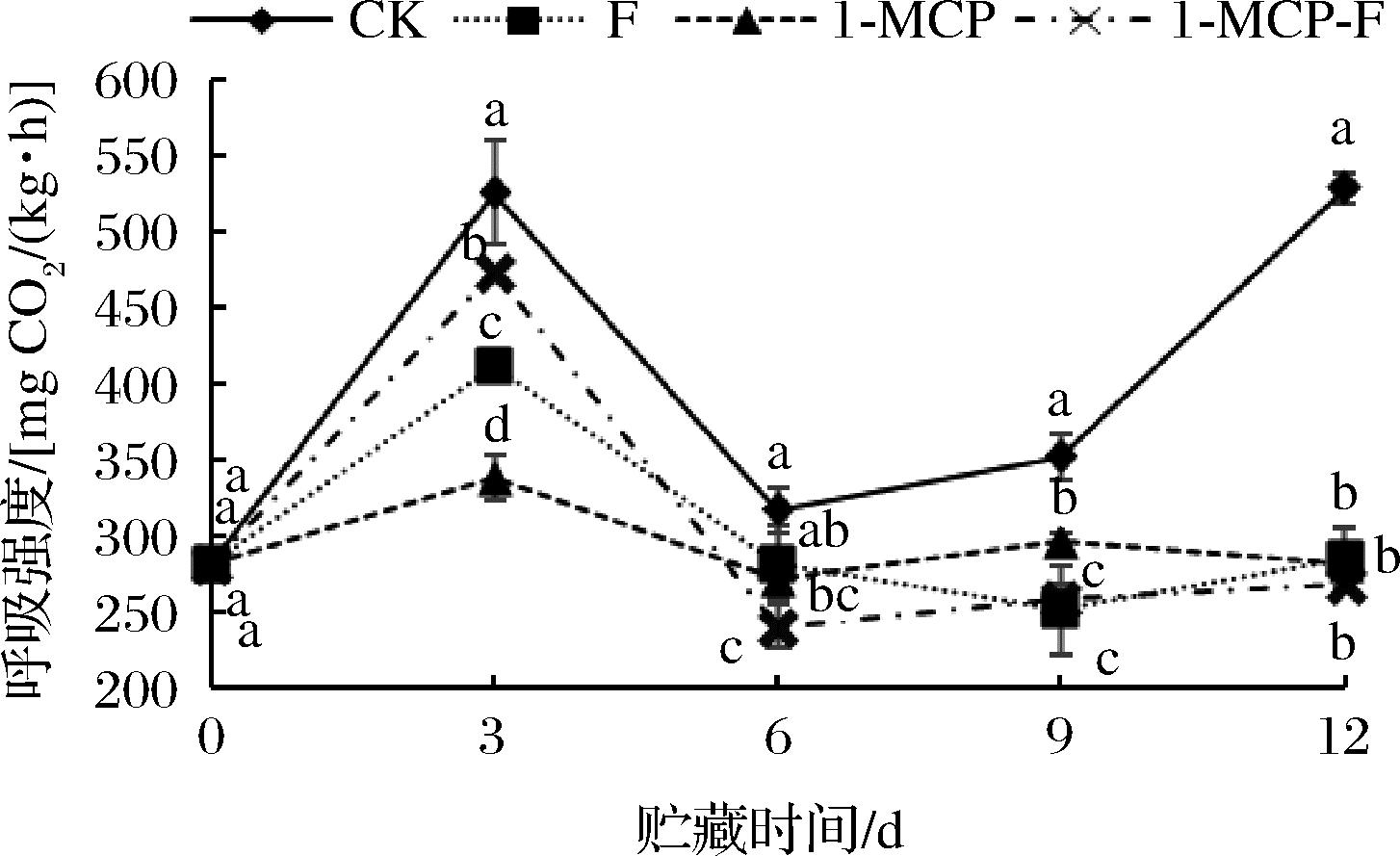
图6 1-MCP结合生物保鲜剂处理对甘蓝呼吸强度的影响
Fig.6 Effects of 1-MCP combined with biological preservative on respiratory intensity of fresh cut cabbage
2.5.2 1-MCP结合生物保鲜剂处理对甘蓝乙烯生成速率的影响
1-MCP结合生物保鲜剂处理对甘蓝乙烯生成速率的影响如图7所示。由图7可知,在贮藏期间,所有处理组乙烯生成速率呈先上升后下降的趋势。9 d时,各组均出现乙烯峰值,CK组、F处理组、1-MCP处理组、1-MCP-F处理组鲜切甘蓝乙烯生成速率峰值分别为26.46、23.65、24.78、25.41 μL/(kg·h);12 d时CK组、F组、1-MCP组、1-MCP-F处理组鲜切甘蓝乙烯生成速率分别下降至20.25、17.08、16.42、15.77 μL/(kg·h),1-MCP-F组鲜切甘蓝乙烯生成速率最低,且显著低于CK组和F处理组(P<0.05),与1-MCP处理组无明显差异。由此可说明,1-MCP处理和1-MCP结合生物保鲜剂处理对抑制鲜切甘蓝乙烯生成速率效果较好。
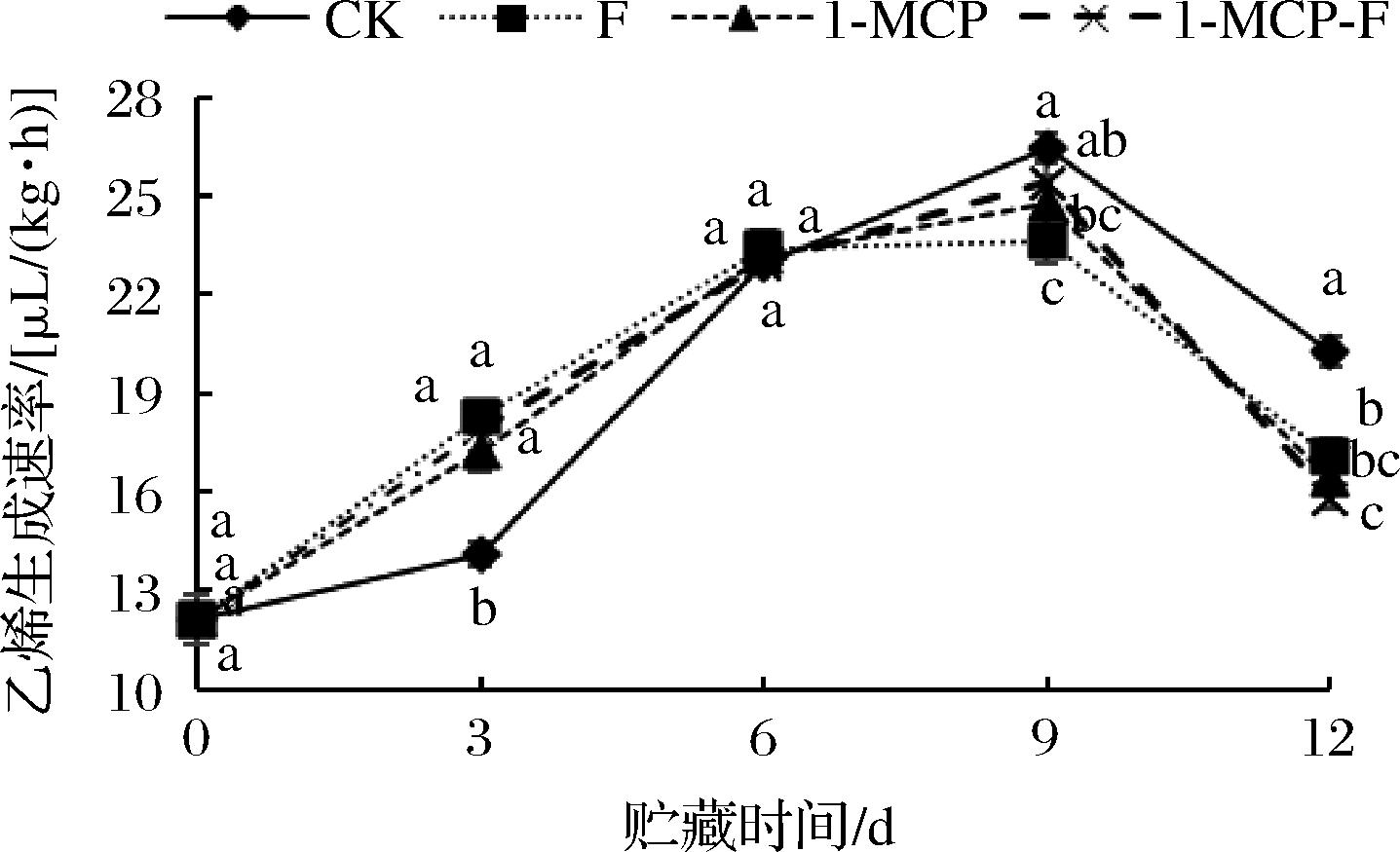
图7 1-MCP结合生物保鲜剂处理对鲜切甘蓝乙烯生成速率的影响
Fig.7 Effect of 1-MCP combined with biological preservative on ethylene production rate of fresh cut cabbage
2.6 1-MCP结合生物保鲜剂处理对鲜切甘蓝衰老指标及相关酶的影响
2.6.1 1-MCP结合生物保鲜剂处理对相对电导率的影响
1-MCP结合生物保鲜剂处理对相对电导率的影响见图8。由图8可知,CK组和其他处理组在整个贮藏期间鲜切甘蓝相对电导率持续上升。12 d时,CK组、F处理组、1-MCP处理组、1-MCP-F处理组鲜切甘蓝相对电导率分别为48.06%、27.82%、23.47%、21.07%,相对电导率由大到小排序依次为CK组>F组>1-MCP组>1-MCP-F组,1-MCP-F处理组鲜切甘蓝相对电导率显著低于CK组、F组、1-MCP组(P<0.05)。结果表明,随着贮藏时间的延长,各组鲜切甘蓝的细胞膜皆受到不同程度的损伤,但经1-MCP结合生物保鲜剂处理能较好抑制鲜切甘蓝的相对电导率的增加。
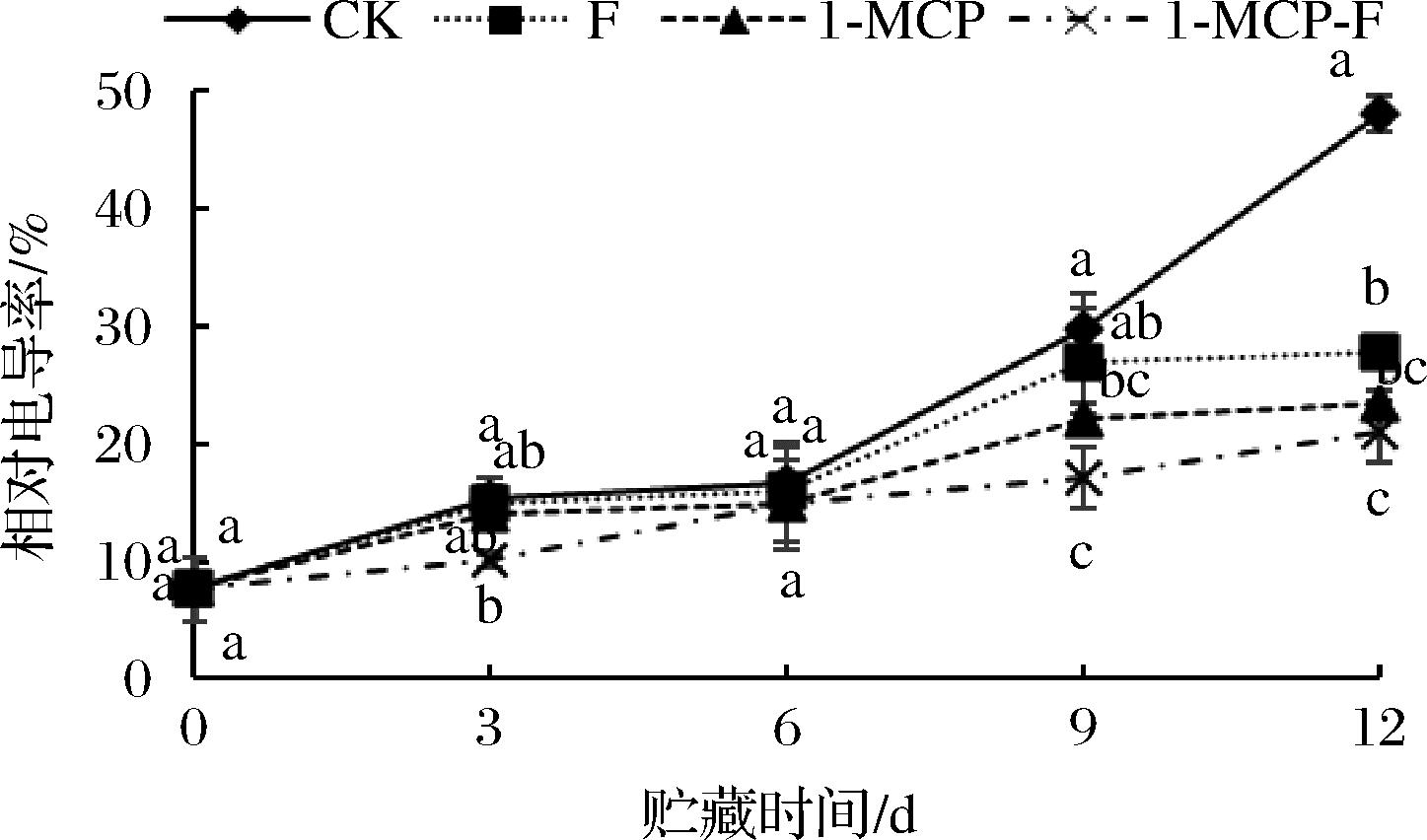
图8 1-MCP结合生物保鲜剂处理对鲜切甘蓝相对 电导率的影响
Fig.8 Effect of 1-MCP combined with biological preservative on relative conductivity of fresh cut cabbage
2.6.2 1-MCP结合生物保鲜剂处理对鲜切甘蓝MDA含量的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝MDA含量的影响见图9。由图9可知,整个贮藏期间所有处理组鲜切甘蓝MDA含量呈上升趋势,CK组鲜切甘蓝MDA含量上升速率高于其他处理组,1-MCP-F处理组鲜切甘蓝MDA含量上升最缓慢。12 d时,CK组鲜切甘蓝MDA含量最高为0.288 μmol/g,1-MCP-F组鲜切甘蓝MDA含量最低为0.165 μmol/g,1-MCP-F组鲜切甘蓝MDA含量显著低于CK组(P<0.05)。由此可知,1-MCP结合生物保鲜剂处理可有效抑制鲜切甘蓝MDA的上升,保持细胞膜完整性及膜透性。
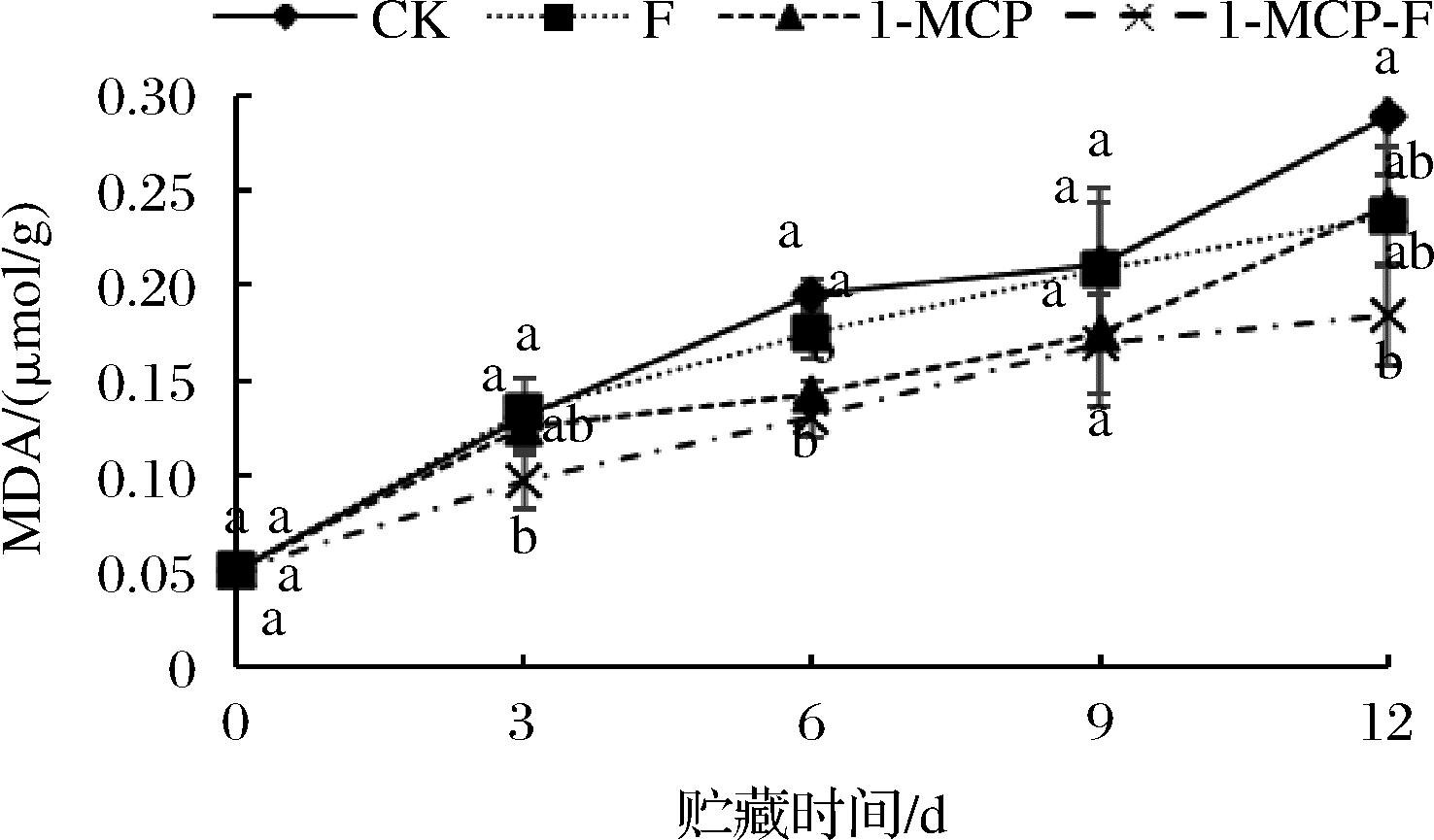
图9 1-MCP结合生物保鲜剂处理对鲜切甘蓝MDA 含量的影响
Fig.9 Effect of 1-MCP combined with biological preservative on MDA content of fresh cut cabbage
2.6.3 1-MCP结合生物保鲜剂处理对鲜切甘蓝PPO活性的影响
PPO能催化酚类物质形成褐色的醌类物质,在果蔬褐变中起重要作用。1-MCP结合生物保鲜剂处理对鲜切甘蓝PPO活性的影响如图10所示,随着贮藏时间的不断延长,CK组鲜切甘蓝PPO活性上升最快,1-MCP-F处理组PPO活性上升速率缓慢。12 d时CK组、F组、1-MCP处理组、1-MCP-F处理组PPO活性分别为0.272、0.245、0.253、0.242 U/g。1-MCP-F处理组PPO活性最低,CK组鲜切甘蓝PPO活性显著高于F组、1-MCP处理组、1-MCP-F处理组(P<0.05),但各处理组之间PPO活性差异不显著。
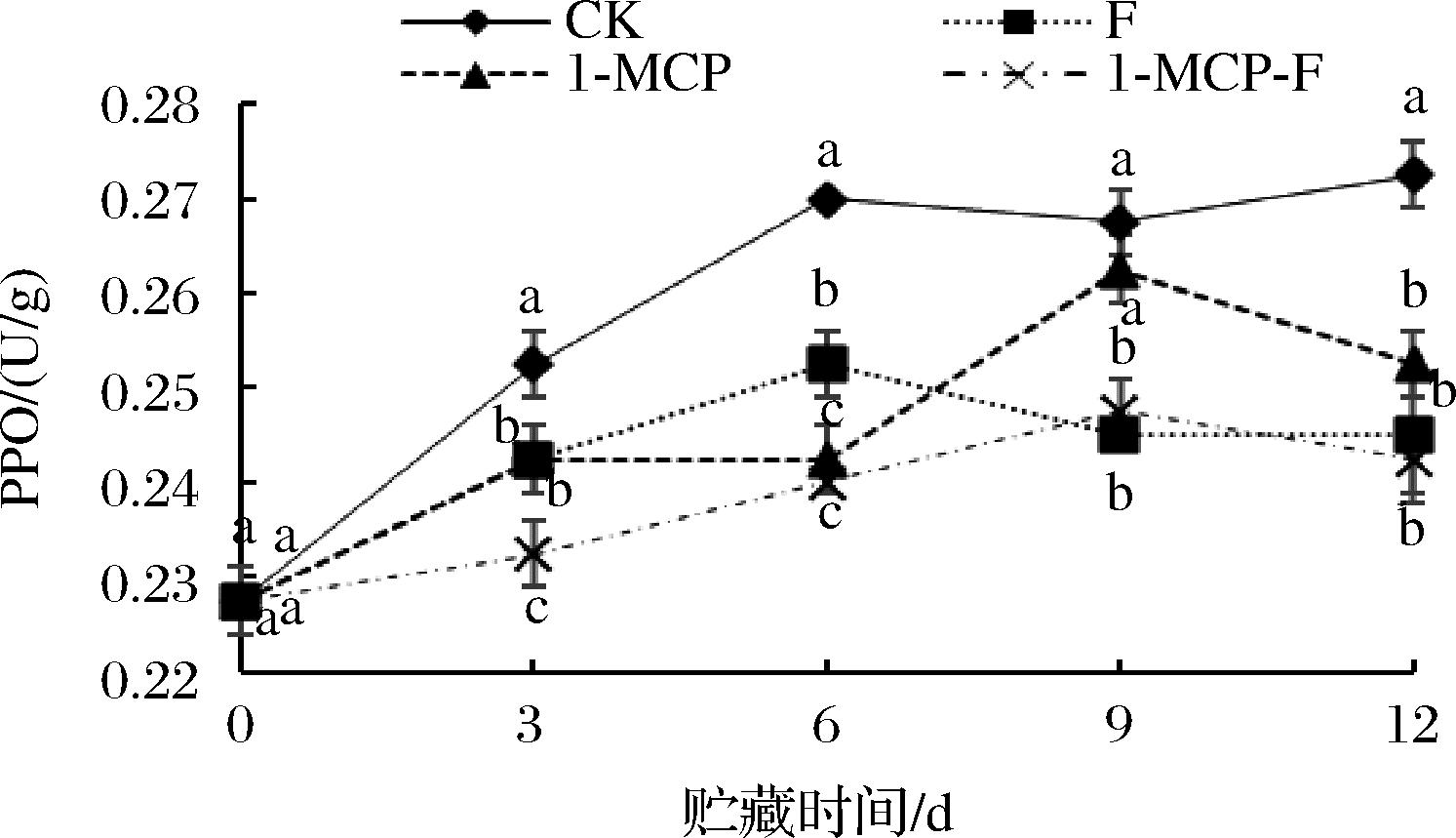
图10 1-MCP结合生物保鲜剂处理对鲜切甘蓝PPO 活性的影响
Fig.10 Effect of 1-MCP combined with biological preservative on PPO activity of fresh cut cabbage
2.6.4 1-MCP结合生物保鲜剂处理对鲜切甘蓝POD活性的影响
1-MCP结合生物保鲜剂处理对鲜切甘蓝POD酶活性的影响如图11所示。图11为鲜切甘蓝贮藏期间POD活性的变化趋势。在整个贮藏期间,鲜切甘蓝POD活性呈先上升后下降的趋势,分析原因可能是因为鲜切甘蓝面对逆境时自身抗氧化系统激活,使POD活性提升,后期随着鲜切甘蓝呼吸强度增加,营养物质损失严重,氧化胁迫增加,无力支撑抗氧化系统,POD活性下降。CK组鲜切甘蓝POD活性在贮藏3 d时达到峰值,显著(P<0.05)高于其他组,其他处理组均能够推迟鲜切甘蓝POD活性峰值的出现,在6 d 时出现峰值;12 d时,1-MCP-F组鲜切甘蓝POD酶活性最低为142.2 U/g,1-MCP-F处理组鲜切甘蓝POD活性显著低于其他组(P<0.05)。
2.6.5 1-MCP结合生物保鲜剂处理对鲜切甘蓝CAT活性的影响
CAT能够在机体遭遇胁迫时直接清除H2O2,将H2O2分解为H2O和O2。CAT活性增加是克服多余H2O2对代谢组织伤害的适应特征。1-MCP结合生物保鲜剂处理对鲜切甘蓝CAT活性的影响见图12。由图12可知,在整个贮藏期,CK组鲜切甘蓝CAT活性的下降趋势显著高于其他处理组(P<0.05),1-MCP-F处理组鲜切甘蓝CAT活性下降幅度最为缓慢。12 d时,CK组鲜切甘蓝CAT活性最低为13.61 U/g,1-MCP-F处理组鲜切甘蓝CAT活性最高为40.56 U/g。由此可说明1-MCP结合生物保鲜剂处理可以抑制鲜切甘蓝CAT活性降低。
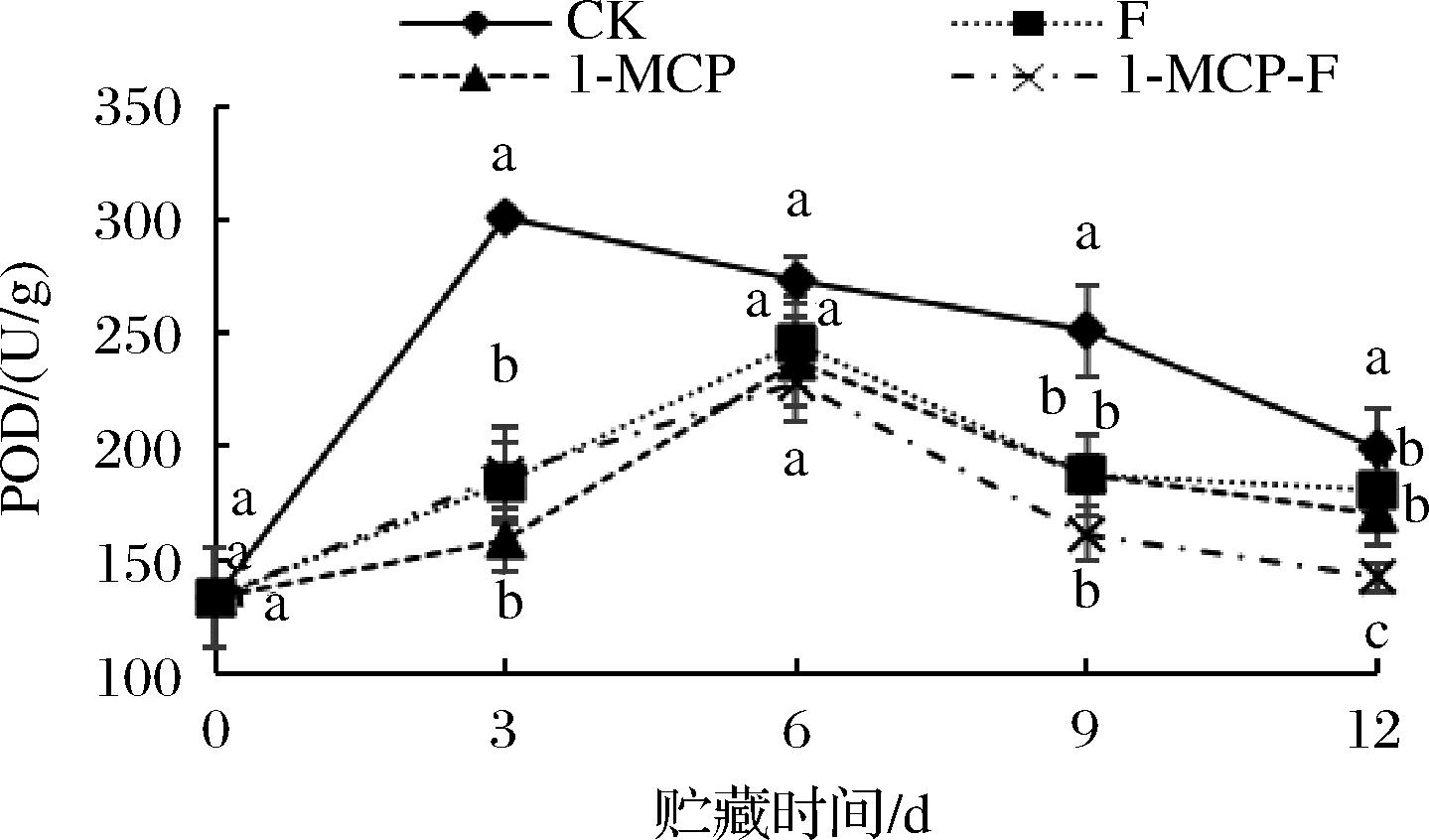
图11 1-MCP结合生物保鲜剂处理对鲜切甘蓝POD活性的影响
Fig.11 Effect of 1-MCP combined with preservative on POD activity of fresh cut cabbage
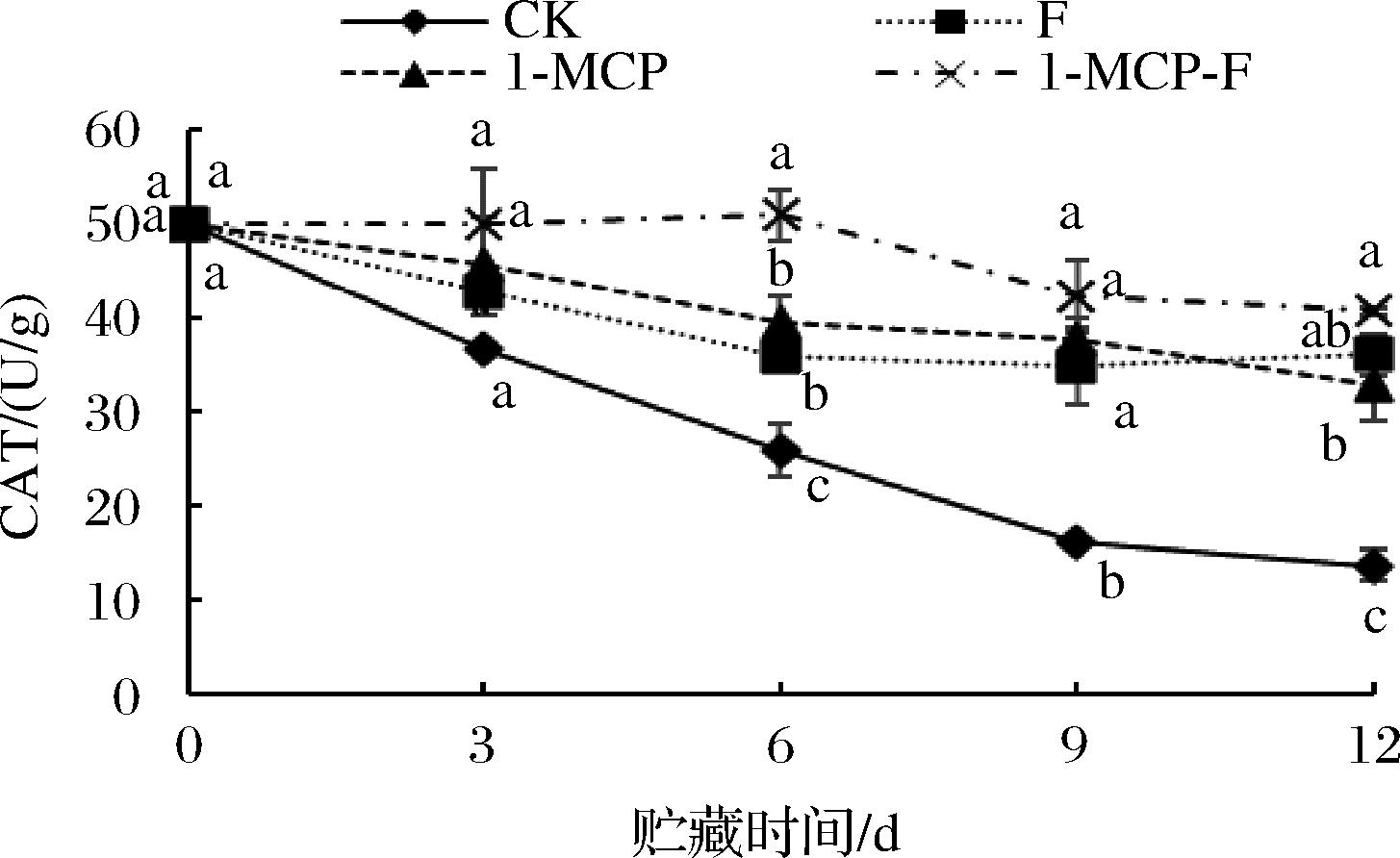
图12 1-MCP结合生物保鲜剂处理对鲜切甘蓝CAT活性的影响
Fig.12 Effects of 1-MCP combined with biological preservative on CAT activity of fresh cut cabbage
3 结论与讨论
甘蓝经鲜切加工后通常表现为呼吸速率和乙烯释放速率加快、营养物质流失、质地变软和产生黄化褐变等现象[19]。1-MCP作为一种乙烯受体抑制剂,可以阻断乙烯的合成反应,明显降低果蔬的腐烂率,更好地保持果蔬的贮藏品质。巴良杰等[20]研究了1-MCP结合60Co-γ辐照对蓝莓贮藏期品质的影响,实验结果表明,采后用1 μL/L 1-MCP+1.5 kGy辐照处理对蓝莓保鲜效果最好,在感官品质、含水率、总酚含量、总黄酮含量、维生素C含量和α-葡萄糖苷酶抑制率等指标效果均好于对照组及其他处理组。胡花丽等[21]采用多变量统计分析评价1-甲基环丙烯对牛心甘蓝贮藏特性的影响,实验结果表明,1-MCP对叶绿素、总硫代葡萄糖苷、叶酸、抗坏血酸、DPPH自由基清除率及羟自由基清除率、丙二醛和亚硝酸盐均有影响。WANG等[22]对聚丙烯包装和1-MCP延缓金针菇软化、木质化及相关酶基因转录水平进行了研究,结果表明,1-MCP处理与聚丙烯包装配合使用能显著控制金针菇的软化和木质化,1-MCP处理和聚丙烯包装的组合可以有效地影响金针菇木质化和软化相关酶基因的表达。本实验中,1-MCP结合生物保鲜剂处理组与其他处理组相比,抑制维生素C、还原糖、叶绿素a、叶绿素b含量的下降效果更好,12 d时其含量为对照的346%、122%、251%、237%;降低了鲜切甘蓝呼吸强度和乙烯生成速率峰值,实验结果表明,1-MCP结合生物保鲜剂可有效抑制鲜切甘蓝黄化,保持鲜切甘蓝的贮藏品质,与相关文献结论相类似。
通过测定酶促反应及抗氧化相关酶(POD、PPO、CAT)的活性发现,随着贮藏期的延长,POD、PPO活性呈升高趋势,CAT活性呈降低趋势,分析原因可能是POD和PPO参与了酶促褐变反应,而CAT则可能是由于贮藏后期鲜切甘蓝衰老变质导致其活性下降。而 1-MCP结合生物保鲜剂处理可有效抑制POD、PPO活性的升高,CAT活性的降低,并且有效抑制相对电导率、MDA含量的上升,延缓鲜切甘蓝衰老。徐超等[23]对不同贮藏期马铃薯块茎鲜切后货架品质变化规律进行了研究,研究发现随着马铃薯贮藏期的延长,除苯丙氨酸解氨酶(phenylalanineammonialyase,PAL)活性外,其鲜切产品酶促褐变相关酶活性均呈升高趋势,且在马铃薯贮藏后期的鲜切产品中表现活跃,这可能与PPO和POD参与酶促褐变反应以及4CL和C4H参与苯丙烷类代谢物的生物合成有关,而PAL活性下降可能是贮藏后期马铃薯块茎衰老导致其在鲜切产品中活性下降。唐娟等[24]研究了采前CaSO4处理对甘蓝芽苗菜贮藏过程中的抗氧化酶和生物活性物质的影响,研究发现CAT活性在果蔬贮藏中的变化与果蔬种类有很大关系,在不同果蔬中的变化趋势不同,具体原因还有待于进一步研究。王佳宇等[25]研究了不同切分方式对鲜切花椰菜品质和抗氧化活性的影响,结果表明PPO含量的升高是由于果蔬受到切割伤害后,细胞膜系统会遭受到破坏,造成区域化接触所致,进而会发生酶促褐变,导致酚类物质氧化分解。这些研究结果与本实验结果基本一致。
综上所述,生物保鲜剂、1-MCP、1-MCP结合生物保鲜剂这3种不同处理方式均能对鲜切甘蓝起到保鲜效果,且1-MCP结合生物保鲜剂贮藏保鲜效果最好,实验结果可为鲜切甘蓝保鲜提供新思路及技术支撑。
[1] 董欣瑞, 张珮, 袁楚珊, 等. 1-MCP联合乙烯吸附剂处理对黄桃果实冷害与糖代谢的影响[J]. 中国食品学报, 2022, 22(9):208-216.
DONG X R, ZHANG P, YUAN C S, et al. Effects of 1-MCP combined with ethylene adsorbent on chilling injury and sugar metabolism of peach fruit[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(9):208-216.
[2] HU H L, ZHAO H H, ZHANG L G, et al. The application of 1-methylcyclopropene preserves the postharvest quality of cabbage by inhibiting ethylene production, delaying chlorophyll breakdown and increasing antioxidant capacity[J]. Scientia Horticulturae, 2021, 281:109986.
[3] 李光荣, 刘欢, 张文祥, 等. 生物保鲜剂结合物理技术在果蔬保鲜中应用的研究进展[J]. 食品工业科技, 2021, 42(12):383-388. LI G R, LIU H, ZHANG W X, et al. Progress of bio-preservatives combined with physical technologies in fruits and vegetables preservation[J]. Science and Technology of Food Industry, 2021, 42(12):383-388.
[4] GRZEGORZEWSKA M, BADE EK E, SZCZECH M, et al. The effect of hot water treatment on the storage ability improvement of fresh-cut Chinese cabbage[J]. Scientia Horticulturae, 2022, 291:110551.
EK E, SZCZECH M, et al. The effect of hot water treatment on the storage ability improvement of fresh-cut Chinese cabbage[J]. Scientia Horticulturae, 2022, 291:110551.
[5] KIM Y E, MIN S C. Inactivation of Salmonella in ready-to-eat cabbage slices packaged in a plastic container using an integrated in-package treatment of hydrogen peroxide and cold plasma[J]. Food Control, 2021, 130:108392.
[6] TAKUNDWA B A, BHAGWAT P, PILLAI S, et al. Antimicrobial efficacy of nisin, oregano and ultrasound against Escherichia coli O157∶H7 and Listeria monocytogenes on lettuce[J]. LWT, 2021, 139:110522.
[7] 吴欣蔚. 真空预冷同步结合气调技术对叶类蔬菜保鲜的研究[D]. 广州: 华南理工大学, 2017.
WU X W. Study on preservation of leaf vegetables by vacuum cooling synchronously coupled with modified atmosphere technique[D]. Guangzhou: South China University of Technology, 2017.
[8] 林丽莎. 1-MCP处理延缓采后芙蓉李果实后熟衰老及其生理机制研究[D]. 福州: 福建农林大学, 2015.
LIN L S. Studies on 1-MCP delaying ripening and senescence of harvested’Furong’ plum fruit and its physiological mechanism[D]. Fuzhou: Fujian Agriculture and Forestry University, 2015.
[9] 纪淑娟, 熊振华, 程顺昌, 等. 1-MCP和CO2自发释放处理对西兰花常温货架期的保鲜作用[J]. 食品与发酵工业, 2014, 40(2):202-206.
JI S J, XIONG Z H, CHENG S C, et al. Effects of spontaneous release 1-MCP and CO2 on the quality of broccolis during shelf life[J]. Food and Fermentation Industries, 2014, 40(2):202-206.
[10] 徐茂军, 马卫兴, 华士川. 钼蓝比色法测定食品中的还原型维生素C[J]. 食品与发酵工业, 1993, 19(5):38-41.
XU M J, MA W X, HUA S C. Determination of vitamin C in food by molybdenum blue spectrophotometry[J]. Food and Fermentation Industries, 1993, 19(5):38-41.
[11] 郭敏亮. 3, 5-二硝基水杨酸比色法测定还原糖[J]. 江苏农学院学报, 1990, 11(2):40.
GUO M L. Colorimetric determination of reducing sugar with 3, 5-dinitrosalicylic acid[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 1990, 11(2):40.
[12] 关文强, 张怡, 刘莉莉, 等. 不同颜色菜花生长过程中抗氧化活性与成分的变化研究[J]. 华北农学报, 2013, 28(6):186-191.
GUAN W Q, ZHANG Y, LIU L L, et al. Primary study on antioxidant compounds and pigments during floret development of cauliflower with different color[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(6):186-191.
[13] 康丹丹, 张鹏, 李江阔, 等. 相温贮藏对采后兰州百合冷藏期间品质的影响[J]. 食品与发酵工业, 2020, 46(24):175-181.
KANG D D, ZHANG P, LI J K, et al. Effects of phase temperature storage on post-harvest quality of Lanzhou lily during cold storage[J]. Food and Fermentation Industries, 2020, 46(24):175-181.
[14] 张建超, 张鹏, 田世平, 等. 苹果霉心病无损检测研究进展[J]. 包装工程, 2020, 41(1):23-30.
ZHANG J C, ZHANG P, TIAN S P, et al. Research progress in nondestructive detection technology of apple core rot[J]. Packaging Engineering, 2020, 41(1):23-30.
[15] 张清航, 张永涛. 植物体内丙二醛(MDA)含量对干旱的响应[J]. 林业勘查设计, 2019(1):110-112.
ZHANG Q H, ZHANG Y T. Study on response to drought stress of MDA content in plants[J]. Forest Investigation Design, 2019(1):110-112.
[16] 王清章, 刘怀超, 孙颉. 莲藕贮藏中褐变度及多酚氧化酶活性的初步研究[J]. 中国蔬菜, 1997(3): 4-6.
WANG Q Z, LIU H C, SUN J. Study on browning degree (B. D) and polyphenoloxidase (P. P. O) activity of lotus rhizome during the storage[J]. China Vegetables, 1997(3): 4-6.
[17] 李忠光, 龚明. 愈创木酚法测定植物过氧化物酶活性的改进[J]. 植物生理学通讯, 2008, 44(2):323-324.
LI Z G, GONG M. Improvement of guaiacol method for determination of plant peroxidase activity[J]. Plant Physiology Communications, 2008, 44(2):323-324.
[18] 蔡慧. 不同处理对软枣猕猴桃采后生理生化变化的影响[D]. 长春: 吉林农业大学, 2012.
CAI H. Effect of different treatments on fruit physiological and biochemical changes of Actinidia arguta[D]. Changchun: Jilin Agricultural University, 2012.
[19] 王丹, 鲁榕榕, 马越, 等. 切分方式对鲜切紫甘蓝营养品质和挥发性风味物质的影响[J]. 食品科学技术学报, 2020, 38(4):27-36; 62.
WANG D, LU R R, MA Y, et al. Effect of cutting direction on nutritional quality and volatile flavor substances of fresh-cut purple cabbage[J]. Journal of Food Science and Technology, 2020, 38(4):27-36; 62.
[20] 巴良杰, 罗冬兰, 曹森, 等. 1-MCP结合60Co-γ辐照对蓝莓贮藏期品质的影响[J]. 北方园艺, 2019(8):118-124.
BA L J, LUO D L, CAO S, et al. Effects of 1-MCP combined with 60Co-γ irradiation on the quality of blueberry during storage[J]. Northern Horticulture, 2019(8):118-124.
[21] 胡花丽, 赵欢欢, 罗淑芬, 等. 多变量统计分析评价1-甲基环丙烯对牛心甘蓝贮藏特性的影响[J]. 食品与发酵工业, 2020, 46(16):208-214.
HU H L, ZHAO H H, LUO S F, et al. Evaluation the effect of 1-methylcyclopropene on storage characteristic of heart-shaped cabbage based on multivariate statistical analysis[J]. Food and Fermentation Industries, 2020, 46(16):208-214.
[22] WANG W J, LI Y, LI F H, et al. Polypropylene crisper and 1-MCP delay the softening, lignification and transcription levels of related enzyme genes of golden needle mushrooms (Flammulina velutipes)[J]. Journal of Integrative Agriculture, 2022, 21(1):249-260.
[23] 徐超, 赵雅琦, 王清, 等. 不同贮藏期马铃薯块茎鲜切后货架品质变化规律[J]. 食品与发酵工业, 2022, 48(9):208-215.
XU C, ZHAO Y Q, WANG Q, et al. Shelf quality changes of fresh-cut potatoes during storage[J]. Food and Fermentation Industries, 2022, 48(9):208-215.
[24] 唐娟, 许可心, 朱英莲, 等. 采前CaSO4处理对甘蓝芽苗菜采后品质的影响[J]. 中国食品学报, 2019, 19(6):193-200.
TANG J, XU K X, ZHU Y L, et al. Effect of preharvest CaSO4 treatment on quality in postharvest cabbage sprouts[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(6):193-200.
[25] 王佳宇, 管玉格, 王怡, 等. 切分方式对鲜切花椰菜品质和抗氧化活性的影响[J]. 包装工程, 2022, 43(3):87-95.
WANG J Y, GUAN Y G, WANG Y, et al. Effects of cutting styles on quality and antioxidant activity of fresh-cut cauliflower[J]. Packaging Engineering, 2022, 43(3):87-95.