肉类食品是人类饮食的重要组成部分,也是世界上最大的食物消费之一。我国的肉制品加工产量早在2016年就达到1亿t,占世界总产量的30%,是世界上最大的肉类加工国之一。现在年消费量稳步上升[1]。同时,我国是与美国和巴西同时排行第一的肉制品消费国,肉类总消费量达8 500万t,占世界肉类消费总量的30%。
中国食肉的历史源远流长,方式多种多样,但大多采用传统腌制方式保存。传统腌制肉制品是指将畜禽的生肉加入盐(或卤水)和香料腌制,并在适当的温度条件下经过风干、熟化等工序,最终形成独特的腌制风味。我国加工品种较多,代表产品有金华火腿、宣威火腿、广式腊肠、腊肉等[2]。与此同时,随着经济的发展,人们对于健康也越来越关注,传统肉制品的安全性也开始被越来越多地提及。
生物活性肽是由大约2~20个通过肽键连接的氨基酸组成的短聚合物。在食物中,它们是无活性的,是前体蛋白的一部分。但由于其是食品加工(发酵、老化、酶促加工)或消化过程而释放的,活性肽可以影响身体的许多生理功能,如抗氧化剂、抗菌、抗癌、抗血栓、抗糖尿病、免疫调节和益生菌[3]。近些年的研究发现,在传统腌制火腿中存在很多活性肽,胡亚亚等[4]证实金华火腿粗肽中的400~1 000 Da的粗肽,具有很强的抗氧化能力;左庆翔[5]通过体内与体外实验证实了金华火腿的NLLPP、DEP、DAVLPA这3条活性肽具有降血压效果;郑锦晓等[6]通过体外实验发现宣威火腿中QYYNGEEHVRFDSDVGEYR具有抗菌的效果;吴宝森等[7]也通过体外实验证实了诺邓火腿具有一定的抗氧化能力。
通过测定不同时期干腌牛肉粗肽的DPPH自由基清除率、羟自由基清除率、超氧阴离子自由基清除率和ABTS阳离子自由基清除率来评定干腌牛肉中生物活性肽的抗氧化活性能力。测试了粗肽对于大肠杆菌、金黄色葡萄球菌和白色念珠菌的抑菌能力。并分离出了抗氧化能力较强的短肽。腌制肉制品是我国传统特色食品之一,该文研究了干腌牛肉加工过程中肽类物质的释放及其抗氧化、抑菌活性,对于科学认识干腌肉制品加工工艺的科学内涵具有一定的意义。
1 材料与方法
1.1 材料与试剂
材料:牛腱子,市售,购自永辉超市;食盐,购自永辉超市,淮盐牌。
试剂选择:ABTS、DPPH、1,10-菲咯啉,Sigma-Aldrich(上海)贸易有限公司;盐酸、无水乙醇、牛血清蛋白、氢氧化钠、邻二氮菲、过氧化氢、硫酸亚铁,上海凌峰化学试剂有限公司;1,1-二苯基-2-三硝基苯肼、三氯乙酸、谷胱甘肽(glutathione,GSH),上海阿拉丁试剂有限公司。所有其他化学品和试剂均为分析级。
1.2 仪器与设备
721 N可见光分光光度计,上海仪电分析仪器有限公司;多功能离心机,Eppendorf/艾本德;SHB-ⅢA环水式真空泵,上海聚昆仪器设备有限公司;ATY224精密电子天平,常州万泰天平仪器有限公司;UV-3600紫外可见近红外分光光度计,岛津企业管理(中国)有限公司;100~1 000 mL移液枪,Shanghai jiaan Analyzer Factory。
1.3 实验方法
1.3.1 样品处理
采用下述传统腌制牛肉方法腌制,将牛肉分切成300 g每份,按照5%食用盐,90%相对湿度,3~5 ℃,腌制5 d;随后12 ℃,80%相对湿度,腌制5 d;随后20 ℃,70%相对湿度,腌制7 d,体重下降45%;最后22.5 ℃下,腌制30 d。取样时间为腌制的第0、5、10、17、32、47天。
1.3.2 粗肽提取
提取方法根据ZHU等[8]进行修改。本实验采用盐酸提取法,剥去肉眼可见的脂肪和结缔组织,用匀浆机将50 g肌肉在250 mL 0.01 mol/L盐酸中匀浆。均质采用4次冲程,每次30 s,在冰水中冷却。匀浆在低温(12 000×g,4 ℃,20 min)下离心,快速定性滤纸过滤后,用3倍量乙醇变性沉淀上清液中的蛋白质组分。将混合物在4 ℃下放置20 min,然后再在4 ℃下以12 000×g离心20 min。然后,将混合物在50 ℃、55 r/min的旋转蒸发器中除去乙醇,然后冷冻干燥并贮存在-20 ℃中进行进一步检测。粗肽含量的测定参照徐娟等[9]方法,得到回归线方程为y=0.128 1x-0.000 2,R2=0.999 7,进而求得多肽含量,以下所有结果测试前均按此方法测定肽质量浓度并配制溶液。
1.3.3 粗肽的平均链长
平均链长采用严群芳[10]方法,稍加调整。茚三酮显色液配制:25 mL沸水中依次加入1 g茚三酮,1 g 维生素C,搅拌15 min后冷却,过滤后的沉淀用清水洗涤3次,干燥可得还原茚三酮。将170 mg茚三酮和30 mg还原茚三酮溶于20 mL乙醇中,即得茚三酮显色液。在1 mL粗肽液(1 mg/mL)中依次加入1 mL醋酸缓冲液和1 mL显色液,沸水浴15 min,冷却后加入3 mL乙醇,波长在570 nm处测吸光度A值。配制梯度浓度甘氨酸标准氨基酸溶液,绘制标准曲线,计算多肽含量,根据氨基酸平均分子质量计算多肽个数。
1.3.4 粗肽的氨基酸含量与形貌观察
为了探究消化系统对于粗肽液的影响,选用胃蛋白酶、胰蛋白酶处理粗肽。方法如下,将提取液用去离子水配质量浓度为1 mg/mL粗肽液,用1.0 mL HCl调节体系的pH值为2.0,加入4%(粗肽含量的4%,质量分数)胃蛋白酶,搅拌后37 ℃恒温反应2 h,取出沸水浴灭酶10 min,冷却后4 000 r/min离心15 min。取经胃蛋白酶处理后的粗肽液,用0.9 mol/L碳酸氢钠调pH值至5.3,再用1.0 mol/L氢氧化钠调至7.5,加入4%(粗肽含量的4%,质量分数)胰蛋白酶,搅拌后37 ℃恒温反应2 h,取出沸水浴灭酶10 min,冷却后4 000 r/min离心15 min,冷冻干燥。粗肽样品中加5%磺酸水杨酸沉淀蛋白(1∶4,g∶mL),用高速冰冻离心机在18 000 r/min转速下离心30 min,取上清液过保存,用0.45 μm+0.22 μm混合膜过滤后上机分析。
取质量5 mg的粗肽冻干粉,25 ℃进行圆二色谱测定,在190~260 nm,以1 nm间隔和1 nm带宽采集数据。
1.3.5 抗氧化测试
采用DPPH法和羟自由基清除法,研究了不同时期不同部位干腌牛肉活性肽在1 mg/mL质量浓度下的抗氧化能力,对照组为同质量浓度的GSH。
1.3.5.1 DPPH自由基清除率
根据LI等[11]方法,稍加修改。将不同腌制时期的提取物分别配制成质量浓度为1 mg/mL的粗肽液,以GSH作为对照组。将2 mL 0.2 mmol/L DPPH自由基溶液(95%乙醇溶解)加入2 mL样品,混匀,室温避光反应30 min,在517 nm波长处测样品吸光度。空白为2 mL样品加2 mL 95%乙醇,对照为2 mL DPPH加2 mL 95%乙醇,同样条件下测A517 nm。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中,As,Ab分别代表样品和空白的吸光度。
1.3.5.2 超氧阴离子自由基清除率
参照LIU等[12]方法并稍加修改。具体方法如下,无菌水配制质量浓度为1 mg/mL的粗肽液与GSH对照。1.5 mL粗肽液,依次加入0.5 mL 300 μmol/L氯化硝基四氮唑蓝(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 468 μmol/L还原型辅酶Ⅰ(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 60 μmol/L过硫酸氢钾(pH 8.0 Tris-HCl缓冲液配制),振荡混匀,25 ℃水浴5 min,560 nm波长测定吸光值,以缓冲液代替样品作为空白对照。超氧阴离子自由基清除率按公式(2)计算:
超氧阴离子自由基清除率![]()
(2)
式中:As,Ab分别代表样品和空白吸光度。
1.3.5.3 羟自由基清除率
参照LI等[11]的方法进行。混合物由4 mL 1,10-邻菲咯啉(5 mmol/L)和4 mL FeSO4(5 mmol/L)组成,然后加入3 mL磷酸盐缓冲液(pH 7.4),然后加入3 mL H2O2(0.01%)和4 mL粗肽(1 mg/mL)。最后,将混合物在36 ℃下放置1 h,在536 nm处测量吸光度。对照:用蒸馏水代替多肽溶液,其他试剂与样品相同。空白:用蒸馏水代替H2O2,其他试剂与样品相同。使用公式(3)确定结果:
羟自由基清除率![]()
(3)
式中:As,Ac和Ab分别代表样品、对照和空白的吸光度。
1.3.5.4 ABTS阳离子自由基清除率
根据ZHU等[8]所描述的方法进行。将5 mL 7 mmol/L ABTS溶液与88 μL 140 mmol/L过硫酸钾溶液混合,在20 ℃下放置20 h,加入约3倍75%(体积分数)乙醇,在734 nm波长处的吸光度为0.70±0.02,得到ABTS阳离子自由基。样品由9.8 mL稀释的ABTS阳离子自由基溶液和0.2 mL 1 mg/mL粗肽组成。以0.2 mL蒸馏水和9.8 mL稀释的ABTS阳离子自由基溶液的混合物为空白,以1 mg/mL粗肽0.2 mL和9.8 mL蒸馏水为对照。所有混合物在室温下放置0.5 h,用分光光度计在734 nm处测定。ABTS阳离子自由基清除活性如公式(4)所示:
ABTS阳离子自由基清除率![]()
(4)
式中:As,Ac和Ab分别表示样品、对照和空白的吸光度
1.3.6 抗氧化性能的稳定性研究
肽在被人体摄入后,消化部位的酸化,酶解以及盐分,都可能会对其稳定性产生影响,甚至失活。本研究主要研究成熟后的干腌牛肉食盐含量,温度,pH等因素对粗肽液抗氧化活性的影响。
1.3.6.1 食盐含量对于粗肽液抗氧化活性的影响
配制质量浓度1 mg/mL粗肽液,分别添加0.0%、2.0%、4.0%、6.0%、8.0%、10.0% (质量分数) NaCl,在121 ℃、0.1 MPa条件下加热15 min,冷却至室温,测定其DPPH自由基清除率、超氧阴离子自由基清除率和羟自由基清除率。
1.3.6.2 温度对于粗肽液抗氧化活性的影响
配制质量浓度1 mg/mL粗肽液,分别在25、40、60、80、100 ℃水浴2 h后,快速冷却至室温,测定其DPPH自由基清除率、超氧阴离子自由基清除率和羟自由基清除率。
1.3.6.3 pH对于粗肽液抗氧化活性的影响
配制质量浓度1 mg/mL粗肽液,分别在pH为3.0、5.0、7.0、9.0、11.0室温下放置1 h,然后将各溶液pH值调至7.0,测定其DPPH自由基清除率、超氧阴离子自由基清除率和羟自由基清除率。
1.3.7 抑菌率测试
测定粗肽液对金黄色葡萄球菌、O157型大肠杆菌、白色念珠菌的抑菌活性,测定结果以抑菌率表示。首先对粗肽液进行超滤处理,截留分子质量3 kDa以下的肽液进行冻干。使用PBS配制粗肽液,质量浓度为5 mg/mL。将O157型大肠杆菌、金黄色葡萄球菌、白色念珠菌培养至对数期,并用无菌生理盐水进行稀释,调整浓度为106 CFU/mL。按照体积比1∶4吸取细菌培养液500 mL与2 mL粗肽液(0.22 μm混合膜过滤)混合后加入实验管中,对照组为无菌磷酸盐缓冲溶液。然后进行培养,O157型大肠杆菌与金黄色葡萄球菌放于37 ℃恒温振荡器中振荡培养18 h,白色念珠菌放于28 ℃恒温振荡器中振荡培养48 h。取出拍照并记录菌落数。抑菌率采用公示(5)计算:
抑菌率![]()
(5)
式中:实验组为加粗肽液组,对照组为未加粗肽液组。
1.3.8 抗氧化肽分离鉴定
取适量样品用C18除盐柱进行除盐。根据抗氧化实验结果测试,选择干腌成熟的牛肉进行分离纯化,选择SephadexG-25和SephadexG-15分别进行2次分离纯化。SephadexG-25分离纯化条件:选择26 mm×1 m层析柱,蒸馏水经45 nm过滤后作为洗脱液进行洗脱,调节流速0.5 mL/min,每管收集5 mL洗脱液,分别进行抗氧化性能测试,选择抗氧化性能好的收集液进行SephadexG-15二次分离纯化并进行抗氧化性能测试,条件同SephadexG-25。
nano-HPLC-MS/MS分析:将样品经由配备在线纳喷离子源的LC-MS/MS分析。整套系统为串联EASY-nanoLC 1200的Q ExactiveTM Plus质谱仪(Thermo Fisher Scientific, MA, USA)。共上样5 μL样品(分析柱:Acclaim PepMap C18, 75 μm×25 cm),以60 min的梯度分离样品,柱流量控制在300 nL/min,柱温为40 ℃,电喷雾电压2 kV,梯度从2%的B相起始,在47 min以非线性梯度升高到35%,1 min内升高到100%,维持12 min。
质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS 采集间切换。质谱参数设置如下:a) MS:扫描范围(m/z):200~1 800;分辨率:70 000;AGC target:3e6;最大注入时间:50 ms;b)HCD-MS/MS:分辨率:17 500;AGCtarget:1e5;最大注入时间:45 ms;碰撞能量:28;动态排除时间:30 s。
1.4 数据分析与统计处理
实验中用Origin 2018绘图。使用Microsoft Excel 工作表来统计数据。
2 结果与分析
2.1 粗肽提取
由图1可知,在0~2.0 mg/mL的质量浓度范围内牛血清蛋白线性良好,线性标准方程为y=0.128 1x-0.000 2(R2=0.999 7);其中y为540 nm下的吸光度,x为牛血清蛋白的质量浓度(mg/mL)。
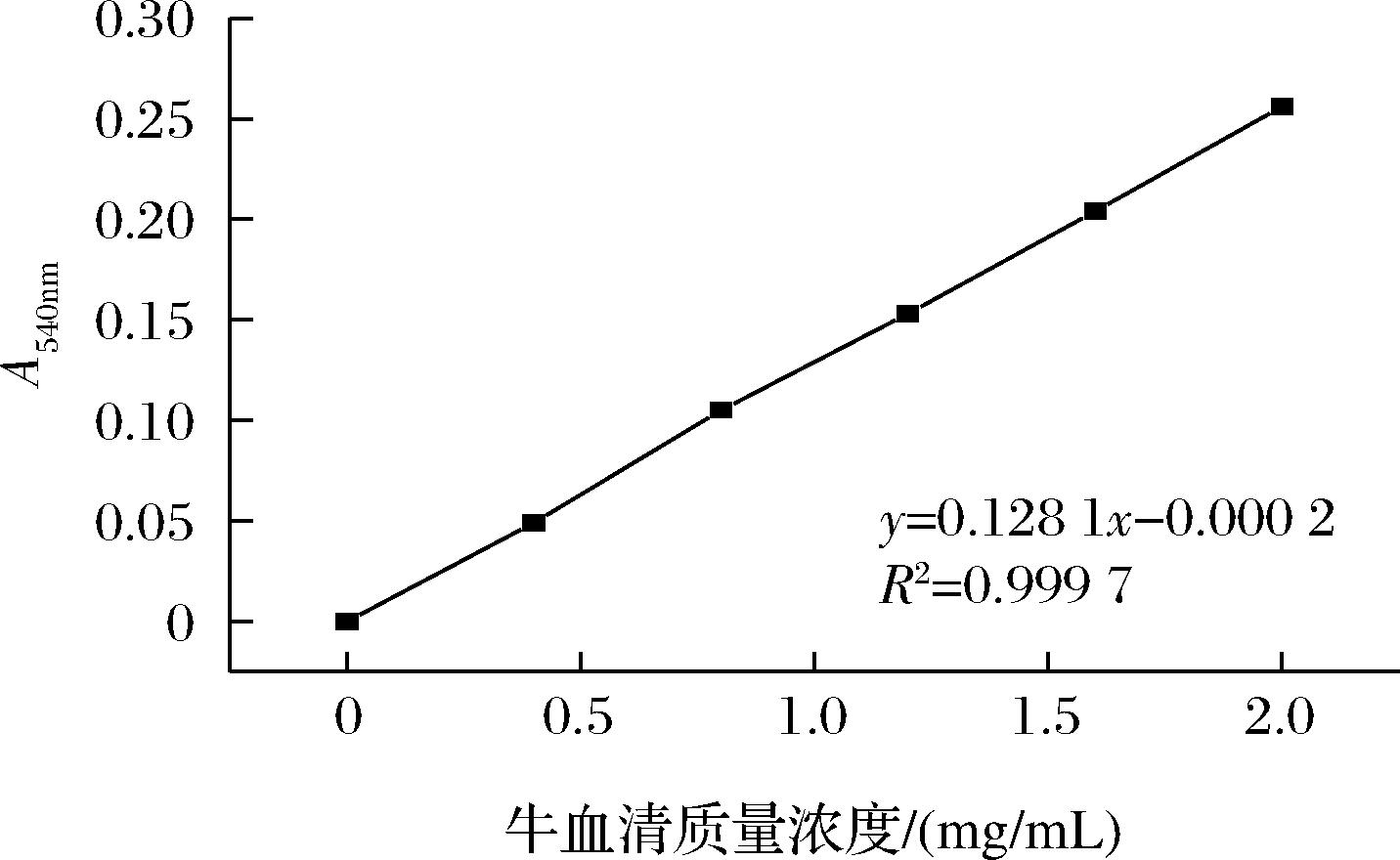
图1 牛血清蛋白标准曲线
Fig.1 Bovine serum protein standard curve
蛋白质在生物体内具有广泛的功能特性,可以形成网络和结构,并能与水、盐等成分协同作用,对肉的质地、感官和营养品质等的形成起着重要作用。肉类发酵过程中会发生蛋白质水解,肌动蛋白、肌球蛋白和胶原蛋白是肉类中的主要结构蛋白[13],首先是内源肽酶水解(主要为组织蛋白酶和钙激活蛋白酶)分解完整蛋白质生成小肽,外源肽释放将小肽进一步降解单氨基酸、二肽或三肽[14]。根据标准曲线计算不同加工时长样品中粗肽含量,如图2所示,未加工时期粗肽含量约为1.46 mg/mL,腌制47 d后粗肽含量约为1.72 mg/mL,相比增加了17.8%。粗肽含量随着腌制时长的延长而增加。
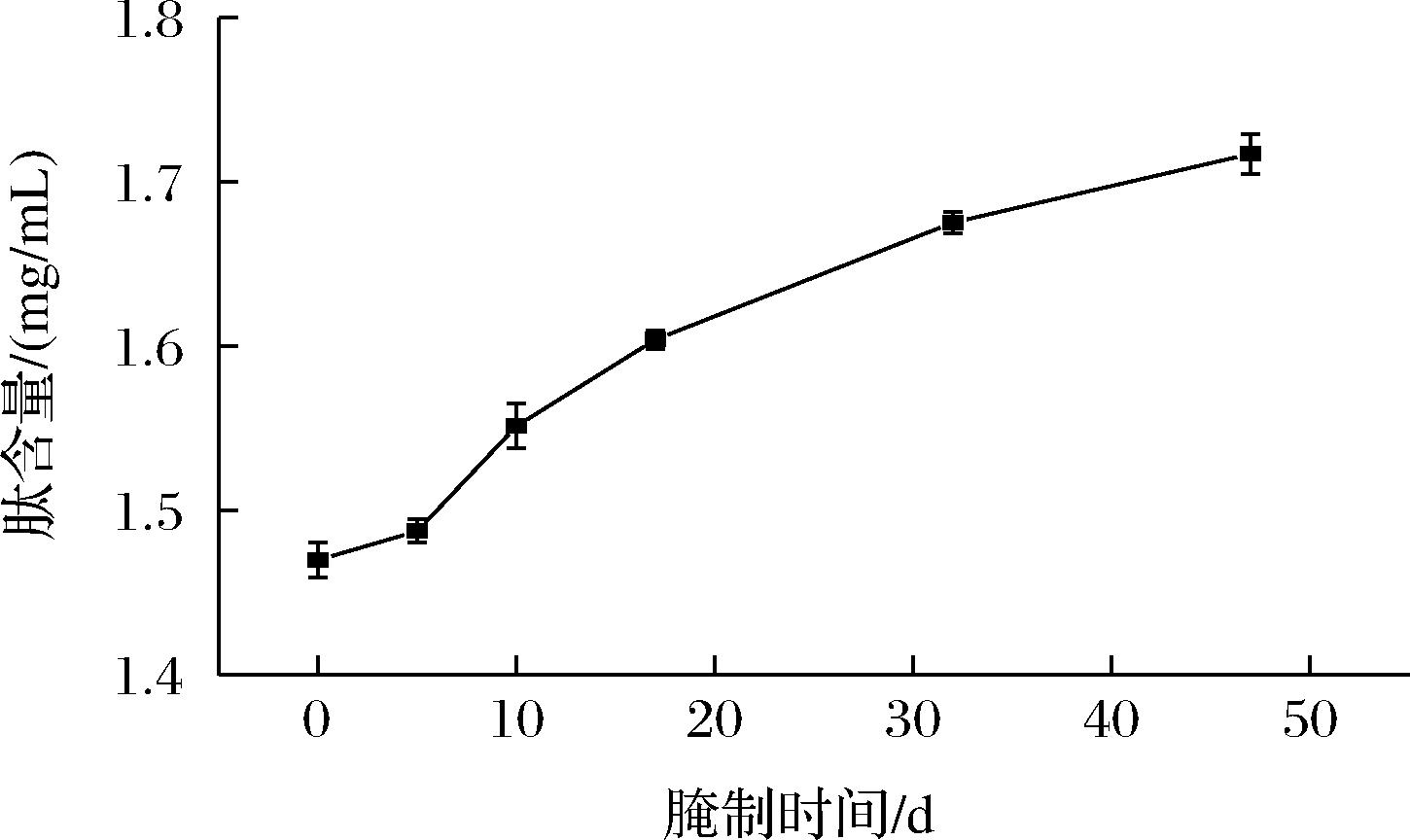
图2 不同时期肽含量
Fig.2 Peptide content in different periods
2.2 粗肽平均链长
甘氨酸标准曲线为y = 0.013 5x-0.015 4(R2=0.999 9),通过计算得出不同时期粗肽平均链长,见表1。
表1 不同时期粗肽平均链长以及肽链平均分子质量
Table 1 Average chain length of crude peptides and average molecular weight of peptide chains in different periods
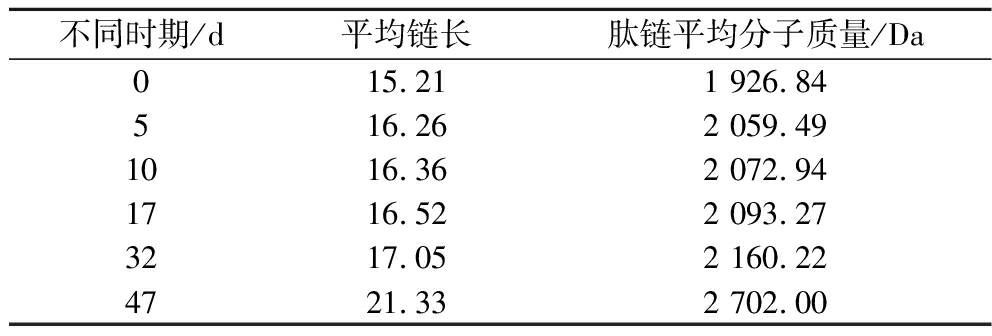
不同时期/d平均链长肽链平均分子质量/Da015.211 926.84516.262 059.491016.362 072.941716.522 093.273217.052 160.224721.332 702.00
粗肽为不同链长的多肽组成的混合物,由表1可知,不同加工时期的粗肽的平均链长为15.21、16.26、16.36、16.52、17.05和21.33。肽链平均分子质量分别为1 926.84、2 059.49、2 072.94、2 093.27、2 160.22、2 702.00 kDa。
2.3 粗肽的氨基酸含量与形貌观察
氨基酸的类型和组成的对于活性肽的抗氧化功能的影响的探究是必需的[15]。由于原料、酶以及制备条件的不同,抗氧化肽的氨基酸组成、序列以及结构也有所不同。迄今为止获得的抗氧化肽的分子质量大多为500~3 000 U,具有抗氧化能力的氨基酸主要包括酸性氨基酸、疏水性氨基酸、含硫氨基酸、芳香族氨基酸等[16]。LIU等[12]结果表明,含有酪氨酸的二肽具有较强的自由基清除能力。除疏水性氨基酸外,酸性氨基酸侧链的氨基和羧基可与金属离子螯合,钝化氧化金属离子,减少自由基链式反应的进行,从而发挥抗氧化作用。
3种不同处理方式的氨基酸成分见表2。3种粗肽液氨基酸含量分别为29.81、64.199、258.111 mg/mL,均高于牛肉的17.749 mg/mL。经过2 h胃蛋白酶消化后,氨基酸水解成小片段,而在胰蛋白酶作用下多肽被更彻底的水解。由表2可得出结论,疏水性氨基酸Val、Leu等在经过两段酶解处理后氨基酸含量显著增加,具有金属离子螯合能力的Met、Glu、Lys与Arg等同样显著增加。
表2 三种不同处理方式的氨基酸成分 单位:mg/mL
Table 2 Amino acid composition of three different treatments
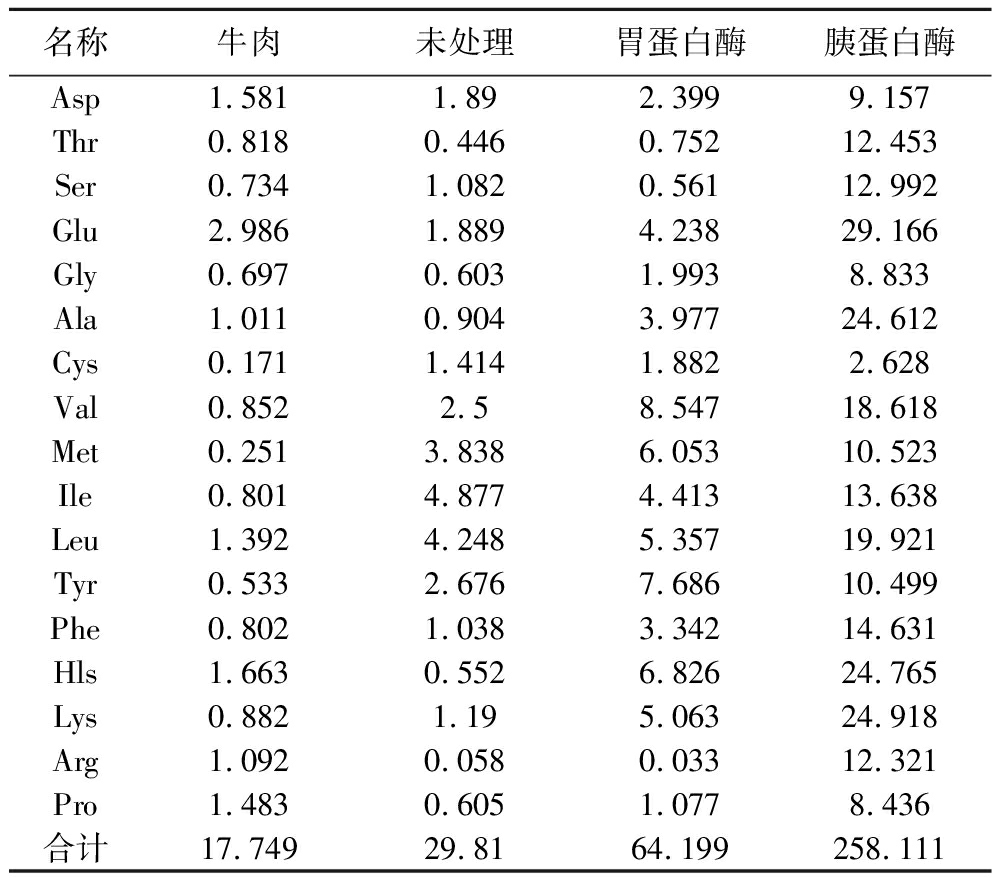
名称牛肉未处理胃蛋白酶胰蛋白酶Asp1.5811.892.3999.157Thr0.8180.4460.75212.453Ser0.7341.0820.56112.992Glu2.9861.8894.23829.166Gly0.6970.6031.9938.833Ala1.0110.9043.97724.612Cys0.1711.4141.8822.628Val0.8522.58.54718.618Met0.2513.8386.05310.523Ile0.8014.8774.41313.638Leu1.3924.2485.35719.921Tyr0.5332.6767.68610.499Phe0.8021.0383.34214.631Hls1.6630.5526.82624.765Lys0.8821.195.06324.918Arg1.0920.0580.03312.321Pro1.4830.6051.0778.436合计17.74929.8164.199258.111
活性肽的空间结构对其发挥抗氧化也有重要作用。CHEN等[17]研究指出肽的氨基酸序列和构象可能对肽的氧化有很大的影响。CHAN等[18]对于肌肽及其相关含组氨酸二肽淬灭自由基能力的电子自旋共振研究,也得出了类似的结论。圆二色谱的结果(图3)显示,粗肽在195、215 nm附近有吸收带,在205 nm 附近有较弱吸收带,进一步的统计分析证实,粗肽冻干粉的圆二色谱测试中,由24.10%的粗肽呈β-折叠,72.10%的粗肽呈反平行,12.80%的粗肽呈平行。
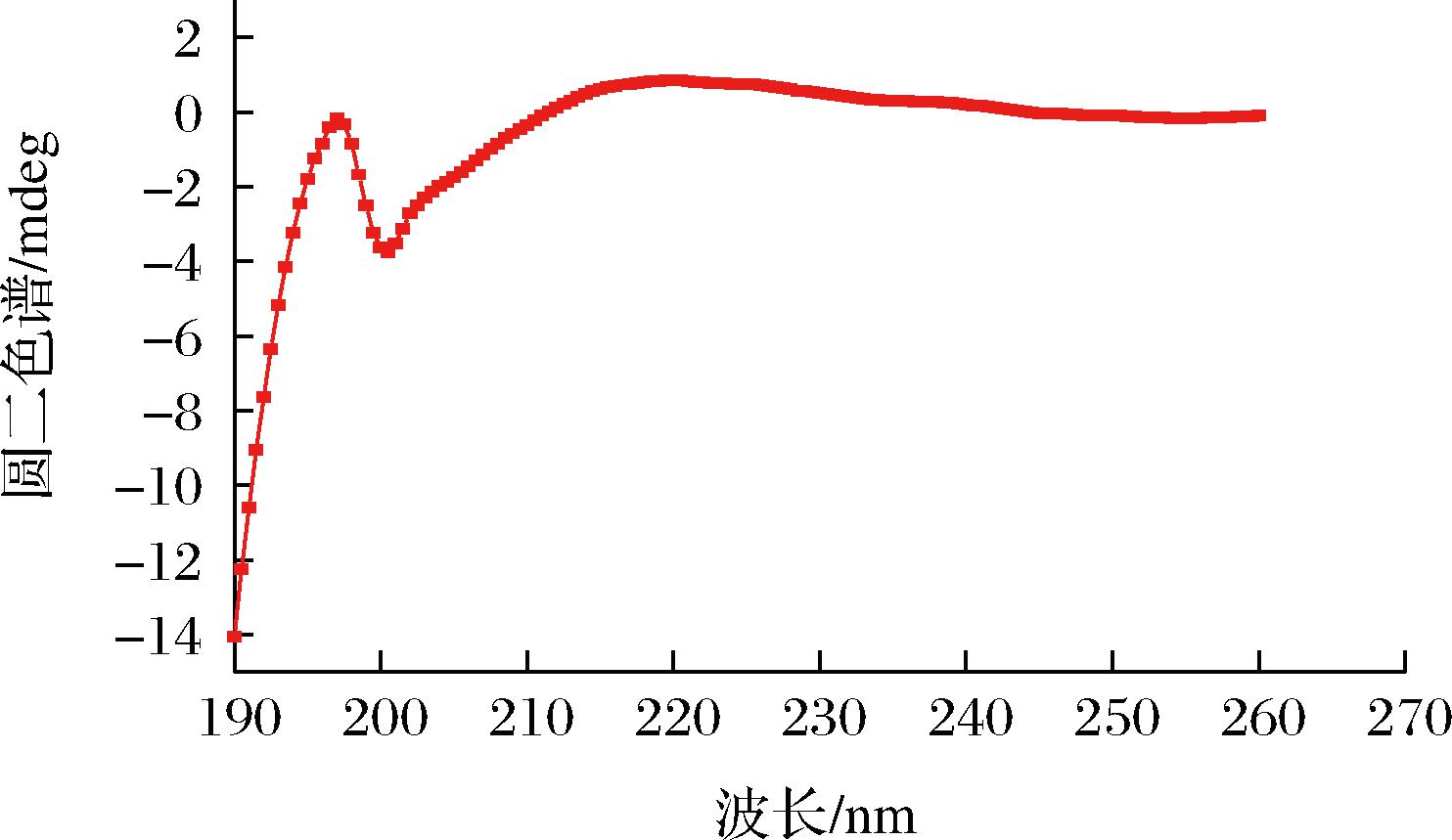
图3 粗肽圆二色谱
Fig.3 Crude peptide circular dichroism
2.4 抗氧化测试
抗氧化能力是发酵肉制品中生物活性肽最主要的功能特性,CASTELLANO等[19]发现经酸乳清腌制的发酵牛肉会释放大量生物活性肽,其中最主要的就是抗氧化功能肽,例如EKAGAHLKG。
DPPH法的原理是通过向DPPH自由基提供氢原子来测量抗氧化剂淬灭自由基的能力。干腌火腿中的色氨酸和酪氨酸具有良好的供氢能力,可以为自由基提供氢原子,从而形成稳定的苯氧基、吲哚等中间产物,可以减缓或终止自由基链式反应[20]。如图4-a所示,未处理前的粗肽1 mg/mL的DPPH自由基清除率约为68.03%,干腌结束后约为78.33%,同比增加了10.30%,但还是远低于同浓度GSH的95.87%。超氧阴离子自由基清除率、羟自由基清除率和ABTS阳离子自由基清除率也同样是测定抗氧化能力和还原能力的常用方法,通过测试发现,干腌结束后的超氧阴离子自由基清除率、羟自由基清除率和ABTS阳离子自由基清除率,分别为81.05%、26.89%和36.92%,相较于未腌制的增加了14.11%、9.89%和24.39%,依然低于同质量浓度的GSH。
2.5 粗肽抗氧化性能的稳定性研究
生物活性肽需要保持其特定结构的完整性才能发挥其生理功能,维持较高的生物活性。研究表明,生物活性肽在胃肠道中可被人体唾液、胃酸和蛋白酶消化后结构发生降解,导致其生物活性降低甚至丧失[15]。
2.5.1 NaCl对于粗肽液抗氧化活性的影响
由图5可以看出,随NaCl含量增加,DPPH自由基清除率先增加后减小。0%添加量时,DPPH自由基清除率约为75.74%;添加量增加到6%时,DPPH自由基清除率达到最高,约为81.91%;添加量增加10%时,DPPH自由基清除率又随之降低,约为74.85%。羟自由基清除率呈现下降趋势,0%添加量时,羟自由基清除率约为25.87%,随着NaCl添加量的增加,羟自由基清除率开始下降,10%添加量时约为12.06%,清除率最低,同比下降了13.81%。超氧阴离子自由基清除率随着NaCl添加量的增加呈先下降后增加趋势。0%添加量时,超氧阴离子自由基清除率最高约为84.42%;2%添加量时,超氧阴离子自由基清除率最低约为54.24%;而后随着NaCl添加量的增加,超氧阴离子自由基清除率开始上升,10%添加量时,超氧阴离子自由基清除率约为65.23%。
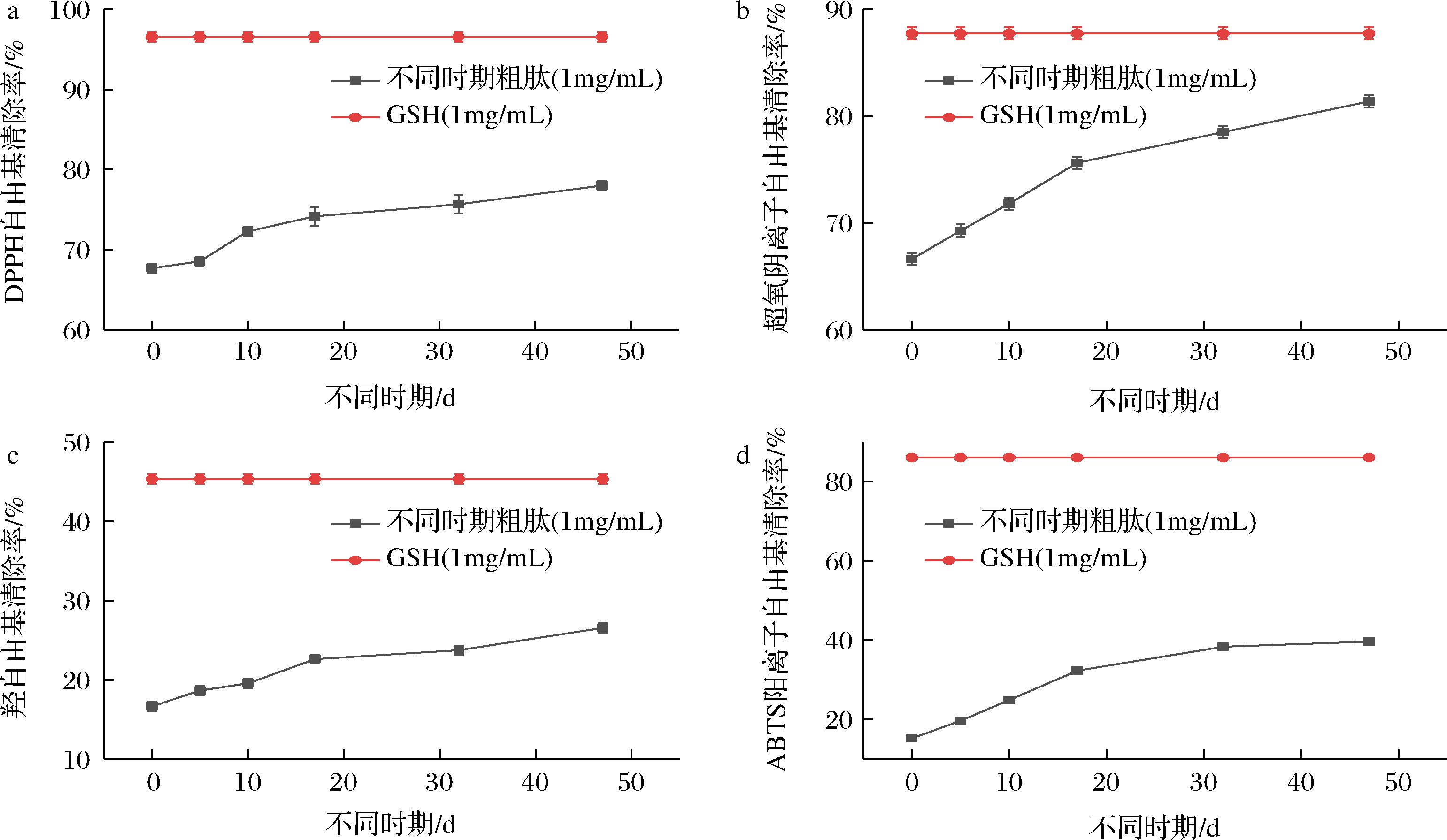
a-DPPH自由基清除率;b-超氧阴离子自由基清除率;c-羟自由基清除率;d-ABTS阳离子自由基清除率
图4 不同时期抗氧化能力
Fig.4 Antioxidant capacity in different periods
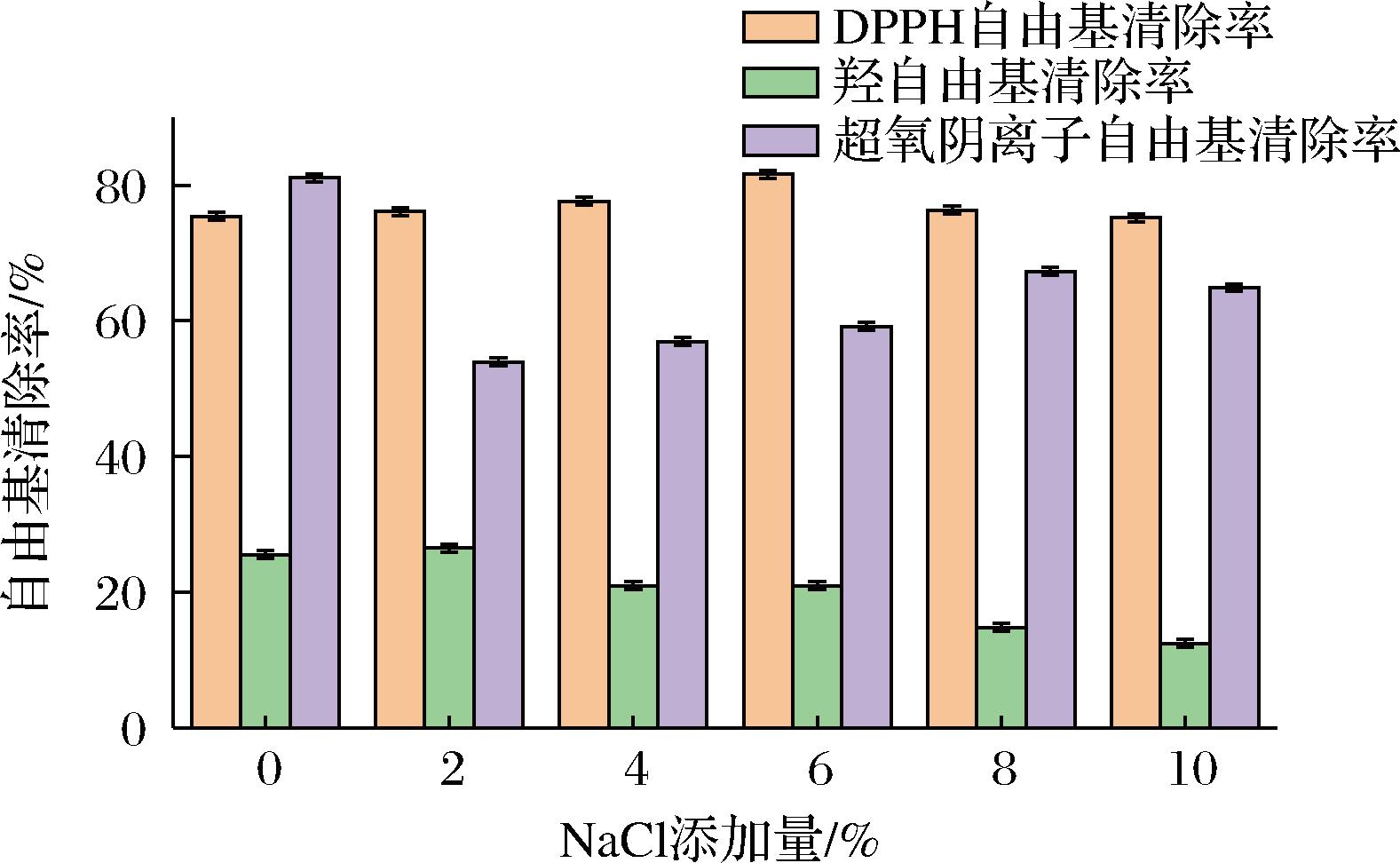
图5 NaCl添加量对粗肽液抗氧化活性的影响
Fig.5 Effect of NaCl on the antioxidant activity of crude peptide solution
2.5.2 温度对于粗肽液抗氧化活性的影响
由图6可以看出,随温度增加,抗氧化能力开始改变,呈现先增加后减小的趋势,25 ℃时,DPPH自由基清除率、羟自由基清除率和超氧阴离子自由基清除率约为63.55%、18.26%和72.87%;60 ℃时,清除率最高,约为73.94%、28.23%和79.86%;100 ℃时,自由基清除率最低,约为59.89%、12.58%和57.57%。
2.5.3 pH对于粗肽液抗氧化活性的影响
由图7可以看出,随pH增加,抗氧化能力开始改变,呈现先增加后减小的趋势,pH 3.0时,DPPH自由基清除率、羟自由基清除率和超氧阴离子自由基清除率约为58.25%、9.28%和31.14%;pH 7.0时,清除率最高,约为70.30%、24.41%和61.36%;pH 11.0时,自由基清除率最低,约为61.89%、15.01%和52.84%。
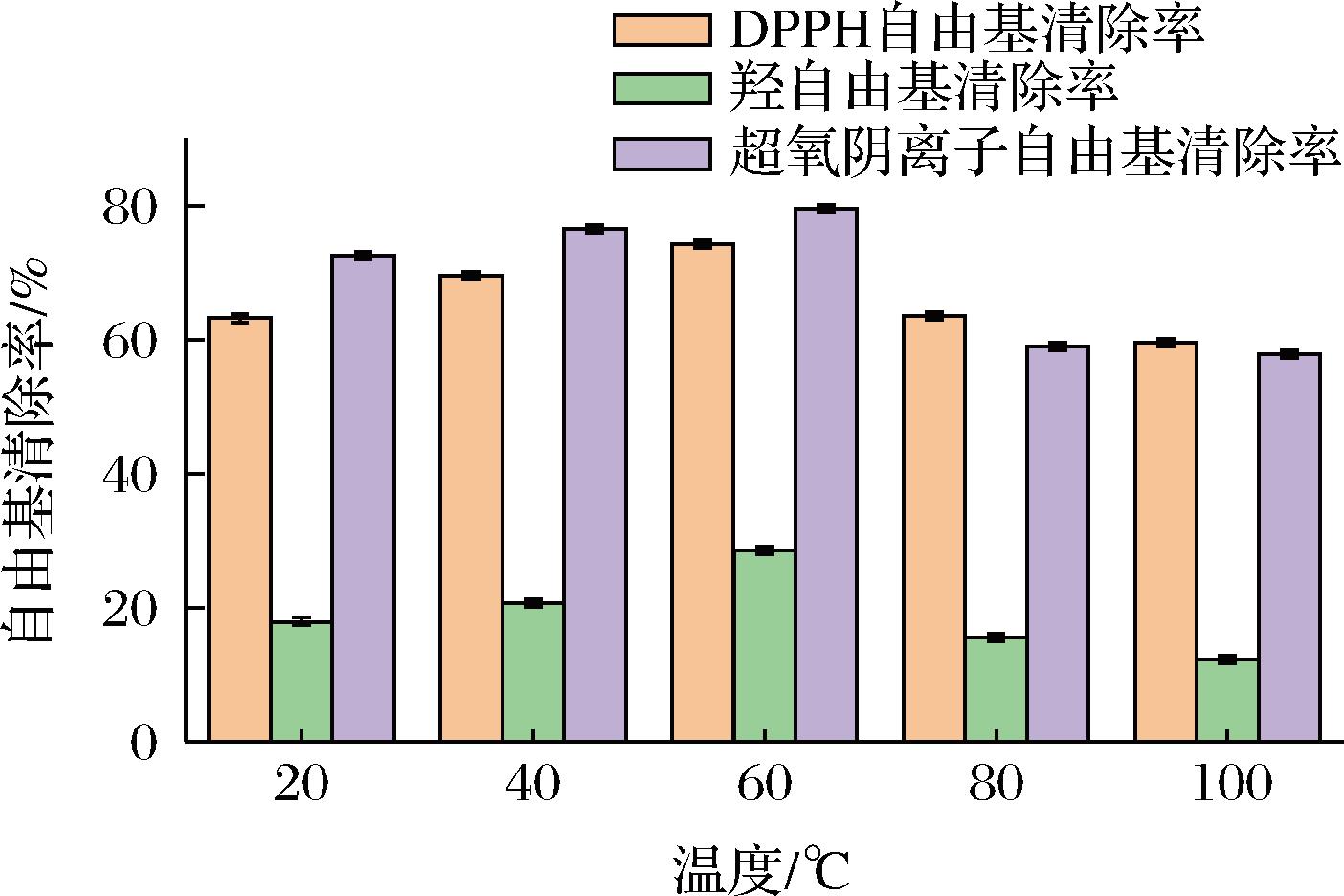
图6 温度对粗肽液抗氧化活性的影响
Fig.6 Effect of temperature on the antioxidant activity of crude peptide solution
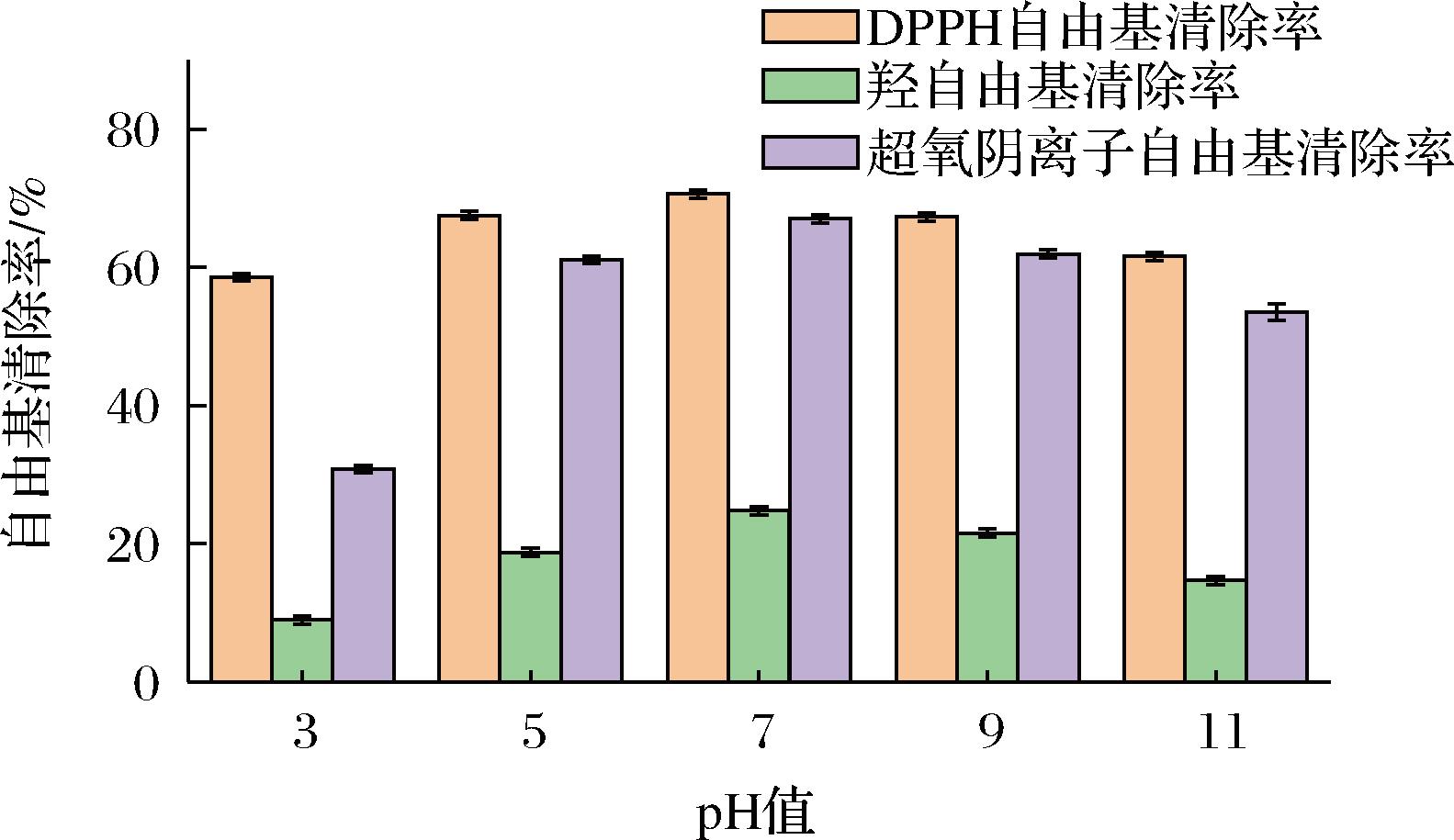
图7 pH对粗肽液抗氧化活性的影响
Fig.7 Effect of pH on the antioxidant activity of crude peptide solution
2.6 抑菌率测试
抗菌肽是生物活性肽的另一个重要性能。抗菌肽分布广泛,在复杂多细胞生物的进化中发挥重要作用,也是非常重要的防御细菌、真菌和病毒的武器[21]。郑锦晓等[6]分离比较了宣威火腿、金华火腿、如皋火腿粗多肽,结果表明,3种火腿均可抑制大肠杆菌的生长。CASTELLANO等[22]对西班牙火腿的抗菌肽进行提取、抑菌活性的测定以及纯化鉴定,结果表明RHGYM的抑菌活性最强。
经测试,结果如图8所示,5 mg/mL粗肽液可以有效抑制O517型大肠杆菌、金黄色葡萄球菌和白色念珠菌,经计算抑菌效果为75.45%、48.53%和44%。O517型大肠杆菌为革兰氏阴性菌,结构简单,一层肽聚糖构成细胞壁,粗肽通过复杂的机制抑制了靶细胞壁组分的合成或是对细胞壁结构造成破坏,从而降低了大肠杆菌的生长能力;金黄色葡萄球菌作为一种典型的革兰氏阳性菌,相较于O517大肠杆菌的细胞壁来说,更厚且结构紧密,不易破坏,致使粗肽难以破坏细胞壁发挥抑制作用;白色念珠菌作为一种典型的条件致病性真菌,对热的抵抗力不强,60 ℃加热1 h即可杀死,但对化学制剂、紫外线的抵抗力较强。

a-O157型大肠杆菌;b-金黄色葡萄球菌;c-白色念珠菌
图8 粗肽液(5 mg/mL)抑菌率
Fig.8 Bacterial inhibition rate of crude peptide solution (5 mg/mL)
注:上为实验组,下为对照组。
2.7 抗氧化肽分离鉴定
凝胶过滤色谱法是目前最广泛的多肽分离方法,该方法分离条件温和,回收率高,操作简单,基于样品分子质量大小达到分离效果。由表3可知,经由SephadexG-25分离后得到了6个组分,各组分性能差异较大,其中组分C抗氧化性能最好。质量浓度为1 mg/mL时抗氧化能力为69.33%、17.58%、65.52%。
表3 SephadexG-25分离组分抗氧化活性 单位:%
Table 3 Antioxidant activities of SephadexG-25 isolated fractions
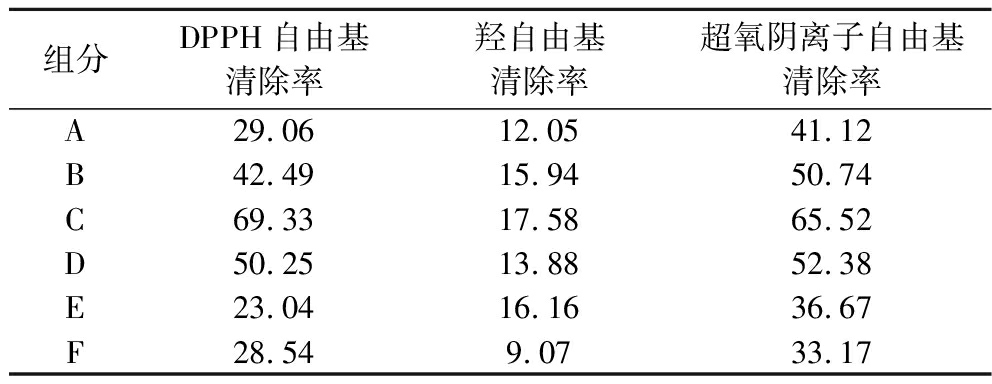
组分DPPH自由基清除率羟自由基清除率超氧阴离子自由基清除率A29.0612.0541.12B42.4915.9450.74C69.3317.5865.52D50.2513.8852.38E23.0416.1636.67F28.549.0733.17
组分C再次经由SephadexG-15二次分离后得到5个组分,如图9、图10所示,各组分差异不大。活性肽分离纯化后,由质谱结合软件分析及蛋白质数据库分析氨基酸序列,得到的氨基酸序列分别为:DALKKK、FDGDF、HLPSDF、FLSDH、TPTDWK。

图9 SephadexG-15二次分离抗氧化测试
Fig.9 Antioxidant test of SephadexG-15 secondary separation

图10 DALKKK、FDGDF、HLPSDF、FLSDH、TPTDWK质谱
Fig.10 Mass spectra of DALKKK, FDGDF, HLPSDF, FLSDH and TPTDWK
3 结论
本实验通过测定不同时期干腌牛肉的抗氧化与抑菌指标,通过盐酸提取法,发现粗肽含量随着腌制时间的延长而显著增加,干腌牛肉抗氧化性能随着腌制时间的延长而增加,对不同自由基的清除效果也呈现较大差异,清除效果最好的为超氧阴离子自由基,1 mg/mL时可以达到81.05%,DPPH自由基清除率、羟自由基清除率和ABTS阳离子自由基最终清除率为78.33%、26.89%和36.92%。通过稳定性测试,发现0% NaCl、60 ℃和pH 7.0时抗氧化能力最强。验证了粗肽液在5 mg/mL时对于O517型大肠杆菌、白色念珠菌和金黄色葡萄球菌的抑菌能力,分别可以达到75.45%、44%和48.53%。经过SephadexG-25和SephadexG-15分别进行2次分离纯化后发现5个肽具有良好的抗氧化活性,分别为DALKKK、FDGDF、HLPSDF、FLSDH、TPTDWK。本研究结果表明,传统的中国干腌肉制品对人体健康是有益的。作为食源性生物活性肽重要的来源之一的传统干腌肉制品,可作为功能性食品的一个新的探究方向,具有很大的研究空间和研究价值。
[1] 李轻舟, 王红育.发酵肉制品研究现状及展望[J].食品科学, 2011, 32(3):247-251.
LI Q Z, WANG H Y.Present status and prospects of research oil fermented meat products[J].Food Science, 2011, 32(3):247-251.
[2] 马菊, 孙宝忠, 郝永清.国内外发酵肉制品历史及发展现状比较[J].肉类研究, 2006, 20(9):45-47.
MA J, SUN B Z, HAO Y Q.Comparisons with history and the current status of fermented meat productions at home and abroad[J].Meat Research, 2006, 20(9):45-47.
[3] BHAT Z F, KUMAR S, BHAT H F.Bioactive peptides of animal origin:A review[J].Journal of Food Science and Technology, 2015, 52(9):5377-5392.
[4] 胡亚亚, 邢路娟, 周光宏, 等.不同提取方法对金华火腿粗肽液抗氧化活性的影响[J].食品工业科技, 2015, 36(14):115-118. HU Y Y, XING L J, ZHOU G H, et al.Effect of extraction methods on the antioxidant activity of crude peptides from Jinhua ham[J].Science and Technology of Food Industry, 2015, 36(14):115-118.
[5] 左庆翔. 金华火腿降血压肽的特性研究及分离纯化[D].南京:南京农业大学, 2017.
ZUO Q X.Study on the characteristics of Jinhua ham hypotensive peptide and its isolation and purification[D].Nanjing:Nanjing Agricultural University, 2017.
[6] 郑锦晓, 邢路娟, 周光宏, 等.三种中国传统干腌火腿中粗多肽的抗氧化与抑菌活性的比较[J].食品工业科技, 2018, 39(16):75-79;86.
ZHENG J X, XING L J, ZHOU G H, et al.Antioxidant and antibacterial abilities of crude peptides extracted from the three Chinese traditional dry-cured hams[J].Science and Technology of Food Industry, 2018, 39(16):75-79;86.
[7] 吴宝森, 王桂瑛, 谷大海, 等.诺邓火腿抗氧化肽的分离纯化与鉴定[J].食品与发酵工业, 2018, 44(7):102-109.
WU B S, WANG G Y, GU D H, et al.Isolation, purification and identification of antioxidant peptides of Nordeng ham[J].Food and Fermentation Industries, 2018, 44(7):102-109.
[8] ZHU C Z, ZHANG W G, KANG Z L, et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science, 2014, 96(2):783-789.
[9] 徐娟, 吕嘉枥.乳蛋白水解液中多肽含量测定方法的研究[J].食品科技, 2010, 35(12):275-278.
XU J, LYU J F.Determination of content of peptides in milk protein hydrolysates[J].Food Science and Technology, 2010, 35(12):275-278.
[10] 严群芳. 大豆抗氧化肽的分离及其生物活性研究[D].南京:南京农业大学, 2006.
YAN Q F.Study on the separation of soybean antioxidative peptides and their antioxidant activity[D].Nanjing:Nanjing Agricultural University, 2006.
[11] LI Y H, JIANG B, ZHANG T, et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J].Food Chemistry, 2008, 106(2):444-450.
[12] LIU F, OOI V E, CHANG S T.Free radical scavenging activities of mushroom polysaccharide extracts[J].Life Sciences, 1997, 60(10):763-771.
[13] VISESSANGUAN W, BENJAKUL S, RIEBROY S, et al.Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J].Meat Science, 2004, 66(3):579-588.
[14] BRUNTON N P, LYNG J G, ZHANG L, et al.The use of dielectric properties and other physical analyses for assessing protein denaturation in beef biceps femoris muscle during cooking from 5 to 85 ℃[J].Meat Science, 2006, 72(2):236-244.
[15] GALLEGO M, GROOTAERT C, MORA L, et al.Transepithelial transport of dry-cured ham peptides with ACE inhibitory activity through a Caco-2 cell monolayer[J].Journal of Functional Foods, 2016, 21:388-395.
[16] LI B B, XU Y, LI J, et al.Effect of oxidized lipids stored under different temperatures on muscle protein oxidation in Sichuan-style sausages during ripening[J].Meat Science, 2019, 147:144-154.
[17] CHEN L L, SONG L Y, LI T F, et al.A new antiproliferative and antioxidant peptide isolated from Arca subcrenata[J].Marine Drugs, 2013, 11(6):1800-1814.
[18] CHAN W K M, DECKER E A, LEE J B, et al.EPR spin-trapping studies of the hydroxyl radical scavenging activity of carnosine and related dipeptides[J].Journal of Agricultural and Food Chemistry, 1994, 42(7):1407-1410.
[19] CASTELLANO P, MORA L, ESCUDERO E, et al.Antilisterial peptides from Spanish dry-cured hams:Purification and identification[J].Food Microbiology, 2016, 59:133-141.
[20] VASTAG Z, POPOVIC L, POPOVIC S, et al.Antioxidant and angiotensin-I converting enzyme inhibitory activity in the water-soluble protein extract from Petrovac Sausage (Petrovsk Kolb
Kolb sa)[J].Food Control, 2010, 21(9):1298-1302.
sa)[J].Food Control, 2010, 21(9):1298-1302.
[21] K![]() SKA P, W
SKA P, W JCIAK K M, STADNIK J.Bioactive peptides from beef products fermented by acid whey-in vitro and in silico study[J].Scientia Agricola, 2019, 76(4):311-320.
JCIAK K M, STADNIK J.Bioactive peptides from beef products fermented by acid whey-in vitro and in silico study[J].Scientia Agricola, 2019, 76(4):311-320.
[22] GALLEGO M, MORA L, ESCUDERO E, et al.Bioactive peptides and free amino acids profiles in different types of European dry-fermented sausages[J].International Journal of Food Microbiology, 2018, 276:71-78.