荨麻(Urtica fissa E.pritz.)属荨麻科一年生草本植物,具有广泛的药用和食用价值。荨麻在82个国家都有作为食物的悠久历史[1],其中含有丰富的营养物质,如蛋白质、脂肪、灰分、膳食纤维等[2]。同时荨麻中含有丰富的微量元素,例如钙、钾、锶、铁、锰、锌、钠、铜等元素[3]。荨麻也被用于很多食谱中,如荨麻与白乳酪、土豆、蜂蜜调味肉豆蔻用来制作荨麻美食。同时荨麻也具有抗氧化、抗炎[4]、抗菌[5]、降血糖[6-7]等作用。大量研究表明荨麻提取物具有一定的降糖活性,可用于治疗胰岛素抵抗及其糖尿病相关并发症。如麻叶荨麻乙醇提取物可缓解糖尿病小鼠的高血糖症状[8];荨麻叶提取物通过改善记忆功能来逆转糖尿病介导的海马毒碱胆碱能系统的改变[9],也将其用于生产ZnO纳米颗粒,进而提高ZnO的降糖作用[10]。建立3T3-L1细胞模型分析荨麻叶提取物对胰岛素刺激下神经酰胺的积累和 Akt 磷酸化的调节作用[11],通过增强Akt 磷酸化来减少神经酰胺的积累和胰岛素敏感性,从而达到降糖作用。多糖是荨麻主要活性成分之一,具有降糖、抗炎等多种药理活性。目前,提取荨麻多糖(polysaccharides from Urtica fissa, PUF)的方法主要有超声辅助酶解法、回流提取、半仿生提取等方法[12]。但回流提取生产周期长,导致原料损耗大,多糖得率较低;超声辅助酶解法由于设备因素影响,目前在产业化的利用较少。而半仿生提取法可以模仿口服药物在胃肠道的转运过程,采用选定pH值的酸性水和碱性水,依次连续提取得到含指标成分高的活性混合物。由于该提取溶剂更接近胃肠道的提取环境,因此可尽量多地保留有效成分,确保得到最佳有效成分[13]。
α-葡萄糖苷酶可以在低聚糖的非还原端切割α-1,4糖苷键释放葡萄糖,而葡萄糖经小肠吸收进入血液,导致血糖水平上升。随着血糖浓度的逐渐升高,胰岛素与胰高血糖素的动态平衡被打破[14],从而使得胰岛素促进葡萄糖摄取和利用的效率下降,从而出现胰岛素抵抗。有研究表明,鸡血藤水提物通过抑制α-淀粉酶,改善胰岛素抵抗,起到降糖作用[15]。桔梗醇提物对α-淀粉酶和α-葡萄糖苷酶有较强的抑制作用,同时提高IR-HepG2细胞的葡萄糖消耗量[16]。
本文以荨麻为研究对象,采用半仿生提取法对荨麻多糖的提取进行优化,确立最佳提取工艺。通过建立IR-HepG2模型,测定甘油三酯(triglyceride,TG)、己糖激酶(hexokinase,HK)、丙酮酸激酶(pyruvate kinase,PK)、糖原含量,来评价荨麻多糖的降糖活性与降糖机制,为荨麻多糖在食品开发等应用提供理论基础。
1 材料与方法
1.1 材料与试剂
荨麻,2018年8月采自陕西旬阳;HepG2(人肝脏胚胎肿瘤细胞),购买于中国科学院上海生命科学研究院细胞库;DMEM 高糖培养基,生工生物工程(上海)股份有限公司;胎牛血清,浙江天杭生物科技股份有限公司;细胞增殖与毒性检测试剂盒(CCK-8),美国APExBIO生物科技有限公司;胰酶-EDTA,美国Gibco公司;重组人胰岛素、葡萄糖检测试剂盒,上海源叶生物科技有限公司;甘油三酯(TG)检测试剂盒、丙酮酸激酶(PK)检测试剂盒、己糖激酶(HK)检测试剂盒、糖原检测试剂盒,南京建成生物工程研究所;DEAE纤维素、间羟基联苯、D-(+)-半乳糖醛酸、考马斯亮蓝 G-250、牛血清白蛋白(bovine albumin,BSA)、D-无水葡萄糖、普通透析袋、Tris、α-葡萄糖苷酶、α-淀粉酶、DNS 试剂、4-硝基苯基-β-D-吡喃葡萄糖苷(PNPG)、阿卡波糖,上海源叶生物科技有限公司;铁氰化钾、硫酸亚铁,天津市天力化学试剂公司;水杨酸、30%双氧水,天津市红岩化学试剂厂;氨基磺酸,天津市科密欧化学试剂有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
TDL-40B型电子天平,上海精密科学仪器有限公司;FD-1F-50型真空冷冻干燥机,上海比郎仪器制造有限公司;BS-100A型自动部份收集器、WH-3 涡旋混合器,上海沪西分析仪器厂有限公司;Nikon Eclipse TI 倒置式生物显微镜,日本尼康;Varioskan flash 全波长扫描多功能读数仪,赛默飞世尔科技有限公司(芬兰)。
1.3 实验方法
1.3.1 荨麻多糖提取工艺优化
1.3.1.1 荨麻多糖提取
取干燥荨麻叶粉碎,过40目筛,荨麻叶粗粉石油醚脱脂,采用半仿生提取法[17-18]提取荨麻多糖。称取荨麻叶粗粉2 g,先以适量酸液进行提取(调节pH1),再以适量碱液进行提取(调节pH2),合并提取液,减压浓缩至1/4体积后,醇沉24 h,去掉乙醇,离心10 min(8 000 r/mim),双蒸水复溶后减压浓缩,得到荨麻粗多糖水溶液。Sevag法除蛋白[19],振荡10 min后静置,离心取上清液,减压浓缩。在-80 ℃ 预冷冻,-56 ℃ 冻干48 h,得到荨麻粗多糖(polysaccharides from Urtica fissa,PUF)。
1.3.1.2 荨麻多糖提取单因素试验
(a)pH1对多糖得率的影响
固定pH1为8、料液比为1∶20(g∶mL)、提取温度为80 ℃、提取时间为65 min,考察pH1为1、2、3、4、5 时对多糖得率的影响。
(b)pH2对多糖得率的影响
固定pH1为3、料液比为1∶20(g∶mL)、提取温度为 80 ℃ 提取时间为65 min,考察pH2为 7、8、9、10、11时对多糖得率的影响。
(c)料液比对多糖得率的影响
固定pH1为3、pH2为8、提取温度为80 ℃、提取时间为65 min,考察料液比为1∶10(g∶mL)、1∶15(g∶mL)、1∶20(g∶mL)、1∶25(g∶mL)、1∶30(g∶mL)时对多糖得率的影响。
(d)提取温度对多糖得率的影响
固定pH1为3、pH2为8、料液比为1∶15(g∶mL)、提取时间为65 min,考察取温度为55、65、75、85、95 ℃时对多糖得率的影响。
(e)提取时间对多糖得率的影响
固定pH1为3、pH2为8、料液比为1∶15(g∶mL)、提取温度为80 ℃,考察提取时间为 45、55、65、75、85 min时对多糖得率的影响。
1.3.1.3 响应面优化分析
选取pH1、pH2、料液比、提取温度、提取时间作为实验因素,采用响应面优化分析[20]建立数学回归模型,以多糖得率为指标进行PUF提取工艺优化。
表1 响应面因素水平表
Table 1 Response surface factor level table

水平因素A(pH1)B(pH2)C(料液比)(g∶mL)D(提取时间)/minE(提取温度)/℃1491∶2085750381∶157565-1271∶106555
1.3.2 荨麻粗多糖各组分含量测定
1.3.2.1 总糖含量测定
本实验采用苯酚硫酸法[21]测定总糖含量,于490 nm处测定吸光度,通过葡萄糖标准曲线计算PUF总糖含量。
1.3.2.2 蛋白质含量测定
本实验采用Bradford法[22],以牛血清白蛋白(BSA)为标准品,于595 nm处进行吸光度测定,从而绘制BSA标准曲线,计算PUF蛋白质含量。
1.3.2.3 糖醛酸含量测定
本实验采用间羟基联苯[23]测定糖醛酸的含量,以半乳糖醛酸标准曲线为基础,计算PUF的糖醛酸含量。
1.3.3 荨麻多糖的纯化
采用DEAE离子交换柱层析法[24]对荨麻粗多糖进行分离纯化,具体方法如下:称取4 g PUF干燥粉末,用双蒸水充分溶解后缓慢倒入层析柱内,依次用0、0.1、0.3、0.5 mol/L的NaCl溶液洗脱,流速为1.5 min 每管。当洗脱组分收集完全无残留时,绘制洗脱曲线。减压浓缩透析48 h 除去盐及小分子物质,冷冻干燥得4份纯化荨麻多糖。
1.3.4 各纯化荨麻多糖体外降糖作用的比较
测定荨麻多糖对α-葡萄糖苷酶和α-淀粉酶的抑制能力,分别配制不同质量浓度的荨麻多糖和阿卡波糖溶液(2、4、8、12、16、20 mg/mL),在α-葡萄糖苷酶抑制能力的实验中[25],依据已有方法,其中阿卡波糖为阳性对照,于405 nm 处测定吸光度值,比较4份纯化荨麻多糖对α-葡萄糖苷酶的抑制率。
在α-淀粉酶抑制能力测定中[26],分别取不同浓度的荨麻多糖和阿卡波糖加入试管中,加入α-淀粉酶溶液,37 ℃ 孵育10 min。加入1%淀粉溶液振荡混匀,37 ℃ 孵育10 min,冷却后加入DNS试剂终止反应。沸水浴5 min 后冷却至室温,用双蒸水定容至10 mL。以阿卡波糖为阳性对照,于 540 nm 处测定吸光度值,比较4份纯化荨麻多糖对α-淀粉酶的抑制率。
1.3.5 纯化荨麻多糖 PUF3分子质量测定及单糖组成分析
1.3.5.1 分子质量测定
根据文献[26],采用离子色谱仪分析PUF3(0.3 mol/L NaCl 洗脱组分)的分子质量。测定条件为:BRT105-104-102串联凝胶色谱柱(8 mm×300 mm);流动相为0.05 mol/L NaCl 溶液;流速0.6 mL/min;柱温为40 ℃;进样量为20 μL;示差检测器RI-10A。
1.3.5.2 单糖组成分析
参考文献[27]方法分析样品的单糖组成。条件为:色谱柱为SHISEIDO C18柱(4.6 mm×250 mm,5 μm);流动相:A:0.1 mol/L KH2PO4(pH 6.8);B:乙腈,V(A)∶V(B)=82∶18;流速为1.0 mL/min;柱温为25 ℃;进样量为10 μL;波长为245 nm。
1.3.6 细胞实验
1.3.6.1 HepG2 细胞的培养
HepG2细胞复苏后培养于DMEM高糖培养基(含10% 胎牛血清,1% 青霉素-链霉素混合液),置于37 ℃,5% CO2培养[27]。
1.3.6.2 胰岛素浓度对细胞活力的影响
以5×104 cells/ mL的密度将细胞接种于96孔板培养,每孔100 μL,设置空白组、对照组、胰岛素组。待细胞贴壁后,弃去旧培养基,加入无血清培养基饥饿10 h。之后分别加入含有10-9、10-8、10-7、10-6、10-5 mol/L 胰岛素的无血清培养基,每孔10 μL,每个浓度6个复孔。将96孔板在培养箱中孵育适当的时间长度之后向板的每个孔中加入10 μL CCK-8溶液,孵育 4 h。轻轻摇匀,在450 nm处测定吸光度值[28]。细胞活力检测计算如公式(1)所示:
细胞存活率![]()
(1)
式中:A1 为胰岛素组吸光度;A2为空白组吸光度;A3为对照组吸光度;
1.3.6.3 IR-HepG2细胞模型的构建
以2×105 cells/ mL 的密度将细胞接种于96 孔板中培养,每孔200 μL。设置空白组、模型组,每组6个复孔。模型组分别加入含有 10-9、10-8、10-7、10-6、10-5 mol/L 胰岛素的培养基,空白组不加胰岛素。分别诱导24、48、72 h,按照葡萄糖测定试剂盒说明书的方法,测定葡萄糖含量,计算不同胰岛素浓度在不同作用时间下的葡萄糖消耗量,构建IR-HepG2细胞模型。
1.3.6.4 PUF3对细胞增殖的影响
以2×105 cells/ mL的密度将细胞接种于96孔板中培养,每孔200 μL。设置空白组、多糖组。空白组为不含细胞的培养基组,多糖组分别加入PUF3不同剂量62.5,250,1 000 μg/mL的完全培养液。通过细胞增殖检测,考察PUF3高、中、低剂量对细胞增殖的影响。
1.3.6.5 PUF3对IR-HepG2细胞葡萄糖消耗量的影响
以2×105 cells/ mL的密度将细胞接种于96孔板中培养。设置空白组、模型组、阳性对照组、PUF3 高中低剂量组,每组6个复孔,除空白组外所有孔加入含10-7 mol/L胰岛素的无血清培养基孵育48 h。空白组、模型组加入无血清培养基,阳性对照组加入含有1 000 μg/mL 二甲双胍的无血清培养基,PUF3高中低剂量组分别加入含有62.5、250、1 000 μg/mL PUF3 的无血清培养液。试剂盒测定葡萄糖含量,计算PUF3对IR-HepG2 细胞葡萄糖消耗量的影响。
1.3.6.6 PUF3对IR-HepG2细胞HK、PK、TG的影响
细胞分组及处理方式同1.3.6.5节,处理结束后,收集细胞,清洗1~2次。离心弃上清,加入1 mL PBS 重悬,冰水浴超声破碎(功率:60 W,3~5 s 1次,间隔30 s)。参照HK、PK、TG 试剂盒说明书进行操作。
1.3.6.7 PUF3对IR-HepG2细胞糖原合成的影响
细胞分组及处理方式同1.3.6.5节,处理结束后,收集细胞。PBS 清洗1~2次。离心弃上清液,加入碱溶液 0.225 mL,沸水浴 20 min,加双蒸水 0.225 mL,为糖原检测液。混匀后沸水浴 5 min,冷却后于 620 nm 测定吸光度。
1.4 数据分析
Design-Expert 8.0.6分析响应面实验结果,实验数据以平均值±标准偏差来表示,采用Origin 9.8.0进行绘图。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 单因素试验
由图1-a可知,随着提取液pH1的升高,荨麻多糖的得率先升高后降低,pH1为3时,荨麻多糖提取率最高为6.20%。当pH1超过3时,多糖提取率出现降低的趋势。这可能是由于在一定范围内,酸性提取液有利于细胞纤维水解,促进多糖类成分的溶出;但酸性过强时,多糖结构中糖苷键被破坏,使得多糖水解。因此,最优的pH1值为3。
由图1-b可知,随着提取液pH2的升高,多糖得率先升高后降低,pH2为8时,多糖提取率最高为6.77%。当pH2超过8时,多糖提取率出现降低的趋势。这可能是由于在碱性条件下,荨麻细胞壁发生破裂,从而促进多糖的溶出;但随着碱性的增强,多糖的糖苷键被破坏,多糖构象发生改变,使得多糖水解,从而降低多糖得率。因此,最优的pH2值为8。
由图1-c可知,随着料液比的增加,荨麻多糖得率先升高后降低,料液比1∶15(g∶mL)时提取率最高为6.47%。当料液比超过1∶15(g∶mL)时,多糖提取率出现降低的趋势。这可能是由于随着溶剂体积的增大,荨麻粉末与溶剂充分接触,有利于溶剂进入植物细胞,从而增加多糖的释放;当溶出达到平衡后,会导致其他物质的溶出,而降低多糖得率。因此,较佳料液比为1∶15(g∶mL)。
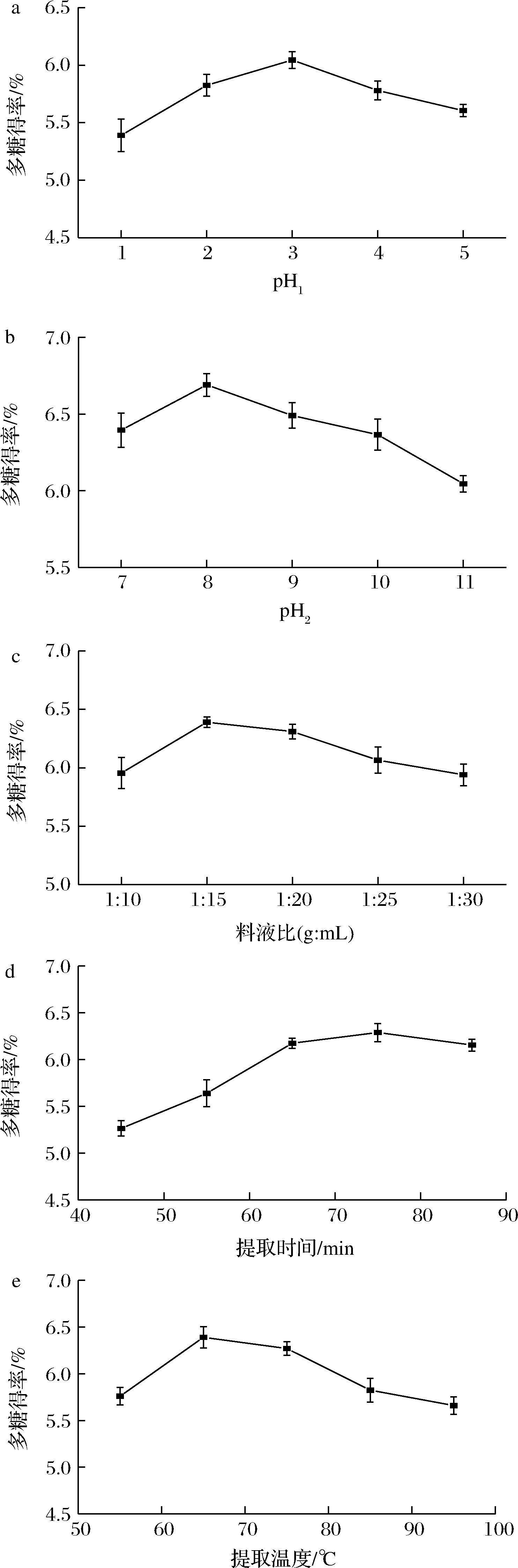
a-pH1;b-pH2;c-料液比;d-提取时间;e-提取温度
图1 提取条件对荨麻多糖得率的影响
Fig.1 Effect of extraction conditions on extraction yield of the Urtica fissa polysaccharide
由图1-d可知,随着提取时间延长,多糖得率逐渐升高,提取时间为75 min 时,多糖得率达到6.27%。提取时间继续延长,则多糖得率出现降低的趋势。这可能是由于提取到一定时间,多糖溶出达到平衡,继续提取会使其他物质溶出增多,从而降低多糖得率。且延长提取时间会增大提取成本,因此,较佳的提取时间为75 min。
由图1-e可知,温度在55~65 ℃ 时,提取率呈上升趋势,65 ℃ 时提取率最高为6.47%。当温度>65 ℃时,提取率开始下降。这可能是由于温度过高,多糖结构被破坏,使得多糖得率降低。因此选取65 ℃为较佳的提取温度。
2.2 响应面优化试验结果
以pH1(A)、pH2(B)、料液比(C)、提取时间(D)、提取温度(E)5个因素为自变量,多糖得率(Y)为响应值,进行响应面试验设计,结果见表1。采用 Box-Behnken 中心复合设计建立数学回归模型,得出回归方程如下:
Y=7.33+0.088A+0.032B+0.047C+0.022D-1.875E-0.03E+0.047AB+0.028AC+0.001AD-0.011AE-0.048BC-0.013BD+0.029BE+0.015CD+0.030CE+0.023DE-0.28A2-0.11B2-0.11C2-0.069D2-0.055E2
根据表2响应面方差分析和显著性分析可知,该模型的P<0.000 1,具有极显著行,失拟项不显著(P>0.000 1),R2=0.977 5,说明该模型可靠,通过F值得到荨麻多糖得率五大因素的影响大小依次为:A>C>B>D>E。且模型中AB和BC的交互作用均为极显著(P<0.01),AC、AD、AE、BD、BE、CD、CE、DE的交互作用不显著。
通过分析各种交叉因素,做出响应面图,如图2所示。响应面的曲线变化越大,表明因素交叉的因素越明显。由图2可以看出,响应面的弯曲程度的大小为:AC>AB>BC>CE>BE,即pH1和料液比的响应面最为陡峭,其对多糖提取率的影响最为显著。
表2 响应面法回归模型方差分析
Table 2 Variance analysis of response surface method regression model

方差来源平方和自由度均方差F值P值显著性模型0.94200.04754.25<0.000 1∗∗A(pH1)0.1310.13144.4<0.000 1∗∗B(pH2)0.01610.01618.830.000 2∗∗C(料液比)0.03610.03641<0.000 1∗∗D(提取时间)0.007 48210.007 4828.630.007E(提取温度)0.000 056 2510.000 056 250.0650.801AB0.008 9310.008 9310.30.003 6∗∗AC0.003 13610.003 1363.620.068 7AD0.000 00410.000 0040.004 6160.946 4AE0.000 48410.000 4840.560.461 8BC0.009 31210.009 31210.750.003 1∗∗BD0.000 67610.000 6760.780.385 5BE0.003 42210.003 4223.950.058CD0.000 910.000 91.040.317 9CE0.003 6610.003 664.220.050 5DE0.002 11610.002 1162.440.130 7A20.710.7803.44<0.000 1∗∗B20.110.1115.92<0.000 1∗∗C20.110.1115.74<0.000 1∗∗D20.04210.04248.47<0.000 1∗∗E20.02710.02730.69<0.000 1∗∗残差0.022250.000 866 6失拟项0.02200.001 0033.110.105 8不显著纯误差0.001 61150.000 322 3总离差0.9645
注:*表示差异显著(P<0.05),**表示差异极显著(P <0.01)。

a-pH1和pH2;b-料液比和pH2;c-料液比和提取温度;d-料液比和 pH1;e-提取温度和pH2
图2 因素交互影响三维图
Fig.2 3D diagram of factor interaction
应用Design-Expert V8.0.6 软件,求解所得回归方程,得出提取荨麻多糖最优工艺条件:pH1为3.29、pH2为8.31、料液比为1∶15.86(g∶mL)、提取时间为76.59 min、提取温度为65.44 ℃,预测多糖提取率为7.12%。之后对该参数进行验证,结合实际条件调整提取参数为pH1为3、pH2为8、料液比为1∶16(g∶mL)、提取时间为77 min、提取温度为 65 ℃,多糖提取率为 7.04%,与单因素预测值差异较小,说明方法可行。
2.3 荨麻多糖各组分含量
由图3可知,通过苯酚-硫酸法测定得到荨麻多糖的总糖含量为78.48%;考马斯亮蓝法测定蛋白含量,得出荨麻多糖的蛋白含量为5.34%;间羟基联苯法测定糖醛酸含量,得到荨麻多糖的糖醛酸含量为16.12%。
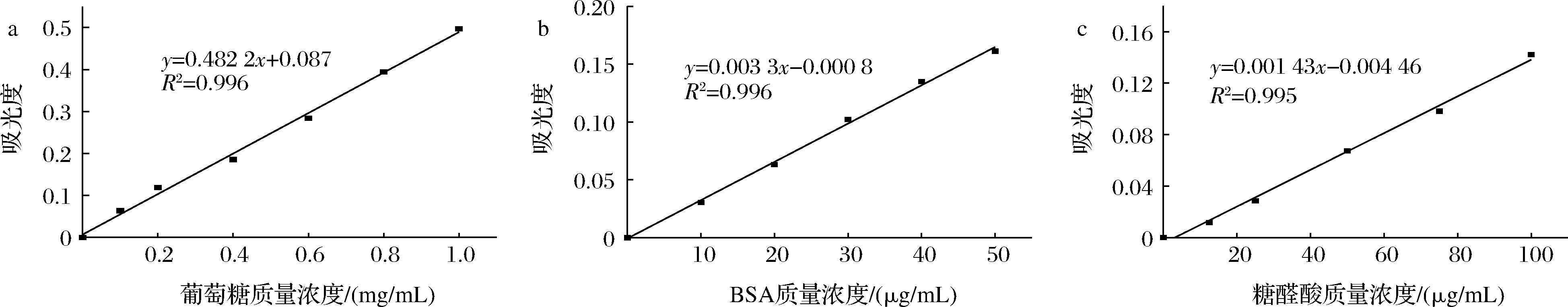
a-葡萄糖含量;b-BSA含量;c-糖醛酸含量
图3 荨麻多糖各组分含量标准曲线
Fig.3 Standard curve of each component content of Urtica fissa polysaccharide
2.4 荨麻多糖分离纯化结果
采用DEAE-纤维素离子层析柱对荨麻粗多糖进行分离和纯化,其洗脱曲线如图4所示。由图4可知,经过DEAE 纤维素柱层析出现4个较为明显的洗脱峰。透析、冷冻干燥得4种纯化荨麻多糖分别为:PUF1(0 mol/L NaCl 洗脱组分)、PUF2(0.1 mol/L NaCl 洗脱组分)、PUF3(0.3 mol/L NaCl洗脱组分)、PUBZ(0.5 mol/L NaCl 洗脱组分)。
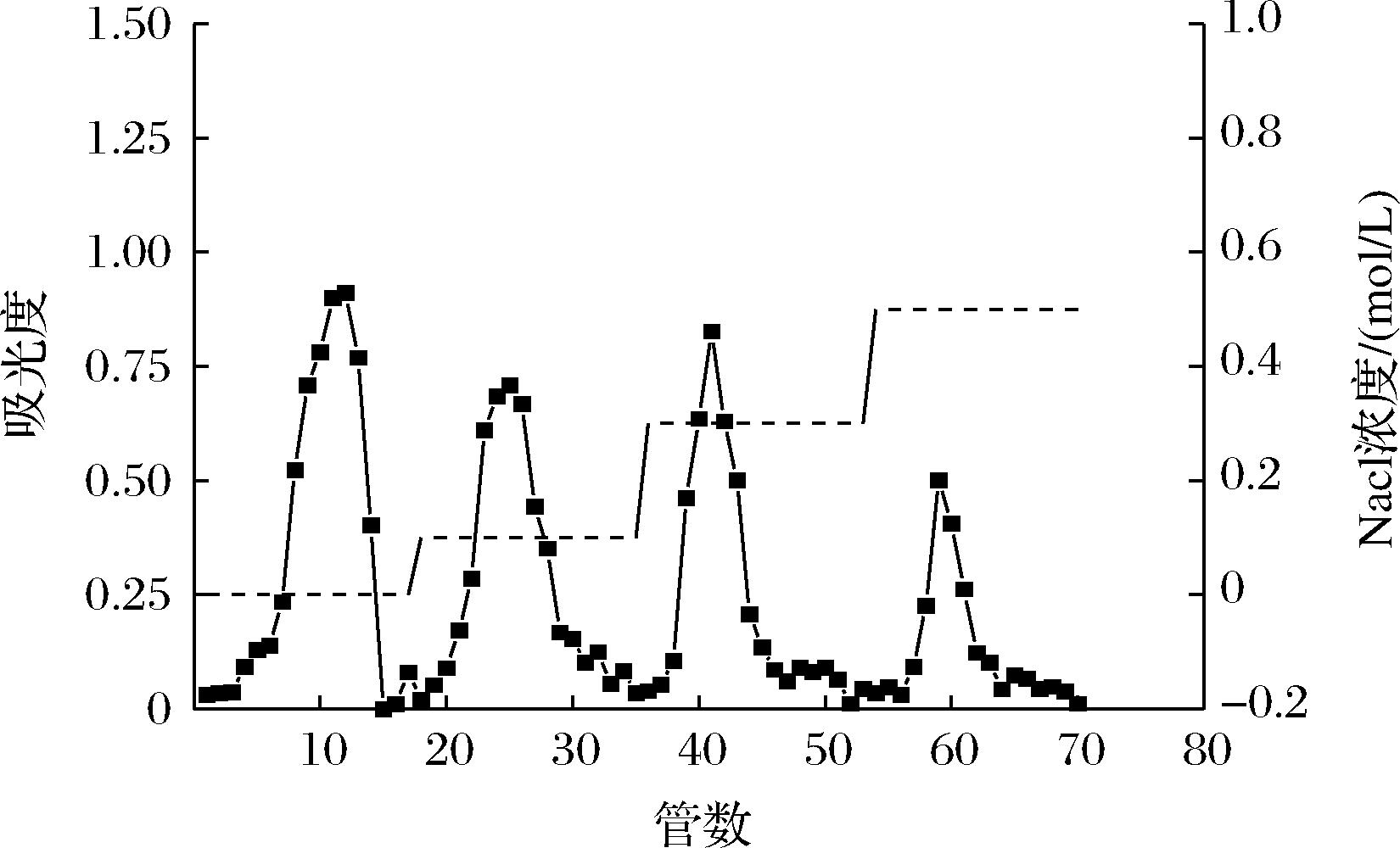
图4 DEAE纤维素柱层析洗脱曲线
Fig.4 DEAE fiber column elution curve
2.5 各纯化荨麻多糖体外降糖作用的比较结果
荨麻多糖的体外降糖活性结果见图5。如图5-a所示,各纯化荨麻多糖均具有较好的α-葡萄糖苷酶抑制能力,且荨麻多糖对α-葡萄糖苷酶抑制率随着浓度的增加而增强,当多糖质量浓度为20 mg/mL,各纯化荨麻多糖的α-葡萄糖苷酶的抑制率均达到最高。其中PUF3对α-葡萄糖苷酶的抑制能力最强,其抑制率为69.48%。各纯化荨麻多糖对α-淀粉酶抑制能力测定的结果见图5-b所示,4种纯化荨麻多糖均具有α-淀粉酶抑制能力,且当多糖质量浓度为20 mg/mL 时,4种纯化荨麻多糖的α-淀粉酶抑制率均最高,其中PUF3对α-淀粉酶的抑制能力最强,其为89.45%。表明本研究提取纯化的荨麻多糖能够通过抑制α-葡萄糖苷酶、α-淀粉酶而表现为降糖作用,其中降糖作用最强的是PUF3。

a-α-葡萄糖苷酶;b-α-淀粉酶
图5 荨麻多糖各组分对α-葡萄糖苷酶和α-淀粉酶抑制能力
Fig.5 α-Glucosidase inhibition test and α-amylase inhibition test of Urtica fissa polysaccharide component
2.6 纯化荨麻多糖 PUF3分子质量测定及单糖组成分析
2.6.1 分子质量测定
如图6所示,根据葡聚糖的相对分子质量及谱图分析,其存在时间为 35.333 min,通过方程换算得到:荨麻多糖PUF3的Mw为3.07×105 Da,Mn为1.65×105 Da,Mp为2.26×105Da。
2.6.2 单糖组成分析
由图7可知,PUF3中含有甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖以及岩藻糖,摩尔比1.32∶0.65∶14.76∶2.49∶5.20∶3.13∶27.13∶20.90∶1.16,表明PUF3 是一种杂多糖,半乳糖和阿拉伯糖是其主要单糖组分。
2.7 胰岛素浓度对细胞活力的影响
由图8可知,胰岛素浓度为10-9~10-5 mol/L,均对细胞存活率无显著影响,存活率都在90%以上,可作为建模安全浓度范围。
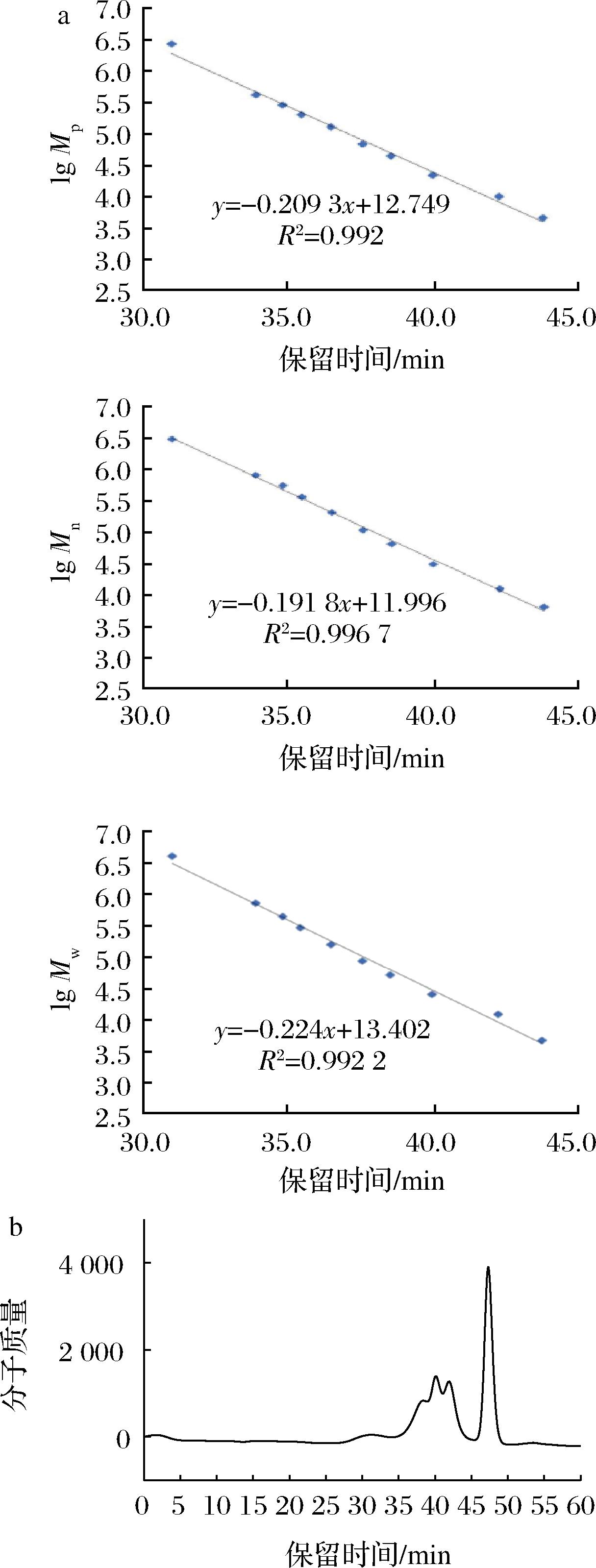
a-葡聚糖相对分子质量;b-荨麻多糖 PUF3 的分子质量分布
图6 荨麻多糖 PUF3 的分子质量分布图
Fig.6 Urtica fiss polysaccharide PUF3 molecular weight distribution
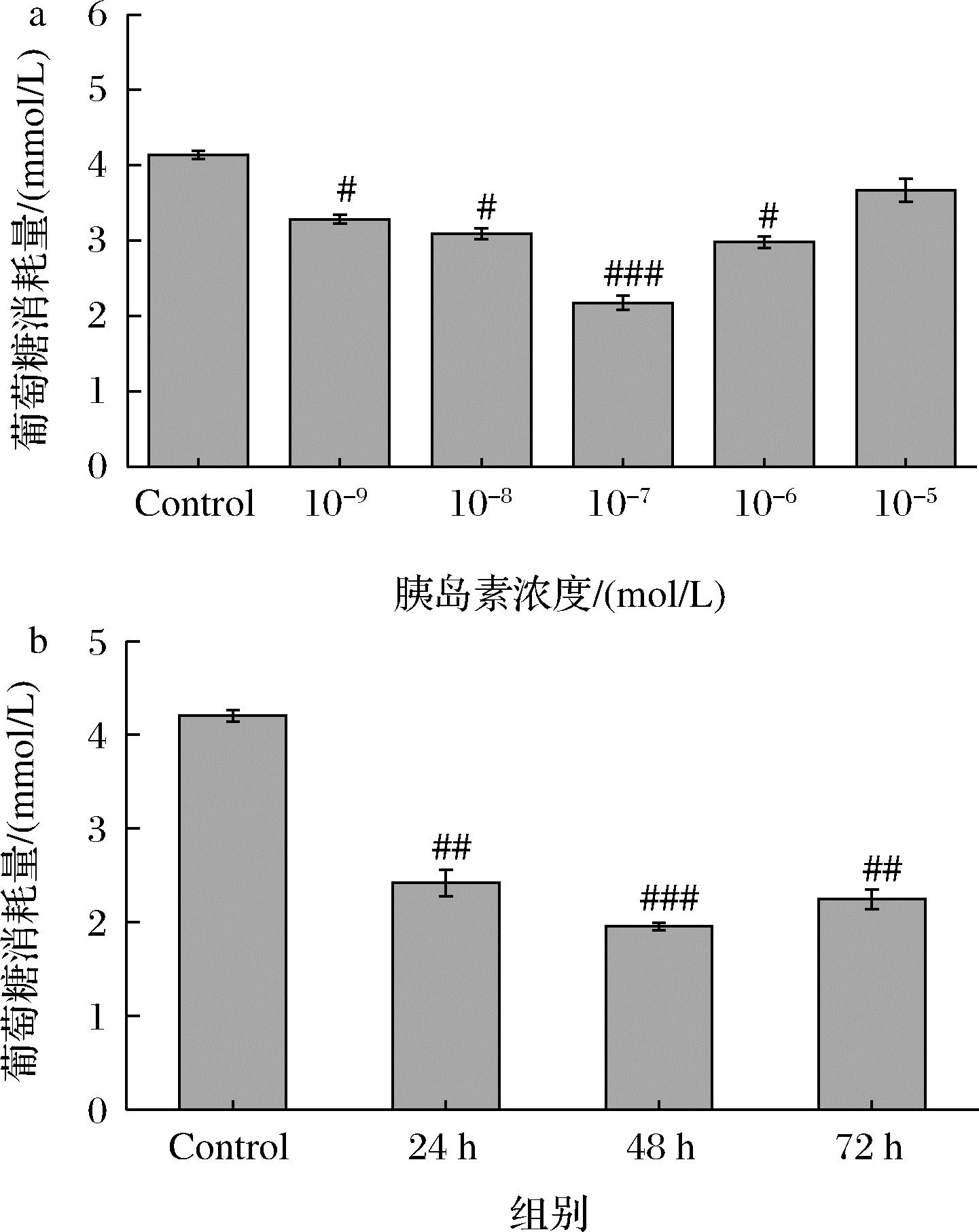
2.8 IR-HepG2细胞模型的构建
如图9所示,加入浓度为10-9~10-5 mol/L的胰岛素,IR-HepG2细胞葡萄糖消耗量均显著降低(P<0.05,P<0.001)。与空白组(Control)相比,10-7 mol/L的胰岛素葡萄糖消耗量最小。因此,将此浓度作为 HepG2 细胞胰岛素抵抗模型的最佳浓度。在10-7 mol/L最佳胰岛素浓度的作用下,分别处理细胞24、48、72 h,发现在48 h时,与Control组相比,葡萄糖消耗量下降53.44%。因此,选择胰岛素的浓度为10-7 mol/L,作用时间48 h 可以成功构建IR-HepG2细胞模型。

1-甘露糖;2-核糖;3-鼠李糖;4-葡萄糖醛酸;5-半乳糖醛酸; 6-葡萄糖;7-半乳糖;8-木糖;9-阿拉伯糖;10-岩藻糖 a-混合标准单糖;b-荨麻多糖 PUF3
图7 标准品及PUF3 的液相色谱图
Fig.7 Liquid chromatogram of PUF3 and standards
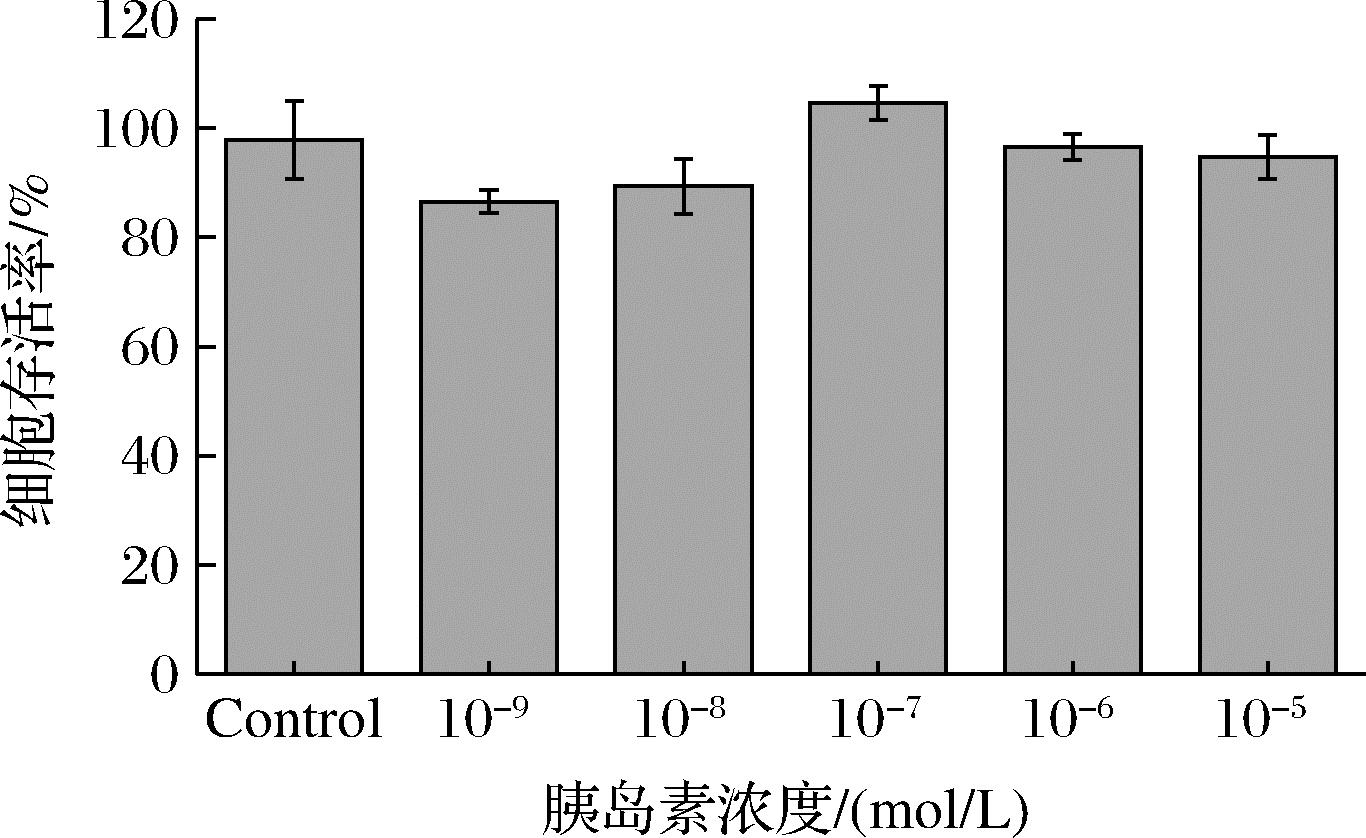
图8 胰岛素浓度对 HepG2 细胞活力的影响
Fig.8 The effect of insulin concentration on the viability of HepG2 cells
2.9 PUF3对细胞增殖的影响
由图10可以看出,PUF3不影响 HepG2细胞增殖,3个剂量作用下的细胞存活率均高于90%,表明PUF3基本无细胞毒性。
2.10 PUF3 对 IR-HepG2细胞葡萄糖消耗量的影响
由图11可知,与Control相比,PUF3低、中、高浓度均能促进IR-HepG2细胞对葡萄糖的吸收,具有统计学差异(P<0.05,P<0.01)。并且葡萄糖的消耗量随PUF3浓度的增加而增加。研究发现,在3T3-L1细胞中,葡萄糖消耗显著增加可以促进胰岛素的作用强度,进而达到降糖作用[29]。由此可知,PUF3可能通过增加葡萄糖消耗量而表现为降糖作用。
a-胰岛素浓度;b-胰岛素作用时间
图9 HepG2 细胞葡萄糖消耗量
Fig.9 Glucose consumption in HepG2 cells
注:与Control相比,#P<0.05,##P<0.01,###P<0.001。
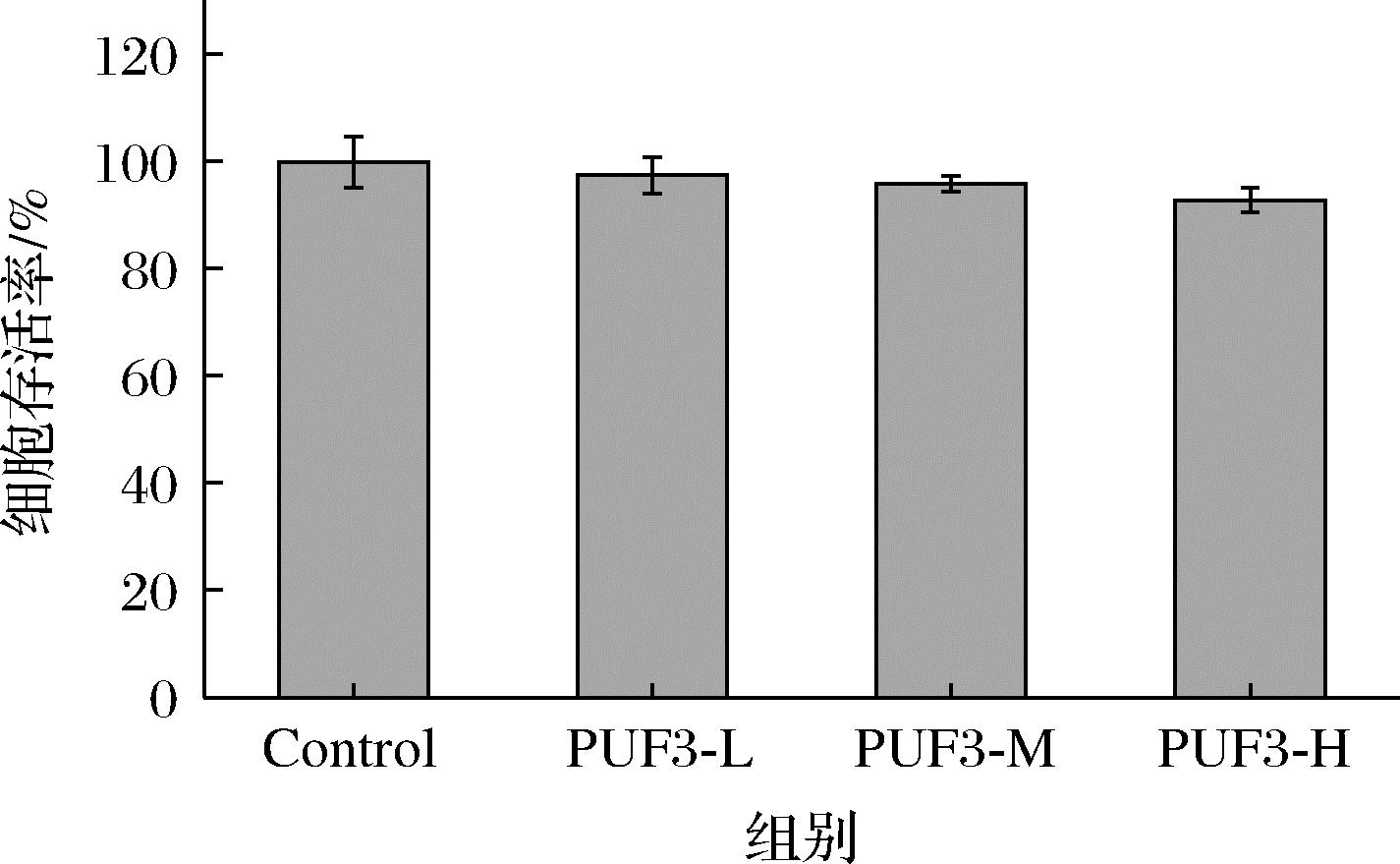
图10 多糖 PUF3 对 IR-HepG2 细胞存活率的影响
Fig.10 Effect of polysaccharide PUF3 on the survival rate of IR-HepG2 cells
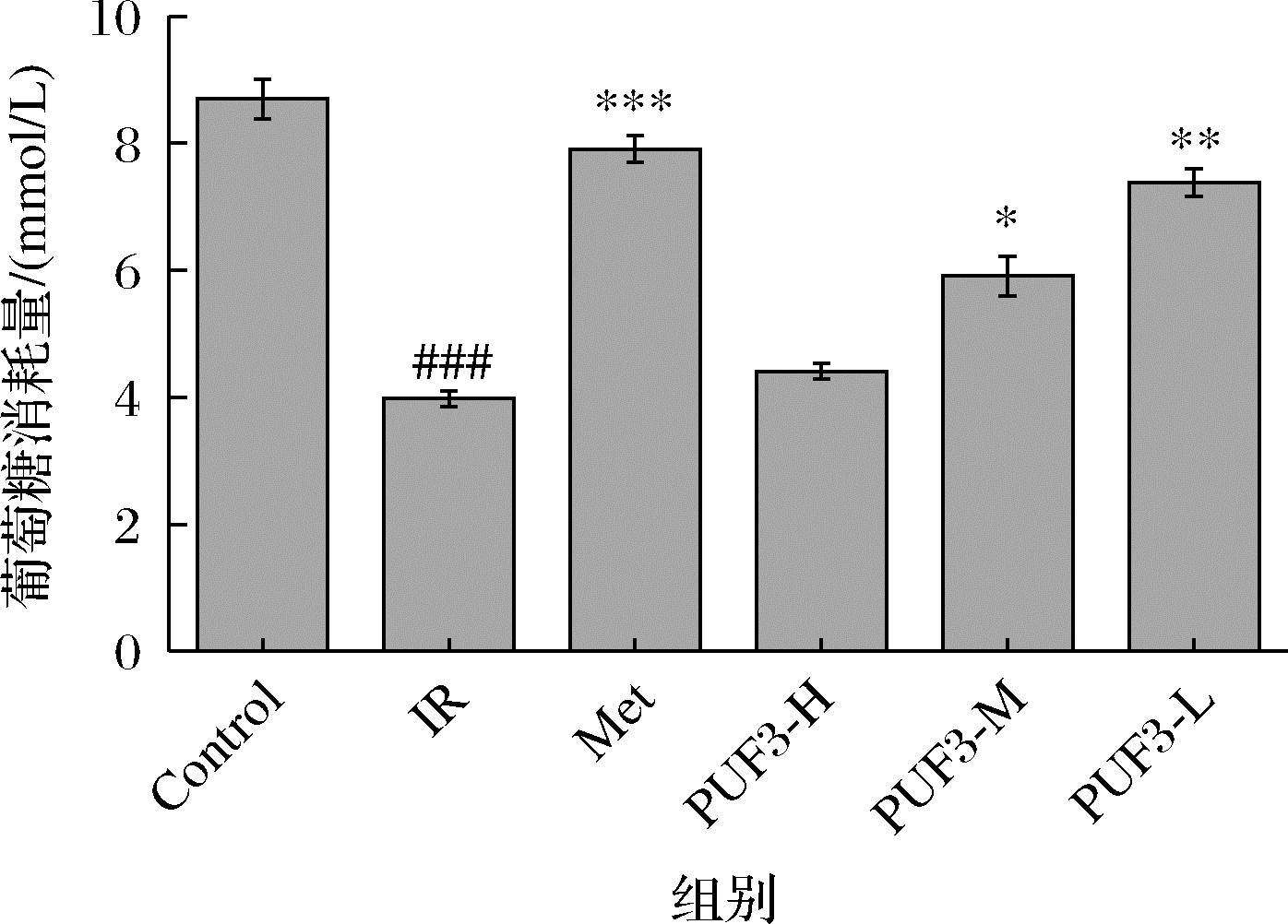
图11 多糖 PUF3 对 IR-HepG2 细胞内葡萄糖消耗量的影响
Fig.11 Effect of polysaccharide PUF3 on intracellular glucose consumption of IR-HepG2
注:与Control组相比,###P<0.001;与IR组相比,*P<0.05, **P<0.01,***P<0.001。
2.11 PUF3对IR-HepG2细胞中HK、PK、TG的影响
PUF3对IR-HepG2细胞中HK、PK、TG含量测定结果如图12所示。由图12-a、图12-b可知,与Control相比PUF3低、中、高浓度均能上调IR-HepG2 细胞的HK、PK活力,PK含量随PUF3浓度的增加而上升(P<0.05,P<0.01),而在PUF3-M浓度处理下,HK活力最高。已知调节HK、PK活性是促进葡萄糖代谢的作用环节之一[30]。因此PUF3可能通过增加IR-HepG2 细胞内HK、PK活性而促进糖代谢,进而发挥降糖作用。
由图12-c可知,PUF3 低、中、高浓度均能降低IR-HepG2细胞的TG含量,具有统计学差异(P<0.05)。并且TG含量随 PUF3 浓度的增加而降低,呈浓度依赖性。已知可以通过抑制细胞的TG积累来改善IR[31]。由此可知,PUF3可通过降低IR-HepG2 细胞内TG,从而达到降糖作用。
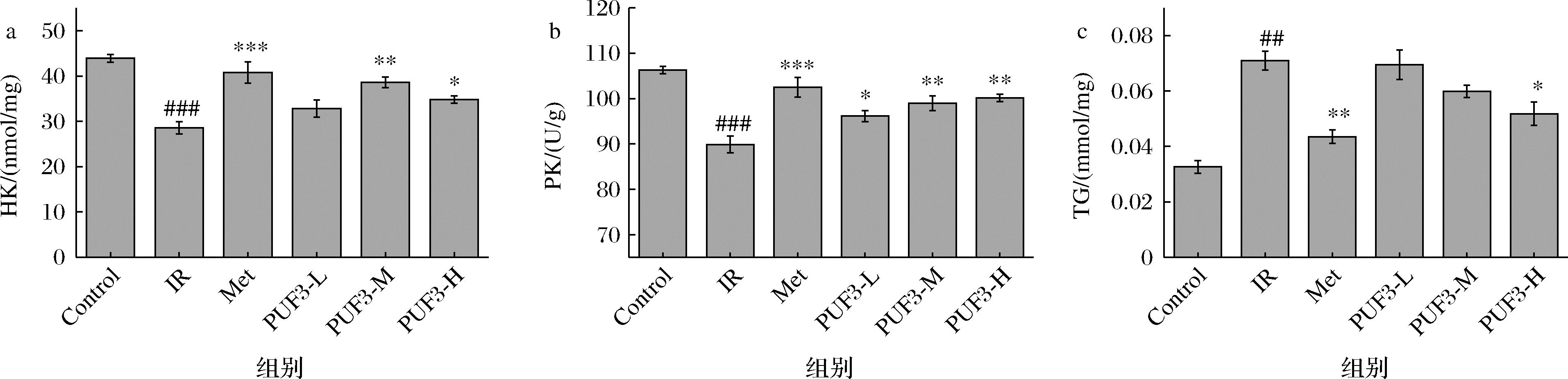
a-HK;b-PK;c-TG
图12 PUF3 对 IR-HepG2细胞内HK、PK、TG 含量的影响
Fig.12 Effect of PUF3 on HK、PK、TG in IR-HepG2 cells
注:与Control 组相比,###P <0.001;与 IR 组相比,*P<0.05,**P<0.01,*** P<0.001。
2.12 PUF3对IR-HepG2细胞糖原合成的影响
机体存在胰岛素抵抗,对胰岛素敏感性降低,继而降低了胰岛素刺激的肝糖原合成。如图13所示,与空白组(Control)相比,PUF3 低、中、高浓度均能上调IR-HepG2细胞的糖原含量,并且糖PUF3原含量随 PUF3 浓度的增加而增加。其中 PUF3-H 影响显著(P<0.05)。PUF3 低、中、高浓度的糖原含量与 IR 组相比分别上升了3.89%、5.20%、7.88%。
CAO等[32]通过研究发现马尾藻多糖能促进糖原合成,从而降低葡萄糖含量。由此可知,PUF3可通过增加IR-HepG2 细胞内糖原含量,促进糖代谢,从而达到降糖作用。
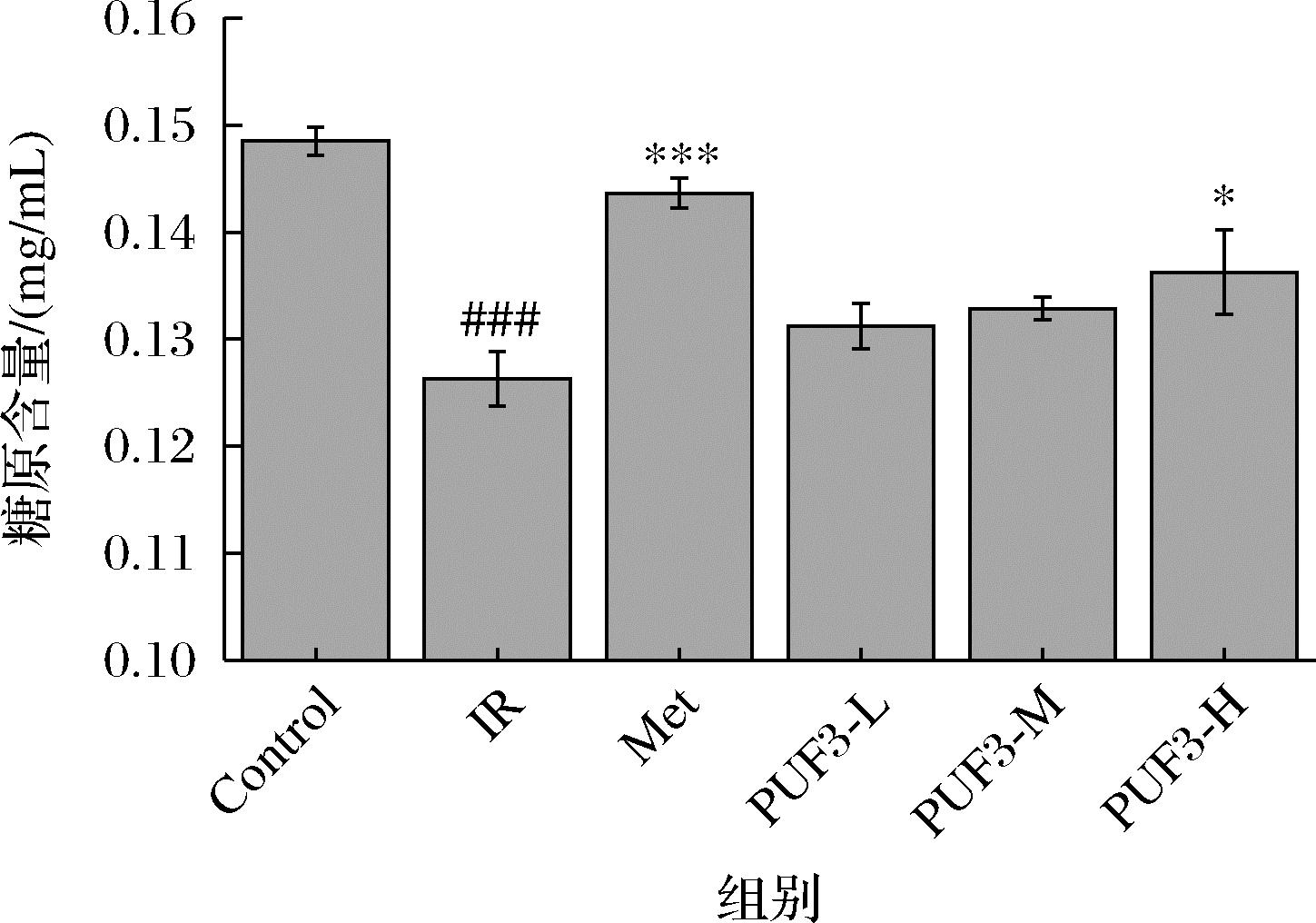
图13 PUF3 对 IR-HepG2 细胞内糖原含量的影响
Fig.13 Effect of UF3 on the glycogen content in IR-HepG2 cells
注:与Control 组相比,###P<0.001;与 IR 组相比, *P <0.05,***P <0.001。
3 结论与讨论
有效成分经口服进入人体后,其消化与吸收受到胃肠道pH环境的影响,采用半仿生提取法符合人体对药物的吸收特性,能使药效物质最大限度地提取出来,能保持其原有的功效。
因此,本次实验采用半仿生提取法提取多糖,通过单因素实验分析pH1、pH2、料液比、提取温度、提取时间各因素对荨麻多糖得率的影响,利用响应面优化荨麻多糖提取工艺,得到最佳提取工艺条件为:pH1为3、pH2为8、料液比为1∶16(g∶mL)、提取温度为65 ℃、提取时间为77 min,荨麻多糖得率为7.04%,基本与响应面模型的理论预测值相符。试验提取条件和因素水平设置合理,证明此模型预测结果准确,可用于荨麻多糖提取的工艺优化。多糖的构型十分复杂,需要多种分析方法进行测定,本文通过测定分子质量、单糖组成,初步表征PUF3结构表明,PUF3 Mw为3.07×105 Da,Mn 为 1.65×105 Da,Mp 为 2.26×105 Da,主要由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖构成,摩尔比为 1.32∶0.65∶14.76∶2.49∶5.20∶3.13∶27.13∶20.90∶1.16, 说明PUF3是一种杂多糖。
胰岛素抵抗为Ⅱ型糖尿病的主要发病机制之一,可通过有效成分干预从而改善胰岛素抵抗状态,有助于改善糖尿病。本研究表明在PUF3高浓度作用下,IR-HepG2细胞的葡萄糖消耗量最高,为IR 组的1.85倍。同时,PUF3 能显著增加 IR-HepG2细胞内 PK、HK 活力及糖原含量,促进糖代谢,进而实现降糖作用, 为荨麻多糖在食品开发等应用提供理论基础。
[1] ![]() S,
S, ![]() M, et al.The functional food production:Application of stinging nettle leaves and its extracts in the baking of a bread[J].Food Chemistry, 2020, 312:126091.
M, et al.The functional food production:Application of stinging nettle leaves and its extracts in the baking of a bread[J].Food Chemistry, 2020, 312:126091.
[2] ADHIKARI B M, BAJRACHARYA A, SHRESTHA A K.Comparison of nutritional properties of Stinging nettle (Urtica dioica) flour with wheat and barley flours[J].Food Science &Nutrition, 2016, 4(1):119-124.
[3] 贾慧萍, 胡樱, 魏晶晶, 等.宽叶荨麻化学成分和药理作用及其开发利用研究进展[J].青海草业, 2021, 30(2):57-60;63.
JIA H P, HU Y, WEI J J, et al.Research progress of chemical components, pharmacological effects and resource utilization of Urtica laetevirens maxim[J].Qinghai Prataculture, 2021, 30(2):57-60;63.
[4] DHOUIBI R, AFFES H, BEN SALEM M, et al.Screening of pharmacological uses of Urtica dioica and others benefits[J].Progress in Biophysics &Molecular Biology, 2020, 150:67-77.
[5] QUAN H X, SUN N, LIU S L, et al.The analysis of flavonoids and triterpenes extracted from Urtica by LC-MS and the antimicrobial activity of the extracts[J].Journal of Food Processing and Preservation, 2021, 45(9):e15706.
[6] HUSSAINI Z S, ASKNDARI H, ALAMI K, et al.Effect of rheum ribes and Urtica dioica on type 2 diabetic rats[J].International Journal of Pharmaceutical and Phytopharmacological Research, 2021, 11(1):63-69.
[7] SHOKRZADEH M, MIRSHAFA A, YEKTA MOGHADDAM N, et al.Mitochondrial dysfunction contribute to diabetic neurotoxicity induced by streptozocin in mice:Protective effect of Urtica dioica and pioglitazone[J].Toxicology Mechanisms and Methods, 2018, 28(7):499-506.
[8] LONG W Y, TANG H C, ZHONG X, et al.Hypoglycemic and lipid-lowering effects of extracted from the aerial part of Urtica cannabina L.on alloxan-induced hypergl-ycemic mice[J].IOP Conference Series:Earth and Environmental Science, 2020, 512:012097.
[9] GOHARI A, NOORAFSHAN A, AKMALI M, et al.Urtica dioica distillate regenerates pancreatic beta cells in streptozotocin-induced diabetic rats[J].Iranian Journal of Medical Sciences, 2018, 43(2):174.
[10] BAYRAMI A, HAGHGOOIE S, POURAN S R, et al.Synergistic antidiabetic activity of ZnO nanoparticles encompassed by Urtica dioica extract[J].Advanced Powder Technology, 2020, 31(5):2110-2118.
[11] OBANDA D N, RIBNICKY D, YU Y, et al.An extract of Urtica dioica L.mitigates obesity induced insulin resistance in mice skeletal muscle via protein phosphatase 2A (PP2A)[J].Scientific Reports, 2016, 6(1):1-9.
[12] YANG L, CAO D, GU X D, et al.Optimization of extraction process for polysaccharides of Urtica fissa E.Pritz[J].Medicinal Plant, 2018, 9(2):44-47.
[13] 沈子琦, 信传鑫, 田瑞, 等.半仿生法降解桦褐孔菌菌核多糖的研究[J].畜牧与饲料科学, 2019, 40(12):1-5.
SHEN Z Q, XIN C X, TIAN R, et al.Semi-bionic degradation of polysaccharides isolated from the Sclerotium of Inonotus obliquus [J].Animal Husbandry and Feed Science, 2019, 40(12):1-5.
[14] NOLAN C J, PRENTKI M.Insulin resistance and insulin hypersecretion in the metabolic syndrome and type 2 diabetes:Time for a conceptual framework shift[J].Diabetes and Vascular Disease Research, 2019, 16(2):118-127.
[15] POUALEU KAMANI S, KAMGAING WAGUIA J, MIAFFO D, et al.Efficacy of Emilia coccinea aqueous extract on inhibition of α-amylase enzyme activity and insulin resistance in dexamethasone treated-rats[J].Metabolism Open, 2022, 15:100193.
[16] WANGKIRI N, SARNSRI T, THONGKANJANA T, et al.Antioxidant potentials and inhibitory activities against α-amylase and α-glucosidase, and glucose uptake activity in insulin-resistance HepG2 cells of some medicinal plants[J].Agriculture and Natural Resources, 2021, 55(1):98-104.
[17] 范保瑞, 马逢伯, 刘卉.半仿生法提取夏枯草中熊果酸和齐墩果酸 [J].河北大学学报(自然科学版), 2019, 39(6):605-610.
FAN B R, MA B F, LIU H, et al.Study on the extraction of ursolic acid and oleanolic acid of Prunella vulgaris by semi bionic method[J].Journal of Hebei University (Natural Science Edition), 2019, 39(6):605-610.
[18] CHEN G, LIU Y J, CUI X.Ultrasonic-assisted semi-bionic extraction of total flavonoids from Soutellaria barbata[J].Medicinal Plant, 2014, 5(1):7-10.
[19] THUY H L T, BAO C H, PHUONG T V T, et al.Deproteinization in purification of exopolysaccharide from Ophiocordyceps sinensis olive oil-stimulated culture[J].International Journal of Agricultural Technology, 2018, 14(7):2151-2162.
[20] THU DAO T A, WEBB H K, MALHERBE F.Optimization of pectin extraction from fruit peels by response surface method:Conventional versus microwave-assisted heating[J].Food Hydrocolloids, 2021, 113:106475.
[21] CHEN F, HUANG G L.Antioxidant activity of polysaccharides from different sources of ginseng[J].International Journal of Biological Macromolecules, 2019, 125:906-908.
[22] REKOWSKI A, LANGENKAMPER G, DIER M, et al.Determination of soluble wheat protein fractions using the Bradford assay[J].Cereal Chemistry, 2021, 98(5):1059-1065.
[23] SHANG H M, CHEN S L, LI R, et al.Influences of extraction methods on physicochemical characteristics and activities of Astragalus cicer L.polysaccharides[J].Process Biochemistry, 2018, 73:220-227.
[24] CUI M X, TIAN J Y, SUN J, et al.Isolation, structural analysis and anti-inflammatory activity of a polysaccharide from Ilex cornuta fruits[J].Chemistry &Biodiversity, 2022, 19(6):e202200084.
[25] KUMARI P K, UMAKANTH A V, NARSAIAH T B, et al.Exploring anthocyanins, antioxidant capacity and α-glucosidase inhibition in bran and flour extracts of selected sorghum genotypes[J].Food Bioscience, 2021, 41:100979.
[26] POOVITHA S, PARANI M.In vitro and in vivo α-amylase and α-glucosidase inhibiting activities of the protein extracts from two varieties of bitter gourd (Momordica charantia L.)[J].BMC Complementary and Alternative Medicine, 2016, 16(1):185.
[27] CHEN S, WU Q G, LI X L, et al.Characterization of cytochrome P450 s (CYP)-overexpressing HepG2 cells for assessing drug and chemical-induced liver toxicity[J].Journal of Environmental Science and Health, Part C, 2022, 39(1):68-86.
[28] NOVOSELOVA E G, GLUSHKOVA O V, PARFENUYK S B, et al.Protective effect of peroxiredoxin 6 against toxic effects of glucose and cytokines in pancreatic RIN-m5F β-cells[J].Biochemistry (Moscow), 2019, 84(6):637-643.
[29] CHEN G L, XU Y B, WU J L, et al.Hypoglycemic and hypolipidemic effects of Moringa oleifera leaves and their functional chemical constituents[J].Food Chemistry, 2020, 333:127478.
[30] CHENG J W, SONG J L, WEI H L, et al.Structural characterization and hypoglycemic activity of an intracellular polysaccharide from Sanghuangporus sanghuang mycelia[J].International Journal of Biological Macromolecules, 2020, 164:3305-3314.
[31] ZHANG Q, KONG X J, YUAN H, et al.Mangiferin improved palmitate-induced-insulin resistance by promoting free fatty acid metabolism in HepG2 and C2C12 cells via PPARα:Mangiferin improved insulin resistance[J].Journal of Diabetes Research, 2019: 2052675.
[32] CAO C L, LI C, CHEN Q, et al.Physicochemical characterization, potential antioxidant and hypoglycemic activity of polysaccharide from Sargassum pallidum[J].International Journal of Biological Macromolecules, 2019, 139:1009-1017.