脱落酸(S-abscisic acid,S-ABA),一种重要的植物生长调节剂,其与生长素、赤霉素、细胞分裂素、乙烯共同组成五大植物内源生长调节剂[1-2],其主要功能为提高植物抗病性、抗寒性、抗旱性,加速营养物质积累,提高作物逆境下的抵御和修复能力,显著改善植物品质、提高苗木成活率、增加水稻分蘖和提高水稻抗性、保花保果[1]、还具有促进种子和果实贮存蛋白与糖分的积累,提高农作物与水果的品质以及控制花芽分化,调节花期的应用[3],现主要生产方式为发酵生产,产生菌为Botrytis cinerea[4]。
液态发酵过程中,Botrytis cinerea菌体形态会因多种外部工艺条件以及营养条件变化,出现絮状聚集体、菌丝团块、菌丝球等表现(图1),而这些表现直接影响了发酵液物质、氧传质以及黏度、流动情况等特性[5-6]。目前关于S-ABA发酵生产相关的文献主要针对于高产菌株筛选[7-8]、培养基优化[9]、发酵条件优化[10-11]方面,而关于菌体形态与S-ABA产量研究较少。以往的针对其他丝状真菌液态发酵研究中,通过考察基因表达[12-13]、调节搅拌转速[14]、调整碳氮比[15]、增加微颗粒[16]来进行菌体形态控制,对次级代谢产物的生产具有重要意义[17-18]。本研究结合真菌形态工程理论,采用响应面分析方法优化发酵工艺及相关参数,控制发酵过程中的菌体形态,从而达到提高S-ABA产量,为Botrytis cinerea菌体工业化发酵产S-ABA提供依据。
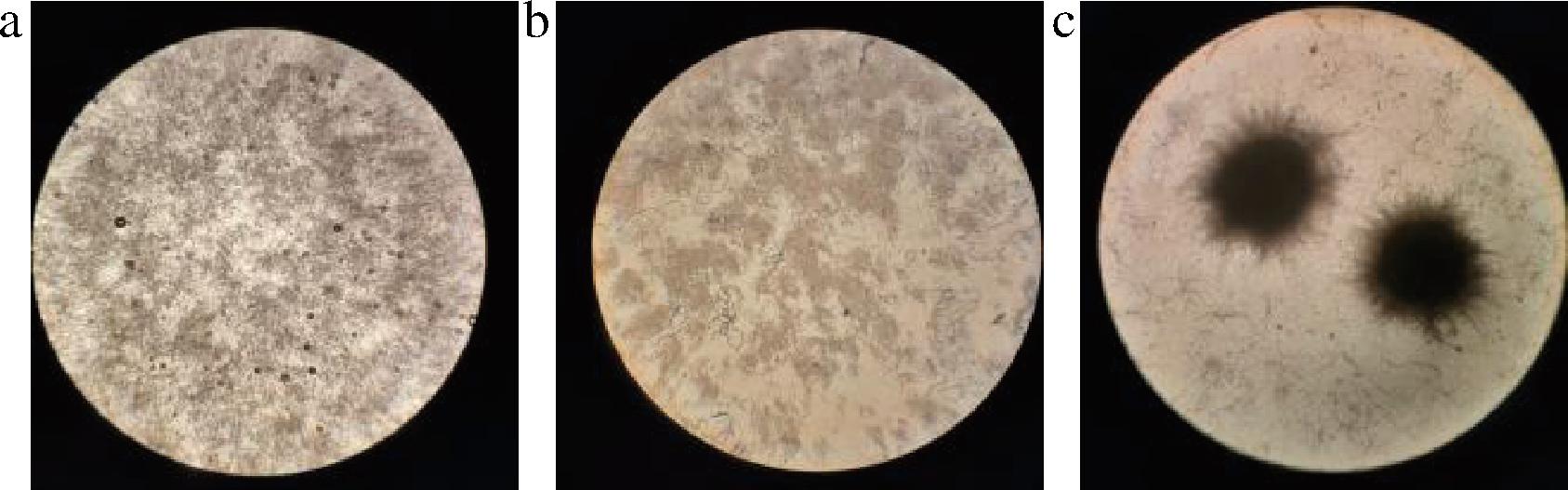
a-絮状聚集体;b-菌丝团块;c-菌丝球
图1 Botrytis cinerea液态发酵菌体的形态
Fig.1 Morphology of Botrytis cinerea liquid fermentation cell
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
本文实验中所使用的Botrytis cinerea菌株由龙蟒福生科技有限公司保存,由中科院成都生物研究所谭红教授诱变筛选的高产Botrytis cinerea菌株。
1.1.2 试剂
大豆蛋白粉、SD-300分散型,临沂山松生物制品有限公司;葡萄糖、玉米蛋白粉、玉米淀粉、食品级玉米油,山东西王糖业有限公司;甘油(食品级),中孚油脂(广州)集团有限公司;琼脂粉(分析纯),天津致远化学试剂有限公司、泡敌、GPE-2000,江苏海安石油化工厂;ZnSO4、MnSO4、FeSO4、(NH4)2SO4、MgSO4·7H2O、KH2PO4,均分析纯试剂,西陇科学股份有限公司。
1.1.3 培养基
种子培养基:PDA培养基取马铃薯200 g,去皮切成小块,用蒸馏水煮沸20 min,8层纱布过滤,加入20 g葡萄糖,定容至1 L。灭菌参数为121 ℃,20 min。
发酵培养基(g/L):玉米淀粉15、玉米油1、甘油5.5、玉米蛋白粉2、K2HPO4 0.6、MnSO4 0.01、FeSO4 0.01、ZnSO4 0.01 g/L。
1.2 仪器与设备
ME204分析天平,瑞士梅特勒托利多;SW-CJ-2F超净工作台,中国苏州净化;G80F23CN3P-BM1(G0)微波炉,中国格兰仕电器;TG16-WS离心机,中国湘仪;DGG-9240AD鼓风干燥箱,中国上海齐欣;BSD-YX3600恒温摇床,中国上海博迅;LX-B50L高压蒸汽灭菌锅,中国合肥华泰医疗设备有限公司;CX23显微镜,日本奥林巴斯;LC20高效液相色谱系统,日本岛津;15L-50L×2小试发酵系统,中国上海国强。
1.3 实验方法
1.3.1 培养方法
种子活化:取保存于-64 ℃的菌种接种于PDA平板,28 ℃恒温培养48 h。将保存的菌种接种到茄瓶培养基中,28 ℃培养24~48 h,观察菌落形态。用接种环挑取一环茄瓶中的菌种,接种到50 mL/250 mL种子培养基中,28 ℃、200 r/min恒温培养18 h。
发酵培养(摇瓶):使用灭菌后的移液器吸取2 mL接种发酵培养摇瓶(带挡板),培养基100 mL/500 mL,28 ℃、200 r/min恒温培养20 d。
发酵培养(发酵罐):以0.1%的接种量(10 mL摇瓶种子液)接种到发酵罐种子培养液,发酵培养基的装液量为 50 L发酵罐装入 16 L 培养基,转速200~600 r/min,通气量 1~3 vvm,27 ℃下培养 18 d。
1.3.2 分析方法
菌体生长量测定方法:干重法测定菌体生长量,量取10 mL发酵液入15 mL离心管,称取10 mL发酵液重量,离心条件,使用水平转子,10 000 r/min,离心10 min。离心完成后倾倒上清液,蒸馏水冲洗菌体,再进行离心,冲洗程序重复2次。将离心管放入60 ℃鼓风干燥箱,烘干48 h,称重得到菌体干重。
菌体形态测定法:菌体形态采用拍照结合显微镜标尺测量菌体形态,唐文俊等[19]在建立黑曲霉发酵过程中菌体形态的分析方法时,使用显微测微尺预先确定拍摄照片的像素点与实际长度比例,再使用软件进行统计分析。鉴于公司现有条件,调整形态分析方法如下:对发酵液进行搅拌混合,吸取3 mL滴入盛有20 mL生理盐水的培养皿,分散菌体,吸取分散的菌体滴加在显微镜标尺合适的量程内,进行显微观察,拍照并记录菌丝形态、尺寸数据。每一批发酵液重复10个处理,对数据进行平均得到发酵液体平均尺寸。
S-ABA含量检测制样方法:取适量发酵液,5 000 r/min离心5 min,吸取上清液,超纯水稀释10倍,通过0.22 μm水系膜直接进样检测。
S-ABA含量检测液相条件:S-ABA为胞内产生释放至发酵液,参考姚晨涛等[20]对高效液相色谱法测定S-ABA及对其设计浓度验证实验中的方法,采用HPLC系统,包含脱气机(DGU-20A3R),二元泵(LC-20AT),自动进样器(SIL-20A),柱温箱(CTO-10AS vp),UV/VIS检测器(SPD-20A),使用Eclipse XDB-C18 色谱柱(150 mm×4.6 mm,3.5 μm),进样量:10 μL,以V(甲醇)∶V(水)=1∶1(用磷酸调pH值至3)为流动相,在254 nm处对试样中的S-ABA进行高效液相色谱分离和测定。柱温30 ℃,流动相流速1.5 mL/min。
Plackett-Burman试验设计:在单因素实验基础上,以S-ABA产量为主要响应值,菌丝球直径为次要响应值,对搅拌强度、初始pH、CaCO3添加量、接种量、通气量以及碳氮比6个影响因素进行评价,设计Plackett-Burman试验,筛选出主效应因素,每个因素取最低(-1)和最高(1)两个水平,共12组实验,试验因素和水平见表1。
表1 Plackett-Burman试验设计的因素水平表
Table 1 Factor level table for Plackett-Burman experimental design

水平因素A(搅拌转速)/(r/min)B(初始pH)C(CaCO3添加量)/%D(接种量)/%E(通气量/换气比)/vvmF(碳氮比)-13506050.52017007512.5230
实验中将6个因素进行全面考察,实验次数n=12的实验设计,A、B、C、D、E、F分别代表碳氮比、初始pH、CaCO3添加量、接种量、通气量以及搅拌强度6个影响因素,每个因素取最低最高两个水平。
响应面分析:以Plackett-Burman试验结果为基础,进行Box-Behnken设计,对实验结果进行回归分析、误差分析并求得最优值,响应面分析结果,绘制响应面分析图,根据结果确定最佳发酵条件。用响应面分析所得的最佳发酵工艺条件进行3个批次平行实验,结果取平均值,验证所得的数学模型可靠性,得到最优发酵工艺结果。
1.4 数据处理与分析
采用Excel 2021、Design Expert 11处理数据和统计分析,GraphPad Prism 8软件进行绘图。
2 结果与分析
2.1 不同碳氮比对Botrytis cinerea菌体形态和产酸的影响
由表2可知,S-ABA产量随着碳氮比变化而变化,最高产量出现在碳氮比为25,达到1 218 mg/L,较CK(均值964.33 mg/L)提高26.3%,后随着碳氮比增高而降低,说明在适合的碳氮比条件下,可以有效提高Botrytis cinerea S-ABA产量,但过高的碳氮比会抑制S-ABA的合成,主要原因可能为底物抑制导致。同时,菌丝在液态发酵条件下菌体交联成团,紧密缠绕形成核区,更高的碳氮比会使核区增大,较大的核区会影响营养物质及溶解氧对核区内部菌丝体的供应,影响菌丝代谢,最终造成S-ABA产量差异,因此综合以上各参数,选择碳氮比25为最佳的Botrytis cinerea发酵培养基碳氮比条件。
表2 不同碳氮比对Botrytis cinerea形态和发酵结果的影响
Table 2 Effects of different C/N ratios on morphology and fermentation results of Botrytis cinerea

组别菌丝球尺寸/mm特点产量/(mg/L)pH干重/gCK1.7±2较紧实964.333.715.37碳氮比25∶12.2±1松散,分支较多1 174.333.525.29碳氮比30∶12.5±1松散,多分支962.333.425.33碳氮比35∶12.8±2松散,核区明显907.673.385.35碳氮比40∶13.2±3多分支,核区大704.333.325.35
2.2 不同pH对Botrytis cinerea菌体形态和产酸的影响
由表3可知,随着pH的逐渐升高,S-ABA产量、发酵最终pH、杂质含量及发酵液干重均有不同的表现,发酵液中最终pH随初始pH增大而增大,说明初始pH会影响整体发酵过程的酸碱平衡,因为碳源代谢会产生有机酸,使整体发酵体系偏酸性。发酵液干重方面,pH 4平均值5.33 g/10 mL,pH 7为5.36 g/10 mL,说明初始pH的变化对发酵液干重无明显影响,即发酵液初始pH对生长量影响较小;S-ABA产量方面,最高产量出现在pH 5.5,达到1 060.33 mg/L,较CK(均值989.67 mg/L)提高7.14%,后随着pH增高而先升高后降低,最低值为pH 7,均值为789.33 mg/L,说明在适合的pH条件下,可以有效提高Botrytis cinerea合成S-ABA产量,但过高或者过低的pH会产生抑制,主要原因可能为S-ABA的相关合成酶在pH值为5.5左右时有较好活性。菌丝体随pH的增长,尺寸先增大后减小,菌丝均较为紧密且表面光滑。说明在合适的pH条件下能形成适当松散的结构,有助于发酵液与菌丝球内部菌丝的物质、空气交换,利于产量的提高。因此综合以上各参数,选择pH值为5.5最佳的Botrytis cinerea发酵培养基pH条件。
表3 不同pH对Botrytis cinerea形态和发酵结果的影响
Table 3 Effects of different pH on the morphology and fermentation results of Botrytis cinerea
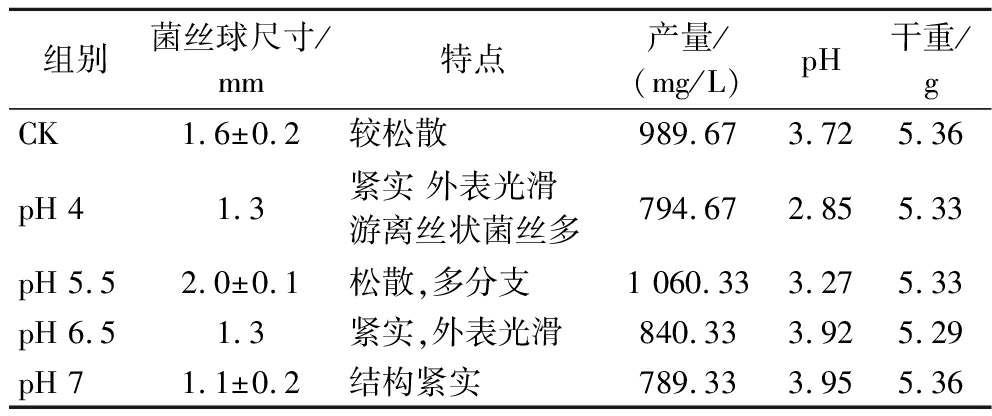
组别菌丝球尺寸/mm特点产量/(mg/L)pH干重/gCK1.6±0.2较松散989.673.725.36pH 41.3紧实 外表光滑游离丝状菌丝多794.672.855.33pH 5.52.0±0.1松散,多分支1 060.333.275.33pH 6.51.3紧实,外表光滑840.333.925.29pH 71.1±0.2结构紧实789.333.955.36
2.3 不同CaCO3浓度对Botrytis cinerea菌体形态和产酸的影响
如表4所示,发酵液pH随着CaCO3浓度的增加而增加(CaCO3添加量为50、60、70、80、90、100 g/L,分别以CaCO3 1~CaCO3 5代表),原因是CaCO3对发酵产生的有机酸有中和作用,影响发酵液pH变化;发酵液干重方面, CaCO3 1平均值5.31 g/10 mL,CaCO3 5为5.98 g/10 mL,干重随CaCO3增加而增加,原因是CaCO3不参与Botrytis cinerea发酵过程的生理活动;S-ABA产量方面,最高产量出现在CK组,达到978.33 mg/L,后随着CaCO3增加逐渐降低,最低值为CaCO3 5,均值为185.33 mg/L,说明在添加CaCO3条件下,对Botrytis cinerea产S-ABA有不利的影响,结合最佳pH摇瓶结果,最佳pH条件为5.5,而添加CaCO3条件下会影响发酵液pH变化,不利于S-ABA的合成。同时,随着CaCO3含量的增加,菌丝球趋向于形成更小更不规则的梭形,菌丝球紧实,边缘粗糙,部分黏着CaCO3颗粒。分析认为,微颗粒虽然不参与菌体生长,但会增加菌体在发酵培养基中碰撞的概率,菌丝以CaCO3颗粒为核心形成菌丝球,密度大结构紧实,边缘菌丝易与其他菌丝球互相缠绕、包裹形成多个核心,宏观表现为不规则或梭形,不利于S-ABA合成。因此综合以上各参数,选择不在培养基中增加CaCO3。
表4 CaCO3浓度对Botrytis cinerea形态和发酵结果的影响
Table 4 Effects of CaCO3 concentration on the morphology and fermentation results of Botrytis cinerea
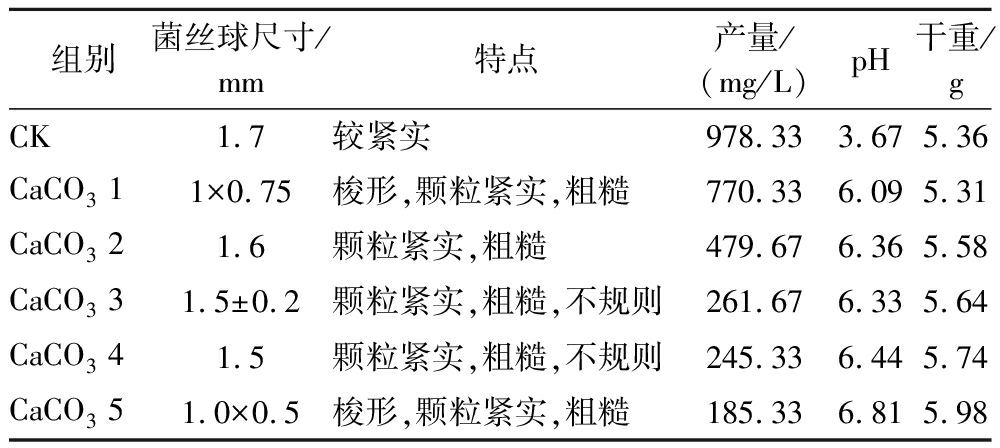
组别菌丝球尺寸/mm特点产量/(mg/L)pH干重/gCK1.7较紧实978.333.675.36CaCO3 11×0.75梭形,颗粒紧实,粗糙770.336.095.31CaCO3 21.6颗粒紧实,粗糙479.676.365.58CaCO3 31.5±0.2颗粒紧实,粗糙,不规则261.676.335.64CaCO3 41.5颗粒紧实,粗糙,不规则 245.336.445.74CaCO3 51.0×0.5梭形,颗粒紧实,粗糙185.336.815.98
2.4 接种量对Botrytis cinerea菌体形态和产酸的影响
在摇瓶实验基础上,总结适用于S-ABA发酵的碳氮比、固态载体添加量及最适pH,在50 L小试罐水平对接种量、通气比、搅拌转速条件。
根据统计,发酵12 d之前S-ABA积累量与接种量大小正相关,如图2所示,原因为接种量多,菌体数量大,S-ABA积累量相对更高;12 d之后,接种量10%罐与12.5%接种量罐S-ABA积累量相当,至发酵结束均保持较高的日增量,发酵结束时达到最大值6 938 mg/L。菌体形态方面,除10%接种量外,其他的接种量条件菌丝球尺寸波动较大, 10%接种量菌丝球保持1~1.2 mm,变化较小。因此综合以上表现,选择发酵最佳接种量为10%。
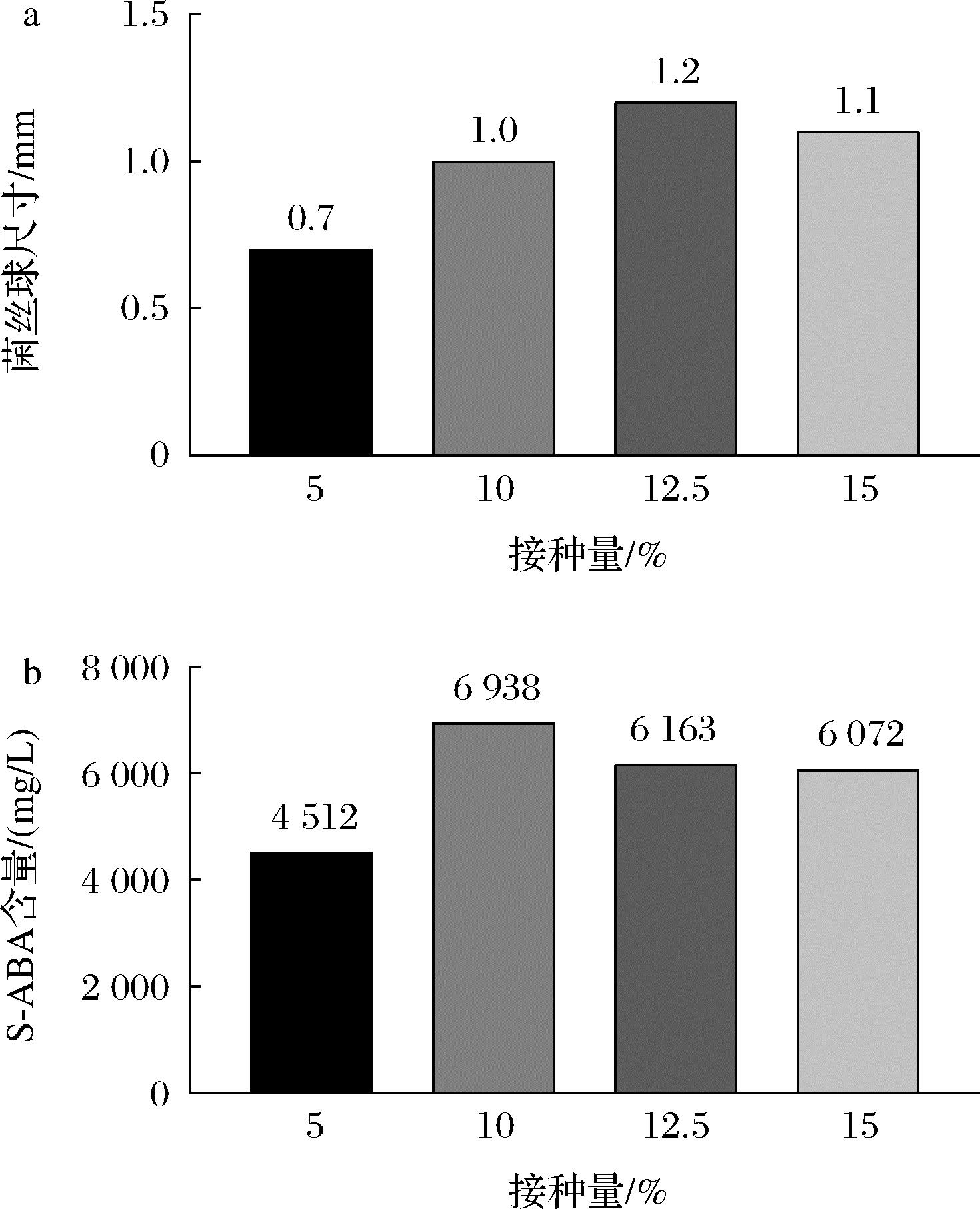
a-接种量对菌丝球尺寸的影响;b-接种量对发酵结果的影响
图2 接种量对Botrytis cinerea形态和发酵结果的影响
Fig.2 Effects of inoculation amount on the morphology and fermentation results of Botrytis cinerea
2.5 通气量对Botrytis cinerea菌体形态和产酸的影响
根据通气量实验,S-ABA的积累伴随着通气量的增长而增长,如图3所示。最低为0.5 vvm:4 479 mg/L,最高为3 vvm:7 013 mg/L。核算发酵液蒸腾损失,最高S-ABA产量为1 vvm:6 719.68 mg/L;伴随着通气比增加,菌体趋向于形成颗粒更小的菌丝球,结构致密,表面光滑,最小为通气量3 vvm,直径0.4 mm;而1 vvm发酵液菌丝球尺寸维持0.9~1.2 mm,结构相对疏松,有助于物质与氧气对菌丝球内部的扩散。
在此实验基础上,可以确定最佳通气比为1 vvm。
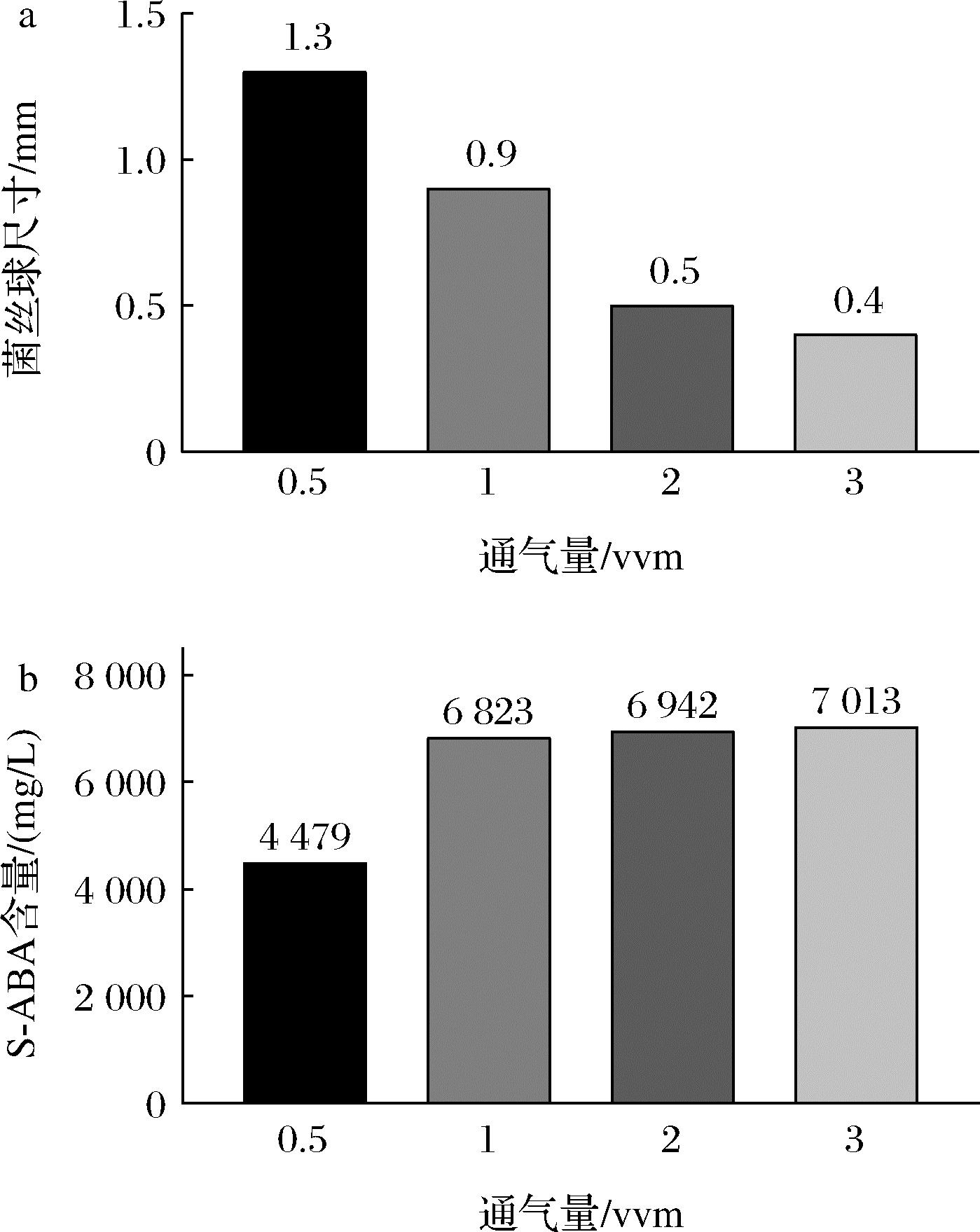
a-通气量对菌丝球尺寸的影响;b-通气量对发酵结果的影响
图3 通气量对Botrytis cinerea形态和发酵结果的影响
Fig.3 Effects of ventilation capacity on the morphology and fermentation results of Botrytis cinerea
2.6 搅拌对Botrytis cinerea菌体形态和产酸的影响
在转速实验中,S-ABA的产量随着转速增高而先升高后降低,如图4所示,最高出现在500 r/min,达到6 853 mg/L,较最低转速200 r/min提高56.96%。最低值为200 r/min,均值为4 366 mg/L, 700 r/min条件下产量低于500 r/min,说明合适的搅拌条件对S-ABA合成是有利,但过高或者过低的搅拌会抑制S-ABA的合成;在菌丝球尺寸方面,350 r/min转速条件下菌丝球尺寸最大,为2.0 mm左右,最低为700、0.5、500 r/min转速条件下菌丝球尺寸维持在0.8~1 mm,尺寸适中、体积稳定,菌丝形成与破坏达到一定的平衡,合成S-ABA在营养条件、通气条件以及结构、菌丝球表面条件均处于较为稳定的状态。综合以上表现,500 r/min为最适合的搅拌转速条件。

a-转速对菌丝球尺寸的影响;b-转速对发酵产量的影响
图4 搅拌强度对Botrytis cinerea形态和发酵结果的影响
Fig.4 Effects of agitation intensity on the morphology and fermentation results of Botrytis cinerea
2.7 S-ABA发酵工艺响应面优化
在单因素实验基础上,以搅拌强度(A)、初始pH(B);CaCO3添加量(C)、接种量(D)、通气量(E)以及碳氮比(F)为自变量,以S-ABA产量为主要响应值,菌丝球直径为次要响应值,对6个影响因素进行评价,进行Plackett-Burman试验。根据实验结果,选取对S-ABA产量、菌丝球直径显著性影响的因素为搅拌转速、接种量和初始pH,进行3因素3水平的Box-Behnken 中心组合原理进行的响应面实验,实验设计方案与结果见表5、表6。
2.8 响应面试验回归方程的建立及方差分析
利用Design-Expert11软件对试验设计的结果进行多项式回归拟合分析,得到S-ABA产量回归方程:R=7 028.37-332.64A-774.03B-255.84C-350.51AB-1 178.82AC-815.74BC-1 691.35A2-1 535.5B2-2 510.53C2,根据表7中有关于回归模型的方差分析,可以发现此数学模型的P<0.000 1,表示该模型的回归性极显著,失拟项P=>0.1,不显著,说明该模型的拟合性好,相关系数R2=0.983 9,该模型可靠性高,可用于Botrytis cinerea产S-ABA的优化,根据F值可知,各个因素对S-ABA产量的影响大小顺序是:接种量>搅拌转速>初始pH。
表5 Box-Behnken实验设计的因素水平表和编码
Table 5 Factor level table and coding for Box-Behnken experimental design
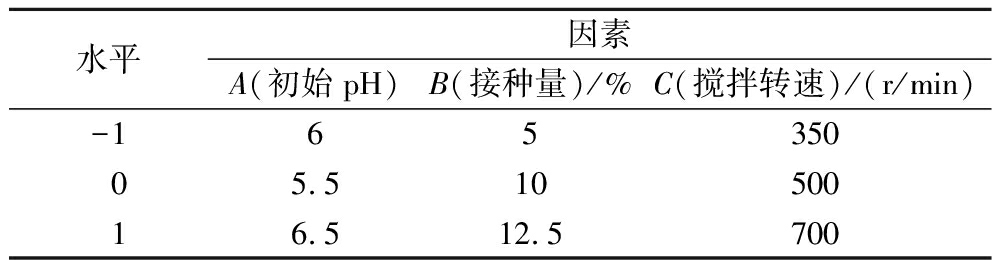
水平因素A(初始pH)B(接种量)/%C(搅拌转速)/(r/min)-16535005.51050016.512.5700
表6 响应面试验设计与结果
Table 6 Response surface experimental design and results

实验号A B C S-ABA产量/(mg/L)菌丝球直径/mm1-10-12 009.031.520006 092.641301-13 153.081.440006 215.38150-1-12 918.881.26-1-104 636.931.470-115 577.64181012 425.860.690113 401.11.310-10-12 472.971.4111-1-12 696.960.4120-106 713.661131101 905.40.8140006 444.13115-1103 476.311.3160006 852.130.917-1015 071.741.1
表7 S-ABA的回归模型的方差分析
Table 7 Analysis of variance in the regression model of S-ABA

来源平方和自由度均方F值P值模型50 390 00095 598 00047.62<0.000 1A 600 2001600 2005.10.058 4B 4 040 00014 040 00034.360.000 6C122 5001122 5001.040.341 4AB265 0001265 0002.250.177AC2 205 00012 205 00018.750.003 4BC1 826 00011 826 00015.530.005 6A210 550 000110 550 00089.71<0.000 1B25 423 00015 423 00046.120.000 3C24 404 00014 404 00037.450.000 5残差823 0007117 600失拟项380 5003126 8001.150.432 2净误差442 5004110 600总和51 210 00016
对另一响应值菌丝球尺寸,根据试验设计的结果进行多项式回归拟合分析,得到菌丝球直径的回归方程:R=0.863 2-0.398A+0.120 2B-0.029 5C+0.143 4AB+0.110 8AC+0.021 1BC-0.107 8A2+0.198 3B2+0.148 6C2,根据表8关于回归模型的方差分析表现,可以发现此数学模型类似于S-ABA产量回归模型,在影响因子显著性上与S-ABA积累量不同,为搅拌转速>接种量>初始pH,此数学模型的P<0.000 1,表示该模型的回归性极显著,失拟项P=>0.1,不显著,说明该模型的拟合性好,相关系数R2=0.983,该模型可靠性高,可用于Botrytis cinerea菌体形态的优化。
响应面的等高线、坡度以及坐标轴的交点在响应面实验中反映了试验的各个因子对结果响应值的影响的大小,由图5可知,搅拌强度、初始pH以及接种量交互作用显著,影响S-ABA产量最显著的因素是接种量的大小,表现为响应面弧度变化最大,其次是搅拌强度,且搅拌强度与初始pH交互作用、接种量与初始pH交互作用影响也极显著。同时,影响菌丝球形态的因素交互作用表现如图6所示。
表8 菌丝球直径的回归模型的方差分析
Table 8 Analysis of variance for regression models of filamentous sphere diameter

来源平方和自由度均方F值P值模型1.4190.156 344.99<0.000 1A 0.859 410.859 4247.42<0.000 1B 0.097 410.097 428.040.001 1C0.001 610.001 60.469 40.515 3AB0.044 410.044 412.780.009AC0.019 3 10.019 35.550.050 7BC0.001 210.001 20.3510.572 2A20.042 810.042 812.330.009 8B20.090 510.090 526.050.001 4C20.015 410.015 44.440.073 1残差0.024 370.003 5失拟项0.011 830.003 91.260.400 1净误差0.012 540.003 1总和1.4316
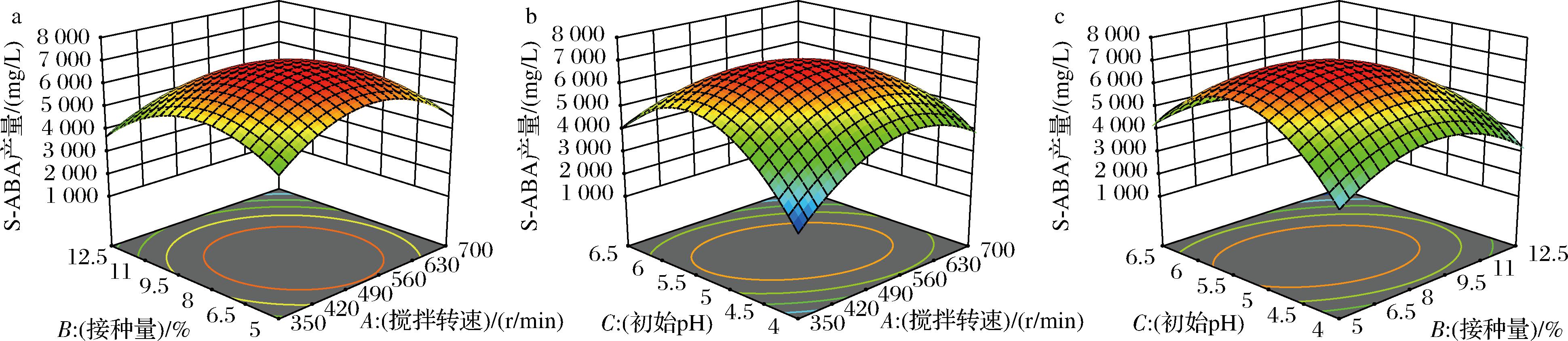
a-搅拌转速与接种量交互作用对S-ABA产量的影响;b-搅拌转速与初始pH交互作用对S-ABA产量的影响; c-接种量与初始pH交互作用对S-ABA产量的影响
图5 各因素的交互作用对S-ABA产量的影响
Fig.5 The impact of the interaction of various factors on the yield of S-ABA

a-搅拌转速与接种量交互作用对菌丝球直径的影响;b-搅拌转速与初始pH交互作用对菌丝球直径的影响; c-接种量与初始pH交互作用对菌丝球直径的影响
图6 各因素的交互作用对菌丝球直径的影响
Fig.6 The influence of the interaction of various factors on the diameter of filamentous spheres
2.9 响应面验证试验
利用已经建立的数学模型预测S-ABA的最佳工艺条件为搅拌强度535.819 r/min;初始pH=5.127 11;接种量10.777 9%,考虑到实际的操作,修正以上工艺参数如下,搅拌强度535 r/min;初始pH 5.1;接种量11%。
在此条件下3次重复实验结果为:S-ABA产量平均值7 189.52 mg/L,菌丝球直径0.95 mm,与理论预测值产量7 105.3 mg/L、菌丝球尺寸0.913 875 mm,偏差较小,说明该模型能够较好地预测S-ABA的发酵结果,同时相对于单因素实验最高产量6 938 mg/L提升3.63%,与原工艺相比(平均产量6 597.82 mg/L),提升了约8.23%,与福生公司生产平均产量6 400~6 600 mg/L相比,提升11.5%。
3 结论
通过单因素实验、Plackett-Burman试验,分别以S-ABA积累量、菌丝球直径作为响应值,在6种变量中确定了搅拌强度、接种量、初始pH为最主要的影响因素,后续通过3因素3水平的Box-Behnken实验进行响应面分析,明确了对S-ABA产量的影响大小顺序是:接种量>搅拌转速>初始pH,而在对菌丝球形态影响因子显著性搅拌转速>接种量>初始pH,各因素交互性上,针对S-ABA的产量,搅拌强度与初始pH交互作用、接种量与初始pH交互作用影响极显著,同时针对菌丝球尺寸变化,搅拌强度与接种量的符合作用影响极显著。
通过响应面实验得到最佳工艺参数:搅拌强度535 r/min;初始pH 5.1;接种量:11%。在此条件下3次重复实验结果为:S-ABA产量平均值7 189.52 mg/L,菌丝球直径0.95 mm,与理论预测值产量7 105.3 mg/L、菌丝球尺寸0.913 875 mm,偏差较小,说明该模型能够较好地预测S-ABA的发酵结果,且平均实验产量与原工艺相比(平均产量6 597.82 mg/L),提升了约8.23%,与福生公司生产平均产量6 400~6 600 mg/L相比,提升11.5%,工艺优化效果明显。
[1] 施天穹, 彭辉, 季荣钰, 等. 微生物发酵法产脱落酸的研究进展[J]. 化工进展, 2016, 35(7):2140-2144.
SHI T Q, PENG H, JI R Y, et al. Production of abscisic acid by fermentation: A review[J]. Chemical Industry and Engineering Progress, 2016, 35(7):2140-2144.
[2] 解艳玲, 杜军, 沈振荣, 等. S-诱抗素研究进展[J]. 安徽农业科学, 2013, 41(4):1517-1518; 1554.
XIE Y L, DU J, SHEN Z R, et al. Research advance of S-auxin[J]. Journal of Anhui Agricultural Sciences, 2013, 41(4):1517-1518; 1554.
[3] 谭红. 真菌发酵生产天然脱落酸[J]. 精细与专用化学品, 2002, 10(24):16-18.
TAN H. Natural abscisic acid produced by fungus fermentation[J]. Fine and Specialty Chemicals, 2002, 10(24):16-18.
[4] 郑珩, 吴江, 吴梧桐. 脱落酸产生菌的遗传育种[J]. 菌物系统, 1999, 18(2):164-167.
ZHENG H, WU J, WU W T. Mutation and selection of high producing strains of abscisic acid[J]. Mycosystema, 1999, 18(2):164-167.
[5] MARUMO S, KATAYAMA M, KOMORI E, et al. Microbial production of abscisic acid by Botrytis cinerea[J]. Agricultural and Biological Chemistry, 1982, 46(7):1967-1968.
[6] DRIOUCH H, H NSCH R, WUCHERPFENNIG T, et al. Improved enzyme production by bio-pellets of Aspergillus niger: Targeted morphology engineering using titanate microparticles[J]. Biotechnology and Bioengineering, 2012, 109(2):462-471.
NSCH R, WUCHERPFENNIG T, et al. Improved enzyme production by bio-pellets of Aspergillus niger: Targeted morphology engineering using titanate microparticles[J]. Biotechnology and Bioengineering, 2012, 109(2):462-471.
[7] SABERI A, JALILI H, NIKFARJAM A, et al. Monitoring of Aspergillus terreus morphology for the lovastatin production in submerge culture by impedimetry[J]. Biochemical Engineering Journal, 2020, 159:107615.
[8] MIYAZAWA K, YOSHIMI A, ABE K. The mechanisms of hyphal pellet formation mediated by polysaccharides, α-1, 3-glucan and galactosaminogalactan, in Aspergillus species[J]. Fungal Biology and Biotechnology, 2020, 7(1):1-13.
[9] BIZUKOJC M, LEDAKOWICZ S. The morphological and physiological evolution of Aspergillus terreus mycelium in the submerged culture and its relation to the formation of secondary metabolites[J]. World Journal of Microbiology and Biotechnology, 2010, 26(1):41-54.
[10] 周欣欣, 陈立萍, 王宁, 等. S-诱抗素(ABA)产业发展现状及展望[J]. 农药科学与管理, 2017, 38(10):21-24.
ZHOU X X, CHEN L P, WANG N, et al. Current situation and prospects of abscisic acid(ABA) industry[J]. Pesticide Science and Administration, 2017, 38(10):21-24.
[11] 郑珩, 盛海林, 吴江, 等. 脱落酸产生菌液体发酵培养基的优化[J]. 中国药科大学学报, 1999, 30(6): 460-462.
ZHENG H, SHENG H L, WU J, et al. Optimization of liquid fermentation condition of abscisic acid producing strains[J]. Journal of China Pharmaceutical University, 1999, 30(6): 460-462.
[12] YANG X L, XIANG L B, ZHANG C, et al. Promotion of monacolin K production in Monascus extractive fermentation: The variation in fungal morphology and in the expression levels of biosynthetic gene clusters[J]. Journal of the Science of Food and Agriculture, 2021, 101(13):5652-5659.
[13] 刘瑞桑, 汤亚杰, 白凤武. 丝状真菌液体深层发酵过程菌丝聚集的调控机制[J]. 生物工程学报, 2019, 35(5):749-758.
LIU R S, TANG Y J, BAI F W. Regulatory mechanism underlying mycelium aggregation during filamentous fungi submerged fermentation[J]. Chinese Journal of Biotechnology, 2019, 35(5):749-758.
[14] CHEN X L, ZHOU J, DING Q, et al. Morphology engineering of Aspergillus oryzae for l-malate production[J]. Biotechnology and Bioengineering, 2019, 116(10):2662-2673.
[15] HUARTE-BONNET C, PAIX O F R S, MASCARIN G M, et al. The entomopathogenic fungus Beauveria bassiana produces microsclerotia-like pellets mediated by oxidative stress and peroxisome biogenesis[J]. Environmental Microbiology Reports, 2019, 11(4):518-524.
O F R S, MASCARIN G M, et al. The entomopathogenic fungus Beauveria bassiana produces microsclerotia-like pellets mediated by oxidative stress and peroxisome biogenesis[J]. Environmental Microbiology Reports, 2019, 11(4):518-524.
[16] DU L Q, GAO B L, LIANG J F, et al. Microparticle-enhanced Chaetomium globosum DX-THS3 β-d-glucuronidase production by controlled fungal morphology in submerged fermentation[J]. 3 Biotech, 2020, 10(3):100.
[17] CAIRNS T C, ZHENG X M, ZHENG P, et al. Moulding the mould: Understanding and reprogramming filamentous fungal growth and morphogenesis for next generation cell factories[J]. Biotechnology for Biofuels, 2019, 12:77.
[18] VEITER L, RAJAMANICKAM V, HERWIG C. The filamentous fungal pellet—Relationship between morphology and productivity[J]. Applied Microbiology and Biotechnology, 2018, 102(7):2997-3006.
[19] 唐文俊,夏建业,储炬,等.黑曲霉发酵过程中菌体形态的分析方法建立及应用.生物工程学报, 2015, 31(2): 291-299.
TANG W J, XIA J Y, CHU J, et al. Development and application of morphological analysis method in Aspergillus niger fermentation.Chin J Biotech, 2015, 31(2): 291-299.
[20] 姚晨涛, 刘铭钰, 孙晓, 等. 高效液相色谱法测定S-诱抗素及对其设计浓度验证. 现代农药, 2019, 18(3):32-35.
YAO C T, LIU M Y, SUN X, et al. Determination of S-ABA and design concentration by high performance liquid chromatography. Modern Agrochemicals, 2019, 18(3):32-35.