玉米淀粉糖渣是玉米淀粉液化、糖化后压滤得到的残渣,其含有丰富的还原糖、蛋白质和膳食纤维等成分。根据姚宇晨等[1]的预测,到2023年,我国玉米淀粉糖产量将超过2 400万t。相应地,预计每年将产生大约200万t的糖渣。目前,多数企业直接将糖渣作为饲料原料进行销售,但由于糖渣适口性差且含有营养限制因子,导致糖渣的饲喂效率较低[2]。
利用微生物发酵能够提升蛋白含量、改善风味、消除营养抑制因子,是实现糖渣高值利用的有效手段[3]。在玉米淀粉糖渣的发酵方式中,固体发酵具有对设备和发酵环境要求低、能耗低、排废少且利用率高等优势[4]。赵建国[5]以Y9601酵母为出发菌,固体发酵玉米淀粉渣, 通过工艺条件优化,产物酵母数可达7.45×109个/g,表观粗蛋白增加12.7%,真蛋白净增加5.46%,但该方法并不能改善玉米淀粉糖渣的风味、口味;曹磊[6]对玉米淀粉糖渣生产功能性乳酸菌活菌饲料进行了研究,在液态发酵中,将鼠李糖乳杆菌的活菌数由4.10×108 CFU/mL提高到1.08×109 CFU/mL,达到乳酸菌发挥有益作用要求的菌体密度;还对鼠李糖杆菌的固态发酵工艺条件进行了优化,得到了1.10×109 CFU/g的活菌数。前人研究表明,利用糖渣生产乳酸菌制剂是可行的。
本研究以玉米淀粉糖渣为原料,采用枯草芽孢杆菌协同乳杆菌发酵,旨在提高对糖渣中糖的利用率和乳杆菌的活菌数。对双菌发酵进行了种子液接种量、含水量、起始pH、装料量等因素的单因素优化,再选取3个显著影响的条件进行响应面优化,以提高乳杆菌活菌数。对双菌发酵产物和单菌发酵的产物的蛋白质、氨基酸、风味物质、抗营养因子和抗氧化能力进行了分析检测。本研究将为提升玉米淀粉糖渣附加值提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
玉米淀粉糖渣由山东菱花集团提供;麸皮采购于市场;化学试剂均购于国药集团化学试剂有限公司、北京伊诺凯试剂有限公司,纯度为分析纯。
1.1.2 菌种
嗜酸乳杆菌(Lactobacillus acidophilus),山东威昂生物科技有限公司;枯草芽孢杆菌(Bacillus subtilis),北海强兴生物科技有限公司。
1.1.3 培养基
1.1.3.1 种子液培养基
采用LB培养基培养芽孢杆菌;采用MRS培养基培养乳杆菌[7]。
1.1.3.2 固体培养基
固体培养基是将种子液培养基中添加30 g/L的琼脂制备而成。
固态发酵培养基:玉米淀粉糖渣与麸皮质量比1∶1,50%含水量,250 mL三角瓶装料量20 g,起始pH值为7,115 ℃灭菌15 min[8]。
1.2 仪器与设备
UV-1800紫外可见分光光度计,博讯(上海)有限公司;高效液相色谱仪,美国安捷伦有限公司;凯氏定氮仪,山东海能仪器有限公司;味觉分析仪,日本INSENT公司;Heracles II电子鼻,法国Alpha MOS S.A.有限公司。
1.3 实验方法
1.3.1 固态发酵的条件优化
双菌接种比例的优化:乳杆菌接种量5%,再按照乳杆菌与枯草芽孢杆菌的接种比例为5∶0、5∶1、5∶2、5∶3、5∶4(体积比,下同)接种,在37 ℃发酵48 h后,测定发酵物中的乳杆菌活菌数、pH、残糖量。
单因素发酵优化试验:种子液接种量、含水量、起始pH和装料量进行单因素发酵试验,以最高的乳杆菌菌落数为确定因素的最适范围。
为进一步提高乳杆菌活菌数,对前期单因素优化试验中确定的种子液接种量、起始pH和含水量为影响显著影响因素因素,进行响应面优化试验(表1)。
表1 乳杆菌发酵单因素试验因素与水平
Table 1 Lactobacillus acidophilus fermentation single factor test factors and levels
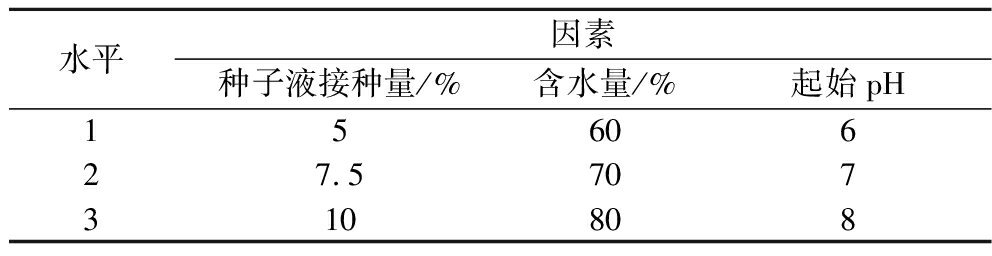
水平因素种子液接种量/%含水量/%起始pH1560627.5707310808
乳杆菌发酵工艺响应面优化试验:基于单因素试验结果,以乳杆菌菌落数(Y)为响应值,利用Box-Behnken进行工艺优化设计。根据响应面法建立的数学模型,分析预测乳杆菌最佳发酵工艺条件,对优化的工艺进行验证,对发酵产物进行评价。
1.3.2 乳杆菌计数方法
无菌条件下将样品稀释100倍,200 r/min摇床上振荡15 min,后逐级稀释至10-6,取100 μL稀释后菌液加入平板中,倒双层MRS固体培养基,37 ℃培养48 h,根据菌落数计乳杆菌数[9]。
1.3.3 葡萄糖测定方法:
葡萄糖测定参照SBA法[10]。
1.3.4 氨基酸、植酸、总酚、DPPH自由基清除率测定方法
将样品冷冻干燥后采用高效液相色谱法测定氨基酸含量[11]、双吡啶法测定植酸含量[12]、福林酚法测定总酚含量[13]、分光光度法测定DPPH自由基清除率[14]、凯氏定氮法测定蛋白质含量[15]。
1.3.5 电子鼻测定方法:
样品经冷冻干燥后采用Heracles Ⅱ电子鼻[16]进行分析测定。
1.3.6 电子舌测定方法:
样品经冷冻干燥后采用味觉分析仪[17]分析。
2 结果与分析
2.1 枯草芽孢杆菌与乳杆菌双菌试验
曹磊[6]对糖渣的固态发酵研究,发现鼠李糖乳杆菌不能直接利用糖渣中的粗蛋白,外源添加2%(质量分数)的蛋白胨可以促进乳杆菌的增殖。因此,氮源可能是限制乳杆菌在糖渣中增殖的主要因素。然而,外部添加氮源的方法不仅会增加成本并且增加了染菌的风险。ZHANG等[8]利用枯草芽孢杆菌MA139的固态发酵提高路氏乳杆菌G8-5的活力,多菌制剂的最高乳酸菌数目为9.01×109 CFU/g,最大芽孢杆菌数目为1.03×1010 CFU/g。研究认为枯草芽孢杆菌分泌蛋白酶并水解粗蛋白,为乳杆菌提供氮源,同时因枯草芽孢杆菌生长消耗了氧气,为乳杆菌增殖营造了厌氧环境。
基于上述已有研究结果,本研究尝试在糖渣中按不同比例同时接入乳杆菌和枯草芽孢杆菌。结果(图1)表明,随着枯草芽孢杆菌比例的增加,葡萄糖消耗量先增加后减少,终pH先下降后上升。乳杆菌活菌数在两菌比例为5∶2时最高,为1.50×109 CFU/g,比未添加枯草芽孢杆菌(5∶0)时高2.86倍,同时,终pH也因为乳杆菌的生长而降低。随着枯草芽孢杆菌比例的继续增加,导致乳杆菌活菌数下降,表明二者之间的竞争加剧,枯草芽孢杆菌成为优势菌株,这不利于葡萄糖利用率的增加。以上现象说明,适量添加枯草芽孢杆菌可以促进乳杆菌的生长,提高葡萄糖利用率。
2.2 响应面优化试验优化提高乳杆菌数
2.2.1 响应面试验优化试验
固定条件为发酵37 ℃、双菌种子液比例为5∶2、发酵时间为48 h、250 mL三角瓶装料量为20 g。以种子液接种量(A)、培养基含水量(B)、初始pH(C)为响应因子,以乳杆菌菌落数(Y)为响应值,根据Box-Behnken设计3因素3水平优化试验,试验设计见表2,响应面二次模型方差分析见表3。
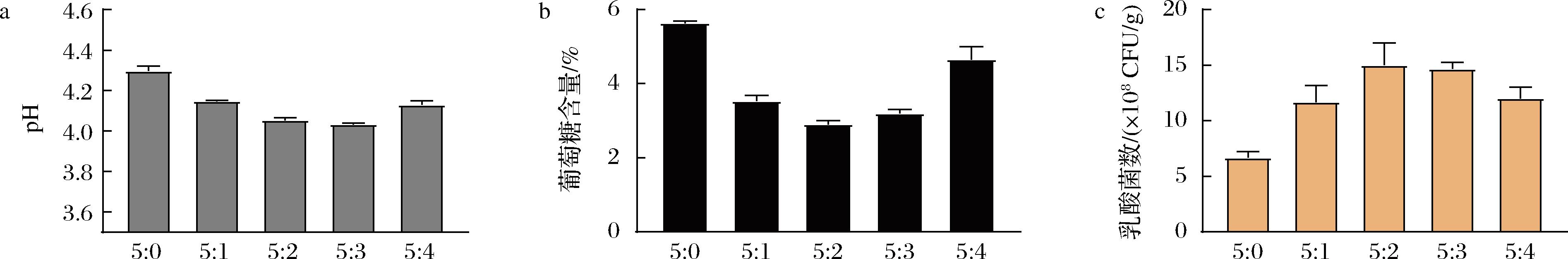
a-pH;b-葡萄糖含量;c-乳酸菌数
图1 枯草芽孢杆菌与乳杆菌接种比例对发酵的影响
Fig.1 Effect of Bacillus subtilis to Lactobacillus inoculation ratio on fermentation
注:比例为嗜酸乳杆菌:枯草芽孢杆菌种子液体积比。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken experimental design and results

实验编号因素种子液接种量/%含水量/%起始pH乳杆菌活菌数/(×109 CFU/g)17.57075.0627.57075.0037.57074.98456073.7557.58084.83658074.01757084.508107064.7397.56064.8510108074.421157063.80127.56084.48137.57074.93147.58064.0315106074.6016107084.60177.57075.06
表3 回归模型的方差分析
Table 3 Variance analysis of regression model

来源平方和自由度均方F值P值模型2.7390.303132.730.0002∗∗A0.655 510.655 570.800.000 2∗∗B0.019 010.019 02.050.201 8C0.125 010.125 013.500.010 4∗AB0.048 410.048 45.230.062 2AC0.172 210.172 218.600.005 0∗∗BC0.342 210.342 236.960.000 9∗∗A20.878 910.878 994.93<0.000 1∗∗B20.432 310.432 346.690.000 5∗∗C20.054 110.054 15.840.052 1残差0.055 660.009 3失拟项0.046 930.1565.400.099 7纯误差0.008 730.002 9总回归2.7816R2=0.980 0R2Adj=0.950 1
注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
根据Design Expert分析软件进行回归分析,得到乳杆菌活菌数对接种量、培养基含水量、初始pH的二次回归模型方程:
Y=4.99+0.268 3A-0.048 7B+0.125C-0.11AB-0.207 5AC+0.292 5BC-0.468 8A2-0.328 7B2-0.116 2C2
失拟项P=0.099 7>0.05影响不显著,说明回归方程有显著性,模型能较好分析和预测响应值;决定系数R2=0.98,说明模型的拟合性较好,调整决定性系数![]() 说明能利用该模型解释95.01%的响应值变化,可信度高。
说明能利用该模型解释95.01%的响应值变化,可信度高。
2.2.2 响应面试验验证的试验
根据响应面法建立的数学模型,分析预测出乳杆菌发酵工艺的最佳条件为:双菌种子液体积比为5∶2,乳杆菌与枯草芽孢杆菌接种量为7.8%,含水量为72%,初始pH为7.26,乳杆菌预测值为5.05×109 CFU/g。
根据优化后的工艺条件,在相同的实验条件下,对单菌和双菌发酵进行了测定,以获取乳杆菌的生长曲线,包括菌落数、pH值和残糖。实验结果如图2所示。
结果表明,在经过枯草芽孢杆菌协同发酵后,乳杆菌活菌数明显增加。相较于单一乳杆菌的发酵,双菌发酵的乳杆菌活菌数增加了2.42倍,达到了5.05×109 CFU/g。验证与模型预测值相符,说明响应面法优化乳杆菌发酵工艺是可行的,枯草芽孢杆菌和乳杆菌在发酵中具有协同作用。同时,发酵后的pH明显下降,这表明乳杆菌代谢活动增强,导致有机酸的累积。另外,葡萄糖消耗量也显著提高,表明协同发酵的代谢效率更高。
2.3 发酵产物组分分析
2.3.1 发酵产物功能性与抗营养因子等物质的分析
总酚在饲料中起到抗氧化、保护营养成分、提高稳定性和延长保存期的作用[18]。表4结果表明发酵可以显著增加总酚含量,其中双菌发酵的含量高于单菌发酵;植酸是一种抗营养因子,抑制动物肠道对矿物质的吸收,对动物生长和健康有负面影响[19],发酵过程中微生物分泌的植酸酶分解了植酸,使其含量显著降低;饲料清除DPPH自由基的能力越强,其抗氧化能力越强,发酵后的产物更有助于动物肠道健康[20]。发酵后,粗蛋白质、水解氨基酸和游离氨基酸的含量会增加。这种现象一方面是由于总体干重的减少,另一方面则是因为乳杆菌和枯草芽孢杆菌分泌的相关酶作用的结果。综合来看,双菌发酵比单菌发酵的效果更好,二者与未发酵的糖渣相比,营养物质增加、功能性增强和抗营养因子减少。

a-乳酸菌数;b-pH;c-葡萄糖含量
图2 单乳杆菌、双菌协同发酵效果对比
Fig.2 Comparison of synergistic fermentation effects of Lactobacillus monosis and Lactobacillus monobacterium
表4 功能性与抗营养因子分析表
Table 4 Table of functional and anti-nutritional factor analysis

项目糖渣乳杆菌发酵物乳杆菌+枯草芽孢杆菌发酵物总酚含量/(mg/g)9.59±0.1314.56±0.0516.49±0.03 植酸含量/(mg/g)1.66±0.01 0.45±0.010.42±0.01DPPH自由基清除率/%85.00±0.01 96.00±0.0197.00±0.01 粗蛋白/(mg/g)14.30±0.05 16.37±0.0620.26±0.08 水解氨基酸/(mg/g)14.13±0.05 16.15±0.0620.12±0.08 游离氨基酸/(mg/g)0.032±0.002 0.063±0.0090.086±0.007
2.3.2 电子鼻风味特征性分析
使用Heracles Ⅱ电子鼻,对糖渣、乳杆菌的单菌发酵物以及双菌的发酵物进行了风味性物质分析(图3)。每个保留时间对应着相应的化合物和相关风味。如表5所示,在保留时间为18.18、24.71 min的潜在可能性组成中,主要成分为二甲硫醚,该物质具有不愉快气味和毒性,另一成分乙硫醇则具有刺激性蒜臭味和微毒性。经过发酵后,这些气味显著减少。在保留时间为52.48、62.70、66.74 min的潜在可能性组成中,主要成分为环己醇、辛酮、庚酸甲酯等具有芳香气味的物质。发酵后,这类物质的含量明显增加。而在保留时间为36.24 min的潜在可能性组成中,主要成分为丁二醇,该物质只在混菌发酵中存在,具有类水果味和奶油味。此外,在保留时间为64.13 min的潜在主要成分中,单菌发酵新增正葵烷等芳香类物质,而混菌发酵则主要新增2-乙基-3-甲基吡嗪,该物质具有强烈的坚果香味。
综上所述,经过发酵后,3种糖渣的气味出现了明显的差异。未发酵的糖渣多为酸臭味等不愉快气味,乳杆菌的单菌发酵物减少了臭味,同时增加了醇和脂类的香味。乳杆菌和枯草芽孢杆菌双菌的发酵物则在减少臭味的基础上,增加了强烈的类坚果香味。单菌发酵和双菌协同发酵都可以改善糖渣的风味,但双菌协同发酵的香味更为浓烈。
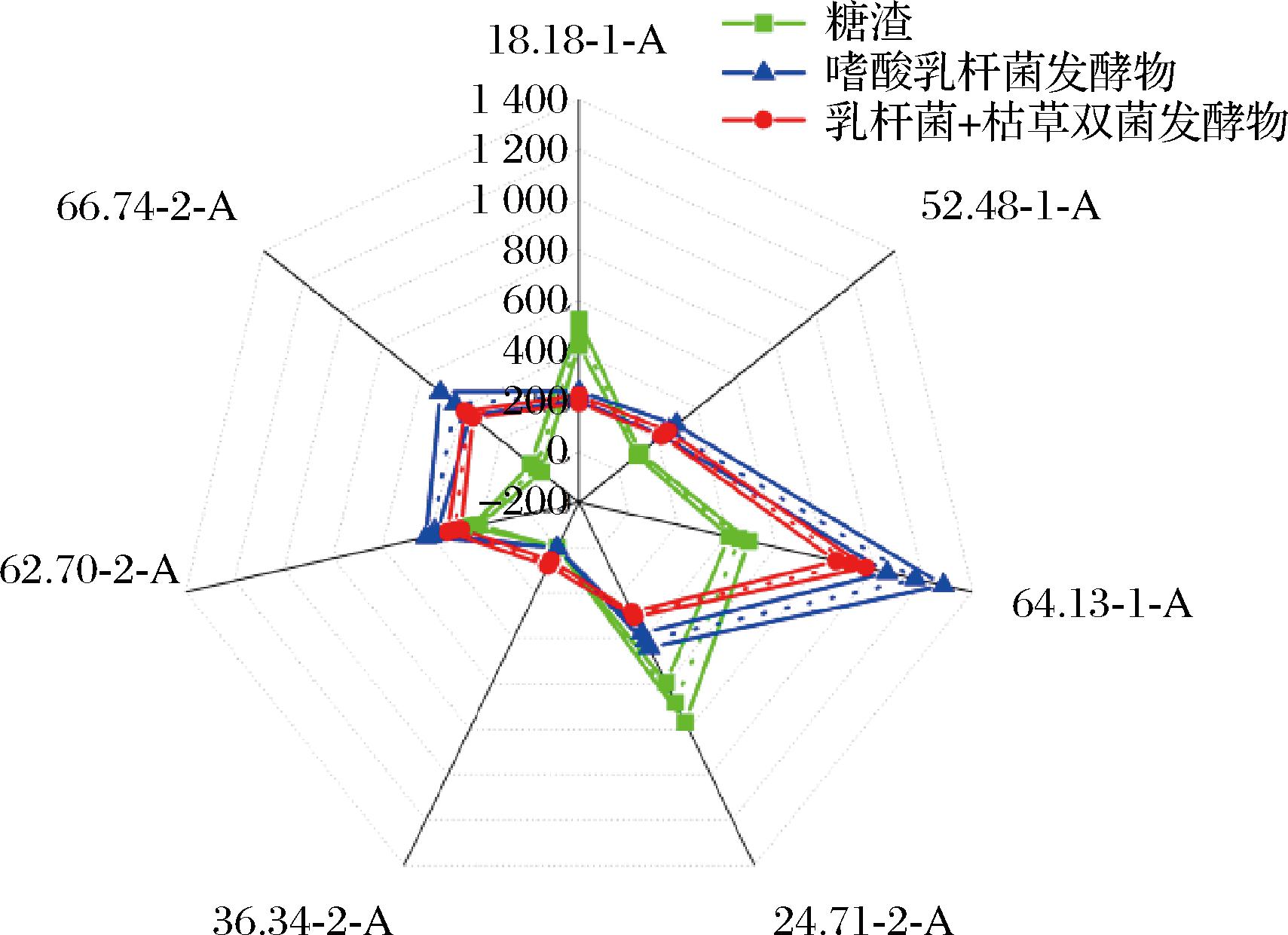
图3 电子鼻风味雷达图
Fig.3 Electronic nose flavor radar
表5 风味物质成分表
Tabel 5 Table of flavor compounds

编码保留时间/min检测到的化学挥发物质118.18二甲基硫化物、乙硫醇224.711,2-二氯乙烷、二异丙醚336.341,2-丁二醇452.48环己醇、3-庚醇562.702-辛酮、苯甲醛664.132-乙基-3-甲基吡嗪、癸烷766.74庚酸甲酯、2-辛醛
2.3.3 电子舌味道分析
电子舌能感知液体环境中的不同味感,将待测样品的化学信号转化为电信号,电信号通过信号采集单元和模式识别系统转化为电势差,其输出值为电子舌评分[21]。由表6可知,发酵减少了苦味,增加了涩味、苦味回味和涩味回味,分析原因为发酵降解了苦味物质,而又增加了可导致涩味的多酚类物质,使得味道变化;又由于发酵后鲜味氨基酸含量的增加,鲜味也有显著增加,发酵消耗了部分培养基中的糖导致甜味减少,而分泌的乳酸等酸性物质导致酸味也显著增加。王玉[22]对21日龄断奶仔猪进行添加风味剂的研究中,发现联合添加鲜味剂和复合有机酸具有提高采食量的作用。发酵使糖渣味道更偏向于鲜味和酸味,与研究中风味剂相似。
表6 电子舌味道分析表 单位:分
Table 6 Table of electronic tongue taste analysis
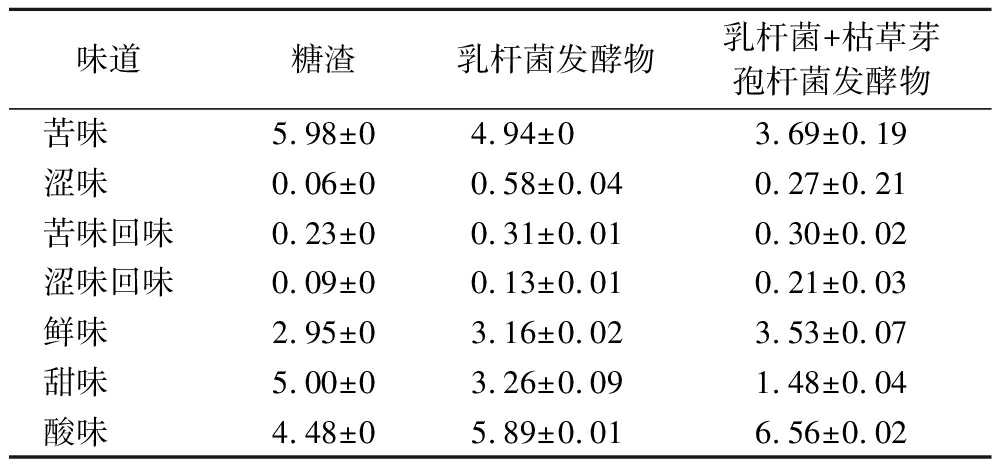
味道糖渣乳杆菌发酵物乳杆菌+枯草芽孢杆菌发酵物苦味 5.98±04.94±0 3.69±0.19涩味 0.06±00.58±0.040.27±0.21苦味回味0.23±00.31±0.010.30±0.02涩味回味0.09±00.13±0.010.21±0.03鲜味 2.95±03.16±0.023.53±0.07甜味 5.00±03.26±0.091.48±0.04酸味 4.48±05.89±0.016.56±0.02
3 结论
单乳杆菌发酵玉米淀粉糖渣,乳杆菌活菌数为5.24×108 CFU/g。采用枯草芽孢杆菌与乳杆菌协同发酵,乳杆菌活菌数提升到1.50×109 CFU/g,是单菌发酵的2.86倍。并通过工艺优化,将乳杆菌活菌数提高至5.05×109 CFU/g,比相同条件下单菌发酵的活菌数高出2.42倍。
对糖渣、单菌发酵和双菌发酵的产物进行分析,结果表明,发酵可降低植酸含量、增加总酚含量、提升抗氧化能力,同时蛋白质和氨基酸含量也有所增加。在气味方面,发酵可减少异味,增加醇和酯类香气,双菌发酵还兼具浓烈的类坚果香味。此外,口味上也有所改善,减少了苦味,增加了酸味和鲜味,双菌发酵的效果优于单菌发酵。
本研究方法可用于糖渣的资源化利用,提升糖渣的价值,在工业生产中的应用还需进一步研究。
[1] 姚宇晨, 徐光辉, 杨钊, 等.淀粉糖行业发展趋势分析及展望[J].农产品加工, 2021(21)77-82.
YAO Y C, XU G H, YANG Z, et al.Analysis and prospect of the development trend of starch sugar industry[J].Academic Periodical of Farm Products Processing, 2021(21)77-82.
[2] 张琪, 华惠敏.玉米淀粉渣开发利用及研究进展[J].中国酿造, 2013, 32(12):14-16.
ZHANG Q, HUA H M.Development and utilization of corn starch residue[J].China Brewing, 2013, 32(12):14-16.
[3] 高东宁, 曹磊, 许赣荣.以玉米淀粉糖渣为原料制备米曲发酵酱油[J].生物加工过程, 2011, 9(3):61-65.
GAO D N, CAO L, XU G R.Fermentation of soy sauce using corn starch cake as raw material[J].Chinese Journal of Bioprocess Engineering, 2011, 9(3):61-65.
[4] 葛龙, 赵艳, 章亭洲. 固态发酵技术的特点与应用. 饲料与畜牧, 2010(8):54-56.
GE L, ZHAO Y, ZHANG T Z. Characteristics and application of solid-state fermentation technology. Animal Agriculture, 2010(8):54-56.
[5] 赵建国. 固态发酵玉米淀粉渣生产蛋白饲料的研究[J].工业微生物, 1999, 29(4):9-11.
ZHAO J.The study on using corn starch residue to produce feed protein[J].Industrial Microbiology, 1999, 29(4):9-11.
[6] 曹磊. 玉米淀粉糖渣发酵制备乳酸活菌饲料[D].无锡:江南大学.
CAO L.Preparation of lactic acid feed by fermentation of corn starch sugar residue[D].Wuxi:Jiangnan University.
[7] 张莉. 乳杆菌的有氧代谢与枯草芽孢杆菌益生作用机制研究[D].济南:山东大学,2012.
ZHANG L.Study on aerobic metabolism of Lactobacillus and probiotic mechanism of Bacillus subtilis[D].Jinan:Shandong University,2012.
[8] ZHANG Y R, XIONG H R, GUO X H.Enhanced viability of Lactobacillus reuteri for probiotics production in mixed solid-state fermentation in the presence of Bacillus subtilis[J].Folia Microbiologica, 2014, 59(1):31-36.
[9] 俞漪, 曲勤凤, 胡雪莲.食品中乳酸菌含量倾注法与涂布法结果差异性研究[J].农产品加工, 2012(8):137-139.
YU Y, QU Q F, HU X.The result differences by pouring method and coating method in detecting content of lactic acid bacteria in food[J].Farm Products Processing, 2012(8):137-139.
[10] 李宪民, 丁芳, 樊伟丽, 等. 生物传感分析仪测定葡萄糖和L-乳酸的影响因素研究. 亚太传统医药, 2008, 4(9):5-7.LI X M, DING F, FAN W L, et al. Study on influencing factors of determining glucose and L-lactic acid by biosensor analyzer. Asia-Pacific Traditional Medicine, 2008, 4(9):5-7.
[11] 赫欣睿, 武中庸, 叶永丽, 等.高效液相色谱法测定氨基酸的研究进展[J].分析测试学报, 2016, 35(7):922-928.
HE X R, WU Z Y, YE Y L, et al.Research progress on detection of amino acids by high performance liquid chromatography[J].Journal of Instrumental Analysis, 2016, 35(7):922-928.
[12] 史冰清. 植酸的测定及其提取工艺[J].现代食品, 2017(15):78-80.
SHI B Q.The determination of phytic acid and its extraction process[J].Modern Food, 2017(15):78-80.
[13] 胡志平, 王传明, 陆廷祥, 等.UV法测定苗药仙鹤草中总黄酮、总酚的含量[J].中国民族医药杂志, 2018, 24(8):39-41.
HU Z P, WANG C M, LU T X, et al.The content of total flavonoids and total phenol in the Miao medicine Agrimonia pilosa ledeb determined by UV method[J].Journal of Medicine and Pharmacy of Chinese Minorities, 2018, 24(8):39-41.
[14] MENSOR L L, MENEZES F S, LEIT O G G, et al.Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method[J].Phytotherapy Research:PTR, 2001, 15(2):127-130.
O G G, et al.Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method[J].Phytotherapy Research:PTR, 2001, 15(2):127-130.
[15] S EZ-PLAZA P, MICHA
EZ-PLAZA P, MICHA OWSKI T, NAVAS M J, et al.An overview of the Kjeldahl method of nitrogen determination.part I.early history, chemistry of the procedure, and titrimetric finish[J].Critical Reviews in Analytical Chemistry, 2013, 43(4):178-223.
OWSKI T, NAVAS M J, et al.An overview of the Kjeldahl method of nitrogen determination.part I.early history, chemistry of the procedure, and titrimetric finish[J].Critical Reviews in Analytical Chemistry, 2013, 43(4):178-223.
[16] FALASCONI M, CONCINA I, GOBBI E, et al.Electronic nose for microbiological quality control of food products[J].International Journal of Electrochemistry, 2012, 2012:1-12.
[17] VLASOV Y, LEGIN A, RUDNITSKAYA A.Electronic tongues and their analytical application[J].Analytical and Bioanalytical Chemistry, 2002, 373(3):136-146.
[18] LACHMAN J, HOSNEDL V, PIVEC V, et al.Polyphenols in cereals and their positive and negative role in human and animal nutrition[J].Cereals for Human Health and Preventive Nutrition, 1998,7(11):118-125.
[19] HARLAND B F.Phytic acid complex in feed ingredient[J].Phytase in Animal Nutrition &Waste Management, 1999 (3):17-19.
[20] GO I I, BRENES A, CENTENO C, et al.Effect of dietary grape pomace and vitamin E on growth performance, nutrient digestibility, and susceptibility to meat lipid oxidation in chickens[J].Poultry Science, 2007, 86(3):508-516.
I I, BRENES A, CENTENO C, et al.Effect of dietary grape pomace and vitamin E on growth performance, nutrient digestibility, and susceptibility to meat lipid oxidation in chickens[J].Poultry Science, 2007, 86(3):508-516.
[21] 刘忠英, 冉乾松, 潘科, 等.基于电子舌的3种氨基酸单体呈味特性研究[J].食品科技, 2022, 47(4):296-302.
LIU Z Y, RAN Q S, PAN K, et al.Flavor characteristics of three amino acid monomers based on electronic tongue[J].Food Science and Technology, 2022, 47(4):296-302.
[22] 王玉. 饲料风味剂和复合有机酸对断奶仔猪采食量及养分消化率的影响[D].雅安:四川农业大学,2015.
WANG Y. Effects of feed flavor agents and organic acids on feed intake and nutrient digestibility in piglets. Ya′an: Sichuan Agricultural University, 2015.