L-抗坏血酸,又称维生素C,在水果和蔬菜中含量丰富,是一种重要的水溶性抗氧化剂[1],参与胶原蛋白、细胞间质和神经递质的合成,有助于改善机体免疫系统功能[2]。由于人体不能合成维生素C,需要依靠膳食水果和蔬菜等摄入每日的必需量。针叶樱桃被认为是天然维生素C之王,它是一种产于中美洲至南美洲北部的水果,深受消费者青睐,由于其富含抗坏血酸,常被用作天然抗坏血酸的典型来源[3]。抗坏血酸产品有着广阔的市场前景,针叶樱桃是我国天然维生素C产品的主要原料,由于巨大的市场需求,针叶樱桃粉主要依靠北美、欧洲和日本等国家进口。近年来在针叶樱桃粉相关产品中掺入合成抗坏血酸的事件时有发生,尽管添加了工业合成的抗坏血酸,但仍声称是天然抗坏血酸,该行为造成消费者利益受损,行业信誉度损失。因此,亟需建立一种高精度快速检测抗坏血酸产品中外源添加合成抗坏血酸的分析方法。
稳定同位素技术是当前国际食品掺假鉴别领域打击假冒伪劣产品有效的科技手段之一[4]。该技术具有常规理化方法不可比拟的优越性,已经通过该技术实现对葡萄酒[5-6]、调味品[7-10]、油脂[11-14]、蜂蜜[15-17]等食品的掺假鉴别、质量评价及产地溯源。目前,国内尚无利用稳定同位素技术对抗坏血酸测定的相关研究,国外已陆续有应用元素分析-同位素比值质谱(elemental analysis-stable isotope ratio mass spectrometry, EA-IRMS)和气相色谱-燃烧-稳定同位素比值质谱(gas chromatography-combustion-stable isotope ratio mass spectrometry, GC-C-IRMS)对橘子汁、针叶樱桃汁中抗坏血酸稳定同位素比值进行测定[18-19]的报道。EA-IRMS适合全样品检测,前处理步骤繁琐复杂;GC-C-IRMS测定抗坏血酸需要衍生化,对操作人员的要求较高。本文首次采用液相色谱-稳定同位素比值质谱法对样品中抗坏血酸在线分离并准确测定其δ13C值,具有操作简单、无需衍生化、标准品和样品遵循同等处理原则(principle of identical treatment, PIT)的优势。
本研究拟建立利用稳定同位素技术鉴别天然来源和合成来源抗坏血酸的碳稳定同位素特征。建立液相色谱稳定同位素比值质谱(liquid chromatography-stable isotope ratio mass spectrometry, LC-IRMS)准确测定抗坏血酸δ13C值的方法,对方法进行了优化及验证。探究了天然和合成来源抗坏血酸的碳稳定同位素差异,以实现对天然抗坏血酸产品真实性的准确测定。
1 材料与方法
1.1 材料与试剂
7个不同品牌的维生素C片,从电商旗舰店购买,研磨后备用;19个不同浓度、不同地区的针叶樱桃粉从厂家直接购买。L-抗坏血酸标准品,纯度≥99.8%,购自上海叶源生物科技有限公司;
IAEA-CH-6蔗糖[δ13CPDB=(-10.449±0.2)‰],奥地利维也纳国际原子能机构,作为碳稳定同位素比值分析的参考物质;浓硫酸(优级纯)、磷酸(优级纯)和过硫酸钠(Na2S2O8, 纯度≥99%),国药集团化学试剂有限公司。
1.2 仪器与设备
Flash 2000元素分析仪配有Conflo IV接口、LC端(LC IsoLink+ConFlo IV)、Delta V Advantage稳定同位素质谱仪(isotope ratio mass spectrometry,IRMS),美国Thermo Fisher Scientific公司;十万分之一天平,瑞士Mettler-Toledo公司;涡旋振荡器,北京科伟永兴仪器有限公司。
1.3 前处理方法
准确称取0.500 g样品加入50 mL超纯水涡旋振荡,过0.45 μm水系滤膜,移取200 μL稀释至抗坏血酸含量0.10~0.50 g/L后保存试样,吸取1 mL至棕色进样小瓶LC-IRMS测定抗坏血酸δ13C值。
1.4 EA-IRMS测定条件
EA-IRMS直接测定抗坏血酸纯品的碳稳定同位素比率。EA-IRMS仪器的氧化管温度为960 ℃,还原管温度为650 ℃,气相色谱柱炉温为50 ℃,氦气流速为100 mL/min,准确称取0.2~0.3 mg样品,每个样品平行测定2次。进行样品测试时,每个样品的分析起始和结尾阶段通入CO2参考气,用于对进样过程稳定性的评价。
1.5 LC-IRMS测定条件
LC-IRMS测定样品中抗坏血酸的δ13C值。
色谱条件:色谱柱为Syncronis C18柱(250 mm×4.6 mm, 5 μm);流动相为水-pH 2硫酸溶液 (90∶10, 体积比),流速0.250 mL/min;柱温30 ℃,进样体积10 μL。磷酸溶液和过二硫酸钠溶液作为反应助剂,流速0.050 mL/min,反应炉温度99.5 ℃,将色谱在线分离的有机物转换成CO2。
质谱条件:离子源为电子轰击离子源(EI源);扫描方式为正离子扫描;氦气压力为0.4 MPa;离子源电压为9.488 kV;真空度为2.6×10-6 mBar。每次测定样品前后分别测定3次CO2标准参考气(每次20 s)。
1.6 数据校正与计算
稳定同位素比率的计算是将已知同位素比率的标准品作为参考,计算未知样本稳定同位素比率的相对值,结果以(千分差,‰)表示,按公式(1)计算:
δ13C=(R样品/R标准-1)×1 000
(1)
式中:R样品,样品中重同位素与轻同位素的丰度比,即13C/12C;R标准,国际标准物质美国南卡罗莱纳州白垩系Pee Dee组拟箭石化石(pee dee belemnite,PDB)的碳重同位素与轻同位素的丰度比。本研究选择IAEA-CH-6[δ13CPDB=(-10.449±0.2)‰]作为实际测定中的参考物质。实验结果由Isodat 3.0软件进行数据处理和计算,Excel分析数据,Origin 2019软件作图。
2 结果与分析
2.1 色谱条件优化
LC-IRMS在线将目标物和其他物质分开,并将目标物中碳元素转化成CO2测定,要求流动相不含有机溶剂,对流速、柱温等也有要求,相比常规液相在应用上存在一定局限性。因此,实验首先建立LC-IRMS测定抗坏血酸δ13C值的液相方法的优化。
2.1.1 流动相选择
LC-IRMS要求色谱流动相不含甲醇等有机洗脱液,因此实验选择纯水-pH2硫酸溶液体系探究流动相比例对目标峰的分离度的情况。以抗坏血酸标准品为研究对象,选择流动相水-pH2硫酸溶液分别以体积比为100、90∶10、80∶20的配制比例测定,出峰情况见图1。流动相为100%纯水时,目标峰的出峰时间相对提前,且抗坏血酸峰较宽,分离度差(图1-a);改变流动相水-pH2硫酸溶液的体积比至90∶10时,能显著改善峰形,峰分离度较好(图1-b);再增加硫酸溶液体积比至80∶20时,出峰时间稍稍延迟,与流动相体积比90∶10相比,峰形无明显差异(图1-c)。综合考虑,选择流动相水-pH2硫酸溶液体积比为90∶10作为后续实验的条件。
2.1.2 柱温及流速选择
柱温越高,色谱分离过程会加快,通常效率也会更高,但存在一些样品混合物共洗脱的可能性[20],且抗坏血酸水溶液存在遇热易氧化的特性。因此,LC-IRMS测定关键组分的在线分离,选择合适的柱温度控制是必要的。实验以抗坏血酸标准品为研究对象,选择25、30、35、40、45 ℃的梯度温度,在每个梯度下对标准品重复3次测定,探究柱温对δ13C值测定的影响。由表1可知,在25~35 ℃,抗坏血酸δ13C值的测定标准偏差≤0.06‰,说明测定结果稳定且不同温度时的测定结果也无明显差异,而由于样品遇热易氧化特性,在色谱柱温度较高的情况下,δ13C值测定标准偏差较大。故综合考虑实验选取30 ℃作为后续实验的柱温条件。
表1 色谱柱温度对抗坏血酸δ13C值测定的影响
Table 1 Effect of column temperature on determination of δ13C value of ascorbic acid

色谱柱温度/℃抗坏血酸δ13C值/‰平均值标准偏差25-11.830.1030-11.930.0135-11.980.0540-12.220.2145-12.180.17
一般流速越高,出峰时间越快,样品测定时间越短。LC-IRMS由于流动相为水溶液体系,在色谱柱中滞黏度较高,故流速不宜太快。以抗坏血酸标准品为研究对象,研究在0.200~0.450 mL/min流速内δ13C测定值(n=3)的变化特征。由表2可知,随着流速提高,出峰时间提前,抗坏血酸的δ13C值测定结果较稳定,因此在实际分析中可在0.200~0.450 mL/min范围内任意设定一个流速参数。考虑到随着流速增加,色谱柱柱压逐渐增高,为了延长色谱柱的寿命及分析效率,本方法选择0.250 mL/min作为流动相流速。
综上,LC-IRMS测定抗坏血酸的δ13C值的分析条件为:Syncronis C18(250 mm×4.6 mm, 5 μm)色谱柱,流动相为水-pH2硫酸溶液(90∶10, 体积比),色谱柱温度30 ℃,流速0.250 mL/min,进样量10 μL,抗坏血酸在980 s左右出峰。选择一款针叶樱桃粉样品按照1.3节前处理条件水解后,1.4节方法进行测定,测定结果见图1-d,抗坏血酸目标峰与其他峰可以完全分离准确测定。
表2 流速对抗坏血酸δ13C值测定的影响
Table 2 Effect of flow rate on determination of δ13C value of ascorbic acid

流速/(mL/min)出峰时间/sδ13C值/‰标准偏差/‰柱压/bar0.2001007-11.850.08230.250979-11.800.02280.300943-11.890.06350.350917-11.810.04410.400884-11.900.09480.450841-11.880.0555
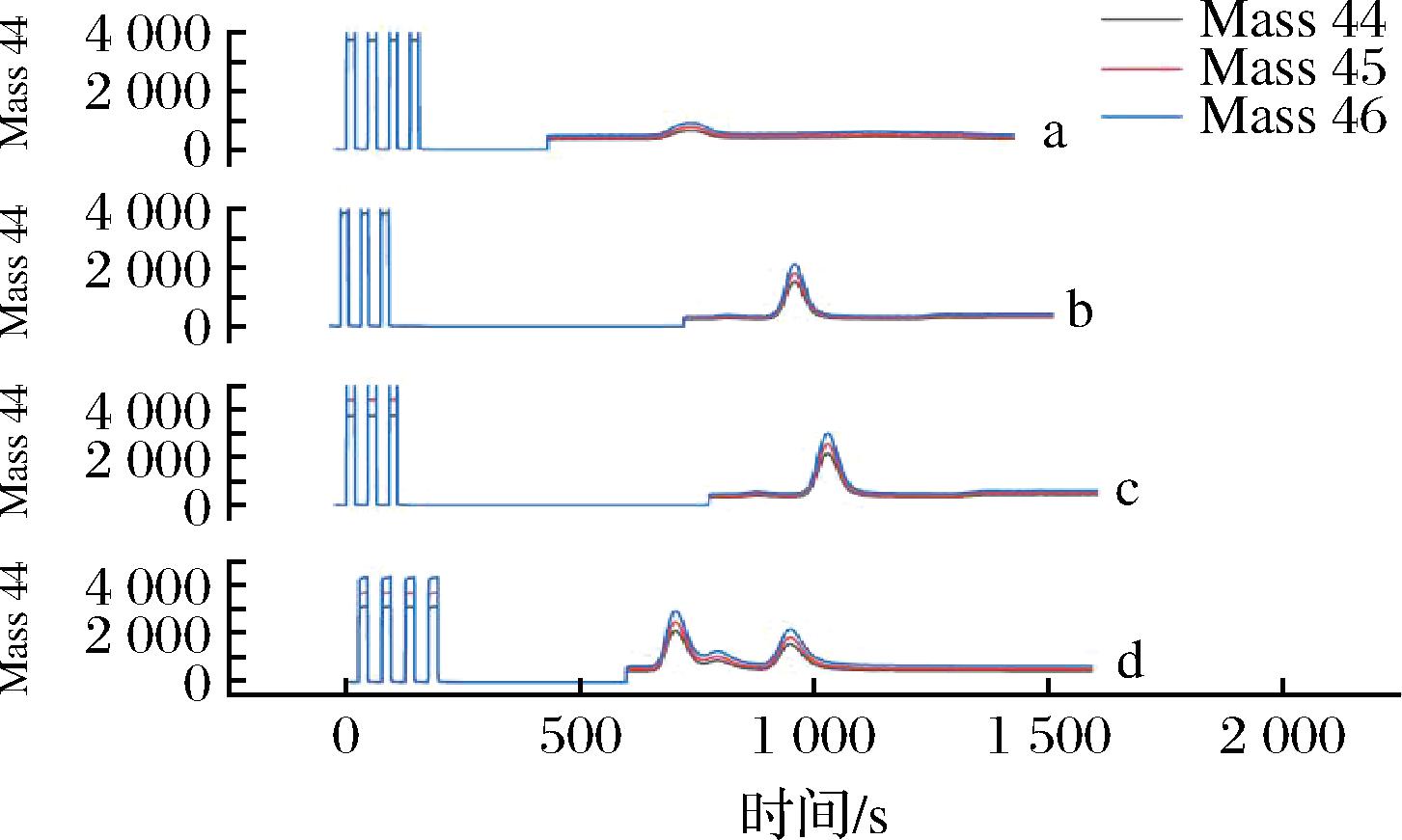
a-流动相为100% H2O的标准品色谱图; b-流动相为90% H2O和10% PH2 H2SO4溶液的标准品色谱图; c-流动相为80% H2O和20%PH2 H2SO4的标准品色谱图; d-色谱条件优化后对针叶樱桃粉样品测定的色谱图
图1 不同条件下抗坏血酸色谱图
Fig.1 The peak chromatogram of ascorbic acid under different conditions
2.2 方法准确性验证
由于缺少抗坏血酸碳稳定同位素的参考物质,因而不能直接测量参考物质的形式对LC-IRMS测定抗坏血酸δ13C值的准确性进行验证。为了探究建立的LC-IRMS测定抗坏血酸δ13C值过程是否发生同位素分馏,选择抗坏血酸标准品为研究对象,分别使用本章建立的LC-IRMS测定方法和文献中报道的EA-IRMS方法进行处理后测定(n=5),测定结果见表3。由表3可知,采用本方法测定的抗坏血酸δ13C值与EA-IRMS测定方法相比,测定结果的差值均小于0.25%,说明LC-IRMS方法测定抗坏血酸δ13C值准确有效,液相色谱在线分离提取抗坏血酸与参考物质时遵循同等转化原则。
表3 LC-IRMS和EA-IRMS测定抗坏血酸δ13C值的比较 单位:‰
Table 3 Comparison of δ13C values of ascorbic acid determined by LC-IRMS and EA-IRMS
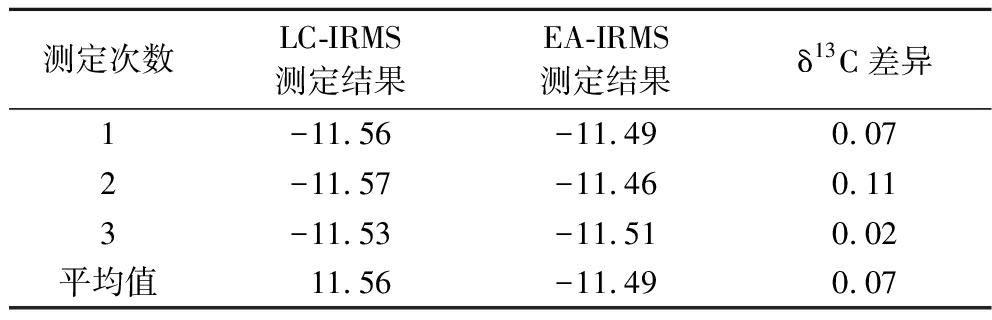
测定次数LC-IRMS测定结果EA-IRMS测定结果δ13C差异1-11.56-11.490.072-11.57-11.460.113-11.53-11.510.02平均值11.56-11.490.07
2.3 方法精密度验证
以抗坏血酸标准品和针叶樱桃粉为研究对象,按照1.3节步骤前处理后在重复条件下分别测定δ13C值,连续测定6次,在再现性条件下,5 d内对标准品和样品完成6次独立测定,结果见表4。可见测定抗坏血酸δ13C的标准偏差为0.06‰~0.15‰,说明该方法满足抗坏血酸δ13C检测要求。
表4 LC-IRMS测定抗坏血酸δ13C的重复性和再现性(n=6) 单位:‰
Table 4 Repeatability and reproducibility of determination of ascorbic acid δ13C by LC-IRMS (n=6)

样品重复性再现性δ13C标准偏差δ13C标准偏差抗坏血酸 -11.850.10-11.990.08针叶樱桃粉-24.880.09-24.980.14
2.4 不同来源抗坏血酸碳稳定同位素比值测定
从市面上随机购买了不同产地的合成维生素C片和针叶樱桃粉共26个产品,用LC-IRMS测定并分析不同来源抗坏血酸同位素特征,测定结果见表5。不同产地的合成来源维生素C片δ13C值为-11.74‰~-10.28‰,而天然针叶樱桃粉中抗坏血酸δ13C值为-25.00‰~-22.01‰,两者具有显著的碳同位素分布特征(图2)。本方法检测天然和合成来源抗坏血酸的δ13C值数据与文献报道数据一致[19]。
从现有数据来看,产地对合成来源维生素C的δ13C值分布无影响,且维生素C的生产过程使用了C4植物糖作为起始材料。合成维生素C的方式主要有化学合成法和发酵法,市售的抗坏血酸大多为发酵法生产,该法具有经济、安全、可大规模生产等优势。发酵法主要以D-葡萄糖、山梨糖等为原料,并加入假单胞杆菌等进行发酵,发酵完成后,进行提取和精制等步骤以获得精品维生素C。因此,可根据天然来源的抗坏血酸δ13C值分布规律鉴别产品中的抗坏血酸是否存在外源添加的现象。
表5 不同来源样品中抗坏血酸的δ13C值
Table 5 δ13C values of ascorbic acid in samples from different sources
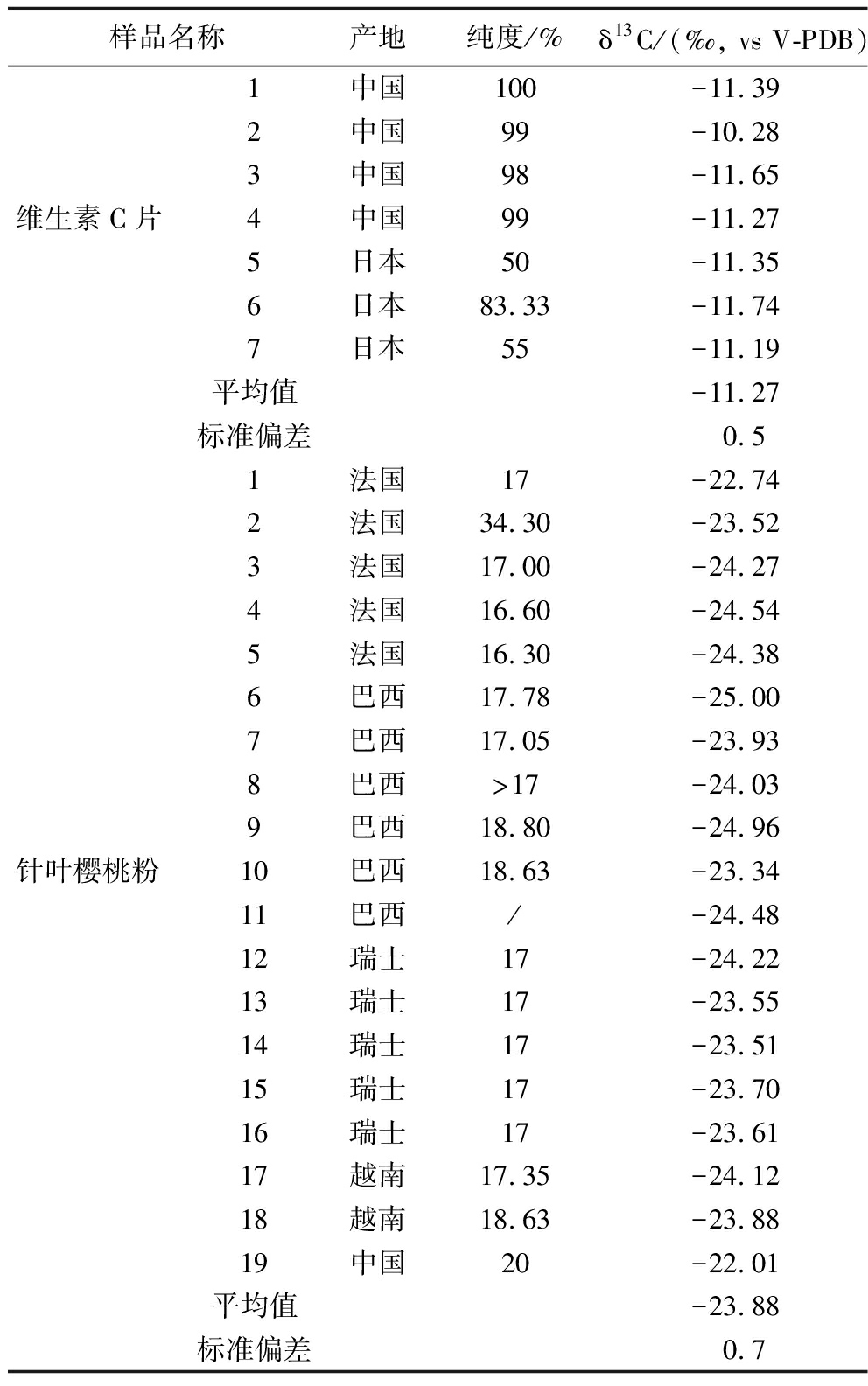
样品名称产地纯度/%δ13C/(‰, vs V-PDB)1中国100-11.392中国99-10.283中国98-11.65维生素C片4中国99-11.275日本50-11.356日本83.33-11.747日本55-11.19平均值-11.27标准偏差0.51法国17-22.742法国34.30-23.523法国17.00-24.274法国16.60-24.545法国16.30-24.386巴西17.78-25.007巴西17.05-23.938巴西>17-24.039巴西18.80-24.96针叶樱桃粉10巴西18.63-23.3411巴西/-24.4812瑞士17-24.2213瑞士17-23.5514瑞士17-23.5115瑞士17-23.7016瑞士17-23.6117越南17.35-24.1218越南18.63-23.8819中国20-22.01平均值-23.88标准偏差0.7
注:/表示无数据。
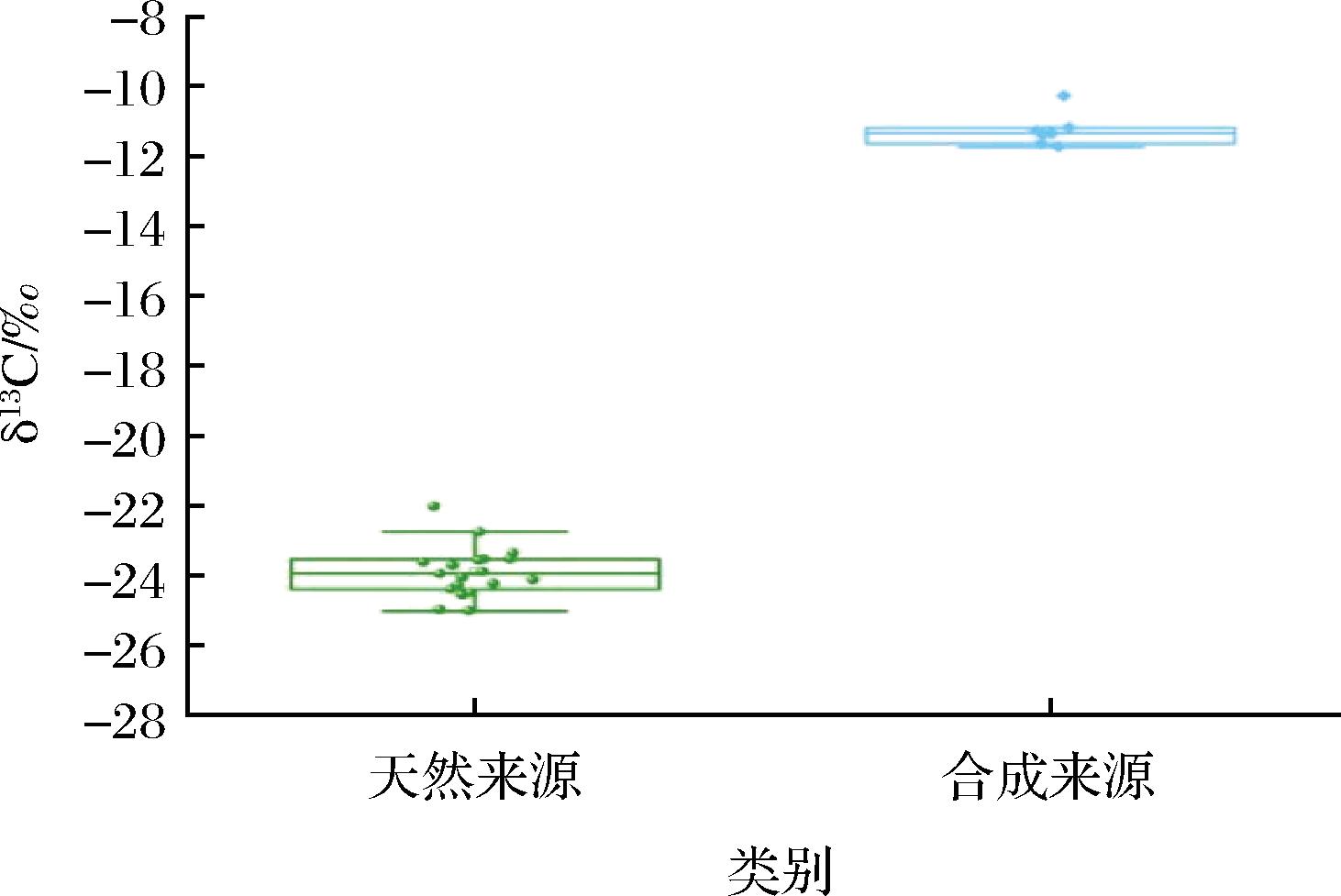
图2 天然和合成来源抗坏血酸δ13C值分布图
Fig.2 Distribution of δ13C value of ascorbic acid from natural and synthetic sources
3 结论与讨论
本研究基于稳定同位素技术在食品掺假鉴别领域的广泛应用基础,建立了LC-IRMS测定针叶樱桃粉中抗坏血酸的δ13C值的方法,标准品和样品遵循同等处理原则,在发生同位素分馏的情况下仍能对碳稳定同位素比值准确测定。该方法具有前处理方法简单、测定时间短等优点,方法的精密度和准确性较好。在实际样品分析中,实现了天然和合成来源抗坏血酸的有效分离测定,丰富了抗坏血酸相关产品的检测和鉴别技术,有助于保障消费者利益,维护相关产品的市场公平竞争。
[1] NJUS D, KELLEY P M, TU Y J, et al.Ascorbic acid:The chemistry underlying its antioxidant properties[J].Free Radical Biology and Medicine, 2020, 159:37-43.
[2] ZOU M Y, NIE S P, YIN J Y, et al.Ascorbic acid induced degradation of polysaccharide from natural products:A review[J].International Journal of Biological Macromolecules, 2020, 151:483-491.
[3] KABASAKALIS V,SIOPIDOU D, MOSHATOU E.Ascorbic acid content of commercial fruit juices and its rate of loss upon storage[J].Food Chemistry, 2000, 70(3):325-328.
[4] CAMIN F, BONTEMPO L, PERINI M, et al.Stable isotope ratio analysis for assessing the authenticity of food of animal origin[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(5):868-877.
[5] AKAMATSU F, SHIMIZU H, HAYASHI S, et al.Chemometric approaches for determining the geographical origin of Japanese Chardonnay wines using oxygen stable isotope and multi-element analyses[J].Food Chemistry, 2022, 371(1):131113.
[6] 王道兵, 钟其顶, 高红波, 等.GasBenchⅡ-IRMS测定葡萄酒水中δ18O方法研究[J].质谱学报, 2014, 35(4):355-360.
WANG D B, ZHONG Q D, GAO H B, et al.Determination of oxygen isotope ratios of water in wine by GasBenchⅡ-IRMS[J].Journal of Chinese Mass Spectrometry Society, 2014, 35(4):355-360.
[7] PERINI M, PAOLINI M, SIMONI M, et al.Stable isotope ratio analysis for verifying the authenticity of balsamic and wine vinegar[J].Journal of Agricultural and Food Chemistry, 2014, 62(32):8197-8203.
[8] KOBAYASHI K, TANAKA M, TANABE S, et al.Distinguishing glutamic acid in foodstuffs and monosodium glutamate used as seasoning by stable carbon and nitrogen isotope ratios[J].Heliyon, 2018, 4(9):e00800.
[9] GREULE M, MOSANDL A, HAMILTON J T G, et al.Comment on authenticity and traceability of Vanilla flavors by analysis of stable isotopes of carbon and hydrogen[J].Journal of Agricultural and Food Chemistry, 2015, 63(21):5305-5306.
[10] 国辉, 班楠, 王道兵, 等.酱油中内源性苯甲酸本底含量调查与溯源分析[J].食品科学, 2021, 42(20):286-291.
LI G H, BAN N, WANG D B, et al.Investigation and traceability analysis of endogenous benzoic acid in soy sauce[J].Food Science, 2021, 42(20):286-291.
[11] ELGADI S, OUHAMMOU A, TAOUS F, et al.Combination of stable isotopes and fatty acid composition for geographical origin discrimination of one argan oil vintage[J].Foods, 2021, 10(6):1274.
[12] JIMÉNEZ-MORILLO N T, PALMA V, GARCIA R, et al.Multivariate geostatistical analysis of stable isotopes in Portuguese varietal extra virgin olive oils[J].Microchemical Journal, 2020, 157:105044.
[13] 王道兵, 岳红卫, 高冠勇, 等.基于稳定氢氧同位素技术的花生油掺假检测技术研究[J].中国粮油学报, 2021, 36(8):118-122. WANG D B, YUE H W, GAO G Y, et al.Research on detection of adulterated peanut oil by stable hydrogen/oxygen isotope analysis[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(8):118-122.
[14] 马玉华, 唐方东, 刘佳煜, 等.稳定同位素比技术用于橄榄油的掺假鉴定[J].质谱学报, 2021, 42(2):189-196.
MA Y H, TANG F D, LIU J Y, et al.Olive oil adulteration identification using stable isotope ratio technique[J].Journal of Chinese Mass Spectrometry Society, 2021, 42(2):189-196.
[15] MAGDAS D A, GUYON F, PUSCAS R, et al.Applications of emerging stable isotopes and elemental markers for geographical and varietal recognition of Romanian and French honeys[J].Food Chemistry, 2021, 334:127599.
[16] SCHIMMELMANN A, QI H P, DUNN P J H, et al.Food matrix reference materials for hydrogen, carbon, nitrogen, oxygen, and sulfur stable isotope-ratio measurements:Collagens, flours, honeys, and vegetable oils[J].Journal of Agricultural and Food Chemistry, 2020, 68(39):10852-10864.
[17] 黄学者, 王蕾, 魏红跃, 等.云南3种特色蜂蜜糖组分的稳定碳同位素比值测定与分析[J].核农学报, 2020, 34(S1):79-88. HUANG X Z, WANG L, WEI H Y, et al.Determination and analysis of stable δ13C value of sugar components in three kinds of characteristic honey from Yunnan Province[J].Journal of Nuclear Agricultural Sciences, 2020, 34(S1):79-88.
[18] HANAMURA T, UCHIDA E, ISHIGURO Y, et al.Discrimination between ascorbic acid from acerola and of synthetic origin by measuring 13C and 18O stable isotope ratios[J].Chemistry Letters, 2012, 41(9):929-931.
[19] ALBERTINO A, BARGE A, CRAVOTTO G, et al.Natural origin of ascorbic acid:Validation by 13C NMR and IRMS[J].Food Chemistry, 2009, 112(3):715-720.
[20] 李学民, 贾光群, 曹彦忠, 等.液相色谱-同位素比质谱法同时测定葡萄酒中甘油和乙醇的δ13C值[J].色谱, 2013, 31(12):1201-1205.
LI X M, JIA G Q, CAO Y Z, et al.Simultaneous determination of δ13C values of glycerol and ethanol in wine by liquid chromatography coupled with isotope ratio mass spectrometry[J].Chinese Journal of Chromatography, 2013, 31(12):1201-1205.