佛手(Citrus medica L.var.sarcodactylis Swingle)属于芸香科柑橘属,是香橼(Citrus medica L.)的变种,顶端较底部稍宽,有手指状裂瓣,果肉为浅黄色或浅黄白色,外果皮为橙黄色或黄绿色[1]。作为药食两用的柑橘类水果,目前对佛手已有大量的研究,但并不全面。据报道,佛手具有抗氧化[2]、抗衰老[3]、抗炎[4]、抗菌[5]、降血糖[6]、免疫抑制[7]等活性,这些生物活性与佛手中的香豆素、类黄酮等丰富的生物活性物质密切相关。香豆素是佛手中主要的生物活性成分,迄今为止已在佛手中发现50余种香豆素类化合物。其次是类黄酮,在佛手柑中发现40种左右的类黄酮化合物[3,8-18]。
香豆素类化合物是重要的生物活性成分之一,存在于多种植物和微生物中,根据结构不同可分为:简单香豆素、呋喃香豆素、吡喃香豆素和其他香豆素[19]。香豆素是中药中重要的化合物,具有广泛的生物活性,例如降血糖[20]、抗血栓[21]、抗流感[22]等。由于香豆素具有许多生物活性潜力,并且在佛手中的种类最多,因此佛手中的香豆素类化合物具有重要的研究意义。MA等[23]建立了一种超高效液相色谱方法,在45 min内同时测定5种香豆素。一种正相-液相色谱-液相色谱/光电二极管阵列(normal phase-liquid chromatography-liquid chromatography/photodiode array,NP-LC-LC/PDA)方法在60 min内分析了2种手性香豆素和2种呋喃香豆素。这些方法不仅检测时间长,并且检测到的目标化合物数量![]() 等[25]建立了一种高效液相色谱结合二极管阵列检测器(high performance liquid chromatography coupled with diode array detector,HPLC-DAD)方法测定香豆素,虽然分析时间较短,在15 min内能使目标化合物有效分离,但检测目标较少,只有3种香豆素。由于香豆素结构的多样性以及重要的生物活性,有必要开发一种在短时间内检测多种香豆素的方法。
等[25]建立了一种高效液相色谱结合二极管阵列检测器(high performance liquid chromatography coupled with diode array detector,HPLC-DAD)方法测定香豆素,虽然分析时间较短,在15 min内能使目标化合物有效分离,但检测目标较少,只有3种香豆素。由于香豆素结构的多样性以及重要的生物活性,有必要开发一种在短时间内检测多种香豆素的方法。
目前需要一种高效的分析方法,充分定性并定量佛手中的香豆素类化合物。对于植物或其他复杂样品中的目标化合物的筛选和定量,超高效液相色谱三重四极杆质谱法(ultra-performance liquid chromatography tandem triple quaternary mass spectrometry,UPLC-QqQ-MS/M)的多反应检测模式(multiple reaction monitoring,MRM)可以避免峰重叠引起的干扰,并且灵敏度更高,检测时间更短。因此,本实验建立了一种新的UPLC-QqQ-MS/MS方法,用于快速靶向筛查和定量分析佛手中的香豆素。这是目前定量和定性佛手中香豆素类化合物最快速全面的方法。为了评估该方法是否可用于实际样品检测,通过标准曲线、灵敏度、准确度和精密度对其进行了验证。香豆素的靶向筛查与定向分析为佛手作为药材或者食品提供了理论依据,并为后续研究奠定了基础。
1 材料与方法
1.1 材料与试剂
本实验的41种香豆素标准品包括16种简单香豆素、23种呋喃香豆素和2种其他香豆素,购自不同公司。异橙皮内酯(≥98%)、橙皮内酯(≥98%)、蛇床子素(≥98%)、异茴芹内酯(≥98%)、异欧前胡素(≥99%)、欧前胡素(≥99%)、水合氧化前胡素(≥98%)、氧化前胡素(≥98%)、异紫花前胡内酯(≥98%)、花椒毒醇(≥98%)、白当归素(≥98%)、珊瑚菜素(≥98%)、8-氧甲基异欧前胡内酯(≥98%),上海源叶生物技术有限公司;茵芋苷(≥98%)、7-甲氧基香豆素(≥98%)、七叶内酯(≥98%)、异嗪皮啶(≥98%)、秦皮素(≥98%)、4-甲基伞形酮(≥98%)、香豆素(≥98%)、白当归脑(≥98%)、8-羟基佛手苷内酯(≥98%)、独活素(≥98%)、5,7-二羟基-4-甲基香豆素(≥98%)、异补骨脂素(≥98%)、蟛蜞菊内脂(≥98%)、4-羟基香豆精(≥98%)、5-牻牛儿醇基-7-甲氧基香豆素(≥99.9%)、滨蒿內酯(≥95.0%)、8-(牻)牛儿醇基补骨脂素(≥98.5%)、香柠檬亭(≥96.9%)、补骨脂素(≥99.1%),成都克洛玛生物科技有限公司;柠檬内酯(≥98.2%)、香柑醇(≥98%)、花椒毒素(≥98%)、佛手柑內酯(≥98%),北京金谛泽浩科技有限公司;橙皮油内酯(≥98.5%)、橙皮内酯水合物(≥99.0%)、6′,7′-环氧香柠檬亭(≥95.1%)、6′,7′-二羟基香柠檬亭 (≥97.8%),美国Sigma-Aldrich公司;伞形花内酯(≥99.0%),德国Dr.Ehrenster GmbH公司。用甲醇制备各标准品的储备溶液,质量浓度为100 mg/L,存于-80 ℃。
乙腈和甲醇均为色谱纯,上海星可高纯溶剂有限公司;甲酸为色谱纯,上海安谱实验科技股份有限公司;超纯水由Milli-Q Advantage A10超纯水器(美国Millpore公司)产生。
1.2 仪器与设备
Shimadzu LC-30AD液相色谱仪,日本岛津公司;SCIEX QTRAP 6500串联质谱仪,美国AB公司;Acquity UPLC HSS T3色谱柱,美国Waters公司;Sigma3-15K高速冷冻离心机,德国Sigma公司;0.22 μm有机相针式过滤器,上海安谱科学仪器有限公司;KQ5200DE超声波清洗仪,昆山市超声仪器有限公司;PB3002-S /FACT分析天平,瑞士Mettler Toledo;Milli-Q Advantage A10超纯水机,美国Millipore公司等。
1.3 样品制备及提取
在中国浙江省、云南省、广东省和重庆市采摘佛手果实样品,每个产地至少20个,均处于商业成熟期。采摘后的佛手果实用超纯水清洗擦干,制成均匀鲜样在-20 ℃贮存备用。
将5.0 g均制鲜样置于离心管中,加入12.5 mL甲醇,超声提取30 min,8 000 r/min离心5 min,将上清液收集到50 mL离心管中。重复1次上述步骤,合并2次提取液,将提取液用0.22 μm有机相针式滤器过滤到进样小瓶后上机检测。
1.4 UPLC-QqQ-MS/MS条件
本研究使用Shimadzu LC-30AD液相色谱仪,ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm, 1.8 μm),柱温40 ℃,进样量1.0 μL,流速0.3 mL/min,样品室温度15 ℃。流动相为乙腈(B)和含有0.1%(体积分数,下同)甲酸的纯水(A),梯度洗脱程序:0~3 min:10%B~30%B;3~6.5 min,30%B~65%B;6.5~7.5 min,65% B~70% B;7.5~9.5 min,70%B~95%B;9.5~11 min,95%B~95%B;11~11.1 min,95%B~10%B;11.1~14 min,10%B~10%B。在梯度洗脱程序的最后3 min(11~14 min),平衡并洗涤色谱柱。
质谱为SCIEX QTrap® 6500+ MS/MS系统,采用电喷雾离子源(electrospray ionization,ESI),正负电离模式。部分化合物的离子种类、前体离子、产物离子、去簇电压(declustering potential,DP)、碰撞能量(collision energy,CE)等详细质谱参数见表1,其他MRM参数和离子源条件参照GUO等[26]的方法。
1.5 方法学验证
通过线性评估、灵敏度、精密度和准确度对定量方法进行评估。使用0.05、0.10、0.25、0.5、1、2.5、5、10、12.5、25.00、50.00、100.00 μg/L系列混合稀释标准溶液进行线性评估。检测限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)分别为信噪比(S/N)≥3和≥10时对应物质的浓度,用于评估该方法的灵敏度。方法精密度通过日内差和日间差来评估,日内差是同一天对同一标准溶液检测3次结果的相对标准偏差(relative standard deviation,RSD),日间差是连续3 d对同一标准溶液的检测结果的RSD。准确度则通过回收率实验进行评估,即向样品中添加适当浓度的标准溶液,计算添加前后的提取液浓度差值与实际添加浓度的比值得到添加回收率。
表1 部分化合物MRM参数列表
Table 1 Partial compounds and their MRM parameters
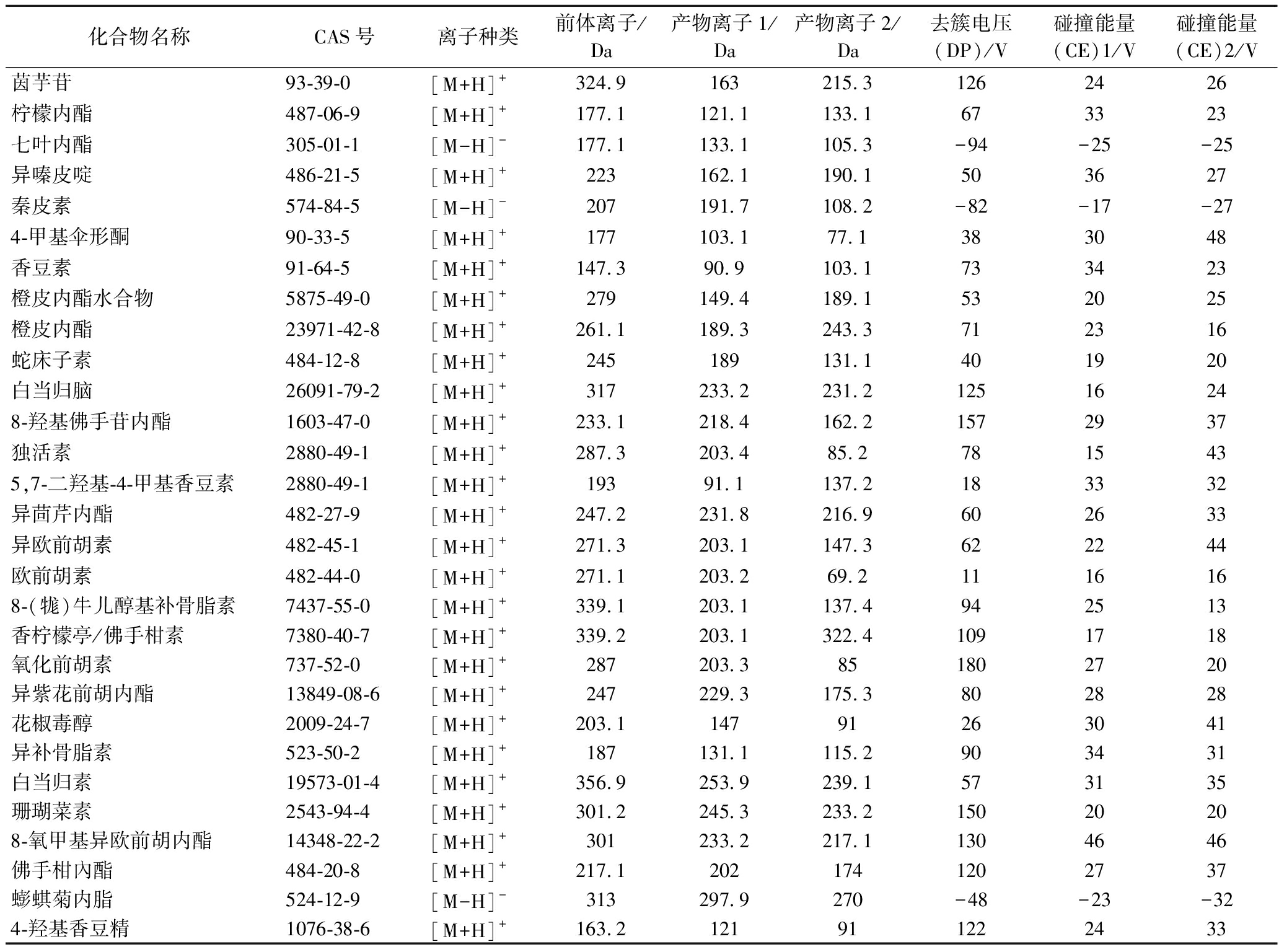
化合物名称CAS号离子种类前体离子/Da产物离子1/Da产物离子2/Da去簇电压(DP)/V碰撞能量(CE)1/V碰撞能量(CE)2/V茵芋苷93-39-0[M+H]+324.9163215.31262426柠檬内酯487-06-9[M+H]+177.1121.1133.1673323七叶内酯305-01-1[M-H]-177.1133.1105.3-94-25-25异嗪皮啶486-21-5[M+H]+223162.1190.1503627秦皮素574-84-5[M-H]-207191.7108.2-82-17-274-甲基伞形酮90-33-5[M+H]+177103.177.1383048香豆素91-64-5[M+H]+147.390.9103.1733423橙皮内酯水合物5875-49-0[M+H]+279149.4189.1532025橙皮内酯23971-42-8[M+H]+261.1189.3243.3712316蛇床子素484-12-8[M+H]+245189131.1401920白当归脑26091-79-2[M+H]+317233.2231.212516248-羟基佛手苷内酯1603-47-0[M+H]+233.1218.4162.21572937独活素2880-49-1[M+H]+287.3203.485.27815435,7-二羟基-4-甲基香豆素2880-49-1[M+H]+19391.1137.2183332异茴芹内酯482-27-9[M+H]+247.2231.8216.9602633异欧前胡素482-45-1[M+H]+271.3203.1147.3622244欧前胡素482-44-0[M+H]+271.1203.269.21116168-(牻)牛儿醇基补骨脂素7437-55-0[M+H]+339.1203.1137.4942513香柠檬亭/佛手柑素7380-40-7[M+H]+339.2203.1322.41091718氧化前胡素737-52-0[M+H]+287203.3851802720异紫花前胡内酯13849-08-6[M+H]+247229.3175.3802828花椒毒醇2009-24-7[M+H]+203.114791263041异补骨脂素523-50-2[M+H]+187131.1115.2903431白当归素19573-01-4[M+H]+356.9253.9239.1573135珊瑚菜素2543-94-4[M+H]+301.2245.3233.215020208-氧甲基异欧前胡内酯14348-22-2[M+H]+301233.2217.11304646佛手柑內酯484-20-8[M+H]+217.12021741202737蟛蜞菊内脂524-12-9[M-H]-313297.9270-48-23-324-羟基香豆精1076-38-6[M+H]+163.2121911222433
1.6 数据分析
在Analyst®(SCIEX)软件上进行LC-MS/MS检测和数据收集,使用MultiQuant®(SCIEX)软件进行定量分析。使用使用Excel 2019、Origin 2018c和SPSS R26进行统计分析和绘图。每种样品均重复检测3次,数据结果表示为“平均值±标准差”。
2 结果与分析
2.1 质谱方法优化
每种化合物通过针泵进样,进入手动调谐模式进行优化其MRM参数。首先通过一级质谱扫描确定前体离子,通过碎离子扫描确定产物离子信息,进一步调整优化每个离子对的DP和CE。优化结果如表1所示,每种化合物由2个离子对,其中前体离子和产物离子1是定量离子对,前体离子和产物离子2是辅助定性离子对。实验结果表明,大多数香豆素类化合物在正离子模式下显示出更高的响应值,只有七叶内酯、秦皮素和蟛蜞菊内脂在负离子模式下显示出更高的响应值。由于使用了MRM模式,确保了实验的高效性和准确性,能够准确定量保留时间相同的化合物。
2.2 液相方法优化
通过优化液相参数,包括色谱柱、流动相和洗脱梯度等条件,实现了41种香豆素类化合物的良好分离。优化过程中使用的标准溶液质量浓度为50.00 μg/L,Acquity HSS T3色谱柱能保留极性更大的化合物,提供稳定的保留时间。选择乙腈作为流动相B,比甲醇洗脱效率更高,对色谱柱的压力更低。优化流动相B结果如图1所示所示,尝试通过向乙腈中添加0.1%甲酸来减弱拖尾,但噪音更大且响应值更低,最终选择纯乙腈作为流动相B。为了提高香豆素类化合物的分离效果和响应值,流动相A有3种优化方案,包括含0.1%甲酸、0.2%甲酸和0.5%甲酸的纯水。3种流动相A的正负离子流图如图1所示,含0.1%甲酸比含0.2%甲酸的水峰形更好,且比含0.5%甲酸的水对正负离子的电离效果更好,故选择含0.1%甲酸的纯水作为流动相A。优化了洗脱梯度以确保化合物在较短时间内正常分离,包括8组同分异构体:欧前胡素与异欧前胡素、8-(牻)牛儿醇基补骨脂素和佛手柑素、补骨脂素和异补骨脂素、花椒毒素和佛手柑内酯、橙皮内酯和异橙皮内酯、柠檬内酯和滨蒿內酯、珊瑚菜素和8-氧甲基异欧前胡内酯、香柑醇和花椒毒醇。液相方法优化后相对应的总离子流图(total ions chromatogram,TIC)、正离子提取流图[(+)XIC]和负离子提取流图[(-)XIC]如图2所示,该方法在14 min内有效分离了41种香豆素类化合物,其中包括8组同分异构体。

a-正离子;b-负离子
图1 正离子(+XIC)和负离子(-XIC)下提取的离子流图
Fig.1 Extracted ion chromatograms in positive (+XIC) and negative (-XIC) ion mode

a-总离子流图;b-正离子提取离子流图;c-负离子提取离子流图
图2 标准品总离子流图、正离子提取流图和负离子提取流图
Fig.2 Total ion chromatograms, extracted ion chromatograms in positive ion mode and negative ion mode from the standard mixture
注:化合物序号对应表2。
2.3 方法学验证
将混合标准品稀释成0.05、0.10、0.25、0.5、1、2.5、5、10、12.5、25.00、50.00、100.00 μg/L系列溶液,每种标准物质使用至少5个适宜浓度与MRM定量离子峰面积进行线性拟合。标准曲线、相关系数和线性范围如表2所示,线性相关系数均大于0.99,表明每种化合物的浓度与峰面积的线性关系良好。相同浓度下的不同物质响应值不同,检测限和定量限通过计算每种化合物信噪比和浓度来确定。39种化合物的LOD≤1.00 μg/L,37种化合物的LOQ≤1.00 μg/L。此外,6′,7′-二羟基香柠檬亭的LOD和LOQ最高,分别为2.61、8.7 μg/L,橙皮内酯的灵敏度最高,LOD和LOQ分别为0.002、0.006 μg/L。
将适当浓度的标准溶液加入佛手样品中,用甲醇提取稀释后评估该定量方法对41种香豆素类化合物的准确度和精确度。如表2所示,所有香豆素类化合物的添加回收率为80.43%~119.73%。仪器的精确度通过计算同一混合标准品的日内差和日间差的RSD进行评估,每种化合物的日内RSD<4.85%,日间RSD<5.44%。结果表明,该定量方法的灵敏度、精确度和准确度高,可用于佛手样品的41种香豆素的靶向筛查和定量分析。
表2 方法学验证相关参数
Table 2 Parameters related to method validation

化合物名称日内差/%日间差/%标准曲线线性范围检测限/(μg/L)定量限/(μg/L)保留时间/min加标回收率/%简单香豆素1茵芋苷1.732.16y=2.43e3x+8.22e2(r=0.995 4) 1~1000.160.542.49922柠檬内酯3.144.24y=4.016e4x+1.77e4(r=0.992 2) 1~1000.270.895.88803七叶内酯2.405.44y=9.24e3x+2.43e4(r=0.992 3) 2.5~1000.80.83.161024异嗪皮啶4.792.78y=2.6e4x+1.24e3(r=0.995 2)0.25~1000.070.234.351055秦皮素0.175.29y=3.55e3x+6.86e2(r=0.995 7) 0.5~1000.140.473.5110064-甲基伞形酮1.692.76y=1.4e4x+1.62e4(r=0.997 9)0.05~1000.010.044.878975,7-二甲氧基香豆素2.381.60y=3.72e4x+1.52e4(r=0.998 5) 0.5~1000.080.266.61038异橙皮内酯1.240.77y=1.71e5x+1.52e4(r=0.998 1)0.05~1000.010.036.771109伞形花内酯3.121.47y=9.54e3x+8.14e3(r=0.993 1) 2.5~1000.311.024.29810橙皮油内酯2.572.81y=1.02e5x+1.48e5(r=0.996 3)0.05~1000.0020.00810.2120115-牻牛儿醇基-7-甲氧基香豆素1.721.39y=2.54e5x+8.92e2(r=0.995 5)0.01~1000.0020.00810.5611712滨蒿內酯0.664.17y=2.75e4x+2.49e3(r=0.993 6) 1~1000.30.995.1912013香豆素0.912.80y=2.01e4x+2.69e3(r=0.993 1) 1~1000.030.15.410314橙皮内酯水合物0.903.16y=2.87e3x+2.84e3(r=0.996 0) 2.5~1000.411.46.929715橙皮内酯1.830.95y=3.48e5x+2.34e4(r=0.997 1)0.01~1000.0020.0066.9211016蛇床子素3.740.45y=3.69e5x+1.45e3(r=0.994 4)0.05~1000.0090.038.599呋喃香豆素17白当归脑3.223.77y=8.64e4x+7.39e4(r=0.998 8) 0.1~1000.030.097.24100188-羟基佛手苷内酯3.231.71y=1.84e4x+8.84e4(r=0.996 9) 1~1000.270.895.489719独活素1.080.98y=3.84e4x+8.42e3(r=0.998 2)0.25~1000.040.146.9195205,7-二羟基-4-甲基香豆素1.870.56y=1.12e3x+2.22e4(r=0.999 4) 1~1000.20.684.4510521异茴芹内酯1.663.71y=2.17e5x+1.48e4(r=0.995 1) 1~1000.260.886.7510522异欧前胡素2.860.72y=9.53e4x+6.77e2(r=0.997 2) 0.1~1000.020.088.7110223欧前胡素1.901.98y=1.63e5x+1.58e3(r=0.995 5)0.05~1000.010.048.13102246’,7’-环氧香柠檬亭4.051.50y=2.623e4x+3.5e3(r=0.998 5) 0.5~1000.830.288.81 187256’,7’-二羟基香柠檬亭1.453.10y=1.66e2x+4.06e2(r=0.990 4) 10~1002.618.76.993268-(牻)牛儿醇基补骨脂素1.831.80y=5.49e4x+5.87e3(r=0.995 6) 0.1~1000.150.0510.058727香柠檬亭4.850.54y=7.72e4x+5.86e3(r=0.996 2) 0.1~1000.010.0410.5111128补骨脂素2.701.98y=2.38e4x+2.75e3(r=0.992 2) 0.5~1000.140.486.1811229香柑醇2.511.09y=2.78e4x+3.86e3(r=0.996 7) 1~1000.230.785.5310530水合氧化前胡素2.371.71y=1.2e4x+1.63e3(r=0.992 4) 1~1000.220.725.4610731氧化前胡素0.912.09y=1.04e4x+7.57e3(r=0.999 1) 1~1000.20.686.911532异紫花前胡内酯3.101.04y=3.33e4x+9.03e3(r=0.994 4) 0.5~1000.090.315.368233花椒毒素1.742.68y=5.44e4x+1.01e3(r=0.994 6) 0.5~1000.10.346.349734花椒毒醇3.252.10y=3.98e4x+1.2e4(r=0.994 2) 1~1000.270.8810.058135异补骨脂素2.842.29y=4.45e4x+9.77e2(r=0.996 9) 0.5~1000.070.256.328136白当归素2.712.40y=3.08e2x+3.23e2(r=0.993 1) 5~1001.44.75.578137珊瑚菜素2.124.39y=4.64e4x+7.68e2(r=0.998 8)0.25~1000.050.188.4297388-氧甲基异欧前胡内酯3.013.60y=2.76e3x+4.61e2(r=0.997 2)2.5~1000.3118.6210939佛手柑內酯3.131.06y=9.19e4x+4.09e3(r=0.996 1)0.25~1000.080.256.7289其他40蟛蜞菊内脂0.733.79y=2.69e4x+3.15e3(r=0.995 8)0.25~1000.030.255.51108香豆素414-羟基香豆精3.691.99y=1.92e4x+2.52e4(r=0.991 0) 1~1000.190.634.92104
2.4 佛手中香豆素类化合物靶向筛查与定量分析
将新建立的UPLC-QqQ-MS/MS方法用于浙江省、云南省、广东省和重庆市4个产地佛手样品中41种香豆素类化合物的靶向筛查与定量分析。根据4个产地佛手样品提取物的统计结果(图3),在所测的佛手样品中未检测到所有41种目标化合物,并且4个产地的佛手样品所检测到的香豆素种类数量不同。在浙江佛手中可以检测并定量29种香豆素,云南佛手中有28种,而广东和重庆佛手中只有25种。由于有的化合物含量低于相应的定量限但高于检测限,有的香豆素可以检测到但不能定量,例如花椒毒醇和蟛蜞菊内脂。

a-简单香豆素;b-呋喃香豆素
图3 不同产地佛手的香豆素类化合物含量
Fig.3 The calculated contents of coumarins in different regions
注:化合物顺序按箭头所示方向排列。
在16种简单香豆素、23种呋喃香豆素和2种其他香豆素中,有6种化合物未在任何一个产地的佛手样品中检测到,包括秦皮素、8-羟基佛手苷内酯、5,7-二羟基-4-甲基香豆素、花椒毒素、8-氧甲基异欧前胡内酯和4-羟基香豆精。在浙江佛手中有5种化合物能检测到但不能定量,包括异橙皮内酯、6′,7′-二羟基香柠檬亭、补骨脂素、花椒毒醇和蟛蜞菊内脂,后三者同样在云南佛手中只能定性不能定量。七叶内酯、6′,7′-环氧香柠檬亭、异补骨脂素和蟛蜞菊内脂在广东佛手中不能定量,重庆佛手中异补骨脂素和6′,7′-二羟基香柠檬亭低于定量限。
4个产地佛手样品中简单香豆素柠檬内酯含量均为最高,其中浙江佛手的柠檬内酯含量最高,为(241.73±21.03) μg/g,其次是广东佛手为(156.93±16.56) μg/g,云南佛手有(127.13±13.85) μg/g,最后是重庆佛手(95.18±1.89) μg/g。此外,含量最多的呋喃香豆素为白当归素。谭涛等[27]检测了浙江佛手和云南佛手中的21种香豆素,结果表明柠檬内酯的含量最高,此结果与本文相同,但不同的是含量最多的呋喃香豆素为氧化前胡素,有可能因为他们的检测中未涉及到白当归素。虽然佛手样品定量到的呋喃香豆素种类最多,有15种,但定量到的简单香豆素的总含量远高于呋喃香豆素。在ZHONG等[14]的研究中,广东佛手中并未检测到欧前胡素、氧化前胡素、香柑醇和橙皮内酯,但在本研究中,可以筛查并定量,这表明了该方法的高灵敏度。在本研究中,首次检测并定量了4种香豆素,包括橙皮内酯水合物、异茴芹内酯、8-(牻)牛儿醇基补骨脂素和香柠檬亭。
3 结论
本研究开发了一种高效快速的UPLC-QqQ-MS/MS方法,可在14 min内筛查并定量41种香豆素类化合物,包括16种香豆素、23种呋喃香豆素和2种其他香豆素。该方法具有良好的线性关系、灵敏度、准确度和精确度,线性相关系数均大于0.99,回收率为80.43%~119.73%,日内差小于4.85%,日间差小于5.44%。该方法可应用于真实样品的检测,对4个不同产地的佛手果实中的41种香豆素类化合物进行筛查和定量,浙江佛手中检出的香豆素类化合物最多,柠檬内酯是含量最高的香豆素。有4种香豆素首次在佛手中检测并定量,包括橙皮内酯水合物、异茴芹内酯、8-(牻)牛儿醇基补骨脂素和香柠檬亭。该方法是目前涉及香豆素类化合物最多、检测速度最快的定量方法,对不同产地佛手的靶向筛查和定量分析可为佛手作为食品或药品提供理论依据和数据支持。
[1] 国家药典委员会. 中华人民共和国药典(2020版一部)[M].北京:中国医药科技出版社, 2020:185-186.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China (2020, Volume 1)[M].Beijin:China Medical Science Press, 2020:185-186.
[2] WU Z, LI H, TU D W, et al.Extraction optimization, preliminary characterization, and in vitro antioxidant activities of crude polysaccharides from finger citron[J].Industrial Crops and Products, 2013, 44:145-151.
[3] LUO X G, WANG J, CHEN H Q, et al.Identification of flavoanoids from finger citron and evaluation on their antioxidative and antiaging activities[J].Frontiers in Nutrition, 2020, 7:584900.
[4] JI L N, FAN X M, HOU X L, et al.Jieduquyuziyin prescription suppresses inflammatory activity of MRL/lpr mice and their bone marrow-derived macrophages via inhibiting expression of IRAK1-NF-κB signaling pathway[J].Frontiers in Pharmacology, 2020, 11:1049.
[5] WANG E W, LI Y Q, MAGUY B L, et al.Separation and enrichment of phenolics improved the antibiofilm and antibacterial activity of the fractions from Citrus medica L.var.sarcodactylis in vitro and in tofu[J].Food Chemistry, 2019, 294:533-538.
[6] MA Q G, TANG Y, SANG Z P, et al.Structurally diverse biflavonoids from the fruits of Citrus medica L.var.sarcodactylis Swingle and their hypolipidemic and immunosuppressive activities[J].Bioorganic Chemistry, 2021, 117:105450.
[7] PENG B, YANG J N, HUANG W J, et al.Structural characterization and immunoregulatory activity of a novel heteropolysaccharide from bergamot (Citrus medica L.var.sarcodactylis) by alkali extraction[J].Industrial Crops and Products, 2019, 140:111617.
[8] CHAN Y Y, HWANG T L, KUO P C, et al.Constituents of the fruits of Citrus medica L.var.sarcodactylis and the effect of 6,7-Dimethoxy-coumarin on superoxide anion formation and elastase release[J].Molecules, 2017, 22(9):1454.
[9] CHU J, LI S L, YIN Z Q, et al.Simultaneous quantification of coumarins, flavonoids and limonoids in Fructus Citri Sarcodactylis by high performance liquid chromatography coupled with diode array detector[J].Journal of Pharmaceutical and Biomedical Analysis, 2012, 66:170-175.
[10] 吴学峰, 谢斌, 黄晓兰, 等.基于UPLC-Q-TOF MS技术快速鉴定蒸制广佛手化学成分[J].质谱学报, 2021, 42(3):207-217.
WU X F, XIE B, HUANG X L, et al.Rapid analysis compositions of processed Citrus medica L.var.sarcodactylis swingle by UPLC-Q-TOF MS[J].Journal of Chinese Mass Spectrometry Society, 2021, 42(3):207-217.
[11] 魏莹, 陈珍, 杨兰, 等.HPLC法同时测定不同产地佛手中5个成分的含量[J].药物分析杂志, 2017, 37(12):2180-2184.
WEI Y, CHEN Z, YANG L, et al.Simultaneous determination of 5 components in Fructus Citris Sarcodactylis from different habitats by HPLC[J].Chinese Journal of Pharmaceutical Analysis, 2017, 37(12):2180-2184.
[12] 孙全, 徐冲, 刘霞, 等.HPLC同时测定川佛手中的橙皮苷与5,7-二甲氧基香豆素[J].华西药学杂志, 2017, 32(6):646-648.
SUN Q, XU C, LIU X, et al.Simultaneous determination of aurantiamarin and 5,7-dimethoxycoumarin in citri sarcodactylis fructus from Sichuan by HPLC[J].West China Journal of Pharmaceutical Sciences, 2017, 32(6):646-648.
[13] 胡瀚文, 赵永艳, 杨天龙, 等.基于UPLC-Q-Orbitrap HRMS的川佛手化学成分分析[J].中国实验方剂学杂志, 2020, 26(7):148-155.
HU H W, ZHAO Y Y, YANG T L, et al.Analysis and identification of chemical constituents of citri sarcodactylis fructus by UPLC-Q-orbitrap HRMS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(7):148-155.
[14] ZHONG Y M, FENG Y F, WU X, et al.Rapid identification of coumarins from Fructus citri sarcodactylis by UPLC/Q-TOF-MS[J].Natural Product Research, 2015, 29(1):53-58.
[15] 钟艳梅, 冯毅凡, 郭姣.基于UPLC-Q-TOF-MS的广佛手化学成分快速鉴定研究[J].天然产物研究与开发, 2014, 26(12):1965-1970;2040.
ZHONG Y M, FENG Y F, GUO J.Rapid identification of components from Fructus citri sarcodactylis based on ultra-high performance liquid chromatography time-of-flight mass spectrometry[J].Natural Product Research and Development, 2014, 26(12):1965-1970;2040.
[16] 吴春蓉. 佛手物质基础及质量评价研究[D].广州:广东药科大学, 2018.
WU C R.Study on the material base and quality evaluation of fructus citrus sarcodactylis[D].Guangzhou:Guangdong Pharmaceutical University, 2018.
[17] 王晋. 佛手总黄酮的分离纯化及其抗氧化活性研究[D].广州:华南农业大学, 2018.
WANG J.Studeies on separation, purification and antioxidant activities of bergamot total flavonoids[D].Guangzhou:South China Agricultural University, 2018.
[18] 臧文静. 不同品种柑橘果实黄酮类化合物组分鉴定与抗氧化活性研究[D].杭州:浙江大学, 2019.
ZANG W J.Identification and determination of flavonoids from different Citrus cultivars fruit and their antioxidant activity[D].Hangzhou:Zhejiang University, 2019.
[19] KATSORI A M, HADJIPAVLOU-LITINA D.Coumarin derivatives:An updated patent review (2012-2014)[J].Expert Opinion on Therapeutic Patents, 2014, 24(12):1323-1347.
[20] NAOWABOOT J, SOMPARN N, SAENTAWEESUK S, et al.Umbelliferone improves an impaired glucose and lipid metabolism in high-fat diet/streptozotocin-induced type 2 diabetic rats[J].Phytotherapy Research, 2015, 29(9):1388-1395.
[21] MIRA A, YAMASHITA S, KATAKURA Y, et al.In vitro neuroprotective activities of compounds from Angelica shikokiana Makino[J].Molecules, 2015, 20(3):4813-4832.
[22] KHOMENKO T M, ZARUBAEV V V, ORSHANSKAYA I R, et al.Anti-influenza activity of monoterpene-containing substituted coumarins[J].Bioorganic &Medicinal Chemistry Letters, 2017, 27(13):2920-2925.
[23] MA S N, LI Q, FENG Y M, et al.Simultaneous determination of five coumarins in Peucedanum decursivum radix by UPLC[J].Journal of Chromatographic Science, 2022, 60(2):173-178.
[24] DUGO P, RUSSO M, SAR M, et al.Multidimensional liquid chromatography for the determination of chiral coumarins and furocoumarins in Citrus essential oils[J].Journal of Separation Science, 2012, 35(14):1828-1836.
M, et al.Multidimensional liquid chromatography for the determination of chiral coumarins and furocoumarins in Citrus essential oils[J].Journal of Separation Science, 2012, 35(14):1828-1836.
[25] ![]() K, S
K, S DECK
DECK J,
J, ![]() J.HPLC separation and determination of dicoumarol and other simple coumarins in sweet clover[J].Nova Biotechnologica et Chimica, 2018, 17(1):95-102.
J.HPLC separation and determination of dicoumarol and other simple coumarins in sweet clover[J].Nova Biotechnologica et Chimica, 2018, 17(1):95-102.
[26] GUO P M, PANG W H, ZHAO X J, et al.A rapid UPLC-QqQ-MS/MS method for targeted screening and quantitative analysis of secondary metabolites in satsuma mandarin[J].European Food Research and Technology, 2021, 247(7):1725-1736.
[27] 谭涛, 董思龙, 秦艳, 等.佛手类黄酮和香豆素类物质的靶向筛查和定量分析研究[J].食品与发酵工业, 2023,49(18):297-305.
TAN T, DONG S L, QIN Y, et al.Targeted screening and quantitative analysis of flavonoids and coumarins in fingered citron (Citrus medica L.var.sarcodactylis Swingle)[J].Food and Fermentation Industries, 2023,49(18):297-305.