葡萄属于葡萄科(Vitaceae),葡萄属(Vitis),葡萄属植物按照系统分类学可以分为真葡萄亚属(Subgen.Euvitis Planch)和圆叶葡萄亚属(Subgen.Muscadinia Planch)。真葡萄亚属有70多个种,按照地理起源形成了3个种群,既欧亚、北美和东亚三大种群。按照葡萄用途不同,又可以分为鲜食品种、加工品种和砧木品种等[1-2]。红地球和蛇龙珠均属欧亚种且红地球归为鲜食葡萄类[3]、蛇龙珠归为酿酒葡萄类[4]。嘉宝果[Plinia cauliflora (Mart.) Kausel],又名树葡萄,为桃金娘科(Myrtaceae)拟爱神木属(Myrciaria)热带亚热带常绿小乔木或大型灌木[5],其原产于巴西,味道甜美宜人,略带酸味[6]。由于在本土引进早期主要作为一种观赏类植物,所以在本研究将其归为观赏类葡萄。
香气作为反映葡萄风味品质的重要指标,是大量挥发性化合物的复杂混合物,其成分因葡萄品种而异[7-9],且葡萄浆果中的芳香成分决定葡萄制品的典型风味特征[10]。葡萄中的挥发性化合物由游离态和结合态组成,游离态挥发物是可直接从葡萄果实闻到的一类香气物质,为葡萄贡献主要的品种香气[11],因其本身就具有挥发性,所以通过葡萄汁就可检测到[12]。结合挥发物基本上作为无味前体存在于葡萄中[13],这些与糖苷结合的挥发物可以在葡萄加工及在人口腔中酶的作用下进一步水解,释放出它们的苷元,这些释放的苷元可以影响葡萄及葡萄加工产品的整体香气[11],其水解可以通过酸、热、酶促和超声波等方法实现[14-17]。结合态挥发物也在许多葡萄品种中被确定为葡萄香气的前体,负责葡萄及葡萄加工制品的某些特定品种香气属性[18-21]。红地球、蛇龙珠作为重要的鲜食、酿酒葡萄品种其挥发性物质已被广泛研究,而树葡萄由于含有丰富的多酚类物质、具有营养健康方面的益处和用于开发衍生食品的潜在用途,近年来被广泛研究,但研究主要集中于非挥发性物质,而鲜有对其挥发性物质的研究[22-23]。
本研究采用固相萃取(solid phase extraction,SPE)技术及酶解法对葡萄的芳香糖苷进行提取及水解,并采用顶空固相微萃取-气相色谱联用三重四级杆质谱(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-QQQ)技术对3种葡萄果实中的游离及糖苷结合态挥发性化合物进行检测及半定量,其中用总离子流扫描(SCAN)模式对葡萄醇类、酯类、羰基类、酸类、萜烯类等挥发性物质进行检测,同时用选择离子监测(selected ion monitor,SIM)模式对与葡萄中绿色香气相关的C6醇/醛类物质及与含量低于SCAN模式检测限的甲氧基吡嗪类(methoxypyrazines,MPs)物质进行单独检测。旨在明晰3种葡萄的游离态及结合态挥发性物质的成分构成,为葡萄产品的鲜食与加工的香气品质识别与调控提供一定的理论指导。
1 材料与方法
1.1 材料与试剂
‘红地球’采摘于宁夏贺兰山东麓永宁产区,‘蛇龙珠’采摘于宁夏贺兰山东麓青铜峡产区,‘树葡萄’采摘于福建莆田产区;三者均为2019年采摘的成熟期果实。样品采摘后置于装有冰袋的泡沫箱中运输至实验室,然后放置于-20 ℃冰箱冷冻备用。
氯化钠、氢氧化钠、葡萄糖,国药集团化学试剂有限公司;色谱级无水乙醇、交联聚乙烯吡咯烷酮(crosslinked polyvinylpyrrolidone,PVPP)、葡萄糖酸内酯、氟化钠,上海阿拉丁试剂有限公司;Cleanert PEP-SPE树脂柱(200 mg/6 mL),天津飞诺美公司;HPLC级甲醇,美国Thermo Fisher公司;色谱级二氯甲烷,山东禹王试剂公司;AR 2000葡萄糖苷酶,美国Creative Enzymes公司;4-甲基-2-戊醇(色谱纯),纯度≥98%,日本TCI公司;C8~C20正构烷烃、3-异丁基-2-甲氧基吡嗪(3-isobutyl-2-methoxypyrazine, IBMP)、3-异丙基-2-甲氧基吡嗪(3-isopropyl-2-methoxypyrazine, IPMP)和3-仲丁基-2-甲氧基吡嗪(3-sec-butyl-2-methoxypyrazine, SBMP),纯度≥99%,美国Sigma试剂公司。
1.2 仪器与设备
ME104E型万分之一精度电子天平,上海梅特勒-托利多仪器有限公司;SZ-1型快速混匀器,常州圆仪仪器公司;万能高速粉碎机,浙江红景天有限公司;PHS-3C型pH计,上海雷磁公司;7890B-7000D气相色谱质谱联用仪,美国Agilent公司;Visiprep DL SPE真空固相萃取装置,美国Supelco公司;低温超速离心机,德国Eppendorf公司;旋转蒸发仪,美国Lab Tech公司。
1.3 实验方法
1.3.1 葡萄果实基本理化指标检测
葡萄果实基本理化指标检测方法参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定,总糖:直接滴定法;pH值:pH计测定法;总酸:酸碱滴定法。百粒重则采用直接称量法。上述所有检测均重复3次。
1.3.2 果实游离态挥发性化合物的提取及分析
游离态全种类挥发性化合物提取:随机选取100粒葡萄果实,液氮速冻后打碎成粉末,然后准确称取15 g葡萄果粉置于50 mL离心管中,加入0.15 g PVPP和0.1 g葡萄糖酸内酯,待果粉微融后快速混匀样品,后放置于4 ℃冰箱中静置4 h,以凝集蛋白及沉淀单宁等大分子非挥发性化合物。静置后将样品于4 ℃下以8 000 r/min的速率离心10 min后取上清液即得澄清葡萄汁[24]。
游离态C6醇/醛类化合物提取:同游离态全种类挥发性化合物提取。
游离态MPs提取:随机选取50粒除梗的葡萄果实,液氮速冻后打碎成粉末,称10 g葡萄果粉于50 mL离心管中,然后加入5 mL的NaF溶液(80 mg/L),快速混匀样品后在4 ℃下静置30 min以提取果实中的MPs。静置后的样品在4 ℃下以8 000 r/min的速度离心10 min取上清液[25]。
游离态各类挥发性化合物检测:取5 mL澄清葡萄汁、1.5 g NaCl、10 μL(1.008 3 g/L)内标加入到20 mL顶空瓶中,之后拧紧瓶盖,每个样品做2个重复。将顶空瓶置于自动进样器中,首先在250 ℃下对萃取头老化10 min,样品在50 ℃ 400 r/min下稳定5 min,随后将萃取头插入到顶空瓶进行吸附,在50 ℃ 400 r/min下吸附30 min,然后将萃取头插入到进样口中,在240 ℃下脱附10 min,进样模式为不分流进样。加热柱箱的起始温度为50 ℃,保持1 min,之后以3 ℃/min的速率升温至220 ℃并保持5 min,流路载气为纯度≥99.999%的高纯氦气,流速1 mL/min,传输线温度为250 ℃,离子源温度230 ℃,四级杆温度150 ℃,电子能量70 eV,采用SCAN模式进行检测,离子质量扫描范围m/z为35~300[26]。
游离态C6醇/醛类化合物检测:取5 mL澄清葡萄汁、1.5 g NaCl、10 μL(1.008 3 g/L)内标加入到20 mL顶空瓶中,之后拧紧瓶盖。样品置于自动进样器后的处理过程同游离态各类挥发性化合物检测。柱箱温度条件如下:初始温度为50 ℃保持1 min,之后以20 ℃/min的速率升温至110 ℃,紧接着以1 ℃/min的速率升温至135 ℃,最后以20 ℃/min的速率升温至220 ℃后结束。流路载气为纯度≥99.999%的高纯氦气,传输线温度为250 ℃,离子源温度230 ℃,四级杆温度150 ℃,电子能量70 eV,采用SIM模式进行检测,正己醛的定量特征离子m/z为56,定性特征离子m/z为44和41;E-2-己烯醛的定量特征离子m/z为83,定性特征离子m/z为55和41;正己醇的定量特征离子m/z为56,定性特征离子m/z为55和43;E-3-己烯醇和Z-3-己烯醇的定量特征离子m/z为67,定性特征离子m/z为82和41;E-2-己烯醇和Z-2-己烯醇的定量特征离子m/z为57,定性特征离子m/z为67和41。
游离态MPs检测:取5 mL上清液、1.5 g NaCl、10 μL(1.008 3 g/L)内标加入到20 mL顶空瓶中,旋紧瓶盖,每个样品做2个重复。样品置于自动进样器后的处理过程同游离态各类挥发性化合物检测。柱箱温度条件如下:初始温度为50 ℃保持1 min,之后以20 ℃/min的速率升温至110 ℃,紧接着以2 ℃/min的速率升温至160 ℃,最后以20 ℃/min的速率升温至220 ℃后结束。流路载气为纯度≥99.999%的高纯氦气,传输线温度为250 ℃,离子源温度230 ℃,四级杆温度150 ℃,电子能量70eV,采用SIM模式进行检测,IPMP定量特征离子m/z为137,定性特征离子m/z为152和124;SBMP定量特征离子m/z为138,定性特征离子m/z为124和151;IBMP定量特征离子m/z为124,定性特征离子m/z为151和94。
检测结果使用NIST 17标准质谱库对物质进行定性分析,依据色谱保留时间和质谱信息在NIST 17标准谱库中检索,同时计算RI值(retention index,RI)[27]。并对3种葡萄挥发物采用内标半定量法来对比物质相对含量的差异。
1.3.3 果实结合态挥发性化合物的提取及分析
结合态全种类挥发性化合物提取:澄清葡萄汁的获取同1.3.2节。首先依次使用10 mL甲醇、10 mL水活化固相萃取柱;之后将5 mL澄清葡萄汁缓慢通过固相萃取柱进行吸附分离,然后使用5 mL的超纯水通过萃取柱,以除去吸附的糖、酸和大多数其他极性化合物,接下来使用5 mL的二氯甲烷通过萃取柱,来除去吸附的游离态挥发物,最后使用10 mL甲醇洗脱,将结合态香气的糖苷结合前体洗脱下来并收集。收集的甲醇洗脱液使用旋转蒸发仪旋干,然后重新溶解于10 mL的柠檬酸-磷酸盐缓冲液中(0.2 mol/L,pH=5),收集缓冲液,之后向缓冲液中加入100 μL的AR 2000糖苷酶溶液(100 g/L),摇匀后放置于40 ℃ 的培养箱中培养16 h进行酶促水解,每组样品做2个重复[28]。
结合态C6醇/醛类化合物提取:同结合态全种类挥发性化合物提取。
结合态全种类挥发性化合物检测:取5 mL酶促水解结合态挥发物缓冲液、1.5 g NaCl、10 μL(1.008 3 g/L)内标加入到20 mL顶空瓶中,之后拧紧瓶盖。后续检测程序同1.3.2节游离态各类挥发性化合物检测。
结合态C6醇/醛类化合物检测:取5 mL酶促水解结合态挥发物缓冲液、1.5 g NaCl、10 μL(1.008 3 g/L)内标加入到20 mL顶空瓶中,之后拧紧瓶盖。后续检测程序同1.3.2节游离C6醇/醛类化合物检测。
1.4 数据处理
所有统计分析均由R 4.2.1软件进行。采用单向方差分析(ANOVA)评估不同葡萄品种理化参数间的显著差异(P<0.05),采用最小显著差异(least significant difference,LSD)事后检验。通过R中的“pheatmap”包进行聚类分析,探索游离和结合挥发性化合物的差异。
2 结果与分析
2.1 不同葡萄果实基本理化指标检测结果分析
pH值、还原糖、滴定酸及百粒重是评估葡萄成熟度的重要指标。如图1所示,由4种理化指标可知红地球、树葡萄、蛇龙珠均已成熟[3,5,25]。且由图1-A可知,红地球百粒重最大,树葡萄次之,蛇龙珠最低;由图1-B可知,3种葡萄中,蛇龙珠的pH值最大,树葡萄最小,红地球居中;由图1-C和图1-D可知,蛇龙珠还原糖含量最高,滴定酸含量居中;树葡萄还原糖含量最低,滴定酸含量最高;红地球还原糖含量居中,滴定酸含量最低;3种葡萄的4个理化指标间均具有显著性差异;如图1-E所示,3种葡萄还原糖/滴定酸也存在显著性差异,树葡萄的糖酸比远远低于红地球和蛇龙珠,可能存在由于口感过酸而不被多数喜爱偏甜鲜食葡萄的中国消费者广泛接受问题[29],且由于低的糖酸比其在酿酒用途上也存在局限性。但树葡萄被证明具有很高的营养保健功效[22],所以若能在栽培过程中改善树葡萄高酸低糖的问题,可既保留其营养价值又丰富用途。
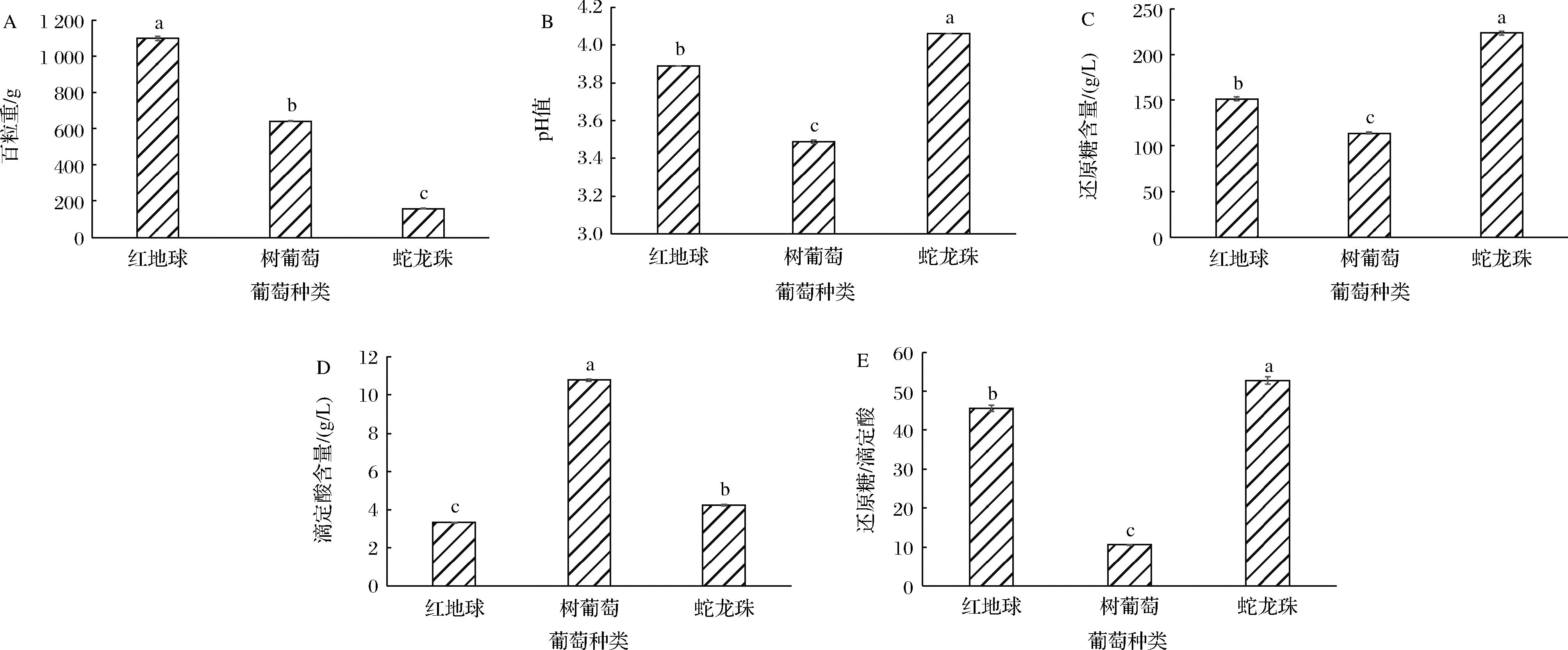
A-百粒重;B-pH值;C-还原糖;D-滴定酸;E-还原糖/滴定酸
图1 葡萄果实的基本理化指标
Fig.1 The basic physical and chemical indicators of grape fruit
注:不同小写字母表示差异显著(P<0.05)。
2.2 葡萄果实游离及结合态C6挥发性化合物含量
C6醇/醛根据其气味描述被命名为绿叶挥发物(green leaf les,GLVs)[30],是葡萄绿色香气的主要来源,这类物质能对葡萄及加工制品的品质产生重要影响[31]。本研究选择葡萄及加工产品中常见的7种C6醇/醛类物质进行了SIM模式检测。表1结果表明,红地球中游离态C6醇/醛类物质总含量最高,树葡萄最低,三者含量之间具有显著性差异;而结合态C6醇/醛类物质则是蛇龙珠最高,红地球最低;且红地球中的游离态及蛇龙珠中的结合态C6醇/醛类物质均以C6醛为主,而有研究表明C6醛相对于C6醇具有更低的感官阈值,更易对葡萄香气产生影响[32],所以红地球作为鲜食葡萄能以其清新的绿色植物香气吸引消费者,而蛇龙珠作为酿酒葡萄,其较高浓度的结合态C6醛可在发酵及陈酿过程被释放出来进而影响葡萄酒香气。红地球的游离态C6醇以正己醇和E-2-己烯醇为主,二者含量显著高于蛇龙珠和树葡萄;蛇龙珠的游离态C6醇中Z-3-己烯醇含量最高,树葡萄的游离态C6醇中E-2-已烯醇含量最高。蛇龙珠的结合态C6醇中正己醇含量最高,树葡萄的C6醇中Z-3-己烯醇含量最高,红地球中结合态C6醇/醛类物质含量均最低。
表1 葡萄果实游离、结合态C6醇/醛类挥发性化合物含量
Table 1 Contents of free and bound C6 alcohol/aldehyde volatile compounds in grape fruits
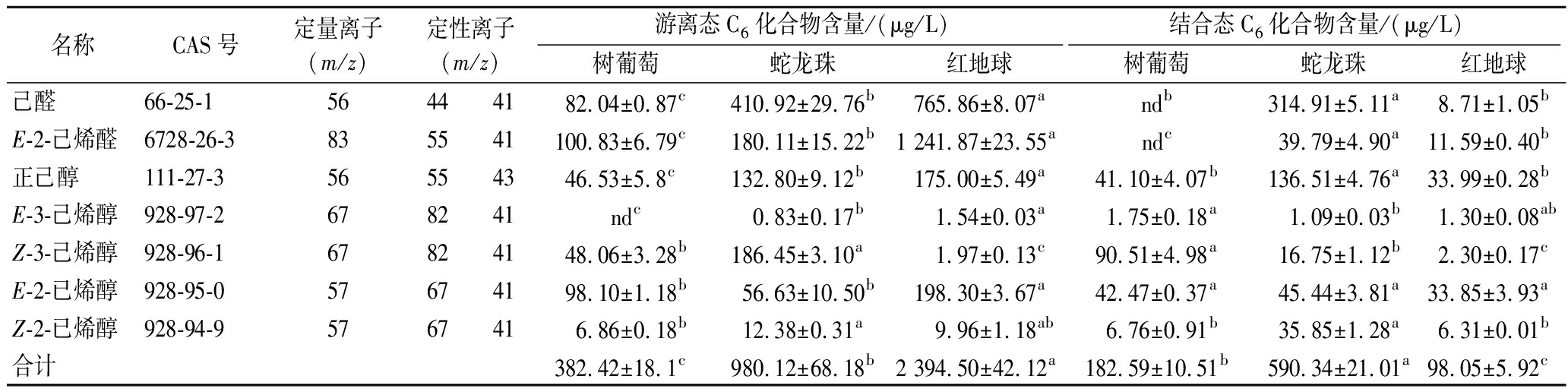
名称CAS号定量离子(m/z)定性离子(m/z)游离态C6化合物含量/(μg/L)结合态C6化合物含量/(μg/L)树葡萄蛇龙珠红地球树葡萄蛇龙珠红地球己醛66-25-1 56444182.04±0.87c410.92±29.76b765.86±8.07andb314.91±5.11a8.71±1.05bE-2-己烯醛6728-26-3 835541100.83±6.79c180.11±15.22b1 241.87±23.55andc39.79±4.90a11.59±0.40b正己醇111-27-3 56554346.53±5.8c132.80±9.12b175.00±5.49a41.10±4.07b136.51±4.76a33.99±0.28bE-3-己烯醇928-97-2 678241ndc0.83±0.17b1.54±0.03a1.75±0.18a1.09±0.03b1.30±0.08abZ-3-己烯醇928-96-1 67824148.06±3.28b186.45±3.10a1.97±0.13c90.51±4.98a16.75±1.12b2.30±0.17cE-2-已烯醇928-95-057674198.10±1.18b56.63±10.50b198.30±3.67a42.47±0.37a45.44±3.81a33.85±3.93aZ-2-已烯醇928-94-9 5767416.86±0.18b12.38±0.31a9.96±1.18ab6.76±0.91b35.85±1.28a6.31±0.01b合计382.42±18.1c980.12±68.18b2 394.50±42.12a182.59±10.51b590.34±21.01a98.05±5.92c
注:“nd”表示未检测到相应物质(下同);“a,b,c”表示3种葡萄中游离、结合态C6醛、醇类物质含量的显著性差异(LSD Fisher test,P<0.05)。
2.3 葡萄果实游离态MPs挥发性化合物含量
MPs是一类在葡萄中被广泛的研究的物质,因为它们所带来的草本和植物类感官特征会对葡萄及加工制品的香气和风味产生或利或弊的影响[33]。如葡萄酒中的MPs有时被认为是品种香气,但过高含量的MPs可能会产生不可接受的绿色和未成熟的香气,对葡萄酒质量产生负面影响[34-35]。因目前未有研究表明存在结合态MPs,所以本研究对3种葡萄中常见的游离态MPs类物质的检测结果如表2所示,树葡萄中MPs含量最高,红地球最低;且树葡萄中有最高含量的IPMP,IPMP能给葡萄带来土豆、芦笋的香气;蛇龙珠中有最高含量的IBMP,且IBMP仅在蛇龙珠中存在,而IBMP能给葡萄增加青椒、草本的香气;SBMP则在3种葡萄中含量均最低,对葡萄香气产生的影响较小。
2.4 葡萄果实游离及结合态挥发性化合物特征分析
为探究以红地球、蛇龙珠、树葡萄为材料的鲜食、酿酒、观赏类葡萄的风味物质特征,本研究利用HS-SPME-GC-QQQ技术对不同葡萄果实游离及结合态挥发性化合物进行检测,本实验共测得游离态挥发性化合物共74种,其中红地球26种,蛇龙珠32种,树葡萄55种(表3);共测得结合态挥发性化合物共40种,其中红地球17种,蛇龙珠23种,树葡萄28种(表4)。为解析三类葡萄的风味物质特征,对3种葡萄的游离及结合态挥发性化合物进行聚类分析并作出热图。
表2 葡萄果实游离态MPs挥发性化合物含量
Table 2 Contents of free MPs volatile compounds in grape fruit

名称CAS号定量离子(m/z)定性离子(m/z)游离态MPs化合物含量/(ng/L)树葡萄蛇龙珠红地球IPMP25773-40-4137152124406.69±22.09a122.16±4.98b37.24±3.37cSBMP24168-70-513812415157.74±3.18a19.47±0.02b21.67±0.84bIBMP24683-00-912415194ndb105.19±6.70andb合计464.43±25.27a246.82±11.7b58.91±4.21c
注:“a,b,c”表示3种葡萄中游离态MPs类物质含量的显著性差异(LSD Fisher test,P<0.05)。
表3 葡萄果实游离态挥发性化合物相对含量
Table 3 Relative content of free volatile compounds in grape fruit
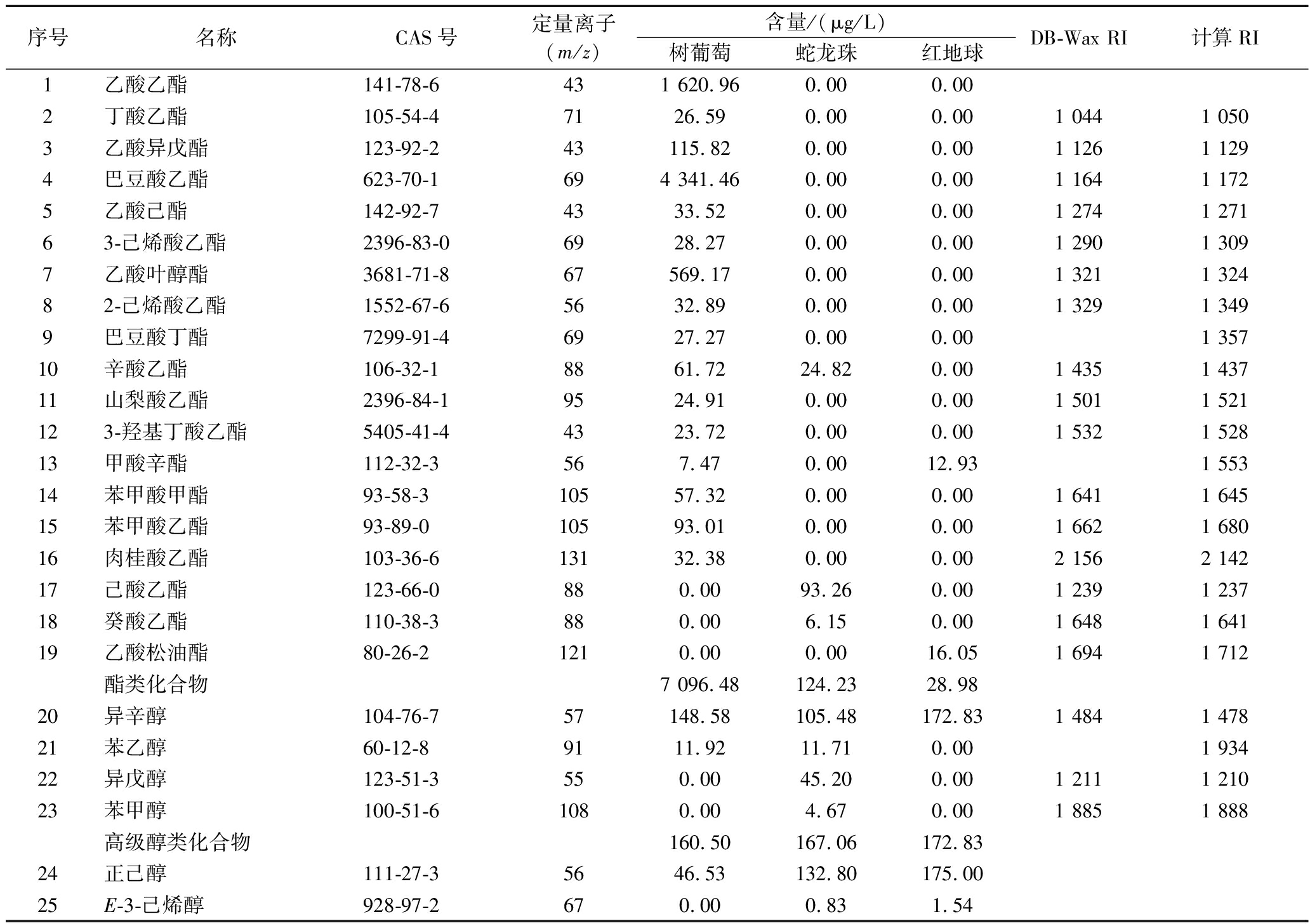
序号名称CAS号定量离子(m/z)含量/(μg/L)树葡萄蛇龙珠红地球DB-Wax RI计算RI1乙酸乙酯141-78-6431 620.96 0.00 0.002丁酸乙酯105-54-47126.59 0.00 0.00 1 0441 0503乙酸异戊酯123-92-243115.82 0.00 0.00 1 1261 1294巴豆酸乙酯623-70-1694 341.46 0.00 0.00 1 1641 1725乙酸己酯142-92-74333.52 0.00 0.00 1 2741 27163-己烯酸乙酯2396-83-06928.27 0.00 0.00 1 2901 3097乙酸叶醇酯3681-71-867569.17 0.00 0.00 1 3211 32482-己烯酸乙酯1552-67-65632.89 0.00 0.00 1 3291 3499巴豆酸丁酯7299-91-46927.27 0.00 0.00 1 35710辛酸乙酯106-32-18861.72 24.82 0.00 1 4351 43711山梨酸乙酯2396-84-19524.91 0.00 0.00 1 5011 521123-羟基丁酸乙酯5405-41-44323.72 0.00 0.00 1 5321 52813甲酸辛酯112-32-3567.47 0.00 12.93 1 55314苯甲酸甲酯93-58-310557.32 0.00 0.00 1 6411 64515苯甲酸乙酯93-89-010593.01 0.00 0.00 1 6621 68016肉桂酸乙酯103-36-613132.38 0.00 0.00 2 1562 14217己酸乙酯123-66-0880.00 93.26 0.00 1 2391 23718癸酸乙酯110-38-3880.00 6.15 0.00 1 6481 64119乙酸松油酯80-26-21210.00 0.00 16.05 1 6941 712酯类化合物7 096.48 124.23 28.98 20异辛醇104-76-757148.58 105.48 172.83 1 4841 47821苯乙醇60-12-8 9111.92 11.71 0.00 1 93422异戊醇123-51-3 550.00 45.20 0.00 1 2111 21023苯甲醇100-51-61080.00 4.67 0.00 1 8851 888高级醇类化合物160.50 167.06 172.8324正己醇111-27-35646.53 132.80 175.00 25E-3-己烯醇928-97-2670.00 0.83 1.54
续表3
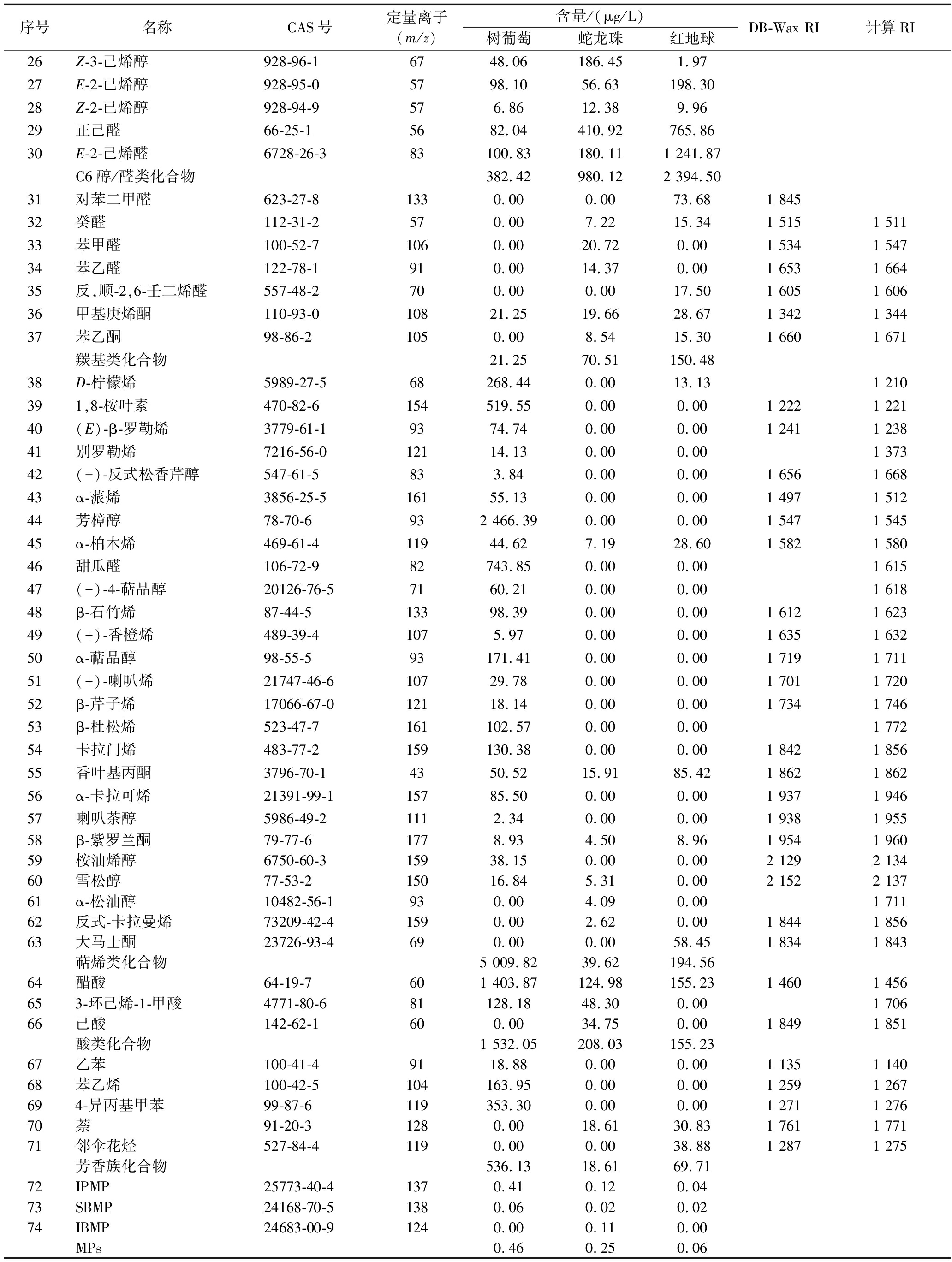
序号名称CAS号定量离子(m/z)含量/(μg/L)树葡萄蛇龙珠红地球DB-Wax RI计算RI26Z-3-己烯醇928-96-16748.06 186.45 1.9727E-2-已烯醇928-95-05798.10 56.63 198.3028Z-2-已烯醇928-94-9576.86 12.38 9.9629正己醛66-25-15682.04 410.92 765.8630E-2-己烯醛6728-26-383100.83 180.11 1 241.87C6醇/醛类化合物382.42 980.12 2 394.50 31对苯二甲醛623-27-81330.00 0.00 73.681 84532癸醛112-31-2570.00 7.22 15.34 1 5151 51133苯甲醛100-52-71060.00 20.72 0.00 1 5341 54734苯乙醛122-78-1910.00 14.37 0.00 1 6531 66435反,顺-2,6-壬二烯醛557-48-2700.00 0.00 17.50 1 6051 60636甲基庚烯酮110-93-010821.25 19.66 28.67 1 3421 34437苯乙酮98-86-21050.00 8.54 15.30 1 6601 671羰基类化合物21.25 70.51 150.4838D-柠檬烯5989-27-568268.44 0.00 13.13 1 210391,8-桉叶素470-82-6154519.55 0.00 0.00 1 2221 22140(E)-β-罗勒烯3779-61-19374.74 0.00 0.00 1 2411 23841别罗勒烯7216-56-012114.13 0.00 0.00 1 37342(-)-反式松香芹醇547-61-5833.84 0.00 0.00 1 6561 66843α-蒎烯3856-25-516155.13 0.00 0.00 1 4971 51244芳樟醇78-70-6932 466.39 0.00 0.00 1 5471 54545α-柏木烯469-61-411944.62 7.19 28.60 1 5821 58046甜瓜醛106-72-982743.85 0.00 0.00 1 61547(-)-4-萜品醇20126-76-57160.21 0.00 0.00 1 61848β-石竹烯87-44-513398.39 0.00 0.00 1 6121 62349(+)-香橙烯489-39-41075.97 0.00 0.00 1 6351 63250α-萜品醇98-55-593171.41 0.00 0.00 1 7191 71151(+)-喇叭烯21747-46-610729.78 0.00 0.00 1 7011 72052β-芹子烯17066-67-012118.14 0.00 0.00 1 7341 74653β-杜松烯523-47-7161102.57 0.00 0.00 1 77254卡拉门烯483-77-2159130.38 0.00 0.00 1 8421 85655香叶基丙酮3796-70-14350.52 15.91 85.42 1 8621 86256α-卡拉可烯21391-99-115785.50 0.00 0.00 1 9371 94657喇叭茶醇5986-49-21112.34 0.00 0.00 1 9381 95558β-紫罗兰酮79-77-61778.93 4.50 8.96 1 9541 96059桉油烯醇6750-60-315938.15 0.00 0.00 2 1292 13460雪松醇77-53-215016.84 5.31 0.00 2 1522 13761α-松油醇10482-56-1930.00 4.09 0.00 1 71162反式-卡拉曼烯73209-42-41590.00 2.62 0.00 1 8441 85663大马士酮23726-93-4690.00 0.00 58.45 1 8341 843萜烯类化合物5 009.82 39.62 194.5664醋酸64-19-7601 403.87 124.98 155.23 1 4601 456653-环己烯-1-甲酸4771-80-681128.18 48.30 0.00 1 70666己酸142-62-1600.00 34.75 0.00 1 8491 851酸类化合物1 532.05 208.03 155.2367乙苯100-41-49118.88 0.00 0.00 1 1351 14068苯乙烯100-42-5104163.95 0.00 0.00 1 2591 267694-异丙基甲苯99-87-6119353.30 0.00 0.00 1 2711 27670萘91-20-31280.00 18.61 30.83 1 7611 77171邻伞花烃527-84-41190.00 0.00 38.88 1 2871 275芳香族化合物536.13 18.61 69.7172IPMP25773-40-41370.41 0.12 0.0473SBMP24168-70-51380.06 0.02 0.0274IBMP24683-00-91240.00 0.11 0.00 MPs0.46 0.25 0.06
表4 葡萄果实结合态挥发性化合物相对含量
Table 4 Relative contents of bound volatile compounds in grape fruit

序号名称CAS号定量离子(m/z)含量/(μg/L)树葡萄蛇龙珠红地球DB-Wax RI计算RI1乙酸乙烯酯108-05-4 4337.26 0.00 0.00 1 0152甲酸庚酯112-23-2 700.00 9.71 0.00 1 4513甲酸辛酯112-32-3 560.00 11.67 6.38 1 5534水杨酸甲酯119-36-8 1200.00 61.75 0.00 1 8051 8115棕榈酸乙酯628-97-7 880.00 1.57 0.00 2 2462 221酯类化合物37.26 84.70 6.386异辛醇104-76-7 5728.87 33.32 33.33 1 4731 47871-壬醇143-08-8 705.89 0.00 0.00 1 6581 6568苯甲醇100-51-6 10813.67 40.78 18.17 1 8851 8889苯乙醇60-12-8 9147.34 59.50 27.29 1 93310异戊醇123-51-3 550.00 19.63 0.00 1 2111 210113-甲基-3-丁烯-1-醇763-32-6 680.00 5.57 0.00 1 2471 251122-庚醇543-49-7 450.00 10.89 0.00 1 3101 318133-甲基-2-丁烯-1-醇556-82-1 710.00 5.59 0.00 1 3131 324高级醇类化合物95.77 175.29 78.7914正己醇111-27-35641.10 136.51 33.9915E-3-己烯醇928-97-2671.75 1.09 1.3016Z-3-己烯醇928-96-16790.51 16.75 2.3017E-2-已烯醇928-95-05742.47 45.44 33.8518Z-2-已烯醇928-94-9576.76 35.85 6.3119己醛66-25-1560.00 314.91 8.7120E-2-己烯醛6728-26-3830.00 39.79 11.59C6醇/醛类化合物182.59 590.34 98.0521苯乙醛122-78-1 917.25 0.00 0.00 1 6531 66422苯甲醛100-52-7 1060.00 0.00 35.81 1 5341 54723甲基异丁基甲酮108-10-1 439.85 8.15 0.00 1 0191 022242-己酮591-78-6 4312.00 9.80 0.00 1 0881 101252-辛酮111-13-7 430.00 0.00 35.25 1 2831 217羰基类化合物29.09 17.95 71.0626水芹烯99-83-2 9329.22 0.00 0.00 1 1761 17227α-松油烯99-86-5 12114.20 0.00 0.00 1 1871 18628D-柠檬烯5989-27-5 6856.71 0.00 4.68 1 21029β-水芹烯555-10-2 9334.59 0.00 0.00 1 2121 22130(E)-β-罗勒烯3779-61-1 9342.32 0.00 0.00 1 2411 23831(Z)-氧化芳樟醇5989-33-3 592.08 0.00 0.00 1 4781 47232芳樟醇78-70-6 93392.69 0.00 0.00 1 5471 54533(-)-反式松香芹醇547-61-5 927.07 0.00 0.00 1 6561 66834α-萜品醇98-55-5 9340.08 4.98 0.00 1 7191 71135桃金娘烯醇515-00-4 7945.17 0.00 0.00 1 7941 81136橙花醇106-25-2 694.94 4.06 8.93 1 8371 84937橙花丙酮3879-26-3 431.91 0.00 2.78 1 86338桃金娘烷醇514-99-8 932.57 0.00 0.00 1 883萜烯类化合物673.54 9.04 16.3939醋酸64-19-7 60222.15 75.09 0.00 1 4601 456酸类化合物222.15 75.09 0.0040对伞花烃99-87-6 11977.99 0.00 0.00 1 276芳香族化合物77.99 0.00 0.00

图2 不同葡萄果实游离态挥发性化合物聚类热图
Fig.2 Clustering heatmap of free volatile compounds in different grape fruit
由图2可知,3种葡萄的游离态挥发性风味物质特征区分明显。对红地球葡萄整体香气有贡献的物质包括:E-2-己烯醇、E-3-己烯醇、正己醇、E-2-己烯醛、己醛5种C6醇/醛类,甲基庚烯酮、对苯二甲醛、反,顺-2,6-壬二烯醛、苯乙酮、癸醛5种羰基类化合物,大马士酮、香叶基丙酮2种萜烯类,乙酸松油酯、甲酸辛酯2种酯类,邻伞花烃、萘2种芳香族化合物及异辛醇1种高级醇类,共17种物质;对蛇龙珠葡萄整体香气有贡献的物质包括:反式-卡拉曼烯、α-松油醇2种萜烯类,癸酸乙酯、己酸乙酯2种酯类,Z-3-己烯醇、Z-2-己烯醇2种C6醇/醛类,苯甲醛、苯乙醛2种羰基类,异戊醇、苯甲醇2种高级醇类,己酸1种酸类及IBMP 1种MPs,共12种物质;对红地球葡萄整体香气有贡献的物质包括:D-柠檬烯、别罗勒烯、1,8-桉叶素等22种萜烯类,苯甲酸乙酯、苯甲酸甲酯、山梨酸乙酯等15种酯类,IPMP和SBMP 2种MPs,4-异丙基甲苯、乙苯、苯乙烯3种芳香族化合物,醋酸、3-环己烯-1-甲酸2种酸类及苯乙醇1种高级醇,共45种物质。
由图3可知,3种葡萄的结合态挥发性风味物质特征也具有很高的区分度,红地球葡萄中贡献结合态香气的物质包括:橙花醇、橙花丙酮2种萜烯类,2-辛酮、苯甲醛2种羰基类化合物,共4种物质;蛇龙珠葡萄中贡献结合态香气的物质包括:正己醇、己醛、Z-2-己烯醇、E-2-己烯醛4种C6醇/醛类,异戊醇、3-甲基-2-丁烯-1-醇、3-甲基-3-丁烯-1-醇、2-庚醇、苯甲醇、异辛醇6种高级醇类,甲酸辛酯、棕榈酸乙酯、水杨酸甲酯、甲酸庚酯4种酯类,共14种物质;树葡萄中贡献结合态香气的物质包括:芳樟醇、D-柠檬烯、桃金娘烯醇等11种萜烯类,苯乙醛、1-壬醛、2-乙酮、甲基异丁基甲酮4种羰基类,E-3-己烯醇、Z-3-己烯醇、E-2-己烯醇3种C6醇/醛类,乙酸乙烯酯1种酯类,苯乙醇1种高级醇类,醋酸1种酸类及对伞花烃1种芳香族化合物,共22种物质。
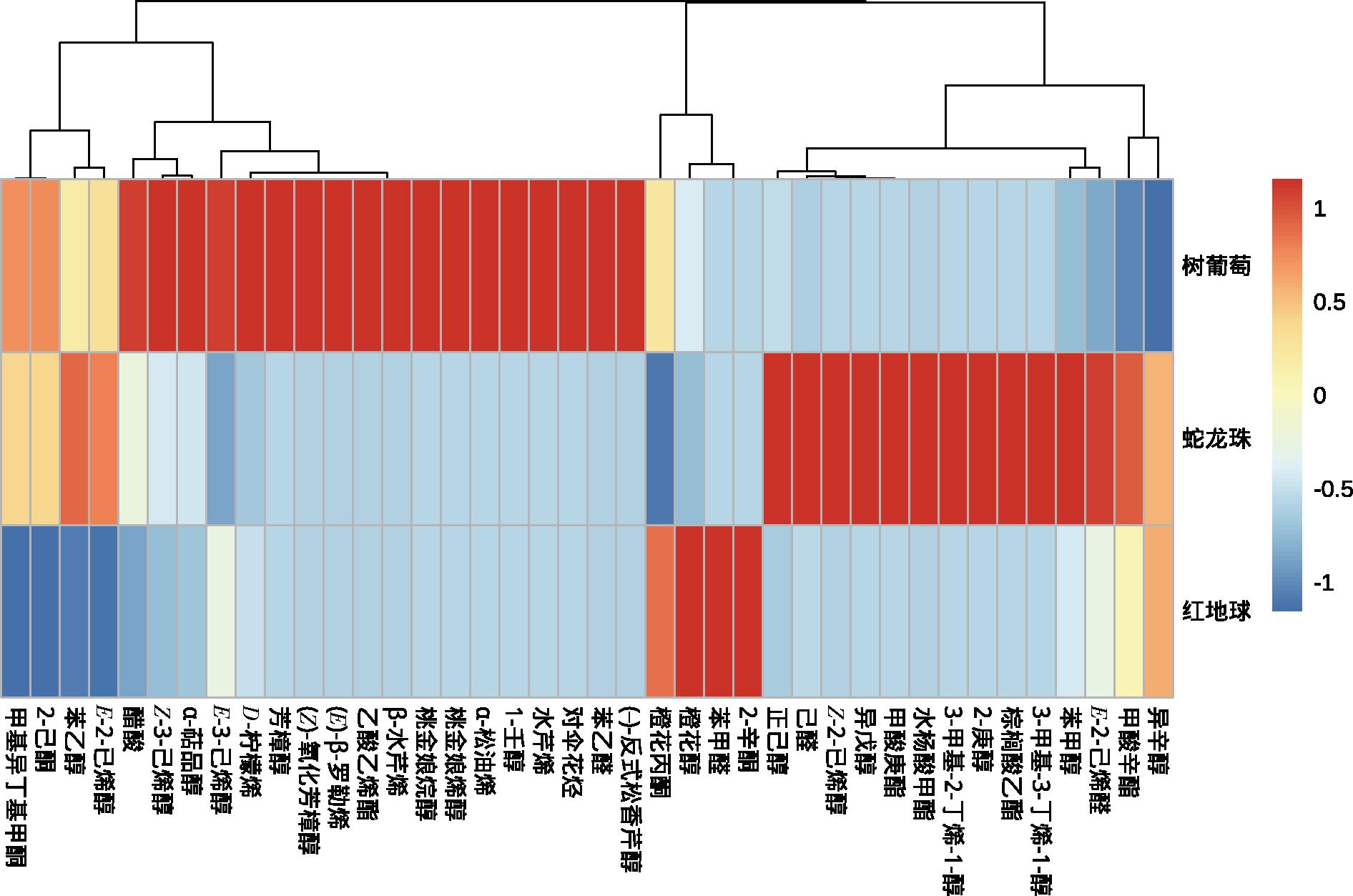
图3 不同葡萄果实结合态挥发性化合物聚类热图
Fig.3 Clustering heatmap of bound volatile compounds in different grape fruit
相比蛇龙珠与树葡萄,红地球挥发性风味物质种类较少,其游离态香气以C6醇/醛贡献的绿色植物及基羰基类化合物贡献的柑橘、甜瓜、山楂、紫罗兰、合欢花等花果香为主。蛇龙珠的结合态挥发物种类比游离态更丰富,使其能葡萄酒发酵及陈酿过程能释放更多的香气,提高葡萄酒香气的复杂度,这与前人研究[11]相似;且其结合态C6醇醛及高级醇类物质种类较多,可为葡萄酒中主要产生果香的酯类物质的合成提供反应底物。树葡萄的挥发性风味物质最丰富且总含量最高,能给葡萄贡献复杂、浓郁的香气,其游离及结合态香气都主要由萜烯类化合物贡献,但相比于蛇龙珠与红地球中的α-松油醇、香叶基丙酮、大马士酮等能给葡萄带来花香、甜香等香气的萜烯类化合物,树葡萄中所含有的萜烯主要为雪松醇、1,8-桉叶素、别罗勒烯、D-柠檬烯等贡献植物、草本及等香气的物质,且此类萜烯中有多种物质具有抗炎抑菌和保健功效[36-39],所以树葡萄的挥发性物质也参与其营养保健的作用。
3 结论
红地球、蛇龙珠、树葡萄的百粒重、pH值、还原糖、滴定酸4种理化之间指标均具有显著性差异,三者相比,红地球果粒大、酸度低、含糖量较低;蛇龙珠果粒小、酸度较低、含糖量高;树葡萄果粒中等、酸度高、含糖量低。其理化指标与三类葡萄各自的主要用途有一定的相关性。
红地球葡萄果实经定性分析共检测到26种游离态挥发物、17种结合态挥发物;蛇龙珠中共检测到32种游离态挥发物、23种结合态挥发物;树葡萄中共检测到55种游离态挥发性物、28种结合态挥发物。3种葡萄果实的游离及结合态挥发物经聚类分析可看出,三者在香气特征上是可以被完全区分的。红地球果实游离态挥发物总含量主要由C6醇/醛类、高级醇、萜烯类、羰基类及酸类化合物构成;结合态挥发物种类较少且微量,对整体香气的影响较小。蛇龙珠果实游离态挥发物总含量主要由C6醇/醛类、高级醇类及酯类化合物构成,且其含有较高含量的极低阈值化合物IBMP,此化合物对葡萄香气影响较大;结合态挥发物含量主要由C6醇/醛类及高级醇类化合物构成。树葡萄游离态挥发物含量主要由酯类、萜烯类、酸类、芳香族、C6醇/醛类化合物及构成,且其含有较高含量的低阈值化合物IPMP;结合态挥发物含量主要由萜烯类及C6醇/醛类化合物构成。
[1] VENKITASAMY C, ZHAO L M, ZHANG R H, et al.Grapes.[M].Amsterolam: Elsevier, 2019:133-163.
[2] 刘崇怀. 中国葡萄属(Vitis L.)植物分类与地理分布研究[D].郑州:河南农业大学,2012.
LIU C H.Studies on taxonomy and geographical distribution of Chinese wild grape species[D].Zhengzhou:Henan Agricultural University, 2012.
[3] 颜孙安, 黄彪, 林香信, 等.6种鲜食葡萄营养成分比较分析[J].食品安全质量检测学报, 2021, 12(1):283-290.
YAN S A, HUANG B, LIN X X, et al.Comparison and analysis of nutritional components of 6 kinds of table grapes[J].Journal of Food Safety and Quality Inspection, 2021, 12(1):283-290.
[4] ZHONG X M, YAO Y X, DU Y P, et al.‘Cabernet Gernischt’ is most likely to be ‘Carmenère’[J].Vitis-Geilweilerhof, 2012, 51(3):125-127.
[5] 只佳增, 钱云, 陈鸿洁.嘉宝果研究进展及利用前景[J].热带农业科技, 2018, 41(3):35-39.
ZHI J Z, QIAN Y, CHEN H J.The advances in research of Myrciaria cauliflora and its prospects for application[J].Tropical Agricultural Science &Technology, 2018, 41(3):35-39.
[6] WU S B, DASTMALCHI K, LONG C L, et al.Metabolite profiling of jaboticaba (Myrciaria cauliflora) and other dark-colored fruit juices[J].Journal of Agricultural and Food Chemistry,2012, 60(30):7513-7525.
[7] ALEM H, RIGOU P, SCHNEIDER R, et al.Impact of agronomic practices on grape aroma composition:A review[J].Journal of the Science of Food and Agriculture, 2019, 99(3):975-985.
[8] LIN J, MASSONNET M, CANTU D.The genetic basis of grape and wine aroma[J].Horticulture Research, 2019, 6:81.
[9] 程焕, 陈健乐, 周晓舟, 等.水果香气物质分析及合成途径研究进展[J].中国食品学报, 2016, 16(1):211-218.
CHENG H, CHEN J L, ZHOU X Z, et al.Advances in identification and biosynthetic pathwayof key aroma in fruits[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(1):211-218.
[10] 李宝丽, 邓建玲, 蔡欣, 等.顶空固相微萃取-气质联用结合主成分分析研究纯葡萄汁的香气成分[J].中国食品学报, 2016, 16(4):258-270.
LI B L, DENG J L, CAI X, et al.Studies on aroma components in pure grape juice by HS-SPME-GC-MS coupled with PCA[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(4):258-270.
[11] HJELMELAND A K, EBELER S E.Glycosidically bound volatile aroma compounds in grapes and wine:A review[J].American Journal of Enology and Viticulture, 2015, 66(1):1-11.
[12] 韩晓, 杨航宇, 陈为凯, 等.欧亚种‘丹娜’葡萄不同砧穗组合果实香气物质的差异比较[J].食品科学, 2022, 43(24):223-231.
HAN X, YANG H Y, CHEN W K, et al.Comparison of differences in aroma components among Vitis vinifera L.cv.‘tannat’ grapes grafted onto different rootstocks[J].Food Science, 2022, 43(24):223-231.
[13] ![]() I, HUMAR I, GAJDO
I, HUMAR I, GAJDO
![]() J, et al.Free and bound volatile aroma compounds of ‘Maraštiná’ grapes as influenced by dehydration techniques[J].Applied Sciences, 2020, 10(24):8928.
J, et al.Free and bound volatile aroma compounds of ‘Maraštiná’ grapes as influenced by dehydration techniques[J].Applied Sciences, 2020, 10(24):8928.
[14] FAN G, QIAO Y, YAO X L, et al.Free and bound volatile compounds in juice and peel of Jincheng oranges[J].European Food Research and Technology, 2009, 229(4):571-578.
[15] UBEDA C, SAN-JUAN F, CONCEJERO B, et al.Glycosidically bound aroma compounds and impact odorants of four strawberry varieties[J].Journal of Agricultural and Food Chemistry, 2012, 60(24):6095-6102.
[16] WEN Y Q, HE F, ZHU B Q, et al.Free and glycosidically bound aroma compounds in cherry (Prunus avium L.)[J].Food Chemistry, 2014, 152:29-36.
[17] SUN Y J, PENG W, ZENG L, et al.Using power ultrasound to release glycosidically bound volatiles from orange juice:A new method[J].Food Chemistry, 2021, 344:128580.
[18] WANG D, CAI J, ZHU B Q, et al.Study of free and glycosidically bound volatile compounds in air-dried raisins from three seedless grape varieties using HS-SPME with GC-MS[J].Food Chemistry, 2015, 177:346-353.
[19] GHASTE M, NARDUZZI L, CARLIN S, et al.Chemical composition of volatile aroma metabolites and their glycosylated precursors that can uniquely differentiate individual grape cultivars[J].Food Chemistry, 2015, 188:309-319.
[20] LIU B, XU X Q, CAI J, et al.The free and enzyme-released volatile compounds of distinctive Vitis amurensis var.Zuoshanyi grapes in China[J].European Food Research and Technology, 2015, 240(5):985-997.
[21] NOGUEROL-PATO R, GONZ LEZ-
LEZ- LVAREZ M, GONZ
LVAREZ M, GONZ LEZ-BARREIRO C, et al.Evolution of the aromatic profile in Garnacha Tintorera grapes during raisining and comparison with that of the naturally sweet wine obtained[J].Food Chemistry, 2013, 139(1-4):1052-1061.
LEZ-BARREIRO C, et al.Evolution of the aromatic profile in Garnacha Tintorera grapes during raisining and comparison with that of the naturally sweet wine obtained[J].Food Chemistry, 2013, 139(1-4):1052-1061.
[22] INADA K O P, LEITE I B, MARTINS A B N, et al.Jaboticaba berry:A comprehensive review on its polyphenol composition, health effects, metabolism, and the development of food products[J].Food Research International(Ottawa, Ont.), 2021, 147:110518.
[23] WU S-B, LONG C L, KENNELLY E J.Phytochemistry and health benefits of jaboticaba, an emerging fruit crop from Brazil[J].Food Research International, 2013, 54(1):148-159.
[24] LAN Y B, QIAN X, YANG Z J, et al.Striking changes in volatile profiles at sub-zero temperatures during over-ripening of ‘Beibinghong’ grapes in Northeastern China[J].Food Chemistry, 2016, 212:172-182.
[25] GU X B, ZHANG X E, WANG K Q, et al.GC-MS untargeted analysis of volatile compounds in four red grape varieties (Vitis vinifera L.cv) at different maturity stages near harvest[J].Foods, (Basel, Switzerland), 2022, 11(18):2804.
[26] QIAN X, JIA F Y, CAI J A, et al.Characterization and evolution of volatile compounds of cabernet sauvignon wines from two different clones during oak barrel aging[J].Foods, (Basel, Switzerland), 2021, 11(1):74.
[27] ZELLNER B D, BICCHI C, DUGO P, et al.Linear retention indices in gas chromatographic analysis:A review[J].Flavour and Fragrance Journal, 2008, 23(5):297-314.
[28] CHEN K, WEN J F, MA L Y, et al.Dynamic changes in norisoprenoids and phenylalanine-derived volatiles in off-vine Vidal blanc grape during late harvest[J].Food Chemistry, 2019, 289:645-656.
[29] MU W S, LI C C, DONG T, et al.Chinese consumers′ behavior and preference to table grapes:Based on a comparative study of 2009 and 2014[J].British Food Journal, 2016, 118(1):231-246.
[30] GIGOT C, ONGENA M, FAUCONNIER M, et al.The lipoxygenase metabolic pathway in plants:Potential for industrial production of natural green leaf volatiles[J].Biotechnologie, Agronomie, Société et Environnement, 2010, 14(3):451-460.
[31] AMEYE M, ALLMANN S, VERWAEREN J, et al.Green leaf volatile production by plants:A meta-analysis[J].The New Phytologist, 2018, 220(3):666-683.
[32] KALUA C M, BOSS P K.Comparison of major volatile compounds from Riesling and Cabernet Sauvignon grapes (Vitis vinifera L.) from fruitset to harvest[J].Australian Journal of Grape and Wine Research, 2010, 16(2):337-348.
[33] MOZZON M, SAVINI S, BOSELLI E, et al.The herbaceous character of wines[J].Italian Journal of Food Science, 2016, 28(2):190-207.
[34] LEI Y J, XIE S, GUAN X Q, et al.Methoxypyrazines biosynthesis and metabolism in grape:A review[J].Food Chemistry, 2018, 245:1141-1147.
[35] 谷晓博,张雪,王克清,等.葡萄酒中生青气味的研究进展[J].食品与发酵工业, 2021, 47(12):277-284.
GU X B, ZHANG X, WANG K Q, et al.Recent advances on green flavor in wine[J].Food and Fermentation Industries, 2021, 47(12):277-284.
[36] LI F H, ZHANG J, LIN M B, et al.Anti-inflammatory terpenes from Schefflera rubriflora C.J.Tseng &G.Hoo with their TNF-α and IL-6 inhibitory activities[J].Phytochemistry, 2019, 163:23-32.
[37] APEL M A, SOBRAL M, ZUANAZZI J Å, et al.Essential oil composition of four Plinia species (Myrtaceae)[J].Flavour and Fragrance Journal, 2006, 21(3):565-567.
[38] LAGO J H G, SOUZA E D, MARIANE B, et al.Chemical and biological evaluation of essential oils from two species of myrtaceae-Eugenia uniflora L.and Plinia trunciflora (O.Berg) kausel[J].Molecules(Basel, Switzerland), 2011, 16(12):9827-9837.
[39] FREITAS T P, TAVER I B, SPRICIGO P C, et al.Volatile compounds and physicochemical quality of four jabuticabas (Plinia sp.)[J].Molecules(Basel, Switzerland), 2020, 25(19):4543.