硒在碘甲状腺原氨酸脱碘酶、谷胱甘肽过氧化物酶、硫氧还原蛋白酶等多种酶中发挥重要的生理作用,包括代谢重金属、抗癌、抗氧化、增强免疫力等,是人体健康的关键元素和营养素[1-3]。人体对硒的需求量范围不宽,摄入过多会硒中毒,摄入不足可引起肿瘤、心血管疾病、大骨节病、胰腺纤维化、关节炎、白内障等疾病[4-5]。硒的生物利用度和毒性不仅与硒的总量有关,还取决于硒的化学形态以及浓度[6-7],人体所需要的硒元素主要以有机硒存在,无机硒不易被人体吸收[8]。硒在我国分布不均衡,缺硒地区的人群面临硒摄入不足的风险,此外,硒主要以无机硒的形态存在于土壤以及水中。面对以上难题,近年来富硒食品应运而生,其中富硒蔬菜产业快速发展,市场上出现了大量的富硒蔬菜,但富硒蔬菜质量参差不齐,存在以无机硒冒充有机硒的乱象,对富硒蔬菜中硒含量及形态鉴定迫在眉睫。
硒形态分析通常采用色谱法分离,原子光谱法检测,而高效液相色谱-电感耦合等离子体质谱法[9-10](high performance liquid chromatography-inductively coupled plasma-mass spectrometry,HPLC-ICP-MS)具有检出限低、分离能力好、分析精度高,线性范围宽等特性现已成为测定硒形态的主要方法。目前,硒形态测定研究主要集中于谷物[11]、土壤[12]、水[13]、大米[14]等,多采用恒温水浴酶提取,提取时间较长,且多采用原子荧光光谱法检测,检出限较高。超声波辅助酶提取法能够更好地破坏植物的细胞壁,有效分散被提取物,促进被提取物与蛋白质、纤维素等大分子分离,现在利用超声波辅助酶提取法结合HPLC-ICP-MS检测富硒蔬菜的研究报道仍较少。
本文以柠檬酸溶液为淋洗液,探讨了前处理提取方式、提取时间、蛋白酶种类、蛋白酶加入量、提取液pH值以及淋洗液的浓度、pH值、甲醇添加剂等对检测结果的影响,确定最佳条件,使甲基硒代半胱氨酸(methyl selenocysteine,MeSeCys)、亚硒酸盐![]() 硒代蛋氨酸(selenomethionine,SeMet)、硒酸盐
硒代蛋氨酸(selenomethionine,SeMet)、硒酸盐![]() 硒代胱氨酸(selenocystine,SeCys2)5种硒形态在7 min内有效分离,本研究可以为规范富硒蔬菜生产和安全性评价提供科技支撑。
硒代胱氨酸(selenocystine,SeCys2)5种硒形态在7 min内有效分离,本研究可以为规范富硒蔬菜生产和安全性评价提供科技支撑。
样品为采用外源硒处理蔬菜;MeSeCys (GBW 10088)![]() (GBW 10033)、SeCys2(GBW 10087)
(GBW 10033)、SeCys2(GBW 10087)![]() (GBW 10032)、SeMet (GBW 10034)标准物质溶液、蛋白酶XIV(≥3.5 units/mg)、木瓜蛋白酶(300 U/mg)、一水合柠檬酸(色谱纯)、氨水(优级纯)、甲醇(色谱纯)、0.25 μm滤膜,天津津腾科技公司。
(GBW 10032)、SeMet (GBW 10034)标准物质溶液、蛋白酶XIV(≥3.5 units/mg)、木瓜蛋白酶(300 U/mg)、一水合柠檬酸(色谱纯)、氨水(优级纯)、甲醇(色谱纯)、0.25 μm滤膜,天津津腾科技公司。
Ultimate3000-iCAPRQ型超高效液相色谱-电感耦合等离子体质谱联用仪,美国Thermo Fisher公司;BINDER FD 115电热鼓风干燥箱,美国BINDER公司;KQ-500E超声波清洗器,昆山市超声仪器公司;SHA-BA型水浴恒温振荡器,江苏科析仪器有限公司;GL-88B型旋涡混合器,江苏海门市英林贝尔仪器制造有限公司;SWT 2240电子天平(感量为0.1 mg),北京莱伯泰科仪器股份有限公司。
1.3.1 试样处理
将样品用蒸馏水清洗,冷冻干燥后使用粉碎机将样品粉碎,过100目筛,收集备用。
1.3.2 样品的提取
称取约0.2 g外源硒处理蔬菜样品于10 mL塑料离心管中,加入4 mg蛋白酶XIV,加入5 mL水(氨水调节pH值为7.5),在37 ℃超声波提取80 min,高速离心10 min,取下层清液,过0.25 μm水相滤膜,上机测定。
1.3.3 标准溶液的配制
分别取一定量的![]() 标准溶液于5个2 mL的容量瓶中,配制成质量浓度为25 μg/mL的标准储备溶液;于一只10 mL的容量瓶中加入5种硒形态标准储备溶液400 μL,配成质量浓度为1.00 μg/mL的硒形态混合标准溶液;分别吸取5种硒形态混合标准溶液于10 mL容量瓶,配成质量浓度为0.0、0.2、1.0、5.0、10.0、25.0、50.0、100.0 ng/mL的系列混合标准工作溶液,摇匀备用。
标准溶液于5个2 mL的容量瓶中,配制成质量浓度为25 μg/mL的标准储备溶液;于一只10 mL的容量瓶中加入5种硒形态标准储备溶液400 μL,配成质量浓度为1.00 μg/mL的硒形态混合标准溶液;分别吸取5种硒形态混合标准溶液于10 mL容量瓶,配成质量浓度为0.0、0.2、1.0、5.0、10.0、25.0、50.0、100.0 ng/mL的系列混合标准工作溶液,摇匀备用。
1.4.1 色谱条件
Hamilton PRP-X100色谱柱(250 mm×4.1 mm,10 μm);淋洗液:25 mmol/L柠檬酸溶液(pH 6.5);洗脱方式:等度洗脱;流速:1 mL/min;柱温:25 ℃;进样量:50 μL;洗脱时间:10 min。
1.4.2 ICP-MS 工作条件
射频功率1 548 W;雾化室温度2 ℃;载气流量0.5 L/min;辅助气流量0.1 L/min;载气:高纯氩气;采样深度:8.0 mm。
在富硒蔬菜生产中,硒元素的生物转化代谢受培育方式、蔬菜种类等影响,所以不同富硒蔬菜中硒形态不同。ARI等[15]研究发现采用硒酸盐对韭菜生物强化后主要以![]() 种硒形态为主。而本研究称取0.2 g富硒菠菜进行条件优化,但此样品中只能检出
种硒形态为主。而本研究称取0.2 g富硒菠菜进行条件优化,但此样品中只能检出![]() 种硒形态化合物,所以就以这3种硒形态化合物的含量为指标来进行优化。
种硒形态化合物,所以就以这3种硒形态化合物的含量为指标来进行优化。
2.1.1 提取方式的影响
朱羽庄等[16]在测定海产品中硒形态时在50 ℃、180 r/min的条件下酶解12 h,王欣等[17]在测定富硒食品也是在恒温摇床上酶解提取7 h,提取时间较长,而MOREDA-PI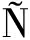 EIRO等[18]发现采用超声波酶解提取方法可以缩短提取时间。硒形态提取的关键在于酶,但酶提取时间较长,超声波产生的空化作用可以增强酶与细胞基质之间的碰撞,从而改善酶与底物的相互作用,可以缩短提取时间。本文对2种提取方式进行了实验对比,结果如图1所示,从结果看出2种提取方式对富硒蔬菜的提取结果相差不大,但恒温振荡酶解提取耗时较长,超声波辅助酶提取缩短了提取时间,所以对于蔬菜样品采用超声波辅助酶提取效果最佳。
EIRO等[18]发现采用超声波酶解提取方法可以缩短提取时间。硒形态提取的关键在于酶,但酶提取时间较长,超声波产生的空化作用可以增强酶与细胞基质之间的碰撞,从而改善酶与底物的相互作用,可以缩短提取时间。本文对2种提取方式进行了实验对比,结果如图1所示,从结果看出2种提取方式对富硒蔬菜的提取结果相差不大,但恒温振荡酶解提取耗时较长,超声波辅助酶提取缩短了提取时间,所以对于蔬菜样品采用超声波辅助酶提取效果最佳。
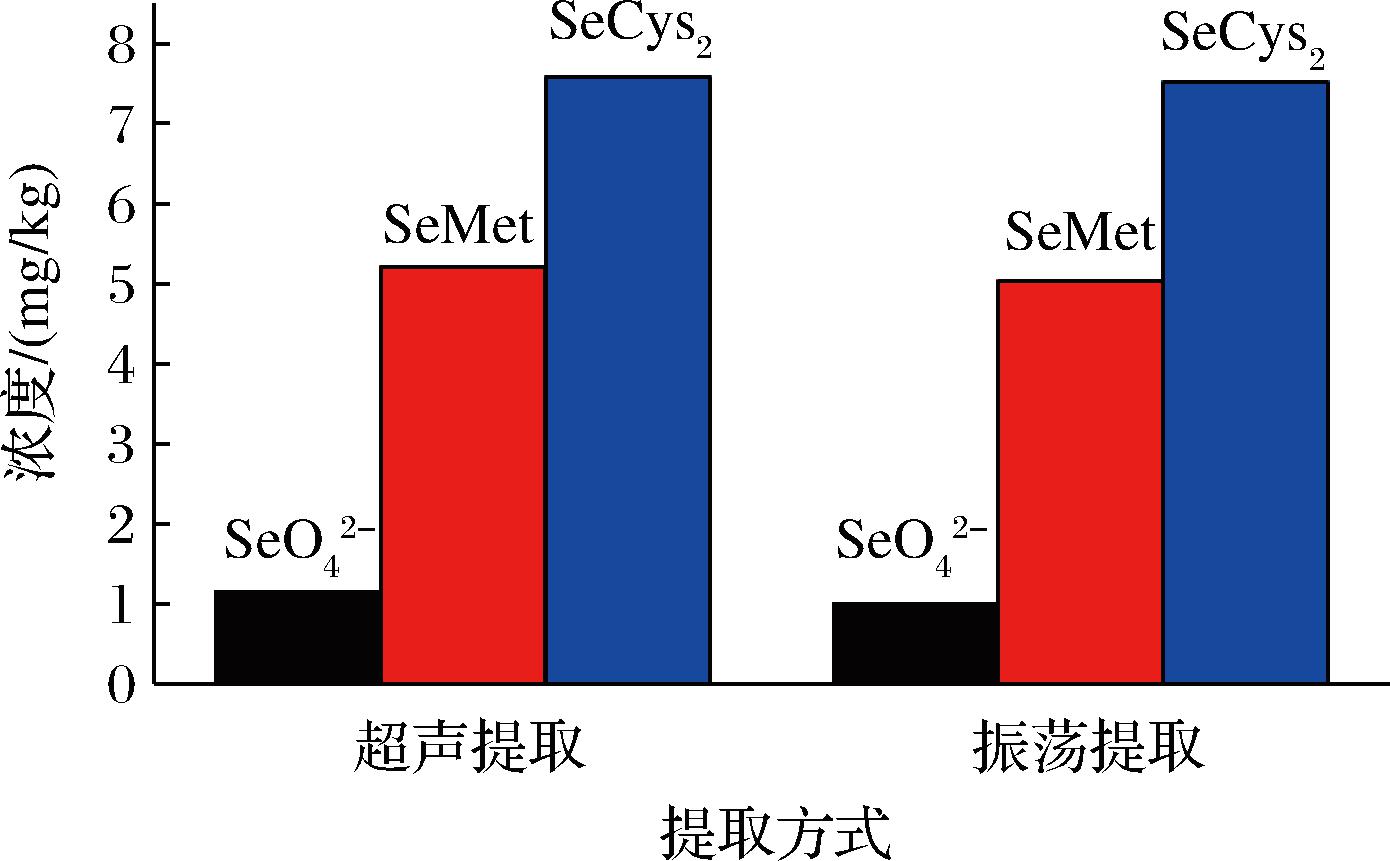
图1 不同提取方式对比图
Fig.1 The contrast of different extract methods
2.1.2 提取酶种类的影响
硒在生物体中主要以有机硒存在,与蛋白质、多肽等大分子结合在一起,张泽洲等[19]报道采用酶解的方法提取效率更高。酶作为一种催化剂,具有活性位点,但不同的酶活性位点不同,基质不同的样品,结合点也不同,所以提取能力存在差异。本文分别考察了蛋白酶XIV、木瓜蛋白酶对提取结果的影响,从图2中可以看出不同蛋白酶对SeMet的提取影响较大,当使用蛋白酶XIV时大大增加了SeMet的提取效率,所以选择蛋白酶XIV作为提取酶。朱羽庄等[16]发现使用木瓜蛋白酶和蛋白酶XIV在提取海产品中硒形态效率相差不大,此处提取差异较大的原因可能是所用木瓜蛋白酶的酶活力较低。由于蛋白酶XIV的最适温度在37 ℃,所以样品提取温度为37 ℃。
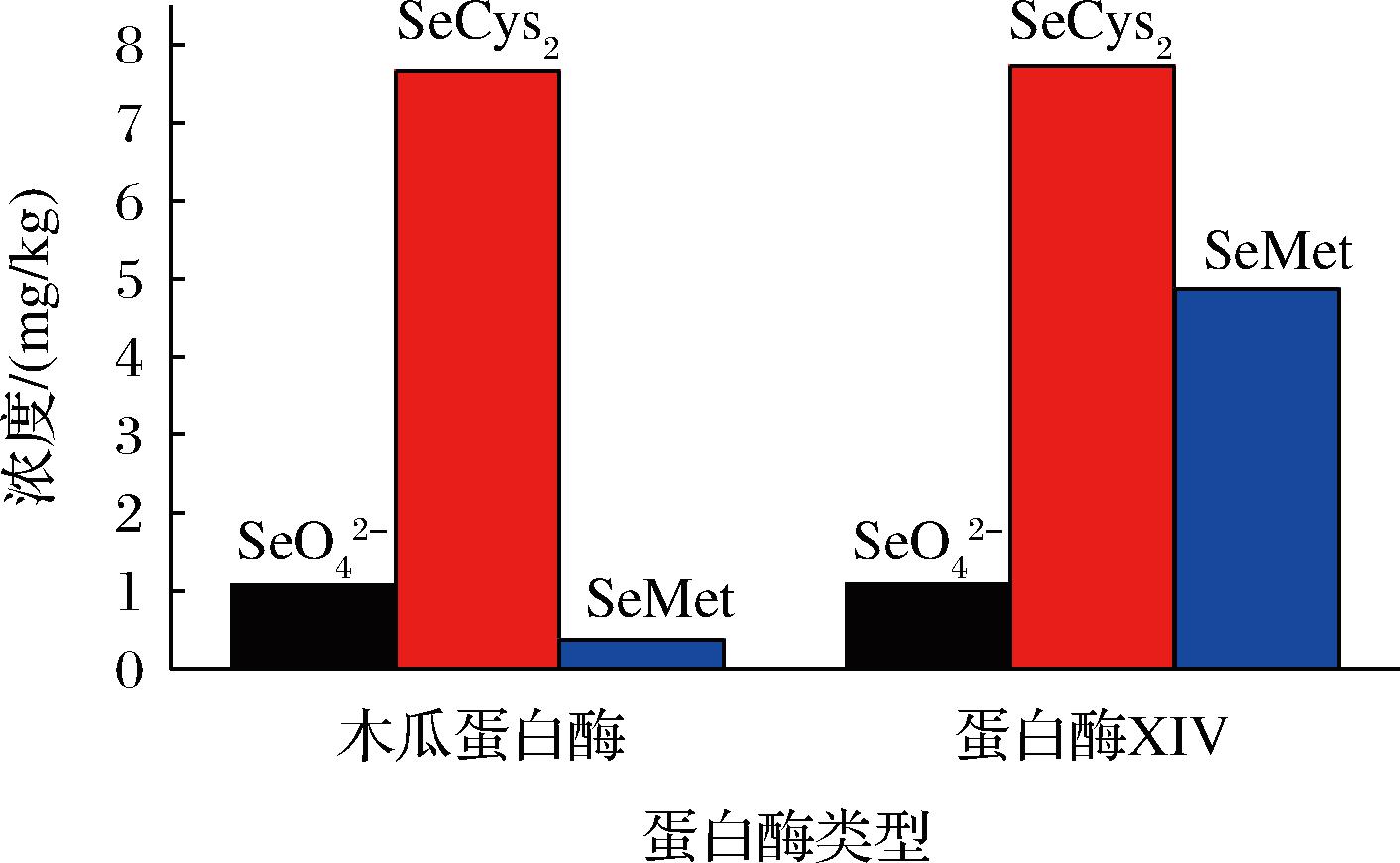
图2 不同提取酶对比图
Fig.2 The contrast of different extraction protease
2.1.3 蛋白酶XIV用量的影响
试验考察了不同蛋白酶XIV用量(1、2、3、4、5、6、7 mg)对提取结果的影响,从图3中可以看出随着蛋白酶XIV的用量从1 mg开始逐渐增加,![]() 的提取量逐渐增加,但
的提取量逐渐增加,但![]() 的增加幅度较小,可能因为
的增加幅度较小,可能因为![]() 在富硒蔬菜中被蛋白质、纤维素等大分子包裹结合的较少,所以蛋白酶XIV的用量对其影响较小。当蛋白酶XIV增至4 mg时,含量变化不大,所以最佳用量为4 mg。
在富硒蔬菜中被蛋白质、纤维素等大分子包裹结合的较少,所以蛋白酶XIV的用量对其影响较小。当蛋白酶XIV增至4 mg时,含量变化不大,所以最佳用量为4 mg。
图3 蛋白酶XIV用量对提取结果的影响
Fig.3 Effect of the amount of protease XIV on extraction results
2.1.4 提取时间的影响
考察不同提取时间(20、40、60、80、100、120、140 min)对提取结果的影响,从图4中可以看出20~80 min随提取时间延长,提取含量增加,80 min后含量变化不大,同时,![]() 的含量随时间变化幅度较小,可能
的含量随时间变化幅度较小,可能![]() 被基质中的大分子包裹结合的较少,容易解离出来,所以最佳超声波提取时间为80 min。
被基质中的大分子包裹结合的较少,容易解离出来,所以最佳超声波提取时间为80 min。
2.1.5 提取液pH的影响
提取液的pH值对提取效率也会有影响,因为pH影响蛋白酶的活性,而蛋白酶的活性影响着与底物的相互作用,从而对提取结果产生影响。试验考察了提取液pH对提取结果的影响,分别用氨水调节pH值为6.0、6.5、7.0、7.5、8.0、8.5、9.0的提取液,其结果如图5所示,随着pH从6.0升至7.5,提取含量逐渐升高,而pH从7.5到9.0,提取含量又逐渐降低,所以最佳pH值为7.5,而7.5刚好与蛋白酶XIV的最佳pH值接近。

图4 提取时间对提取结果的影响
Fig.4 Effect of the extraction time on extraction results
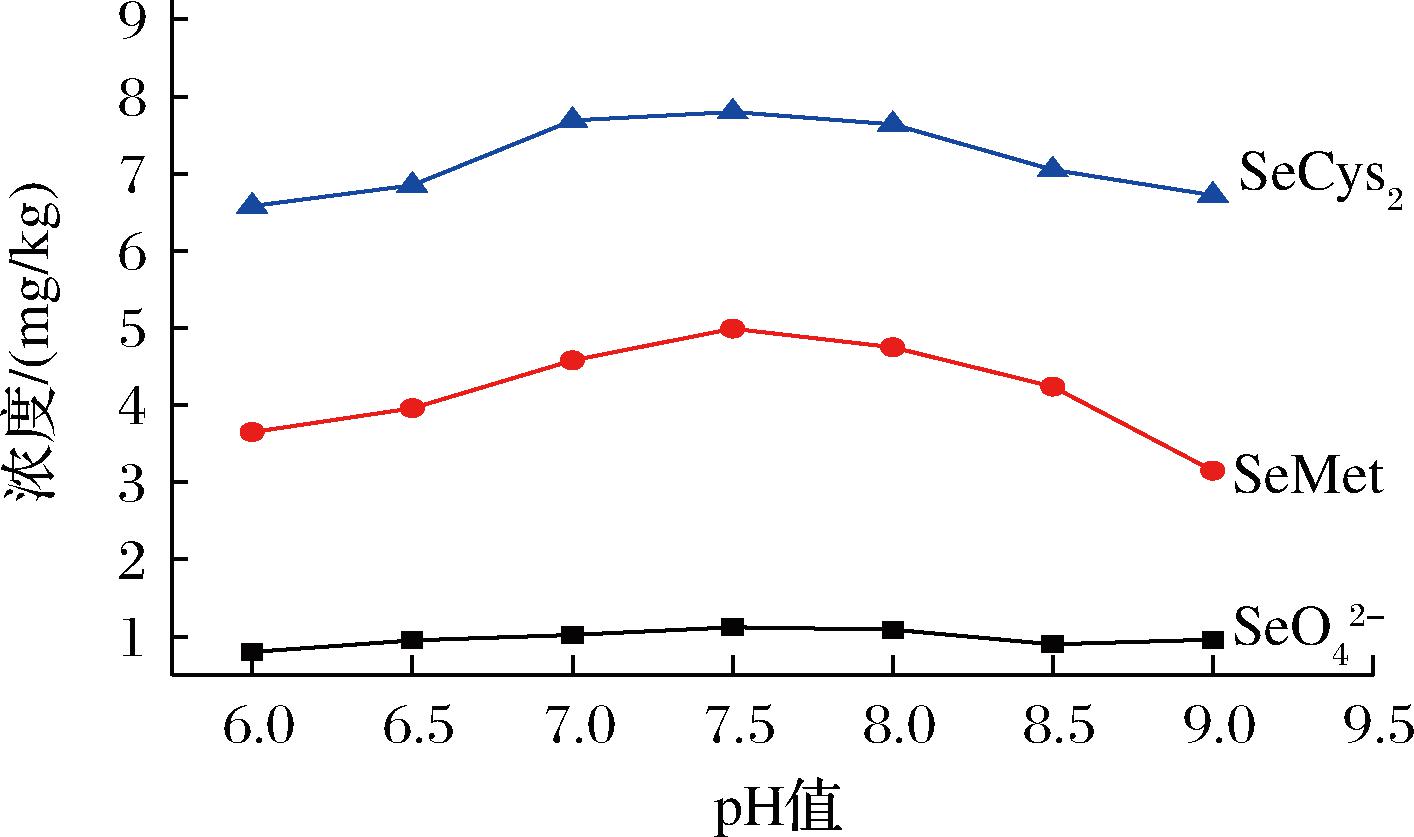
图5 提取液pH对提取结果的影响
Fig.5 Effect of pH of extraction solution on extraction results
2.2.1 淋洗液浓度的影响
Hamilton PRP-X100色谱柱是一种具有强碱性季铵基团的阴离子交换柱,一般使用磷酸盐或柠檬酸等作为淋洗液,本文使用柠檬酸为淋洗液。淋洗液的浓度对于色谱分离有着重要的作用,浓度的改变也会引起色谱分离的改变。本文探究了20、25、30 mmol/L 3个淋洗液浓度对5种硒形态分离的影响。从图6可以看出,随着淋洗液浓度从20 mmol/L升至30 mmol/L,![]() 的出峰时间前移,MeSeCys出峰时间后移,对其他形态的出峰时间影响较小。
的出峰时间前移,MeSeCys出峰时间后移,对其他形态的出峰时间影响较小。![]() 出峰时间减小可能是因为随着淋洗液浓度增加,淋洗液离子强度增强,从而导致
出峰时间减小可能是因为随着淋洗液浓度增加,淋洗液离子强度增强,从而导致![]() 与色谱柱中的季铵基团作用力减弱,MeSeCys出峰时间延长是因为离子强度的增加使其与色谱柱中的季铵集团作用力增强。当浓度为30 mmol/L时,
与色谱柱中的季铵基团作用力减弱,MeSeCys出峰时间延长是因为离子强度的增加使其与色谱柱中的季铵集团作用力增强。当浓度为30 mmol/L时,![]() 与MeSeCys的分离度降低,已不能基线分离;当浓度为20 mmol/L时,
与MeSeCys的分离度降低,已不能基线分离;当浓度为20 mmol/L时,![]() 与MeSeCys的分离度没有25 mmol/L时的分离度好,所以综合考虑选用25 mmol/L为淋洗液的浓度。
与MeSeCys的分离度没有25 mmol/L时的分离度好,所以综合考虑选用25 mmol/L为淋洗液的浓度。

![]()
图6 不同淋洗液浓度下标准样品色谱图
Fig.6 Chromatograms of standard samples in different concentration of eluent
2.2.2 淋洗液pH的影响
淋洗液pH对色谱分离至关重要,在25 mmol/L的柠檬酸淋洗液浓度下,探讨了pH分别为4.5、5.5、6.0、6.5时对分离的影响,从图7中可以看出pH值主要影响![]() 的出峰时间,对SeCys2出峰时间影响较小,可能因为在此pH范围内SeCys2的电离强度不大。随着pH值从4.5升至6.5,MeSeCys出峰时间延后,
的出峰时间,对SeCys2出峰时间影响较小,可能因为在此pH范围内SeCys2的电离强度不大。随着pH值从4.5升至6.5,MeSeCys出峰时间延后,![]() 出峰时间提前,这主要是因为pH影响柠檬酸的质子化反应,从而影响硒不同形态与流动相之间的相互作用,最后保留时间改变。当pH值为6.5时,SeMet的出峰时间明显后移因为此pH条件下SeMet携带更多负电荷,增加了与色谱柱的作用,所以保留时间滞后。pH 4.5时不能完全有效分离5种硒形态,当pH为6.5时,
出峰时间提前,这主要是因为pH影响柠檬酸的质子化反应,从而影响硒不同形态与流动相之间的相互作用,最后保留时间改变。当pH值为6.5时,SeMet的出峰时间明显后移因为此pH条件下SeMet携带更多负电荷,增加了与色谱柱的作用,所以保留时间滞后。pH 4.5时不能完全有效分离5种硒形态,当pH为6.5时,![]() 及MeSeCys不能基线分离,pH 5.5与pH 6.0相比,在pH 6.0条件下
及MeSeCys不能基线分离,pH 5.5与pH 6.0相比,在pH 6.0条件下![]() 与MeSeCys分离度更好,所以最佳pH值为6.0。
与MeSeCys分离度更好,所以最佳pH值为6.0。
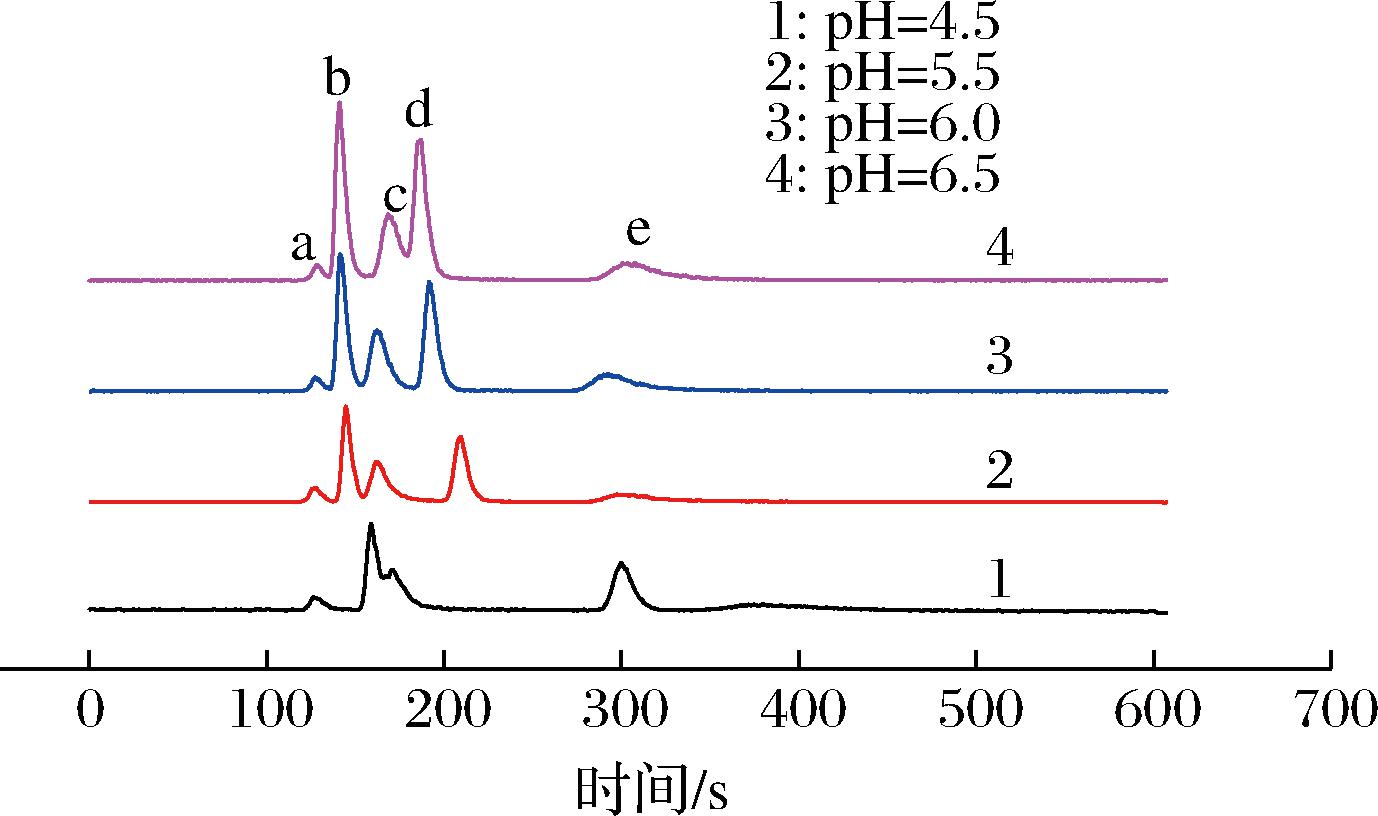
![]()
图7 不同pH淋洗液下标准样品色谱图
Fig.7 Chromatograms of standard samples in different pH of eluent
2.2.3 淋洗液中甲醇添加剂的影响
LUO等[20]发现在流动相中添加少量甲醇可以提高流动相洗脱能力,因为甲醇可以改变硒代氨基酸与阴离子色谱柱之间的相互作用力,本文探究了0.1%、0.5%、1%甲醇添加剂对分离的影响,其结果如图8所示。随着甲醇含量的增加,MeSeCys、SeMet出峰时间提前,这个结果与LUO等[20]的研究一致,是因为甲醇的加入使硒代氨基酸的烷基链与色谱柱作用力减弱。当甲醇浓度为0.5%或1%时,![]() 和MeSeCys已不能基线分离,而当甲醇含量太低如加入0.1%的甲醇时,对提高分离度没有太大作用。这可能是因为所使用的流动相浓度和pH值与LUO等[20]使用的不一样,因为色谱分离是多重作用的结果,同时考虑到甲醇的毒性,所以淋洗液中不添加甲醇。
和MeSeCys已不能基线分离,而当甲醇含量太低如加入0.1%的甲醇时,对提高分离度没有太大作用。这可能是因为所使用的流动相浓度和pH值与LUO等[20]使用的不一样,因为色谱分离是多重作用的结果,同时考虑到甲醇的毒性,所以淋洗液中不添加甲醇。
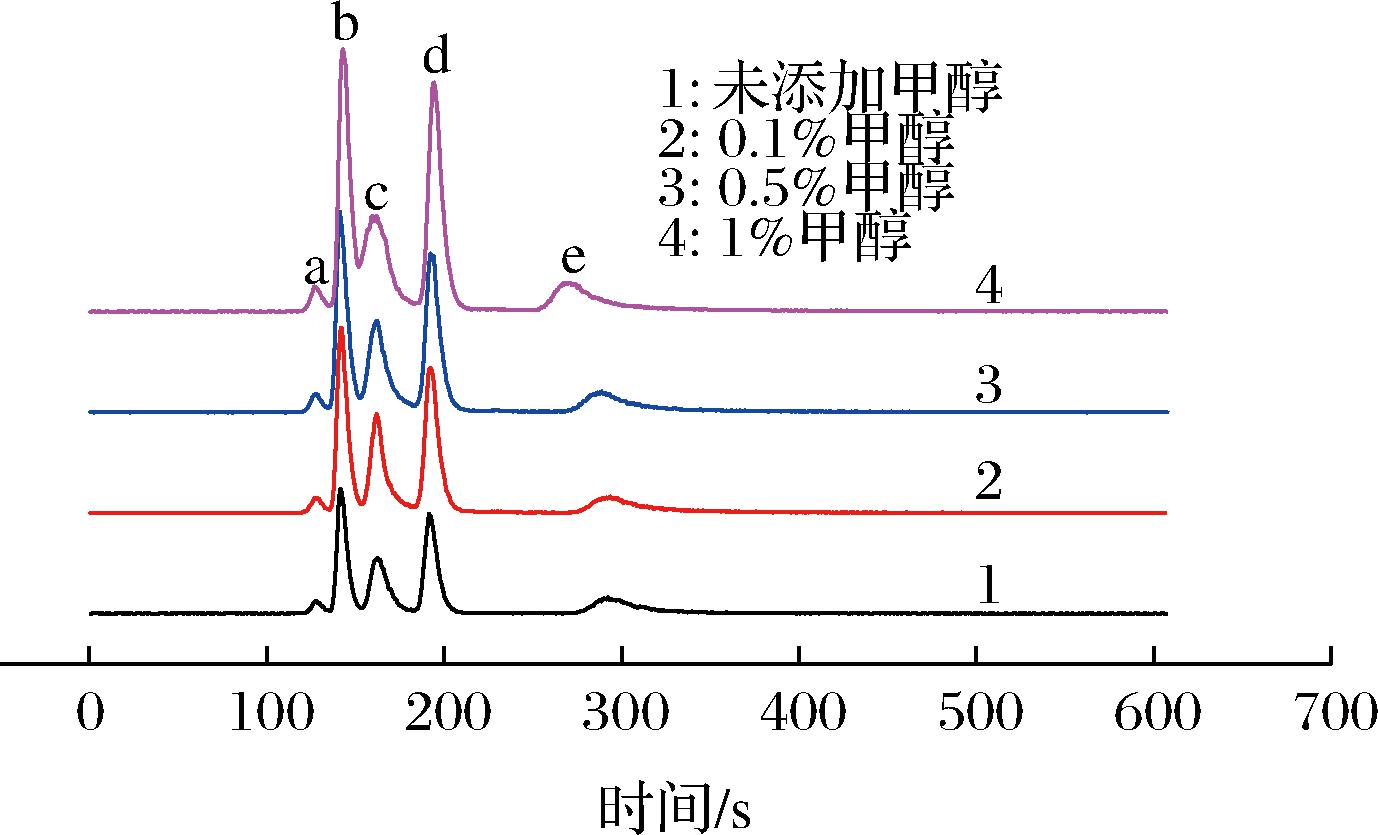
![]()
图8 淋洗液中添加甲醇的标准样品色谱图
Fig.8 Chromatograms of standard samples in different additions of methanol
分别配制质量浓度为0、5、10、25、50、100 ng/mL的![]() 等5种混合标准溶液,以标准品80Se色谱峰面积为纵坐标,对应化合物质量浓度为横坐标,绘制标准曲线,具有较好的线性关系,5种硒形态的相关系数均大于0.999 3,检出限也满足检测需求,结果见表1。
等5种混合标准溶液,以标准品80Se色谱峰面积为纵坐标,对应化合物质量浓度为横坐标,绘制标准曲线,具有较好的线性关系,5种硒形态的相关系数均大于0.999 3,检出限也满足检测需求,结果见表1。
表1 五种硒形态的线性测试结果
Table 1 Linear test results of 5 kinds of selenium species
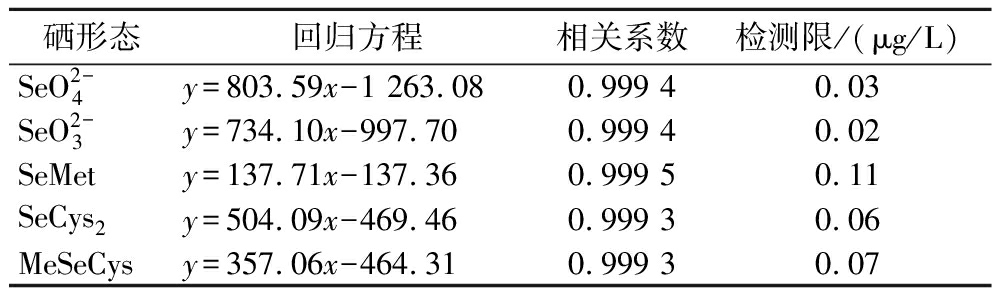
硒形态回归方程相关系数检测限/(μg/L)SeO2-4y=803.59x-1 263.080.999 40.03SeO2-3y=734.10x-997.700.999 40.02SeMety=137.71x-137.360.999 50.11SeCys2y=504.09x-469.460.999 30.06MeSeCysy=357.06x-464.310.999 30.07
称取0.2 g硒处理菠菜叶,定量加入不同水平标准品,每个梯度6个平行样品,采用优化后方法处理后测定其加标回收率。结果表明,平均回收率在96.3%~104.2%,相对标准偏差在7.6%以下,符合定量分析的要求,结果见表2。与倪张林等[21]测定富硒蔬菜的方法相比,其回收率为80.1~99.2%,相较而言,本研究回收率更高。
表2 回收率实验结果(n=6)
Table 2 Results of spiked recovery assays (n=6)

硒形态测定值/(ng/mL)加标量/(ng/mL)加标测定值/(ng/mL)回收率/%梯度1梯度2梯度1梯度2梯度1梯度2平均回收率/%相对标准偏差/%SeO2-453.455.0110.0106.3166.496.2102.799.52.7SeO2-3010.09.711.220.997.0104.5100.86.8SeMet247.2250.0500.0508.9769.8104.7103.7104.27.6SeCys2379.3400.0800.0775.31 178.899.099.999.55.8MeSeCys030.060.029.656.398.793.896.37.2
将本方法用于3个富硒蔬菜和3个普通蔬菜的测定,结果见表3,富硒蔬菜均有不同形态检出,普通蔬菜均未检出硒形态,这可能是因为土壤中硒元素缺乏。3种富硒蔬菜中检出![]() 种形态,无机硒主要以硒酸盐为主,有机硒含量较高的为硒代蛋氨酸和硒代半胱氨酸。同时,不同种类蔬菜硒形态的种类和含量均不同,与文献报道的一致,如倪张林等[21]从4种富硒蔬菜中检出MeSeCys、SeMet、SeCys2 3种形态,而ARI等[15]从韭菜中检出
种形态,无机硒主要以硒酸盐为主,有机硒含量较高的为硒代蛋氨酸和硒代半胱氨酸。同时,不同种类蔬菜硒形态的种类和含量均不同,与文献报道的一致,如倪张林等[21]从4种富硒蔬菜中检出MeSeCys、SeMet、SeCys2 3种形态,而ARI等[15]从韭菜中检出![]() 种形态。不同种类的富硒蔬菜硒形态种类和含量存在差异可能因为不同种类的蔬菜其生物转化代谢能力不同,同时硒形态还受培育方式,培育环境等的影响。
种形态。不同种类的富硒蔬菜硒形态种类和含量存在差异可能因为不同种类的蔬菜其生物转化代谢能力不同,同时硒形态还受培育方式,培育环境等的影响。
表3 富硒蔬菜和普通蔬菜硒形态测定结果 单位:mg/kg
Table 3 Determination results of selenium species in se-enriched vegetables and common vegetables

样品SeO2-4SeO2-3SeMetSeCys2MeSeCys富硒菠菜1.17未检出2.101.88未检出富硒胡萝卜0.58未检出0.301.57未检出富硒白菜0.90未检出2.021.390.20普通白菜未检出未检出未检出未检出未检出普通胡萝卜未检出未检出未检出未检出未检出普通菠菜未检出未检出未检出未检出未检出
通过对提取条件和色谱条件的优化发现当采用蛋白酶XIV超声波辅助提取、提取温度37 ℃,提取时间80 min,提取溶液pH值为7.5、柠檬酸淋洗液浓度为25 mmol/L、淋洗液pH值为6.0时可以有效分离蔬菜中的![]() 等5种硒形态,此方法缩短了前处理时间,并在7 min内可完成样品的测定。但高效液相色谱-电感耦合等离子体质谱法不能提供化合物分子结构,所以对于没有标准物质的硒形态检测,需要其他仪器进行结构鉴定,同时,硒形态与其他元素之间的相互关系也有待深入研究。
等5种硒形态,此方法缩短了前处理时间,并在7 min内可完成样品的测定。但高效液相色谱-电感耦合等离子体质谱法不能提供化合物分子结构,所以对于没有标准物质的硒形态检测,需要其他仪器进行结构鉴定,同时,硒形态与其他元素之间的相互关系也有待深入研究。
[1] SHAHID M, NIAZI N K, KHALID S, et al.A critical review of selenium biogeochemical behavior in soil-plant system with an inference to human health[J].Environmental Pollution, 2018, 234:915-934.
[2] RAYMAN M P.Selenium intake, status, and health:A complex relationship[J].Hormones, 2020, 19(1):9-14.
[3] KIELISZEK M.Selenium-fascinating microelement, properties and sources in food[J].Molecules, 2019, 24(7):1298.
[4] 计峰, 苏琪, 赵学志, 等.不同剂量补硒对大鼠氧化应激损伤的保护作用[J].营养学报, 2019, 41(1):63-67.
JI F, SU Q, ZHAO X Z, et al.Protective effect on oxidative stress injury by selenium supplementation in rats[J].Acta Nutrimenta Sinica, 2019, 41(1):63-67.
[5] LIU H L, WANG X Q, ZHANG B M, et al.Concentration and distribution of selenium in soils of mainland China, and implications for human health[J].Journal of Geochemical Exploration, 2021, 220:106654.
[6] 吕其壮, 颜秋, 陈艳, 等.微量元素硒在动物体内的抗病毒作用研究进展[J].土壤, 2018, 50(6):1113-1118.
LV Q Z, YAN Q, CHEN Y, et al.Research progress of antiviral effects of microelement selenium in animal body[J].Soils, 2018, 50(6):1113-1118.
[7] 杨旭, 董文宾.富硒食品的研究进展[J].食品安全质量检测学报, 2017, 8(6):2091-2097.
YANG X, DONG W B.Research progress of Se-enriched food[J].Journal of Food Safety &Quality, 2017, 8(6):2091-2097.
[8] 任江姿, 郑平, 吴景, 等.硒代氨基酸提取与检测技术研究进展[J].湖南农业科学, 2018(8):123-127.
REN J Z, ZHENG P, WU J, et al.Review on extraction and analysis methods of seleno amino acids[J].Hunan Agricultural Sciences, 2018(8):123-127.
[9] 林樾, 陈尚卫, 虞锐鹏, 等.高效液相色谱-电感耦合等离子体质谱法测定富硒碎米荠中的硒形态[J].分析科学学报, 2021, 37(5):637-642.
LIN Y, CHEN S W, YU R P, et al.Determination of selenium speciations in selenium-enriched Cardamine violifolia by high performance liquid chromatography-inductively coupled plasma mass spectrometry[J].Journal of Analytical Science, 2021, 37(5):637-642.
[10] 陈露, 嵇晶, 金佳颖, 等.高效液相色谱-电感耦合等离子体质谱法测定海藻中5种砷形态[J].食品与发酵工业, 2020, 46(15):270-275.
CHEN L, JI J, JIN J Y, et al.Determination of five arsenic species in seaweed by HPLC-ICP-MS[J].Food and Fermentation Industries, 2020, 46(15):270-275.
[11] 龚洋, 雷正达, 李莉, 等.液相色谱-氢化物发生原子荧光光谱法测定富硒稻谷中硒的形态[J].食品与发酵科技, 2020, 56(2):105-108.
GONG Y, LEI Z D, LI L, et al.HPLC-HG-AFS determination of selenium morphology in Se-rich paddy[J].Food and Fermentation Sciences &Technology, 2020, 56(2):105-108.
[12] 李爱民, 范俊楠, 贺小敏, 等.高效液相色谱-原子荧光光谱法测定土壤中4种有效硒形态[J].分析科学学报, 2021, 37(3):403-407.
LI A M, FAN J N, HE X M, et al.Determination of four available selenium species in soils by high performance liquid chromatography-atomic fluorescence spectrometry[J].Journal of Analytical Science, 2021, 37(3):403-407.
[13] 陈绍占, 张妮娜, 刘丽萍.液相色谱-电感耦合等离子体质谱联用技术分析水中5种硒形态[J].中国卫生检验杂志, 2021, 31(9):1048-1051.
CHEN S Z, ZHANG N N, LIU L P.Analysis of 5 selenium forms in water by liquid chromatography-inductively coupled plasma mass spectrometry[J].Chinese Journal of Health Laboratory Technology, 2021, 31(9):1048-1051.
[14] 孙瑞, 张琪, 曾卓华, 等.不同加工方式对富硒大米硒损失、形态及体外生物利用度影响[J].食品与发酵工业, 2022, 48(11):172-178.
SUN R, ZHANG Q, ZENG Z H, et al.Effects of different processing methods on selenium loss, form and bioavailability in vitro of selenium-enriched rice[J].Food and Fermentation Industries, 2022, 48(11):172-178.
[15] ARI B, ÖZ E, CAN S Z, et al.Bioaccessibility and bioavailability of selenium species in Se-enriched leeks (Allium Porrum) cultivated by hydroponically[J].Food Chemistry, 2022, 372:131314.
[16] 朱羽庄, 梅光明, 杨盈悦, 等.高效液相色谱-电感耦合等离子体质谱法测定海产品中5种硒形态的含量[J].理化检验-化学分册, 2022, 58(3):291-298.
ZHU Y Z, MEI G M, YANG Y Y, et al.Determination of 5 selenium species in seafood products by high performance liquid chromatography-inductively coupled plasma mass spectrometry[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2022, 58(3):291-298.
[17] 王欣, 幸苑娜, 陈泽勇, 等.高效液相色谱-电感耦合等离子体质谱法检测富硒食品中6种硒形态[J].分析化学, 2013, 41(11):1669-1674.
WANG X, XING Y N, CHEN Z Y, et al.Determination of 6 selenium species in selenium- enriched food by hyphenated technique of high performance liquid chromatography-inductively coupled plasma mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2013, 41(11):1669-1674.
[18] MOREDA-PI EIRO J, S
EIRO J, S NCHEZ-PI
NCHEZ-PI ERO J, MA
ERO J, MA ANA-L
ANA-L PEZ A, et al.Selenium species determination in foods harvested in Seleniferous soils by HPLC-ICP-MS after enzymatic hydrolysis assisted by pressurization and microwave energy[J].Food Research International, 2018, 111, 621-630.
PEZ A, et al.Selenium species determination in foods harvested in Seleniferous soils by HPLC-ICP-MS after enzymatic hydrolysis assisted by pressurization and microwave energy[J].Food Research International, 2018, 111, 621-630.
[19] 张泽洲. 典型农作物中硒形态分析及其硒-镉相互作用研究[D].武汉:中国地质大学, 2019.
ZHANG Z Z.Selenium speciation and selenium-cadmium interaction in staple crops[D].Wuhan:China University of Geosciences, 2019.
[20] LUO Y E, CHEN G, DENG X Q, et al.Speciation of selenium in selenium-enriched foods by high- performance liquid chromatography-inductively coupled plasma-tandem mass spectrometry[J].Separations, 2022, 9(9):242.
[21] 倪张林, 汤富彬, 张玮, 等.HPLC-DRC-ICP-MS测定富硒蔬菜中的硒形态[J].分析试验室, 2013, 32(2):39-43.
NI Z L, TANG F B, ZHANG W, et al.Determination of selenium species in se-enriched vegetables by HPLC-DRC-ICP-MS[J].Chinese Journal of Analysis Laboratory, 2013, 32(2):39-43.