刺梨(Rosa roxburghii Tratt)系蔷薇科蔷薇属药食同源植物[1],主要分布在我国西南地区[2]。因其独特的风味而备受关注,并且富含多糖、维生素、黄酮、多酚等具有药理功效的成分[3],使得刺梨果实在医药领域拥有较高的保健和药用价值[4]。在药理方面的研究显示,刺梨具有抗氧化、抗衰老、降血糖[5]、治疗胃溃疡、促进消化、抗动脉粥样硬化等多种药理作用[6]。
国内对刺梨的研究已经十分火热,但也局限于传统方法的研究,如营养特性及产品开发,抗氧化、降血糖、降血脂等。针对刺梨活性成分的研究大多是从多酚、多糖等单一化合物的角度进行,且刺梨在代谢组学方面的研究鲜有报道。同一物质用不同溶剂提取,其含量、特性都可能发生改变,非靶向代谢组学能系统、全面地分析,获取大量代谢物的数据,从而解析提取物中小分子的差异。代谢物提取是代谢组学研究中最关键的一步,选择合适的提取方法为后续利用代谢组学寻找刺梨具有功能活性的关键代谢产物提供了有效的方法,有利于对刺梨中各代谢物进行深入研究。
代谢组学(metabolomics)是在特定条件下对生物体所含代谢物整体进行定性定量,可揭示特定时间和特定条件下代谢物的种类和含量,覆盖范围广[7],对于20多万种的植物代谢物[8],代谢组学的思路对其具有较大的意义。依据检测方式与研究目的的不同,代谢组学被分为非靶向和靶向[9]。非靶向旨在检测出样品中所有的代谢物,能发现一些新的化合物。由于数据库数据不全,定性时较为困难,也只能相对定量[10]。但它的优势在于整体性的检测出样品中的化合物,以便于后续鉴定分析。靶向代谢组学能较为精确的定量出目标代谢物[11]。本文采用非靶向代谢组学对刺梨不同提取物进行分析,通过整体检测刺梨中的化合物,结合多元统计方法筛选出目标代谢物,对代谢物进行分析,查阅文献发现其具有的功能活性,为进一步研究提供数据支持。
1 材料与方法
1.1 材料与仪器
刺梨,贵州省龙里县;甲醇、乙腈(纯度≥99.9%),美国Thermo公司;2-氯苯丙氨酸(纯度98.5%),上海阿拉丁生化科技股份有限公司;甲酸(纯度≥ 98%),东京化成工业株式会社;甲酸铵(纯度≥ 99%),美国Sigma-Aldrich公司;H2O(纯度100%),美国Millipore公司。
Vanquish液相色谱仪、Q-Exactive质谱仪,美国Thermo公司;ACQUITY UPLC® HSS T3 1.8 μm (2.1 mm×150 mm)色谱柱,美国Waters公司。
1.2 实验方法
1.2.1 提取物制备
刺梨全果提取物水-乙醇(占比60%)溶液的制备:称取刺梨样品按料液比1∶10(g∶mL)与混合,45 ℃水浴2 h,45 ℃、功率200 W超声30 min,过滤,收集滤渣,重复提取2次合并滤液,蒸发浓缩至浸膏状,分别用水和60%乙醇定容得到25 mL刺梨粗提物,置于-20 ℃冰箱保存备用(6个生物学重复样本)。
刺梨果渣(由同批次刺梨果压榨干燥得到)提取物的处理同1.2.1节。
1.2.2 样本预处理
精确称量样本200 mg(±1%)于2 mL EP管中,准确加入0.6 mL 2-氯苯丙氨酸(4 mg/L)甲醇(-20 ℃)配制,涡旋振荡30 s加入100 mg玻璃珠,放入组织研磨器中,55 Hz研磨60 s室温超声15 min;12 000 r/min,4 ℃离心10 min,取上清液300 μL 过0.22 μm膜过滤,过滤液加入到检测瓶中用剩余待测样本进行超高效液相色谱-高分辨质谱技术(ultra high performance liquid chromatography high resolution mass spectrometry, UPLC-HRMS)检测。
1.2.3 色谱-质谱分析
色谱条件:采用ACQUITY UPLC® HSS T3 1.8 μm (2.1 mm×150 mm)色谱柱,自动进样器温度设为8 ℃,以0.25 mL/min的流速,40 ℃的柱温,进样2 μL进行梯度洗脱,流动相为正离子0.1%(体积分数)甲酸水(C)-0.1%甲酸乙腈(D);负离子5 mmol/L甲酸铵水(A)-乙腈(B)。梯度洗脱程序为0~1 min,2%B/D;1~9 min,2%~50% B/D;9~12 min,50%~98% B/D;12~13.5 min,98% B/D;13.5~14 min,98%~2% B/D;14~20 min,2% D-正模式(14~17 min,2% B-负模式)。
质谱条件:仪器使用电喷雾离子源(electron spray ionization,ESI),正负离子电离模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30 arb,辅助气10 arb。毛细管温度325 ℃,以分辨率70 000进行全扫描,扫描范围81~1 000,并采用HCD进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS信息[12]。
1.2.4 数据预处理
通过Proteowizard软件对原始数据进行分析及处理,利用R语言的XCMS程序包进行峰识别、峰过滤、峰对齐;得到包括质荷比、保留时间及峰面积等信息的数据矩阵。
1.2.5 物质鉴定
代谢物的鉴定首先根据精确分子质量进行确认,后续根据MS/MS碎片模式对HMDB、METLIN、Massbank、LipidMaps以及mzClound标准品数据库确认注释获得代谢物。
1.3 数据处理
利用SIMCA 14.1软件进行主成分分析(principal component analysis, PCA),可以判断不同样本生物学重复之间代谢组的数据可靠性和稳定性[13]。正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)模型表明各提取物组与其他3个提取物组之间的差异性[14]。对差异代谢物的筛选依据是SIMCA 14.1软件导出的变量重要性投影(variable importance projection value,VIP)值、P值和差异倍数(fold change,FC)。VIP值>1,P值<0.05及FC≥2和FC≤0.5为一般的差异代谢物筛选标准。在此基础上,本实验设定VIP值>1.3、P值<0.01、FC≥3和FC≤0.1筛选最终的显著差异代谢物。通过MBRole 2.0代谢通路分析功能,根据筛选出来的差异代谢物KEGG ID获得刺梨不同提取物代谢物的代谢途径[15]。
2 结果与分析
2.1 提取物数据的稳定性考察
UPLC-HRMS有较高的灵敏性和较广的分析范围,样本中含量极低的物质也能检测出,因此非靶向代谢组学常用UPLC-HRMS检测样品。在刺梨的提取实验中,常用的方法是水提、醇提。刺梨工业中,刺梨果渣产量巨大且利用率不高,但根据已有研究发现果渣中的活性成分十分丰富,研究前景可观。故设计以下4种提取方法:刺梨全果水提、刺梨全果醇提、刺梨果渣水提、刺梨果渣醇提,这4种不同提取物的正负离子模式下重叠的总离子流图(total ion chromatogram,TIC)如图1所示。
ESI+模式获得22 447个前体分子,ESI-模式获得11 835个前体分子。在二级质谱信息中,4种提取方式共得到316种代谢物。主要包括脂类、氨基酸类、糖类、酚类、维生素等,其中脂类68种、氨基酸52种、糖类48种、酚类28种、维生素14种。

A-ESI+;B-ESI-
图1 刺梨不同提取物总离子流图
Fig.1 Total ion flow diagram of different extracts of Rosa roxburghii Tratt
PCA结果(图2)显示,刺梨不同提取物的生物学重复都汇集在一起,且全部样本均位于95%置信区间内[16],表明不同提取物数据的可靠性与稳定性较好,在测定过程中未出现明显偏差[17]。每个图形表示一个样本,不同的组根据图形的颜色和形状来区别。图形之间越近,样品中代谢物越相似;反之,样本越远,其整体代谢物差异越大。通过观察全部样本的PCA得分图,可以体现样本的总体分布趋势。PCA显示出4个主成分,其中主成分1(PC1)的贡献率为45.8%,主成分2(PC2)的贡献率为23.2%,不同样品组在两个坐标轴上彼此分离,说明刺梨不同提取物的代谢物有一定的差异。
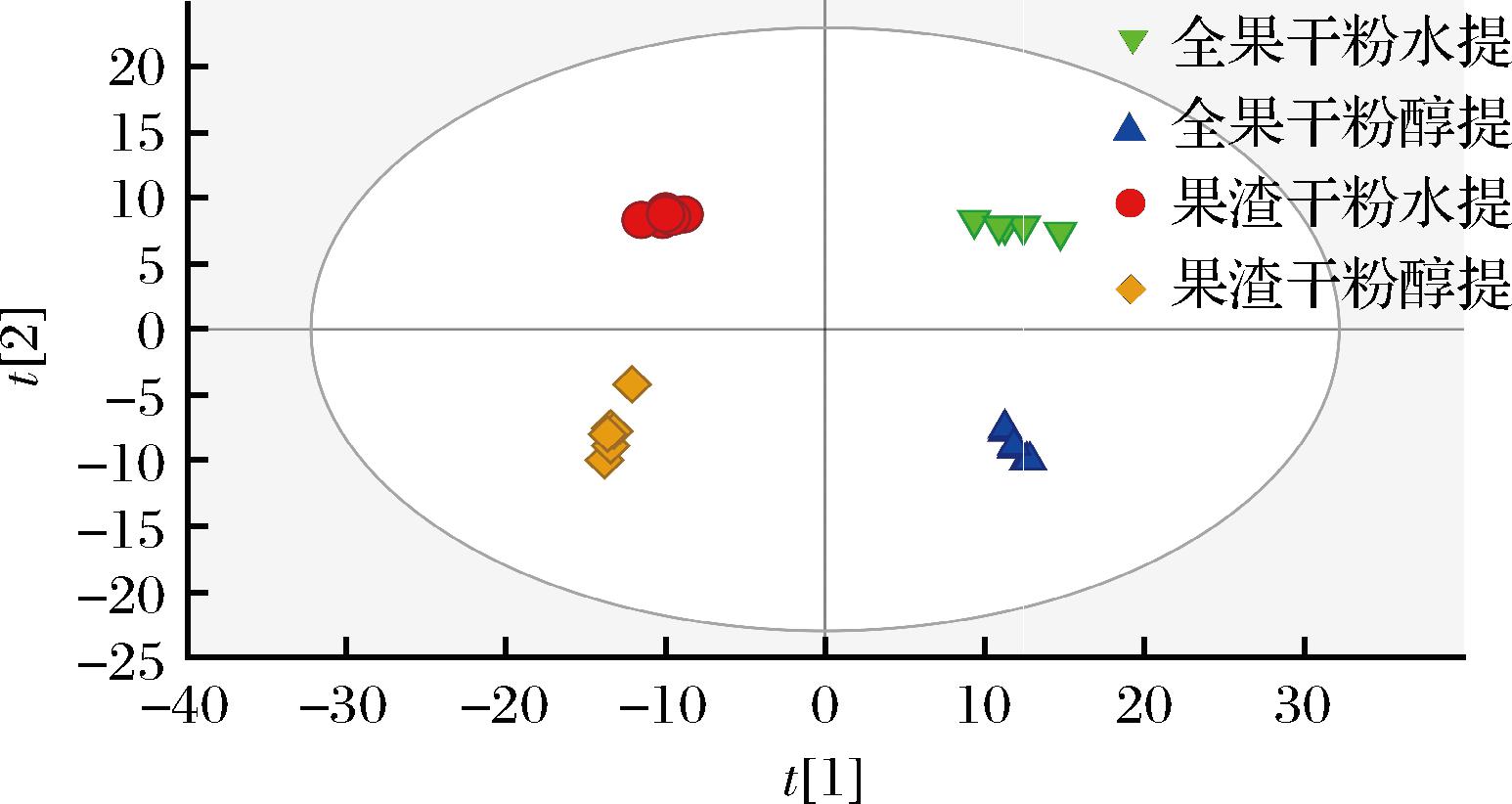
图2 刺梨不同提取物代谢组的PCA得分
Fig.2 PCA scores of different extracts of Rosa roxburghii Tratt
2.2 刺梨不同提取物的差异性比较
为了提高分类效能,在PCA模型初步处理样本后,采用能降低系统噪声干扰的OPLS-DA模型分析数据[18]。95%置信区间是衡量样本可取性的重要指标[19],本次实验的全部样本处于区间内,表明本次样本具有可取性。不同提取物OPLS-DA分析结果表明,每个提取物与其他3个提取物在第一主成分轴上明显分开,说明其代谢物之间代谢成分差异明显(图3)。在图3四幅OPLS-DA得分图中样本间横向距离越远说明组间差异越大,纵向距离越近说明组内重复性越好。图中数据表明,2组样本存在明显差异性。
置换检验能够判断OPLS-DA模型是否过拟合,对于OPLS-DA模型导出的VIP值、P值和FC才更具说服力[20]。图中横坐标为保留原始数据的百分比,纵坐标为R2Y或Q2值[21]。最右边横纵坐标均为1的点为真实值,左边所有的模拟预测的R2(>0.9)和Q2(>0.9)都要低于真实值[22],并且R2总是大于Q2,Q2的回归线截距要小于0.05。对OPLS-DA模型进行200次排列实验,得到模型评估指标见表1。本次实验数据均满足以上条件,表明模型可靠没有过拟合[23]。
表1 OPLS-DA模型的主要评估指标
Table 1 Main evaluation indexes of OPLS-DA model

模型全果水提全果醇提果渣水提果渣醇提R2Y(cum)0.9830.9930.9830.99Q2(cum)0.9750.990.9730.982R2的截距0.1440.1230.1390.0821Q2的截距-0.64-0.599-0.574-0.671
2.3 差异代谢物的筛选与表征
对316个物质进行差异代谢物筛选,根据VIP值>1、P值<0.05、FC≥2和FC≤0.5共筛选出168个差异代谢物。各提取组相较于其他3组分别筛选到30、42、75、21个差异代谢物。在此基础上,对不同样本组之间具有差异的代谢物进行更严格的筛选,最终得到49种显著差异代谢物(VIP>1.3、P<0.01、FC≥3和FC≤0.1)(表2)。
如表2所示,各提取组相较于其他3组筛选出的49种差异代谢物为5种、17种、21种、6种。其中脂类11种、维生素2种、糖类10种、酚类10种、氨基酸6种、核苷酸4种、醇2种、萜类4种。刺梨中的许多代谢产物,如萜类、脂类、酚类、多糖等,对人体具有促进健康的功能。

A-全果水提与其他组对比;B-全果水提置换检验;C-全果醇提与其他组对比;D-全果醇提置换检验;E-果渣水提与其他组对比; F-果渣水提置换检验;G-果渣醇提与其他组对比;H-果渣醇提置换检验
图3 刺梨不同提取物代谢物的OPLS-DA得分和置换检验
Fig.3 OPLS-DA score and displacement test of metabolites of different extracts of Rosa roxburghii Tratt
通过火山图可以直观地观察到各组分与其他组分的筛选出的显著差异代谢物(图4),图中横坐标表示log2FC纵坐标表示-log10P圆点为不显著代谢物,菱形为log2FC>0的代谢物,六边形为log2FC<0的代谢物,筛选出的49种差异代谢物用注释编号标出。其中全果干粉水提上调代谢物有2个,下调代谢物3个。全果干粉醇提上调代谢物有7个,下调代谢物有10个。果渣干粉水提上调代谢物有19个,下调代谢物有2个。果渣干粉醇提上调代谢物有1个,下调代谢物有5个。总体而言,上调差异代谢物多于下调差异代谢物。在本次实验中,上调差异代谢物黄酮类为最多。有研究发现在一定的条件下脂肪酸会降解为部分黄酮类化合物,这是因为脂类会被相应的酶分解成脂肪酸,并且因为脂肪酸的不稳定性,可在特定条件下分解为酮类和酚类[24]。
如图5所示,聚类热图可将代谢组学数据可视化[25]。每行代表一个代谢物,每列代表一个样本。4个不同提取物的代谢物水平存在显著差异,这些特征被投射到热图上,并用于样本聚类。图中颜色表示相对含量,红色块表示含量高表达,白色块表示含量低表达。差异代谢物在4种不同提取物中的相对含量明显区分。全果干粉水提中的积雪草酸、儿茶素、精氨基琥珀酸、富马酸、柚皮素7-O-β-D-葡萄糖苷含量相对较高。全果干粉醇提中的海藻糖、柚皮素查尔酮、抗坏血酸盐、蜜二糖含量相对较高。果渣干粉水提中的L-苹果酸、D-木糖、杜松酸、3-甲基硫代丙酸、(-)-表没食子儿茶素含量相对较高。果渣干粉醇提中的羟基异亮氨酸、异鼠李糖、青蟹肌醇、13-L-氢过氧基亚油酸含量相对较高。
表2 刺梨提取物差异代谢物的鉴定信息
Table 2 Identification information of differential metabolites in Rosa roxburghii Tratt extract
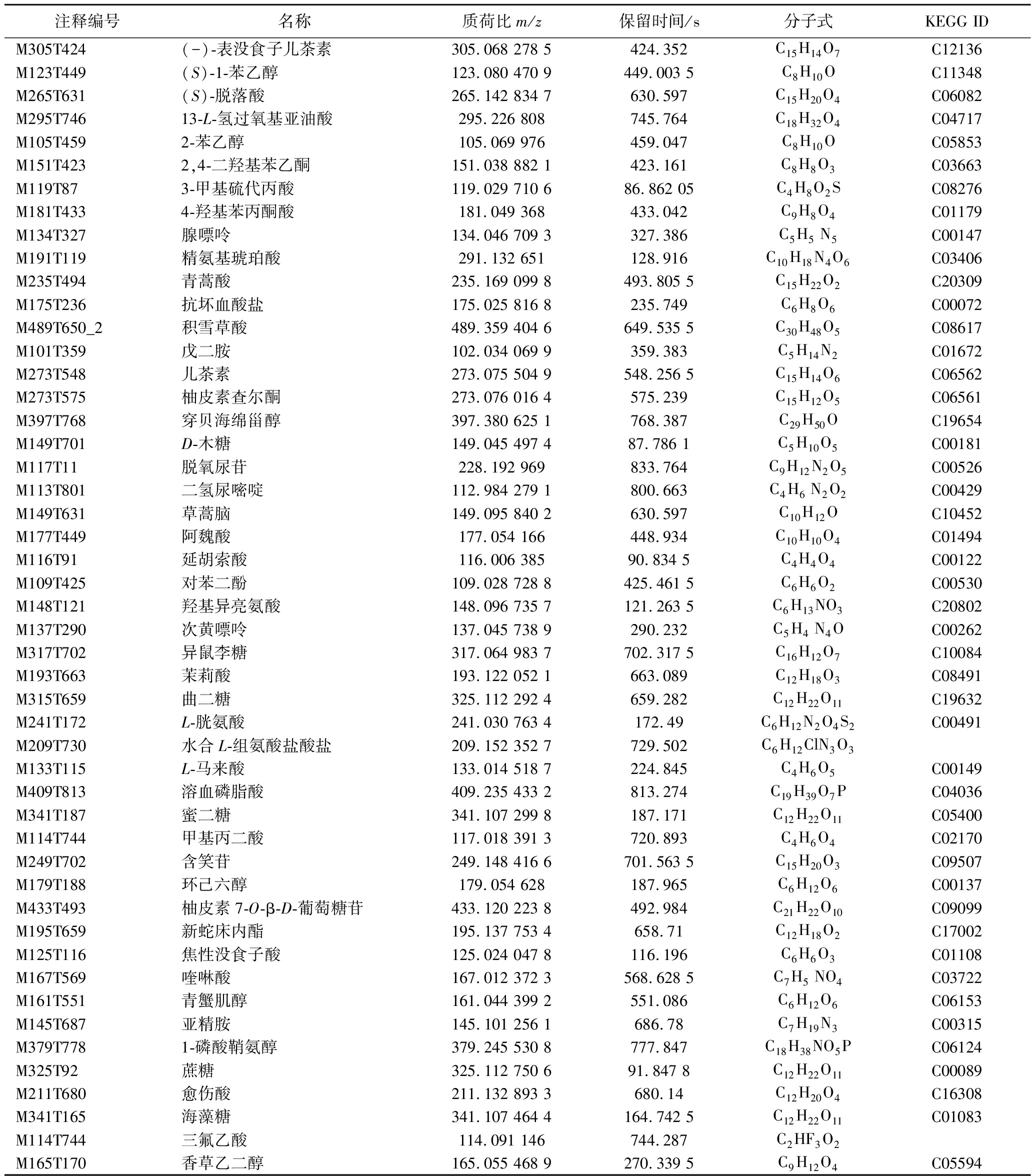
注释编号名称质荷比m/z保留时间/s分子式KEGG IDM305T424(-)-表没食子儿茶素305.068 278 5424.352C15H14O7C12136M123T449(S)-1-苯乙醇123.080 470 9449.003 5C8H10OC11348M265T631(S)-脱落酸265.142 834 7630.597C15H20O4C06082M295T74613-L-氢过氧基亚油酸295.226 808745.764C18H32O4C04717M105T4592-苯乙醇105.069 976459.047C8H10OC05853M151T4232,4-二羟基苯乙酮151.038 882 1423.161C8H8O3C03663M119T873-甲基硫代丙酸119.029 710 686.862 05C4H8O2SC08276M181T4334-羟基苯丙酮酸181.049 368433.042C9H8O4C01179M134T327腺嘌呤134.046 709 3327.386C5H5 N5C00147M191T119精氨基琥珀酸291.132 651128.916C10H18N4O6C03406M235T494青蒿酸235.169 099 8493.805 5C15H22O2C20309M175T236抗坏血酸盐175.025 816 8235.749C6H8O6C00072M489T650_2积雪草酸489.359 404 6649.535 5C30H48O5C08617M101T359戊二胺102.034 069 9359.383C5H14N2C01672M273T548儿茶素273.075 504 9548.256 5C15H14O6C06562M273T575柚皮素查尔酮273.076 016 4575.239C15H12O5C06561M397T768穿贝海绵甾醇397.380 625 1768.387C29H50OC19654M149T701D-木糖149.045 497 487.786 1C5H10O5C00181M117T11脱氧尿苷228.192 969833.764C9H12N2O5C00526M113T801二氢尿嘧啶112.984 279 1800.663C4H6 N2O2C00429M149T631草蒿脑149.095 840 2630.597C10H12OC10452M177T449阿魏酸177.054 166448.934C10H10O4C01494M116T91延胡索酸116.006 38590.834 5C4H4O4C00122M109T425对苯二酚109.028 728 8425.461 5C6H6O2C00530M148T121羟基异亮氨酸148.096 735 7121.263 5C6H13NO3C20802M137T290次黄嘌呤137.045 738 9290.232C5H4 N4OC00262M317T702异鼠李糖317.064 983 7702.317 5C16H12O7C10084M193T663茉莉酸193.122 052 1663.089C12H18O3C08491M315T659曲二糖325.112 292 4659.282C12H22O11C19632M241T172L-胱氨酸241.030 763 4172.49C6H12N2O4S2C00491M209T730水合L-组氨酸盐酸盐209.152 352 7729.502C6H12ClN3O3M133T115L-马来酸133.014 518 7224.845C4H6O5C00149M409T813溶血磷脂酸409.235 433 2813.274C19H39O7PC04036M341T187蜜二糖341.107 299 8187.171C12H22O11C05400M114T744甲基丙二酸117.018 391 3720.893C4H6O4C02170M249T702含笑苷249.148 416 6701.563 5C15H20O3C09507M179T188环己六醇179.054 628187.965C6H12O6C00137M433T493柚皮素7-O-β-D-葡萄糖苷433.120 223 8492.984C21H22O10C09099M195T659新蛇床内酯195.137 753 4658.71C12H18O2C17002M125T116焦性没食子酸125.024 047 8116.196C6H6O3C01108M167T569喹啉酸167.012 372 3568.628 5C7H5 NO4C03722M161T551青蟹肌醇161.044 399 2551.086C6H12O6C06153M145T687亚精胺145.101 256 1686.78C7H19N3C00315M379T7781-磷酸鞘氨醇379.245 530 8777.847C18H38NO5PC06124M325T92蔗糖325.112 750 691.847 8C12H22O11C00089M211T680愈伤酸211.132 893 3680.14C12H20O4C16308M341T165海藻糖341.107 464 4164.742 5C12H22O11C01083M114T744三氟乙酸114.091 146744.287C2HF3O2M165T170香草乙二醇165.055 468 9270.339 5C9H12O4C05594

A-全果干粉水提;B-全果干粉醇提;C-果渣干粉水提;D-果渣干粉醇提
图4 刺梨不同提取物差异代谢物的火山图
Fig.4 Volcanic map of different metabolites from different extracts of Rosa roxburghii Tratt
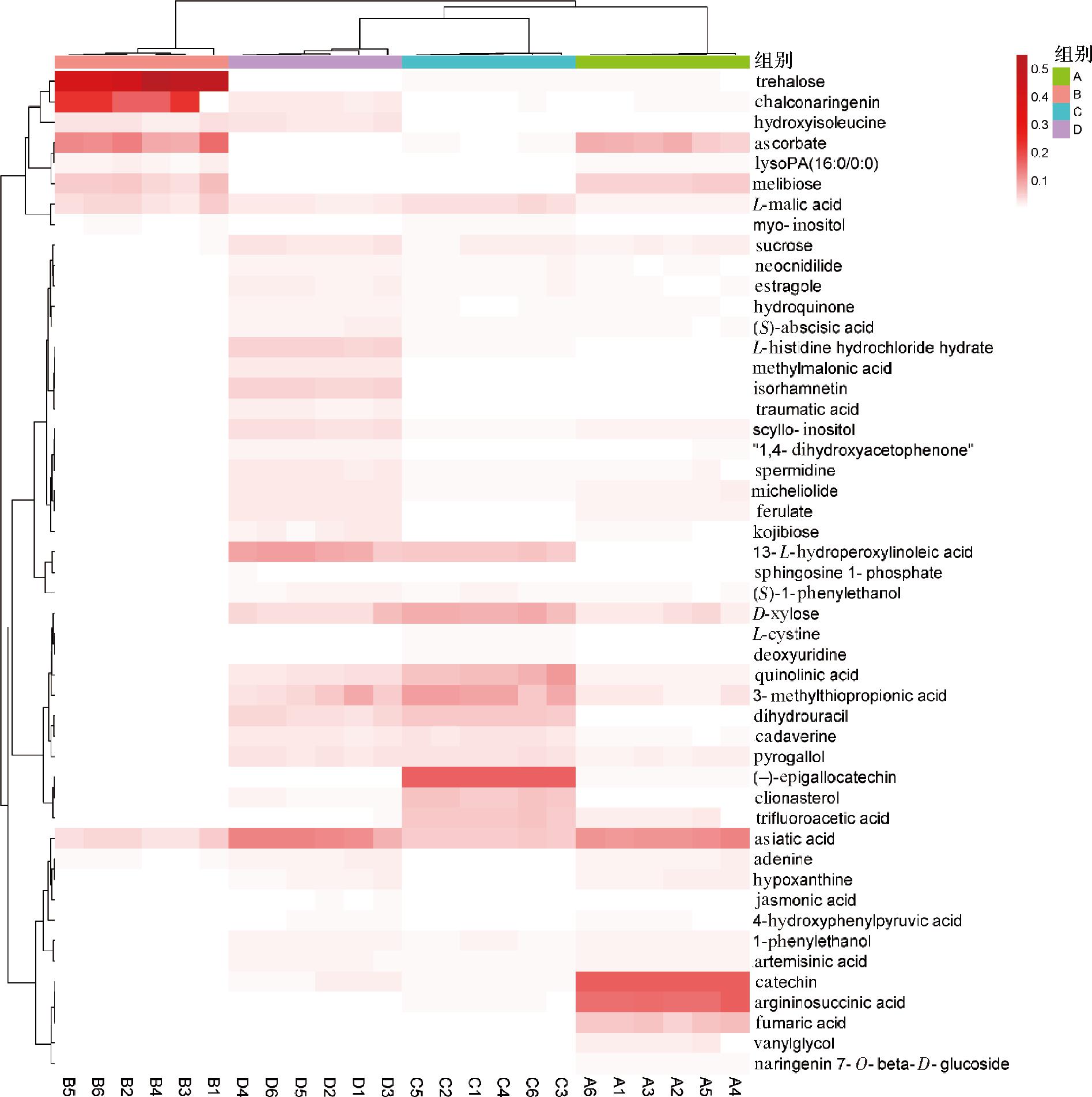
A-全果干粉水提;B-全果干粉醇提;C-果渣干粉水提;D-果渣干粉醇提
图5 不同提取物的聚类热图
Fig.5 Cluster heat map of different extracts
2.4 差异代谢物的代谢通路分析
利用筛选出的差异代谢物KEGG ID进行MBRole 2.0的通路分析,得到P<0.01的代谢途径有11条(P值越小,则该代谢通路的差异性越显著)。这11条代谢途径分别是淀粉与蔗糖的代谢、磷酸转移酶系统、半乳糖代谢、谷胱甘肽代谢、酪氨酸代谢、类黄酮生物合成、植物激素的生物合成、β-丙氨酸代谢、鸟氨酸、赖氨酸和烟酸生物碱的生物合成、苯丙烷类化合物的生物合成、ABC转运蛋白生物合成。结合P值与刺梨功能活性物质特征,本次实验的差异物代谢通路为类黄酮生物合成途径。如图6所示,参与类黄酮生物合成代谢通路的有4个代谢物,分别是有柚皮素查尔酮、儿茶素、柚皮素7-O-β-D-葡萄糖苷、(-)-表没食子儿茶素[(-)-epigallocatechin,EGC]。
由类黄酮生物合成代谢通路图可知(图7),对香豆酰辅酶a(C6-C3)与3个丙二酰辅酶a(C3)分子的缩合成柚皮素查尔酮与二苯基丙烷(C6-C3-C6)单元,通过共轭环闭合将其转化为柚皮素与黄酮(2-苯基色素-4-酮)主链,进一步的修饰产生多种结构形式,包括查尔酮、黄烷酮、黄酮以及异黄酮[26]。张帅[27]的研究表明柚皮素查尔酮具有抗肿瘤作用。
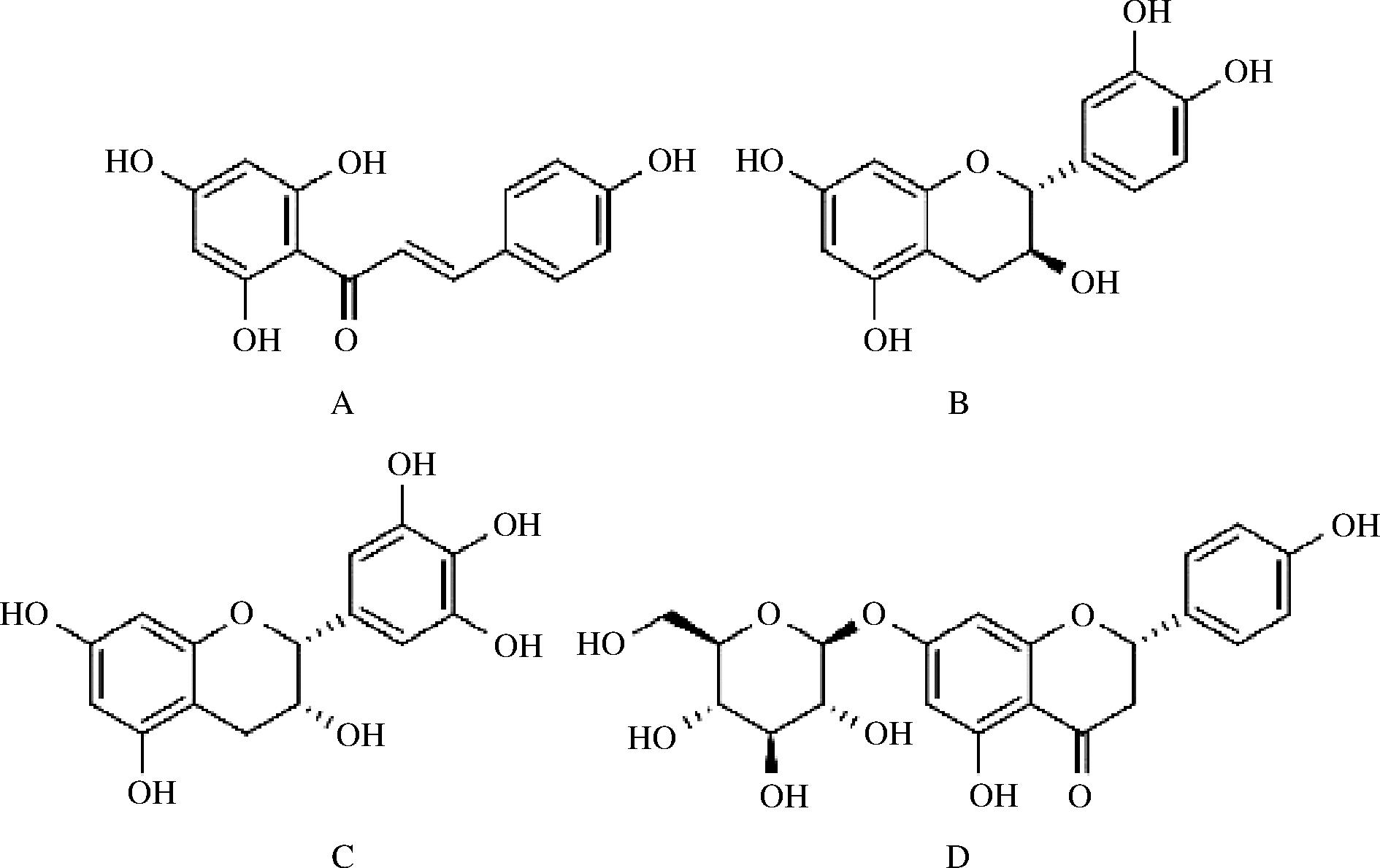
A-柚皮素查尔酮;B-(+)-儿茶素;C-(-)-表没食子儿茶素; D-柚皮素7-O-β-D-葡萄糖苷
图6 类黄酮生物合成代谢通路的4个代谢物
Fig.6 Four metabolites of flavonoid biosynthesis and metabolism pathway
(+)-儿茶素的合成路径为亮花青素+NADPH+H+生成(+)-儿茶素+NADP++H2O。KIM等[28]证明了植物源性儿茶素具有优异的抗感染、抗炎和抗氧化活性。儿茶素和富含儿茶素的植物材料通过体内研究中的炎症机制在短期和长期有效地抑制炎症应激。因此,儿茶素本身或含有儿茶素的营养制剂可作为强效抗感染剂或具有优异生理活性的功能性食品材料。
(-)-表没食子儿茶素的合成路径为delphinidin+2 NADPH+H+生成(-)-表没食子儿茶素+2 NADP+。KIM等[29]的研究表明,用EGC与没食子酸处理脂肪细胞可抑制脂肪细胞分化,表没食子儿茶素可显著调节成熟脂肪细胞的代谢基因转录,EGC确实在调节脂肪细胞分化和代谢方面发挥了有益的作用。在CHEN等[30]阿尔兹海默症的研究中,证明了多酚化合物EGC和表儿茶素没食子酸酯可以通过与Cu2+和Zn2+的螯合作用,有效缓解A40抗体聚集,减少活性氧的产生,从而降低Cu2+和Zn2+-A40诱导的神经元毒性。

图7 类黄酮生物合成代谢通路图(来源:KEGG PATHWAY Database)
Fig.7 Pathway map of flavonoids biosynthesis and metabolism (source:KEGG PATHWAY Database)
注:方框为酶的国际命名编号;普通圆圈为化合物;红圆圈为本次的4个代谢物;实箭头为反应方向;虚箭头为与其他代谢途径的关系。
柚皮素7-O-β-D-葡萄糖苷的合成路径为黄烷酮7-O-β-D-葡萄糖基转移酶与柚皮素生成UDP和柚皮素7-O-β-D-葡萄糖苷[31],国内外对其研究较少,但它同属类黄酮一类,推测其也具备以上功能活性。在后续的研究中,可加强对刺梨抗肿瘤、抗氧化、抗感染、减肥等方面的研究。
3 结论
代谢组学是一门交叉学科,对于各学科的综合运用要求较高,能更全面,更精准地反馈物质的整体信息。全面、细致地了解代谢异常和差异是代谢组学的一个重要特性。本研究基于UPLC-HRMS非靶向代谢组学分析刺梨不同提取物,PCA结果显示,不同提取物的生物学重复都汇聚在一起,说明刺梨不同提取物数据的稳定性较好,在测定过程中未出现明显偏差。组内样本点都很好地聚集在一起,证明代谢物种类和含量都相近。OPLS-DA模型分析表明各组与其他提取物代谢物差异性较大,并根据VIP、P、FC值筛选出49种显著差异代谢物。总体而言,上调差异代谢物多于下调差异代谢物,上调差异代谢物黄酮类最多。经过MBRole 2.0通路分析,这49种差异代谢物参与的代谢通路有11条,其中类黄酮生物合成途径最为显著。参与类黄酮生物合成代谢通路的有4个代谢物,分别是有柚皮素查尔酮、儿茶素、柚皮素7-O-β-D-葡萄糖苷、(-)-表没食子儿茶素。儿茶素、柚皮素7-O-β-D-葡萄糖苷含量在全果水提中相对较高,柚皮素查尔酮含量在全果醇提中相对较高,(-)-表没食子儿茶素含量在果渣水提中相对较高。这4种代谢物在国内外的研究中展现出优异的功能活性特点。本文探究不同提取物的代谢物差异,为以后以代谢组学为基础的刺梨研究提供理论参考。在后续的实验中,可加强对刺梨抗肿瘤、抗氧化、抗感染、减肥等方面的研究。
[1] 高秀丽. 药食同源民族药-刺梨[M].北京:科学出版社, 2017:1-2.
GAO X L.Rosa roxburghii, a national medicine with the same origin in medicine and food [M].Beijing: Science Press, 2017:1-2.
[2] 罗兵, 张建敏. 基于TRIZ和AD理论的刺梨采摘机设计研究. 农机化研究, 2023, 45(1):24-29.
LUO B, ZHANG J M. Design and research of prickly pear picking machine based on TRIZ and AD theory. Journal of Agricultural Mechanization Research, 2023, 45(1):24-29.
[3] 侯金丽. 刺梨植物乳杆菌发酵饮料的研制及其抗氧化作用. 食品科技, 2022, 47(2):140-146.
HOU J L. Development and antioxidant effect of Rosa roxburghii beverage fermented by Lactobacillus plantarum. Food Science and Technology, 2022, 47(2):140-146.
[4] 秦龙龙, 周锐丽.刺梨的营养保健功能及应用发展趋势[J].食品研究与开发, 2016, 37(13):212-214.
QIN L L, ZHOU R L.The healthcare function and development trend of Toxburgh Rose[J].Food Research and Development, 2016, 37(13):212-214.
[5] 周广志, 鲁敏, 安华明.刺梨果实发育过程中主要活性物质含量及其抗氧化性分析[J].食品科学, 2018, 39(22):20-25.
ZHOU G Z, LU M, AN H M.Analysis of bioactive substance contents and antioxidant activities in Rosa roxburghii fruits during development[J].Food Science, 2018, 39(22):20-25.
[6] LI H, FANG W Y, WANG Z, et al.Physicochemical, biological properties, and flavour profile of Rosa roxburghii Tratt, Pyracantha fortuneana, and Rosa laevigata Michx fruits:A comprehensive review[J].Food Chemistry, 2022, 366:130509.
[7] XIE H M, WANG H D, CHEN B X, et al.Untargeted metabolomics analysis to unveil the chemical markers for the differentiation among three Gleditsia sinensis-derived herbal medicines by ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J].Arabian Journal of Chemistry, 2022, 15(5):103762.
[8] XUE Z Y, TAN Z, HUANG A C, et al.Identification of key amino acid residues determining product specificity of 2, 3-oxidosqualene cyclase in Oryza species[J].The New Phytologist, 2018, 218(3):1076-1088.
[9] YANG M, YIN M Z, CHU S S, et al.Colour, chemical compounds, and antioxidant capacity of Astragali Radix based on untargeted metabolomics and targeted quantification[J].Phytochemical Analysis, 2022, 33(4):599-611.
[10] XIAO Q, MU X L, LIU J S, et al.Plant metabolomics:A new strategy and tool for quality evaluation of Chinese medicinal materials[J].Chinese Medicine,2022,17(1):1-19.
[11] BINGOL K.Recent advances in targeted and untargeted metabolomics by NMR and MS/NMR methods[J].High-throughput, 2018, 7(2):9.
[12] MONNERAT G, SEARA F A C, EVARISTO J A M, et al.Aging-related compensated hypogonadism:Role of metabolomic analysis in physiopathological and therapeutic evaluation[J].The Journal of Steroid Biochemistry and Molecular Biology, 2018, 183:39-50.
[13] 吴海燕, 徐芝亮. 基于主成分分析和判别分析的广地龙产地溯源研究. 药物分析杂志, 2022, 42(3):387-393.
WU H Y, XU Z L. Provenance traceability of earthworm based on the principal component analysis and discriminant analysis. Chinese Journal of Pharmaceutical Analysis, 2022, 42(3):387-393.
[14] 周欣, 张琳, 毛婵, 等.基于化学计量学方法结合正交偏最小二乘判别分析的陈皮饮片HPLC指纹图谱研究[J].中草药,2019,50(9):2194-2200.
ZHOU X, ZHANG L, MAO C, et al.HPLC fingerprints research on decoction pieces of Citri Reticulatae Pericarpium based on chemometrics methods combined with orthogonal partial least square discriminate analysis[J].Chinese Traditional and Herbal Drugs, 2019, 50(9):2194-2200.
[15] 贾聪, 芦鑫, 高锦鸿, 等.基于代谢组学分析不同颜色花生红衣的组成差异[J].食品科学, 2019, 40(19):46-51.
JIA C, LU X, GAO J H, et al.Metabolomic analysis of differences in chemical composition of peanut skins with different colors[J].Food Science, 2019, 40(19):46-51.
[16] DE ANDRADE VIEIRA É, CO LHO J G S, GRISI C V B, et al.Correlation and influence of antioxidant compounds of peels and pulps of different species of cacti from Brazilian Caatinga biome using principal component analysis[J].South African Journal of Botany, 2022, 147:434-442.
LHO J G S, GRISI C V B, et al.Correlation and influence of antioxidant compounds of peels and pulps of different species of cacti from Brazilian Caatinga biome using principal component analysis[J].South African Journal of Botany, 2022, 147:434-442.
[17] 孟益德, 吕庚鑫, 刘攀峰, 等.不同产地杜仲雄花的非靶向代谢组学比较与分析[J].中南林业科技大学学报, 2022, 42(1):156-166.
MENG Y D, LYU G X, LIU P F, et al.Comparison and analysis of untargeted metabolomics of male flowers of Eucommia ulmoides from different origins[J].Journal of Central South University of Forestry &Technology, 2022, 42(1):156-166.
[18] YE S T, LU H M.Determination of fatty acids in rice oil by gas chromatography-mass spectrometry (GC-MS) with geographic and varietal discrimination by supervised orthogonal partial least squares discriminant analysis (OPLS-DA)[J].Analytical Letters, 2022, 55(5):675-687.
[19] 欧阳红军, 刘义军, 袁源, 等.HS-SPME-GC-MS结合OPLS-DA分析提取方法对牛油果油挥发性香气化合物的影响[J].南方农业学报, 2021, 52(3):779-788.
OUYANG H J, LIU Y J, YUAN Y, et al.HS-SPME-GC-MS coupled with OPLS-DA to analyze the effects of extraction methods on volatile aroma compounds of avocado oil[J].Journal of Southern Agriculture, 2021, 52(3):779-788.
[20] 潘曦, 刘辉, 王昊, 等.基于近红外光谱和OPLS-DA的不同牌号卷烟分类识别方法研究[J].分析测试学报, 2020, 39(11):1385-1391.
PAN X, LIU H, WANG H, et al.Classification discrimination of different types of cigarette based on near infrared spectroscopy and OPLS-DA algorithm[J].Journal of Instrumental Analysis, 2020, 39(11):1385-1391.
[21] 罗春燕, 姚新转, 陈佳, 等.基于非靶向代谢组学分析冠突散囊菌发酵红茶茶汤前后代谢物变化[J].食品科技, 2021, 46(5):246-253.
LUO C Y, YAO X Z, CHEN J, et al.Analysis of substance differences before and after fermentation of black tea infusion by Eurotium Cristatum based on non-targeted metabonomics[J].Food Science and Technology, 2021, 46(5):246-253.
[22] 李伟, 刘亚丽, 宋永贵, 等.UPLC-Q-TOF-MSE结合OPLS-DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J].中草药, 2015, 46(15):2212-2218.
LI W, LIU Y L, SONG Y G, et al.Rapid identification on chemical constituents in fruits of Schisandra sphenanthera and Schisandra chinensis and discrimination markers by UPLC-QTOFMSE combined with OPLSDA[J].Chinese Traditional and Herbal Drugs, 2015, 46(15):2212-2218.
[23] 陈叶青, 范欣生, 朱振华, 等.基于UPLC-ESI-Q-TOF-MS/MS技术分析双参平肺颗粒化学成分[J].中草药, 2020, 51(2):321-329.
CHEN Y Q, FAN X S, ZHU Z H, et al.Chemical constituents of Shuangshen Pingfei Granules by UPLC-ESI-Q-TOF-MS/MS[J].Chinese Traditional and Herbal Drugs, 2020, 51(2):321-329.
[24] 任传英, 卢淑雯, 洪滨, 等.糙米和大米非靶向代谢组学分析[J].食品科学, 2022, 43(20):183-190.
REN C Y, LU S W, HONG B, et al.Non targeted metabolomics analysis of brown rice and rice[J].Food Science, 2022, 43(20):183-190.
[25] IVANISEVIC J, BENTON H P, RINEHART D, et al.An interactive cluster heat map to visualize and explore multidimensional metabolomic data[J].Metabolomics, 2015, 11(4):1029-1034.
[26] YAHYAA M, ALI S, DAVIDOVICH-RIKANATI R, et al.Characterization of three chalcone synthase-like genes from apple (Malus x domestica Borkh.)[J].Phytochemistry, 2017, 140:125-133.
[27] 张帅. 柚皮素查尔酮通过诱导细胞自噬、凋亡及PI3K/Akt信号通路调控抗胶质瘤作用[D].济南:山东大学, 2017.
ZHANG S.Naringin chalcone regulates the anti glioma effect by inducing autophagy, apoptosis and PI3K/Akt signal pathway [D].Jinan:Shandong University, 2017.
[28] KIM J M, HEO H J.The roles of catechins in regulation of systemic inflammation[J].Food Science and Biotechnology, 2022, 31:957-970.
[29] KIM H S, MOON J H, KIM Y M, et al.Epigallocatechin exerts anti-obesity effect in brown adipose tissue[J].Chemistry &Biodiversity, 2019, 16(10):e1900347.
[30] CHEN T T, YANG Y F, ZHU S J, et al.Inhibition of Aβ aggregates in Alzheimer′s disease by epigallocatechin and epicatechin-3-gallate from green tea[J].Bioorganic Chemistry, 2020, 105:104382.
[31] MCINTOSH C A, LATCHINIAN L, MANSELL R L.Flavanone-specific 7-O-glucosyltransferase activity in Citrus paradisi seedlings:Purification and characterization[J].Archives of Biochemistry and Biophysics, 1990, 282(1):50-57.