冷冻可以通过抑制微生物的生长和酶的活性来维持食品原有的营养价值及感官品质,延长食品的贮存时间,是防止食品浪费的有效手段之一[1]。但在传统冷冻过程中,形成的大而不规则的冰晶会刺破食品的组织细胞,导致不可逆的结构损伤、汁液损失、营养价值下降等问题[2]。为了解决这些问题,近年来研究者们提出了许多新型方法来抑制冷冻过程中冰晶的形成,使食品处于过冷(超冰温)状态贮藏,从而改善产品的品质,如电场辅助过冷[3]、磁场辅助过冷[4]、添加冰点调节剂[5]等。这些技术虽然可以避免冰晶的形成,减小冰晶对食品组织细胞的破坏,但由于晶核的形成是复杂且不可预测的过程,因此处于过冷状态的食品内仍会随时诱发成核发生冻结[6]。
等容冷冻(isochoric freezing,ICF)是一种新型技术,指将食品放进一个体积恒定且密闭的容器中进行冷冻贮藏[7]。这项技术首先由RUBINSKY及他的团队在2005年提出[8]。他们认为,在等容体系中,随着温度的降低,形成的冰晶会对液相施加高压,从而降低液相的冻结点,使得系统内存在一定体积的低温且未被冻结的液相,当食品处于过冷态的液相中时,既能抑制酶活性,又可以阻止冰晶的形成[9],从而改善了冷冻产品的品质。并且,因体系内始终有液相的存在,可以减缓渗透压的变化幅度,降低食品细胞的脱水损伤。因为等容环境下冰晶的体积变化仅与温度有关,当温度不变时,系统内就不会新形成冰[10],因此,相对于其他过冷贮藏技术,等容冷冻系统内的液相的过冷态是稳定的,消除了冰晶成核的不确定性。此外,等容冷冻技术还能减少能源消耗与碳排放[11],据该团队的另一成员BILBAO-SAINZ在一篇新闻报道中所言,如果等容冷冻技术可以全面应用于冷冻行业,减少的碳排放量相当于减少了一百万辆汽车[12]。目前,在果蔬、肉制品、水产品和微生物等领域,等容冷冻技术已经有了一些初步研究。
本文对等容冷冻技术原理以及在食品行业中的研究进展进行综述,同时对等容冷冻技术当前存在的局限之处进行探讨分析,展望其未来在食品低温保存行业的发展潜力,以期为其在食品冷冻方面的研究与应用提供更多的参考。
1 等容冷冻概述
1.1 等容冷冻原理
从热力学的观点来看,等容系统可以被认为是一个体积固定且密闭的系统。图1显示了纯水的压力-温度图,显示了其中4种不同冰相在水的相图中的存在的条件范围,在显示的所有冰相中(冰Ⅰ、冰Ⅱ、冰Ⅲ、冰Ⅴ),与液态水共享相界的有冰Ⅰ、冰Ⅲ和冰Ⅴ相,不同冰相的密度不同[13]。除冰Ⅰ相外,其他冰相的密度均比水高。等容系统中的冻结过程将精确地遵循冰Ⅰ和水之间的液相线,直到冰Ⅰ、冰Ⅲ和水的三相点,此时,体系内有约45%的溶液保持液态,在此之后,系统内将生成冰Ⅲ相,因冰Ⅲ的密度高于冰Ⅰ相,形成冰Ⅲ相后固相体积减少,无法继续产生高压,并将导致体系内充满冰晶。因此,等容冷冻的设定温度应控制在三相点温度以上。
在等容系统中,因为体积是恒定的,且腔壁是刚性的,因此冰的膨胀会对剩余的液相施加压力,从而降低液相的冻结点。随着温度的降低,压力会继续上升,直到液相线上系统的温度等于设定的温度。然而,由于勒夏特列原理指出,如果改变影响平衡的条件之一(如温度、压强),平衡将向着能够减弱这种改变的方向移动。因此,当水在冻结膨胀时,在恒定体积系统中产生的压力将阻碍冰的进一步生成,即刚性容器内的冰无法无限生长,而是与液相保持一定的体积比。此时,在恒定温度、固定体积下,体系的压力变化存在一个动态平衡,这可保证等容冷冻体系内的液相处于稳定的过冷状态[14]。

图1 水在等容条件下的相变图[15]
Fig.1 Phase change diagram for water under isochoric conditions
等容冷冻过程如图2所示,在冷冻开始前,在远离样品的一端建立成核点(一些固体,如螺母等),并在腔内充满液体以排尽气体[16],密封后将设备放入低温环境中。随着温度的不断降低、且有促成核物质的存在,冰晶开始在成核点处形成,不断生长并向四周施加压力,使得液相受到的压力不断增加,凝固点降低,维持在液态。当到达目的温度时,样品被保存在过冷的液相中而不发生冻结,从而维持新鲜的品质。

图2 等容冷冻过程示意图
Fig.2 Schematic diagram of the process of isochoric freezing
冷冻过程中将所需的压力自发维持在最低的水平、且样品不发生冻结的两大特点,使得等容冷冻成为了一种节能减排的冷冻技术。据POWELL-PALM等[17]报道,因为食品并未被冻结,故相较于传统的冷冻方法,等容冷冻最大限度地提高了有效热质量,在显著提高系统的温度稳定性的情况下,使得整体能耗降低了约70%。ZHAO等[18]通过建立相变模型预测之后认为:若等容冷冻技术得以广泛应用,理论上全球每年的能耗将减少6.49×1010 kW·h,同时减少4.59×1010 kg的碳排放量。
1.2 等容冷冻设备
与其他一些新兴技术,如电场辅助、磁场辅助等相比,等容冷冻不需要复杂的设备仪器,只需要一个承压能力较强的容器,同时通过冰浴或其他方法对容器外部降温到目的温度,并增加一个压力传感器即可,如图3所示。
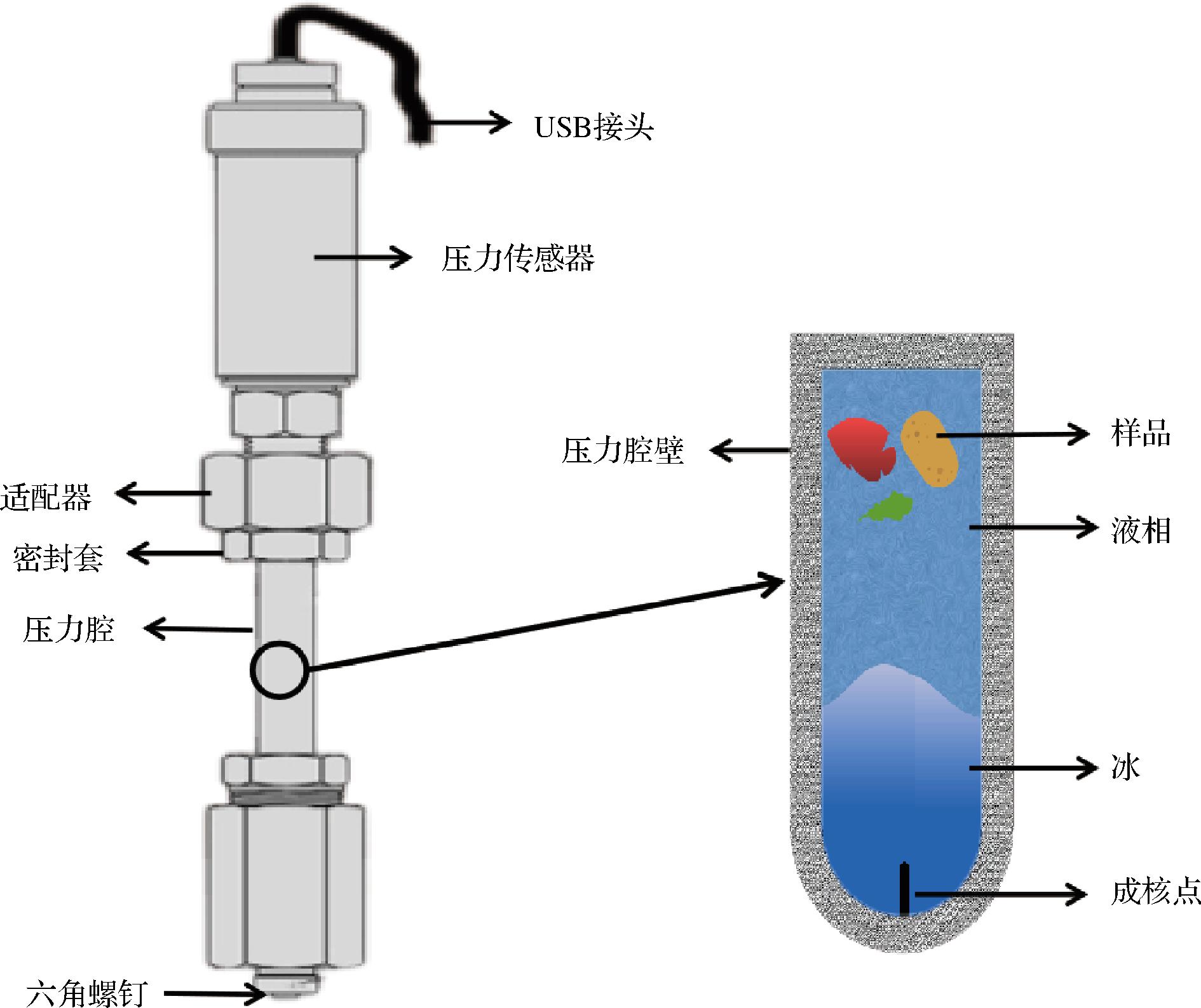
图3 等容冷冻装置示意图[19]
Fig.3 Schematic diagram of the device of isochoric freezing[19]
在等容冷冻过程中,随着温度的降低,压力腔壁承受的压力逐渐升高,直至抵达水的三相点(209.9 MPa),因此,腔壁所需的材料通常需要较高的抗压能力,如钛[20]、不锈钢[21]等。同时,因为不溶空气会导致腔内冰晶体积的增加[16],因此需要保证腔体内气体的消除以及腔的密封程度,图3中的六角螺钉、箍、密封套、栓等部件均用来提高腔体的密封程度。在冷冻过程中,通过压力传感器实时监测腔内的压力,以判定冷冻终点。
在压力腔内,样品可以装于塑封袋或塑料离心管等较柔软的小容器中或直接浸泡在液体内,以保证样品与液相接触,在小容器内外需要装满液体以保证腔体内没有气泡。可以根据不同的样品或目的选择不同的液体,鱼、肉类可选择等渗的氯化钠溶液[22],果蔬可选择等渗的蔗糖溶液[23]或抗坏血酸溶液[24]。在保存蛋白质制剂方面,加入蔗糖溶液可减缓蛋白质的冷变性[25],还可以降低血红蛋白的聚集性,提高其在冷冻时的稳定性[26]。
等容冷冻设备简单、操作方便,无需对目前存在的制冷基础设施进行较大的改变,就可以应用于冷链运输的全过程,甚至放置于家用冰箱内。但设备本身需要具有极高的抗压能力及密封性,因此目前仅有实验性的小型设备,无法应用于实际生产。未来需要在保证安全与性能的同时,进一步提高等容冷冻设备的容积,以扩大其应用范围。
2 等容冷冻改善冻藏食品品质的原理
相对于传统的冷冻方法,等容冷冻可以在低温且不产生冰晶的情况下稳定地保存食品,消除因冰晶生长给食品带来的冷冻损伤,又因为体系内始终存在液相,可以减缓因冰晶生长带来的脱水损伤。同时,因温度降低而产生的高压也会对食品中的微生物产生一定的影响,从而抑制食品的腐败。
2.1 消除冰晶生长产生的细胞机械损伤
在传统冷冻过程中,由于冰晶的生长,细胞被刺破,导致食品在解冻后的品质急剧下降。等容冷冻可使食品保存在稳定的过冷环境中,这可以消除冷冻过程中食品细胞因冰晶生长而引起的机械损伤[27],也能稳定细胞内外的渗透压,从而更好地维持冷冻食品的品质。N STASE等[28]研究了等容冷冻对罗非鱼品质的影响,如图4所示,冷冻处理后,相对于等压冷冻,经等容冷冻处理后的罗非鱼细胞间隙没有显著增加,细胞排布紧密,更接近新鲜样品,这证明经等容冷冻处理后,肌肉内部并未产生冰晶。LYU等[29]在植物细胞中也有相似的发现,经等容冷冻处理后的马铃薯细胞未被冰晶破坏,避免了细胞内容物流出,证明等容冷冻可以抑制冰晶对马铃薯的冷冻损伤(图5)。
STASE等[28]研究了等容冷冻对罗非鱼品质的影响,如图4所示,冷冻处理后,相对于等压冷冻,经等容冷冻处理后的罗非鱼细胞间隙没有显著增加,细胞排布紧密,更接近新鲜样品,这证明经等容冷冻处理后,肌肉内部并未产生冰晶。LYU等[29]在植物细胞中也有相似的发现,经等容冷冻处理后的马铃薯细胞未被冰晶破坏,避免了细胞内容物流出,证明等容冷冻可以抑制冰晶对马铃薯的冷冻损伤(图5)。

A-新鲜肌肉;B-经3 h等压冷冻后贮存在-5 ℃下的肌肉; C-经3 h等容冷冻后贮藏在-5 ℃下的肌肉
图4 不同条件冷冻后罗非鱼肌肉组织微观图像[28]
Fig.4 Comparison between fresh muscle under different freeze conditions[28]
注:星号表示肌纤维束,白色虚线指向包裹肌纤维束的结缔组织。

A、D-新鲜组;B、E--5 ℃等压冷冻组; C、F--5 ℃等容冷冻组,箭头指向细胞壁
图5 新鲜和经等压冷冻、等容冷冻的马铃薯切片由甲苯 胺蓝O染色后的显微照片[29]
Fig.5 Micrographs of fresh, isobaric frozen and isochoric frozen potato sections stained by toluidine blue[29]
等容冷冻过程中不在食品细胞内产生冰晶的特点,使其果蔬、水产等易发生冻害的食品具有极大的应用潜力,扩大其应用后可以促进这些食品的市场规模进一步扩大。
2.2 减缓渗透压变化带来的细胞脱水损伤
冰晶在形成过程中会不断增加液体中溶质的浓度,因此在传统的等压冷冻过程中,食品细胞环境中的渗透压会随着冰晶的形成而逐渐升高,导致食品细胞不断脱水,引起细胞内pH值的变化,导致营养物质的变性。添加冷冻保护剂可以减缓细胞的脱水损伤,但冷冻保护剂最大的缺点是如何在食品中加入和去除,且其潜在毒性也需要学者慎重考虑。而在等容冷冻过程中,因冰晶生长产生的压力可通过液体传递给食品细胞,使得食品细胞内部的水的凝固点降低,避免在降温过程中食品细胞内部产生冰晶,减缓渗透压变化带来的细胞脱水损伤,另外,体系中液相的存在也起到了减缓渗透压变化的作用。
2.3 抑制微生物的生长
等容冷冻过程中会同时产生高压和低温的环境。其中,高压可以通过破坏微生物的细胞膜、膜蛋白、核糖体等,影响微生物细胞的结构和代谢[30],而较低的温度可以抑制酶的活性从而抑制微生物的生长与繁殖。目前研究表明,等容冷冻对培养基环境中的常见致腐菌和致病菌的生长具有一定的抑制效果,包括大肠杆菌、鼠伤寒沙门氏菌、单核细胞增生李斯特菌。
大肠杆菌是较易污染食品的致病菌之一,摄入后可能会引起人发生胃肠道感染等疾病,因此杀灭食品中的大肠杆菌具有积极意义,PRECIADO[31]最先研究了等容冷冻处理对大肠杆菌的影响,发现经-20 ℃等容冷冻处理后2 h后,大肠杆菌的存活率急剧下降。SALINAS-ALMAGUER等[32]在大肠杆菌方面与PRECIADO[31]的实验结果有差异。他在不同温度的等容条件下对大肠杆菌悬浮液进行冷冻处理。结果发现,在等容条件中,并非温度越低,大肠杆菌繁殖越缓慢,而是存在临界温度。如图6所示,在当环境温度低于三相点之后,会在环境中形成密度相对于冰Ⅰ相更大的冰Ⅲ相,减少了固相的体积,为部分大肠杆菌提供相对安全的环境,使得大肠杆菌免受高压的影响,并在解冻之后重新繁殖。而在-15 ℃时,环境中的冰Ⅰ相与水相共存,当冰Ⅰ相体积增大时,产生的压力能通过液相传递给大肠杆菌,导致充满细菌悬浮液的试管中的大肠杆菌全部灭绝。
POWELL-PALM等[33]研究了不同冷冻温度/暴露时间的等容/等压冷冻处理和恢复时间对大肠杆菌的影响,发现在较高的温度下(-10/-15 ℃),较短的暴露时间(30/60 min)无法对大肠杆菌产生明显的抑制作用,甚至在当冷冻温度为-10和-15 ℃,暴露30/60 min时表现出相反的效果;而在-20 ℃下,随暴露时间的延长,受伤细胞的百分比逐渐升高,且活细胞数量在经120 min后数量百分比降低了约50%,大肠杆菌遭到永久性破坏,另外,作者还发现,虽然等容冷冻与等压冷冻处理后大肠杆菌的数量均有随温度降低而降低的趋势,但在同样温度下,等容冷冻的对数下降值远高于等压冷冻,这进一步证明了等容冷冻的抑菌能力。
沙门氏菌(Salmonella)和单核细胞增生李斯特菌(Listeria monocytogenes)2种在冷冻食品中常见的致病菌,摄入后可能导致的胃肠道疾病,严重的可能会造成菌血症。因此,这2种细菌对评价冷冻食品的安全性极其重要,学者们需要尤为关注。BRIDGES等[34]在不同温度下测试鼠伤寒沙门氏菌(S.enterica serovar Typhimutium, ATCC 14028)和单核细胞增生李斯特菌(L.monocytogenes serotype 4b, ATCC 19115)在等容冷冻条件下的存活情况。发现经过等容冷冻处理之后,2种细菌均能降至不可恢复的水平,菌落总数对数减少值均能达到7 lg CFU/mL以上,而等压冷冻处理后的减少值分别为1.3 lg CFU/mL和2.1 lg CFU/mL。另外,等容冷冻处理在每个阶段的抑菌能力均比等压冷冻处理强。经电子显微镜观察后发现,等容冷冻处理24 h后的鼠伤寒沙门氏菌细胞会发生非常明显的变形、萎缩和质壁分离现象(图6)。
以上研究证明了等容冷冻处理可以利用低温与高压来抑制微生物的生长繁殖。但研究对象都是在悬浮液/培养基中而非食品体系,且研究的致病、致腐的微生物种类较少。未来还需要进一步研究等容冷冻处理对存在于食品中的微生物的影响,探讨出既可抑制病原微生物的繁殖,又能维持食品细胞结构完整性的处理参数,进一步提高冷冻食品的贮藏稳定性及安全性。

A-过夜生长(不处理);B-在-15 ℃等压冷冻24 h; C-在-15 ℃等容冷冻24 h
图6 鼠伤寒沙门氏菌在不同生长条件下的图像[34]
Fig.6 Images of Salmonella typhimurium under different grown conditions[34]
注:刻度条表示TEM图像为1 μm,FE-SEM图像为2 μm; 箭头指出细胞质与细胞膜的可见分离。
3 等容冷冻在食品贮藏方面的应用
等容冷冻技术最初被应用于生物材料的保存研究方面,例如哺乳动物细胞[35]、胰岛[36]、心脏[21],这些研究为器官的保存、移植提供了更多、更好的参考。近年来,等容冷冻也被引入到食品冷冻中,目前对等容冷冻技术在食品冷冻中的研究应用相对较少,但在植物性食品和动物性食品中都有所研究。
3.1 等容冷冻在植物性食品方面的应用
在冷冻过程中,水分含量较高的果蔬通常会因内部冰晶的生长导致细胞膜破裂,抗坏血酸、酚类化合物等活性物质流出,使解冻后的感官品质和营养价值发生巨大劣变,而在等容冷冻过程中,食品可以保存于过冷的液相中,从而避免冰晶生长的影响。目前,等容冷冻在植物食品领域的研究主要集中在较易发生腐败变质的菠菜、圣女果、甜樱桃以及马铃薯的冷冻。
LYU等[29]在-3 ℃下将等容冷冻与等压冷冻对比。结果发现,与等压冷冻相比,经过等容冷冻后,马铃薯的重量与新鲜样品几乎一致,没有出现脱水现象,色泽也与新鲜样品接近,说明经等容冷冻后马铃薯细胞膜并未因冰晶生长而破坏,使得酶促褐变受到抑制(图5)。同样用马铃薯作为实验对象,CRISTINA等[37]将等容冷冻、等压冷冻与单体快速冷冻3种方法对比,得到的质量、显微结构方面的结果与LYU等[29]的类似,并且,等容冷冻处理还能提高马铃薯中的总酚含量及抗氧化能力,并将褐变的发生时间推迟一周(图7)。

图7 经不同条件冷冻并解冻3 h后的马铃薯图片[37]
Fig.7 Pictures of potatoes frozen under different conditions and thawed for 3 h[37]
ZHAO等[24]对等容冷冻处理马铃薯的参数进行了优化试验。将马铃薯放置于不同的冷冻液中,采用不同的温度/压力和不同的压力变化率,研究不同处理条件对马铃薯品质的影响。发现,浸泡在等渗的抗坏血酸溶液中,以低于0.02 MPa/s的速度升至156 MPa的冷冻马铃薯切片质量较好,其具有与新鲜样品接近的颜色、质量、和弹性,但因为压力的增加,马铃薯切片的硬度有13%的增幅。
除了马铃薯,BILBAO-SAINZ等[23,38-40]还将该技术研究于幼叶菠菜、圣女果、甜樱桃和石榴。用等容冷冻、速冻、等压冷冻分别对甜樱桃进行冷冻处理后,BILBAO-SAINZ等[38]发现等容冷冻处理降低了甜樱桃的滴水损失,色泽与质构与新鲜样品更为接近,维持了甜樱桃的外观(图8),且抗坏血酸、可溶性酚类物质的含量的下降程度最低,这证明了等容冷冻在水果方面的应用潜力。BILBAO-SAINZ等[23]将幼叶菠菜在等容冷冻、等压冷冻及商业冷冻处理后测定其品质。结果发现,等压冷冻处理后,菠菜的质量和厚度会发生显著的减小,外观表现为叶片柔软、透明。而经过等容冷冻后的菠菜,其营养物质,如抗坏血酸、叶绿素、多酚的下降程度最低,这说明其抗氧化活性下降最为缓慢,同时细胞结构更为完整,外观也更加接近新鲜样品。对于圣女果,BILBAO-SAINZ等[39]将经4种方法(10 ℃下贮藏、单体快速冷冻、-2.5 ℃等容冷冻和-2.5 ℃等压冷冻)贮藏4周之后的圣女果品质进行对比,结果显示,等容冷冻处理可以维持圣女果的质量、外观(图9)以及质构,经冷冻扫描电镜观察后发现,等容冷冻处理的圣女果的细胞结构更为完整,这可能是其营养物质保留量相对较高的原因。经过-2.5 ℃的等容冷冻处理后,BILBAO-SAINZ等[40]还发现,相对于冷藏,石榴的总花色苷、抗坏血酸的含量更高,好氧菌如酵母和霉菌的数量也显著降低。
在果蔬冷冻贮藏过程中,等容冷冻处理之后的果蔬贮藏稳定性显著增强,不仅可以通过抑制冰晶的生长来防止细胞组织被破坏而引起外观变化,还在抑制酶活性等方面具有一定的作用,可以有效地维持果蔬的品质与营养价值。但目前研究的样品种类、数量过少,并且等容冷冻抑制酶活性的详细机制还未被确定,在等容冷冻过程中产生的高压对细胞的作用也不容忽视。因此,还需进一步扩大等容冷冻在植物性食品方面的研究广度与深度,在寻找不同食品的最佳处理方式的同时确保等容冷冻在节能减排方面的优势。

A-分别为新鲜样品;B--4 ℃等容冷冻;C--7 ℃等容冷冻; D--4 ℃等压冷冻;E--7 ℃等压冷冻;F-单体快速冷冻
图8 不同条件冷冻后甜樱桃的外观与横截面对比[38]
Fig.8 The appearance and cross section of sweet cherry after freezing under different conditions were compared[38]

A-新鲜样品;B--2.5 ℃等容冷冻;C-10 ℃、85%相对湿度下贮存;D-单体快速冷冻;E--2.5 ℃等压冷冻
图9 新鲜圣女果和冷冻处理后保存4周后的照片[39]
Fig.9 Photograph of fresh grape tomato and preserved tomatoes after four weeks[39]
3.2 等容冷冻在动物性食品方面的应用
等容冷冻技术不仅在植物性食品的冷冻中有所应用,在动物性食品中也有所应用。但目前,等容冷冻技术在动物性食品中的研究较少。
N STASE等[28]的研究表明了等容冷冻在维持动物性食品品质方面具有良好的效果,通过对比不同条件冷冻处理后的罗非鱼鱼片组织形态后发现,经过-3 ℃等容冷冻处理之后的鱼片的细胞组织结构与新鲜样品之间没有显著差异,而经相同温度下等压处理的鱼片组织结构则发生严重的肌肉纤维收缩、分裂现象,肌纤维束也失去了规则的多边形形状。这是因为在等容冷冻过程中,溶液渗透压较稳定,相应的,贮存在其中的细胞也不会发生细胞脱水和电解质失衡现象。
STASE等[28]的研究表明了等容冷冻在维持动物性食品品质方面具有良好的效果,通过对比不同条件冷冻处理后的罗非鱼鱼片组织形态后发现,经过-3 ℃等容冷冻处理之后的鱼片的细胞组织结构与新鲜样品之间没有显著差异,而经相同温度下等压处理的鱼片组织结构则发生严重的肌肉纤维收缩、分裂现象,肌纤维束也失去了规则的多边形形状。这是因为在等容冷冻过程中,溶液渗透压较稳定,相应的,贮存在其中的细胞也不会发生细胞脱水和电解质失衡现象。
之后BILBAO-SAINZ等[22]研究了等容冷冻对罗非鱼鱼片贮藏质量的影响,用等容冷冻、冷藏、过冷和冷冻4种方法处理鱼片。发现经等容冷冻处理可大幅减缓挥发性盐基氮值和硫代巴比妥酸值增加,这表明等容冷冻处理能够抑制脂质的氧化与微生物的繁殖。另外,等容冷冻处理后的鱼片质量略有增加且pH值变化不明显,通过观察微观结构后发现,等容冷冻处理之后的细胞间隙与新鲜样品最为相近,仍然存在均匀的肌纤维束且肌纤维束仍保持多边形的截面形状(图10),这能解释为什么等容冷冻处理之后鱼片的咀嚼性、黏性和弹性能得到较好的保持。除了罗非鱼,RINWI等[41]研究了在等容冷冻过程中,不同的氯化钠浓度对鸡肉品质的影响,发现使用2.5%的氯化钠溶液作为冷冻液可以更好地维持肌肉的品质,同时也发现,在-4 ℃和-8 ℃下,等容系统的温度、压力和时间之间具有相关性,证明了在等容冷冻过程中,监测并控制压力和温度具有可行性。

A-新鲜样品;B--20 ℃冷冻贮藏14 d;C--3 ℃等容冷冻 贮藏14 d;D-5 ℃贮藏14 d;E--3 ℃微冻贮藏14 d
图10 罗非鱼鱼片组织横切面的显微照片[22]
Fig.10 Micrographs of cross-section of tilapia fillet tissue[22]
虽然等容冷冻对改善冷冻罗非鱼和鸡肉品质有着明显的作用,但仅通过少量样品,无法证实等容冷冻在动物性食品方面的优势,未来仍需在这一方面进行更广泛的研究。
4 总结
等容冷冻是一种食品低温贮存技术,具有设备简单、操作方便、绿色节能等优点,它可以通过抑制冷冻食品中冰晶的生长保持冷冻食品的品质。目前虽有部分研究表明等容冷冻可以防止冰晶出现、抑制腐败菌和致病菌生长,但目前等容冷冻技术在医药领域研究较多,在食品应用较少,主要集中于果蔬以及培养基环境中的致病菌,因此为推进等容冷冻技术在食品中的应用,应该扩大其研究对象。此外,由于材料强度的限制,等容冷冻设备目前仅有实验型,密封性不易保证且冷冻室容积不大,这仍是限制该设备发展的重要问题,需要食品机械方面和食品保藏方面科学家的共同努力以推动等容冷冻技术的发展,使其尽快应用于我国的冷链运输过程中。
[1] GUSTAVSSON J, CEDERBETG C, SONESSON U, et al.Global Food Losses and Food Waste:Extent, Causes and Prevention[M].Food and Agriculture Organization of the United Nations,2011.
[2] SUN Q X, ZHAO X X, ZHANG C, et al.Ultrasound-assisted immersion freezing accelerates the freezing process and improves the quality of common carp (Cyprinus carpio) at different power levels[J].LWT, 2019, 108:106-112
[3] 谢菲菲. 电场辅助(超)冰温贮藏对生鲜肉品质的影响[D].宁夏大学, 2022.
XIE F F.Effects of electric field-assisted ice-temperature/supercooling storage on the quality of fresh meat[D].Ningxia University, 2022.
[4] LIN H X, HE X X, LIU C H, et al.Static magnetic field-assisted supercooling preservation enhances water-holding capacity of beef during subzero storage[J].Innovative Food Science and Emerging Technologies, 2022, 80:103106.
[5] 胡烨, 何建东, 王朋, 等.养殖大黄鱼冰点调节剂研制[J].中国食品学报,2013,13(1):51-60.
HU Y, HE J D, WANG P, et al.Development of freezing-point regulator for cultured Large Yellow Croaker[J].Journal of Chinese Institute of Food Science and Technology,2013,13(1):51-60.
[6] FUKUMA Y, YAMANE A, ITOH T, et al.Application of supercooling to long-term storage of fish meat[J].Fisheries science, 2012, 78(2):451-461.
[7] ZHU Z W, LI T A, SUN D W.Pressure-related cooling and freezing techniques for the food industry:Fundamentals and applications[J].Critical Reviews in Food Science and Nutrition, 2021, 61(17):2793-2808.
[8] RUBINSKY B, PEREZ P A, CARLSON M E.The thermodynamic principles of isochoric cryopreservation[J].Cryobiology, 2005, 50(2):121-138.
[9] NIDA S, MOSES J A, ANANDHARAMAKRISHNAN C.Isochoric freezing and its emerging applications in food preservation[J].Food Engineering Reviews, 2021, 13(4):812-821.
[10] PRECIADO J A, RUBINSKY B.Isochoric preservation:A novel characterization method[J].Cryobiology, 2010, 60(1):23-29.
[11] 罗江钊. 食品新冷冻概念可在减少能源使用的基础上提高质量与安全性[J].中国食品学报, 2021, 21(9):424-425.
LUO J Z.New food freezing concept improves quality and safety with reduced energy use[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):424-425.
[12] KIM K.New food freezing concept improves quality, increases safety and cuts energy use[EB].Agricultural Research Service, 2021-09-02.
[13] 秦晓玲, 朱栩量, 曹靖雯, 等.冰的氢键振动研究[J].物理学报, 2021, 70(14):108-128.
QIN X L, ZHU X L, CAO J W, et al.Investigation of hydrogen bond vibrations of ice[J].Acta Physica Sinica, 2021, 70(14):108-128
[14] 张博博, 孙钦, 许朝阳, 等.超冰温技术研究进展[J].保鲜与加工, 2020, 20(6):227-232.
ZHANG B B, SUN Q, XU Z Y, et al.Research advance on controlled supercooling-point technology[J].Storage and Process, 2020, 20(6):227-232.
[15] BE CHEA G A, C
CHEA G A, C MPEAN
MPEAN I, SCUTARU L M, et al.Freezing water simulations in isochoric systems-preliminary analysis[J].IOP Conference Series:Materials Science and Engineering, 2021, 1138(1):012003 (6pp).
I, SCUTARU L M, et al.Freezing water simulations in isochoric systems-preliminary analysis[J].IOP Conference Series:Materials Science and Engineering, 2021, 1138(1):012003 (6pp).
[16] PEREZ P A, PRECIADO J, CARLSON G, et al.The effect of undissolved air on isochoric freezing[J].Cryobiology, 2016, 72(3):225-231.
[17] POWELL-PALM M J, RUBINSKY B.A shift from the isobaric to the isochoric thermodynamic state can reduce energy consumption and augment temperature stability in frozen food storage[J].Journal of Food Engineering, 2019, 251:1-10.
[18] ZHAO Y H, POWELL-PALM M J, WANG J J, et al.Analysis of global energy savings in the frozen food industry made possible by transitioning from conventional isobaric freezing to isochoric freezing[J].Renewable and Sustainable Energy Reviews, 2021,151:111621.
[19] BE CHEA G A, C
CHEA G A, C MPEAN
MPEAN  I, T
I, T B
B CARU M B, et al.Glucose and glycerol temperature-pressure correlations for the design of cryopreservation protocols in an isochoric system at subfreezing temperature[J].Biochemical and Biophysical Research Communications, 2021, 559:42-47.
CARU M B, et al.Glucose and glycerol temperature-pressure correlations for the design of cryopreservation protocols in an isochoric system at subfreezing temperature[J].Biochemical and Biophysical Research Communications, 2021, 559:42-47.
[20] 弗兰克·鲁格纳尼, 赵国江.冰点以下温度保存生物物质的多相定容装置、系统和方法:中国, CN109964921A[P].2019-07-05.
RUGANANI F, ZHAO G J.Multiphase volumetric devices, systems and methods for the preservation of biological substances at sub-freezing temperatures:China, CN109964921A[P].2019-07-05.
[21] WAN L, POWELL-PALM M J, LEE C, et al.Preservation of rat hearts in subfreezing temperature isochoric conditions to -8 ℃ and 78 MPa[J].Biochemical and Biophysical Research Communications, 2018, 496(3):852-857.
[22] BILBAO-SAINZ C, SINROD A J G, WILLIAMS T, et al.Preservation of Tilapia (Oreochromis aureus) fillet by isochoric (constant volume) freezing[J].Journal of Aquatic Food Product Technology, 2020:1-12.
[23] BILBAO-SAINZ C, SINROD A J G, LAN D, Preservation of spinach by isochoric (constant volume) freezing[J].International Journal of Food Science &Technology, 2019, 55(5).
[24] ZHAO Y H, BILBAO-SAINZ C, WOOD D, et al.Effects of isochoric freezing conditions on cut potato quality[J].Foods, 2021, 10(5):974.
[25] CORREIA C, TAVARES E, LOPES C, et al.Stability of protein formulations at subzero temperatures by isochoric cooling[J].Journal of Pharmaceutical Sciences, 2020, 109(1):316-322.
[26] ROSA M, LOPES C, MELO E P, et al.Measuring and modeling hemoglobin aggregation below the freezing temperature[J].The Journal of Physical Chemistry B, 2013, 117(30):8939-8946.
[27] ZHAO Y H, POWELL-PALM M J, UKPAI G, et al.Phase change interface stability during isochoric solidification of an aqueous solution[J].Applied Physics Letters, 2020, 117(13):133701.
[28] N STASE G, LYU C N, UKPAI G, et al.Isochoric and isobaric freezing of fish muscle[J].Biochemical and Biophysical Research Communications, 2017, 485(2):279-283.
STASE G, LYU C N, UKPAI G, et al.Isochoric and isobaric freezing of fish muscle[J].Biochemical and Biophysical Research Communications, 2017, 485(2):279-283.
[29] LYU C, N STASE G, UKPAI G, et al.A comparison of freezing-damage during isochoric and isobaric freezing of the potato[J].Peerj, 2017, 5(5):e3322.
STASE G, UKPAI G, et al.A comparison of freezing-damage during isochoric and isobaric freezing of the potato[J].Peerj, 2017, 5(5):e3322.
[30] LI H, SUN X H, LIAO X J, et al.Control of pathogenic and spoilage bacteria in meat and meat products by high pressure:Challenges and future perspectives[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):3476-3500.
[31] PRECIADO J A.The fundamentals of isochoric freezing and its role in the cryopreservation of biological materials[D].Berkeley University of California, 2007.
[32] SALINAS-ALMAGUER S, ANGULO-SHERMAN A, SIERRA-VALDEZ F J, et al.Sterilization by cooling in isochoric conditions:The case of Escherichia coli[J].PLoS One, 2015, 10(10):e0140882.
[33] POWELL-PALM M J, PRECIADO J, LYU C N, et al.Escherichia coli viability in an isochoric system at subfreezing temperatures[J].Cryobiology, 2018, 85:17-24.
[34] BRIDGES D F, BILBAO-SAINZ C, POWELL-PALM M J, et al.Viability of Listeria monocytogenes and Salmonella Typhimurium after isochoric freezing[J].Journal of Food Safety, 2020,40(5):e12840.
[35] PRECIADO J, RUBINSKY B.The effect of isochoric freezing on mammalian cells in an extracellular phosphate buffered solution[J].Cryobiology, 2018,82:155-158.
[36] POWELL-PALM M J, ZHANG Y F, ARUDA J, et al.Isochoric conditions enable high subfreezing temperature pancreatic islet preservation without osmotic cryoprotective agents[J].Cryobiology, 2019, 86:130-133.
[37] CRISTINA B S, ZHAO Y H, GARY T, et al.Effect of isochoric freezing on quality aspects of minimally processed potatoes[J].Journal of Food Science, 2020, 85(9):2656-2664.
[38] BILBAO-SAINZ C, SINROD A, POWELL-PALM M J, et al.Preservation of sweet cherry by isochoric (constant volume) freezing[J].Innovative Food Science and Emerging Technologies, 2019, 52:108-115.
[39] BILBAO-SAINZ C, SINROD A J G, DAO L, et al.Preservation of grape tomato by isochoric freezing[J].Food Research International, 2021, 143(3):110228.
[40] BILBAO-SAINZ C, CHIOU B S, TAKEOKA G, et al.Isochoric freezing and isochoric supercooling as innovative postharvest technologies for pomegranate preservation[J].Postharvest Biology and Technology, 2022, 194:112072.
[41] RINWI T G, SUN D W, MA J, et al.Effects of isochoric freezing on freezing process and quality attributes of chicken breast meat[J].Food Chemistry, 2023,405:134732.