花色苷是一类天然水溶性色素,广泛存在于植物的花、果实、茎和叶等组织的细胞液中,使其呈现由红、紫红到蓝等不同颜色。花色苷是具有2-苯基苯并吡喃结构的一类糖苷衍生物,在葡萄、蓝莓、黑枸杞、红甘蓝等果蔬中含量尤为丰富。研究表明,花色苷具有抗氧化、抑制细胞凋亡、抗炎、保护心血管[1-2]、预防近视、维持肠道菌群多样性等功能[3-4],并可显著增强机体免疫力,从而提升机体应对病原菌和病毒侵袭时的抗病能力,保障身体健康[5]。由于天然花色苷安全无毒、着色效果佳且有益健康,已广泛应用于食品、药品及化妆品等行业。
我国果蔬资源丰富,2021年水果和蔬菜产量分别高达2.87亿t和7.82亿t,均居世界首位。目前,我国大宗果蔬副产物的综合精深加工利用率仍然不高,这不但造成环境污染,而且严重浪费宝贵资源,果蔬副产物的高效综合利用已成为困扰果蔬加工企业的突出难题。而蓝莓、黑莓、葡萄、越橘、黑枸杞、红甘蓝等果蔬副产物是天然花色苷提取的优质原料。但果蔬花色苷在提取过程中稳定性较差,易受光照、温度、pH值、氧气、金属离子和酶等因素影响,导致其生物活性丧失和褪色。因此,果蔬花色苷的绿色高效提取、结构稳定修饰及其生理活性是当前研究的热点。本文就不同果蔬中花色苷结构特征、合成途径、提取方法及其功能活性进行了综述,为进一步研究花色苷的结构稳定性、生理功能和代谢机理以及为其在食品(保健品)配料中的应用提供借鉴。
1 果蔬花色苷的理化特性
1.1 花色苷的结构
花色苷是自然界中广泛存在于植物中的水溶性色素,据统计,27个科,73个属的500多种植物含有花色苷,赋予果蔬红色、粉红、蓝色、紫色等五彩缤纷的颜色。花色苷是花青素母核和糖基通过糖苷键结合形成,属于类黄酮化合物。花青素基本碳骨架为C6—C3—C6,两个芳香环A 和 B由一个含氧六元杂环C隔开,是2-苯基苯并吡喃阳离子的多羟基和多甲氧基衍生物,其结构如图1所示[4]。
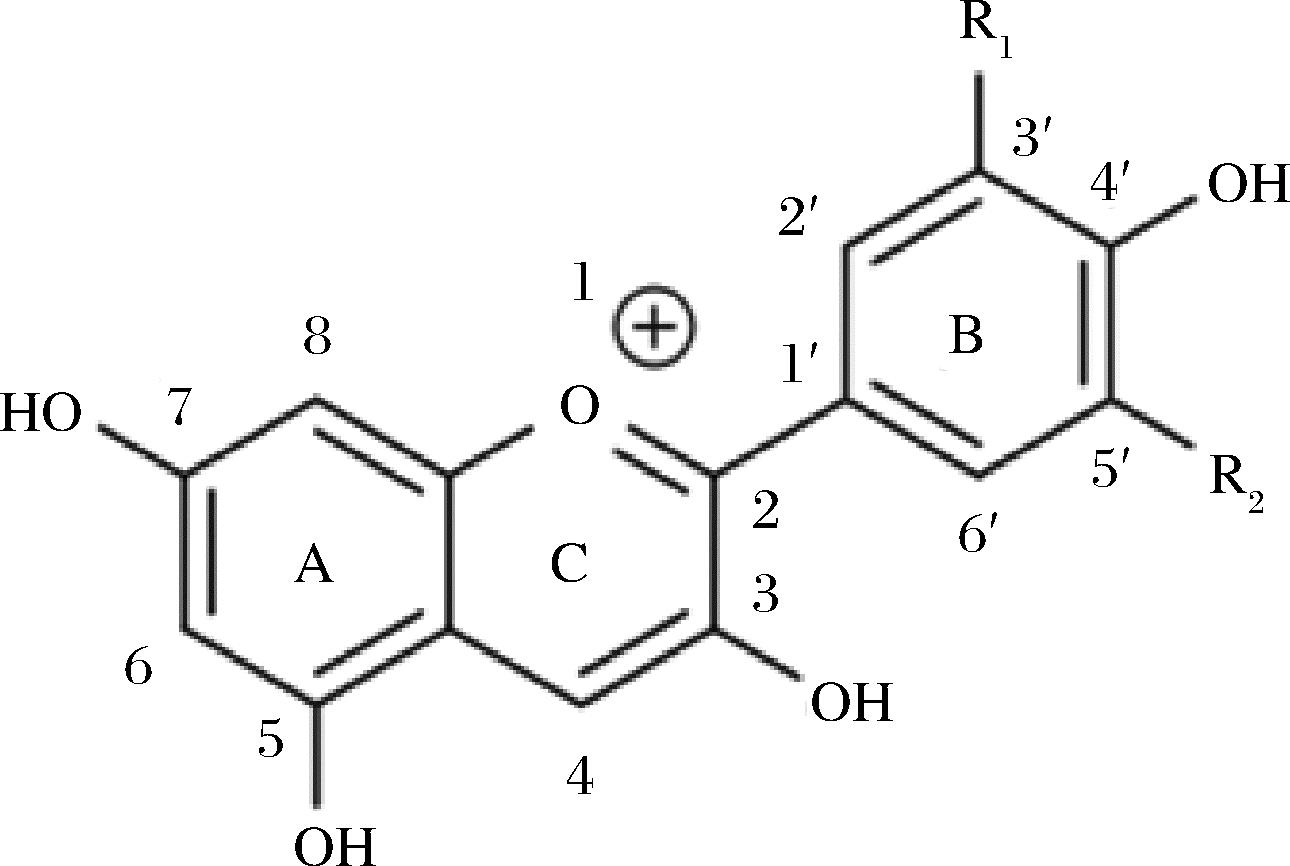
图1 花色苷的基本结构
Fig.1 The general structure of anthocyanins
目前,从植物中发现的花色苷种类超过500 种,果蔬中最常见的花色苷有矢车菊素(50%)、飞燕草素(12%)、芍药色素(12%)、天竺葵色素(12%)、牵牛花色素(7%)以及锦葵色素(7%)[5],6种花色苷取代基位置见表1。与花青素结合的糖基主要有葡萄糖、半乳糖、阿拉伯糖、木糖、鼠李糖、芸香糖、槐糖等,通过糖苷键在C3、C5、C7、C3′和C5′位点与花青素相连,其中矢车菊素-3-葡萄糖苷在自然界中分布最广。花色苷结构上的差异决定了其生物学性状和功能的多样性[6]。由于花色苷具有共轭结构,在紫外光区和可见光区都有显著吸收,最大吸收波长范围分别为270~280 nm和520~550 nm。羟基或甲氧基在B环上的取代会影响花色苷的最大吸光度,B环上的羟基取代越多,花色苷在可见光范围内的最大吸收就越大。B环上邻位和对位羟基的存在会促进更长波长光的吸收和红移[7]。
目前对花色苷结构的研究主要采用质谱、高效液相色谱、紫外-可见光谱、核磁共振、离子迁移谱以及液相色谱-质谱联用等技术[4,8]。果蔬花色苷的糖基位于C环的3号位点和A环的5号位点,不同果蔬来源的花色苷种类也有差异,表2总结了不同来源花色苷的结构及其鉴定技术。
表1 常见果蔬花色苷取代基及呈色特征
Table 1 The substituents and chromatic features of common anthocyanins
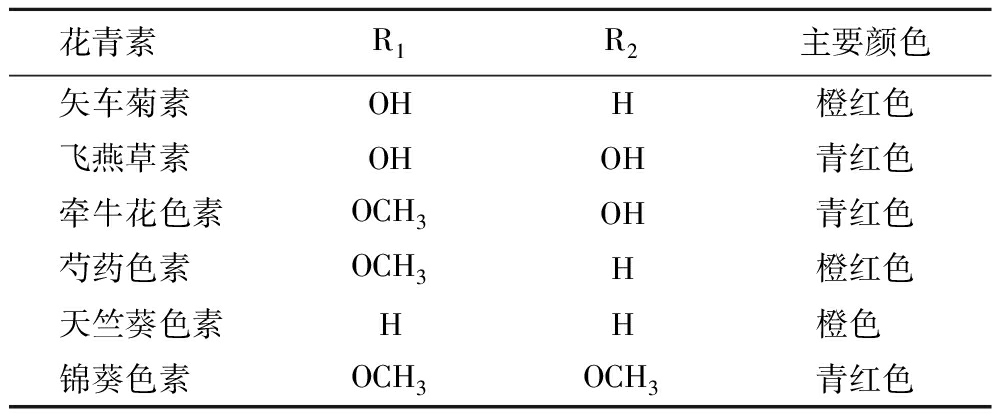
花青素 R1R2主要颜色矢车菊素 OHH橙红色飞燕草素 OHOH青红色牵牛花色素OCH3OH青红色芍药色素 OCH3H橙红色天竺葵色素HH橙色 锦葵色素 OCH3OCH3青红色
1.2 花色苷的合成
在果蔬植物中花色苷的生物合成可分为3个阶段:苯丙烷代谢、类黄酮代谢和花色苷合成修饰[9],合成不同种类的花色苷,整个过程需要在多种酶的参与下完成,具体途径见图2。
表2 常见果蔬花色苷的结构及含量
Table 2 Structure and content of common anthocyanins in fruits and vegetables

果蔬品种产地提取方法提取介质器官/组织主要花色苷结构含量鉴定方法参考文献紫叶李子Prunus cerasiferavar.atropurpurea中国西安超声甲醇[0.1%(体积分数)盐酸]叶子矢车菊素-3-O-半乳糖苷矢车菊素-3-O-葡萄糖苷矢车菊素-3-O-芸香糖苷54.5%32.2%11.2%HPLC-DAD/ESI-MS[10]番茄靛蓝玫瑰中国广东浸提甲醇/甲酸(9∶1,体积比)果皮芍药素-3-(反式-对-香豆酰基)-芸香糖苷-5-葡萄糖苷(2.73±0.25) mg/kgUPLC-QTOF-MS[11]草莓/土耳其埃拉齐格浸提酸化甲醇果实矢车菊素-3-O-葡萄糖苷天竺葵素-3-O-葡萄糖苷(4.2±0.5) mg/kg(50±7.5) mg/kgHPLC-ESI-MS[12]菊苣ChioggiaRosa di GoriziaRosa di VeronaTreviso PrecoceTreviso Tardivo意大利威尼托浸提甲醇/甲酸(99∶1,体积比)叶子矢车菊素-3-O-(6″-O-丙二酰基)-葡萄糖苷(511.5±235) mg/kg鲜重(260.5±71) mg/kg鲜重(37.7±8) mg/kg鲜重(338.2±80) mg/kg鲜重(168.7±55) mg/kg鲜重HPLC-UV/DAD 和 HPLC-MS/MS[13]覆盆子//低共熔溶剂/超声氯化胆碱/1,4-丁二醇(1∶3,摩尔比)果实矢车菊素-3-葡萄糖苷矢车菊素-3-芸香糖苷(1.378±0.009) mg/gUV-Vis、HPLC-ESI-MS/MS、NMR[14]葡萄//酶/超声果胶酶果皮果肉飞燕草素-3,5-O-二葡萄糖苷矢车菊素-3-O-芸香糖苷锦葵色素-3-(反式-对-香豆酰基)-芸香糖苷-5-葡萄糖苷芍药素-3-(反式-对-香豆酰基)-芸香糖苷-5-葡萄糖苷(3.01±0.04) mg/g(0.57±0.04) mg/kg(8.40±0.93) mg/kgHPLC-MS/MS[15]蓝莓/中国哈尔滨微波乙醇[60%(体积分数)盐酸]果实矢车菊素飞燕草素973.2 mg/kg554.1 mg/kgHPLC[16]蓝靛果Lonicera caerulea奥地利超临界CO2酸化乙醇果实矢车菊素芍药素天竺葵素(9.0±0.6) mg/g(0.52±0.03) mg/g(0.11±0.01) mg/gHPLC[17]食用菜椰Euterpe edulis Mart.巴西超临界CO2酸化乙醇果皮和果肉矢车菊素-3-葡萄糖苷矢车菊素-3-芸香糖苷芍药素-3-葡萄糖苷芍药素-3-芸香糖苷0.865±0.0055.243±0.0060.034±0.0000.069±0.001UPLC-QTOF-MS[18]
注:HPLC-DAD/ESI-MS,高效液相色谱-二极管阵列检测器/电喷雾质谱(high-pressure liquid chromatography-diode-array detector/electrospray ionization-mass spectrometry);UPLC-QTOF-MS,超高效液相色谱-串联四极杆飞行时间质谱(ultra performance liquid chromatography-quadrupole time of flight-mass spectrometry);HPLC-ESI-MS,高效液相色谱-电子喷雾电离质谱法(high performance liquid chromatography-electrospray ionization-mass spectrometry);HPLC-UV/DAD,高效液相色谱-紫外二极管阵列检测器(high performance liquid chromatography-ultraviolet/diode array detector );UV-Vis,紫外可见分光光度计(ultraviolet-visible spectrophotometer);NMR,核磁共振(nuclear magnetic resonance)。

图2 花色苷的生物合成途径
Fig.2 Biosynthesis pathway of anthocyanins
注:PAL,phenylalanine ammonia-lyase,苯丙氨酸解氨酶;C4H,cinnamate 4-hydroxylase,肉桂酸-4-羟化酶;4CL,para-coumaroyl:CoA ligase,4-香豆酸辅 酶A连接酶;MT,methyltransferases,甲基转移酶;UFGT,UPD-glucose flavonoid 3-O-glucosyl transferase,UDP-葡萄糖类黄酮3-O-葡萄糖基转移酶。
在第一阶段,苯丙氨酸经苯丙氨酸解氨酶、肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶的一系列酶促反应,合成4-香豆酰辅酶A。
在第二阶段,4-香豆酰辅酶A与3分子的丙二酰辅酶A在查耳酮合酶的作用下发生缩合,生成柚皮素查尔酮(四羟基查耳酮),然后经查耳酮异构酶催化生成柚皮素,之后在黄烷酮3-羟化酶催化下生成二氢黄酮醇,其在类黄酮-3′-羟化酶或类黄酮-3′,5′-羟化酶的作用下分别可生成二氢槲皮素或二氢杨梅素。在第三阶段,以上一阶段生成的3种二氢黄酮醇为底物,在黄烷酮醇-4-还原酶的催化下生成3种无色花色苷,再在花青素合成酶的催化作用下生成有色的矢车菊素、天竺葵色素和飞燕草素。矢车菊素和飞燕草素在O-甲基转移酶的催化下,又可生成芍药色素、牵牛花色素和锦葵色素,最后在UDP-葡萄糖类黄酮3-O-葡萄糖基转移酶的作用下与葡萄糖以糖苷键的形式连接生成6种花色苷,即芍药素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷、飞燕草素-3-葡萄糖苷、矮牵牛花色素-3-葡萄糖苷以及锦葵色素-3-葡萄糖苷[19]。大多数花青苷合成酶松散地结合在内质网上,但合成终产物花色苷可以通过囊泡运输以及谷胱甘肽S-转移酶、多药及毒物外排转运蛋白输送到果蔬细胞的液泡中[20]。
1.3 花色苷的性质
花色苷具有数个活性羟基和带正离子的母核,易溶于水、甲醇、乙醇、乙酸等极性溶剂,不溶于苯、石油醚、乙醚等非极性溶剂。花色苷的多羟基结构使其不稳定,羟基越多稳定性越差,花色苷糖基上羟基酰化和游离羟基的糖苷化可以提高花色苷的稳定性[21-22]。花色苷具有高度pH敏感性,在不同pH值下花色苷在4种不同结构(图3)之间处于动态平衡,且动态平衡会随pH值的变化而发生改变[23]。当pH值为1~2时,花色苷主要以红色的黄烊盐阳离子形式存在;当pH值为4~5时,以无色的甲醇假碱形式存在;当pH值为6~6.5时,以蓝色的醌型碱形式存在;当pH>7时,以淡黄色的查尔酮形式存在。加工或贮藏过程中的环境因素也会影响花色苷的稳定性,如温度、光、氧、酶、抗坏血酸、金属离子、氨基酸、二氧化硫、酚酸、糖及其降解产物等[24]。花色苷单体类型不同,其符合的降解动力学级别也不同,花色苷降解在多数情况下符合一级动力学,但无氧或含氧化剂等条件下,花色苷降解符合零级或二级动力学[25]。
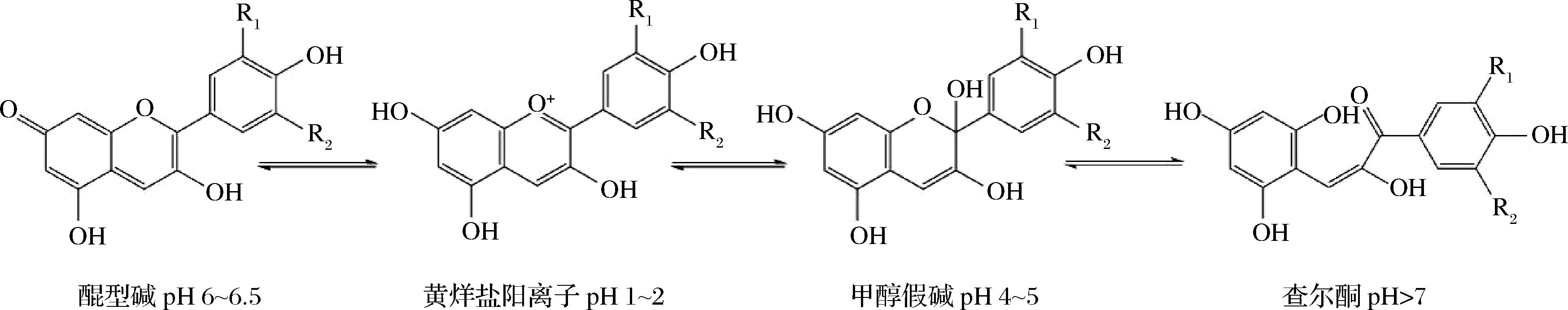
图3 不同pH条件下花色苷的主要存在形式
Fig.3 Main forms of anthocyanins in different pH conditions
2 果蔬花色苷的提取工艺
目前,果蔬花色苷提取方法主要有溶剂浸提、超声波辅助提取、微波辅助提取、超临界流体提取、酶提取以及低共熔溶剂提取等,对常见果蔬花色苷提取方法及提取含量进行了汇总(表2),并对不同果蔬花色苷提取技术的优缺点进行比较(表3)。
2.1 溶剂浸提法
浸提法的原理是“相似相溶”,通过所提活性成分与其余组分在溶剂中的溶解度差异来分离目标产物,具有简单、成本低廉的优点,但也存在提取效率低和环境不友好等缺点[26]。对于果蔬花色苷来说,常用水、甲醇、乙醇、丙酮和乙腈等溶剂结合酸化剂进行提取。BARNES等[27]对比了不同提取溶剂(甲醇、乙醇、丙醇、异丙醇、乙腈)和不同酸化剂(三氟乙酸、盐酸、甲酸、乙酸)对蓝莓花色苷提取的影响,发现V(甲醇)∶V(水)∶V(三氟乙酸)=70∶30∶1为提取剂时,总花色苷含量最高。CHANDRASEKHAR等[28]也对比了甲醇、酸化甲醇、丙酮和70%(体积分数)丙酮水溶液等溶剂对红甘蓝花色苷的提取,确定在50%(体积分数)乙醇和酸化水作为提取剂,花色苷含量最高,达到390.6 mg/L。与前两者不同的是,NISTOR等[29]不仅对比了4种不同的酸化溶剂(甲醇、乙醇、丙酮、水)对北美沙果(Aronia melanocarpa)果实和黑胡萝卜(Daucus carota sp.)根花色苷的提取率,而且还测定了提取物的抗氧化活性,发现乙醇和甲醇提取时,花色苷表现出最高的提取率和抗氧化活性。溶剂浸提法是传统植物活性物质提取产业化应用最广泛的方法,但其耗时长,甲醇、乙醇等溶剂残留危害人体健康,且易造成污染环境问题,因此未来需寻找绿色环保溶剂,同时与其他物理场联用提高提取效率。
表3 不同果蔬花色苷提取方法的对比
Table 3 Comparison of different extraction methods of anthocyanins from fruits and vegetables

提取方法优点缺点发展方向溶剂浸提法操作简单、成本低提取效率低、溶剂残留、不环保绿色溶剂替代有机溶剂超声波辅助提取法耗时短、节约溶剂、提取率高工业化设备制作难度大、成本高,功率过高时破坏花色苷成分解决提取罐周壁超声空白区问题微波辅助提取法效率高、溶剂使用少、易控制温度升高花色苷易降解精准控温,减少花色苷的损失超临界流体提取法绿色、无残留、可工业应用设备小、成本高设备大型化、超临界逆流萃取和分流萃取提高纯度酶辅助提取法反应条件温和、提取率高、环保节能提取条件要求高与物理场技术联用提高效率低共熔溶剂提取法易制备、环保提取物回收困难溶剂回收简易化
2.2 超声波辅助提取法
花色苷属于果蔬胞内次生代谢物,果蔬花色苷的高效提取需要重点突破细胞壁的屏障。超声波辅助提取主要是利用超声波的空化现象、机械效应以及热效应高效破坏植物细胞壁,大大提高提取溶剂的穿透能力,促进胞内产物的释放、扩散和溶解,具有提取时间短、溶剂少、提取率高、绿色环保、不破坏活性成分等优点[30]。对于不同的果蔬原料和提取溶剂而言,最佳的超声辅助提取条件也有不同差异。WU等[31]以62%(体积分数)乙醇为提取溶剂,超声提取芡实叶中花色苷,响应面优化最佳工艺参数为超声功率300 W,提取温度40 ℃,提取时间38 min,料液比1∶27(g∶mL),提取量为(2.816±0.030) mg/g。LIU等[32]采用超声辅助乙醇提取苹果(‘Royalty’)花色苷,获得的最佳超声功率也为300 W,提取温度为20 ℃,提取时间为20 min,料液比为1∶6(g∶mL),提取量为(2.065±0.015) mg/g。而XUE等[14]采用超声辅助低共熔溶剂提取覆盆子花色苷,结果表明超声功率210 W,提取温度51 ℃,提取时间32 min,料液比1∶20(g∶mL)时,花色苷的提取量最高,可达(1.378±0.009) mg/g。超声辅助提取耗时短,提取率更高,但其工业化大罐提取时存在的罐周壁超声空白区及设备制作难度大、成本高等问题,限制其大规模的产业化应用,未来可在多物理场协同提取方面开展相关研究。
2.3 微波辅助提取法
微波辅助提取的基本原理是细胞内极性物质尤其是水分子吸收微波能,细胞内温度急剧上升,液态水汽化产生巨大压力使细胞膜和细胞壁形成裂纹或微小孔洞,从而使提取溶剂更容易进入细胞内,溶解并释放出胞内物质[33]。此方法具有提取效率高、溶剂消耗量低、易于控制等特点[34]。但微波能会引起溶剂体系升温,所以在利用微波辅助提取果蔬花色苷时要注意微波功率和微波时间参数的设定[6]。刘雪可等[35]采用不同方法提取蓝靛果果渣中的花色苷,发现与常温乙醇浸提相比,微波辅助提取法的花色苷得率提高了78.1%,达233.4 mg/100 g。值得一提的是,为解决容器中的高温导致花色苷降解的问题,LIU等[16]开发了分段式可变功率微波提取蓝莓粉花色苷,其最佳提取参数为:第一阶段微波功率800 W,温度36 ℃,第二阶段微波功率280 W,花色苷提取率最高可达84.82%,比恒功率微波提取法高17.75%。尽管微波辅助提取法的效率较高,但其不适于热敏化合物花色苷的提取回收,为进一步扩大其应用范围,未来可开发真空微波辅助提取技术,通过真空降低溶剂沸点,在较低温度下更利于花色苷的提取。
2.4 超临界流体萃取法
超临界流体萃取法是一种新型绿色的提取方法,超临界流体是介于气液两相间的特殊流体,具有类似于气体的强穿透力和类似于液体的高密度和溶解度,实践中常选用二氧化碳作为超临界流体[36]。超临界流体萃取具有较高的选择性,无萃取剂残留,环境友好,可大规模工业应用等特点,但该方法设备、启动和运行成本高[37]。目前,超临界流体萃取法已被广泛应用于果蔬生物碱、酚类化合物、花色苷、类黄酮、类胡萝卜素、皂苷和油等化合物的提取[38]。田密霞等[39]利用超临界CO2萃取蓝莓花色苷,响应面法优化确定最佳工艺为萃取时间60 min,萃取温度40 ℃,萃取压力28 MPa,液料比为7∶1(mL∶g),花色苷含量为1.58 mg/g。超临界流体萃取虽然没有溶剂残留问题,但其运行过程能耗较高,未来研究可集中在设备大型化、超临界逆流萃取和分流萃取提高花色苷纯度方面。
2.5 酶辅助提取法
酶法提取基本原理是以专一性催化的酶水解植物细胞壁,从而使细胞内花色苷等活性成分释放,具有能耗低、速率快、产量高、提取物回收简单等特点[40]。目前,常用的酶制剂有纤维素酶、半纤维素酶、淀粉酶、果胶酶等[41]。SWER等[42]采用酶和溶剂浸提2种方法提取李子花色苷,结果发现纤维素酶辅助提取得到的花色苷的温度、pH和光稳定性要优于常规溶剂提取的;而就抗氧化性而言,溶剂提取法获得的蓝莓花色苷抗氧化性比酶提取的更强[43]。JOSÉ AILA O GONZ
O GONZ LEZ等[44]利用响应面法分别优化了黑加仑花色苷的超声辅助提取和酶辅助提取的工艺参数,在提取效率相同的情况下,超声辅助提取较酶辅助提取速率更快,时间更短。酶辅助提取法更安全、更快捷,但酶作用最适pH、温度等条件限制了其广泛的应用,未来可将酶辅助提取与物理场联合应用,提高花色苷工业化提取效率。
LEZ等[44]利用响应面法分别优化了黑加仑花色苷的超声辅助提取和酶辅助提取的工艺参数,在提取效率相同的情况下,超声辅助提取较酶辅助提取速率更快,时间更短。酶辅助提取法更安全、更快捷,但酶作用最适pH、温度等条件限制了其广泛的应用,未来可将酶辅助提取与物理场联合应用,提高花色苷工业化提取效率。
2.6 低共熔溶剂提取法
低共熔溶剂(deep eutectic solvents,DES)是由氢键受体(hydrogen bond acceptor,HBA)和氢键供体(hydrogen bond donor,HBD)通过图4[45]所示的氢键作用形成共晶混合物,其熔点低、热稳定性高且环境友好[46],成为一种可替代有机试剂的新型绿色溶剂。DES提取通过氢键与目标化合物直接作用或与细胞壁纤维素分子链间接作用以溶解细胞壁,从而提高提取效果[47-48]。BI等[49]发现6种DES提取桑葚花色苷均高于酸化乙醇提取,其中,氯化胆碱-乳酸(1∶2,摩尔比)提取率最高;通过响应面法优化最佳工艺为提取温度57 ℃,时间32 min,料液比1∶11(g∶mL),此条件下花色苷含量为(6.84±0.21) mg/g。ZANNOU等[50]采用16种DES提取黑莓花色苷,发现氯化胆碱-乙酸(1∶2,摩尔比)提取的总花色苷含量最高。FU等[51]选用6种DES对蓝莓果渣中的花色苷进行提取,结果表明氯化胆碱-草酸提取物中总花色苷含量最高。大量研究结果表明,有机酸作氢键供体时花色苷的提取效率更高。DES制备工艺简单、成本低廉,但DES回收较为困难,且操作较复杂。从产业化应用的角度出发,未来应深入探索分离过程的机理及传质规律,开发适合低共熔溶剂回收利用的工艺流程。
综上,溶剂浸提法产业化应用广泛,但仍存在提取效率低、溶剂残留、污染环境等问题;超声、微波等物理场辅助提取可以有效缩短提取时间,但花色苷结构易破坏且其工业化设备与技术还需不断改进;酶辅助提取安全性高,但酶法提取需要在特定条件下进行;超临界流体和DES是传统有机溶剂的较好替代品,已成为目前的研究热点。这两种方法绿色环保,符合可持续发展的原则,在果蔬花色苷的提取方面具有较好的发展前景。未来超临界流体萃取仪器将朝着设备大型化、超临界逆流萃取和分流萃取提高物质纯度方向发展,DES技术需进一步优化设备及工艺,并开发更简易的DES回收方法。
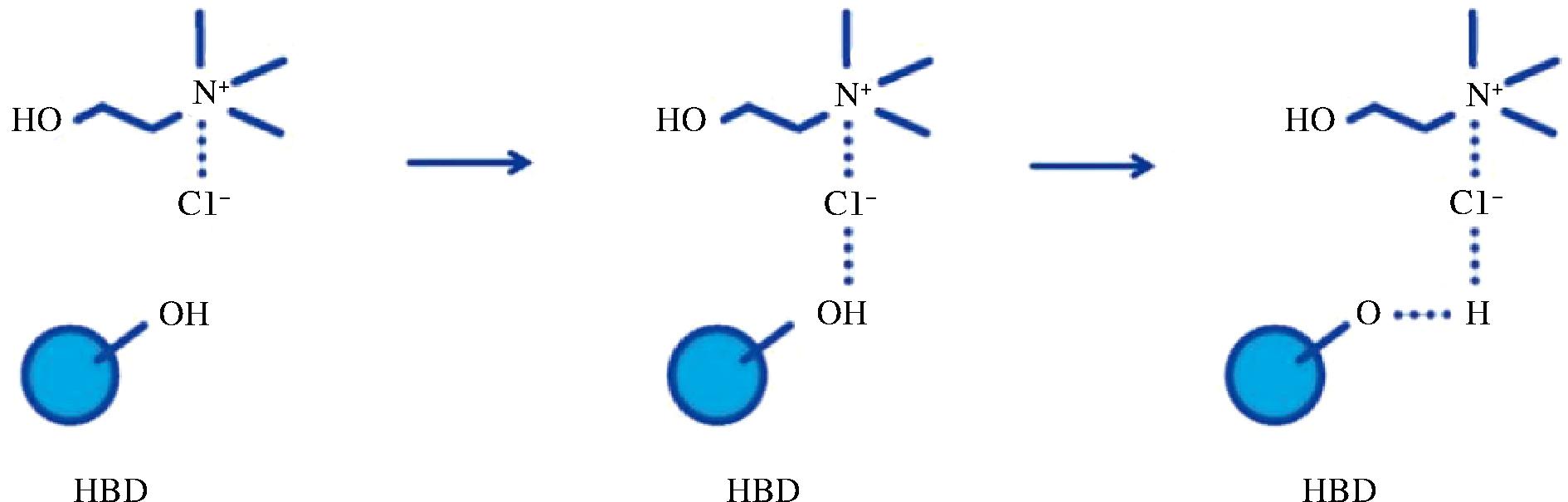
图4 氢键受体(氯化胆碱)与氢键供体之间的相互作用
Fig.4 Interaction between hydrogen bond acceptor (choline chloride) and hydrogen bond donor
3 果蔬花色苷的功能活性
果蔬花色苷的功能活性与其多酚羟基结构密切相关,通过自身氧化释放电子,直接清除自由基。目前研究人员已通过体外实验、动物模型以及双盲实验等方法证明了花色苷的抗氧化、改善心血管健康、保护视力、预防肥胖、保护神经以及抗肿瘤等生理功能(表4)。
表4 果蔬花色苷的功能活性
Table 4 Functional activity of anthocyanins in fruits and vegetables

果蔬品种器官/组织提取溶剂研究模型功能活性主要结果参考文献蓝莓patriot果实60%(体积分数)酸性乙醇抗油脂氧化,还原力,羟自由基、超氧阴离子、DPPH自由基清除能力测定抗氧化脂质体过氧化抑制率达90%以上铁还原力当量浓度:3.259 mg/mL羟自由基IC50值:0.23 mg/mL花色苷质量浓度为80 mg/mL时:超氧阴离子、DPPH自由基清除率达到80%[43]黑果腺肋花楸富康源1号果实60%(体积分数)酸性乙醇DPPH自由基、ABTS阳离子自由基清除能力测定、FRAP测定抗氧化花色苷质量浓度为100 μg/mL时:DPPH自由基清除率达到99.09%ABTS阳离子自由基清除能力相当于2.5倍的TroloxFRAP相当于2.5倍的Trolox[52]嘉宝果Myrciaria caulifloraBerg.果皮74%(体积分数)乙醇ABTS阳离子自由基清除能力测定抗氧化(1 600±143) μmol TE/g[53]黑树莓Rubus spp果肉氯化胆碱/柠檬酸(摩尔比1∶2)酒石酸/木糖醇(摩尔比1∶2)醋酸/山梨醇(摩尔比1∶2)DPPH自由基清除能力测定FRAP测定铁螯合活性测定抗氧化(68.77±2.29) mmol TE/g(83.08±3.78) mmol ISE/g(4 687.67±83.58) mg TE/100 g[50]红甘蓝樱桃/酸樱桃果肉42%(体积分数)酸性乙醇40%(体积分数)酸性乙醇ABTS阳离子自由基清除能力测定抗氧化(41.27±0.24) mmol Troloks/mL(106.80±0.71) mmol Troloks/mL[54]蓝莓黑醋栗Vaccinium myrtillusRibes nigrum果实/31名高血压前期成年男性双盲实验改善心血管健康花色苷治疗后高密度脂蛋白胆固醇含量显著升高(P=0.043)[55]越橘Vaccinium myrtillus L.果肉乙醇载脂蛋白E缺乏小鼠改善心血管健康显著抑制动脉粥样硬化斑块的发展[56]越橘Vaccinium myrtillus L.果肉/人结肠直肠腺癌细胞Caco-2细胞改善心血管健康显著降低胆固醇吸收基因的表达显著上调胆固醇的顶端转运蛋白[57]蓝莓Vacciniun spp.果实无水甲醇复制衰老和光诱导损伤的体外细胞模型保护视觉将过度表达的血管内皮生长因子下调到正常水平以保护细胞免受光诱导的损伤[58]越橘Vaccinium myrtillus L.果实/小鼠光感受器细胞保护视觉调节转录因子4的活化和抑制S-视蛋白的异常聚集[59]蓝莓Vacciniun spp.果实酸化无水甲醇[1%(体积分数)盐酸]视网膜色素上皮细胞体外模型保护视觉阻止衰老相关酶和血管内皮生长因子的过表达[60]
续表4

果蔬品种器官/组织提取溶剂研究模型功能活性主要结果参考文献樱桃甜樱桃果实/C57BL/6小鼠模型预防肥胖40 mg/kg花色苷可使体重减轻5.2%脂肪细胞变小,瘦素分泌[61]紫色玉米Zea Mays L.果实/C57BL/6小模型预防肥胖诱导肝单磷酸腺苷活化蛋白激酶活化导致脂肪酸合酶减少和脂肪酸氧化增加[62]樱桃/果实含0.1 mol/L盐酸的乙醇细胞脂肪沉积模型预防肥胖促进细胞自噬体形成下调脂肪酸合成相关蛋白的表达[63]葡萄/果皮/Wistar大鼠模型保护神经防止脑室注射-链脲霉素诱导的记忆缺陷恢复大脑皮层和海马体的乙酰胆碱酯酶活性[64]黑果腺肋花楸black chokeberry(Aronia melanocarpa)果实65%(体积分数)酸化乙醇SD大模型保护神经保护海马体中的细胞免受不溶性淀粉样蛋白β毒性[65]黑树莓Rubus occidentalis果实/C57BL/6 J小鼠模型抗肿瘤下调肿瘤发生相关基因的表达[66]苹果Malus ‘Royalty’果实50%~70%(体积分数)酸化乙醇对BGC-803胃癌细胞的抑制作用抗肿瘤对BGC-803胃癌细胞具有明显的抑制作用, IC50值:105.5 μg/mL[32]蓝靛果忍冬‘Beilei’果实70%(体积分数)乙醇体外人肝癌细胞(SMMC-7721)体内小鼠肝癌细胞(H22)抗肿瘤体外:导致细胞凋亡体内:抑制促炎因子表达[67]
注:Trolox:具有抗氧化性的水溶性维生素E;TE,Trolox当量(trolox equivalent); FRAP,Fe3+还原能力(Fe3+ reducing ability);ISE,FeSO4当量(FeSO4 equivalent)。
3.1 抗氧化活性
机体内的自由基会损坏细胞的结构与功能,诱导机体氧化应激。花色苷因结构中含有大量酚羟基,具有较强还原性,可与体内自由基反应,使细胞免受氧化损伤,延缓机体衰老。果蔬花色苷的抗氧化性已经通过大量的DPPH、ABTS阳离子等体外自由基清除能力试验得到证实。LI等[43]分析了不同提取方法(溶剂、酶、超声)获得的蓝莓花色苷抗氧化性的差异,发现3种方法提取的花色苷在体外均能有效清除清除羟自由基、超氧阴离子和DPPH自由基并具有油脂抗氧化活性和还原力,其中溶剂提取法获得的蓝莓花色苷抗氧化活性最强,其脂质体过氧化抑制率达90%以上,铁还原力当量质量浓度为3.259 mg/mL,羟自由基半数抑制浓度为0.23 mg/mL,花色苷质量浓度为80 mg/mL时,其超氧阴离子、DPPH自由基清除率达到80%,这是由于前者提取的花色苷含量高于后两者所致。位路路等[52]对超声波辅助提取得到的黑果腺肋花楸花色苷抗氧化活性进行了评价,观察到黑果腺肋花楸花色苷对DPPH自由基和ABTS阳离子自由基具有明显的清除能力,当花色苷质量浓度为100 μg/mL时,其DPPH自由基清除率高达99.09%,ABTS阳离子自由基清除能力相当于2.5倍的Trolox,对还原Fe3+的能力相当于2.5倍的Trolox。值得注意的是,黑果腺肋花楸花色苷的抗氧化性是维生素C的2~4倍。有研究表明花色苷的抗氧化活性优于维生素C,可增强人体免疫系统功能,因此,花色苷具有被开发为新型抗氧化剂的潜力。目前关于花色苷抗氧化研究多采用花色苷混合提取物,未来可针对具体单一花色苷开展抗氧化调控通路及代谢物的鉴定和跟踪研究,同时还可以开展花色苷体内生物利用度研究,确定维持花色苷在体内抗氧化功能的确切剂量和递送机制。
3.2 改善心血管健康活性
在全球范围内心血管疾病依旧是死亡率很高的一类疾病,花色苷可通过改善血脂分布、增加高密度脂蛋白-胆固醇含量,减少低密度脂蛋白-胆固醇、甘油三酯和促炎因子的含量以及降低收缩压和舒张压来预防心血管疾病[68-69]。MAURAY等[56]研究发现在饮食中补充富含越橘花色苷的提取物(包括发酵后的)或花色苷化合物可减少小鼠主动脉粥样硬化病变的形成并延缓小鼠动脉粥样硬化的发展,表明越橘花色苷可降低患心血管疾病的风险。除使用小鼠模型外,HONG等[57]以人结肠直肠腺癌细胞Caco-2细胞为作用对象,研究越橘花色苷对其胆固醇代谢的影响,发现其可显著降低胆固醇吸收基因的表达并上调胆固醇顶端转运蛋白,说明越橘花色苷具有预防高胆固醇血症的潜力。近年来研究发现,花色苷与其他活性物质混合使用可以预防心脑血管疾病。DI PIETRO等[70]研究发现一种新型高负荷ω-3赖氨酸复合物与矢车菊素-3-O-半乳糖苷、飞燕草素-3-O-阿拉伯糖苷等组合使用可以进一步增强该复合物的血管保护特性。总而言之,花色苷可能通过其对细胞抗氧化和炎症的影响来预防动脉粥样硬化和心血管疾病,然而,其潜在作用机制相对较复杂,仍需要进一步研究阐明。抗氧化防御酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)在临床模型中上调,虽然大多数证据表明增加抗氧化酶的活性可提高保护作用,但临床实验的结果好坏参半,未来的临床试验应增加花色苷浓度,以提高花色苷的功效。同时,现有研究表明从果蔬发酵物中提取出的花色苷具有更有效的抗动脉粥样硬化活性,未来可通过发酵等方式改善花色苷的结构和稳定性。
3.3 保护视觉活性
现代社会人们长时间使用电子产品致使用眼过度,开发预防视网膜损伤的高效天然化合物已成迫切需求。研究表明,花色苷具有保护视觉功效,具体机制包括增强视网膜色素水平,调节视网膜酶活性,通过抗氧化保护视网膜细胞,增加视网膜内的循环以及减少黄斑变性等[71-72]。LI等[73]的研究对已有的机制进行了补充,将花色苷的视力保护作用与小分子核糖核酸的功能联系起来,发现矢车菊素-3-O-葡萄糖苷的治疗不仅保护了角膜上皮细胞免受脂多糖诱导的疾病,而且还抑制了调节人类视觉系统中HMGA2/PI3K/Akt通路的活性,提高了角膜上皮细胞对细菌感染的抗性。LIU等[58]采用蓝莓花色苷提取物处理视网膜色素上皮细胞,发现花色苷提取物通过抑制衰老、细胞凋亡及下调过度表达的血管内皮生长因子至正常水平来保护视网膜色素上皮细胞免受光诱导的损伤,因此蓝莓花色苷有一定的视觉保护作用。OOE等[59]采用含越橘花色苷的培养基培养小鼠光感受器细胞,结果表明越橘花色苷可以调节视网膜中转录因子4的活化和抑制S-视蛋白的异常聚集,保护小鼠光感受器细胞系免受细胞损伤。基于以上,蓝莓和越橘花色苷在预防视网膜疾病功能性食品的应用方面具有一定前景。在目前的花色苷视觉保护功能机制的研究中,大多数仅停留在体外测定,未来可以选择动物模型开展研究,研究花色苷在体内的代谢物,以确定花色苷在视觉保护作用中的主要功能形式。此外,花色苷对视网膜的保护作用机制包括调控氧化应激、炎症反应以及细胞凋亡等通路,但各通路间的联合调控机制尚不清晰,未来可进一步研究。
3.4 预防肥胖活性
目前,肥胖现已成为我国乃至全球重要的公共卫生问题,肥胖可显著增加2型糖尿病、高血压、血脂异常、心血管疾病等多种疾病的风险。花色苷具有有效干预肥胖的作用,相关研究与产品开发已成为一个热点。LIU等[74]的研究探讨了蓝莓和蔓越莓花色苷提取物对体重和肠道微生物群的影响,结果发现喂养蓝莓和蔓越莓花色苷提取物的小鼠体重增加显著降低,脂肪组织总质量和总肝脂含量也发生减少。小鼠膳食中补充浆果花色苷促进了乳梭菌属、罗氏菌属等肠道益生菌的生长水平。韩雯[63]研究了樱桃花色苷降脂作用的机制,发现细胞自噬参与樱桃花色苷的降脂作用。即樱桃花色苷可通过促进细胞自噬体形成,上调自噬相关蛋白LC3、Atg5、Beclin1表达水平,下调P62的表达水平进一步缓解抑制HepG2、L02脂质沉积作用,同时樱桃花色苷可下调脂肪酸合成相关蛋白FAS、ACC的表达。基于以上研究结果,摄入花色苷可以预防肥胖,但其在基因调控水平的原理以及在肠道菌群与花色苷代谢物的互作机制上还需更深入研究。此外,对于正常体重与超重个体胃肠道中花色苷代谢和生物转化的差异,以及完整与破坏肠道的微生物菌群在花色苷代谢中的作用研究仍然缺乏。
3.5 保护神经活性
中枢神经系统,尤其是大脑,易受过量活性氧(reactive oxygen species,ROS)的影响,花色苷具有穿过血脑屏障的能力,可直接清除ROS,通过影响抗氧化通路保护神经组织[75-76]。C SEDAS等[77]采用蓝莓和越橘花色苷处理SH-SY5Y细胞,发现花色苷减少了细胞内ROS的产生和脂质过氧化的程度,并上调了CAT和SOD的活性,证明了花色苷具有预防神经元细胞氧化应激的潜力。花色苷可以增强记忆力,如WEN等[65]研究了纯化黑果腺肋花楸花色苷对淀粉样蛋白(Aβ)诱导的大鼠记忆损伤的神经保护作用,发现接受纯化花色苷治疗(50 mg/kg)的大鼠在Morris水迷宫测试中空间记忆改善,此外,大鼠海马体也免受了Aβ的毒性。PACHECO等[64]利用散发性阿尔茨海默型痴呆大鼠模型,研究了葡萄皮花色苷对阿尔茨海默症的影响,发现葡萄皮花色苷可有效防止记忆恶化,清除ROS,提高抗氧化酶CAT和GPx的表达,恢复大脑皮层和海马体的乙酰胆碱酯酶活性。基于以上,富含花色苷的果蔬具有保护神经系统、改善记忆以及预防神经系统退行性疾病的潜力。花色苷在体内的代谢物,如多酚等也具有抗氧化活性,在未来的研究中,可探讨花色苷的神经保护能力与这些代谢物的抗氧化活性是否有关。此外,花色苷穿越血脑屏障的潜力是阿尔茨海默病治疗中的一个主要问题,但其药代动力学研究缺乏,对此,将来可开展临床试验,为阿尔茨海默病治疗中的花色苷干预治疗提供理论基础。
SEDAS等[77]采用蓝莓和越橘花色苷处理SH-SY5Y细胞,发现花色苷减少了细胞内ROS的产生和脂质过氧化的程度,并上调了CAT和SOD的活性,证明了花色苷具有预防神经元细胞氧化应激的潜力。花色苷可以增强记忆力,如WEN等[65]研究了纯化黑果腺肋花楸花色苷对淀粉样蛋白(Aβ)诱导的大鼠记忆损伤的神经保护作用,发现接受纯化花色苷治疗(50 mg/kg)的大鼠在Morris水迷宫测试中空间记忆改善,此外,大鼠海马体也免受了Aβ的毒性。PACHECO等[64]利用散发性阿尔茨海默型痴呆大鼠模型,研究了葡萄皮花色苷对阿尔茨海默症的影响,发现葡萄皮花色苷可有效防止记忆恶化,清除ROS,提高抗氧化酶CAT和GPx的表达,恢复大脑皮层和海马体的乙酰胆碱酯酶活性。基于以上,富含花色苷的果蔬具有保护神经系统、改善记忆以及预防神经系统退行性疾病的潜力。花色苷在体内的代谢物,如多酚等也具有抗氧化活性,在未来的研究中,可探讨花色苷的神经保护能力与这些代谢物的抗氧化活性是否有关。此外,花色苷穿越血脑屏障的潜力是阿尔茨海默病治疗中的一个主要问题,但其药代动力学研究缺乏,对此,将来可开展临床试验,为阿尔茨海默病治疗中的花色苷干预治疗提供理论基础。
3.6 抗肿瘤活性
许多研究表明花色苷能抑制肿瘤细胞生长、阻滞肿瘤细胞增殖,以抑制多种肿瘤细胞生长和转移[78]。CHEN等[66]发现黑树莓花色苷通过调节肠道共生微生物菌群组成,降低白细胞介素(interleukin-1 beta,IL-1β)、环氧合酶-2(cyclooxygenase-2,COX-2)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等促炎因子的表达,抑制炎症反应和细胞增殖,以预防小鼠结直肠癌的发生。LIU等[32]研究发现超声辅助提取的红色苹果(‘Royalty’)花色苷含量越高,其对肿瘤细胞的抑制作用越显著,半数抑制浓度(IC50)值为105.5 μg/mL。此外,研究证明苹果(‘Royalty’)花色苷可通过上调促凋亡蛋白Bax和Bak表达,下调抗凋亡蛋白Bcl-2和Bcl-xL表达,抑制人胃癌细胞增殖。ZHOU等[67]利用蓝靛果忍冬花色苷处理体外人肝癌细胞(SMMC-7721)和体内小鼠肝癌细胞(H22),发现花色苷于体外能在G2/M期显著阻断细胞周期,诱导DNA损伤,最终导致细胞凋亡,而体内可抑制IL-2、TNF-α等促炎因子的表达。结果表明,纯化的蓝靛果忍冬花色苷通过动态调节H22肝癌小鼠的氧化还原平衡和提高免疫调节活性,发挥有效的抗肿瘤作用。综上所述,花色苷具有潜在的抗肿瘤和辅助治疗作用,为未来对抗肿瘤药物的研制提供了一个很好的选项。将来可继续进行小鼠/大鼠模型实验,成熟后可进行临床试验,促进花色苷在治疗肿瘤方面的应用。
4 展望
花色苷是具有多种健康功效的天然着色剂和抗氧化剂,其在食品和医药工业中拥有广阔的应用前景。目前,关于花色苷的分离提取方法、功能活性以及应用已开展了大量研究,但仍存在一些问题值得深入探讨。其一,目前提取方法较多,但大多采用溶剂浸提为主,存在溶剂残留风险限制了其在功能保健食品的应用,而DES作为新型绿色提取技术仍存在挥发性低、提取后难分离的问题,同时DES与目标化合物的相互作用与分离机制仍需进一步研究;其二,关于花色苷功能活性的机理研究相对不足,花色苷在人体内的关键作用靶点、具备功能作用的主要形式以及与人体肠道菌群互作机制研究不够透彻,同时花色苷生物利用度的相关数据和长期干预实验研究也较为匮乏;其三,果蔬花色苷的功能活性研究多以花色苷混合提取物为原料,对花色苷生理活性的研究基本以总花色苷为基础,究竟哪种花色苷发挥生物活性及相关生物活性的调控通路不得而知。因此,未来的研究需完善果蔬花色苷的分离纯化方法,果蔬花色苷混提物中通常含有蛋白、多糖、酚类和脂类等杂质,因此需要采用大孔树脂吸附法、膜分离法和高速逆流色谱法等对其分离纯化以便后续功能性研究。同时借助现代生物技术,如蛋白质组、转录组、代谢组等揭示水果花色苷发挥生理功能的调节通路,对比花色苷的酚类代谢产物与其他植物性食物中的类似酚类化合物在体内的相对生物活性,在相关研究基础上有针对性的研发抗氧化、抗炎、抗心血管疾病、抗癌等生理功效产品。
[1] SILVA S, COSTA E M, CALHAU C, et al.Anthocyanin extraction from plant tissues:A review[J].Critical Reviews in Food Science and Nutrition, 2017, 57(14):3072-3083.
[2] 国石磊.黑果腺肋花楸花色苷分离纯化、结构鉴定及其抗氧化活性研究[D].秦皇岛:河北科技师范学院, 2015.
GUO S L. Purification, structure identification of anthocyanins and its antioxidant activity from Aronia melanocarpa.Qinhuangdao: Hebei Normal University of Science &Technology, 2015.
[3] CHEN L H, HU B, QIN Y H, et al.Advance of the negative regulation of anthocyanin biosynthesis by MYB transcription factors[J].Plant Physiology and Biochemistry, 2019, 136:178-187.
[4] ONGKOWIJOYO P, LUNA-VITAL D A, GONZALE Z DE MEJIA E.Extraction techniques and analysis of anthocyanins from food sources by mass spectrometry:An update[J].Food Chemistry, 2018, 250:113-126.
[5] CASTA EDA-OVANDO A, DE LOURDES PACHECO-HERN
EDA-OVANDO A, DE LOURDES PACHECO-HERN NDEZ M, P
NDEZ M, P EZ-HERN
EZ-HERN NDEZ M E, et al.Chemical studies of anthocyanins:A review[J].Food Chemistry, 2009, 113(4):859-871.
NDEZ M E, et al.Chemical studies of anthocyanins:A review[J].Food Chemistry, 2009, 113(4):859-871.
[6] 聂泽坤.香樟果花色苷的高效提取及其稳态化性质研究[D].淮安:淮阴工学院, 2021.
NIE Z K. Efficient extraction of anthocyanins from Cinnamomum camphora fruit and its steady-state properties.Huaian: Huaiyin Institute of Technology, 2021.
[7] HOUGHTON A, APPELHAGEN I, MARTIN C.Natural blues:Structure meets function in anthocyanins[J].Plants, 2021, 10(4):726.
[8] HUGHES N M, CONNORS M K, GRACE M H, et al.The same anthocyanins served four different ways:Insights into anthocyanin structure-function relationships from the wintergreen orchid, Tipularia discolor[J].Plant Science, 2021, 303:110793.
[9] 刘晓芬, 李方, 殷学仁, 等.花青苷生物合成转录调控研究进展[J].园艺学报, 2013,40(11):2295-2306.
LIU X F, LI F, YIN X R, et al.Recent advances in the transcriptional regulation of anthocyanin biosynthesis[J].Acta Horticulturae Sinica, 2013,40(11):2295-2306.
[10] CHEN F F, SANG J E, ZHANG Y, et al.Development of a green two-dimensional HPLC-DAD/ESI-MS method for the determination of anthocyanins from Prunus cerasifera var.atropurpurea leaf and improvement of their stability in energy drinks[J].International Journal of Food Science &Technology, 2018, 53(6):1494-1502.
[11] WANG H J, SUN S, ZHOU Z, et al.Rapid analysis of anthocyanin and its structural modifications in fresh tomato fruit[J].Food Chemistry, 2020, 333:127439.
[12] KARAASLAN N M, YAMAN M.Anthocyanin profile of strawberry fruit as affected by extraction conditions[J].International Journal of Food Properties, 2017, 20(sup3):S2313-S2322.
[13] ZHANG Y, CHEN F F, SANG J.Green approach for sample preparation and determination of anthocyanins from Lycium ruthenicum Murr.using a β-cyclodextrin-based extraction method coupled with UPLC-DAD analysis[J].Food Analytical Methods, 2018, 11(8):2141-2148.
[14] XUE H K, TAN J Q, LI Q A, et al.Optimization ultrasound-assisted deep eutectic solvent extraction of anthocyanins from raspberry using response surface methodology coupled with genetic algorithm[J].Foods, 2020, 9(10):1409.
[15] TAN J Q, LI Q A, XUE H K, et al.Ultrasound-assisted enzymatic extraction of anthocyanins from grape skins:Optimization, identification, and antitumor activity[J].Journal of Food Science, 2020, 85(11):3731-3744.
[16] LIU C H, XUE H K, SHEN L Y, et al.Improvement of anthocyanins rate of blueberry powder under variable power of microwave extraction[J].Separation and Purification Technology, 2019, 226:286-298.
[17] SAINZ MARTINEZ A, KORNPOINTNER C, HASELMAIR-GOSCH C, et al.Dynamic streamlined extraction of iridoids, anthocyanins and lipids from haskap berries[J].LWT, 2021, 138:110633.
[18] DEL PILAR GARCIA-MENDOZA M, ESPINOSA-PARDO F A, BASEGGIO A M, et al.Extraction of phenolic compounds and anthocyanins from juçara (Euterpe edulis Mart.) residues using pressurized liquids and supercritical fluids[J].The Journal of Supercritical Fluids, 2017, 119:9-16.
[19] 贾赵东, 马佩勇, 边小峰, 等.植物花青素合成代谢途径及其分子调控[J].西北植物学报, 2014,34(7):1496-1506.
JIA Z D, MA P Y, BIAN X F, et al.Biosynthesis metabolic pathway and molecular regulation of plants anthocyanin[J].Acta Botanica Boreali-Occidentalia Sinica, 2014,34(7):1496-1506.
[20] 李栋, 李莉, 徐艳群, 等.植物中花色苷转运蛋白研究进展[J].食品安全质量检测学报, 2020,11(3):669-674.
LI D, LI L, XU Y Q, et al.Research progress of anthocyanin transporters in plants[J].Journal of Food Safety &Quality, 2020,11(3):669-674.
[21] FEI P, ZENG F S, ZHENG S Y, et al.Acylation of blueberry anthocyanins with maleic acid:Improvement of the stability and its application potential in intelligent color indicator packing materials[J].Dyes and Pigments, 2021, 184:108852.
[22] CORTEZ R, LUNA-VITAL D A, MARGULIS D, et al.Natural pigments:Stabilization methods of anthocyanins for food applications[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(1):180-198.
[23] ZHANG Y, BUTELLI E, MARTIN C.Engineering anthocyanin biosynthesis in plants[J].Current Opinion in Plant Biology, 2014, 19:81-90.
[24] CHEN Z Q, WANG C, GAO X D, et al.Interaction characterization of preheated soy protein isolate with cyanidin-3-O-glucoside and their effects on the stability of black soybean seed coat anthocyanins extracts[J].Food Chemistry, 2019, 271:266-273.
[25] 李彬.玫瑰茄花色苷稳定性优化及性质研究[D].天津:天津商业大学, 2022.
LI B.Study on stability optimization and properties of Roselle anthocyanins[D].Tianjin:Tianjin University of Commerce, 2022.
[26] TENA N, ASUERO A G.Up-to-date analysis of the extraction methods for anthocyanins:Principles of the techniques, optimization, technical progress, and industrial application[J].Antioxidants, 2022, 11(2):286.
[27] BARNES J S, NGUYEN H P, SHEN S J, et al.General method for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionization-ion trap-time of flight-mass spectrometry[J].Journal of Chromatography A, 2009, 1216(23):4728-4735.
[28] CHANDRASEKHAR J, MADHUSUDHAN M C, RAGHAVARAO K S M S.Extraction of anthocyanins from red cabbage and purification using adsorption[J].Food and Bioproducts Processing, 2012, 90(4):615-623.
[29] NISTOR M, DIACONEASA Z, FROND A D, et al.Comparative efficiency of different solvents for the anthocyanins extraction from chokeberries and black carrots, to preserve their antioxidant activity[J].Chemical Papers, 2021, 75(2):813-822.
[30] INCE A E, SAHIN S, SUMNU G.Comparison of microwave and ultrasound-assisted extraction techniques for leaching of phenolic compounds from nettle[J].Journal of Food Science and Technology, 2014, 51(10):2776-2782.
[31] WU C Y, WANG H, FAN X H, et al.Waste Euryale ferox salisb.leaves as a potential source of anthocyanins:Extraction optimization, identification and antioxidant activities evaluation[J].Waste and Biomass Valorization, 2020, 11(8):4327-4340.
[32] LIU Y X, ZHAO Y H, ZHUO Y, et al.Ultrasound-assisted extraction of anthocyanins from Malus ‘Royalty’fruits:Optimization, separation, and antitumor activity[J].Molecules, 2022, 27(13):4299.
[33] 宋毓晔, 王渝, 朱千林, 等.植物中花色苷来源及提取方法研究进展[J].食品研究与开发, 2022,43(16):199-208.
SONG Y Y, WANG Y, ZHU Q L, et al.Research progress on sources and extraction methods of plant-based anthocyanin[J].Food Research and Development, 2022,43(16):199-208.
[34] YEDHU KRISHNAN R, RAJAN K S.Microwave assisted extraction of flavonoids from Terminalia bellerica:Study of kinetics and thermodynamics[J].Separation and Purification Technology, 2016, 157:169-178.
[35] 刘雪可, 苏梦飞, 杨宁, 等.不同提取方法对蓝靛果果渣花色苷提取效率的影响[J].食品研究与开发, 2018,39(24):44-48. LIU X K, SU M F, YANG N, et al.Study on anthocyanins extraction efficiency by different extraction technologies from Lonicera caerulea residue[J].Food Research and Development, 2018,39(24):44-48.
[36] 任济夫, 夏建盟, 周振驰, 等.超临界流体在聚合物工业中的应用研究进展[J].塑料工业, 2022,50(7):12-16;124.
REN J F, XIA J M, ZHOU Z C, et al.Application research processes of supercritical fluid in polymer industry[J].China Plastics Industry, 2022,50(7):12-16;124.
[37] POURMORTAZAVI S M, SAGHAFI Z, EHSANI A, et al.Application of supercritical fluids in cholesterol extraction from foodstuffs:A review[J].Journal of Food Science and Technology, 2018, 55(8):2813-2823.
[38] DEL PILAR S NCHEZ-CAMARGO A, PARADA-ALONSO F, IB
NCHEZ-CAMARGO A, PARADA-ALONSO F, IB
 EZ E, et al.Recent applications of on-line supercritical fluid extraction coupled to advanced analytical techniques for compounds extraction and identification[J].Journal of Separation Science, 2019, 42(1):243-257.
EZ E, et al.Recent applications of on-line supercritical fluid extraction coupled to advanced analytical techniques for compounds extraction and identification[J].Journal of Separation Science, 2019, 42(1):243-257.
[39] 田密霞, 李亚东, 胡文忠, 等.响应面分析法优化超临界CO2萃取蓝莓花色苷工艺条件的研究[J].食品工业科技, 2016,37(1):208-212.
TIAN M X, LI Y D, HU W Z, et al.Optimization of supercritical CO2extraction of blueberry anthocyanins using response surface methodology[J].Science and Technology of Food Industry, 2016,37(1):208-212.
[40] PURI M, SHARMA D, BARROW C J.Enzyme-assisted extraction of bioactives from plants[J].Trends in Biotechnology, 2012, 30(1):37-44.
[41] NADAR S S, RAO P, RATHOD V K.Enzyme assisted extraction of biomolecules as an approach to novel extraction technology:A review[J].Food Research International, 2018, 108:309-330.
[42] SWER T L, CHAUHAN K.Stability studies of enzyme aided anthocyanin extracts from Prunus nepalensis L[J].LWT, 2019, 102:181-189.
[43] LI X A, ZHU F Y, ZENG Z W.Effects of different extraction methods on antioxidant properties of blueberry anthocyanins[J].Open Chemistry, 2021, 19(1):138-148.
[44] JOSÉ ALIA O GONZ
O GONZ LEZ M, CARRERA C, BARBERO G F, et al.A comparison study between ultrasound-assisted and enzyme-assisted extraction of anthocyanins from blackcurrant (Ribes nigrum L.)[J].Food Chemistry:X, 2022, 13:100192.
LEZ M, CARRERA C, BARBERO G F, et al.A comparison study between ultrasound-assisted and enzyme-assisted extraction of anthocyanins from blackcurrant (Ribes nigrum L.)[J].Food Chemistry:X, 2022, 13:100192.
[45] SANTOS L B, SANTOS ASSIS R, BARRETO J A, et al.Deep eutectic solvents in liquid-phase microextraction:Contribution to green chemistry[J].TrAC Trends in Analytical Chemistry, 2022, 146:116478.
[46] WANG Y, CHENG H, HE J R, et al.Enzymes-catalyzed Knoevenagel condensation promoted by ionic liquid and deep eutectic solvent[J].Catalysis Letters, 2022, 152(4):1215-1223.
[47] HIKMAWANTI N P E, RAMADON D, JANTAN I, et al.Natural deep eutectic solvents (NADES):Phytochemical extraction performance enhancer for pharmaceutical and nutraceutical product development[J].Plants, 2021, 10(10):2091.
[48] OZTURK B, PARKINSON C, GONZALEZ-MIQUEL M.Extraction of polyphenolic antioxidants from orange peel waste using deep eutectic solvents[J].Separation and Purification Technology, 2018, 206:1-13.
[49] BI Y H, CHI X W, ZHANG R, et al.Highly efficient extraction of mulberry anthocyanins in deep eutectic solvents:Insights of degradation kinetics and stability evaluation[J].Innovative Food Science &Emerging Technologies, 2020, 66:102512.
[50] ZANNOU O, KOCA I.Greener extraction of anthocyanins and antioxidant activity from blackberry (Rubus spp) using natural deep eutectic solvents[J].LWT, 2022, 158:113184.
[51] FU X Z, WANG D, BELWAL T, et al.Natural deep eutectic solvent enhanced pulse-ultrasonication assisted extraction as a multi-stability protective and efficient green strategy to extract anthocyanin from blueberry pomace[J].LWT, 2021, 144:111220.
[52] 位路路, 林杨, 王月华, 等.黑果腺肋花楸花色苷提取工艺优化及其抗氧化活性和组成鉴定[J].食品科学, 2018,39(12):239-246.
WEI L L, LIN Y, WANG Y H, et al. Optimization of extraction of anthocyanins from berries of Aronia melanocarpa and their antioxidant activity and composition. Food Science, 2018, 39(12):239-246.
[53] NUNES MATTOS G N, PESSANHA DE ARA JO SANTIAGO M C P, SAMPAIO DORIA CHAVES A C S D, et al.Anthocyanin extraction from jaboticaba skin (Myrciaria cauliflora Berg.) using conventional and non-conventional methods[J].Foods, 2022, 11(6):885.
JO SANTIAGO M C P, SAMPAIO DORIA CHAVES A C S D, et al.Anthocyanin extraction from jaboticaba skin (Myrciaria cauliflora Berg.) using conventional and non-conventional methods[J].Foods, 2022, 11(6):885.
[54] DEMIRDÖVEN A, KARAB Y
Y KL
KL
 , TOKATL
, TOKATL K, et al.Inhibitory effects of red cabbage and sour cherry pomace anthocyanin extracts on food borne pathogens and their antioxidant properties[J].LWT-Food Science and Technology, 2015, 63(1):8-13.
K, et al.Inhibitory effects of red cabbage and sour cherry pomace anthocyanin extracts on food borne pathogens and their antioxidant properties[J].LWT-Food Science and Technology, 2015, 63(1):8-13.
[55] HASSELLUND S S, FLAA A, KJELDSEN S E, et al.Effects of anthocyanins on cardiovascular risk factors and inflammation in pre-hypertensive men:A double-blind randomized placebo-controlled crossover study[J].Journal of Human Hypertension, 2013, 27(2):100-106.
[56] MAURAY A, MILENKOVIC D, BESSON C, et al.Atheroprotective effects of bilberry extracts in apo E-deficient mice[J].Journal of Agricultural and Food Chemistry, 2009, 57(23):11106-11111.
[57] HONG J M, KIM M, KIM B.The effects of anthocyanin-rich bilberry extract on transintestinal cholesterol excretion[J].Foods, 2021, 10(11):2852.
[58] LIU Y X, SONG X, ZHANG D, et al.Blueberry anthocyanins:Protection against ageing and light-induced damage in retinal pigment epithelial cells[J].The British Journal of Nutrition, 2012, 108(1):16-27.
[59] OOE E, KUSE Y, YAKO T, et al.Bilberry extract and anthocyanins suppress unfolded protein response induced by exposure to blue LED light of cells in photoreceptor cell line[J].Molecular Vision, 2018, 24:621-632.
[60] LIU Y X, LIU M, CHEN Q C, et al.Blueberry polyphenols ameliorate visible light and lipid-induced injury of retinal pigment epithelial cells[J].Journal of Agricultural and Food Chemistry, 2018, 66(48):12730-12740.
[61] WU T, TANG Q, YU Z P, et al.Inhibitory effects of sweet cherry anthocyanins on the obesity development in C57BL/6 mice[J].International Journal of Food Sciences and Nutrition, 2014, 65(3):351-359.
[62] XU H Y, LIU M H, LIU H M, et al.Anthocyanins from purple corn ameliorated obesity in high fat diet-induced obese mice through activating hepatic AMPK[J].Journal of Functional Foods, 2021, 84:104582.
[63] 韩雯.樱桃花色苷的降脂作用及其机制研究[D].杭州:浙江大学,2017.
HAN W. Study on lipid-lowering effect and mechanism of cherry anthocyanins.Hangzhou: Zhejiang University, 2017.
[64] PACHECO S M, SOARES M S P, GUTIERRES J M, et al.Anthocyanins as a potential pharmacological agent to manage memory deficit, oxidative stress and alterations in ion pump activity induced by experimental sporadic dementia of Alzheimer′s type[J].The Journal of Nutritional Biochemistry, 2018, 56:193-204.
[65] WEN H C, CUI H, TIAN H H, et al.Isolation of neuroprotective anthocyanins from black chokeberry (Aronia melanocarpa) against amyloid-β-induced cognitive impairment[J].Foods, 2020, 10(1):63.
[66] CHEN L L, JIANG B W, ZHONG C G, et al.Chemoprevention of colorectal cancer by black raspberry anthocyanins involved the modulation of gut microbiota and SFRP2 demethylation[J].Carcinogenesis, 2018, 39(3):471-481.
[67] ZHOU L P, WANG H, YI J J, et al.Anti-tumor properties of anthocyanins from Lonicera caerulea ‘Beilei’fruit on human hepatocellular carcinoma:In vitro and in vivo study[J].Biomedicine &Pharmacotherapy, 2018, 104:520-529.
[68] XU L, TIAN Z Z, CHEN H, et al.Anthocyanins, anthocyanin-rich berries, and cardiovascular risks:Systematic review and meta-analysis of 44 randomized controlled trials and 15 prospective cohort studies[J].Frontiers in Nutrition, 2021, 8: 747884.
[69] LU S
S  , DOMINGUES F, PEREIRA L.Association between berries intake and cardiovascular diseases risk factors:A systematic review with meta-analysis and trial sequential analysis of randomized controlled trials[J].Food &Function, 2018, 9(2):740-757.
, DOMINGUES F, PEREIRA L.Association between berries intake and cardiovascular diseases risk factors:A systematic review with meta-analysis and trial sequential analysis of randomized controlled trials[J].Food &Function, 2018, 9(2):740-757.
[70] DI PIETRO P, LIZIO R, IZZO C, et al.A novel combination of high-load omega-3 lysine complex (AvailOm©) and anthocyanins exerts beneficial cardiovascular effects[J].Antioxidants, 2022, 11(5):896.
[71] CAMIRE M E.Functional Foods:Herbs, Botanicals and Teas[M].Lancaster:CRC Press, 2000:307-338.
[72] LIU Y X, ZHANG D, HU J M, et al.Visible light-induced lipid peroxidation of unsaturated fatty acids in the retina and the inhibitory effects of blueberry polyphenols[J].Journal of Agricultural and Food Chemistry, 2015, 63(42):9295-9305.
[73] LI X Y, SUN M M, LONG Y.Cyanidin-3-O-glucoside attenuates lipopolysaccharide-induced inflammation in human corneal epithelial cells by inducing Let-7b-5p-mediated HMGA2/PI3K/Akt pathway[J].Inflammation, 2020, 43(3):1088-1096.
[74] LIU J H, HAO W J, HE Z Y, et al.Blueberry and cranberry anthocyanin extracts reduce bodyweight and modulate gut microbiota in C57BL/6 J mice fed with a high-fat diet[J].European Journal of Nutrition, 2021, 60(5):2735-2746.
[75] NUSSBAUM L, HOGEA L M, DANIELA C, et al.Modern treatment approaches in psychoses.Pharmacogenetic, neuroimagistic and clinical implications[J].Farmacia, 2017, 65(1):75-81.
[76] SALEHI B, SHARIFI-RAD J, CAPPELLINI F, et al.The therapeutic potential of anthocyanins:Current approaches based on their molecular mechanism of action[J].Frontiers in Pharmacology, 2020, 11:1300.
[77] C SEDAS G, GONZ
SEDAS G, GONZ LEZ-BURGOS E, SMITH C, et al.Regulation of redox status in neuronal SH-SY5Y cells by blueberry (Vaccinium myrtillus L.) juice, cranberry (Vaccinium macrocarpon A.) juice and cyanidin[J].Food and Chemical Toxicology, 2018, 118:572-580.
LEZ-BURGOS E, SMITH C, et al.Regulation of redox status in neuronal SH-SY5Y cells by blueberry (Vaccinium myrtillus L.) juice, cranberry (Vaccinium macrocarpon A.) juice and cyanidin[J].Food and Chemical Toxicology, 2018, 118:572-580.
[78] LIU J Q, ZHOU H B, SONG L, et al.Anthocyanins:Promising natural products with diverse pharmacological activities[J].Molecules, 2021, 26(13):3807.