米酒在我国具有悠久的历史,其生产和消费相当广泛。我国传统米酒酿造具有多菌种混合发酵的特点,有研究表明在米酒酿造过程中存在着丰富的酵母菌[1]。根据酵母在酿造中的功能,可分为酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces yeasts,NSY)。酿酒酵母具有发酵效率高、耐受酒精浓度高的特点,通常是酒类发酵过程中的优势菌[2]。一般非酿酒酵母的发酵效率较低,产酒精能力弱[3],通常无法用于酒类产品的纯种发酵。但非酿酒酵母通过一系列的复杂生化反应可以产生大量的酶、甘油、酯类和其他代谢物,改善酒体的口感和香气,赋予酒体地域特色[4]。近年来,很多研究开始将酿酒酵母与非酿酒酵母进行混合发酵,对二者进行“取长补短”,旨为保证发酵效率的同时,又能改善产品品质[5-6]。其中在葡萄酒酿造领域应用较多[7]。
在酵母混菌发酵过程中,非酿酒酵母通常主要存在于发酵的早期阶段,随着发酵的进行,非酿酒酵母会在短时间内被酿酒酵母取代[8],说明非酿酒酵母虽然可以与酿酒酵母共同参与酒精发酵,但其生长会受到抑制,有报道乙醇[9]、中长链脂肪酸[10]等酿酒酵母代谢物的影响较大。此外,不同酵母间还存在较为复杂的相互作用。在酵母混合酿造葡萄酒中,葡萄有孢汉生酵母(Hanseniaspora uvarum)、美极梅氏酵母(Metschnikowia pulcherrima)等非酿酒酵母会与酿酒酵母竞争营养物质,导致发酵迟缓甚至停止[11];某些酵母甚至还会产生致死毒素抑制其他酵母生长[12]。近年来,细胞间接触被认为能够降低酵母,尤其是非酿酒酵母[13]的活力。此外,也有研究发现非酿酒酵母能促使酿酒酵母的糖代谢相关基因过量表达,有利于酿酒酵母的生长代谢[14]。综上所述,不同酵母间相互作用机理复杂,影响因素较多。同时,不同酵母菌株间的差异也较大。研究不同酵母间的相互作用及其机制对于酿造行业及相关领域具有较重要的理论和应用价值。
我国传统米酒酿造中也存在这样的问题,酒药和开放的酿造过程会带入丰富的非酿酒酵母,如扣囊复膜酵母(Saccharomycopsis fibuligera)、假丝酵母(Candida)、毕赤酵母(Pichia)等[1]。随着发酵的进行,这些非酿酒酵母逐渐被酿酒酵母所取代[15],酿酒酵母作为酒精发酵的主导菌大量存在,但是相关的作用机制尚不清楚。随着米酒纯种酿造等新工艺的开发,非酿酒酵母与酿酒酵母混菌发酵对于米酒风味和品质的提升也受到了重视[16],对不同酵母间相互作用机制的认识也提出了新的要求,加深对这一问题的理解可以更好地指导我们选育和利用非酿酒酵母,设计发酵策略,优化发酵过程,更大限度地利用微生物特性提高米酒品质。
本研究以2株与米酒酿造相关的常见非酿酒酵母为研究对象,采用同时接种和顺序接种2种方式与酿酒酵母进行米酒混菌发酵,通过对发酵过程理化参数、生物量变化的监测,分析酵母间的相互影响及其相关因素,并对酿酒酵母发酵代谢物、营养物质竞争、细胞-细胞接触等因素的影响进行了探究,旨在对不同酵母间相互作用机制有更多的认识,为更加合理地调控微生物代谢,实现米酒酿造新工艺的优化,酿造优质米酒提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
本研究用于米酒酿造的酿酒酵母(Saccharomyces cerevisiae LBM-2901,Sc),保藏于江南大学酿造微生物学与应用酶学研究室。假丝酵母(Candida glabrata LBM-202,Ca)为从传统米酒发酵醪中分离而来,扣囊复膜酵母(Saccharomycopsis fibuligera LBM-201,Sf)为从米酒酒药中分离得到。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,琼脂20,蒸馏水100 mL,115 ℃灭菌30 min;YPD液体培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,蒸馏水100 mL,115 ℃灭菌30 min。
1.1.2 试剂
无水葡萄糖、无水乙醇、三氯乙酸(trichloroacetic acid,TCA)、3,5-二硝基水杨酸、甲醇,上海国药集团;放线菌酮,青岛高科技工业园海博生物技术有限公司;酵母粉、蛋白胨,美国Thermo Fisher Scientific公司。
1.2 仪器与设备
Agilent 1260高效液相色谱仪,美国Agilent公司;酶标仪,美国Bio-Tek公司;Milli-Q纯水仪,美国Millipore公司;台式高速离心机,德国Eppendorf公司;恒温培养箱,上海博迅医疗生物仪器公司;电子天平,瑞士Mettler Toledo公司。
1.3 实验方法
1.3.1 米酒发酵
为便于研究,本研究采用液态发酵的方式进行米酒发酵,具体操作参照邹凌波[17]的方法,主要过程包括大米浸泡、蒸饭后加入α-淀粉酶液化、糖化酶糖化,制得的糖化米汁还原糖含量为200 g/L左右,115 ℃灭菌30 min备用。米酒发酵分别采用酵母纯种发酵和混菌发酵的方式进行。先将酵母活化,取保藏菌株接种于5 mL YPD液体培养基中,30 ℃、200 r/min恒温培养48 h,使得培养基中细胞数达到108 CFU/mL,备用。
纯种发酵:将活化后的酿酒酵母(Sc)、非酿酒酵母(Ca或Sf)分别接种于100 mL糖化米汁中,酵母接种量均为106 CFU/mL,于带发酵栓的锥形瓶中30 ℃恒温培养箱静置培养。每天定时取样,检测CO2失重、生物量等;发酵液经10 000 r/min离心5 min取上清液,测定发酵液还原糖和酒精含量。失重小于0.2 g即为发酵结束。
混菌发酵:混菌发酵采用两种方式,即同时接种发酵和顺序接种发酵。同时接种发酵:活化后的酿酒酵母Sc分别与非酿酒酵母Ca或Sf同时接种于糖化米汁中进行发酵(分别记为Si-SC+CA,Si-SC+SF);顺序接种发酵:活化后的非酿酒酵母Ca或Sf先接种于糖化米汁中,发酵3 d后,再接种酿酒酵母Sc(分别记为Se-SC+CA,Se-SC+SF)。酵母菌的接种量均为106 CFU/mL,培养条件、理化指标及生物量测定方法同纯种发酵。
样品均设置3个平行。
1.3.2 酵母生物量测定
酵母生物量的测定采用平板计数法[18]。在纯种发酵条件下,直接在YPD平板上进行酵母计数。
在混菌发酵培养条件下,首先利用YPD平板进行总酵母数的计数。适量浓度的放线菌酮(cycloheximide)能够抑制酿酒酵母的生长,而不影响非酿酒酵母的菌落形成[19],所以利用添加400 mg/L放线菌酮的YPD平板可进行非酿酒酵母的计数。总酵母数减去非酿酒酵母数即为酿酒酵母数。
1.3.3 还原糖和酒精测定
发酵液还原糖含量采用DNS法测定[20]。
酒精含量采用高效液相色谱法进行测定[21]。样品经10%三氯乙酸沉淀后静置1 h,取上清液用0.22 μm有机相微孔滤膜过滤,滤液供液相进样。高效液相色谱仪色谱柱为Aminex HPX-87H(150 mm×4.6 mm,Bio-Rad),视差折光检测器(RID)为Waters 2414,流动相为5 mmol/L稀硫酸,流速0.6 mL/min,进样量10 μL。
1.3.4 酿酒酵母发酵代谢物对非酿酒酵母的影响
酿酒酵母发酵代谢物的制备:分别取酿酒酵母Sc纯种发酵2 d和6 d的米酒发酵液静置10 min,取发酵清液于6 000 r/min无菌离心10 min,取上清液在超净台中过0.22 μm无菌滤膜,得到无细胞的发酵上清液作为酿酒酵母Sc发酵代谢物溶液,贮存于-20 ℃冰箱中备用。
酿酒酵母发酵代谢物对非酿酒酵母的影响:分别取2个时间点(米酒发酵2 d和6 d)的酿酒酵母Sc发酵代谢物溶液,测得其酒精和还原糖含量,经过适当处理后,用于考察其对非酿酒酵母的影响。在制备得到的发酵2 d的Sc发酵代谢物溶液中加入适量酒精,使得其酒精终浓度与发酵6 d的发酵液一致(酒精含量约7.5%,体积分数),接种非酿酒酵母进行纯种发酵,记为样品2 d+。在制备得到的发酵6 d的Sc发酵代谢物溶液中加入适量葡萄糖,使得其最终还原糖含量与发酵2 d的发酵液一致(还原糖含量约130 g/L),接种非酿酒酵母进行纯种发酵,记为样品6 d+。
1.3.5 酵母的非接触发酵
根据HU等[22]设计的一种模型,设计透析袋分室发酵实验,以达到分隔酵母菌株发酵的目的,同时维持发酵体系成分均一。取10 kDa截留分子质量的透析袋,经过灭菌后,在无菌条件下加入适量糖化米汁,置于装有等量糖化米汁的锥形瓶内。将非酿酒酵母接种于透析袋内,Sc接种于透析袋外;为验证透析袋对于物质交换的影响,作为对照,将非酿酒酵母接种于透析袋外,Sc接种于透析袋内。接种量均为106 CFU/mL,锥形瓶加发酵栓封口进行发酵。处理样品设置3个平行,30 ℃、低速振荡发酵,每隔一天测定透析袋内外的生物量、乙醇、还原糖含量,连续测定7 d。
2 结果与分析
2.1 不同酵母纯种发酵和混菌发酵过程变化
首先对两种非酿酒酵母Sf和Ca进行米酒纯种发酵及与酿酒酵母Sc混菌发酵,同时以Sc纯种发酵作为对照,发酵过程中葡萄糖和酒精的含量变化如图1、图2所示。在纯种发酵过程中,2株非酿酒酵母都表现出一定的酒精发酵能力,但是利用还原糖和产酒精速度都低于酿酒酵母Sc。Sc纯培养在发酵第10天能达到9.52%的酒精度,而Sf在第14天结束发酵时仅能达到8.91%酒精度,是3株酵母中产酒精量最低、剩余还原糖含量最高的菌株。相较于Sf,Ca利用还原糖、产酒精能力更强,发酵能力较接近于Sc(图2)。这一结果同已有的报道一致[23],表明非酿酒酵母在米酒发酵过程中存在劣势,即发酵效率低,发酵周期长。当然,不同的非酿酒酵母发酵能力也存在差异。在2株非酿酒酵母与Sc混合发酵中,同时接种发酵能够提高发酵效率,发酵第6天时还原糖均基本消耗完全,酒精度分别为9.46%(Si-SC+CA)和9.94%(Si-SC+SF)。但是在顺序接种发酵中,2株非酿酒酵母与Sc组合发酵表现出不同的结果。由于酿酒酵母Sc具有较强的发酵能力,Sc的加入使得与Sf的混菌发酵效率明显提高(图1),但其发酵效率低于Sc纯种发酵。但是Ca与Sc的顺序接种发酵效率却低于Ca的纯种发酵(图2),表明Sc的加入降低了Ca的发酵效率。
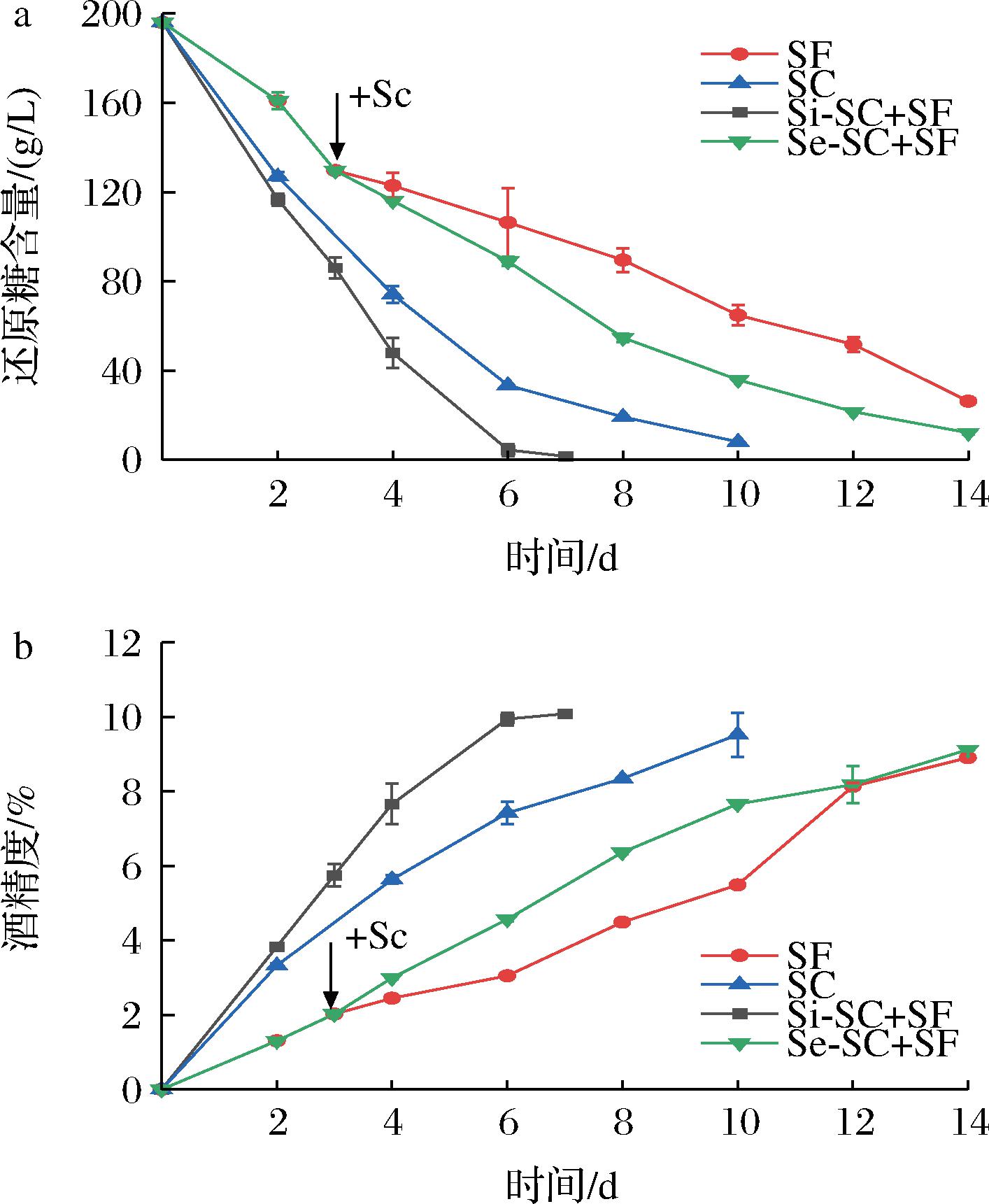
a-还原糖;b-酒精含量
图1 Sf纯种发酵及与Sc混菌发酵过程中还原糖和 酒精含量变化
Fig.1 Sugar consumption and ethanol content profiles of pure and mixed fermentations of Sf and Sc
注:SF:Sf纯种发酵;SC:Sc纯种发酵;Si-SC+SF: Sc与Sf同时接种发酵;Se-SC+SF:Sc与Sf顺序接种发酵。
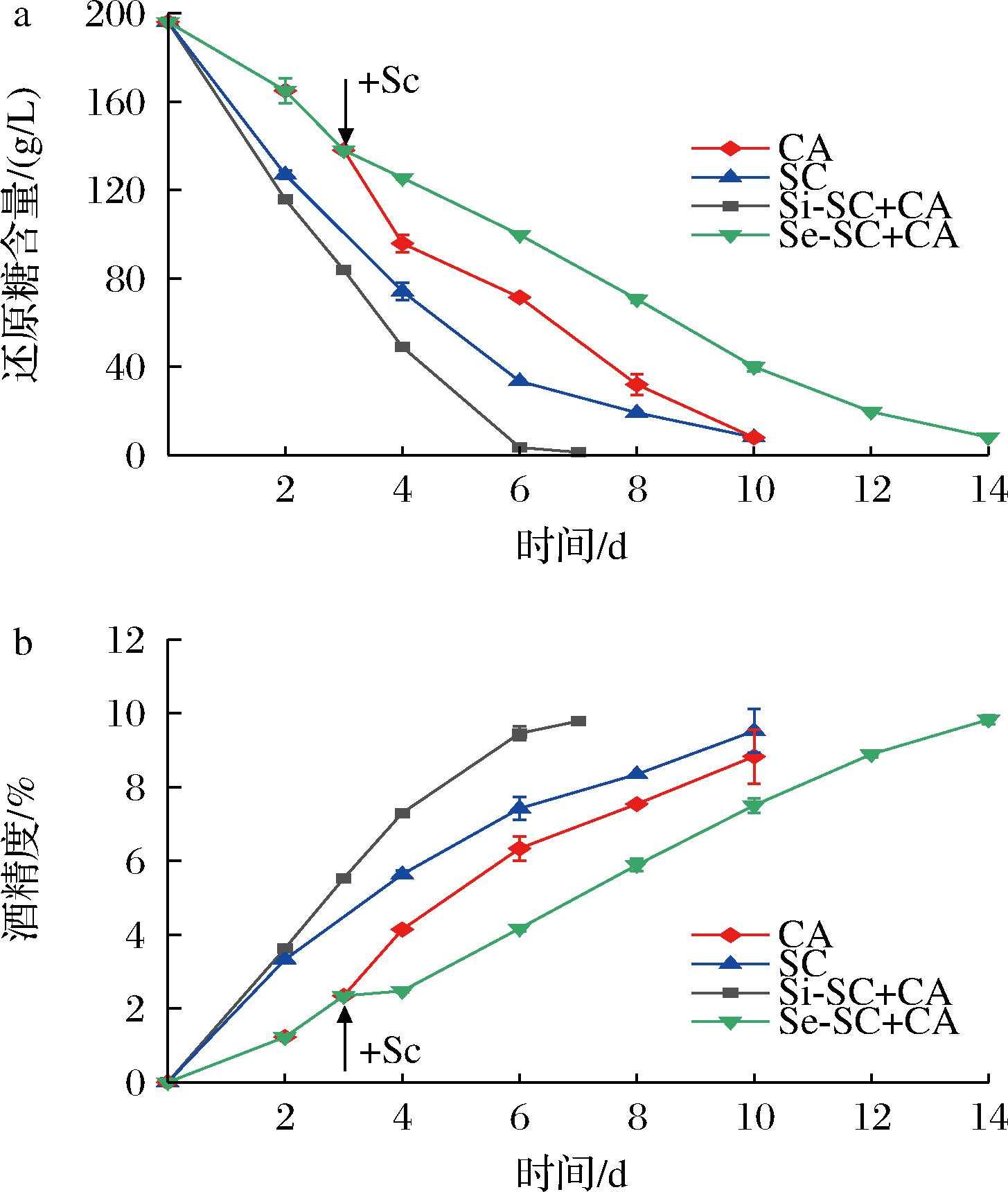
a-还原糖;b-酒精含量
图2 Ca纯种发酵及与Sc混合发酵过程中变化
Fig.2 Sugar consumption and ethanol content profiles of pure and mixed fermentation of Ca and Sc
注:CA:Ca纯种发酵;SC:Sc纯种发酵;Si-SC+CA:Sc与Ca 同时接种发酵;Se-SC+CA:Sc与Ca顺序接种发酵。
以上结果表明,非酿酒酵母与酿酒酵母混菌发酵时,不同的接种方式对米酒发酵过程的影响是不同的,可能存在较为复杂的机制。同时接种发酵对于发酵效率的提升可能是由于不同酵母间的协同作用,但在顺序接种发酵中,不同的非酿酒酵母受到酿酒酵母的影响存在差异,Ca与Sc的混合可能抑制了它们的混合发酵。
2.2 纯种和混菌发酵中不同酵母生物量的变化
进一步对2种混菌发酵过程中不同酵母生物量的变化进行了考察,并与各自酵母纯种发酵过程中的生物量变化进行比较,结果如图3所示。在纯种发酵过程中,2株非酿酒酵母与酿酒酵母的生物量变化相似,均在发酵第2天生物量到达最高,发酵过程中基本维持在较高浓度(107~108 CFU/mL)。在混菌发酵过程中,无论是哪种混菌发酵方式,Sc的生物量变化与其纯种发酵过程类似,没有受到明显影响;对于非酿酒酵母,在发酵初期(酿酒酵母数量较低时),Ca和Sf的生物量变化也没有受到显著影响,但是当Sc生物量达到约107 CFU/mL后,2株非酿酒酵母在2种混菌发酵中的生物量都会迅速下降,之后Sc成为发酵中的优势菌株。这种现象在一些同时接种发酵研究中也有报道[5]。研究结果表明,在混菌发酵过程中,无论哪种非酿酒酵母,较高浓度Sc的抑制作用都是明显存在的,而非酿酒酵母对酿酒酵母的影响则非常有限。因此,由于非酿酒酵母受到了显著的抑制,混菌发酵过程主要是由Sc主导发酵进程,特别是在中后期。虽然同时接种发酵相比于纯种发酵提高了发酵效率,可能与发酵初期2种酵母尚未明显相互影响,从而具有一定的协同作用有关,但是较高浓度的酿酒酵母对于非酿酒酵母的抑制仍然是明显的,而酿酒酵母抑制非酿酒酵母的主要影响因素仍值得进一步研究。

a-Sf纯种及与Sc混菌发酵;b-Ca纯种及与Sc混菌发酵
图3 纯种和混菌发酵中酵母生物量变化
Fig.3 Changes of different yeast biomass in pure and mixed fermentations
2.3 酿酒酵母发酵代谢物以及营养物质对非酿酒酵母的影响
一般认为非酿酒酵母对于酒精的耐受性较弱[24],营养物质缺乏以及酿酒酵母代谢产物也会影响非酿酒酵母的生长[25],这些都可能是在混菌发酵中非酿酒酵母受抑制的原因。为了进一步明确这些因素对于非酿酒酵母的影响,将酿酒酵母Sc发酵米酒过程中不同发酵时间(2、6 d)发酵液经过处理,制备酿酒酵母发酵代谢物溶液作为培养基,分别接入2株非酿酒酵母,探究Sc发酵代谢物对于非酿酒酵母生长的影响。同时,也添加酒精或葡萄糖,考察酒精或营养物质对于非酿酒酵母生长的影响。结果如图4 所示。
由图4可知,与纯种发酵相比,非酿酒酵母Sf和Ca在酿酒酵母发酵代谢物溶液中发酵的生物量均有不同程度的降低,但仍维持在相对稳定的水平,并未出现生物量的快速下降。说明酿酒酵母Sc发酵代谢物对于非酿酒酵母的生长存在一定程度的抑制,但是并不是在混菌发酵中抑制非酿酒酵母生长的主要因素。葡萄糖的添加对于2种非酿酒酵母基本没有影响。对于Sf,较高浓度的酒精在发酵前期对其生长有一定的限制(图4-a),但是也未使其在发酵过程中生物量快速下降。
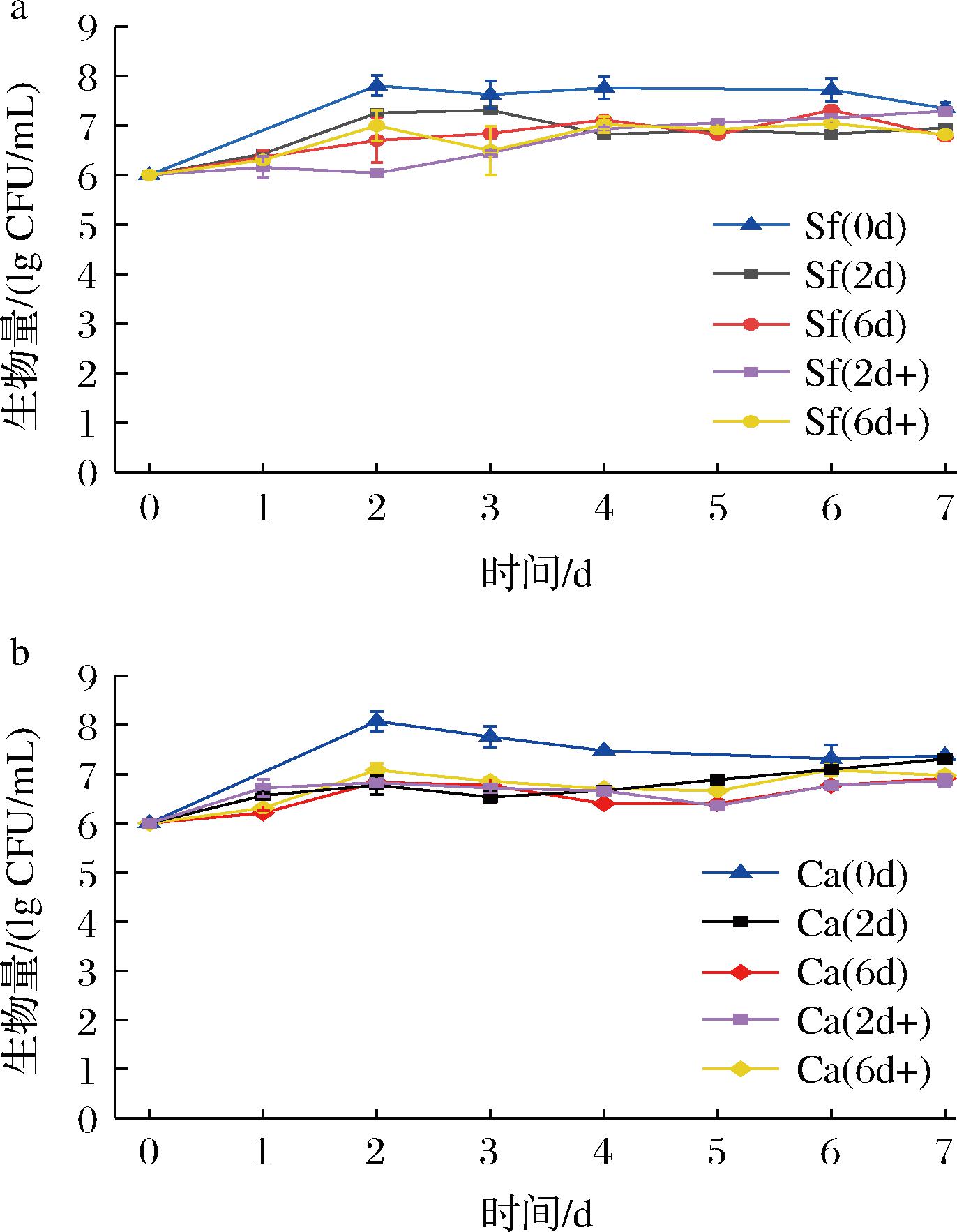
a-Sf生物量变化;b-Ca生物量变化
图4 非酿酒酵母在酿酒酵母米酒发酵代谢物溶液中的生长情况
Fig.4 The growth of non-saccharomyces yeasts in the metabolite solution of Sc from the fermentation of Mijiu
实际上在顺序接种发酵中,Sc接种1 d后,2株非酿酒酵母的生物量均降低了一个数量级(图3),此时酒精度约为3%(图1、图2)。而在纯种发酵过程中,即使酒精度超过8%,2株非酿酒酵母的生物量也未出现迅速下降。这些都说明在混菌发酵过程中,引起酵母生物量迅速下降的主要原因可能并不是酒精的毒害作用,虽然一定浓度的酒精对Sf的生长有一定的影响。从纯培养中也可以发现,发酵后期培养体系中碳源匮乏,而Sf、Ca的生物量基本可以稳定在较高水平,说明营养物质限制也不是非酿酒酵母生物量快速降低的原因。
2.4 细胞非接触发酵对非酿酒酵母的影响
本研究利用透析袋将不同酵母细胞隔离开来,采用非酿酒酵母与Sc非接触发酵,进一步考察细胞-细胞接触对非酿酒酵母的影响。为排除透析袋对于酵母生长的影响,将非酿酒酵母分别接种于透析袋内、外进行对比实验,结果如图5、图6所示。由图5、图6可以看出,非酿酒酵母在透析袋内外的位置不同,对于与Sc非接触发酵过程中还原糖、酒精含量以及生物量的变化趋势无明显影响,说明透析袋除了分隔不同酵母,并未明显影响发酵体系的物质交换和均一性。从酵母生物量的变化来看,2株非酿酒酵母Sf和Ca无论是在透析袋内、外,酵母的生长情况与纯种发酵时基本类似,生物量可以稳定在107~108 CFU/mL,没有出现混菌发酵中生物量快速降低的现象(图3)。

a-Sc接种于透析袋外;b-Sc接种于透析袋内
图5 Sf与Sc非细胞接触发酵过程的主要参数变化
Fig.5 Biomass, sugar and ethanol concentration changes during the fermentations of Sf and Sc without cell-cell contact
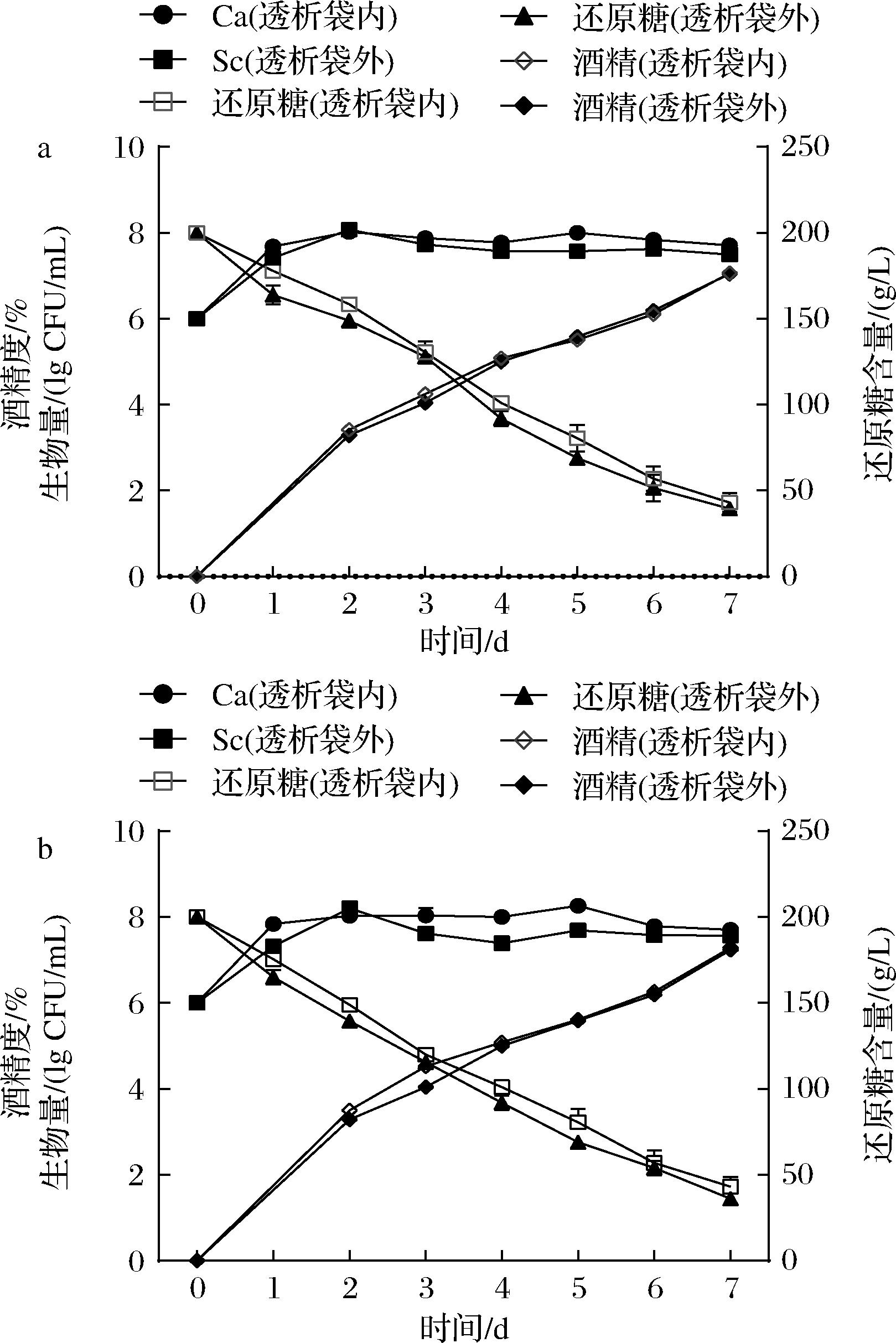
a-Sc接种于透析袋外;b-Sc接种于透析袋内
图6 Ca与Sc非细胞接触发酵过程的主要参数变化
Fig.6 Biomass, sugar and ethanol concentration changes during the fermentations of Ca and Sc without cell-cell contact
这一结果表明,非酿酒酵母在混菌发酵中生物量下降的主要原因应该不是酵母的代谢产物,而非酿酒酵母与酿酒酵母的细胞-细胞接触可能是主要原因。
3 结论
利用2种非酿酒酵母(Sf、Ca)分别与酿酒酵母Sc进行米酒混菌发酵,采用不同的混菌发酵方式(同时接种、顺序接种),可以得到不同的发酵表现。虽然2株非酿酒酵母表现出不同的发酵能力,但是无论采用何种发酵方式,都受到酿酒酵母Sc的影响。当Sc生物量达到107CFU/mL的较高水平时,Sf、Ca生物量出现快速下降,生长受到明显抑制;相反,Sc的生长并未受到明显的影响。利用Sc米酒发酵液为培养体系,考察酿酒酵母发酵代谢物及酒精和还原糖含量对非酿酒酵母的影响,结果表明酿酒酵母发酵代谢物在一定程度上会影响非酿酒酵母的生长活力,较高浓度的酒精也会对Sf的生长产生一定的影响,但这些因素都不会引起混菌发酵中非酿酒酵母生物量的快速下降。采用透析袋分隔发酵的方式对非酿酒酵母和酿酒酵母进行细胞非接触发酵,发现Sc与非酿酒酵母的生长都未受到明显影响,结果表明非酿酒酵母和酿酒酵母细胞-细胞接触是非酿酒酵母在混合发酵过程中受到抑制,生物量快速下降的主要原因。综上所述,在米酒混菌发酵中,酿酒酵母对非酿酒酵母的生长有明显的抑制作用,这种作用机理较为复杂,主要是通过高浓度的Sc活细胞接触来实现的。非酿酒酵母对Sc的影响却较为有限。相关作用机制仍需要进一步深入研究。本研究结果为酿酒酵母与非酿酒酵母间的相互作用研究提供了一些参考,加深了对于传统米酒发酵过程中酵母变化的认识,对于米酒酿造新工艺及其酿造策略优化也具有一定的借鉴作用。
[1] LYU X C, HUANG X L, ZHANG W, et al.Yeast diversity of traditional alcohol fermentation starters for Hong Qu glutinous rice wine brewing, revealed by culture-dependent and culture-independent methods[J].Food Control, 2013, 34(1):183-190.
[2] LIU S, YANG L, ZHOU Y E, et al.Effect of mixed moulds starters on volatile flavor compounds in rice wine [J].LWT-Food Science and Technology, 2019, 112:108215.
[3] CONTRERAS A, HIDALGO C, HENSCHKE P A, et al.Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J].Applied and Environmental Microbiology, 2014, 80(5):1670-1678.
[4] CIANI M, MORALES P, COMITINI F, et al.Non-conventional yeast species for lowering ethanol content of wines[J].Frontiers in Microbiology, 2016, 7:642.
[5] CHEN L H, LI D N, REN L X, et al.Effects of simultaneous and sequential cofermentation of Wickerhamomyces anomalus and Saccharomyces cerevisiae on physicochemical and flavor properties of Mijiu[J].Food Science &Nutrition, 2021, 9(1):71-86.
[6] TANG J, WANG H Y, XU Y.Effect of mixed culture of Saccharomyces cerevisiae and Pichia anomala on fermentation efficiency and flavor compounds in Chinese liquor[J].Microbiology China, 2012, 39(7):921-930.
[7] ZHANG B Q, TANG C, YANG D Q, et al.Effects of three indigenous non-Saccharomyces yeasts and their pairwise combinations in co-fermentation with Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines[J].Food Chemistry, 2022, 368:130807.
[8] UBEDA-IRANZO J, D AZ-HELL
AZ-HELL N P, CHAC
N P, CHAC N-OCA
N-OCA A M, et al.Detection of non-Saccharomyces yeast strains in alcoholic fermentations by direct PCR and/or plating methods[J].European Food Research and Technology, 2015, 241(6):843-850.
A M, et al.Detection of non-Saccharomyces yeast strains in alcoholic fermentations by direct PCR and/or plating methods[J].European Food Research and Technology, 2015, 241(6):843-850.
[9] D′AMORE T, STEWART G G.Ethanol tolerance of yeast[J].Enzyme and Microbial Technology, 1987, 9(6):322-330.
[10] VIEGAS C A, ROSA M F, S -CORREIA I, et al.Inhibition of yeast growth by octanoic and decanoic acids produced during ethanolic fermentation[J].Applied and Environmental Microbiology, 1989, 55(1):21-28.
-CORREIA I, et al.Inhibition of yeast growth by octanoic and decanoic acids produced during ethanolic fermentation[J].Applied and Environmental Microbiology, 1989, 55(1):21-28.
[11] MEDINA K, BOIDO E, DELLACASSA E, et al.Growth of non-Saccharomyces yeasts affects nutrient availability for Saccharomyces cerevisiae during wine fermentation[J].International Journal of Food Microbiology, 2012, 157(2):245-250.
[12] SCHMITT M J, BREINIG F.The viral killer system in yeast:From molecular biology to application[J].FEMS Microbiology Reviews, 2002, 26(3):257-276.
[13] NISSEN P, NIELSEN D, ARNEBORG N.Viable Saccharomyces cerevisiae cells at high concentrations cause early growth arrest of non-Saccharomyces yeasts in mixed cultures by a cell-cell contact-mediated mechanism[J].Yeast, 2003, 20(4):331-341.
[14] CURIEL J A, MORALES P, GONZALEZ R, et al.Different non-Saccharomyces yeast species stimulate nutrient consumption in S.cerevisiae mixed cultures[J].Frontier in Microbiology, 2017, 8:02121.
[15] ZHAO C, SU W, MU Y C, et al.Correlations between microbiota with physicochemical properties and volatile flavor components in black glutinous rice wine fermentation[J].Food Research International, 2020, 138:109800.
[16] YANG Y R, ZHONG H Y, YANG T, et al.Characterization of the key aroma compounds of a sweet rice alcoholic beverage fermented with Saccharomycopsis fibuligera[J].Journal of Food Science and Technology, 2020, 58:3752-3764.
[17] 邹凌波. 酶法酿造米酒新技术的研究[D].无锡:江南大学, 2019.
ZOU L B.Study on the new technology of Mijiu-making by enzymes[D].Wuxi:Jiangnan University, 2019.
[18] 伍保龙, 伍时华, 和晶晶, 等.适合米酒酿造酵母的分离鉴定及葡萄糖发酵特性研究[J].食品工业科技, 2014, 35(17):156-160;166.
WU B L, WU S H, HE J J, et al.Isolation, identification and glucose fermentative characterization of high alcohol yield yeast from rice wine starter[J].Science and Technology of Food Industry, 2014, 35(17):156-160;166.
[19] ZOTT K, MIOT-SERTIER C, CLAISSE O, et al.Dynamics and diversity of non-Saccharomyces yeasts during the early stages in winemaking[J].International Journal of Food Microbiology, 2008, 125(2):197-203.
[20] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3):426-428.
[21] LIU P T, LU L, DUAN C Q, et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Science and Technology, 2016, 71:356-363.
[22] HU K, ZHAO H Y, EDWARDS N, et al.The effects of cell-cell contact between Pichia kluyveri and Saccharomyces cerevisiae on amino acids and volatiles in mixed culture alcoholic fermentations[J].Food Microbiology, 2022, 103:103960.
[23] DOMIZIO P, ROMANI C, LENCIONI L, et al.Outlining a future for non-Saccharomyces yeasts:selection of putative spoilage wine strains to be used in association with Saccharomyces cerevisiae for grape juice fermentation[J].International Journal of Food Microbiology, 2011, 147(3):170-180.
[24] GAO C X, FLEET G H.The effects of temperature and pH on the ethanol tolerance of the wine yeasts, Saccharomyces cerevisiae, Candida stellata and Kloeckera apiculata[J].Journal of Applied Bacteriology, 1988, 65(5):405-409.
[25] 赵剑雷, 邱树毅, 王晓丹, 等.异常威克汉姆酵母与酿酒酵母在混合发酵中的相互作用机制[J].食品科学, 2022, 43(16):201-208.
ZHAO J L, QIU S Y, WANG X D, et al.Interaction mechanism of Wickerhamomyces anomalus and Saccharomyces cerevisiae in mixed culture fermentation[J].Food Science, 2022, 43(16):201-208.