晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)是免疫球蛋白超家族的一员,最早作为晚期糖基化终末产物(advanced glycation end products, AGEs)的受体被发现,并因此得名[1-2]。RAGE在人体肺脏组织中高表达,在人体内皮细胞、T淋巴细胞和巨噬细胞等多种细胞中均有表达[3]。后来研究发现,RAGE能够非序列特异性地与多种配体结合,如S100蛋白、淀粉样蛋白β、高迁移率族蛋白1、DNA、RNA等,是一个模式识别受体。RAGE作为多配体受体,其配体种类多为损伤相关分子模式分子(damage associated molecular pattern molecules, DAMPs),RAGE与其配体结合后,能够激活细胞的下游信号通路,尽管其确切的生理功能尚不清楚,但有充分的证据表明RAGE信号通路能够通过调控炎症反应以及细胞凋亡等生理过程参与免疫反应,进而参与多种疾病的疾病进程,如糖尿病、癌症、败血症等[4-6]。
在真核细胞内,组蛋白作为染色质的主要组成蛋白,能够参与调控基因的复制、转录及翻译等多种生理过程;然而胞外组蛋白却被认为是多种疾病不良预后的生物标志物,其在患者体内水平的升高会导致急性炎症反应等并发症从而加重病情。例如,胞外组蛋白是导致败血症患者死亡的主要原因之一[7];胞外组蛋白水平的升高能够加重肾损伤、促进血栓的生成[8-9];除此之外,在腹膜炎、胰腺炎等多种炎症反应中,胞外组蛋白的浓度均有明显上升[10-12],因此其也被看作是一种内源性DAMPs。当细胞受到损伤时,组蛋白会被释放到胞外,此外,组蛋白还会通过凋亡、坏死细胞,以及中性粒细胞胞外杀菌网络(neutrophil extracellular traps, NETs)被释放。有研究表明,组蛋白能够通过刺激Toll样受体2、4(TLR2/4)介导疾病过程,但其引发炎症反应的具体分子机制目前尚不清楚,对此深入研究能够帮助人们理解胞外组蛋白诱导炎症反应的机制,开发抗炎症疾病的治疗手段。
先前研究发现RAGE能够介导哺乳动物细胞对组蛋白修饰的微米级颗粒的吞噬[13],然而目前并没有报道称组蛋白是RAGE的配体,对RAGE能否直接识别组蛋白,以及该过程能对细胞产生何种影响尚没有研究报道。因此,本研究对组蛋白激活RAGE进而引发的细胞反应做了初步探究,为进一步研究组蛋白及RAGE相关的疾病过程提供了理论依据。
1 材料与方法
1.1 材料与试剂
HEK293T细胞是由HEK293细胞的衍生细胞而来,含有SV40大T抗原;RAGE-敲除HEK293T细胞是由HEK293T细胞敲除RAGE基因而来;RAW264.7细胞是小鼠单核巨噬细胞白血病细胞;RAGE-敲除RAW264.7细胞是由RAW264.7细胞敲除RAGE基因所得;实验细胞均由实验室保存。
DMEM培养基、EDTA-胰酶、PBS、组蛋白,生工生物工程(上海)股份有限公司;标准胎牛血清,美国Hyclone公司;Lyso-Tracker-Red、Calcein AM/PI染色试剂盒、活性氧检测试剂盒、Avidin-FITC,上海碧云天生物技术有限公司;生物素,美国默克公司;赖氨酸,国药集团化学试剂有限公司;ELISA试剂盒,美国eBioScience公司。
1.2 仪器与设备
DS-Ri2共聚焦荧光显微镜,Nikon公司;TY7622振荡混合器,易扩中国有限公司;QB-128旋转培养器,其林贝尔仪器制造有限公司;HYL-A电热恒温摇床、SF-SW-1100生物安全柜,上海三发科学仪器有限公司;MX150高速冷冻离心机,日本日立HITACHI公司;Midi 40二氧化碳培养箱、NanoDrop2000分光光度计,赛默飞世尔科技有限公司;Accuri C6流式细胞仪,美国碧迪医疗器械有限公司;iMark酶标仪,美国伯乐公司。
1.3 实验方法
1.3.1 细胞消化与传代
待细胞铺板率为80%左右(S/S)时,弃上清,用PBS轻轻洗涤细胞2次(洗去板底残留蛋白),加入1 mL 胰酶(含EDTA)并轻轻摇动培养皿,使胰酶与细胞充分接触。2~3 min后,加入4 mL新鲜培养基终止胰酶消化,用移液枪轻轻吹打,将贴壁细胞完全吹打混匀后,吸入离心管中,1 400 r/min离心3 min收集细胞,弃上清液,用5 mL新鲜培养基将白色沉淀吹打混匀,吸取2~2.5 mL接种到37 ℃预热的10 mL 培养基中,在37 ℃含5%二氧化碳的培养箱中静置培养。
1.3.2 绿色荧光标记的组蛋白、DNA-组蛋白复合物的制备
称取1 000 μg组蛋白冻干粉并用1 mL双蒸水溶解,使终质量浓度为1 000 μg/mL,向组蛋白溶液中加入10 μmol生物素,振荡混匀,避光室温孵育30 min后,加入8 μmol赖氨酸避光室温孵育20 min终止反应。向组蛋白溶液中加入10 μL Avidin-FITC,避光室温孵育1 h后,将组蛋白溶液放在4 ℃透析过夜,以去除未与组蛋白结合的Avidin-FITC。绿色荧光标记的DNA-组蛋白复合物的制备是将200 μL透析后的绿色荧光标记的组蛋白与2 nmol 22-nt DNA(序列为5′-GTCGCGTGCCAGATCGGGGTTC-3′)干粉振荡混匀,在4 ℃转盘结合1 h以上。
1.3.3 流式细胞术分析对组蛋白的内化
将HEK293T细胞接种于12孔板(1 mL),每孔接种约2×105个细胞,置于37 ℃含5%二氧化碳的培养箱中静置培养24 h,待铺板率达到80%(S/S)左右时准备实验。将100 μg提前制备的绿色荧光标记的(DNA-)组蛋白与细胞共孵育1 h,孵育结束后PBS洗涤细胞1次,用含EDTA的胰酶消化5 min后再用PBS洗涤2次,上机检测内化效率。
1.3.4 荧光共定位分析
将HEK293T细胞接种于1.5 mL共聚焦显微镜专用培养皿中,待铺板率达到80%(S/S)左右时准备实验。将绿色荧光标记的组蛋白加入到培养皿中,使其终质量浓度为100 μg/mL,在37 ℃含5%二氧化碳培养箱中孵育1 h,然后加入0.06 μL Lyso-Tracker-Red,孵育20 min后,更换新鲜培养基,在显微镜下观察、拍摄。
1.3.5 活性氧检测
将HEK293T细胞接种于12孔板(1 mL),每孔接种约2×105个细胞,待铺板率达到约80%(S/S)时准备实验。按照说明书操作原位装载探针,具体步骤为用无血清培养基1∶1 000稀释荧光探针,使其终浓度为10 μmol/L,去除培养基后,每孔加入500 mL稀释好的荧光探针,37 ℃细胞培养箱孵育30 min,用无血清培养基洗涤3次,以充分去除细胞外的荧光探针。向12孔板每孔中加入100 μg(DNA-)组蛋白,使实验组培养基内组蛋白质量浓度为100 μg/mL,与细胞共孵育1 h后使用PBS洗涤一次细胞,随后用200 μL PBS吹打混匀并收集细胞,使用流式细胞仪进行绿色荧光的检测。
1.3.6 细胞活性与毒性检测实验
使用Calcein AM/PI染色试剂盒进行细胞活性与毒性检测实验。接种约1×105个细胞于铺有细胞爬片的24孔板中(0.5 mL),置于37 ℃细胞培养箱静置培养24 h后每孔加入250 μL Calcein AM/PI检测工作液,37 ℃避光孵育30 min,孵育结束后,在荧光显微镜下观察染色效果,并拍照记录。
1.3.7 细胞因子检测
将RAW264.7细胞接种于12孔板(1 mL),每孔接种约2×105个细胞,置于37 ℃细胞培养箱静置培养24 h后,每个孔中加入100 μL 1 000 μg/mL的组蛋白或DNA-组蛋白复合物,与细胞共同培养8 h后取上清培养基,3 000 r/min离心3 min,每个样品设置4个平行;使用ELISA试剂盒检测炎症因子TNF-α以及IL-6的释放水平。具体步骤如下:
(a)按比例混合捕获抗体及包被缓冲液,涡旋振荡30 s后加入96孔板中,每孔加100 μL,4 ℃密封条件下过夜,使抗体与孔板底部偶联,用含0.05%吐温的PBS缓冲液洗涤3次(后续步骤中洗涤均使用此缓冲液)。
(b)将200 μL ELISA/ELISPOT稀释液加入到已包被抗体的96孔板中,室温下封闭2 h,洗涤1次以上。
(c)用去离子水将TNF-a、IL-6标品稀释至1 000 pg/mL。用去离子水将样品稀释10倍,标准品梯度稀释3次后分别加入孔板中,并用稀释液设置空白对照,每孔体积100 μL,室温密封条件下反应2 h,洗涤3次。
(d)按比例混合检测抗体及稀释液,涡旋振荡30 s后加入96孔板中,每孔100 μL,室温密封条件下反应1 h,洗涤3次。
(e)按比例混合Avidin-HRP以及稀释液,涡旋振荡30 s后加入96孔板中,每孔100 μL,室温密封条件下0.5 h,洗涤5次。
(f)将TMB显色剂按照每孔100 μL加入96孔板,室温避光条件下反应15 min,此时样品由无色变为蓝色;
(g)每孔加入100 μL终止液终止反应,样品由蓝色变为黄色;
(h)用酶标仪测量各孔在450 nm波长下的吸光度值;根据标准曲线及稀释倍数计算各孔样品的细胞因子浓度。
1.4 统计学分析
所有实验均采用至少3个独立数据样本分析,使用GraphPad Prism 9软件计算双尾非配对t-test检验分析统计学显著性,在P<0.05时表示差异具有统计学意义。对于本实验结果标记如下:P≥0.05标记为ns;P<0.05标记为*;P<0.01标记为**;P<0.001标记为***;P<0.000 1标记为****。
2 结果与分析
2.1 敲除RAGE降低HEK293T细胞对组蛋白的内化能力
RAGE与其配体绑定后,多引发吞噬作用[14-15],为了观察HEK293T细胞是否能够识别内化可溶性组蛋白分子,本研究使用绿色荧光(FITC)标记了组蛋白,将其加入到细胞培养基中,使终质量浓度为100 μg/mL,与HEK293T细胞共孵育1 h后,在显微镜下观察。结果显示,野生型细胞呈现明显的组蛋白与溶酶体共定位现象(图1中箭头所指黄色荧光点即为绿色荧光标记的组蛋白与红色荧光标记的溶酶体共定位,比例尺为10 μm),而在RAGE-敲除细胞内则未发现有荧光共定位现象(图1),说明在HEK293T细胞中,RAGE可以介导识别并内化组蛋白。
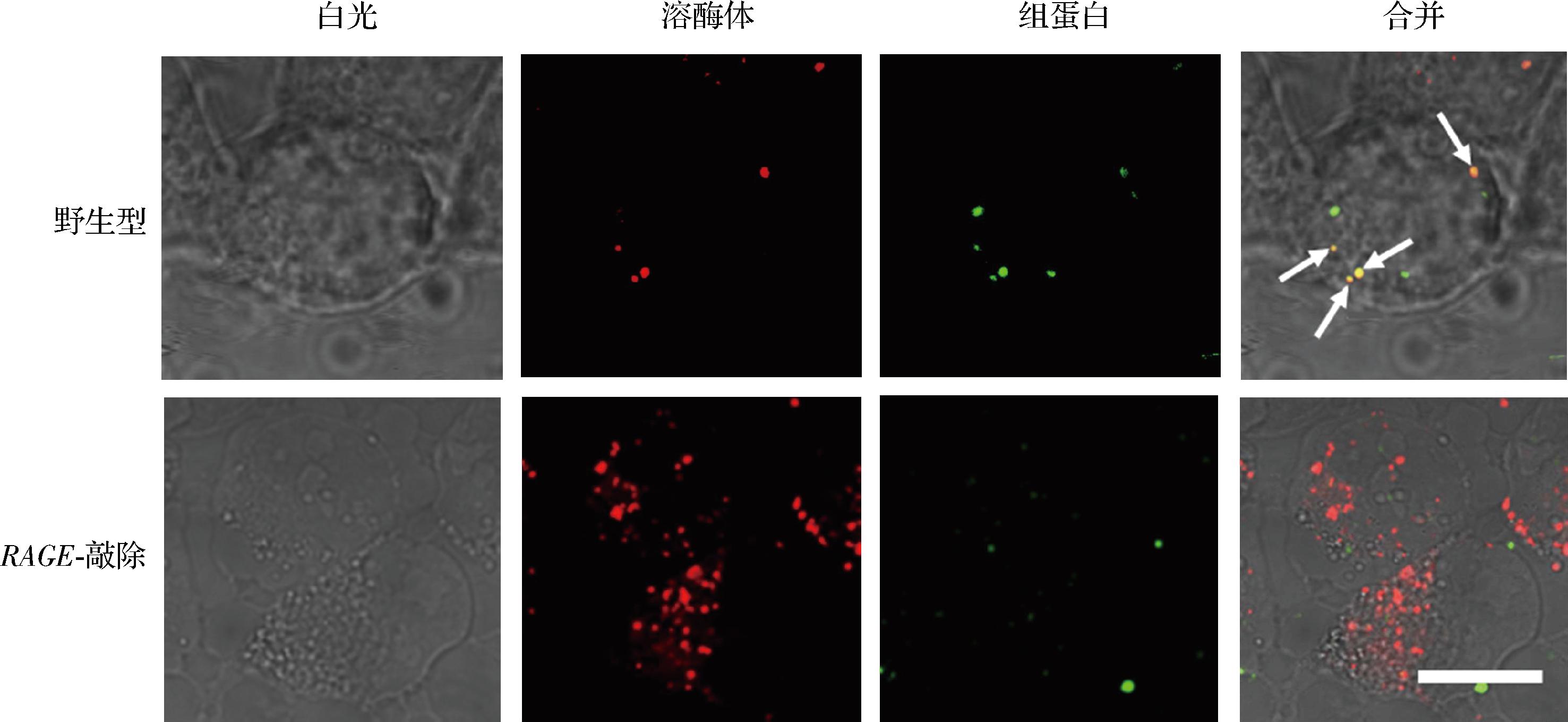
图1 荧光显微镜分析野生型与RAGE-敲除细胞内化组蛋白
Fig.1 Analysis of histone uptake in wild-type and RAGE-KO cells by fluorescence microscopy
为了进一步量化比较野生型和RAGE-敲除细胞对组蛋白的内化能力,采用流式细胞术进行分析。将细胞与100 μg/mL组蛋白共孵育1 h后上机检测,结果显示,在敲除RAGE后,HEK293T细胞对组蛋白的内化能力降低约80%(图2-b),说明RAGE在HEK293T细胞内化组蛋白过程中起到了主导作用。有报道称DNA可以增强组蛋白对TLR2、TLR4的激活作用[16],因此接下来检测了细胞对DNA-组蛋白复合物的内化能力。实验数据显示,将组蛋白与DNA结合后再与细胞共孵育可以显著提升细胞对组蛋白的内化效率,提升约3倍(图2-b)。该实验结果说明DNA可以增强组蛋白对RAGE的激活作用。

a-野生型与RAGE-敲除细胞绿色荧光通道FACS直方图对比; b-FACS直方图的量化表示
图2 敲除RAGE抑制HEK293T细胞对组蛋白的内化
Fig.2 Knock out of RAGE inhibits histone uptake in HEK293T cells
2.2 内化组蛋白不会导致细胞死亡
许多研究表明,胞外组蛋白在体内、体外均表现出明显的细胞毒性[7, 17],因此本研究分析了(DNA-)组蛋白与细胞共孵育后的对细胞活性的影响。如图3所示,将细胞与100 μg/mL组蛋白共孵育1 h后,不论野生型或RAGE-敲除细胞,均呈现钙黄绿素-AM阳性(有绿色荧光)、碘化丙啶阴性(无红色荧光)现象(图3),这表明在本实验条件下,野生型与RAGE-敲除细胞均未在与(DNA-)组蛋白共孵育后造成细胞死亡。

a-野生型细胞染色结果图;b-RAGE-敲除细胞染色结果图
图3 内化组蛋白不会导致细胞死亡
Fig.3 Uptake of histone does not induce cell death
2.3 组蛋白能够通过RAGE导致胞内活性氧浓度升高
RAGE与其配体的绑定会激活多种信号通路,从而引发炎症反应,例如,由活性氧水平升高导致线粒体损伤所引发的炎症反应[18]。因此本研究检测了野生型和RAGE-敲除细胞与100 μg/mL(DNA-)组蛋白共孵育1 h后胞内的活性氧水平。结果显示,组蛋白和DNA-组蛋白复合物均可使野生型细胞的胞内活性氧浓度提高,但(DNA-)组蛋白无法使RAGE-敲除细胞的胞内活性氧浓度升高(图4-c)。DNA-组蛋白复合物提升活性氧水平约为组蛋白的3倍(图4-b),为了排除游离DNA对结果的影响,研究也设置了DNA对照组,结果表明游离DNA不能引起胞内活性氧水平升高(图4-b),这说明组蛋白可以通过激活RAGE导致胞内活性氧水平升高,DNA可以增强组蛋白对RAGE的激活。
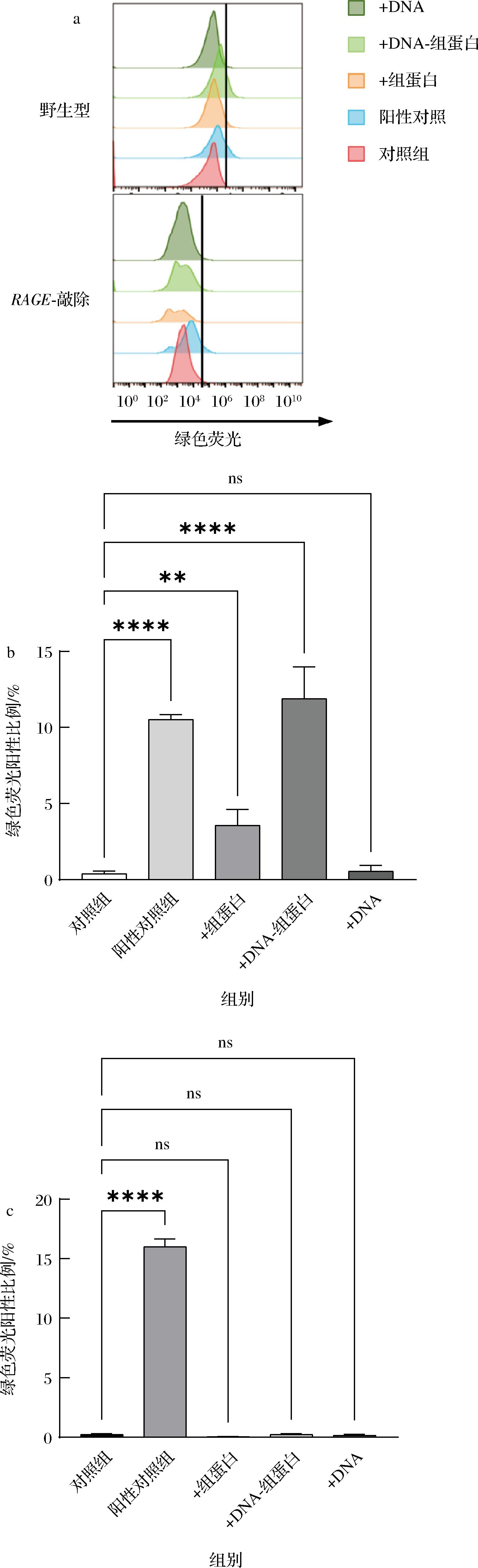
a-野生型和RAGE-敲除细胞绿色荧光通道的FACS直方图对比; b-野生型细胞FACS直方图的量化表示; c-RAGE-敲除细胞FACS直方图的量化表示
图4 组蛋白通过RAGE导致胞内活性氧水平升高
Fig.4 Histone induces ROS production via RAGE
2.4 组蛋白通过RAGE诱导细胞释放炎症因子
RAGE与其配体的绑定会通过多条途径激活下游信号通路,从而导致炎症因子的释放,引发炎症反应[19]。接下来,本研究检测了组蛋白和DNA-组蛋白复合物能否激活RAGE诱导炎症因子的释放。本实验选用巨噬细胞检测炎症因子的释放水平,将细胞与100 μg/mL组蛋白共孵育8 h后取培养基上清进行ELISA检测,结果发现,在与组蛋白共孵育后,野生型巨噬细胞内的TNF-α以及IL-6表达量显著增加,将DNA与组蛋白绑定后能够进一步提升炎症因子的水平,而RAGE-敲除细胞内炎症因子无上调现象(图5)。该结果表明组蛋白能够激活RAGE信号通路,导致胞内炎症反应。
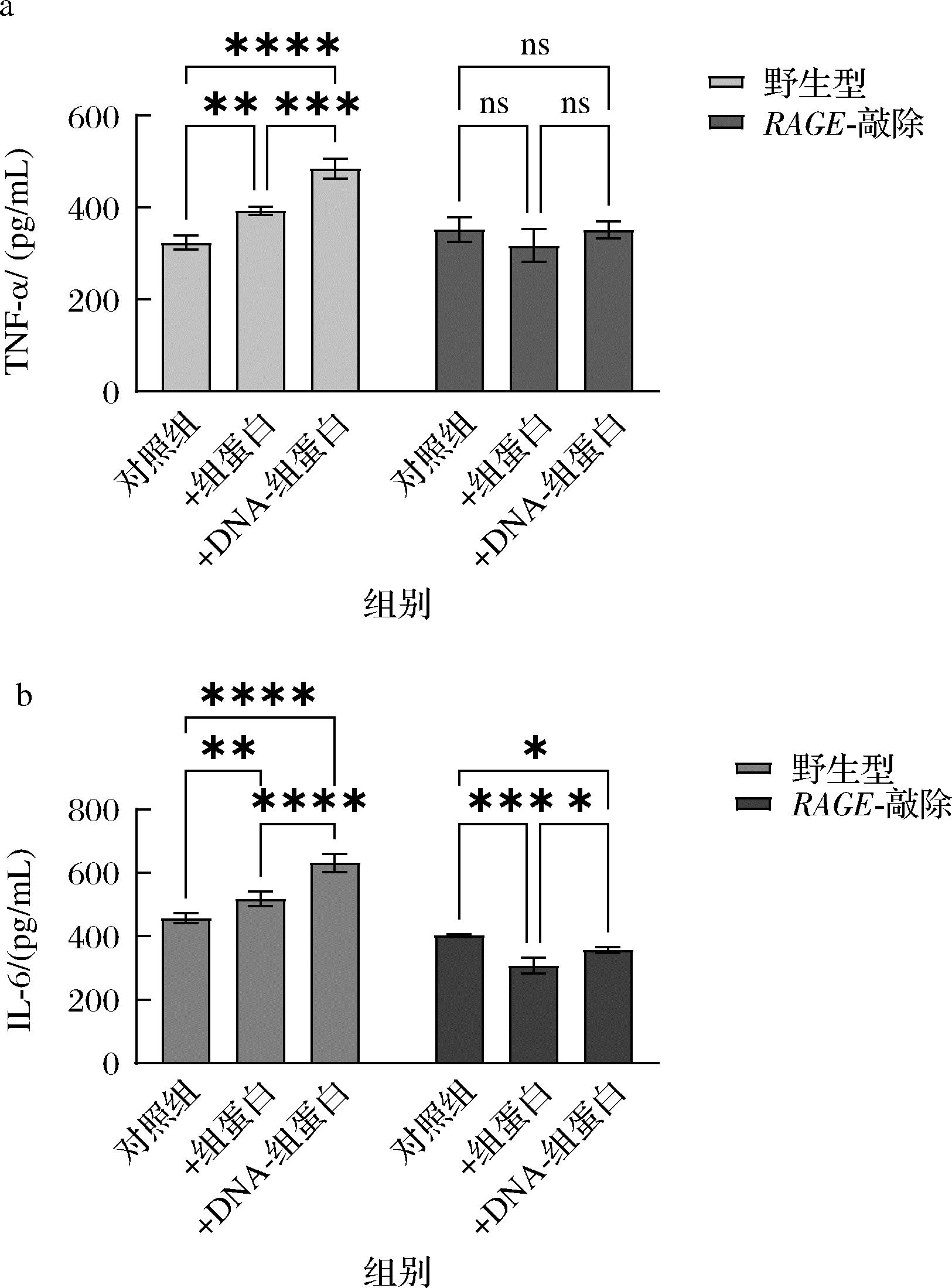
a-ELISA检测TNF-α水平;b-ELISA检测IL-6水平
图5 组蛋白通过RAGE诱导细胞释放炎症因子
Fig.5 Histones induce pro-inflammatory cytokines in macrophages via RAGE
3 结论与讨论
研究表明,RAGE与其配体结合后多引发吞噬作用,例如,使用RAGE特异性抗体封闭的巨噬细胞或Rage-/-小鼠来源的巨噬细胞对凋亡细胞的吞噬活性均有降低[20]。在之前的研究中,发现RAGE参与了非专职吞噬细胞对组蛋白修饰的微米颗粒的吞噬,本研究结果表示,RAGE能够介导细胞对可溶性组蛋白分子的内化,该结果支持了组蛋白是RAGE配体的假设。
近来诸多研究表明组蛋白有强细胞毒性与促炎活性。胞外组蛋白能够激活机体的免疫应答,引发炎症反应,造成并发症从而加重疾病,例如,胞外组蛋白被认为是致死性全身炎症的潜在介质,在多种小鼠器官损伤的模型中,胞外组蛋白的含量均有上升,高浓度胞外组蛋白能够引发无菌性炎症,导致急性肺损伤、多器官功能衰竭,甚至死亡[16, 21]。而在本研究中,将哺乳动物细胞与组蛋白共孵育后并不会造成细胞死亡,这说明在本研究的实验条件下,组蛋白不会表现出强细胞毒性,因此可以将本实验条件作为研究组蛋白与RAGE相关机制的哺乳动物细胞模型。
RAGE作为模式识别受体,能够识别多种DAMPs,其配体的种类决定了它可以参与调控多种病理过程,如糖尿病、神经退行性疾病(如阿尔兹海默症)、慢性炎症反应等[22-23]。与配体结合后,RAGE能够通过刺激NADPH氧化酶,促进胞内活性氧的生成[24],RAGE信号通路的激活还能够促进炎症因子的释放,从而介导炎症反应[18-19]。在本研究中,RAGE与组蛋白结合后能够显著提升胞内活性氧水平,并能够促使TNF-α、IL-6等炎症因子的表达,该结果说明组蛋白能够作为RAGE的配体激活其下游信号通路。
生理条件下,胞外组蛋白多以DNA-组蛋白复合物的形式存在,例如,在炎症反应中被释放到胞外的NETs,以及细胞在凋亡、坏死过程中释放的核小体等。先前研究表明,DNA能够增强组蛋白诱导的血栓的生成[9],本研究将组蛋白与DNA结合,模拟胞外组蛋白的核小体存在形式,结果显示将组蛋白与DNA绑定能够增强其对RAGE的激活作用,该结果更加强化了本研究发现在病理生理过程的重要性。由于DNA是RAGE的配体之一,因此推测DNA能够增强组蛋白与RAGE绑定的亲和力,从而进一步激活RAGE及其下游反应,该假设还需要进一步的结构分析证明。
目前组蛋白在体内诱发疾病的机理尚不明晰,本研究结果表明组蛋白能够通过激活RAGE诱发炎症反应,初步明晰了RAGE与组蛋白之间的联系,为研究RAGE和组蛋白相关的疾病提供了思路,为后续探索组蛋白相关的炎症反应的分子机制提供了一个新的研究方向。
[1] SCHMIDT A M, VIANNA M, GERLACH M, et al.Isolation and characterization of two binding proteins for advanced glycosylation end products from bovine lung which are present on the endothelial cell surface[J].Journal of Biological Chemistry, 1992, 267(21):14987-14997.
[2] NEEPER M, SCHMIDT A M, BRETT J, et al.Cloning and expression of a cell surface receptor for advanced glycosylation end products of proteins[J].Journal of Biological Chemistry, 1992, 267(21):14998-15004.
[3] CHEN M C, CHEN K C, CHANG G C, et al.RAGE acts as an oncogenic role and promotes the metastasis of human lung cancer[J].Cell Death &Disease, 2020, 11(4):265.
[4] SIMS G P, ROWE D C, RIETDIJK S T, et al.HMGB1 and RAGE in inflammation and cancer[J].Annual Review of Immunology, 2010, 28:367-388.
[5] SHI J, XU H, CAVAGNARO M J, et al.Blocking hmgb1/rage signaling by berberine alleviates a1 astrocyte and attenuates sepsis-associated encephalopathy[J].Frontiers in Pharmacology, 2021,12:760186.
[6] PUGAZHENTHI S, QIN L M, REDDY P H.Common neurodegenerative pathways in obesity, diabetes, and Alzheimer′s disease[J].Biochimica et Biophysica Acta-Molecular Basis of Disease, 2017, 1863(5):1037-1045.
[7] XU J, ZHANG X M, PELAYO R, et al.Extracellular histones are major mediators of death in sepsis[J].Nature Medicine, 2009, 15(11):1318-1321.
[8] ALLAM R, SCHERBAUM C R, DARISIPUDI M N, et al.Histones from dying renal cells aggravate kidney injury via TLR2 and TLR4[J].Journal of the American Society of Nephrology, 2012, 23(8):1375-1388.
[9] SEMERARO F, AMMOLLO C T, MORRISSEY J H, et al.Extracellular histones promote thrombin generation through platelet-dependent mechanisms:Involvement of platelet tlr2 and tlr4[J].Blood, 2011, 118(7):1952- 961.
[10] ALLAM R, DARISIPUDI M N, TSCHOPP J, et al.Histones trigger sterile inflammation by activating the nlrp3 inflammasome[J].European Journal of Immunology, 2013, 43(12):3336-3342.
[11] MONACH P A, HUEBER W, KESSLER B, et al.A broad screen for targets of immune complexes decorating arthritic joints highlights deposition of nucleosomes in rheumatoid arthritis[J].Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(37):15867-15872.
[12] KANG R, ZHANG Q H, HOU W, et al.Intracellular Hmgb1 inhibits inflammatory nucleosome release and limits acute pancreatitis in mice[J].Gastroenterology, 2014, 146(4):1097-1107.
[13] YANG Y, LIU G Y, LI F, et al.Receptor for advanced glycation end-products (rage) mediates phagocytosis in nonprofessional phagocytes[J].Communications Biology, 2022, 5(1):824.
[14] XU J, JIANG Y, WANG J, et al.Macrophage endocytosis of high-mobility group box 1 triggers pyroptosis[J].Cell Death &Differentiation, 2014, 21(8):1229-1239.
[15] SIROIS C M, JIN T, MILLER A L, et al.Rage is a nucleic acid receptor that promotes inflammatory responses to DNA[J].Journal of Experimental Medicine, 2014, 211(5):1001.
[16] XU J, ZHANG X M, MONESTIER M, et al.Extracellular histones are mediators of death through tlr2 and tlr4 in mouse fatal liver injury[J].Journal of Immunology, 2011, 187(5):2626-2631.
[17] ALLAM R, KUMAR S V R, DARISIPUDI M N, et al.Extracellular histones in tissue injury and inflammation[J].Journal of Molecular Medicine, 2014, 92(5):465-472.
[18] PIRAS S, FURFARO A L, DOMENICOTTI C, et al.RAGE expression and ROS generation in neurons:Differentiation versus damage[J].Oxidative Medicine and Cellular Longevity, 2016, 2016:9348651.
[19] LI J S, JI T, SU S L, et al.Mulberry leaves ameliorate diabetes via regulating metabolic profiling and ages/rage and p38 mapk/nf-κb pathway[J].Journal of Ethnopharmacology, 2022, 283:114713.
[20] FRIGGERI A, BANERJEE S, BISWAS S, et al.Participation of the receptor for advanced glycation end products in efferocytosis[J].Journal of Immunology, 2011, 186(11):6191-6198.
[21] SCHORN C, JANKO C, KRENN V, et al.Bonding the foe-NETting neutrophils immobilize the pro-inflammatory monosodium urate crystals[J].Frontiers In Immunology, 2012, 3:376.
[22] SHU A M, DU Q, CHEN J, et al.Catalpol ameliorates endothelial dysfunction and inflammation in diabetic nephropathy via suppression of rage/rhoa/rock signaling pathway[J].Chemico-Biological Interactions, 2021, 348:109625.
[23] PAUDEL Y N, ANGELOPOULOU E, PIPERI C, et al.Impact of HMGB1, RAGE, and TLR4 in Alzheimer′s Disease (AD):From Risk Factors to Therapeutic Targeting[J].Cells, 2020, 9(2):383.
[24] MATSUI T, YAMAGISHI S I, TAKEUCHI M, et al.Irbesartan inhibits advanced glycation end product (AGE)-induced proximal tubular cell injury in vitro by suppressing receptor for AGEs (RAGE) expression[J].Pharmacological Research, 2010, 61(1):34-39.