人体肠道内定植复杂的微生物群落,它们共同构成一个稳定的肠道微生态,这些细菌或通过与宿主协同作用或者自身发挥作用,对维护人体健康具有重要意义[1-2]。肠道微生物可以影响代谢、免疫和神经调节,菌群结构的紊乱会导致不同疾病的发生和发展。菌群主要通过自身的代谢产物发挥潜在益生作用,其中,短链脂肪酸(short chain fatty acids, SCFA)是最丰富的代谢物,增加短链脂肪酸的含量有助于降低肠道pH,抑制有害菌的生长,同时对维护肠道稳态,保护肠屏障,缓解炎症和肥胖等具有重要的作用。其中,丁酸盐是结肠细胞的主要能量来源,还具有一定的抗炎作用[3]。
普拉梭菌(Faecalibacterium prausnitzii, F.prausnitzii)是健康人群肠道内丰度较高的物种之一,因其具有潜在益生作用而受到越来越多的关注,许多疾病的发生都与普拉梭菌丰度降低相关。研究表明,在老年人、肥胖人群、Ⅱ型糖尿病患者、特应性皮炎和炎症性肠病(inflammatory bowel disease, IBD)患者肠道内,该物种丰度都显著低于健康人群[4-6]。其次,普拉梭菌也逐渐发展为区别克罗恩病(Crohn′s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)的生物标志物。研究发现,普拉梭菌通过促进抗炎因子的分泌发挥抗炎作用,多项动物实验表明普拉梭菌能够缓解葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的结肠炎[7]。除代谢性疾病之外,许多研究认为普拉梭菌也是调控肠脑轴功能的关键物种,研究表明患有轻度认知障碍受试者的肠道中普拉梭菌丰度比健康人群低,而补充普拉梭菌菌株能够改善阿尔兹海默症小鼠的认知障碍[8]。尽管许多证据证明普拉梭菌对人体具有重要益生作用,但是由于普拉梭菌不可食用和对氧气敏感等特点限制它的发展和应用,因此基于膳食因子和菌群互作是目前最简便有效调节普拉梭菌丰度的方式。
膳食因子是影响肠道菌群结构的最主要因素,通过摄入益生元等物质可以在一定程度上调节菌群结构,促进有益菌生长,抑制有害菌繁殖[9]。研究发现菊粉是重要的双歧因子,可以增加肠道中双歧杆菌丰度[10]。双歧杆菌作为益生菌可以产生大量的乙酸,而乙酸是肠道微生物合成丁酸的重要前体物质[11]。肠道微生物通过复杂的相互作用处于动态平衡,物种之间形成复杂的互作网络,既可以竞争消耗营养物质,也可以协同促进[12-13]。基于此,揭示微生物之间的相互作用也是促进普拉梭菌增殖的重要手段[14]。
本研究建立双歧杆菌与普拉梭菌在菊粉中的共培养模式,通过测定普拉梭菌的菌落数、丁酸盐产量和菊粉利用程度来评估双歧杆菌对普拉梭菌生长的促进作用,进一步通过动物实验探究以菊粉为益生元,双歧杆菌在体内促进普拉梭菌增殖的潜力。
1 材料与方法
1.1 材料、动物、试剂
菊粉(纯度>90%)、酪蛋白胨,上海创赛科技有限公司;葡萄糖、氯化钠、无水硫酸钠、乙醚等其他所有试剂,国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit)、溶菌酶,天根生化科技(北京)有限公司;粪便DNA提取试剂盒(Fast DNA SPIN Kit for Feces),美国MP biomedicals公司;胶回收试剂盒,德国Qiagen公司;普拉梭菌特异性引物,生工生物工程(上海)股份有限公司;20只6周龄无特定病原体(specific pathogen free, SPF)级C57BL/6 J小鼠,北京维通利华实验动物技术有限公司。
1.2 仪器与设备
DG250厌氧工作箱,英国Don Whitley公司;Infinite BZ0酶标仪,瑞士Tecan公司;GR60DA压力蒸汽灭菌锅,厦门致微仪器有限公司;GC-MS,日本岛津公司;ICS-3000离子色谱仪和脉冲安培检测器,美国Dionex公司;离心机,德国Eppendorf公司;高通量组织破碎仪,宁波新芝生物科技股份有限公司;PCR仪,美国Bio-Rad公司;2000C超微量分光光度计,美国Nano Drop公司;振荡器,德国IKA公司。
1.3 实验方法
1.3.1 菌株的活化与鉴定
普拉梭菌CCFM1203和P45均分离自成人的粪便;普拉梭菌A2-165,购自DSMZ德国微生物和细胞培养物保藏中心;3株长双歧杆菌、3株假小链双歧杆菌、2株两歧双歧杆菌、3株动物双歧杆菌和3株短双歧杆菌菌,分离自成人粪便。
分别将普拉梭菌种子液和双歧杆菌种子液接种至YCFA液体培养基和MRS液体培养基(添加0.05% L-半胱氨酸盐酸盐)中,连续活化3代,放置于厌氧工作站中,在37 ℃的条件下培养24~48 h。
菌种鉴定:取菌泥DNA的PCR产物测序,最后在美国NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行BLAST比对,确认菌种。
1.3.2 生长曲线测定
单培养:将普拉梭菌和双歧杆菌分别以2%(体积分数)接种于5 mL菊粉YCFA液体培养基中,在厌氧箱中37 ℃培养48 h,每组设置3个平行。共培养:将普拉梭菌和双歧杆菌以1∶1混合,以2%(体积分数)接种于5 mL菊粉YCFA液体培养基中,在厌氧箱中37 ℃培养48 h,每组设置3个平行。将单培养和共培养体系菌液加至96微孔板中,采用多功能酶标仪Tecan Infinite BZ0测定OD600,每隔30 min自动检测一次且连续测定48 h,以此评估菌株单培养和共培养时利用菊粉的能力。
1.3.3 菌落数测定
通过荧光定量PCR实验分别测定单培养和共培养下普拉梭菌的菌落数。取1 mL培养48 h的菌悬液提取纯菌DNA,方法参照天根细菌基因组DNA提取试剂盒说明书,将所得DNA作为qPCR反应的模板。普拉梭菌特异性引物:F:5′- GGAGGAAGAAGGTCTTCG G-3′;R:5′-AATTCCGCCTACCTCTGCACT-3′。
1.3.4 短链脂肪酸含量测定
取体外发酵所得上清液500 μL于2 mL无菌离心管中,加入40 μL 10%硫酸酸化,振荡30 s混匀。转移至通风橱中,加入1 mL无水乙醚,振荡30 s混匀,以12 000 r/min的转速在4 ℃下离心15 min,将上清液转移至装有0.25 g无水硫酸钠的离心管中静置15 min以充分除取水分,以同样条件离心,将上清液过膜转移至气相小瓶。采用Rtx-Wax柱(30 m×0.25 μm×0.25 μm)和质谱检测器(GC-MS-QP2010Vitta,system)对样品中各短链脂肪酸分离,设置N2为载气,流速为1 mL/min,进样体积为1 μL、分流比为10∶1,初始柱温为100 ℃,以7.5 ℃/min升温速率升温至140 ℃,再以60 ℃/min升温至200 ℃。在200 ℃保持3 min,进样温度为240 ℃,电离温度为220 ℃。
1.3.5 发酵上清液菊粉降解程度测定
样品前处理:取1 mL发酵48 h后的培养上清液,加入等体积乙腈置于冰上30 min沉淀蛋白,在4 ℃下以12 000 r/min的转速离心15 min,取上清液,置于真空浓缩仪中3 h,用500 μL超纯水复溶,用0.22 μm微孔膜过滤,装入进样小瓶等待检测。流动相为洗脱液A:超纯水;洗脱液B:1 mol/L NaAc;洗脱液C:250 mmol/L NaOH;流速0.5 mL/min。洗脱梯度:0 min,4% B和38% C;40 min,40% B和38% C;41 min,4% B和30% C;50 min,4% A和38% B。使用离子色谱仪(ICS-5000)和高性能阴离子交换色谱(high performance anion exchange chromatography, HPAEC)和脉冲安培检测器(pulsed amperometric detection, PAD)进行,采用CarboPac PA200色谱柱(Dionex)。
1.3.6 动物实验设计
本研究使用20只SPF C57BL/6 J雄性小鼠,饲养于江南大学实验动物中心SPF屏障环境中,温度控制在20~26 ℃,相对湿度为40%~70%,照明制度为标准的12 h光照和12 h黑暗循环,每天更换饮水和饲料,饲料为普通饲料,小鼠自由进食进水。所有操作均按照《江南大学实验动物管理办法》执行,所有动物伦理均通过江南大学实验动物福利伦理委员批准。
双歧杆菌干预对小鼠肠道中普拉梭菌丰度及生理功能的影响(伦理批准号:JN.No20220930c080 1115【396】)。将20只6周龄小鼠随机分为4组,每组8只,适应期一周结束后开始实验,实验共计5周,小鼠饲料为普通饲料,自由饮水,具体实验方案设计见表1。
表1 动物实验方案设计
Table 1 The design of animal experiment

组别第1周第2周第3~5周空白组普拉梭菌组菊粉组长双歧杆菌+菊粉组适应性喂养,常规饲料,自由进水灌胃0.2 mL生理盐水灌胃0.2 mL普拉梭菌CCFM1203菌悬液(1×109 CFU/100 μL)灌胃0.2 mL生理盐水灌胃0.2 mL普拉梭菌CCFM1203和长双歧杆菌CCFM1306菌悬液(1×109 CFU/100 μL)灌胃菊粉(300 mg/kg)
1.3.7 粪便DNA提取与16S rRNA测序
取干预至第4周最后一天的小鼠粪便,按照FastDNA Spin Kit for Feces试剂盒提取获得小鼠粪便DNA,然后以其为模板对细菌的V3~V4片段进行PCR。正向引物341F(5′-CCTAYGGGRBGCASCAG-3′),反向引物806R(5′-GGACTACNNGGGTATCTAAT-3′)。用12%琼脂糖凝胶电泳回收PCR扩增产物,按照胶回收试剂盒说明书进行。在Illumina Miseq PE300平台上进行上机检测,下机数据采用QIIME II软件分析。
1.3.8 数据统计与分析
本文实验数据均以“平均值±标准差”(Mean±SD)表示,两组间差异用非配对t检验方法进行统计学分析,未特别说明的均表示与空白组(最左侧柱子)进行显著性差异标注,P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1,利用Graph pad Prism 9.0软件进行绘图。利用生科云(https://www.bioincloud.tech)进行菌群分析。
2 结果与分析
2.1 不同种双歧杆菌促进普拉梭菌在菊粉中菌落数增加
肠道菌群之间存在紧密的互作网络,微生物之间通过互养关系实现协同增殖[15-16],研究发现菊粉可以促进双歧杆菌生长[17]并且与产丁酸菌之间形成互养关系[18]。基于前人研究结果,初步探究双歧杆菌是否与普拉梭菌之间存在互养关系。本研究分别将普拉梭菌CCFM1203、长双歧杆菌CCFM1306和青春双歧杆菌FXJCHJ15M4单培养或共同培养于0.5%菊粉YCFA培养基中,生长情况如图1所示,结果发现普拉梭菌CCFM1203在含有菊粉的培养基中几乎难以生长,而长双歧杆菌CCFM1306和青春双歧杆菌FXJCHJ15M4单独培养的生长情况优于普拉梭菌CCFM1203,其OD600约为0.5。但是当普拉梭菌CCFM1203分别和2株双歧杆菌共同培养于含有菊粉的培养基中时,菌液的OD600可以达到1.0以上,生长情况远强于任何一株菌单独培养,由此推断普拉梭菌和双歧杆菌之间存在相互促进作用。
为进一步探究两菌之间是否存在相互促进作用,以及普拉梭菌和其他种双歧杆菌共培养是否也存在类似现象,本研究选择肠道中常见的长双歧杆菌、假小链双歧杆菌、动物双歧杆菌、两歧双歧杆菌和短双歧杆菌共14株,分别与普拉梭菌在含菊粉的培养基中共同培养,测定普拉梭菌在单独培养和共同培养下的菌落数变化,结果如图2所示。总体来看,3株不同的普拉梭菌分别与14株双歧杆菌共培养后菌落数均显著增加,普拉梭菌菌落数约提高1.5个数量级左右。其中,长双歧杆菌和假小链双歧杆菌刺激普拉梭菌生长的能力最强且不具有菌株特异性,只有两歧双歧杆菌较其他4种双歧杆菌刺激能力弱。
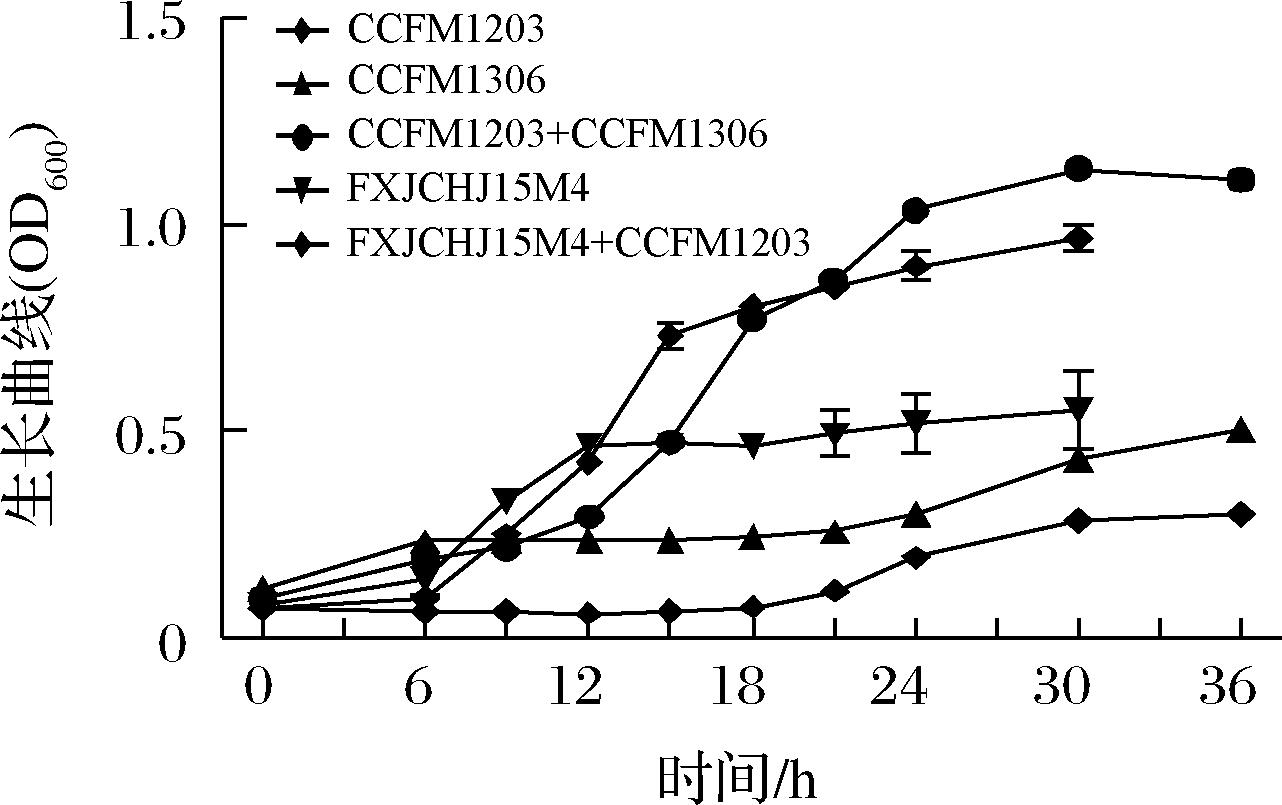
图1 普拉梭菌CCFM1203分别与长双歧杆菌CCFM1306、 青春双歧杆菌FXJCHJ15M4在菊粉中单培养和 共培养的生长曲线
Fig.1 The growth curves of F.prausnitzii CCFM1203, Bifidobacterium longum CCFM1306 and Bifidobacterium adolescens FXJCHJ15M4 in mono- and coculture in inulin

a-普拉梭菌CCFM1203分别与不同双歧杆菌单培养和共培养的菌落数;b-普拉梭菌P45分别与不同双歧杆菌单培养和共培养的菌落数; c-普拉梭菌A2-165分别与不同双歧杆菌单培养和共培养的菌落数
图2 普拉梭菌与不同双歧杆菌在菊粉中单培养和共培养的菌落数
Fig.2 The cell number of F.prausnitzii in mono- and co-culture with Bifidobacterium in inulin
注:所有组别均与图片第一列(单菌培养组别)有显著性差异,***表示P<0.001;****表示P<0.000 1(下同)。
2.2 不同种双歧杆菌促进普拉梭菌在菊粉中代谢短链脂肪酸含量增加
短链脂肪酸是肠道菌群维护宿主健康的一个重要途径[19],双歧杆菌能够为肠道中产丁酸菌提供乙酸而形成互养[20],普拉梭菌通过分泌丁酸发挥抗炎作用,同时为结肠细胞提供能量[21],因此丁酸浓度也是衡量普拉梭菌生长的一个重要指标[22]。本研究测定普拉梭菌在含菊粉培养基单培养和与双歧杆菌共培养后的短链脂肪酸浓度,结果如图3所示,双歧杆菌与普拉梭菌共培养后发酵上清液中乙酸浓度显著下降,特别是普拉梭菌CCFM1203和P45,同时,发酵上清液中丁酸盐浓度显著增加,其中与假小链双歧杆菌或长双歧杆菌共培养后可产生更多的丁酸,最多可增加10.5倍,而两歧双歧杆菌促进丁酸盐产量的能力较差,共培养后丁酸盐含量仅为单培养的2倍,动物双歧杆菌和短双歧杆菌则促进普拉梭菌产丁酸盐的能力具有菌株特异性,只有其中1株可以显著增加丁酸盐浓度。不同株双歧杆菌刺激普拉梭菌产丁酸盐的能力基本与其提高普拉梭菌生长的能力对应,由此进一步说明双歧杆菌可以刺激普拉梭菌生长。
由于普拉梭菌代谢物主要为丁酸,而乙酸是丁酸合成的重要前体物质,因此肠道中其他代谢乙酸的微生物都有促进普拉梭菌产丁酸的潜力,例如多形拟杆菌和Akkermansia菌都可以分泌乙酸被普拉梭菌利用[23-24]。除乙酸外,普拉梭菌对大多数维生素和氨基酸都是营养缺陷型,罗伊氏乳杆菌可以为普拉梭菌生长提供丰富的硫胺素[25],枯草芽孢杆菌通过分泌核黄素而促进普拉梭菌生长[26],核黄素不仅能够作为生长因子促进普拉梭菌,还能降低氧化还原电势促进普拉梭菌在肠道中的定植[27]。
2.3 长双歧杆菌协同普拉梭菌增殖促进发酵上清液中菊粉的降解
发酵上清液中菊粉的聚合度分布可以说明普拉梭菌和双歧杆菌单培养或共培养利用菊粉的程度,结果如图4所示,普拉梭菌CCFM1203培养36 h后几乎不消耗菊粉,长双歧杆菌CCFM1306可以消耗部分菊粉,但是将普拉梭菌CCFM1203和长双歧杆菌CCFM1306共培养36 h后,发酵上清液中大部分聚合度的菊粉均被降解,两菌共培养后的消耗程度远大于单菌单培养,通过分解大片段的菊粉也产生更多的单糖和二糖等小片段,表明双歧杆菌和普拉梭菌共培养后促进菊粉更彻底被消耗利用。除菊粉之外,许多多糖由于分子质量大而限制了普拉梭菌的利用,基于前期研究,普拉梭菌难以在含有褐藻酸钠的培养基中生长,但是多形拟杆菌能将褐藻酸钠降解成褐藻低聚糖后被普拉梭菌利用[28],由此可筛选其他多糖发掘普拉梭菌与肠道微生物更多互养的可能性。
2.4 双歧杆菌干预对小鼠粪便菌群结构及普拉梭菌丰度的影响
体外实验表明长双歧杆菌能显著增加普拉梭菌在含菊粉培养基中的菌落数,刺激普拉梭菌产更多丁酸进而发挥其益生作用,但肠道内菌群多样性高,物种之间的营养竞争作用或协同作用更加复杂,无法得知在肠道内环境中通过双歧杆菌的协同作用是否可以增加普拉梭菌在肠道中的丰度,因此本研究通过将小鼠分为4个组别,分别是“空白组”,“普拉梭菌组”,“菊粉组”和“长双歧杆菌+菊粉”组探究在体内菊粉和/或双歧杆菌对普拉梭菌丰度的影响。基于前人研究发现,小鼠肠道中几乎不含有普拉梭菌,因此首先给除空白组外所有小鼠灌胃普拉梭菌,使该物种在肠道中定植,随后灌胃菊粉和长双歧杆菌进行干预。图5表示干预1个月后不同组别种每只小鼠粪便菌群结构门水平和属水平物种组成。

a-双歧杆菌单培养及与普拉梭菌共培养后发酵上清液中乙酸浓度;b-普拉梭菌CCFM1203单培养及与不同种双歧杆菌共培养后发酵 上清液中丁酸浓度;c-普拉梭菌P45单培养及与不同种双歧杆菌共培养后发酵上清液中丁酸浓度; d-普拉梭菌A2-165单培养及与不同种双歧杆菌共培养后发酵上清液中丁酸浓度
图3 普拉梭菌与双歧杆菌单培养及共培养后的SCFA浓度
Fig.3 The content of SCFAs of F.prausnitzii and Bifidobacterium in mono- and co-culture
注:图a分为5个组别,各个组别均表示与本组最左侧(双歧杆菌单培养)进行显著性差异标注。未标注表示不具有显著性差异; *表示P<0.05;**表示P<0.01(下同)。
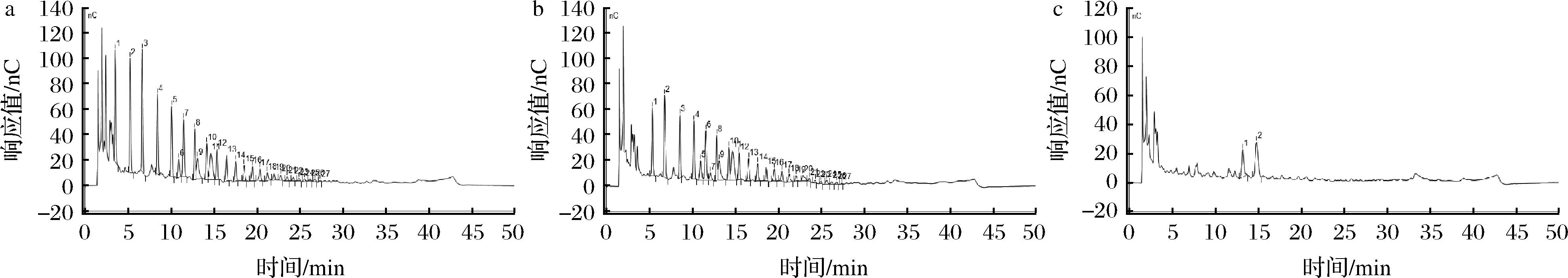
a-普拉梭菌CCFM1203在菊粉中单培养发酵上清液中菊粉聚合度;b-长双歧杆菌CCFM1306在菊粉中单培养发酵上清液中菊粉聚合度; c-拉梭菌CCFM1203和长双歧杆菌CCFM1306在菊粉中共培养发酵上清液中菊粉聚合度
图4 发酵上清液中菊粉分子聚合度
Fig.4 The polymerization degree of inulin in supernatant
图6表明不同干预组别普拉梭菌的丰度均比空白组高,其中只有普拉梭菌组(只灌胃普拉梭菌使其定植,而不进行其他干预)中该物种的丰度显著增加,反而在干预菊粉和长双歧杆菌之后,普拉梭菌的丰度相比于空白组仅有增加的趋势但不具有显著性差异,推断可能是由于给小鼠干预长双歧杆菌和菊粉后,长双歧杆菌能够优先占据优势地位,普拉梭菌缺乏竞争力而难以增殖,这与前人发现的链状双歧杆菌可以增加小鼠肠道中普拉梭菌丰度的结果有所不同[29]。推测由于本实验给小鼠干预长双歧杆菌和普拉梭菌的周期较短,不利于这该株长双歧杆菌在肠道中定植,并且双歧杆菌在小鼠肠道中的定植能力可能有种特异性。
通过LSFse分析,图7表明菊粉的干预会改变肠道菌群结构,显著促进双歧杆菌、乳杆菌和Akkermansia菌在体内增殖并且成为肠道中的优势物种,长双歧杆菌分解菊粉产生的小分子片段可能被其他优势物种优先利用而抑制了与普拉梭菌的协同作用,这与许多研究结果相一致[30]。此外,菊粉干预的剂量可能会影响两种菌的相互作用,可通过设置不同剂量的菊粉浓度进一步探究。
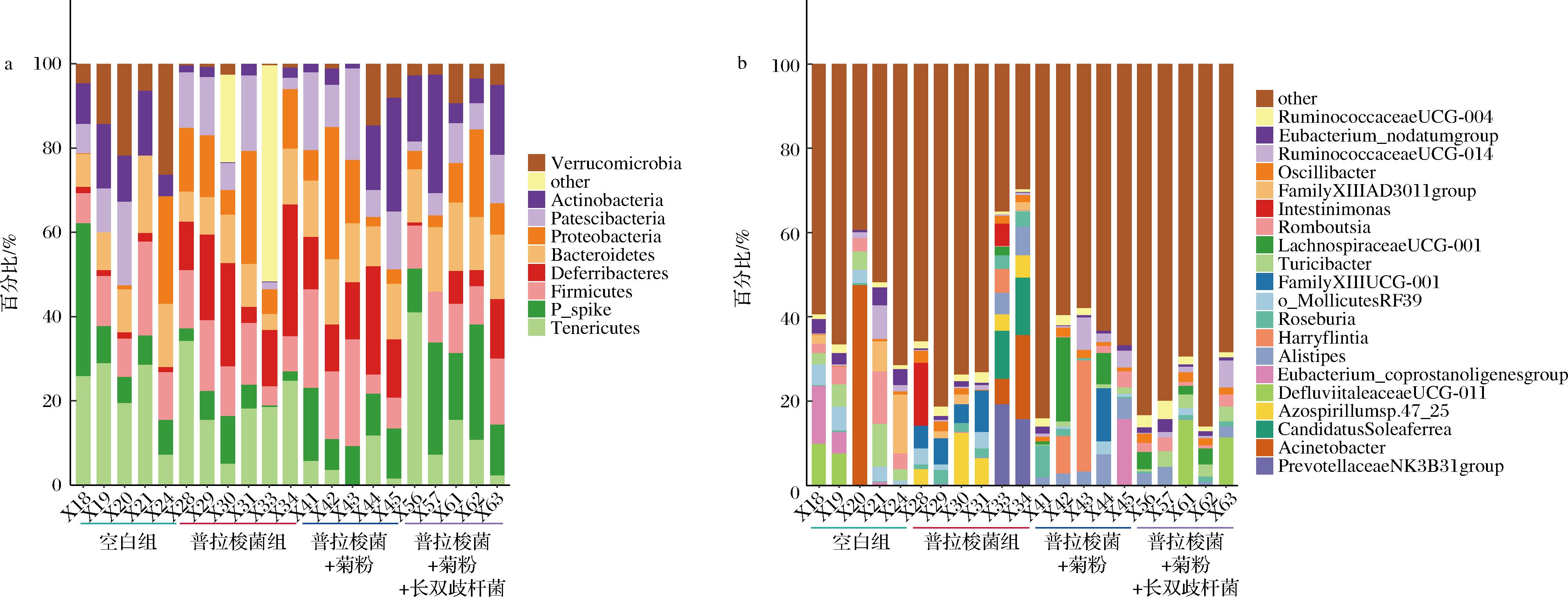
a-门水平;b-属水平
图5 小鼠粪便菌群组成门水平、属水平
Fig.5 Bacteria taxonomic profiling in phylum and genus level
注:图中每个组对应的5根柱子分别表示该组每一只小鼠的粪便菌群的门、属水平组成,如X19、X20、X21分别表示空白组其中3只小鼠的名称。
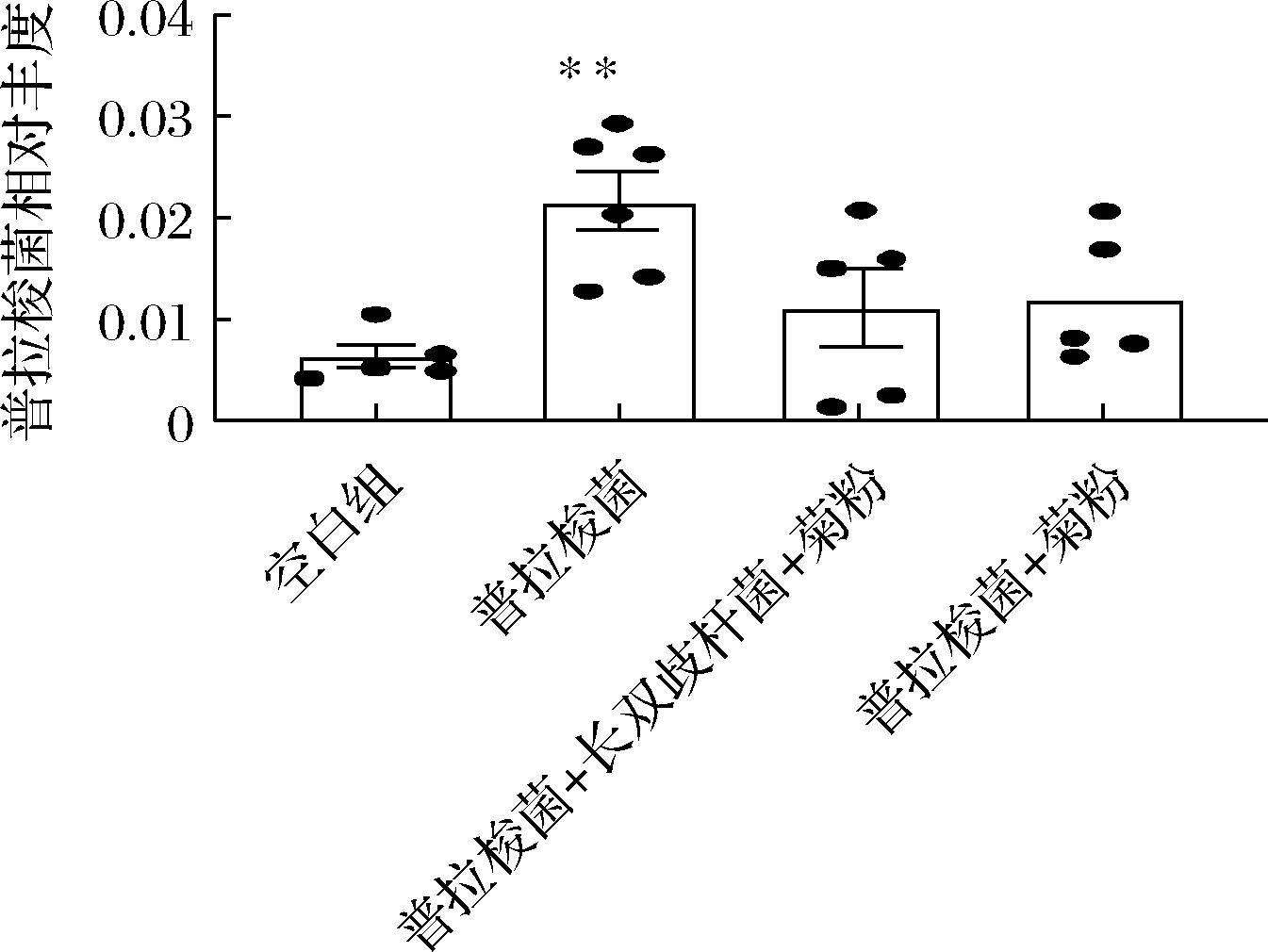
图6 不同组别中普拉梭菌的丰度
Fig.6 The abundance of F.prausnitzii in different groups
2.5 双歧杆菌干预对小鼠粪便中短链脂肪酸含量的影响
肠道菌群的改变伴随其代谢产物的改变。短链脂肪酸通常由肠道中有益菌降解膳食纤维产生,具有抗炎、抑制有害微生物生长、为结肠上皮细胞提供能量等重要益生作用。如图8所示,通过测定小鼠粪便中的短链脂肪酸发现不同组别小鼠粪便中乙酸含量有增加的趋势,其中在对小鼠同时进行长双歧杆菌和菊粉干预后粪便中乙酸含量最高,同时该组别小鼠粪便菌群中双歧杆菌和Akkermansia菌显著增加,而这2种菌属都能够产丰富的乙酸,因此推测这两种菌属是提高粪便中乙酸含量提高的重要贡献者。然而,粪便中短链脂肪酸含量是多种微生物共同代谢的结果,丙酸和丁酸浓度较低,丁酸盐含量在不同组别之间不具有显著性差异。“长双歧杆菌+菊粉组”的丙酸浓度显著降低,推测是被吸收利用。
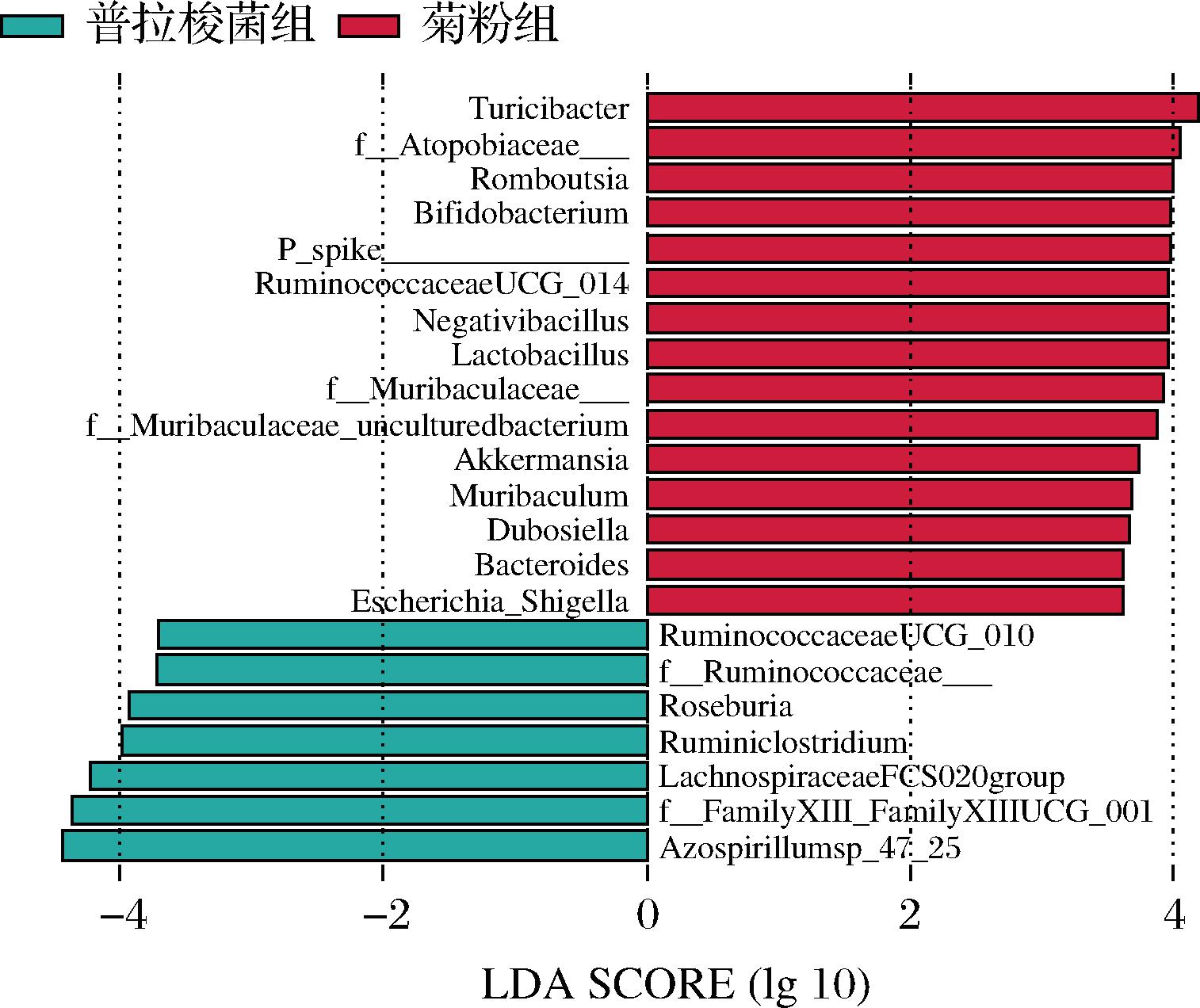
图7 普拉梭菌组与菊粉组的粪便菌群差异物种分析
Fig.7 The analysis of differential species between F.prausnitzii group and inulin group
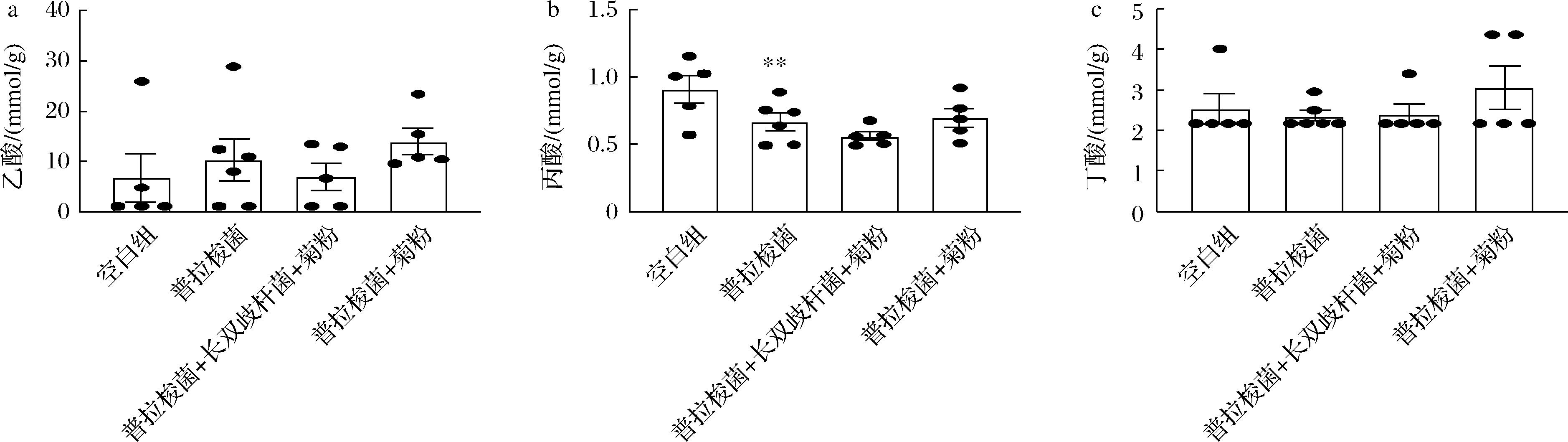
a-乙酸;b-丙酸;c-丁酸
图8 小鼠粪便中短链脂肪酸含量
Fig.8 The content of SCFAs in feces
3 结论
本研究探究双歧杆菌和普拉梭菌基于菊粉的协同增殖模式,通过体外实验表明在含菊粉培养基中培养时,双歧杆菌可以增加普拉梭菌的菌落数,刺激普拉梭菌产生更多丁酸盐,同时使得菊粉被更充分地消耗利用。给小鼠干预菊粉和长双歧杆菌后,其肠道中普拉梭菌丰度具有增加的趋势,且小鼠粪便中乙酸的含量显著提高。
[1] LIU H B, LIAO C, WU L, et al.Ecological dynamics of the gut microbiome in response to dietary fiber[J].The ISME Journal, 2022, 16(8):2040-2055.
[2] BAGHERI S, ZOLGHADRI S, STANEK A.Beneficial effects of anti-inflammatory diet in modulating gut microbiota and controlling obesity[J].Nutrients, 2022, 14(19):3985.
[3] RIOS-COVIAN D, GUEIMONDE M, DUNCAN S H, et al.Enhanced butyrate formation by cross-feeding between Faecalibacterium prausnitzii and Bifidobacterium adolescentis[J].FEMS Microbiology Letters, 2015, 362(21):fnv176.
[4] SOKOL H, SEKSIK P, FURET J P, et al.Low counts of Faecalibacterium prausnitzii in colitis microbiota[J].Inflammatory Bowel Diseases, 2009, 15(8):1183-1189.
[5] MIQUEL S, LECLERC M, MARTIN R, et al.Identification of metabolic signatures linked to anti-inflammatory effects of Faecalibacterium prausnitzii[J].MBio, 2015, 6(2):e00300-15.
[6] DEMIRCI M, TOKMAN H B, UYSAL H K, et al.Reduced Akkermansia muciniphila and Faecalibacterium prausnitzii levels in the gut microbiota of children with allergic asthma[J].Allergologia Et Immunopathologia, 2019, 47(4):365-371.
[7] CARLSSON A H, YAKYMENKO O, OLIVIER I, et al.Faecalibacterium prausnitzii supernatant improves intestinal barrier function in mice DSS colitis[J].Scandinavian Journal of Gastroenterology, 2013, 48(10):1136-1144.
[8] UEDA A, SHINKAI S, SHIROMA H, et al.Identification of Faecalibacterium prausnitzii strains for gut microbiome-based intervention in Alzheimer′s-type dementia[J].Cell Reports Medicine, 2021, 2(9):100398.
[9] BENUS R F J, VAN DER WERF T S, WELLING G W, et al.Association between Faecalibacterium prausnitzii and dietary fibre in colonic fermentation in healthy human subjects[J].British Journal of Nutrition, 2010, 104(5):693-700.
[10] ROSA R F, BOURGONJE A R, SADABAD M S, et al.Reconstitution of prebiotic-driven host-microbe syntrophy in the colon;inulin-frown Faecalibacterium prausnitzii cross-feeds the human intestinal epithelium[J].Gastroenterology, 2019, 156(6):S895.
[11] DUNCAN S H, BARCENILLA A, STEWART C S, et al.Acetate utilization and butyryl coenzyme A (CoA):Acetate-CoA transferase in butyrate-producing bacteria from the human large intestine[J].Applied and Environmental Microbiology, 2002, 68(10):5186-5190.
[12] CAKDER N-PÉREZ L, LLAURAD
N-PÉREZ L, LLAURAD E, COMPANYS J, et al.Interplay between dietary phenolic compound intake and the human gut microbiome in hypertension:A cross-sectional study[J].Food Chemistry, 2021, 344:128567.
E, COMPANYS J, et al.Interplay between dietary phenolic compound intake and the human gut microbiome in hypertension:A cross-sectional study[J].Food Chemistry, 2021, 344:128567.
[13] ZEYBEK N, RASTALL R A, BUYUKKILECI A O.Utilization of xylan-type polysaccharides in co-culture fermentations of Bifidobacterium and Bacteroides species[J].Carbohydrate Polymers, 2020, 236:116076.
[14] D'HOE K, VET S, FAUST K, et al.Integrated culturing, modeling and transcriptomics uncovers complex interactions and emergent behavior in a three-species synthetic gut community[J].Elife, 2018, 7:e37090.
[15] SMITH N W, SHORTEN P R, ALTERMANN E, et al.The classification and evolution of bacterial cross-feeding[J].Frontiers in Ecology and Evolution, 2019, 7:153.
[16] BELZER C, CHIA L W, AALVINK S, et al.Microbial metabolic networks at the mucus layer lead to diet-independent butyrate and vitamin B12 production by intestinal symbionts[J].MBio, 2017, 8(5):e00770-17.
[17] SCOTT K P, MARTIN J C, DUNCAN S H, et al.Prebiotic stimulation of human colonic butyrate-producing bacteria and Bifidobacteria, in vitro[J].FEMS Microbiology Ecology, 2014, 87(1):30-40.
[18] FALONY G, VLACHOU A, VERBRUGGHE K, et al.Cross-feeding between Bifidobacterium longum BB536 and acetate-converting, butyrate-producing colon bacteria during growth on oligofructose[J].Applied and Environmental Microbiology, 2006, 72(12):7835-7841.
[19] THOMSON P, MEDINA D A, ![]() V, et al.Anti-inflammatory effect of microbial consortia during the utilization of dietary polysaccharides[J].Food Research International, 2018, 109:14-23.
V, et al.Anti-inflammatory effect of microbial consortia during the utilization of dietary polysaccharides[J].Food Research International, 2018, 109:14-23.
[20] BELENGUER A, DUNCAN S H, CALDER A G, et al.Two routes of metabolic cross-feeding between Bifidobacterium adolescentis and butyrate-producing anaerobes from the human gut[J].Applied and Environmental Microbiology, 2006, 72(5):3593-3599.
[21] SABATINO A D, MORERA R, CICCOCIPPO R, et al.Oral butyrate for mildly to moderately active Crohn′s disease[J].Alimentary Pharmacology &Therapeutics, 2005, 22(9):789-794.
[22] MACHIELS K, JOOSSENS M, SABINO J, et al.A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis[J].Gut, 2014, 63(8):1275-1283.
[23] WRZOSEK L, MIQUEL S, NOORDINE M L, et al.Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii influence the production of mucus glycans and the development of goblet cells in the colonic epithelium of a gnotobiotic model rodent[J].BMC Biology, 2013, 11:61.
[24] LOPEZ-SILES M, ENRICH-CAP N, ALDEGUER X, et al.Alterations in the abundance and co-occurrence of Akkermansia muciniphila and Faecalibacterium prausnitzii in the colonic mucosa of inflammatory bowel disease subjects[J].Frontiers in Cellular and Infection Microbiology, 2018, 8:281.
N, ALDEGUER X, et al.Alterations in the abundance and co-occurrence of Akkermansia muciniphila and Faecalibacterium prausnitzii in the colonic mucosa of inflammatory bowel disease subjects[J].Frontiers in Cellular and Infection Microbiology, 2018, 8:281.
[25] SOTO-MARTIN E C, WARNKE I, FARQUHARSON F M, et al.Vitamin biosynthesis by human gut butyrate-producing bacteria and cross-feeding in synthetic microbial communities[J].MBio, 2020, 11(4):e00886-e00820.
[26] KOTOWICZ N, BHARDWAJ R K, FERREIRA W T, et al.Safety and probiotic evaluation of two Bacillus strains producing antioxidant compounds[J].Beneficial Microbes, 2019, 10(7):759-771.
[27] KHAN M T, BROWNE W R, VAN DIJL J M, et al.How can Faecalibacterium prausnitzii employ riboflavin for extracellular electron transfer?[J].Antioxidants &Redox Signaling, 2012, 17(10):1433-1440.
[28] MURAKAMI R, HASHIKURA N, YOSHIDA K, et al.Growth-promoting effect of alginate on Faecalibacterium prausnitzii through cross-feeding with Bacteroides[J].Food Research International, 2021, 144:110326.
[29] KIM H, JEONG Y, KANG S N, et al.Co-culture with Bifidobacterium catenulatum improves the growth, gut colonization, and butyrate production of Faecalibacterium prausnitzii:In vitro and in vivo studies[J].Microorganisms, 2020, 8(5):788.
[30] WANG Y N, MENG X C, DONG Y F, et al.Effects of probiotics and prebiotics on intestinal microbiota in mice with acute colitis based on 16S rRNA gene sequencing[J].Chinese Medical Journal, 2019, 132(15):1833-1842.