色素已成为我们日常生活中不可或缺的一部分,几乎应用于所有人造产品中,包括食品、药品、化妆品、纺织品等领域[1]。色素分为合成色素与天然色素两大类,合成色素以便宜和稳定的性质在行业中占主导地位,但一些合成色素对人体有害且致癌,同时污染物的排放可能会导致生态问题[2-3]。随着科学技术的进步和人类生活水平的提高,人们对食品安全问题越来越重视,天然色素主要源于植物、动物和微生物,具有可生物降解、可再生、环境友好等特点,受到消费者的高度关注,其年需求增长率预计可达到10%,约为合成色素的2倍[4-5]。
天然色素中植物源色素的研究最多,应用最广泛,但从植物中提取天然色素受到原料种类、区域、气候等因素的制约,质量与供应量不稳定,成本较高[6],而微生物源色素不受以上因素的限制,微生物生长速度快、生长过程易控制,可在廉价基质中生长而降低生产成本,并且微生物源色素提取更容易[7]。微生物色素是微生物生长繁殖过程中代谢产生的次级产物,通常形成于菌体生长后期,已被广泛应用于食品工业,如类胡萝卜素、红曲色素、核黄素[8-9]。在实际生产应用过程中,适宜生产色素的微生物需达到色素产量高、毒理性清晰和易纯化的基本条件[10-11],目前很多具有食用价值微生物色素的研发和应用工作进展缓慢,有必要对微生物这一潜在色素资源库进行持续开发。
研究表明,微生物代谢合成色素是为了响应各种环境刺激,如太阳辐射、氧应激等,从而提高生存能力[12]。郫县豆瓣是一种以辣椒和脱皮蚕豆为主要原料,经“日晒夜露”的传统酿造工艺而成的半固态调味酱。郫县豆瓣颜色红棕油亮,除辣椒色素的贡献外,其自然酿造过程中蕴含的丰富微生物群落中的产色素微生物也可能起到重要作用[13-14]。因此,本研究以传统酿造郫县豆瓣为分离源,分离、筛选、鉴定郫县豆瓣中的产红色素微生物,采用紫外可见分光光度(ultraviolet visible spectrophotometry,UV-Vis)、高效液相色谱(high performance liquid chromatography,HPLC)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、核磁共振波谱(nuclear magnetic resonance,NMR)、高分辨质谱(high resolution mass spectrum,HRMS)等方法表征目标菌株产红色素的结构特征,确定红色素种类,并对红色素的抑菌能力进行分析,旨在为拓宽产天然红色素微生物种质资源及该功能微生物菌株的进一步发酵制备色素应用开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品
传统酿造郫县豆瓣:成都市郫都区某郫县豆瓣公司。
1.1.2 培养基
基础培养基(g/L):酸水解酪素5,酵母膏10,细菌蛋白胨5,柠檬酸三钠3,氯化钾3,硫酸镁18,氯化钙0.2,硫酸亚铁0.001,氯化钠50,121 ℃灭菌20 min。固体培养基添加20 g/L琼脂粉。
发酵培养基(g/L):酸水解酪蛋白17.5,牛肉浸出粉2,可溶性淀粉1.5,121 ℃灭菌20 min。固体培养基添加20 g/L琼脂粉。
LB培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,121 ℃灭菌20 min。LB固体培养基添加20 g/L琼脂粉。
1.1.3 仪器与设备
HNY-2102C制冷恒温摇床,天津欧诺仪器仪表有限公司;Optima Max-Xp低温超高速离心机,美国贝克曼库尔特有限公司;Scientz-IID超声波细胞粉碎机,宁波新芝生物科技有限公司;Tanon3500R凝胶成像系统,广州誉维生物科技仪器有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器;UV2800PC双光束紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;Waters2695高效液相色谱仪,美国沃特世公司;Spectrum Two傅里叶变换红外光谱仪,上海珀金埃尔默仪器有限公司;ABSCIEX X500R高分辨质谱仪,美国应用生物系统公司。
1.2 实验方法
1.2.1 菌株的筛选
取1.0 g郫县豆瓣于100 mL基础培养基中,30 ℃、150 r/min光照培养5 d。将菌液用无菌生理盐水以10倍稀释法梯度稀释至10-6,涂布挑取产色素的单菌落。
1.2.2 菌株的鉴定
筛选的菌株采用平板划线法进行分离、纯化,观察菌落形态。生理生化鉴定参考《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》中的分析方法进行。提取菌株DNA用于扩增16S rRNA序列进行分子生物学鉴定,将菌株16S rRNA序列结果提交至NCBI的GenBank数据库利用BLAST进行比较,并选取序列相似度高的菌株用以构建系统发育树。
1.2.3 色素粗品制备
筛选的菌株接入发酵培养基中,30 ℃、150 r/min培养12 h活化2代,以2%接种量接入新的发酵培养基中,30 ℃、150 r/min培养48 h。取菌液于8 000 r/min离心10 min,保留菌体。用无菌生理盐水洗涤菌体2次,以酸性甲醇[V(盐酸)∶V(甲醇)=1∶50,pH 3.0]作提取剂,超声波冰浴破碎细胞10 min后浸提30 min。浸提液经8 000 r/min离心10 min,收集上清液。上清液经旋转蒸发仪40 ℃旋转蒸发至干,再用甲醇复溶,即得红色素粗品。
1.2.4 粗色素纯化
通过硅胶柱层析法(层析柱:30 mm × 400 mm,硅胶:200~300目)对色素粗品进行纯化。称取25 g硅胶于石油醚中浸泡1 h,进行湿法装柱,待柱中硅胶充分沉降后从柱顶缓慢加样,以不同比例石油醚和乙酸乙酯作为洗脱剂[15],根据颜色区别收集各组分。将收集到的主要色素组分于旋转蒸发仪中40 ℃蒸发至干,用2~3 mL甲醇(色谱级)复溶,即得纯色素溶液,备用。
1.2.5 高效液相色谱法
HPLC对纯化后的色素进行纯度检测。参考李小群[16]的方法进行检测,色谱条件为:Agilent Eclipse Plus C18色谱柱(4.6 mm×150 mm,5 μm),进样量为10 μL,柱温为30 ℃,检测波长为535 nm,流速为0.4 mL/min,流动相:A为含0.1%(体积分数)三氟乙酸的水,B为乙腈。洗脱条件:0~12 min,5%~100% B;12~13 min,100% B;13~20 min,100%~5% B。
1.2.6 紫外可见分光光度法
菌株GH-2产红色素经硅胶柱层析纯化后均分为2份,通过旋转蒸发仪40 ℃蒸干溶剂,分别用酸性甲醇(pH 3)和碱性甲醇(pH 11)溶解,转入比色皿中,观察该色素在酸性和碱性条件下的颜色差异。并将酸性条件下色素于双光束紫外可见分光光度计中进行全波长扫描,得到该色素的全波长吸收光谱。
1.2.7 傅里叶变换红外光谱法
采用ATR法测定菌株GH-2产生并分离纯化后的红色素,利用FTIR进行扫描,扫描光谱范围为4 000~500 cm-1,分辨率为4 cm-1。
1.2.8 核磁共振波谱法
称取30 mg纯化后的红色素,将其溶解于1 mL CDCl3中,蒸发干燥,并重复2次从而制备样品。在25 ℃下,通过NMR光谱仪对样品进行测定,收集1H-NMR和13C-NMR信号,进行图谱分析。
1.2.9 高分辨质谱法
色谱条件:仪器为ABSCIEX X500R高分辨质谱仪,色谱柱为Ultimate UHPLC LP-C18色谱柱(2.1 mm×100 mm,1.8 μm),柱温为30 ℃,流速为0.3 mL/min,进样量为3 μL,采用梯度洗脱,流动相:A为0.1%(体积分数)甲酸水,B为乙腈。洗脱条件:0~12 min,5%~100% B;12~13 min,100% B;13~20 min,100%~5% B。
质谱条件:离子源为ESI源,正离子扫描模式,离子源温度400 ℃,气帘气体35 psi,毛细管电压5 500 V,雾化气压力55 psi,辅助气压力55 psi,去簇电压70 V,碰撞能量8 V,扫描范围为100~600 m/z。
1.2.10 抑菌活性研究
以副溶血性弧菌(Vibrio parahemolyticus)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和铜绿假单细胞菌(Pseudomonas aeruginosa)为指示菌,将其分别接种在LB培养基中(V.parahemolyticus接种在含有3% NaCl的LB培养基中),于30 ℃培养12 h后,用无菌生理盐水将各菌液等梯度稀释至10-4后均匀涂布到相应的固体培养基中,待涂布完成后,将提前灭菌的牛津杯放置在固体培养基上。每个平板放置2个牛津杯,一个加入150 μL质量浓度为1 mg/mL纯化后色素溶液作为实验组,另一个加入150 μL甲醇溶液作为对照组。固体平板编号后于37 ℃静置培养24 h,观察抑菌圈大小。
2 结果与分析
2.1 菌株分离纯化
从传统酿造郫县豆瓣中筛选获得一株产红色素的菌株GH-2,该菌株纯化后在发酵固体培养基中30 ℃培养24 h后,菌落及形态特征如图1所示。该菌株在固体平板上形成鲜红色菌落,表面及边缘光滑,为圆形凸起状(图1-a)。在扫描电子显微镜下,菌株GH-2的细胞长4.3~5.3 μm,宽1.5~2.5 μm,呈杆状,无孢子(图1-b)。
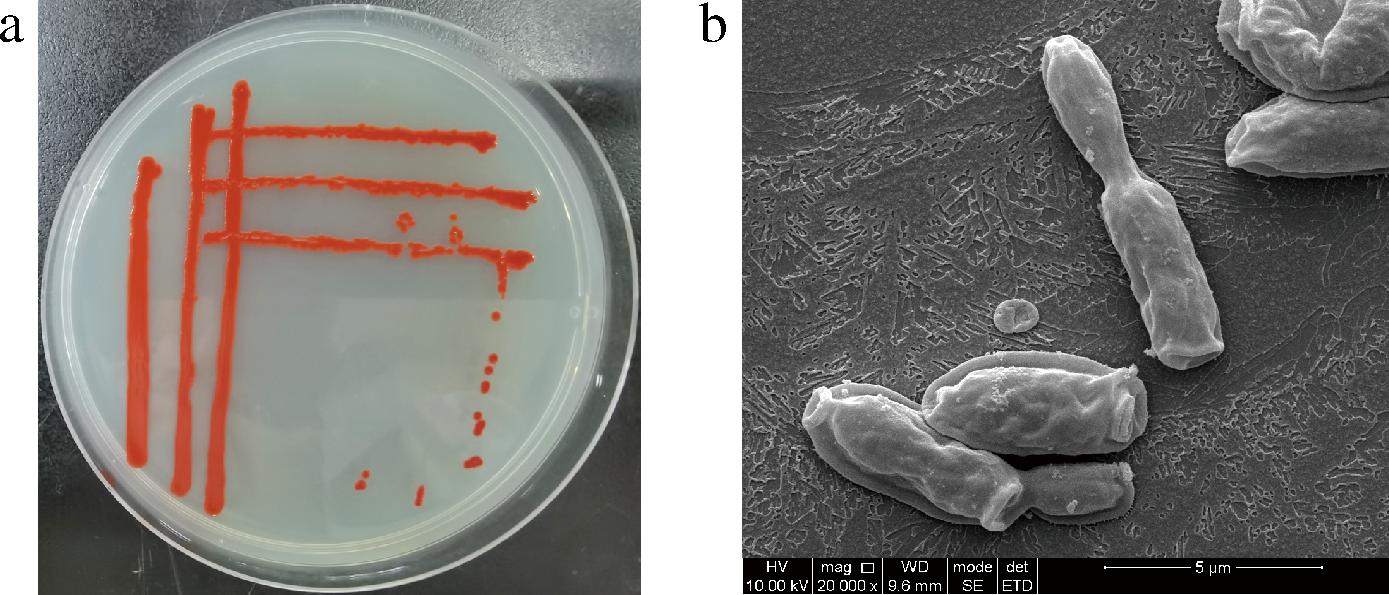
a-菌株GH-2菌落特征;b-个体形态
图1 菌株GH-2菌落特征和个体形态
Fig.1 Colony and cell morphology characteristics of strain GH-2
2.2 菌株GH-2生理生化和分子生物学鉴定
菌株GH-2生理生化结果见表1,该菌株为革兰氏阴性菌,明胶液化、硝酸盐还原、过氧化氢酶、葡萄糖、蔗糖、麦芽糖实验呈阳性,革兰氏染色、硫化氢、尿素、淀粉水解、乳糖、阿拉伯糖实验呈阴性。为明确菌株GH-2的分类学地位和系统发育关系,将菌株16S rRNA序列利用NCBI BLAST进行检索分析,同源性比对,并选取序列相似性高的菌株构建系统发育树(图2),结果显示菌株GH-2的16S rRNA序列与粘质沙雷氏菌(Serratia marcescens)NBRC 102204具有99%的同源性,在系统发育树中聚类于同一进化枝。结合菌株GH-2的形态学、生理生化实验结果和16S rRNA基因序列分析,将菌株GH-2鉴定为S.marcescens。
表1 菌株GH-2生理生化实验结果
Table 1 Physiological and biochemical tests results of strain GH-2

项目结果项目结果项目结果革兰氏染色-硝酸盐还原+硫化氢 -明胶液化 +尿素 -过氧化氢酶+淀粉水解 -葡萄糖 +蔗糖 +麦芽糖 +乳糖 -阿拉伯糖 -
注:“+”为阳性,“-”为阴性。
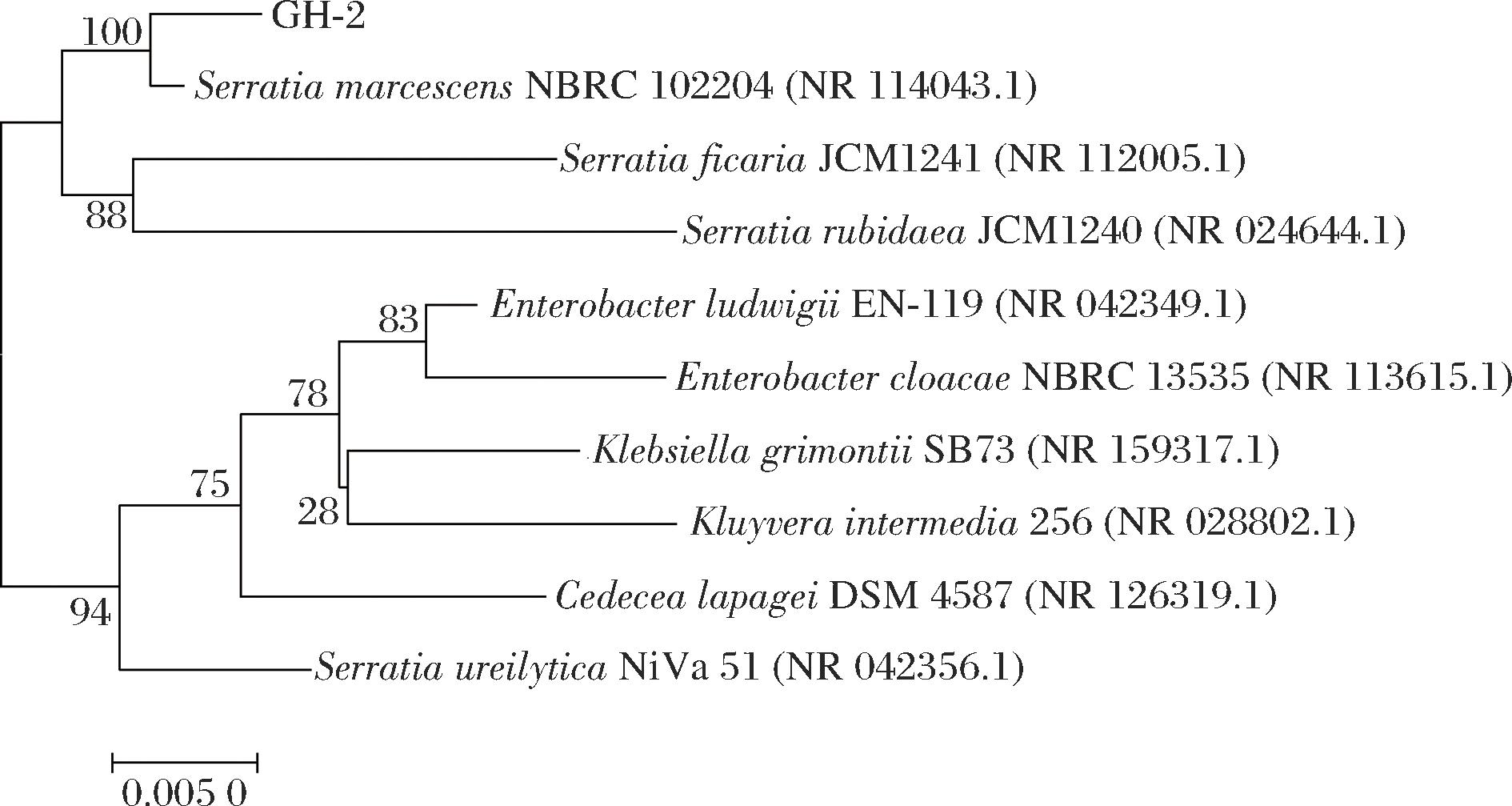
图2 菌株GH-2系统发育树
Fig.2 The phylogenetic tree of strain GH-2
2.3 菌株GH-2产红色素纯度验证
由经硅胶柱层析纯化后的色素样品的HPLC图谱分析结果(图3)可知,在保留时间为2.385 min时检测到一个明显的单一色谱峰,且通过数据处理发现该峰峰面积占总面积的比例为97%,即纯化后的色素纯度为97%,能够满足后续分析的纯度要求。
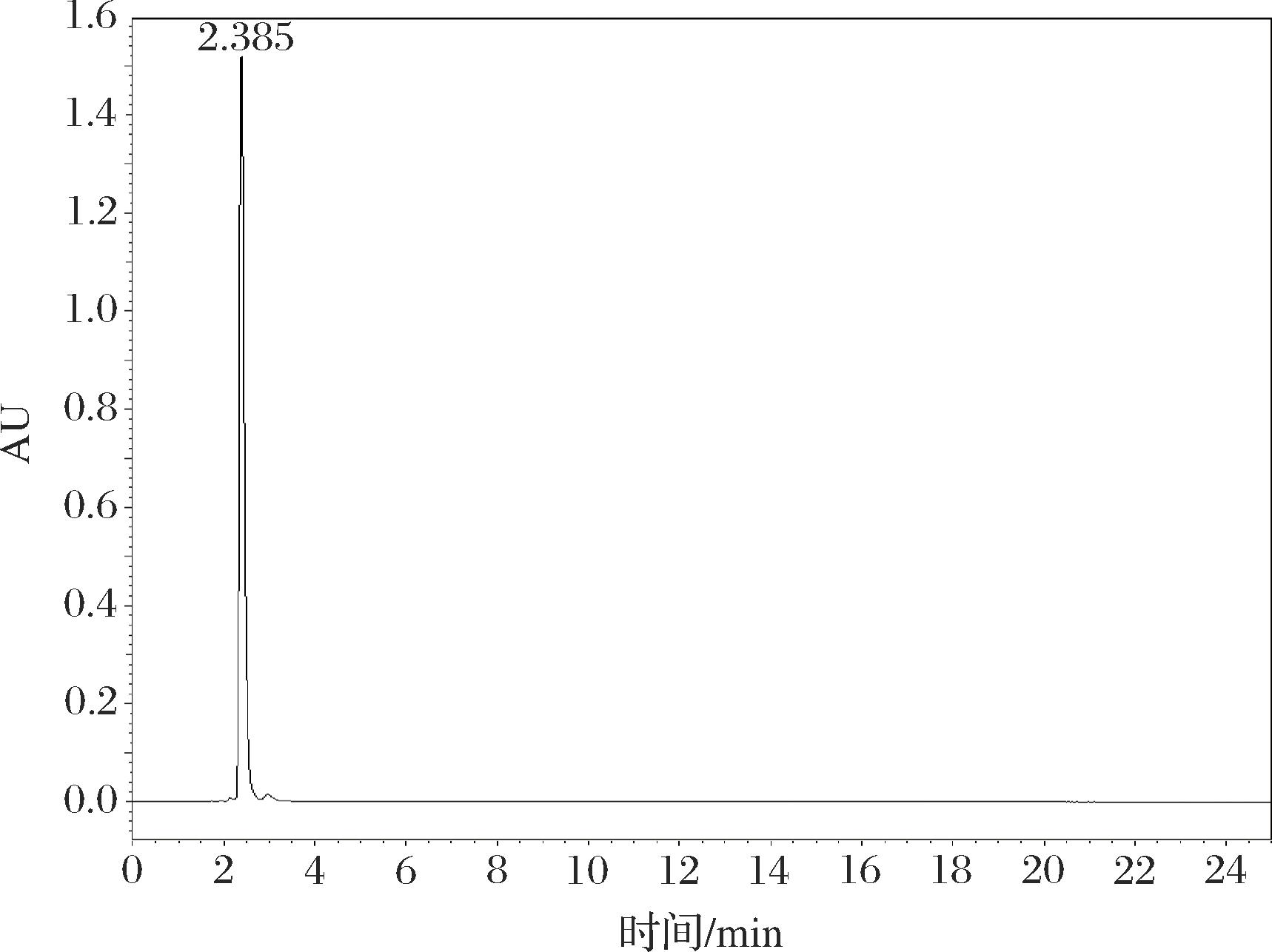
图3 菌株GH-2产纯化红色素的高效液相色谱
Fig.3 HPLC chromatogram of purified red pigment produced by strain GH-2
2.4 菌株GH-2产红色素结构表征
2.4.1 显色反应和紫外可见光吸收光谱分析
S.marcescens GH-2产红色素在酸性和碱性条件下的显色反应及紫外可见光吸收光谱分析结果见图4。结果表明,红色素在酸性甲醇(pH=3)中呈现红色,在碱性甲醇(pH=11)中呈现橙黄色,与文献[17]报道的灵菌红素酸碱特性一致。溶解在酸性甲醇中的红色素UV-Vis检测发现(图4-b),该色素在535 nm处有最大吸收峰,为其特征吸收峰,与RODR GUEZ等[18]报道的灵菌红素在酸性甲醇中的紫外可见光吸收光谱一致,故初步认定菌株GH-2产红色素为灵菌红素。
GUEZ等[18]报道的灵菌红素在酸性甲醇中的紫外可见光吸收光谱一致,故初步认定菌株GH-2产红色素为灵菌红素。

a-显色反应;b-紫外可见光吸收光谱
图4 菌株GH-2产红色素的显色反应和紫外可见光吸收光谱
Fig.4 Color development and UV-Vis spectrum of red pigment produced by strain GH-2
2.4.2 傅里叶变换红外吸收光谱分析
FTIR是对天然产物进行初步定性的有效工具,化合物分子中化学键或官能团特有的振动频率使其在红外吸收光谱不同位置出现吸收峰,现已被广泛应用于多糖、色素官能团的分析[19-20]。菌株GH-2纯化红色素的FTIR结果见图5,谱图表明,该红色素的主要吸收峰在3 306.46、2 951.62、2 840.49、1 644.80、1 448.95、1 409.29、1 112.93、1 013.16 cm-1。其中,3 306.46 cm-1处有一个强而稍宽的吸收峰,是仲胺(—NH—)的伸缩振动峰[21];2 951.62 cm-1处弱而尖的吸收峰为—CH3的不对称伸缩振动峰,2 840 cm-1处为—CH2—的对称伸缩振动峰[22];1 644.80 cm-1处中等强度的吸收峰为C![]() C的伸缩振动峰,表明其化学结构存在共轭效应[23];1 448.95 cm-1和1 409.29 cm-1为—CH2—的弯曲振动峰;1 112.93 cm-1为—C—N—伸缩振动峰[24];1 013.16 cm-1处是该区域最强的峰,为C—O—C的不对称伸缩振动峰[25]。纯化红色素的FTIR分析可知其含有—NH—、—CH3、—CH2—、C
C的伸缩振动峰,表明其化学结构存在共轭效应[23];1 448.95 cm-1和1 409.29 cm-1为—CH2—的弯曲振动峰;1 112.93 cm-1为—C—N—伸缩振动峰[24];1 013.16 cm-1处是该区域最强的峰,为C—O—C的不对称伸缩振动峰[25]。纯化红色素的FTIR分析可知其含有—NH—、—CH3、—CH2—、C![]() C、—C—N—、C—O—C等特征结构。
C、—C—N—、C—O—C等特征结构。
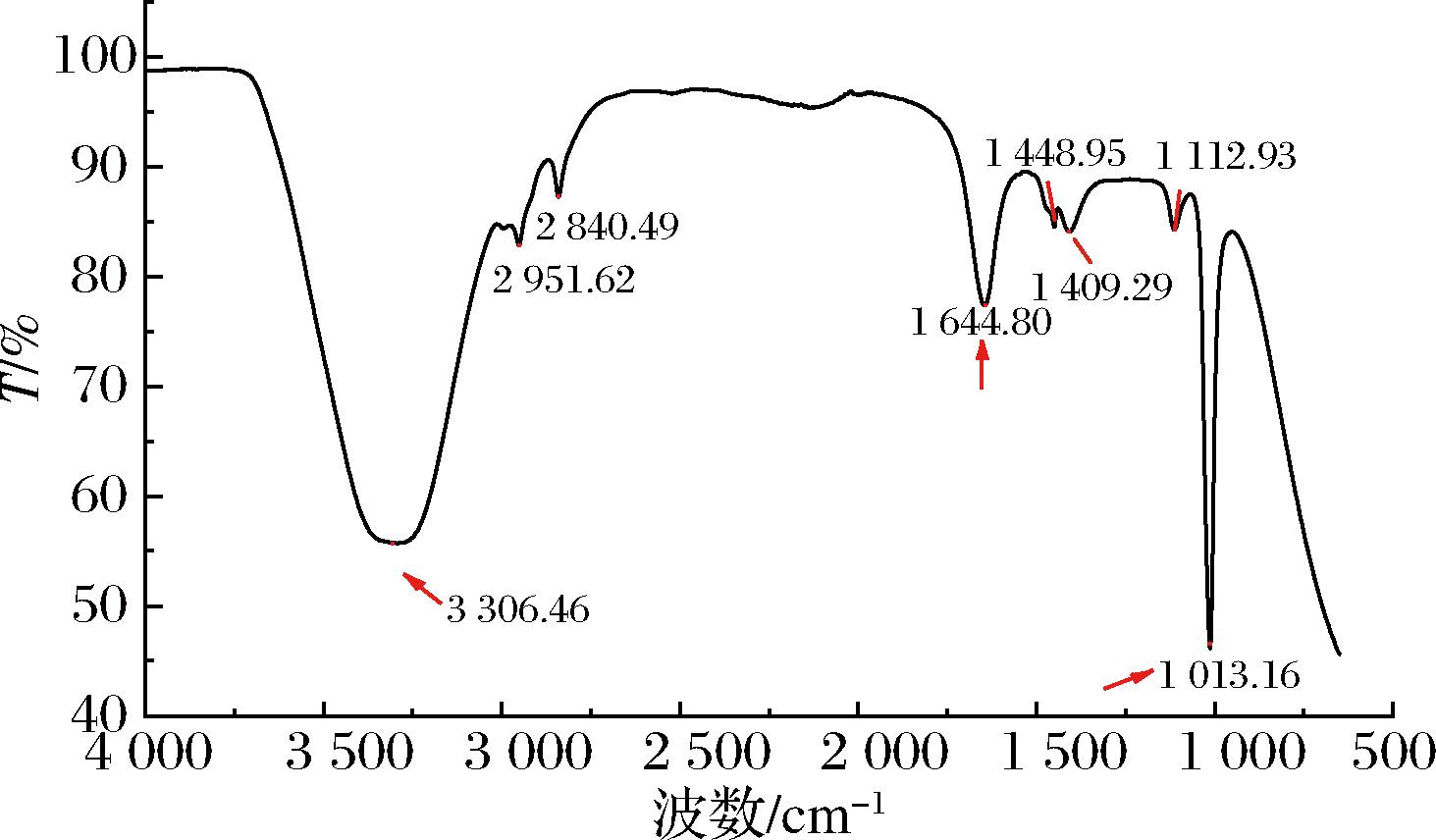
图5 菌株GH-2产红色素的傅里叶变换红外吸收光谱
Fig.5 FTIR spectrum of red pigment produced by strain GH-2
2.4.3 核磁共振波谱分析
菌株GH-2纯化红色素的1H-NMR图谱(图6-a)表明,化学位移δ在0.9~2.4有多重峰出现,是物质结构中—CH3、—CH2—上H的特征峰;δ=12.5对应于与N相连H的特征峰;δ=4.01为—OCH3上H的特征峰;δ在6.09~7.23为吡咯环上吡咯质子的特征信号;δ=7.28是CDCl3溶剂峰;δ=6.7对应于2个吡咯环之间的乙烯基质子[26]。

a-核磁共振氢谱;b-核磁共振碳谱
图6 菌株GH-2产红色素的核磁共振氢谱和核磁共振碳谱
Fig.6 1H-NMR and 13C-NMR spectrum of red pigment produced by strain GH-2
菌株GH-2纯化红色素的13C-NMR图谱(图6-b)显示,其δ=58.74为—OCH3上C的特征峰;δ=167.84为吡咯环B上与—OCH3相连C的特征峰;δ=130.91对应于吡咯环C上与—CH3相连的C特征峰;δ在120.73~127的特征峰则为与N相连的C的特征峰;δ在76.74~77.38的特征峰为CDCl3的溶剂峰[26]。综上可知,该红色素分子结构中含有—CH3、—CH2、—NH—、—OCH3、C![]() C、C—N等结构。
C、C—N等结构。
2.4.4 高分辨质谱分析
进一步利用高分辨质谱对菌株GH-2纯化红色素进行分子质量、结构等鉴定分析,结果见图7。由一级质谱图(图7-a)可知,主要碎片离子为m/z 324.206 6,且以[M+H]+的形式出现,表明该红色素分子的相对分子质量为323,此结果与ARIVUSELVAM等[27]对S.marcescens代谢产物质谱的鉴定结果一致。红色素的MS/MS图谱(图7-b)中出现了m/z 309.182 0和m/z 252.111 1等离子碎片,分别是由m/z 324.206 6失去一个甲基和一个戊基获得,与WILF等[28]报道的灵菌红素二级离子碎片数据结果基本一致。综合UV-Vis、FTIR、NMR以及HRMS等检测分析,菌株GH-2代谢合成红色素为2-甲基-3-戊基灵菌红素,分子式为C20H25ON3,相对分子质量为323,具体结构式如图7-b所示。

a-一级质谱;b-二级质谱
图7 菌株GH-2产红色素的高分辨一级质谱和二级质谱及结构式
Fig.7 MS and MS/MS spectrum and structural formula of red pigment produced by strain GH-2
2.5 菌株GH-2产红色素抑菌活性研究
世界卫生组织资料显示,大多数食源性疾病由细菌及其致病因子引发,如蜡样芽胞杆菌(Bacillus cereus)、V.parahaemolyticus、单增李斯特菌(Listeria monocytogenes)、S.aureus、E.coli、P.aeruginosa等[29-30]。灵菌红素作为一种次级代谢产物具有抗菌、抗癌、抗疟、免疫调节等多种生物活性, B.cereus、酿脓链球菌(Streptococcus pyogenes)和S.aureus等致病菌对其敏感[31-32]。该S.marcescens GH-2产灵菌红素对4株常见食源性致病菌的抑菌活性分析结果如图8所示。结果表明,菌株GH-2产灵菌红素对V. parahaemolyticus有较好的抑制作用,对S.aureus有一定的抑制效果;而对E.coli和P.aeruginosa基本无抑制作用。综上表明,菌株GH-2产灵菌红素可作为潜在的抑菌剂。
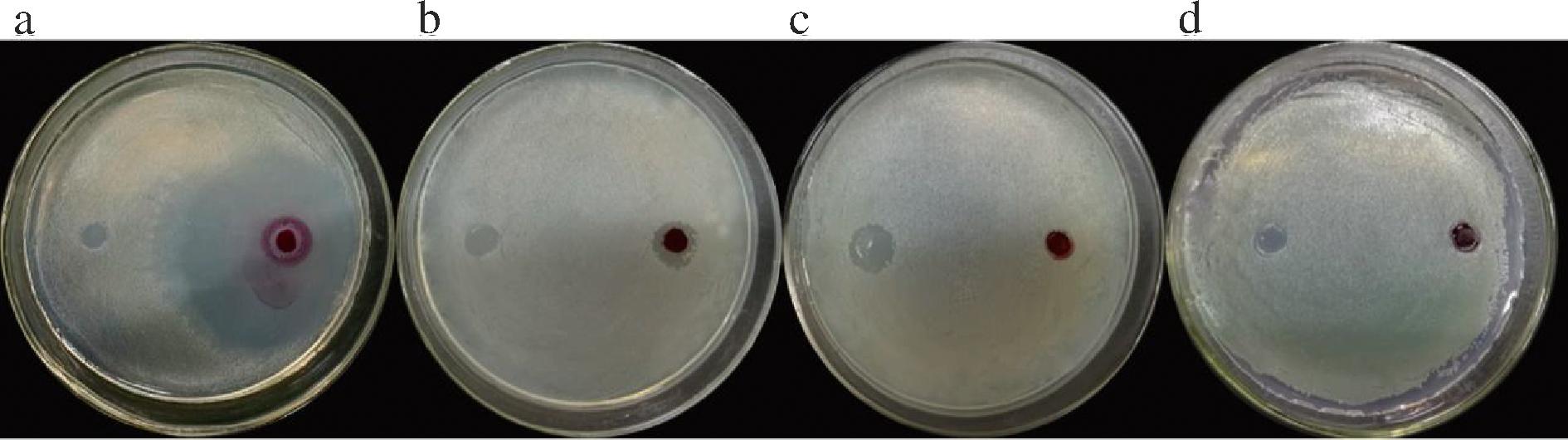
a-副溶血性弧菌;b-金黄色葡萄球菌;c-大肠杆菌;d-铜绿假单胞菌
图8 菌株GH-2产红色素的抑菌活性评价
Fig.8 Antibacterial activity of red pigment produced by strain GH-2
3 结论
随着人们对健康和食品安全需求的日益重视,微生物源天然色素的研究越来越受到关注。本研究从传统酿造郫县豆瓣中分离筛选鉴定获得一株产红色素粘质沙雷氏菌(Serratia marcescens)GH-2。利用UV-Vis、HPLC、FTIR、NMR和HRMS等方法对菌株GH-2产红色素进行结构表征和鉴定,确定该红色素为2-甲基-3-戊基灵菌红素,相对分子质量为323,结构式为C20H25ON3。灵菌红素及其衍生物作为微生物的次级代谢产物具有良好的生物学活性,研究发现菌株GH-2产灵菌红素对食源性致病菌副溶血性弧菌具有较好的抑制作用,对金黄色葡萄球菌也有一定的抑制效果,可作为一种潜在的抑菌剂。综上研究表明,源于传统酿造郫县豆瓣具有代谢产2-甲基-3-戊基灵菌红素的S.marcescens GH-2可作为优质功能微生物资源。后续研究中,本团队将进一步探讨菌株GH-2代谢调控产红色素与郫县豆瓣色泽贡献的关联性,同时对其代谢产灵菌红素对抑制癌细胞、免疫调节等生物学活性进行研究分析,为该产天然色素功能微生物资源的开发应用奠定理论基础。
[1] GREWAL J, WO A CEWICZ M, PYTER W, et al.Colorful treasure from agro-industrial wastes:A sustainable chassis for microbial pigment production[J].Frontiers in Microbiology, 2022, 13:832918.
A CEWICZ M, PYTER W, et al.Colorful treasure from agro-industrial wastes:A sustainable chassis for microbial pigment production[J].Frontiers in Microbiology, 2022, 13:832918.
[2] VENIL C K, ZAKARIA Z A, AHMAD W A.Bacterial pigments and their applications[J].Process Biochemistry, 2013, 48(7):1065-1079.
[3] QIN Z J, WANG X L, GAO S, et al.Production of natural pigments using microorganisms[J].Journal of Agricultural and Food Chemistry, 2023, 71(24):9243-9254.
[4] ARULDASS C A, DUFOSSÉ L, AHMAD W A.Current perspective of yellowish-orange pigments from microorganisms- a review[J].Journal of Cleaner Production, 2018, 180:168-182.
[5] SAJJAD W, DIN G, RAFIQ M, et al.Pigment production by cold-adapted bacteria and fungi:Colorful tale of cryosphere with wide range applications[J].Extremophiles, 2020, 24(4):447-473.
[6] NIGAM P S, LUKE J S.Food additives:Production of microbial pigments and their antioxidant properties[J].Current Opinion in Food Science, 2016, 7:93-100.
[7] ![]() S,
S, ![]() et al.Sources, stability, encapsulation and application of natural pigments in foods[J].Food Reviews International, 2022, 38(8):1 735-1 790.
et al.Sources, stability, encapsulation and application of natural pigments in foods[J].Food Reviews International, 2022, 38(8):1 735-1 790.
[8] 徐春明, 王晓丹, 焦志亮.食用微生物色素的研究进展[J].中国食品添加剂, 2015,26(2):162-168.XU C M, WANG X D, JIAO Z L.Research progress of edible pigments by microorganisms[J].China Food Additives, 2015,26(2):162-168.
[9] SHEN N, REN J N, LIU Y X, et al.Natural edible pigments:A comprehensive review of resource, chemical classification, biosynthesis pathway, separated methods and application[J].Food Chemistry, 2023, 403:134422.[10] 于雪, 张威, 吴玉洁, 等.微生物产色素机制及其生物活性[J].微生物学报, 2022, 62(4):1231-1246.YU X, ZHANG W, WU Y J, et al.Production mechanism and biological activity of microbial pigments[J].Acta Microbiologica Sinica, 2022, 62(4):1231-1246.
[11] 刘洋. 红色素产生菌株的分离鉴定及红色素性质研究[D].黄石:湖北师范大学, 2020.LIU Y.Isolation and identification of red pigment producing strain and study on the properties of red pigment[D].Huangshi:Hubei Normal University, 2020.
[12] DASGUPTA MANDAL D, MAJUMDAR S.Bacteria as biofactory of pigments:Evolution beyond therapeutics and biotechnological advancements[J].Journal of Bioscience and Bioengineering, 2023, 135(5):349-358.
[13] 鲍奕达, 张丽杰, 郑鹏飞, 等.郫县豆瓣发酵过程的微生物多样性及溯源分析[J].微生物学报, 2020, 60(11):2555-2571. BAO Y D, ZHANG L J, ZHENG P F, et al.Diversity and source tracking of microbial community in Pixian broad bean paste[J].Acta Microbiologica Sinica, 2020, 60(11):2 555-2 571.
[14] 吉礼, 蒲开阳, 秦覃, 等.农家日晒与阴制郫县豆瓣产品品质对比分析[J].食品与发酵科技, 2022, 58(3):119-123.JI L, PU K Y, QIN Q, et al.Comparative analysis on the quality of Pixian broad-bean paste made by sunlight and shade in farmhouse[J].Food and Fermentation Science &Technology, 2022, 58(3):119-123.
[15] 李春燕, 牟希, 张媛, 等.1株产灵菌红素家族红色色素细菌的分离鉴定及其色素性质研究[J].食品与发酵工业, 2017, 43(1):1-6.LI C Y, MOU X, ZHANG Y, et al.The identification of prodigiosin family red pigment producing bacterium and characterization of the red pigment[J].Food and Fermentation Industries, 2017, 43(1):1-6.
[16] 李小群. 海洋细菌Notoacmeibacter sp.BGMRC2072鉴定及其次级代谢产物研究[D].南宁:广西大学, 2018.LI X Q.Identification of the marine bacterium Notoacmeibacter sp.BGMRC2072 and study on its secondary metabolites[D].Nanning:Guangxi University, 2018.
[17] 王鹏宇, 徐晨琪, 彭涵, 等.一株产灵菌红素菌株黏质沙雷氏菌H04的分离鉴定及发酵条件优化[J].食品与发酵工业, 2023, 49(11):20-26.WANG P Y, XU C Q, PENG H, et al.Isolation, identification, and optimization of fermentation conditions of a high-yielding prodigiosin Serratia marcescens H04[J].Food and Fermentation Industries, 2023, 49(11):20-26.
[18] RODR GUEZ J, LOBATO C, V
GUEZ J, LOBATO C, V ZQUEZ L, et al.Prodigiosin-producing Serratia marcescens as the causal agent of a red colour defect in a blue cheese[J].Foods, 2023, 12(12):2388.
ZQUEZ L, et al.Prodigiosin-producing Serratia marcescens as the causal agent of a red colour defect in a blue cheese[J].Foods, 2023, 12(12):2388.
[19] TANG L, CHEN Y C, JIANG Z B, et al.Purification, partial characterization and bioactivity of sulfated polysaccharides from Grateloupia livida[J].International Journal of Biological Macromolecules, 2017, 94:642-652.
[20] 张叶飞. 产色素粘质沙雷氏菌的分离鉴定及含灵菌红素合成酶的载体构建[D].成都:成都理工大学, 2019.ZHANG Y F.Isolation and identification of pigmented Serratia marcescens and construction of vector containing prodigiosin synthase[D].Chengdu:Chengdu University of Technology, 2019.
[21] 刘思航, 邹宜均, 常菲菲, 等.一株高产灵菌红素粘质沙雷氏菌的分离鉴定及发酵条件优化[J].应用与环境生物学报, 2018, 24(1):26-32.LIU S H, ZOU Y J, CHANG F F, et al.Isolation and identification of Serratia marcescens producing high levels of prodigiosin and its fermentation optimization[J].Chinese Journal of Applied and Environmental Biology, 2018, 24(1):26-32.
[22] XU H, WANG S S, TIAN Y J, et al.2-Keto-D-gluconic acid and prodigiosin producing by a Serratia marcescens[J].Preparative Biochemistry &Biotechnology, 2021, 51(7):678-685.
[23] ARIVIZHIVENDHAN K V, MAHESH M, BOOPATHY R, et al.A novel method for the extraction of prodigiosin from bacterial fermenter integrated with sequential batch extraction reactor using magnetic iron oxide[J].Process Biochemistry, 2016, 51(10):1731-1737.
[24] 李雪. 粘质沙雷氏菌次级代谢产物灵菌红素的结构鉴定及生物学活性研究[D].济南:齐鲁工业大学, 2021.LI X.Structure identification and biological activity of prodigiosin, a secondary metabolite of Serratia marcescens[D].Jinan:Qilu University of Technology, 2021.
[25] JARDAK M, ATOISSI A, MSALBI D, et al.Antibacterial, antibiofilm and cytotoxic properties of prodigiosin produced by a newly isolated Serratia sp.C6LB from a milk collection center[J].Microbial Pathogenesis, 2022, 164:105449.
[26] VIJAY D, ALSHAMSI N S, MOUSSA Z, et al.Extraction of the anticancer and antimicrobial agent, prodigiosin, from Vibrio gazogenes PB1 and its identification by 1D and 2D NMR[J].Molecules, 2022, 27(18):6030.
[27] ARIVUSELVAM R, DERA A A, PARWEEN ALI S, et al.Isolation, identification, and antibacterial properties of prodigiosin, a bioactive product produced by a new Serratia marcescens JSSCPM1 strain:Exploring the biosynthetic gene clusters of Serratia species for biological applications[J].Antibiotics, 2023, 12(9):1466.
[28] WILF N M, SALMOND G P C.The stationary phase sigma factor, RpoS, regulates the production of a carbapenem antibiotic, a bioactive prodigiosin and virulence in the enterobacterial pathogen Serratia sp.ATCC 39006[J].Microbiology, 2012, 158(Pt3):648-658.
[29] BHUPATHI P, ELHASSAN A-ELGADIR T M, MOHAMMED ALI R H, et al.Fluorescence resonance energy transfer (FRET)-based sensor for detection of foodborne pathogenic bacteria:A review[J].Critical Reviews in Analytical Chemistry, 2023: 1-18.
[30] TOUSHIK S H, PARK J H, KIM K, et al.Antibiofilm efficacy of Leuconostoc mesenteroides J.27-derived postbiotic and food-grade essential oils against Vibrio parahaemolyticus, Pseudomonas aeruginosa, and Escherichia coli alone and in combination, and their application as a green preservative in the seafood industry[J].Food Research International, 2022, 156:111163.
[31] CHOI S Y, LIM S, YOON K H, et al.Biotechnological activities and applications of bacterial pigments violacein and prodigiosin[J].Journal of Biological Engineering, 2021, 15(1):10.
[32] LIM S, BHAK J, JEON S, et al.The kiss of death:Serratia marcescens antibacterial activities against Staphylococcus aureus requires both de novo prodigiosin synthesis and direct contact[J].Microbiology Spectrum, 2022, 10(3):e0060722.