尿酸(uric acid,UA)是嘌呤类核苷酸的代谢产物,在人体中多以尿酸盐形式存在。通常有大约70% UA通过肾脏排出体外[1]。UA能够维持机体正常的生理状态、清除氧自由基、增强人体免疫、促进钠盐的吸收以维持血压稳定[2]。UA难溶于水,当机体嘌呤代谢紊乱,UA生成过多且无法通过排尿的方式排出体外时,UA在血液中过度积累造成高尿酸血症(hyperuricemia,HUA)[3]。2020年的一篇报道显示,中国高尿酸血症的患病率呈逐年上升趋势,中国大陆普通人群中高尿酸血症的患病率为17.4%[4]。HUA分为原发性和继发性,原发性HUA属于遗传性疾病,患者先天性尿素代谢障碍,主要临床表现为痛风;继发性HUA多由长期服用某些药物或多种疾病所引起。长期HUA会造成肝肾损伤,且HUA与高血压、高脂血症、肥胖及胰岛素抵抗有密切关系[5-6]。减少HUA患者血清中UA的含量的方法大致可分为两类,即增加血清中UA的排出和减少血清中UA的生成[7]。UA的生成需要底物黄嘌呤和催化剂黄嘌呤氧化酶(xanthine oxidase,XOD),所以在减少血清中UA的生成方法中,可以通过减少黄嘌呤(底物)含量或者抑制XOD(催化剂)活性来抑制UA的生成[8]。目前用来治疗HUA的药物主要有别嘌呤醇、尿酸氧化酶以及秋水仙碱[9]。国内外HUA患者数量越来越多,严格控制饮食摄入较为困难,药物治疗又有一定的副毒害作用以及局限性,所以寻找低毒高效的治疗方法是目前HUA研究的热点[10-11]。黄嘌呤代谢机制如图1[12]所示。
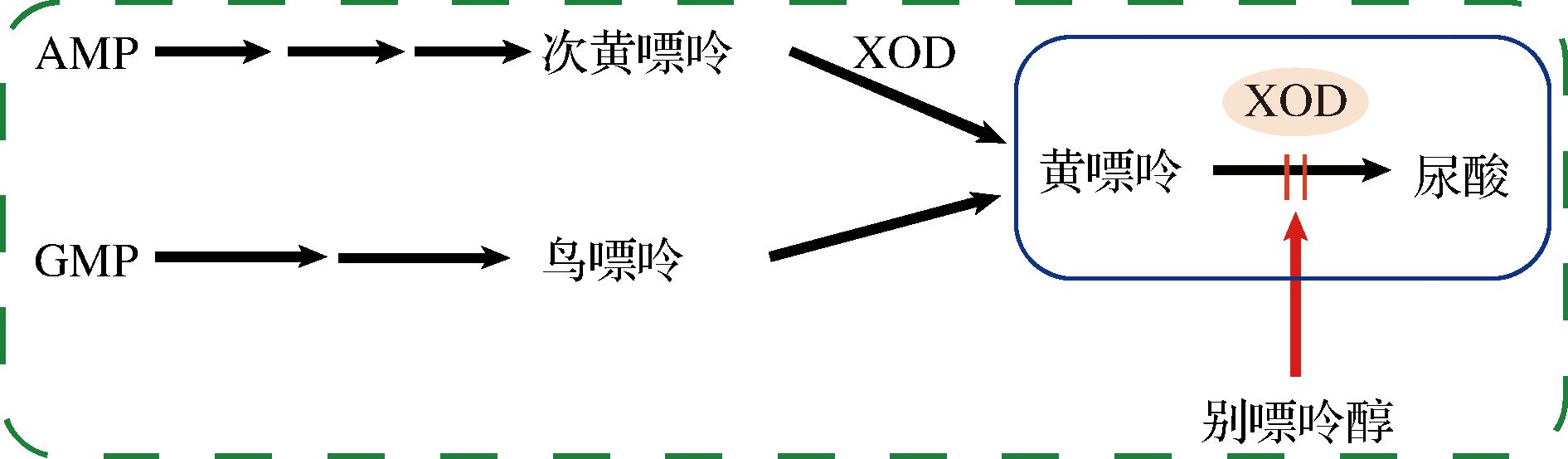
图1 黄嘌呤代谢机制图[12]
Fig.1 Mechanism of xanthine metabolism[12]
益生菌在促进人体健康方面上具有巨大的作用,如缓解乳糖不耐受症状、促进营养物质的吸收与利用、保护心血管系统、调节胆固醇等功能[13-15]。在医疗保健领域中,益生菌具有十分重要的作用,如治疗胃肠道疾病、治疗中枢神经系统疾病、抗癌和增强免疫等[16-19]。近年来国内外相关研究结果表明,某些益生菌能在一定程度上降低HUA模型动物的UA水平[20-22]。菌株Lactobacillus gasseri PA-3不仅在体外能够很好地吸收腺嘌呤,还能通过吸收并降解肌苷及其相关化合物,从而降低大鼠肠道对肌苷及其相关化合物的吸收,以此来达到降低尿酸的作用[23]。从传统泡菜中分离出的副干酪乳杆菌S12可以降解核苷,并能减轻UA对HUA大鼠肾脏的损害[24]。乳杆菌还可以通过调节小鼠肠道菌群结构,增加小鼠肠道中短链脂肪酸的含量,抑制XOD活性,最终缓解小鼠HUA[25]。这些研究结果为我们提供了辅助治疗HUA的新思路。
为了研究菌株X3-2B和37X-3的降尿酸能力及其对HUA的缓解作用,本文分析了2种菌株的体外抑制XOD活性实验结果,并建立了HUA小鼠模型,通过体内实验验证菌株对HUA的缓解作用,以期为把菌株X3-2B和37X-3应用于HUA的辅助治疗提供理论基础。
1 材料与方法
1.1 材料与试剂
植物植乳杆菌(Lactiplantibacillus plantarum)X3-2B和戊糖片球菌(Pediococcus pentosaceus)37X-3均由内蒙古农业大学肉品科学与技术团队提供,菌种保藏于含有30%(体积分数)甘油的冻存管中,于-80 ℃冻存。
5周龄SPF级KM雄性小鼠84只,体重30 g左右,购于斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010,合格证编号110324230101167585。HUA模型饲料(3%氧嗪酸钾和0.3%腺嘌呤,均为质量分数)和基础饲料均定制于赛诺生物科技(四平)有限公司。
XOD活性试剂盒、BCA试剂盒,南京建成生物公司;黄嘌呤、XOD(纯度≥98%),SIGMA公司;甲醇、冰乙酸、四丁基氢氧化铵,麦克林公司。
1.2 仪器与设备
Agilent 1260 vwd高效液相色谱仪,ZORBAX Eclipse XDB C18色谱柱(4.6 mm×250 mm,5.0 μm),美国安捷伦公司;Centrifuge 5810R高速冷冻离心机,Eppendorf艾本德,安徽中科中佳科学仪器有限公司;3110全自动生化分析仪,日立(上海)有限公司;HistoCore Arcadia H全自动封闭式脱水机、HistoCore PEARL石蜡包埋机、HistoCore As全自动轮转式切片机,莱卡公司。
1.3 实验方法
1.3.1 菌株X3-2B和37X-3体外抑制XOD活性测定
采用酶促反应中生成底物尿酸含量的多少反应XOD的活性。参考刘慧敏[26]的方法并略作修改,按照表1向96孔板依次加入磷酸缓冲液(pH 7.5,磷酸根离子浓度0.09 mol/L)、0.2 U XOD溶液、样品溶液,于37 ℃孵育3 min,然后加入1 mmol/L黄嘌呤溶液100 μL,在波长295 nm下记录吸光值,每隔1 min记录1次,共记录12次。在一定范围内,吸光值越大,尿酸生成越多。酶促反应总体积为200 μL,A:酶+底物;B:酶+底物+活菌培养液;C:底物;其中C为空白对照,实验设计如表1所示。
表1 体外XOD活性抑制实验 单位:μL Table 1 In vitro XOD activity inhibition assay
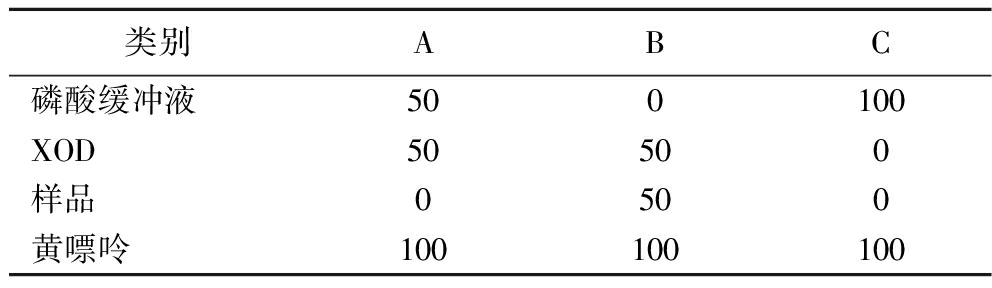
类别ABC磷酸缓冲液500100XOD50500样品0500黄嘌呤100100100
1.3.2 黄嘌呤及尿酸含量的测定
利用HPLC测定菌株X3-2B和37X-3在含有黄嘌呤和XOD的培养环境中培养20、40、60、80、100 min 时,培养基中黄嘌呤和尿酸的含量。
黄嘌呤检测色谱条件[27]。流动相:V(水)∶V(甲醇)∶V(冰乙酸)∶V(10%四丁基氢氧化铵)=879∶100∶15∶6;柱温28 ℃、流速1 mL/min、进样量为10 μL、检测波长260 nm。
尿酸检测色谱条件[28]。流动相A:0.007 mol/L磷酸二氢钾缓冲液(pH 4.02);流动相B:甲醇。流动相A∶流动相B=95∶5;柱温30 ℃、流速1 mL/min、进样量5 μL、检测波长254 nm。
1.3.3 菌株X3-2B和37X-3耐酸耐胆盐性能的测定
将保存于甘油中的菌株X3-2B与37X-3接种于MRS培养基里,37 ℃下培养18~24 h后以2%(体积分数)的接种量接种到新的培养基中,连续传代2次得到活化好的三代菌液。
将三代菌按照2%(体积分数)的接种量分别接种到pH值为2、3、4和胆盐质量浓度为1、2、3 g/L的培养基中,用pH值为6.5、胆盐浓度为0的正常培养基作为对照,37 ℃培养3 h后,用平板计数的方法对菌株的生长情况进行判断。
1.3.4 动物实验设计
动物实验共分为5组(n=12),分别是:对照组(C)、模型组(M)、X3-2B组(X)、37X-3组(L)和别嘌呤醇组(P)。实验动物饲养于独立式笼饲养(individually ventilated cage,IVC)动物试验系统中,饲养温度(20±1) ℃,相对湿度(50±5)%,昼夜12 h交替。实验开始前,小鼠适应性饲养1周,同时在第3、5、6天,用高嘌呤模型饲料替换M组、X组、L组和P组30%的基础饲料,用对照饲料替换C组30%的基础饲料,在第7天将剩余的基础饲料全部替换为高嘌呤模型饲料和相应的对照饲料。所有动物实验严格遵守道德伦理标准。本实验方案开展前已获得内蒙古农业大学“乳品生物技术与工程”教育部重点实验室动物使用许可(许可证号:SYXK蒙2020-0002)。
适应性喂养7 d后,按照表2进行灌胃,灌胃所用的新鲜菌液先使用1.3.3节中方法传三代,取三代菌液配制成浓度为109 CFU/mL的菌液,别嘌呤醇按干粉质量计算剂量。小鼠共饲喂4周,分别在第1、2、3、4周结束时,每组随机抽取3只小鼠禁食不禁水12 h,使用封闭环境吸入异氟烷的方式麻醉小鼠后摘眼球采血,颈椎脱臼处死解剖,收集肾脏,使用液氮速冻,并于-80 ℃保存。在第4周处死小鼠时,每组小鼠分出3个肾脏样本用4%(体积分数)多聚甲醛保存,用于病理学切片分析。血液样本4 ℃静置20 min,离心20 min(4 ℃,3 000 r/min)取上层血清,用200 μL离心管分装,液氮速冻,-80 ℃冻藏。
表2 分组方案与实验设计
Table 2 Groups and experimental design
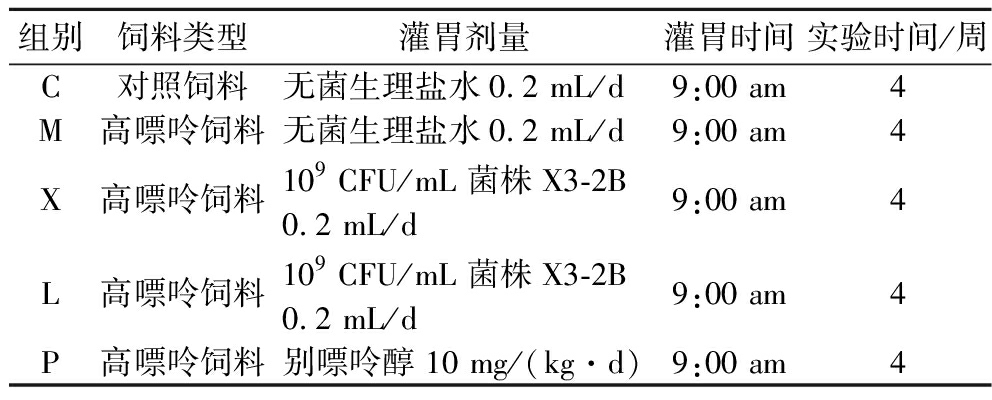
组别饲料类型灌胃剂量灌胃时间实验时间/周C对照饲料无菌生理盐水0.2 mL/d9:00 am4M高嘌呤饲料无菌生理盐水0.2 mL/d9:00 am4X高嘌呤饲料109 CFU/mL 菌株X3-2B0.2 mL/d9:00 am4L高嘌呤饲料109 CFU/mL 菌株X3-2B0.2 mL/d9:00 am4P高嘌呤饲料别嘌呤醇 10 mg/(kg·d)9:00 am4
1.3.5 基础指标及肾脏指数的测定
体重:分别在第0、1、2、3、4周记录小鼠体重。
采食量:分别在第1、2、3、4周记录小鼠采食量。
肾脏指数:按照公式(1)计算肾脏指数:
肾脏指数![]()
(1)
1.3.6 血清生化指标的测定
利用全自动生化分析仪来检测血清中的UA、肌酐(creatinine,Cr)、血尿素氮(blood urea nitrogen,BUN)含量。
1.3.7 小鼠肝脏和肾脏组织病理学分析
取保存于4%(体积分数)多聚甲醛中的肝脏组织和肾脏组织样本,经过梯度脱水和石蜡包埋后,切成5 μm后的切片。使用苏木精染液和伊红染液(hematoxylin and eosin staining,H&E)染色,烘片晾干后置于显微镜下观察肝脏和肾脏组织结构。
1.3.8 小鼠肝脏和结肠中XOD活性测定
在10 mL离心管中,按照料液比为1∶9(g∶mL)分别加入组织块和生理盐水,并加入研磨珠,使用冷冻研磨机将组织进行匀浆,研磨机参数:0 ℃、频率55 Hz,时间持续60 s,重复3次。严格按照XOD及BCA试剂盒说明书进行酶活的测定。
1.4 统计方法
所有实验数据采用平均值±标准差表示,使用SPSS 23.0版本分析数据,使用Graphpad prism 9.0版本进行图绘制,显著性采用字母标注法,不同字母之间表示P<0.05。
2 结果与分析
2.1 菌株X3-2B和37X-3体外抑制XOD活性能力评估
为了验证菌株X3-2B和37X-3对XOD活性具有抑制作用,以XOD的酶促反应为基础(XOD催化黄嘌呤生成UA),分别在20、40、60、80、100 min时测定菌株X3-2B和37X-3培养基(培养基中添加了XOD和黄嘌呤)中黄嘌呤和UA的含量。如图2-a和图2-b所示,随着时间的延长,培养基中UA含量基本保持不变,黄嘌呤含量显著增加(P<0.05)。黄嘌呤累积而UA含量基本不变,这初步证明由黄嘌呤生成UA被抑制。

a-菌株X3-2B组黄嘌呤和尿酸含量;b-菌株37X-3组黄嘌呤和尿酸含量;c-菌株X3-2B组尿酸含量差值;d-菌株37X-3组尿酸含量差值
图2 菌株X3-2B和37X-3体外抑制XOD实验
Fig.2 In vitro XOD inhibition experiments with strains X3-2B and 37X-3
注:不同小写字母代表差异显著(P<0.05)(下同)。
XOD催化黄嘌呤生成UA的过程中,XOD作为底物发挥重要作用[29]。以只添加底物为对照,计算“酶+底物”与“酶+底物+活菌培养液”生成UA的差值,借此反应XOD在酶促反应中的活性,即XOD被抑制时,差值越大。如图2-c和2-d所示,随着酶促反应的进行,UA含量的差值显著升高,说明在此酶促反应过程中,菌株X3-2B和37X-3能有效抑制XOD活性,减少UA生成。综合上述结果,菌株X3-2B和37X-3是通过抑制酶促反应中XOD活性从而减少UA的生成。
2.2 菌株X3-2B和37X-3耐酸耐胆盐性能评估
菌株X3-2B和37X-3作为益生菌需要通过胃和十二指肠,在动物肠道中发挥抑制XOD活性的作用,所以其耐酸和耐胆盐能力非常重要。如图3-a所示,随着pH值的降低,菌株X3-2B和37X-3的活菌数显著降低(P<0.05),最低活菌数为6.4×107 CFU/g(X3-2B)和9.3×107 CFU/g(37X-3)。如图3-b所示,随着胆盐添加量的增加,菌株X3-2B和37X-3的活菌数显著降低(P<0.05),最低活菌数为2.1×106 CFU/g(X3-2B)和2.8×106 CFU/g(37X-3)。虽然pH值降低和胆盐浓度升高都会减少活菌数,但是最低活菌数依然维持较高CFU,说明菌株X3-2B和37X-3具备顺利通过胃和十二指肠的能力,这为后续的体内抑制XOD活性实验提供了基础。
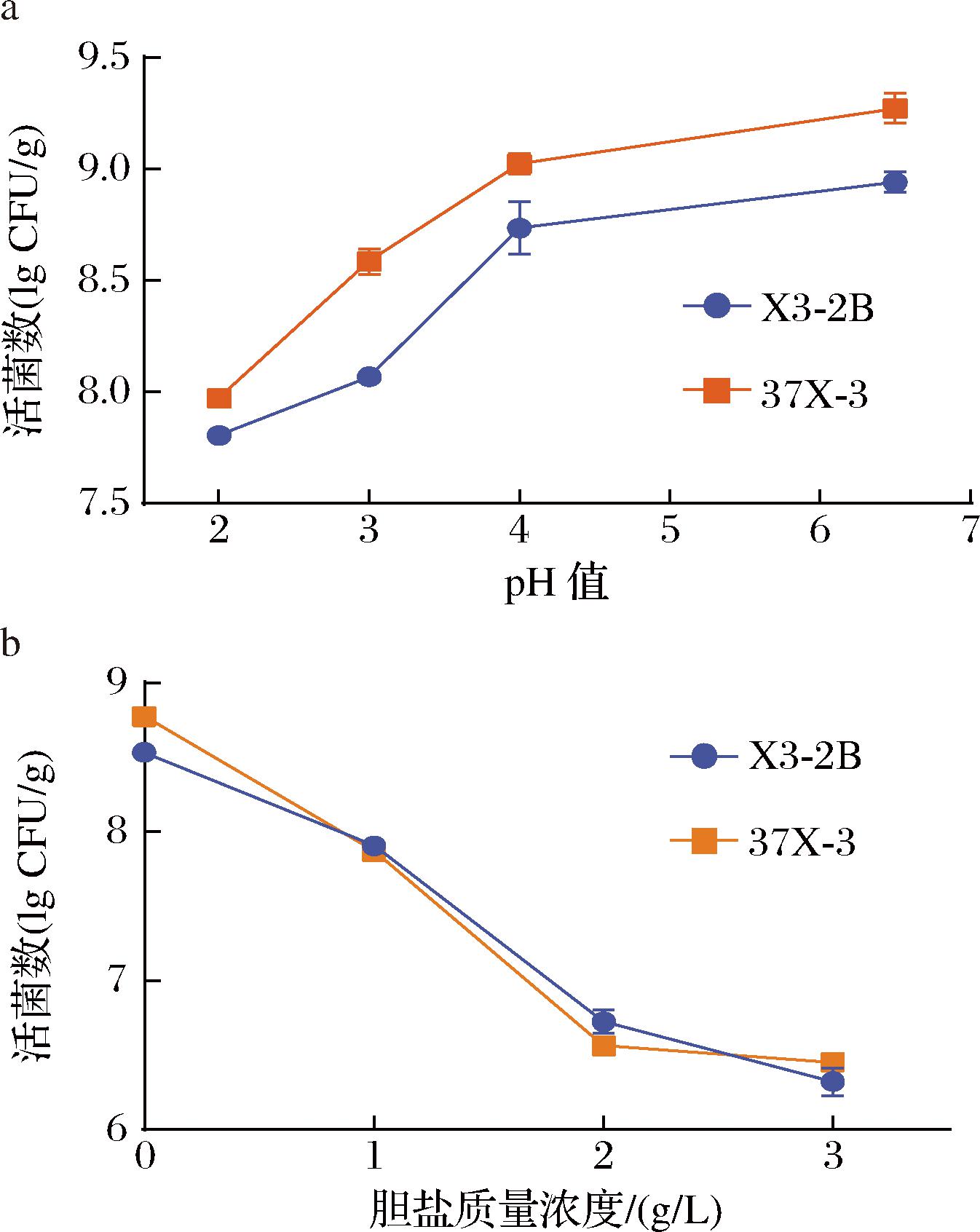
a-耐酸;b-耐胆盐
图3 菌株X3-2B和37X-3耐酸、耐胆盐性能测试
Fig.3 Acid and bile salt resistance testing of strains X3-2B and 37X-3
2.3 菌株X3-2B和37X-3对高尿酸血症小鼠的缓解作用
2.3.1 小鼠生长情况及生理指标的测定
饲喂小鼠高嘌呤饮食4周,建立HUA小鼠模型,同时给小鼠灌胃相应剂量的菌株X3-2B、37X-3以及别嘌呤醇。在实验过程中记录小鼠体重变化情况和采食量;实验结束时,测定小鼠肾脏指数,观察小鼠肾脏外观。如图4-a和4-b所示,C组小鼠的体重和采食量呈缓慢上升趋势,M组小鼠的体重和采食量均呈下降趋势;到第4周时,与C组相比,M组的体重和采食量显著降低(P<0.05)。经过灌胃菌株X3-2B、37X-3以及别嘌呤醇干预后,与M组相比,X组、L组和P组小鼠的体重和采食量显著增加(P<0.05)。如图4-c所示,与C组相比,M组小鼠的肾脏指数显著升高。经过干预后,与M组相比,X、L组和P组小鼠肾脏指数显著降低。从实物图中也可以看到,C组小鼠肾脏呈深红色,肾脏表面光滑、圆润有质感;M组小鼠肾脏颜色发白,肾脏表面有凹陷,呈缩水状;与M组相比,X组、L组和P组小鼠肾脏表面凹陷减少,颜色转深。
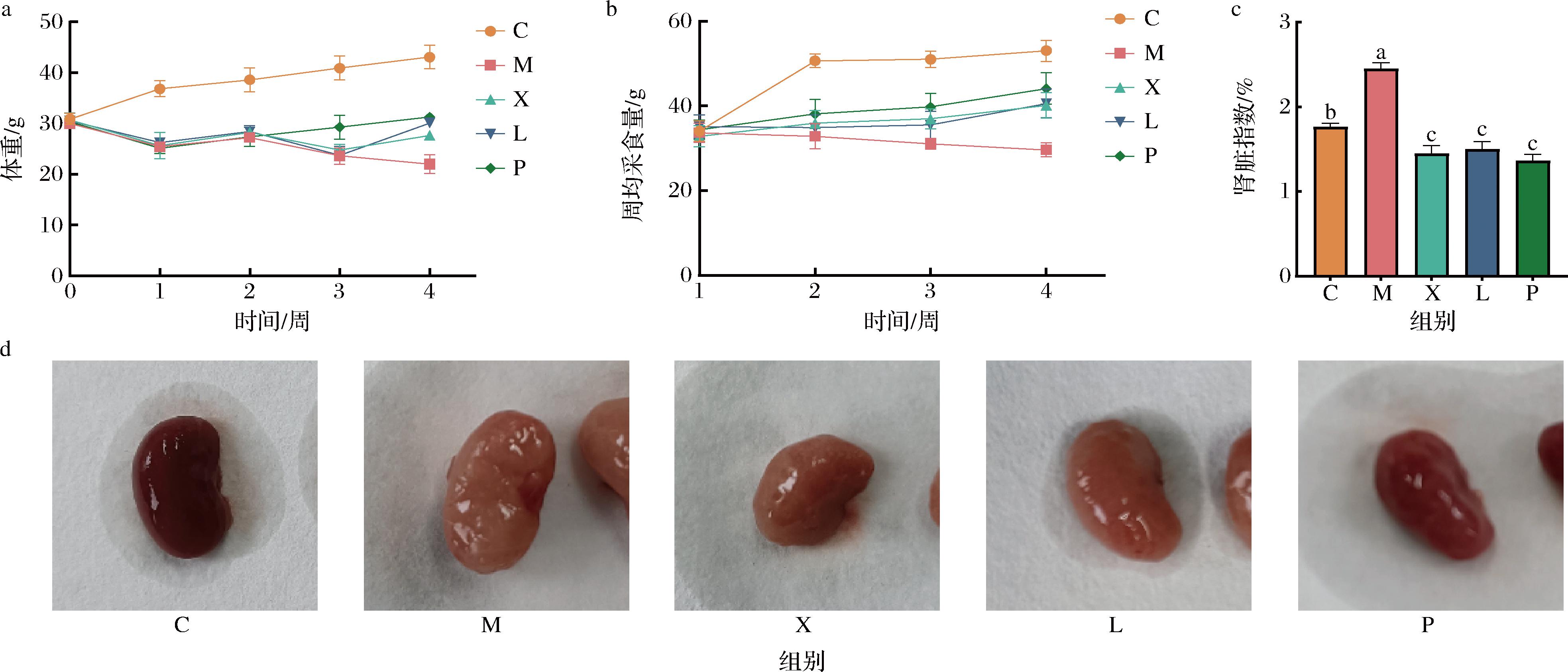
a-小鼠体重变化;b-每周平均采食量;c-实验结束时小鼠的肾脏指数;d-小鼠肾脏实物图
图4 小鼠生长情况及生理指标
Fig.4 Mouse Growth and Physiological Indicators
2.3.2 血清生化指标的测定
HUA最显著的特征就是血清中UA含量显著升高;肾小球病变时,过滤能力下降,大量肾单位受损使代谢产物不能及时排出,水、电解质和酸碱平衡失调,导致BUN和Cr水平增高[30-32]。如图5所示,与C组相比,M组小鼠血清中UA水平、BUN水平和Cr水平显著上升(P<0.05),结合小鼠生长情况和生理指标分析可知,小鼠HUA症状明显,本次实验造模成功。与M组相比(图5),X组、L组和P组小鼠血清中UA水平、BUN水平和Cr水平显著下降(P<0.05)。这些实验结果说明菌株X3-2B、37X-3和别嘌呤醇有效缓解了小鼠HUA症状。这些实验结果与SUN等[33]和DHOUIBI等[34]的研究结果类似。

a-血清中UA含量;b-血清中BUN含量;c-血清中Cr含量
图5 血清生化指标
Fig.5 Serum biochemical indicators
2.3.3 小鼠肾脏病理学切片分析
肾脏H&E染色切片可以直观反映出肾单位结构的变化情况。如图6所示,C组小鼠的肾小球、肾小管结构完整,细胞排列整齐有序,核质清晰。M组小鼠肾小球和肾小管结构被破坏,肾小球严重萎缩,细胞无需排列,相互黏连,并且出现气球状样变。经过干预后,X组、L组和P组小鼠肾小球和肾小管结构维持完整,细胞有序排列,只出现少部分气球状样变。综上所述,菌株X3-2B、37X-3和别嘌呤醇可以通过缓解小鼠HUA症状,维持肾脏结构和功能完整。

图6 第4周小鼠肾脏H&E染色图
Fig.6 H&E staining of mice kidneys at week 4
注:黄色方框为肾小球结构,黄色箭头为气球状样变。
2.3.4 小鼠肠道组织中菌株X3-2B和37X-3对XOD的抑制作用
由体外耐酸耐胆盐实验可知,菌株X3-2B和37X-3在极端环境下仍然能保持较多活菌数。为了验证菌株X3-2B和37X-3能否在小鼠肠道中发挥抑制XOD活性功能,本实验测定了小鼠肠道组织中XOD的活性。由图7可知,与C组相比,M组小鼠肠道组织中XOD显著升高(P<0.05);与M组相比,X组、L组和P组小鼠肠道组织中XOD活性显著下降(P<0.05);说明菌株X3-2B和37X-3可以在小鼠肠道中抑制XOD活性,减少UA生成。
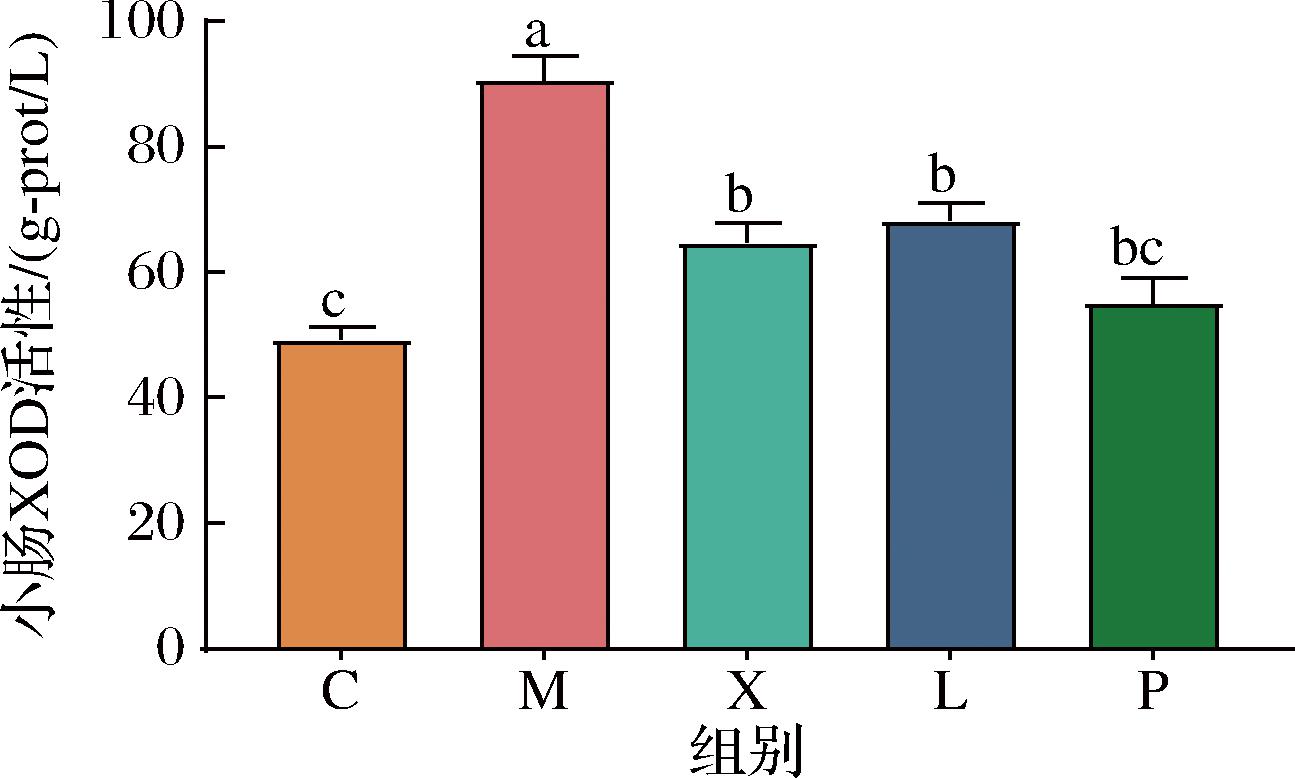
图7 实验结束时小鼠小肠中XOD活性
Fig.7 XOD activity in the small bowel of mice at the end of the experiment
值得注意的是,菌株X3-2B和37X-3并不能通过肠屏障进入肠道组织中,而肠道组织中XOD活性被抑制,这说明菌株X3-2B和37X-3抑制XOD活性的方式可能是分泌了具有抑制XOD活性的生物活性物质,这些生物活性物质可以通过肠屏障,被小肠吸收,在肠道组织中发挥抑制XOD的作用。
3 结论与讨论
随着人们生活水平的提高、饮食习惯的变化,高尿酸血症的发病率也日益增高,有研究表明,长期患有高尿酸血症对心血管、肝肾均有一定的损害,与一些代谢综合征如高血压病、高脂血症的发生有密切关系[35],乳酸菌可以改善人体肠道菌群结构,利用乳酸菌来干预高尿酸血症具有毒副作用小的优点。杨殿斌[36]筛出1株具有体外高降解核苷能力的乳酸菌DM9218,且其对高尿酸血症大鼠也有一定的防治作用;YAMADA等[23]发现菌株Lactobacillus gasseri PA-3能够在体外吸收腺嘌呤和腺苷,从而起到降低尿酸的作用。目前对乳酸菌降低UA和嘌呤的机制方面研究相对较少,因此研究与开发乳酸菌降嘌呤和UA的方法成为当今的热点。
本研究发现菌株X3-2B和37X-3具备XOD抑制能力,可以有效抑制酶促反应中UA的生成;并且菌株X3-2B和37X-3可以在HUA小鼠肠道中发挥抑制XOD活性的能力,有效缓解小鼠HUA症状,与短乳杆菌DM9505[37]抑制小鼠体中XOD的表达结果相一致;而这种抑制效果可能是通过分泌具有XOD抑制活性的生物活性物实现的,同OOI等[38]研究结果。后续实验可以在此基础上开展,深入研究菌株X3-2B和37X-3分泌的具有XOD抑制活性的生物活性物。
[1] 崔佳佳. 尿酸盐晶体形态学及果糖对尿酸转运子影响的研究[D].泰安:泰山医学院, 2010.CUI J J.Study of the morphological changes of urate ctystals and effect of fructose to the urate transporter[D].Taian:Taishan Medical University, 2010.
[2] WANG Z, CUI T, CI X Y, et al.The effect of polymorphism of uric acid transporters on uric acid transport[J].Journal of Nephrology, 2019, 32(2):177-187.
[3] 蓝淑珍, 周恩超.高尿酸血症对慢性肾脏病影响的研究进展[J].中国临床新医学, 2022, 15(9):878-882.LAN S Z, ZHOU E C.Research progress in the effect of hyperuricemia on chronic kidney disease[J].Chinese Journal of New Clinical Medicine, 2022, 15(9):878-882.
[4] HUANG J Y, MA Z F, ZHANG Y T, et al.Geographical distribution of hyperuricemia in mainland China:A comprehensive systematic review and meta-analysis[J].Gloabl Health Research and Policy, 2020, 5(1):52-52.
[5] BOHAT J, HORV
J, HORV THOV
THOV V, PAVL
V, PAVL KOV
KOV M, Et al.Circulating microRNA alternations in primary hyperuricemia and gout[J].Arthritis Research &Therapy, 2021, 23(1):186.
M, Et al.Circulating microRNA alternations in primary hyperuricemia and gout[J].Arthritis Research &Therapy, 2021, 23(1):186.
[6] RUAN F K, LIU C Q, HU W P, et al.Early life PCB138 exposure induces kidney injury secondary to hyperuricemia in male mice[J].Environmental Pollution, 2022, 301:118977.
[7] LI Y K, LI H Q, WANG R, et al.Protective effect of sodium butyrate on intestinal barrier damage and uric acid reduction in hyperuricemia mice[J].Biomedicine &Pharmacotherapy, 2023, 161:114568.
[8] WANG F Q, ZHAO X, SU X, et al.Isorhamnetin, the xanthine oxidase inhibitor from Sophora japonica, ameliorates uric acid levels and renal function in hyperuricemic mice[J].Food &Function, 2021, 12(24):12503-12512.
[9] DALBETH N, CHOI H K, JOOSTEN L A B, et al.Gout[J].Nature Reviews Disease Primers, 2019, 5:69.[10] LIU X P, ZHANG Z J, ZHANG Y, et al.Artificial metalloenzyme-based enzyme replacement therapy for the treatment of hyperuricemia[J].Advanced Functional Materials, 2016, 26(43):7921-7928.
[11] ZHANG L, ZHANG C, ZHUANG Z N, et al.Bio-inspired nanoenzyme for metabolic reprogramming and anti-inflammatory treatment of hyperuricemia and gout[J].Science China Chemistry, 2021, 64(4):616-628.
[12] 张丽萍, 杨建雄.生物化学简明教程[M].北京:高等教育出版社, 2015.ZHANG L P, YANG J X.A Concise Course in Biochemistry[M].Beijing:Higher Education Press, 2015.
[13] DA SILVA T F, CASAROTTI S N, DE OLIVEIRA G L V, et al.The impact of probiotics, prebiotics, and synbiotics on the biochemical, clinical, and immunological markers, as well as on the gut microbiota of obese hosts[J].Critical Reviews in Food Science and Nutrition, 2021, 61(2):337-355.
[14] OAK S J, JHA R.The effects of probiotics in lactose intolerance:A systematic review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(11):1675-1683.
[15] LIANG X, LV Y Y, ZHANG Z, et al.Study on intestinal survival and cholesterol metabolism of probiotics[J].LWT, 2020, 124:109132.
[16] JOHNSTON B C, GOLDENBERG J Z, PARKIN P C, et al.Probiotics and the prevention of antibiotic-associated diarrhea in infants and children[J].JAMA, 2016, 316(14):1484-1485.
[17] WANG H, LEE I-S, BRAUN C, et al.Effect of probiotics on central nervous system functions in animals and humans:A systematic review[J].Journal of Neuroga stroenterology and Motility, 2016, 22(4):589-605.
[18] DING S J, HU C, FANG J, et al.The protective role of probiotics against colorectal cancer[J].Oxidative Medicine and Cellular Longevity, 2020, 2020(1):8884583.
[19] SEHRAWAT N, YADAV M, SINGH M, et al.Probiotics in microbiome ecological balance providing a therapeutic window against cancer[J].Seminars in Cancer Biology, 2021, 70:24-36.
[20] CAO J Y, WANG T, LIU Y S, et al.Lactobacillus fermentum F40-4 ameliorates hyperuricemia by modulating the gut microbiota and alleviating inflammation in mice[J].Food &Function, 2023, 14(7):3259-3268.
[21] MEI Z J, LI D D.The role of probiotics in vaginal health[J].Frontiers in Cellular and Infection Microbiology, 2022, 12:963868.
[22] RAWAL S, ALI S A.Probiotics and postbiotics play a role in maintaining dermal health[J].Food &Function, 2023, 14(9):3966-3981.
[23] YAMADA N, IWAMOTO C, KANO H, et al.Evaluation of purine utilization by Lactobacillus gasseri strains with potential to decrease the absorption of food-derived purines in the human intestine[J].Nucleosides, Nucleotides &Nucleic Acids, 2016, 35(10-12):670-676.
[24] XIAO Y X, ZHANG C X, ZENG X L, et al.Microecological treatment of hyperuricemia using Lactobacillus from pickles[J].BMC Microbiology, 2020, 20(1):195.
[25] 倪彩新. 乳杆菌对高尿酸血症的影响及作用途径探究[D].无锡:江南大学, 2021.NI C X.Study of the effects and approaches of Lactobacillus on hyperuricaemia alleviation[D].Wuxi:Jiangnan University, 2021.
[26] 刘慧敏. 乳酸菌嘌呤降解菌株的筛选、基因组特征及其应用研究[D].扬州:扬州大学, 2021.LIU H M.Screening, genomic characteristics and application of purine degrading lactic acid bacteria[D].Yangzhou:Yangzhou University, 2021.
[27] ZHANG X P, WANG J J, WU Q H, et al.Determination of kanamycin by high performance liquid chromatography[J].Molecules, 2019, 24(10):1902.
[28] WIJEMANNE N, SOYSA P, WIJESUNDARA S, et al.Development and validation of a simple high performance liquid chromatography/UV method for simultaneous determination of urinary uric acid, hypoxanthine, and creatinine in human urine[J].International Journal of Analytical Chemistry, 2018, 2018:1647923.
[29] JIANG S Y, SONG D N, ZHAO H H, et al.Bioactivity and component analysis of water extract of Sophora japonica against hyperuricemia by inhibiting xanthine oxidase activity[J].Foods, 2022, 11(23):3772.
[30] EBEFORS K, BERGWALL L, NYSTRÖM J.The Glomerulus according to the mesangium[J].Frontiers in Medicine, 2022, 8:740527.
[31] PENG R, LIU K, LI W D, et al.Blood urea nitrogen, blood urea nitrogen to creatinine ratio and incident stroke:The Dongfeng-Tongji cohort[J].Atherosclerosis, 2021, 333:1-8.
[32] WANG S, WANG F, WANG X, et al.Elevated creatinine clearance in lupus nephritis patients with normal creatinine[J].International Journal of Medical Sciences, 2021, 18(6):1449-1455.
[33] SUN X W, WEN J, GUAN B S, et al.Folic acid and zinc improve hyperuricemia by altering the gut microbiota of rats with high-purine diet-induced hyperuricemia[J].Frontiers in Microbiology, 2022, 13:907952.
[34] DHOUIBI R, AFFES H, SALEM M B, et al.Creation of an adequate animal model of hyperuricemia (acute and chronic hyperuricemia);study of its reversibility and its maintenance[J].Life Sciences, 2021, 268:118998.
[35] BHOLE V, CHOI J W J, KIM S W, et al.Serum uric acid levels and the risk of type 2 diabetes:A prospective study[J].The American Journal of Medicine, 2010, 123(10):957-961.
[36] 杨殿斌.降血尿酸乳酸菌筛选及乳杆菌对高血尿酸血症大鼠作用的研究[D].大连:大连医科大学, 2013.YANG D B.The screening of lactobacillus reduced blood uric acid and lactobacillus′ effect in hyperuricemia rat model[D].Dalian:Dalian Medical University, 2013.
[37] 邓英. 乳杆菌对高果糖诱导小鼠高尿酸血症的防治作用及机制探讨[D].大连:大连医科大学, 2018.DENG Y.Prevention and cure effects of Lactobacillus on hyperuricemia induced by high fructose diet and its mechanism[D].Dalian:Dalian Medical University, 2018.
[38] OOI K L, ZAKARIA R, TAN M L, et al.The influence of chemical composition of potent inhibitors in the hydrolyzed extracts of anti-hyperuricemic plants to their xanthine oxidase activities[J].Journal of ethnopharmacology, 2021, 278:114-294.