近年来,随着生活水平的提高,人们对食物的品质有了更高的追求,尤其是牛肉因其独特口感、丰富营养以及多样的烹饪方式而备受消费者欢迎。其中,牛肉多肽是由牛肉蛋白质分解而成的多肽类物质,具有多种生物学活性[1],如抗氧化、降血压、降血糖、抗炎和抗肿瘤等作用。
在多肽的研究中,合适的分离方法选择取决于多肽的特性、分离目的和实验条件。柱层析法[2]具有分离精度高、可逆性好等优点,但也存在成本高和操作技能要求较高的缺点。电泳法[3]则以分离速度快、灵敏度高、操作简单等优点而著称。另外,两性离子交换法[4]在蛋白质纯化中得到广泛应用,用于去除蛋白质中的离子、杂质和盐,提高纯度和质量。膜分离技术[5],作为一种高效、简便、节能环保的分离方法,在化工、生物制药、饮料和环保领域得到了广泛应用。该技术利用半透膜[6]在分子水平上选择性地分离不同大小的混合物,其中超滤膜[7]技术被证明是一种高效且低成本的方法,可用于分离不同分子质量的多肽,并保持其生理活性。
在生物领域,量子化学模拟[8]是一项关键技术,用于探究蛋白质和多肽的结构、功能和相互作用。这种模拟通过计算分子的量子力学性质,揭示了在原子和分子水平上发生的化学反应和动态过程。通过量子力学方法,如密度泛函理论和分子力场,可以模拟蛋白质折叠、多肽的构象变化以及其与其他生物分子的相互作用,从而解释其稳定性、抗氧化性能以及与药物的结合方式。
本研究选择了1,2-二(三乙氧基甲硅烷基)乙烷[1,2-bis(triethoxysilyl)ethane,BTESE]衍生的无定形有机硅胶膜,其网络孔径和高渗透性使其在多肽分离中表现出较高性能。通过筛选不同种类的膜,包括聚四氟乙烯(polytetrafluoro-ethylene,PTFE)、醋酸纤维素(cellulose acetate,CA)、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)、混合纤维素(nitrocellulose-cellulose acetate,CN-CA)、聚醚砜(polyethersulfone,PES)等,制备了BTESE/CN-CA复合膜,实现了优异的抗氧化肽分离效果,为后续抗氧化肽研究奠定了理论基础。
1 材料与方法
1.1 材料与试剂
市售牛腱子、食盐(淮盐牌),永辉超市。
超氧化物歧化酶(super oxide dismutase, SOD)活力检测盒,南京建成生物工程研究所;ABTS、DPPH、1,10-菲咯啉,Sigma-Aldrich(上海)贸易有限公司;盐酸、无水乙醇、牛血清蛋白、氢氧化钠、邻二氮菲、过氧化氢,国药集团化学试剂有限公司;五水合硫酸铜、四水合酒石酸钾钠、磷酸氢二钠、磷酸二氢钠、硫酸亚铁、上海凌峰化学试剂有限公司;三氯乙酸、谷胱甘肽(glutathione,GSH),上海阿拉丁试剂有限公司;所有化学品和试剂均为分析级。
1.2 仪器与设备
721N可见光分光光度计,上海仪电分析仪器有限公司;Centrifuge 5804/5804 R-台式离心机,Eppendorf/艾本德;SHJ-1数显恒温水浴锅,金坛市杰瑞尔电器有限公司;循环水真空泵,上海聚昆仪器设备有限公司;ATY224精密电子天平,常州万泰天平仪器有限公司;RE-3000A旋转蒸发仪,上海亚荣生化仪器厂;DZF-6020电热恒温干燥箱,上海精宏实验设备有限公司;德国IKA涡旋混合器、T18高速分散机(匀浆机),艾卡仪器设备有限公司。
1.3 实验方法
1.3.1 多肽的提取
采用下述传统腌制牛肉方法腌制,5%(质量分数)食用盐,90%相对湿度,3~5 ℃,腌制5 d;12 ℃,80%相对湿度,腌制5 d;20 ℃,70%相对湿度,腌制7 d,体重下降45%;22.5 ℃下,腌制30 d。本实验所用的样品为腌制47 d后的干腌牛肉成品。
抗氧化肽的提取采用盐酸提取法[9],用粉碎机将100 g牛肉粉碎,在300 mL 0.01 mol/L盐酸中冷藏浸泡一夜,目的是充分水解,除去脂肪等杂质。4 200 r/min,4 ℃,离心15 min,分离多肽和其他溶质。在上清液中缓慢加入冷乙醇,使样品中的蛋白质凝固,4 ℃下放置20 min。再在4 ℃下以12 000 r/min离心20 min。离心后用旋转蒸发器除去乙醇,-20 ℃下冷冻干燥贮存。
标准曲线采用双缩脲法[10],用500 mL蒸馏水溶解1.50 g五水合硫酸铜和6.00 g四水合酒石酸钾钠,加入300 mL 100 g/L NaOH溶液,定容至1 L。540 nm下测定吸光度值,以牛血清蛋白质量浓度为横坐标(x),以A540nm吸光值为纵坐标(y)绘制标准曲线,算得样品溶液的多肽含量。通过双缩脲法测定标准曲线为y=0.146 3x+0.046 3,R2=0.993 3,曲线拟合良好。
1.3.2 抗氧化能力的测定
1.3.2.1 DPPH自由基清除能力的测定
根据XIA等[12]方法,将提取物分别配制成质量浓度为0.2~1 mg/mL的粗肽液,以GSH作为对照组。将2 mL 0.2 mmol/L DPPH自由基溶液[95%(体积分数)乙醇溶解]加入2 mL样品,混匀,室温避光反应30 min,在517 nm处测样品吸光度。空白为2 mL样品加2 mL 95%(体积分数)乙醇,对照为2 mL DPPH自由基溶液加2 mL 95%乙醇,同样条件下测A517nm。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:As、Ab分别代表样品和空白的吸光度。
1.3.2.2 ABTS阳离子自由基清除能力的测定
根据XIAO等[13]方法,将5 mL 7 mmol/L ABTS溶液与88 μL 140 mmol/L过硫酸钾溶液混合,在20 ℃下放置20 h,加入约3倍75%(体积分数)乙醇,在734 nm处的吸光度为0.70±0.02,得到ABTS阳离子自由基。样品由9.8 mL稀释的ABTS阳离子自由基溶液和0.2 mL粗肽(0.2~1 mg/mL)组成。以0.2 mL蒸馏水和9.8 mL稀释的ABTS阳离子自由基溶液的混合物为空白,以1 mg/mL粗肽0.2 mL和9.8 mL蒸馏水为对照。所有混合物在室温下放置30 min,在734 nm处测定其吸光值。ABTS阳离子自由基清除率的计算如公式(2)所示:
ABTS阳离子自由基清除率![]() 100
100
(2)
式中:As、Ac、Ab分别表示样品、对照和空白的吸光度。
1.3.2.3 超氧阴离子自由基清除能力测定
根据XIA等[12]方法修改,具体方法如下:无菌水配制质量浓度为0.2~1 mg/mL的粗肽液,以相同浓度的GSH为对照组。1.5 mL粗肽液,依次加入0.5 mL 300 μmol/L 硝基氯化四氮唑蓝(nitro blue tetrazolium chloride,NBT)(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 468 μmol/L 还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 60 μmol/L 过硫酸氢钾(peroxymonosulfate,PMS)(pH 8.0 Tris-HCl缓冲液配制),振荡混匀,25 ℃水浴5 min,560 nm处测定吸光值,以缓冲液代替样品作为空白对照。超氧阴离子自由基清除率的计算如公式(3)所示:
超氧阴离子自由基清除能力![]()
(3)
式中:As、Ab分别代表样品和空白吸光度。
1.3.2.4 羟自由基清除率
参照ZHANG等[14]的方法进行,混合物由4 mL的1,10-邻菲咯啉(5 mmol/L)和4 mL 5 mmol/L的FeSO4组成,加入3 mL磷酸盐缓冲液(pH 7.4),然后加入3 mL H2O2(0.01%,体积分数)和4 mL粗肽(0.2~1 mg/mL)。最后,将混合物在36 ℃下放置1 h,在536 nm处测量吸光度。对照:用蒸馏水代替多肽溶液,其他试剂与样品相同。空白:用蒸馏水代替H2O2,其他试剂与样品相同。在536 nm处测量吸光度,羟自由基清除能力的计算如公式(4)所示:
羟自由基清除能力![]()
(4)
式中:As、Ac和Ab分别代表样品、对照和空白的吸光度值。
1.3.3 膜的筛选
本实验选用的6种膜分别为CN-CA水系混合纤维微孔滤膜、CA水系醋酸纤维滤膜、混合膜、PTFE聚四氟乙烯、PES聚醚砜微孔滤膜、PVDF聚偏氟乙烯(亲水)。
1.3.3.1 膜通量
在25 ℃和0.55 MPa跨膜压差下,超滤处理30 mL粗提液(不稀释)。收集透过液和截留液。记录超滤时间T和透过液体积V。膜通量[14]计算如公式(5)所示:
(5)
式中:J代表膜通量,L/(m2·s);V代表过膜液体积,L;T代表取样的时间,s;S代表膜的有效面积,m2。
1.3.4 膜的改性
本实验的纳滤分离膜为实验室自制,选择CN-CA膜为支撑体,采用BTESE作为硅源前驱体,催化剂为盐酸,溶剂为正丙醇,制备了有机硅聚合溶胶。通过超声喷涂法将有机硅溶胶涂覆在CN-CA撑体上制备复合膜,进行纳滤膜分离。
1.3.4.1 溶胶浓度的影响
为考察了不同BTESE溶胶浓度对分离性能的影响。本实验配制溶胶浓度分别为5、10、15、20、25、50 g/L。
1.3.4.2 热处理时间的影响
热处理时间是影响分离层的均匀度及厚度的关键因素,因此要掌握热处理的时间。本实验的热处理时间分别为2.5、5、7.5、10、15 min。
1.3.4.3 温度的影响
为考察温度对复合膜分离性能的影响,本实验的温度分别为100、125、150、200 ℃。
1.3.4.4 压力的影响
为考察压力对复合膜分离性能的影响,本实验的压力分别为0.5、0.75、1.0、1.25、1.5 MPa。
1.3.5 抗氧化肽的鉴定
质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS采集间切换。质谱参数设置如下:(1) MS:扫描范围(m/z):200~1 800;分辨率:70 000;AGC target:3e6;最大注入时间:50 ms;(2)HCD-MS/MS:分辨率:17 500;AGCtarget:1 e5;最大注入时间:45 ms;碰撞能量:28;动态排除时间:30 s。
1.3.6 分子动力学模拟
基于短肽FDGDF与SOD蛋白复合物作为初始结构分别进行全原子分子动力学模拟[15],模拟使用AMBER 18软件进行。各体系均采用LEaP模块给体系添加氢原子,在体系10 Å距离处添加截断的八面体TIP3P溶剂盒,并在所建体系中添加Na+/Cl-用于平衡体系电荷,最后输出用于模拟的拓扑和参数文件。
分子动力模拟采用AMBER 18软件进行模拟。模拟时,非键的截断距离设为10 Å,Particle mesh Ewald(PME)方法被用于计算长程的静电作用,SHAKE约束方法用于氢原子的限制,Langevin算法用于温控,其中碰撞频率γ设为2 ps-1。体系压强为1 atm,积分步长为2 fs,每隔10 ps保存轨迹用于后续分析。最后,NPT(等温等压)的情况下,对整个体系进行500 ps的平衡模拟。最后,2个复合体系在周期边界性条件下,分别进行100 ns的NPT(等温等压)系宗模拟。
1.3.7 分子力学/泊松-波尔兹曼(广义波恩)表面积[molecular mechanics/Poisson Boltzmann (generalized Born) surface area,MM/GBSA]结合自由能计算所有体系的蛋白和配体间的结合自由能通过MM/GBSA方法计算。本研究中采用90~100 ns的MD轨迹用作计算[16],具体如公式(6)所示:
[ΔG]_bind=[ΔG]_complex-([ΔG]_receptor+[ΔG]_ligand)=[ΔE]_internal+[ΔE]_VDW+[ΔE]_elec+[ΔG]_GB+[ΔG]_SA
(6)
式中:[ΔE]_internal表示内能、[ΔE]_VDW表示范德华作用以及[ΔE]_elec表示静电相互作用。其中内能包括键能(ebond)、角能(eangle)、和扭转能(etorsion);[ΔG]_GB和[ΔG]_SA统称溶剂化自由能。其中,[ΔG]_GB为极性溶剂化自由能、[ΔG]_SA为非极性溶剂化自由能。
1.4 数据处理
试验重复3次,数据采用Origin 2022进行分析处理,使用SPSS 20.0对数据进行方差分析,确定差异显著性,分子对接部分采用Pymol 2.3.0进行处理。
2 结果与分析
2.1 抗氧化能力的测定
牛肉多肽对自由基的清除率反映了其抗氧化能力,这种能力可以有效抑制自由基对细胞膜、DNA等的损伤,延缓细胞老化[17]。DPPH自由基是一种稳定的自由基,在与物质发生反应后,其颜色会从紫色转变为淡黄色[18]。从图1-A可以观察到,随着牛肉多肽浓度的增加,其对DPPH自由基的清除率逐渐提高。牛肉多肽质量浓度从0.2 mg/mL增加到1 mg/mL时,对DPPH自由基的清除率由26.89%上升至61.05%。类似地,牛肉多肽对ABTS阳离子自由基的清除率也随浓度增加而增强(图1-B)。此外,在图1-C和图1-D中,牛肉多肽对于其他自由基(如超氧阴离子自由基和羟自由基)的清除率也表现出类似的趋势。随着牛肉多肽浓度的增加,其对超氧阴离子自由基的清除率增加至56.36%。总体而言,牛肉多肽在不同浓度下对自由基的清除率显示出增强的趋势,尤其是对DPPH自由基和超氧阴离子自由基的清除率。
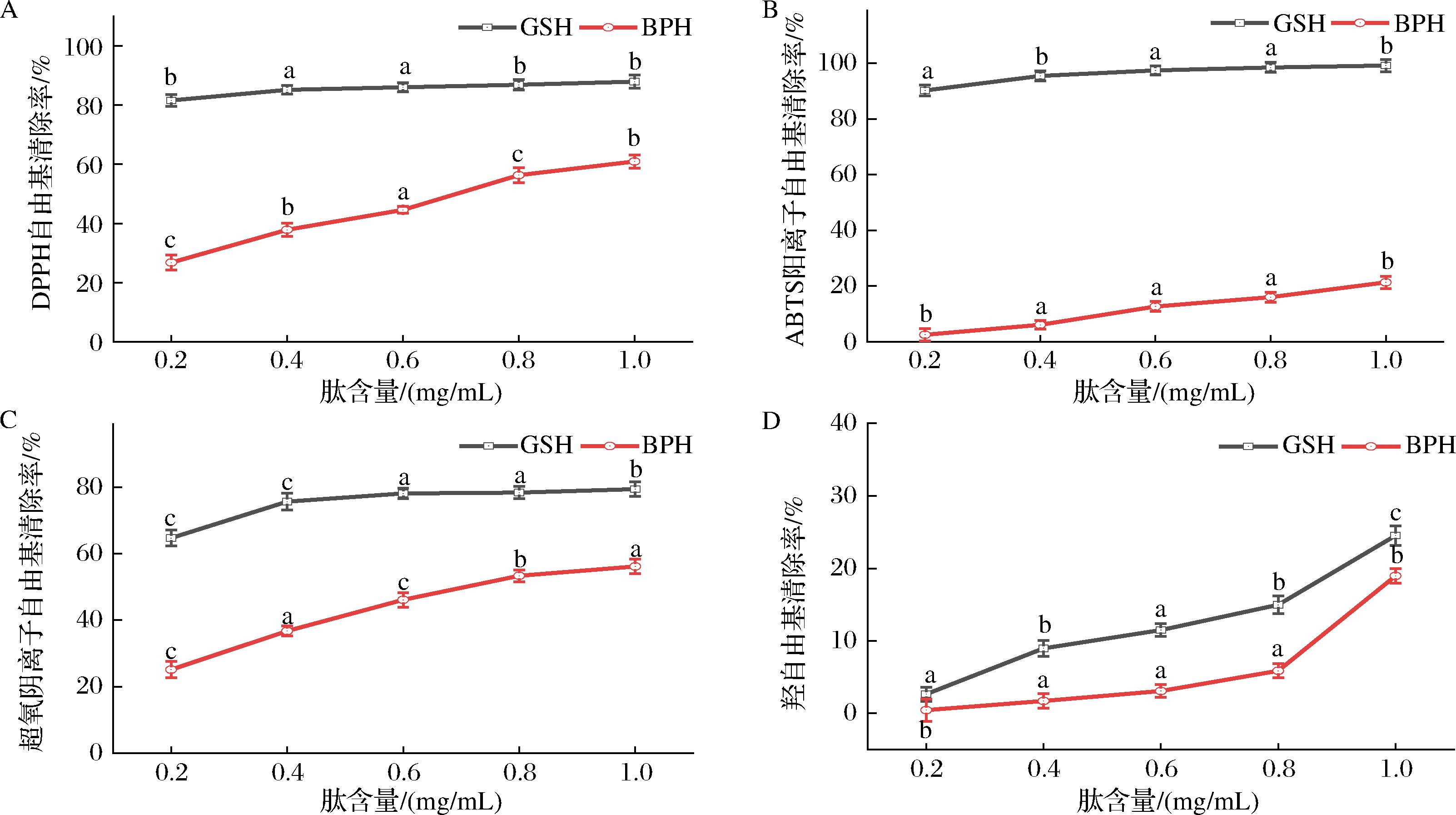
A-DPPH自由基;B- ABTS阳离子自由基;C-超氧阴离子自由基;D-羟自由基
图1 牛肉多肽和GSH对自由基的清除效果
Fig.1 Scavenging effects of beef polypeptides and GSH on free radicals
注:不同字母表示各组之间差异达到显著水平(P<0. 05)(下同)。
2.2 膜的选用
本实验选用直径50 mm、孔径0.45 μm的微孔滤膜,除去多肽液中的不溶性杂质,防止堵塞,再选用0.22 μm的膜进行膜分离。
2.2.1 膜通量的计算
膜通量[19]是指单位时间内通过膜面积的物质量或体积。由表1可知,物质通过6种膜所用时间分别为45、31、23、20、31、22 s,根据公式算得6种膜的膜通量分别为0.905 9、1.315 0、1.772 4、2.038 2、1.315 0、1.838 2 L/(m2·s)。由表1可以看出,CN-CA膜的膜通量最高,也就是单位时间内通过膜的液体量最大。这意味着它可以更快地处理多肽样品中的杂质和污染物,提高处理效率,并且减少所需的膜面积,从而有效降低生产成本。
表1 不同膜过膜时间及膜通量
Table 1 Different membrane passing times and membrane fluxes

膜名称时间/s膜通量/[L/(m2·s)]PTFE聚四氟乙烯450.905 9CA水系醋酸纤维滤膜311.315 0PVDF聚偏氟乙烯(亲水)231.772 4CN-CA水系混合纤维微孔滤膜202.038 2PES聚醚砜微孔滤膜201.315 0混合膜221.838 2
2.2.2 不同膜处理后抗氧化能力测试
图2-A显示,经过膜分离后,PTFE膜中的肽含量最高,其次是CA和CN-CA膜。在膜分离后,多肽的浓度普遍下降。这种下降可能是因为原始多肽样品中含有杂质和污染物,通过微孔滤膜过滤后这些杂质和污染物被膜截留,因此通过膜后的肽含量下降。尽管过膜后多肽含量降低,但抗氧化能力却提升了。这是因为虽然总多肽含量下降,但具有抗氧化作用的牛肉多肽并未减少,因此抗氧化能力得到了提高。
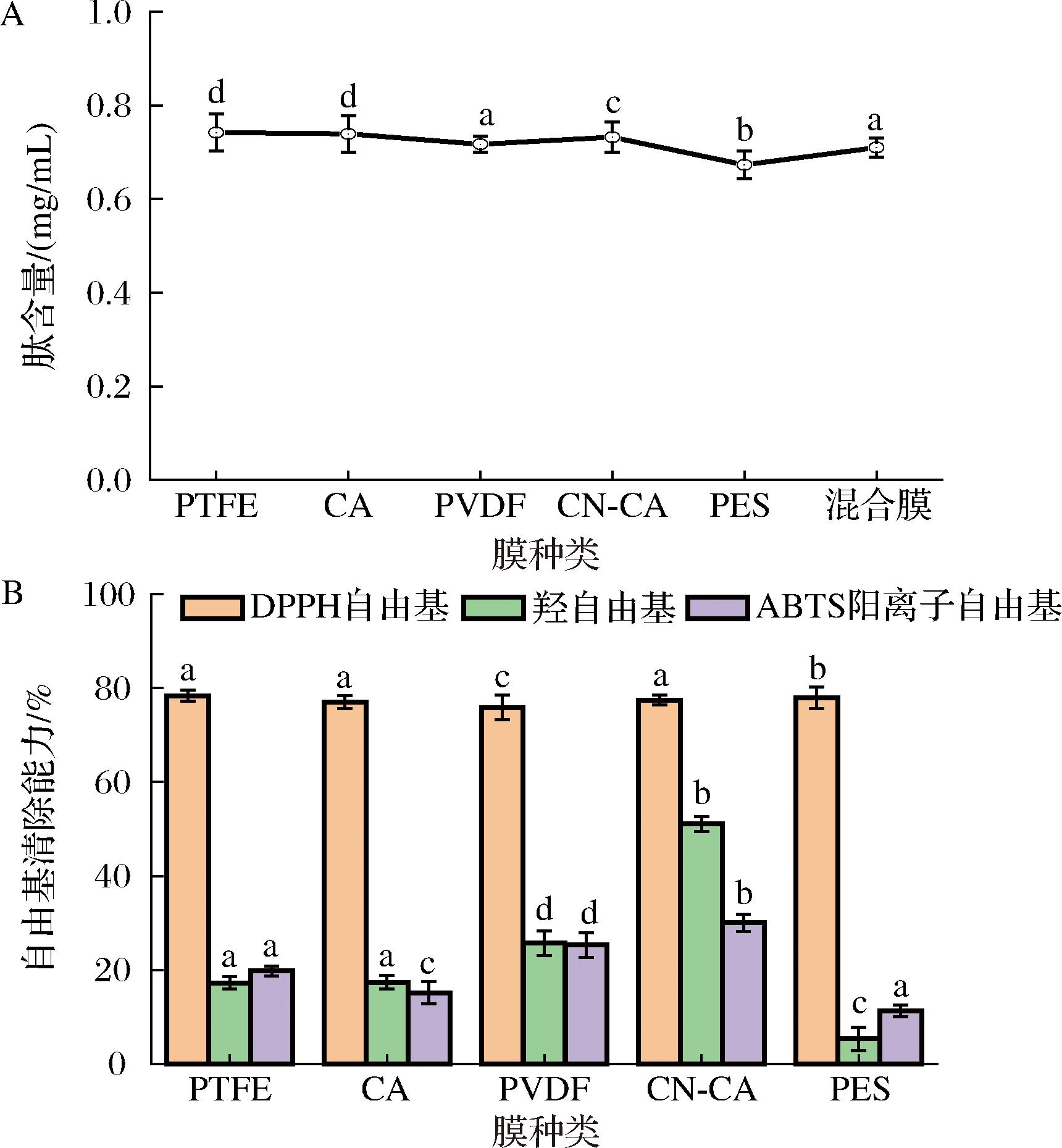
A-肽含量;B-自由基清除能力
图2 不同膜处理后抗氧化能力测试
Fig.2 Antioxidant capacity test after different membrane treatments
在图2-B中,经过6种膜过滤后的牛肉多肽清除率均高于未过膜前的61.05%,表明膜分离后牛肉多肽的DPPH自由基清除能力有所提升。CN-CA膜的羟自由基清除率为51.06%,远高于未过膜前的19.04%,而其他5种膜的提升效果不太显著。因此综合考虑,选用CN-CA膜作为改性材料。
2.3 膜的改性
不同溶胶浓度对膜形成产生不同的影响。如图3-A所示,配制了不同质量浓度的溶胶(5、10、15、20、25、50 g/L),并通过超声雾化探究了最低有效浓度。结果显示在15 g/L时,分离效果最佳,雾滴分布均匀,流速稳定,因为溶胶粒径随着进液流速的增加而增大。因此,选择15 g/L BTESE溶胶作为研究对象。
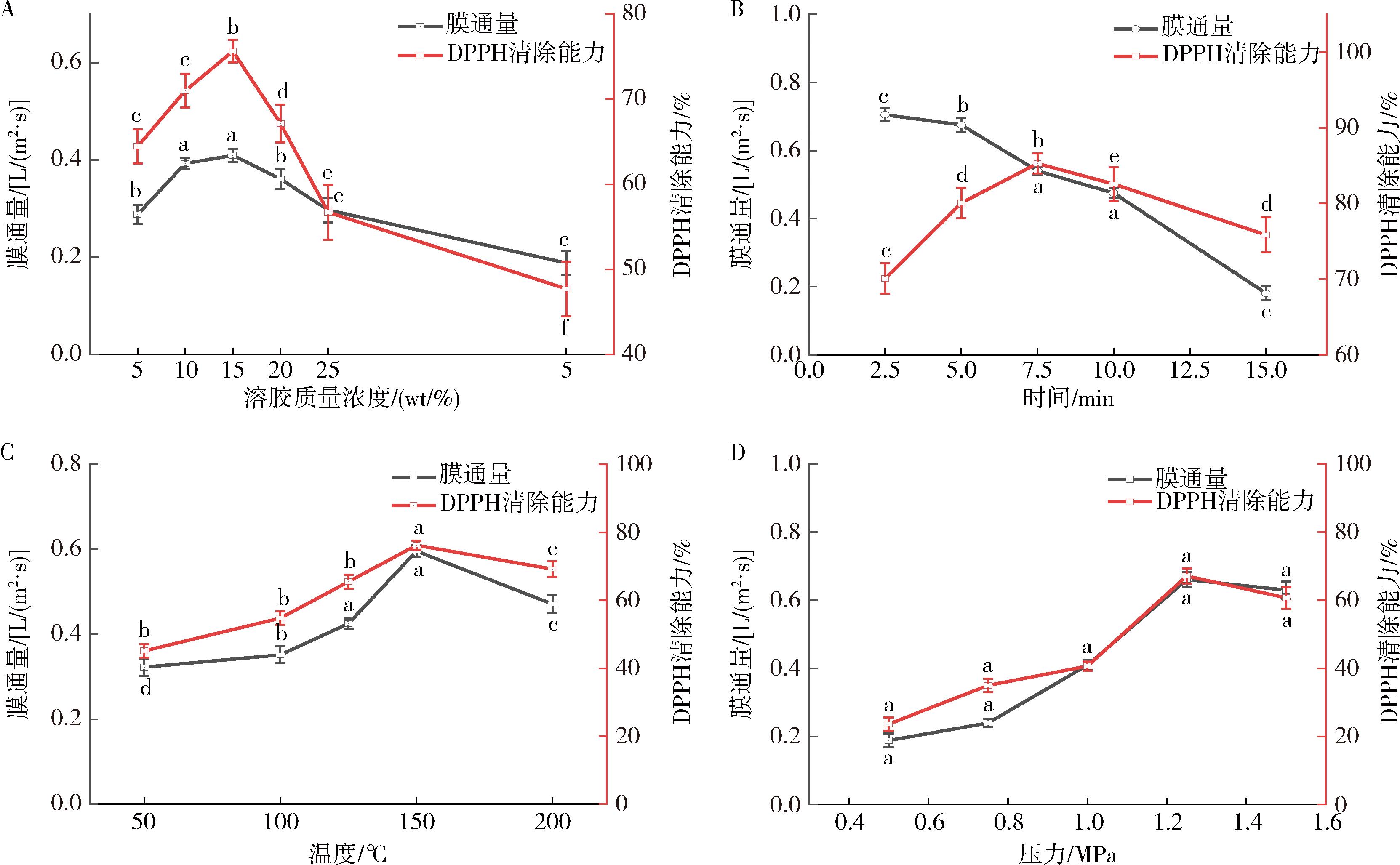
A-溶胶质量浓度;B-热处理时间;C-热处理温度;D-压力
图3 不同因素对BTESE/CN-CA复合膜的分离性能的影响
Fig.3 Effects of different factors on the separation performance of BTESE/CN-CA composite membranes
沉积及热处理时间是影响分离层均匀度和厚度的关键因素。如图3-B结果表明,热处理时间为7.5 min时,分离性能相对较好。然而,喷涂热处理时间也不能过长,否则分离层会变厚,也会导致BTESE活性分离层与支撑体之间的界面应力增大,影响了材料的稳定性和效能,可能使得分离层容易发生开裂。因此,喷涂热处理时间一般不应超过7.5 min。
热处理温度对BTESE有机硅复合膜的分离性能也产生影响。如图3-C所示,在150 ℃热处理下,通量发生衰减,可能是因为CN-CA支撑体发生了缩孔,导致通量骤减。这可能与150 ℃高于CN-CA支撑体的转变温度有关。
最后,图3-D考虑了压力对BTESE有机硅复合膜的分离性能的影响。1.25 MPa的压力下,截留率没有明显上升,可能是因为太高的压力导致CN-CA支撑体可能发生了缩孔,进而限制了截留率的增加。
2.4 多肽分子质量的分布
利用高效液相色谱对牛肉多肽的分子质量分布进行测定。由图4可知,未处理的牛肉多肽的分子质量分布范围较广,分子质量<15 kDa,BTESE/CN-CA改性膜处理后的过膜液的多肽被浓缩。
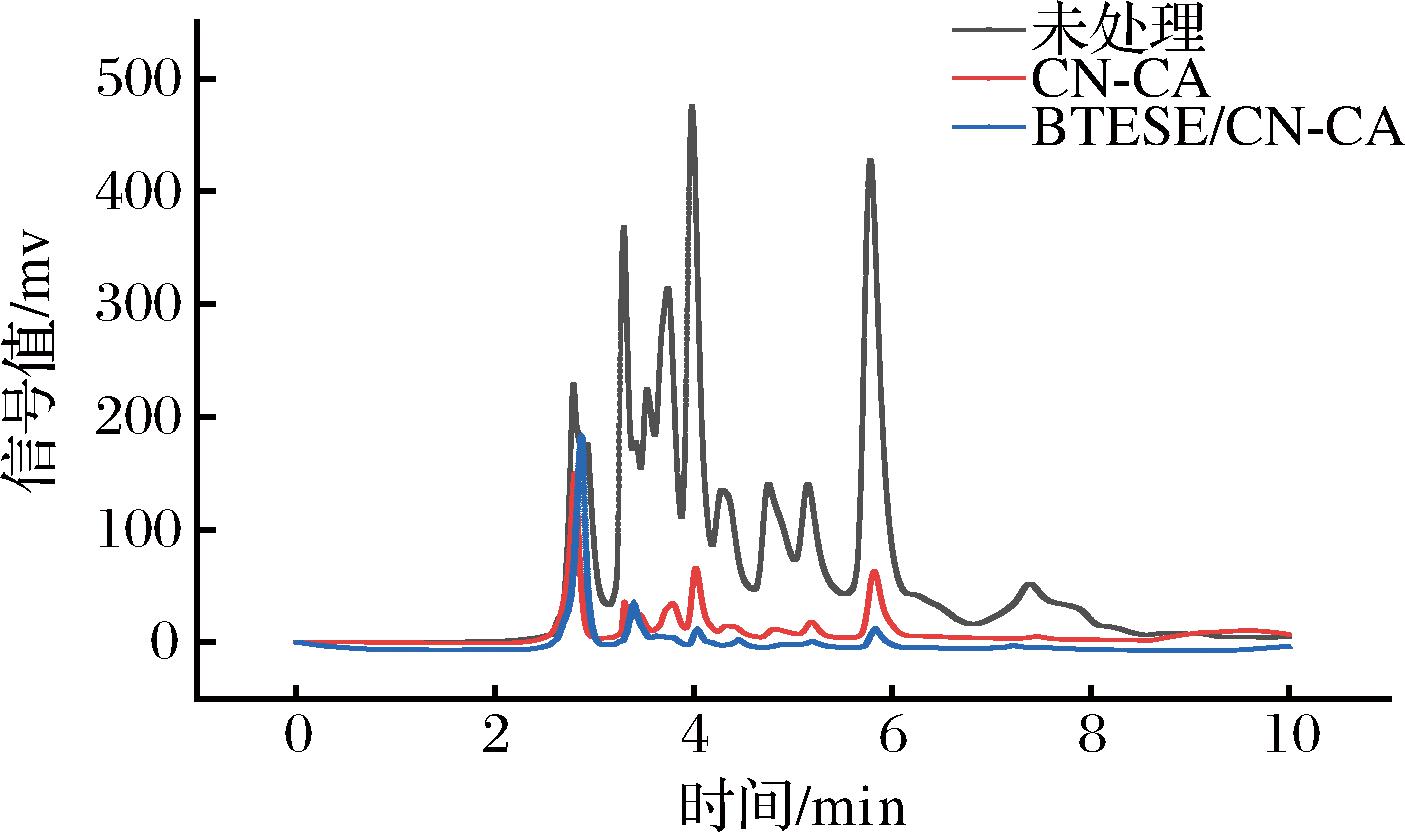
图4 改性前后多肽分子质量的分布
Fig.4 Comparison of antioxidant capacity before and after modification
2.5 抗氧化肽的鉴定
对其进行结构分析,结果如表2所示,鉴定出12个组分,Score为多肽评分(http://distilldeep.ucd.ie/PeptideRanker/)得分为(0~1),越接近1,表明其预测该多肽的生物活性最强。由表2可知,Phe-Asp-Gly-Asp-Phe(FDGDF)的多肽活性最强,得分为0.948 8。半衰期为多肽的一个重要指标,通过预测(https://web.expasy.org/protparam/)多肽在哺乳动物体内的半衰期,可以为后续开发相关多肽产品提供思路。
表2 组分成分分析
Table 2 Analysis of components

组分序列分子式等电点得分/分半衰期/h1FDGDFPhe-Asp-Gly-Asp-Phe3.3150.948 81.12APPSLFAla-Pro-Pro-Ser-Leu-Phe5.7720.933 64.43FDLRGFPhe-Asp-Leu-Arg-Gly-Phe6.1780.916 51.14DPLTGFGKAsp-Pro-Leu-Thr-Gly-Phe-Gly-Lys6.2540.607 11.15LLGLFLeu-Leu-Gly-Leu-Phe5.7840.601 25.56FDLRGKPhe-Asp-Leu-Arg-Gly-Lys9.4380.534 21.17YDMELRTyr-Asp-Met-Glu-Leu-Arg4.3790.427 32.88LPVKYLLeu-Pro-Val-Lys-Tyr-Leu9.0650.365 75.59LALHVLLeu-Ala-Leu-His-Val-Leu7.280.226 25.510FVSEPQSLRVVEKPhe-Val-Ser-Glu-Pro-Gln-Ser-Leu-Arg-Val-Val-Glu-Lys6.560.142 81.111VSEPQSLRVVEKVal-Ser-Glu-Pro-Gln-Ser-Leu-Arg-Val-Val-Glu-Lys6.5570.095 610012LEVRVPLeu-Glu-Val-Arg-Val-Pro6.3970.080 95.5
2.6 分子动力学
通过前期分析,选取研究Score评分最高的FDGDF与SOD构效关系,采用了SOD活力检测盒,通过加入不同的FDGDF测试其SOD活力。结果如图5所示,加入了FDGDF后的SOD活力呈上升趋势。因此推断FDGDF可以提高SOD活力。
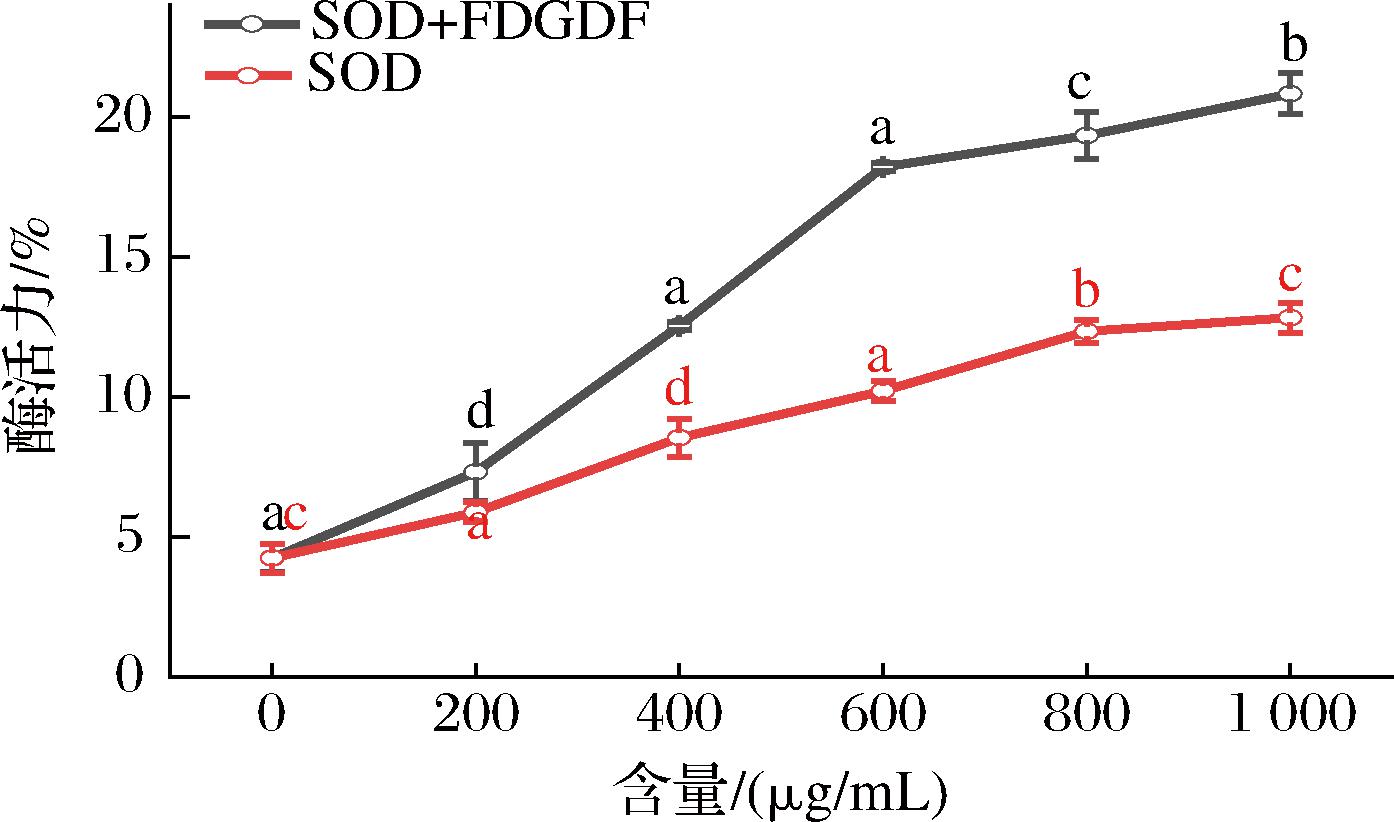
图5 FDGDF与SOD酶活力分析
Fig.5 FDGDF and SOD activity analysis
分子模拟是分析蛋白质作用力的一项重要工具。SOD[20](PDB ID;1E9O)具有极高的稳定性,即使在75 ℃下加温数分钟,也不会失活,而且它对酸碱也非常稳定,可以在pH 5.3~10.5反应。
通过分子对接得到了多肽FDGDF与SOD结合模式和作用细节,如图6所示(FDGDF使用球棍模型显示,C为绿色,O为红色,N为蓝色,SOD蛋白使用淡青色显示。氢键显示为黄色虚线,盐桥显示为洋红色虚线,π-堆叠作用显示为绿色虚线),FDGDF中的苯丙氨酸Phe5的电荷中心与SOD蛋白上的Val113形成一个π-堆叠作用,Ser111与多肽的甘氨酸(Gly,G)的骨架羰基氧形成一个氢键作用,多肽的甘氨酸的酰胺键的氨基与Arg108的骨架羰基氧形成一个氢键。FDGDF的2个天冬氨酸(Asp,D),与Arg108分别形成盐桥作用和氢键作用。
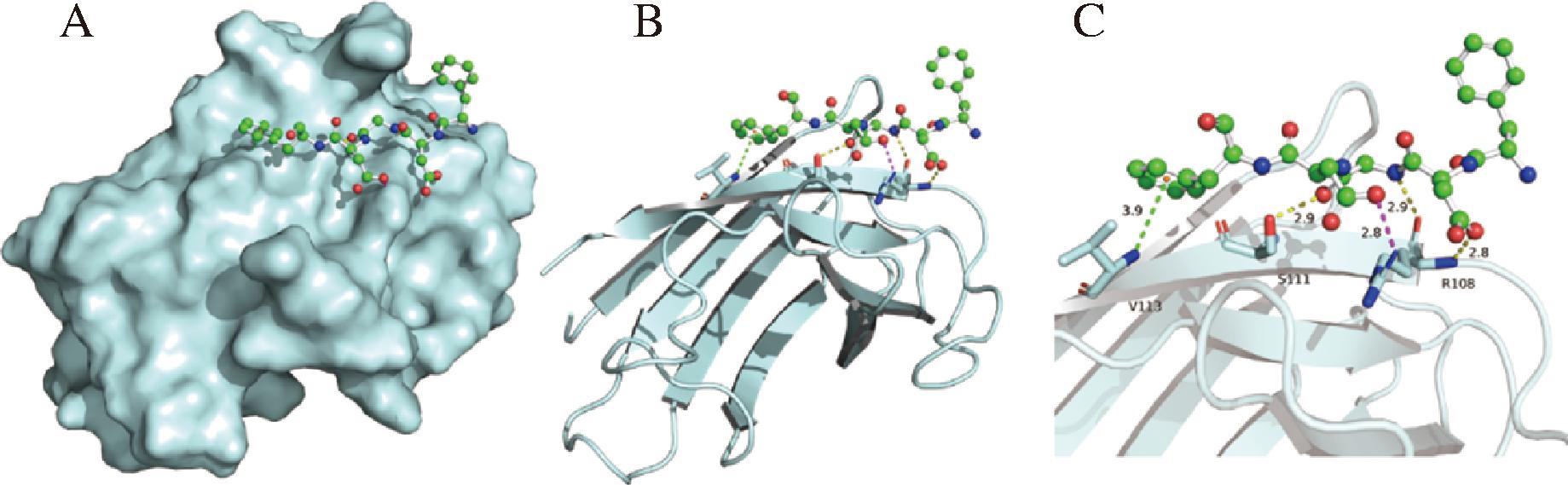
A-结合模式;B-球棍模型;C-作用力细节
图6 SOD蛋白与多肽相互作用的结合模式
Fig.6 SOD protein and peptide interaction binding pattern
本研究对多肽FDGDF的分子相互作用进行了详细分析。结果如图7及表3所示,O40原子通过氢键作用(键长3.9 Å,键能-1.9 kcal/mol);O52原子参与盐桥作用(键长2.8 Å,键能-8.8 kcal/mol),表现出较高的键能;N34原子形成氢键(键长2.9 Å,键能-3.1 kcal/mol);O32原子与Arg108的骨架酰胺通过氢键相连(键长2.8 Å,键能-4.0 kcal/mol),由于其较近的距离和骨架氢键特性,展现出较高的能量值。
表3 SOD蛋白与多肽的键长及键能
Table 3 SOD protein and peptide bond length and bond energy
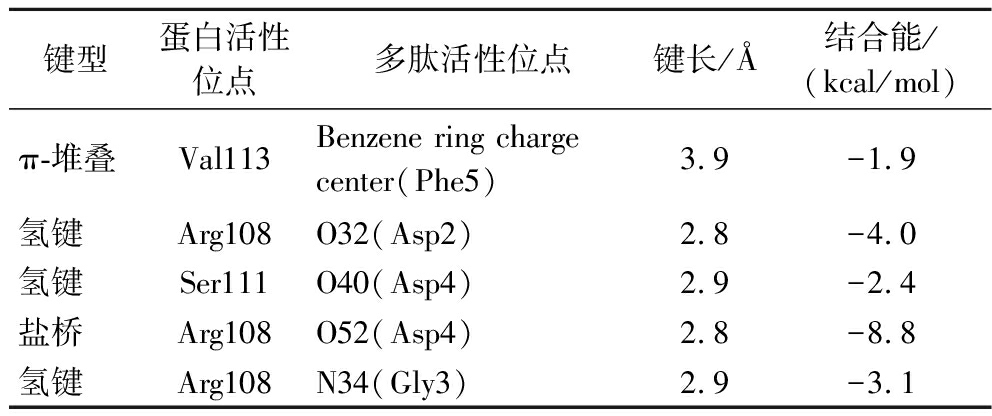
键型蛋白活性位点多肽活性位点键长/Å结合能/(kcal/mol)π-堆叠Val113Benzene ring charge center(Phe5)3.9-1.9氢键Arg108O32(Asp2)2.8-4.0氢键Ser111O40(Asp4)2.9-2.4盐桥Arg108O52(Asp4)2.8-8.8氢键Arg108N34(Gly3)2.9-3.1
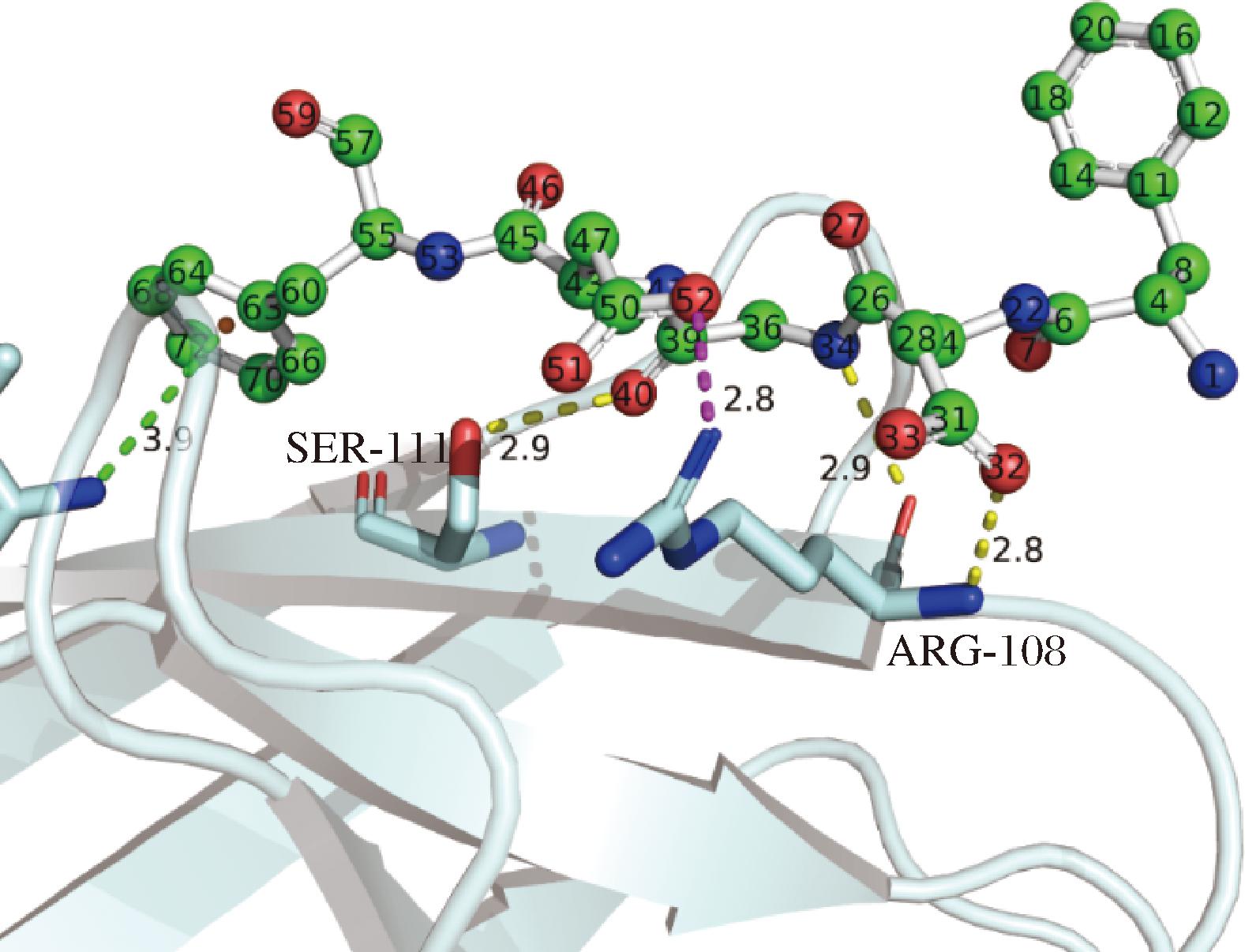
图7 SOD蛋白和肽的作用
Fig.7 SOD protein and peptide action
从作用细节(表3)分析看,2个天冬氨酸对于结合能的贡献非常大,一个是-8.8 kcal/mol,一个是-4.0 kcal/mol,高于其他几个氨基酸的键能,其中苯丙氨酸因为成键距离较远,虽然与Val112的骨架α-碳原子有π-堆叠作用,但是能量贡献仅为-1.9 kcal/mol。
进一步地,本研究使用DFT计算分析了多肽的每个原子的电荷分布、Fukui指数,以及多肽的HUMO和LUMO性质[21]。从图8可以看出,FDGDF的2个天冬氨酸有着较高的电子密度,通过计算得到FDGDF的LUMO值为-0.236 9 Hartree, HOMO为-0.248 6 Hartree,二者距离为0.011 7 Hartree, 距离越小表明活性越强,越易发生反应。
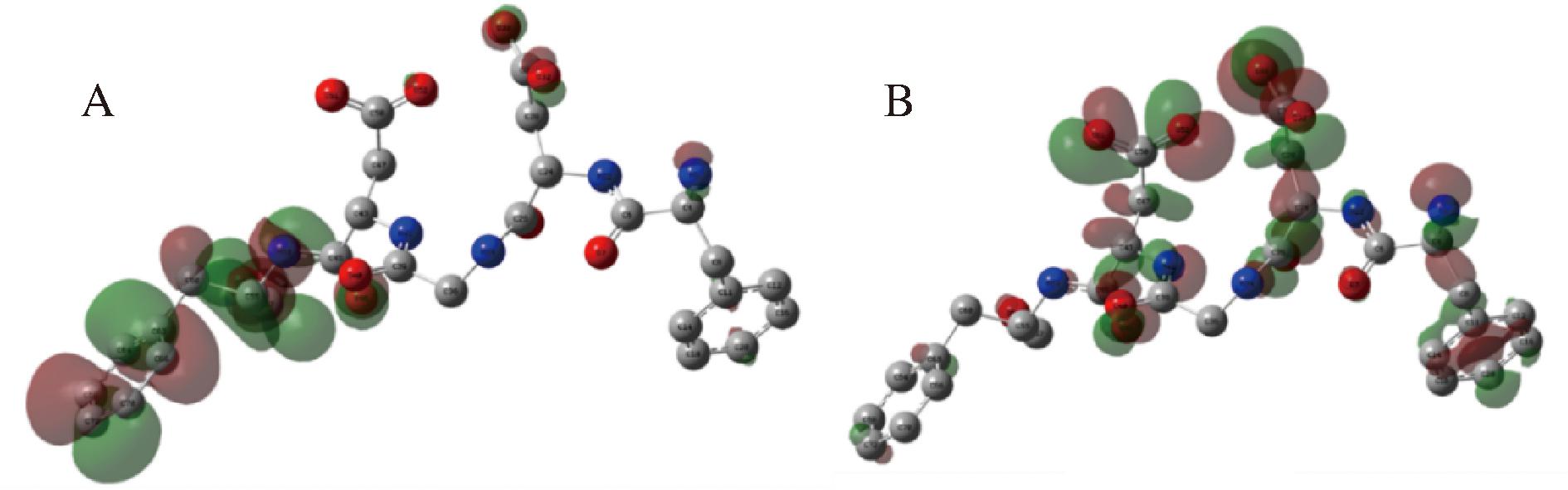
A-HOMO;B-LUMO
图8 多肽的分子轨道分布
Fig.8 Molecular orbital distribution of polypeptides
本研究使用Gaussian在B3LYP/6-31G基组下对FDGDF进行结构优化[22],并利用开源软件包Multiwfn进行电荷分布计算和Fukui指数计算,RESP电荷分布结果见表4。数据表明上述参与反应的原子如O40氧原子电荷为-0.498 9,O52为-0.417 5,O32为-0.433 9,N34为-0.398 5,表明这些原子具有较强的吸电子的能力,和HOMO-LUMO分析较为一致。
表4 多肽中每个原子的局部电荷分布
Table 4 Local charge distribution for each atom of the polypeptide

原子局部电荷O32 -0.433 9N34 -0.398 5O40-0.498 9O52-0.417 5
进一步地,分析Fukui指数,结果见表5,其中f0表示的是原子的反应活性大小,值越大表示参与自由基反应的可能性越大,通过计算表明O32/O40/O52的f0分别为0.069 9、0.016 4和0.076,O32和O52具有较高的f0值,而O40也大于平均值0.013,表明这些原子更容易发生反应,从结合模式上看这些原子的确形成了关键的相互作用,而且键能较高。
表5 Fukui计算结果
Table 5 Calculation results of Fukui index
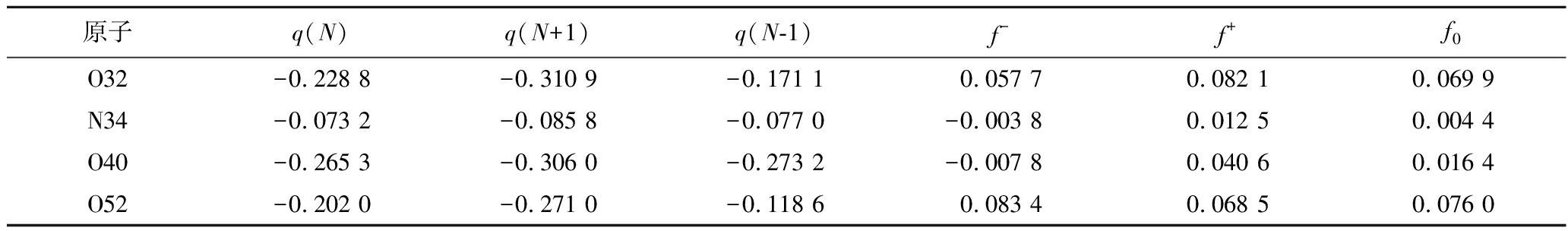
原子q(N)q(N+1)q(N-1)f-f+f0O32-0.228 8-0.310 9-0.171 10.057 70.082 10.069 9N34-0.073 2-0.085 8-0.077 0-0.003 80.012 50.004 4O40-0.265 3-0.306 0-0.273 2-0.007 80.040 60.016 4O52-0.202 0-0.271 0-0.118 60.083 40.068 50.076 0
通过上述Fukui指数,进行亲电性和亲核性计算,结果如表6所示,数值越大表明能力越强,比如参与反应的原子O32/O40/O52的亲电性数值分别为1.861 7、0.921 6和1.554 1,高于大部分原子,表明这些原子更容易参与反应。
表6 原子的亲电性和亲核性
Table 6 Electrophilicity and nucleophilicity of atoms
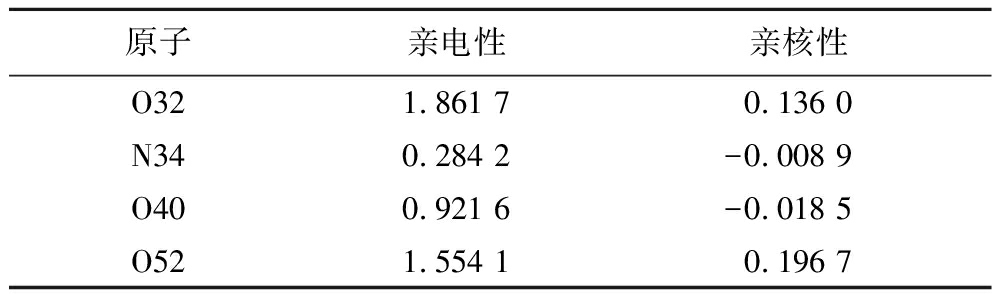
原子亲电性亲核性O32 1.861 70.136 0N34 0.284 2-0.008 9O400.921 6-0.018 5O521.554 10.196 7
2.7 稳定性分析
分子动力学模拟的均方根偏可以反映复合物的运动过程[23],均方根偏差(root mean square deviation,RMSD)越大以及波动越剧烈表示运动剧烈,反之,运动平稳。如图9-A所示,结合或者未结合短肽FDGDF的SOD蛋白在模拟初期,50 ns内到达收敛状态,表明蛋白体系稳定。值得注意的是,其中结合了短肽FDGDF的蛋白(红色)表现出比未结合短肽FDGDF的SOD蛋白更高的RMSD。表明短肽FDGDF增大了蛋白活跃性,短肽的作用下SOD表现出更剧烈的运动。根均方波动(root mean square fluctuation,RMSF)可以反映分子动力学模拟的过程中蛋白的柔性。如图9-B所示结合了短肽FDGDF小分子的SOD蛋白在整体氨基酸序列上表现出比未结合短肽FDGDF时RMSF更加高,表明短肽FDGDF能够提高SOD蛋白的柔性[24],猜测原因为受到短肽结合的影响,使得蛋白柔性发生变化,可能会造成蛋白的内在生理功能。氢键为最强的非共价结合作用之一,数目越多表示结合越好。监测了在模拟期间短肽FDGDF与SOD之间的氢键数目,以反映氢键在两者结合的贡献。如图9-C所示,小分子和蛋白在模拟过程中形成的氢键数目为0~5个。模拟前期以及模拟中期氢键数目为2~3个,模拟后期氢键数目稀疏。意味着氢键非短肽和SOD结合的主要作用力[25]。疏水作用以及溶剂介导的作用才是FDGDF与SOD结合的主要作用力。

A-RMSD;B-RMSF;C-氢键数目
图9 分子动力学模拟过程中复合物RMSD随时间的变化
Fig.9 RMSD of the complex with time during molecular dynamics simulation
基于分子动力学模拟的轨迹,采用MM/GBSA的方法计算了结合能,该结合能可以更为准确地反映小分子和目标蛋白的结合效果。如表7所示,短肽FDGDF与SOD的结合能为(-23.75±1.93) kcal/mol。数值为负数表明该分子与目标蛋白具结合亲和力,数值越低表示结合越强。显然的计算表明短肽FDGDF与SOD的结合亲和力较强。通过能量分解,可以看出短肽FDGDF与SOD结合的主要贡献能为极性溶剂化能,其次是范德华能,再就是非极性溶剂化自由能。表7中,ΔE_VDW为范德华能量;ΔE_elec为静电能;ΔG_GB为对溶剂化的静电贡献;ΔG_SA为对溶剂化的非极性贡献;ΔG_bind为束缚自由能。
表7 结合自由能和能量分量由MM/GBSA预测 单位:kcal/mol Table 7 Binding free energies and energy components predicted by MM/GBSA
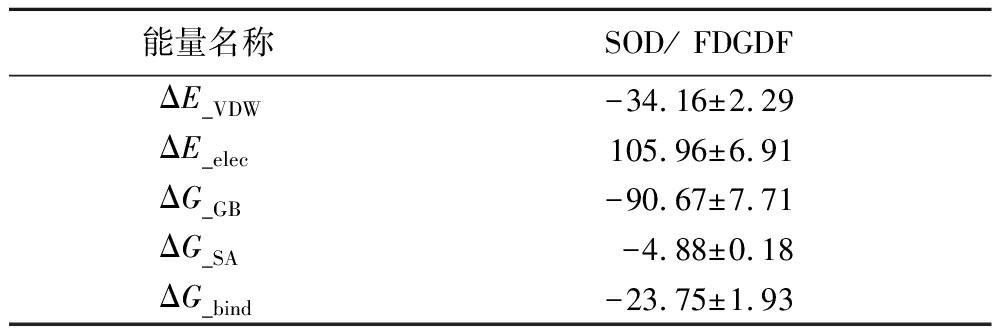
能量名称SOD/ FDGDFΔE_VDW-34.16±2.29ΔE_elec105.96±6.91ΔG_GB-90.67±7.71ΔG_SA-4.88±0.18ΔG_bind-23.75±1.93
3 结论
膜分离技术因其易操作和低成本等优势而备受青睐。相对于其他分离方法,该技术所需设备较少,操作简便,成本亦相对较低。在本研究中,发现膜分离技术是一种有效提取牛肉多肽的方法。然而,由于不同多肽在分子质量和亲疏水性质等方面存在差异,因此需要采用不同材料和孔径的膜进行分离。
本实验选择了盐酸提取法来提取牛肉多肽,并确定了初步去除杂质的步骤。本研究测定了不同浓度的牛肉多肽抗氧化能力,结果显示随着多肽浓度的增加,抗氧化能力也增强。进一步,在对分离后的多肽进行抗氧化测试时,发现经CN-CA膜分离的多肽表现出抗氧化能力的显著提升。为了进一步提高抗氧化能力并优化分离效果,对CN-CA膜进行了改性。通过在特定条件(15 g/L,7.5 min,150 ℃,1.25 MPa)下制备的BTESE/CN-CA,取得了较好的分离效果。通过多肽Score评分和半衰期等指标,发现分离得到的FDGDF具有最强的活性,其Score评分达到0.948 8,表明其具有良好的生物活性。此外,通过量子化学模拟,揭示了FDGDF通过结合SOD的Val113、Arg108、Ser111、Arg108、Arg108,并通过产生氢键来增强其活性的机制。综合而言,本实验通过膜分离技术对牛肉多肽进行了有效的分离纯化,为进一步提升其抗氧化能力提供了理论基础。
[1] MIKO AJCZAK B, FORNAL E, MONTOWSKA M.LC-Q-TOF-MS/MS identification of specific non-meat proteins and peptides in beef burgers[J].Molecules, 2018, 24(1):18.
AJCZAK B, FORNAL E, MONTOWSKA M.LC-Q-TOF-MS/MS identification of specific non-meat proteins and peptides in beef burgers[J].Molecules, 2018, 24(1):18.
[2] WANG W Q, LIU Z C, LIU Y J, et al.Plant polypeptides:A review on extraction, isolation, bioactivities and prospects[J].International Journal of Biological Macromolecules, 2022, 207:169-178.
[3] DORIA S, YOST J, GAGNON Z.Free-flow biomolecular concentration and separation of proteins and nucleic acids using teíchophoresis[J].Talanta, 2023, 255:124198.
[4] ZAMBROWICZ A, ZAB OCKA A, BOBAK
OCKA A, BOBAK  , et al.A simple and rapid method of isolation of active polypeptide complex, yolkin, from chicken egg yolk[J].Food Chemistry, 2017, 230:705-711.
, et al.A simple and rapid method of isolation of active polypeptide complex, yolkin, from chicken egg yolk[J].Food Chemistry, 2017, 230:705-711.
[5] TIAN S Q, YU B X, DU K, et al.Purification of wheat germ albumin hydrolysates by membrane separation and gel chromatography and evaluating their antioxidant activities[J].LWT, 2022, 161:113365.
[6] DE ROSA A, MCGAUGHEY S, MAGRATH I, et al.Molecular membrane separation:Plants inspire new technologies[J].New Phytologist, 2023, 238(1):33-54.
[7] AMINZADEH S, LAUBERTS M, DOBELE G, et al.Membrane filtration of kraft lignin:Structural charactristics and antioxidant activity of the low-molecular-weight fraction[J].Industrial Crops and Products, 2018, 112:200-209.
[8] TAHERI A, SABEENA FARVIN K H, JACOBSEN C, et al.Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J].Food Chemistry, 2014, 142:318-326.
[9] MORIYAMA N, NAGASAWA H, KANEZASHI M, et al.Bis (triethoxysilyl) ethane (BTESE)-derived silica membranes:Pore formation mechanism and gas permeation properties[J].Journal of Sol-Gel Science and Technology, 2018, 86(1):63-72.[10] LI C L, MORA L, TOLDR F.Characterization of antioxidant efficacy of peptide extracts as affected by peptide interactions during the ripening of Spanish dry-cured ham[J].Food Research International, 2021, 147:110525.
F.Characterization of antioxidant efficacy of peptide extracts as affected by peptide interactions during the ripening of Spanish dry-cured ham[J].Food Research International, 2021, 147:110525.
[11] LANGYAN S, BHARDWAJ R, RADHAMANI J, et al.A quick analysis method for protein quantification in oilseed crops:A comparison with standard protocol[J].Frontiers in Nutrition, 2022, 9:892695.
[12] XIA Z, MIAO J Y, CHEN B B, et al.Purification, identification, and antioxidative mechanism of three novel selenium-enriched oyster antioxidant peptides[J].Food Research International, 2022, 157:111359.
[13] XIAO L F, LIANG Y J, LIU G, et al.Identification of antioxidant peptides after digestion and absorption of isinglass by serum peptidomics and cellular antioxidant activity analysis[J].Food &Function, 2023, 14(4):2249-2259.
[14] ZHANG Z W, JIANG S Q, ZENG Y, et al.Antioxidant peptides from Mytilus coruscus on H2O2-induced human umbilical vein endothelial cell stress[J].Food Bioscience, 2020, 38:100762.
[15] HAMID TABARI S, HETTIGE J, MORADI M.All-atom molecular dynamics simulation of stealth liposomes[J].Biophysical Journal, 2017, 112(3):75a.
[16] FERNANDES P A R, COIMBRA M A.The antioxidant activity of polysaccharides:A structure-function relationship overview[J].Carbohydrate Polymers, 2023, 314:120965.
[17] WANG Y, LIU X J, CHEN J B, et al.Citrus flavonoids and their antioxidant evaluation[J].Critical Reviews in Food Science and Nutrition, 2022, 62(14):3833-3854.
[18] ELMAGHRABY N A, OMER A M, KENAWY E-R, et al.Fabrication of cellulose acetate/cellulose nitrate/carbon black nanofiber composite for oil spill treatment[J].Biomass Conversion and Biorefinery, 2022:1-19.
[19] NASROLLAHI N, ABER S, VATANPOUR V, et al.Development of hydrophilic microporous PES ultrafiltration membrane containing CuO nanoparticles with improved antifouling and separation performance[J].Materials Chemistry and Physics, 2019, 222:338-350.
[20] SOZARUKOVA M M, SHESTAKOVA M A, TEPLONOGOVA M A, et al.Quantification of free radical scavenging properties and SOD-like activity of cerium dioxide nanoparticles in biochemical models[J].Russian Journal of Inorganic Chemistry, 2020, 65(4):597-605.
[21] SHIMIZU A, ISHIZAKI Y, HORIUCHI S, et al.HOMO-LUMO energy-gap tuning of π-conjugated zwitterions composed of electron-donating anion and electron-accepting cation[J].Journal of Organic Chemistry, 2021, 86(1):770-781.
[22] ZHOU P, LI X Z, ZHOU J, et al.Insights of the adsorption mechanism of methylene blue on biochar from phytoextraction residues of Citrus aurantium L.:Adsorption model and DFT calculations[J].Journal of Environmental Chemical Engineering, 2023, 11(5):110496.
[23] JOSEPH N N, ROY R N, STEITZ T A.Molecular dynamics analysis of Mg2+ -dependent cleavage of a pistol ribozyme reveals a fail-safe secondary ion for catalysis[J].Journal of Computational Chemistry, 2020, 41(14):1345-1352.
[24] SHARMA M K, BLOMEYER S, NEUMANN B, et al.Crystalline divinyldiarsene radical cations and dications[J].Angewandte Chemie (International Edition), 2019, 58(49):17599-17603.
[25] DIXIT S B, PONOMAREV S Y, BEVERIDGE D L.Root mean square deviation probability analysis of molecular dynamics trajectories on DNA[J].Journal of Chemical Information and Modeling, 2006, 46(3):1084-1093.