荸荠(Eleocharis dulcis(Burm.f.)Trin.ex.Hersch)是一种在淡水湿地、池塘和湖泊中广泛分布的可食用水生被子植物[1]。荸荠块茎中淀粉含量较高,其直链淀粉含量可达22%~27%[2],能作为淀粉提取的潜在来源。荸荠淀粉的凝胶性能和冻融稳定性强,常作为填充剂和增稠剂应用于马蹄糕和其他含荸荠成分的食品中[3]。因天然淀粉热稳定性和抗机械力较差,在冷水中不溶等缺陷,不利于其在食品行业的应用,常通过物理、化学和酶法对其进行改性,以扩大淀粉的实际应用范围。化学改性涉及化学助剂,会对环境和人体健康不利;酶法改性因酶热稳定性、催化效率和生产效益不高等受限;而物理改性则因其能够无化学残留、安全、高效地改性淀粉突显其优势。物理改性中热处理会对食品质地、风味等产生不良影响,现多采用非热处理改性淀粉并保持其原有色泽、气味和其他营养组分等[4]。
超高压(high hydrostatic pressure,HHP)技术作为非热物理改性淀粉的关键技术之一,通常以水进行压力传导,在室温和100~1 000 MPa压力条件下破坏淀粉分子中的非共价键(如氢键和范德华力),使淀粉的内部结构由有序变为无序状态,结晶度降低[5],从而导致淀粉的回生率、黏度和起始糊化温度变化。HHP处理效果与淀粉类型、压力水平、溶剂类型和处理时间有关[6],经HHP改性后的淀粉可以更好地应用到油炸淀粉食品、可食用和可降解的淀粉薄膜食品加工中[7],扩大其应用范围。目前有大量HHP改性谷类、豆类、薯类等常见淀粉的研究,但针对非常规来源淀粉的改性研究尚不多见。当前对荸荠淀粉的改性研究主要集中在化学改性、热处理和添加外源物后淀粉的理化和功能特性变化上,如乙酰化、琥珀酰化、干热处理和添加亲水胶体等[8-10],但针对HHP改性荸荠淀粉的研究有限。本研究将荸荠淀粉于不同压力水平处理后进行相关理化、结构和消化特性测定,探究HHP处理对荸荠淀粉性能的影响,以期为荸荠淀粉的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
荸荠淀粉,鹤山市宅梧选田农副产品加工厂;无水葡萄糖,成都市科隆化学品有限公司;α-淀粉酶(猪胰来源,≥5 U/mg)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂,上海源叶生物科技有限公司;淀粉葡萄糖苷酶(黑曲霉来源,100 000 U/mL),上海易恩化学技术有限公司。
1.2 仪器与设备
SHPP-2L超高压设备,山西力德福科技有限公司;SCIENTZ-10 ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;FA1004A电子分析天平,上海精天电子仪器有限公司;HH-4数显恒温水浴锅,上海力辰邦西仪器科技有限公司;Mastersizer 3000激光粒度仪,英国Malvern公司;RVA-TecMaster快速黏度分析仪,澳大利亚Perten公司;HR-1流变仪,美国TA instrument公司;TA.XT Plus质构仪,英国Stable Micro System公司;Phenom Pro扫描电镜,荷兰Phenom公司;通达TD3500X-射线衍射仪,丹东通达科技有限公司;Spectrum Two傅里叶变换红外光谱分析仪,美国 PE公司;SYNERGY H1酶标仪,Biotek公司。
1.3 实验方法
1.3.1 HHP处理样品
取40 g荸荠淀粉置于聚乙烯袋内,加入200 mL蒸馏水,制成200 g/L淀粉悬浮液,真空包装后在室温下平衡4 h。平衡后在0、200、300、400、500、600 MPa压力下处理20 min,以0 MPa作为对照组,处理后的样品分别命名为HHP-0、HHP-200、HHP-300、HHP-400、HHP-500、HHP-600。将HHP处理后的样品进行冷冻干燥、研磨、过100目筛后备用。
1.3.2 溶解度和膨胀力测定
参考LIU等[11]的方法并做适当的修改测定淀粉的溶解度和膨胀力。称取500 mg样品配制成20 g/L淀粉悬浮液,在90 ℃的水浴锅中振荡加热30 min,冷却至室温后,5 000 r/min离心30 min,将上清液在105 ℃烘箱中烘干至恒重并称重m1,离心管内沉淀物重量记为m2,按公式(1)和公式(2)分别计算溶解度(S)和膨胀力:
溶解度![]()
(1)
膨胀力![]()
(2)
式中:m1:上清液中溶解物的重量,g;m2,沉淀物重量,g;m,干淀粉重量,g。
1.3.3 糊化特性测定
将2.5 g淀粉分散在含25.0 g蒸馏水的快速黏度分析仪(rapid visco analyser,RVA)专用铝盒中,用桨叶充分混匀后放入快速黏度分析仪中,程序设定参照黄艺等[12]的方法。
1.3.4 差示扫描量热法
用差示扫描量热仪(differential scanning calorimeter,DSC)专用铝坩埚称量3 mg样品,加入7 μL蒸馏水后密封,于4 ℃冰箱平衡12 h。测试温度:30~100 ℃,用空坩埚作为空白,记录起始糊化温度(onset temperature,To)、峰值温度(peak temperature,Tp)、终止温度(conclusion temperature,Tc)和热焓值(gelatinization enthalpy,ΔH)。
1.3.5 流变特性测定
将1.3.3节制得的淀粉糊转移到配备40 mm平行板(间隙1 000 μm)的流变仪上,所有测试的温度为25 ℃,平衡时间为1 min,参照SHEN等[13]的方法对淀粉糊进行频率扫描和静态流动扫描。频率扫描:在线性黏弹性应变区域(0.1%应变)内,频率设置为0.1~20 Hz。记录储能模量(G′)和损耗模量(G″)随频率的变化。静态流动扫描:将样品在0.1~100 s-1的剪切速率下进行扫描。
1.3.6 淀粉凝胶质构特性的测定
将样品配成100 g/L的淀粉乳,沸水浴加热20 min后倒入模具(21 mm×21 mm×15 mm)冷至室温,置于4 ℃冰箱12 h,测试前取出室温平衡1 h。测试条件:选用探头P/0.5,测试前速度2 mm/s,测试中和测试后速度1 mm/s,触发力5 g,形变50%,停留时间3 s。
1.3.7 粒径测定
参照ZHANG等[14]的方法进行粒径的测定。取一定量的淀粉样品,将其配成10 g/L的悬浮液,充分摇晃均匀。设置颗粒折射率为1.53,遮光度达到12%~15%时开始测量,所有样品1式3份进行测定。
1.3.8 扫描电镜
将干燥后的淀粉样品均匀涂抹于扫描电子显微镜(scanning electron microscopy,SEM)载样器的导电胶上,氮吹除去多余粉末,在真空度10-2~10-3 Pa下进行喷金30 s,于10 kV加速电压条件下观察3 000×和6 000×样品形貌并拍照。
1.3.9 X-射线衍射分析
参照LIU等[11]的方法用X-射线衍射(X-ray diffraction,XRD)分析荸荠淀粉的晶形结构,扫描范围为4°~40°,步宽为0.02°,通过MDI Jade 6.0软件计算相对结晶度(relative crystallinity,RC)。
1.3.10 傅里叶变换红外光谱分析
根据黄艺等[12]的方法并做适当的修改进行傅里叶变换红外光谱分析,取0.5 g样品于红外光谱仪ATR附件晶体表面,扫描范围为:4 000~400 cm-1,分辨率为4 cm-1,扫描32次,结果用OMNIC 8.2版本进行分析。
1.3.11 体外消化特性测定
参考MILLER[15]的方法,用DNS法对HHP处理后的荸荠淀粉进行体外消化率的测定。
标准曲线的绘制:准确移取0.0、0.2、0.4、0.6、0.8、1.0 mL的1.0 mg/mL标准葡萄糖溶液,用DNS法测定还原糖含量,绘制标准曲线,得到回归方程y=0.901 3x-0.000 4,R2=0.999 1。
淀粉的体外消化率测定参考HU等[16]的方法并略作修改。称量100 mg淀粉样品于离心管中,加入pH 5.2的醋酸钠缓冲液10 mL,90 ℃加热30 min后于37 ℃平衡温度10 min,平衡后加入 2 mL混合酶溶液(α-淀粉酶和淀粉葡萄糖苷酶浓度分别为300 U/mL和50 U/mL)在37 ℃水浴锅加热振荡。在酶解0、20、120 min时分别取出0.5 mL 酶解液,放入含4.5 mL 无水乙醇的10 mL离心管中,5 000 r/min 离心10 min。取0.6 mL上清液用标准曲线相同的方法测定葡萄糖含量,然后根据公式(3)~公式(5)计算样品快速消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)含量:
(3)
(4)
RS/%=(1-RDS-SDS)×100
(5)
式中:G0为样品酶解前的葡萄糖含量,mg;G20为样品酶解20 min产生的葡萄糖含量,mg;G120为样品酶解120 min产生的葡萄糖含量,mg;0.9为葡萄糖与淀粉换算系数;m为淀粉干基重量,mg。
1.4 数据统计与分析
所有实验均重复3次,用Excel处理数据,结果用“平均值±标准差”表示,采用SPSS 27.0对结果进行统计分析,P<0.05表示差异显著,用Origin 2021软件绘图。
2 结果与分析
2.1 HHP处理对荸荠淀粉理化特性的影响
2.1.1 HHP处理对荸荠淀粉溶解度与膨胀力的影响
不同HHP压力处理后的荸荠淀粉在90 ℃的溶解度与膨胀力如图1所示,经HHP处理后淀粉的溶解度和膨胀力整体呈先不变后下降趋势。在200和300 MPa处理后,膨胀力和溶解度无明显变化,当压力增加至400 MPa时,相较于对照组,其溶解度和膨胀力分别下降了17.69%和25.14%,这可能是该压力处理后部分颗粒被压缩,加强了淀粉分子间作用,形成直链淀粉-脂质复合物,可溶性直链淀粉分子的流动性降低,导致溶解度和膨胀力降低[17]。500和600 MPa处理后淀粉的溶解度分别显著降低了81.86%和83.73%,膨胀力分别降低了53.28%和48.32%,可能是该压力处理使淀粉颗粒完全崩解,导致直链淀粉浸出受限,从而降低淀粉的溶解度,另外HHP处理后淀粉分子的重排,也会限制淀粉的水合作用和膨胀能力[11]。
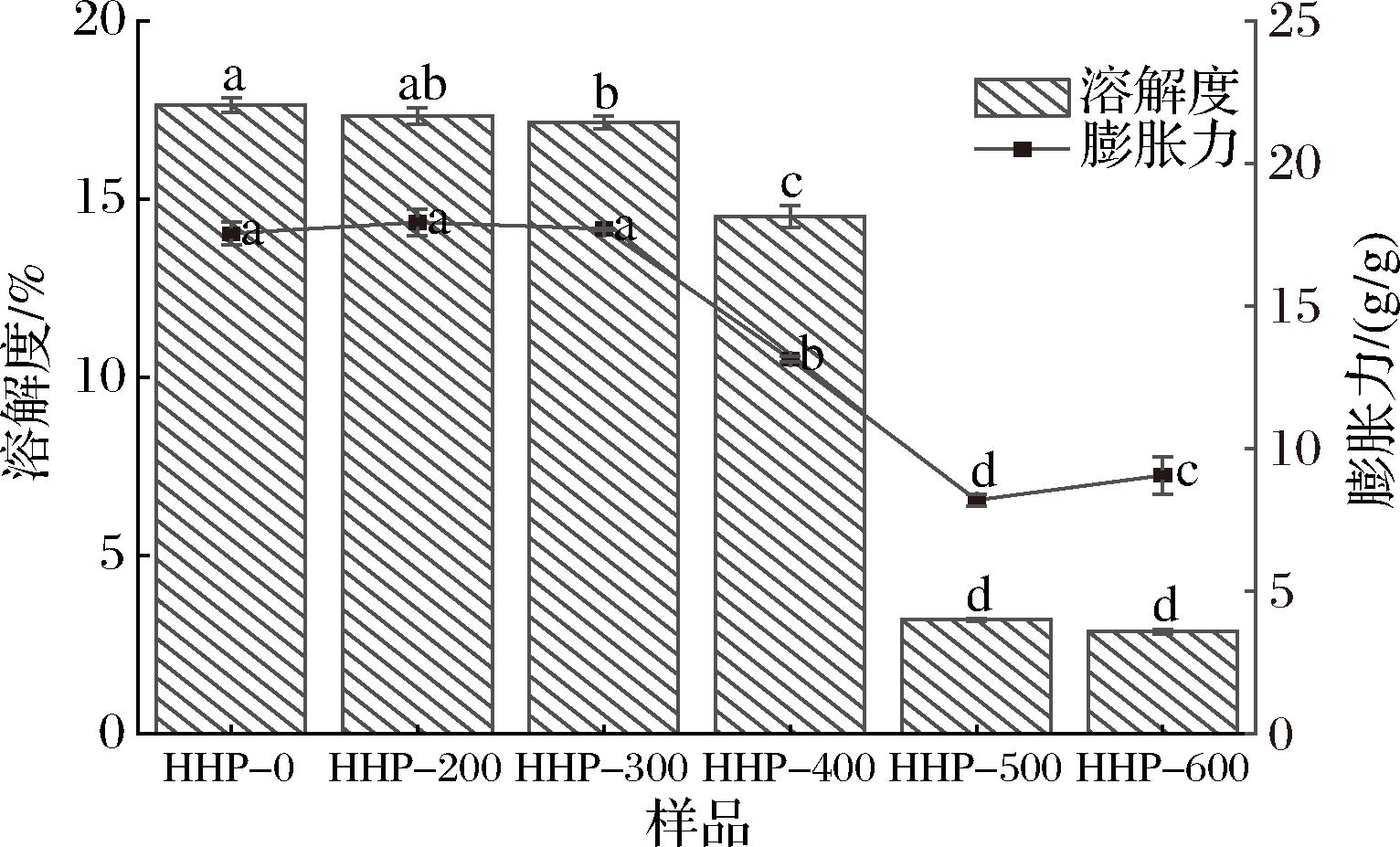
图1 HHP处理对荸荠淀粉溶解度与膨胀力的影响
Fig.1 Effect of HHP treatment on solubility and swelling degree of water chestnut starch
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 HHP处理对荸荠淀粉糊化特性的影响
经HHP处理的样品的糊化特性变化如图2和表1所示。由表1可以看出,经200~600 MPa处理后淀粉的峰值黏度、谷值黏度、崩解值、最终黏度和回生值总体先增加后减少,糊化温度和峰值时间总体呈上升趋势。与对照组相比,400 MPa时峰值黏度从3 414.67 mPa·s降至2 926.00 mPa·s,降低了14.31%。这可能是淀粉颗粒内的分子间相互作用被破坏,直链淀粉分子浸出,从而降低了淀粉颗粒的溶胀性能[18];谷值黏度和最终黏度分别增加了10.25%和23.04%,表明其淀粉糊回生性和稳定性高于对照组。在500和600 MPa处理后,峰值黏度、谷值黏度、崩解值、最终黏度和回生值均显著低于其他压力水平,崩解值降至34.00 mPa·s,未检测出糊化温度。这些变化可能与HHP处理破坏荸荠淀粉晶体结构,淀粉颗粒发生糊化有关[19]。
表1 HHP处理对荸荠淀粉糊化特性参数的影响
Table 1 Effect of HHP treatment on gelatinization characteristic parameters of water chestnut starch

样品峰值黏度/(mPa·s)谷值黏度/(mPa·s)崩解值/(mPa·s)最终黏度/(mPa·s)回生值/(mPa·s)峰值时间/min糊化温度/℃HHP-03 414.67±9.29b1 314.33±19.86b2 100.33±17.62b2 527.33±24.50c1 213.00±9.17c3.22±0.04c65.93±0.46cHHP-2003 414.33±26.50b1 316.67±9.71b2 097.67±23.86b2 507.67±8.96c1 191.00±12.17c3.31±0.03c66.73±0.55abHHP-3003 530.00±6.56a1 324.33±5.69b2 205.67±6.81a2 590.00±8.19b1 265.67±13.50b3.29±0.04c66.80±0.48abHHP-4002 926.00±32.70c1 449.00±90.54a1 477.00±60.90c3 109.67±24.00a1 660.67±66.58a3.73±0.07b67.28±0.50aHHP-500794.00±39.13d752.67±55.72c41.33±17.21d1 243.67±49.66e491.00±6.08e6.88±0.12a~HHP-600747.00±34.77d713.00±35.00c34.00±8.00d1 332.33±42.00d619.33±7.37d6.82±0.10a~
注:不同小写字母表示差异显著(P<0.05)(下同)。
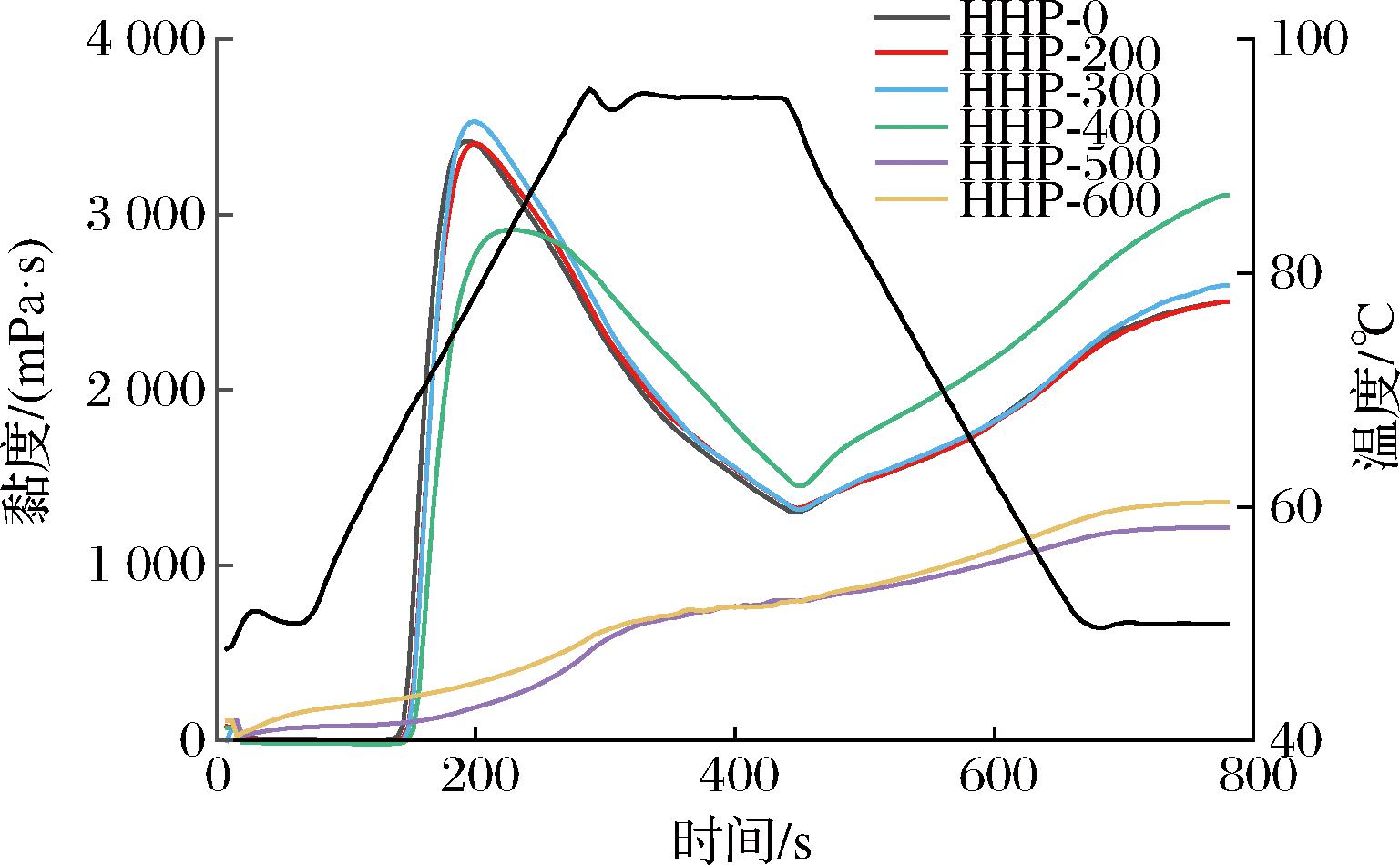
图2 HHP处理对荸荠淀粉糊化特性的影响
Fig.2 Effect of HHP treatment on gelatinization characteristics of water chestnut starch
2.1.3 HHP处理对荸荠淀粉热性能的影响
经HHP处理后的荸荠淀粉样品DSC结果如图3所示,随着压力的增加,吸热峰向低温度方向移动且峰宽变窄,当压力为500和600 MPa时,无法检测到明显的吸热熔融峰,表明该压力处理后荸荠淀粉几乎完全糊化,LI等[20]使用超高压处理藜麦淀粉后同此也未出现熔融峰。HHP处理后淀粉的To、Tp、Tc和ΔH的变化如表2所示,0~300 MPa处理后To和Tp无显著变化,温度范围缩小;400 MPa处理后,To增加了1.75 ℃,Tc和ΔH分别降低了1.35 ℃和0.70 J/g。ΔH的降低是因为随着处理压力的增加,晶体区域被破坏导致断裂键所需要的能量减少[5];To的升高可能是淀粉颗粒内部结构在加压过程中遭到破坏[21]。500和600 MPa处理后荸荠淀粉未显示热力学参数,与其完全糊化有关。
表2 HHP处理对荸荠淀粉R1 047/1 022和热力学参数的影响
Table 2 Effect of HHP treatment on water chestnut starch R1 047/1 022 and thermodynamic parameters
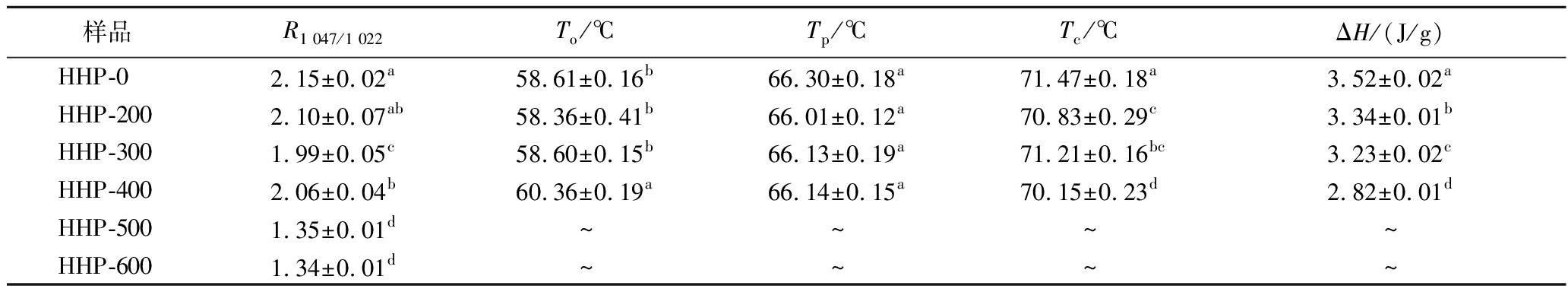
样品R1 047/1 022To/℃Tp/℃Tc/℃ΔH/(J/g)HHP-02.15±0.02a58.61±0.16b66.30±0.18a71.47±0.18a3.52±0.02aHHP-2002.10±0.07ab58.36±0.41b66.01±0.12a70.83±0.29c3.34±0.01bHHP-3001.99±0.05c58.60±0.15b66.13±0.19a71.21±0.16bc3.23±0.02cHHP-4002.06±0.04b60.36±0.19a66.14±0.15a70.15±0.23d2.82±0.01dHHP-5001.35±0.01d~~~~HHP-6001.34±0.01d~~~~
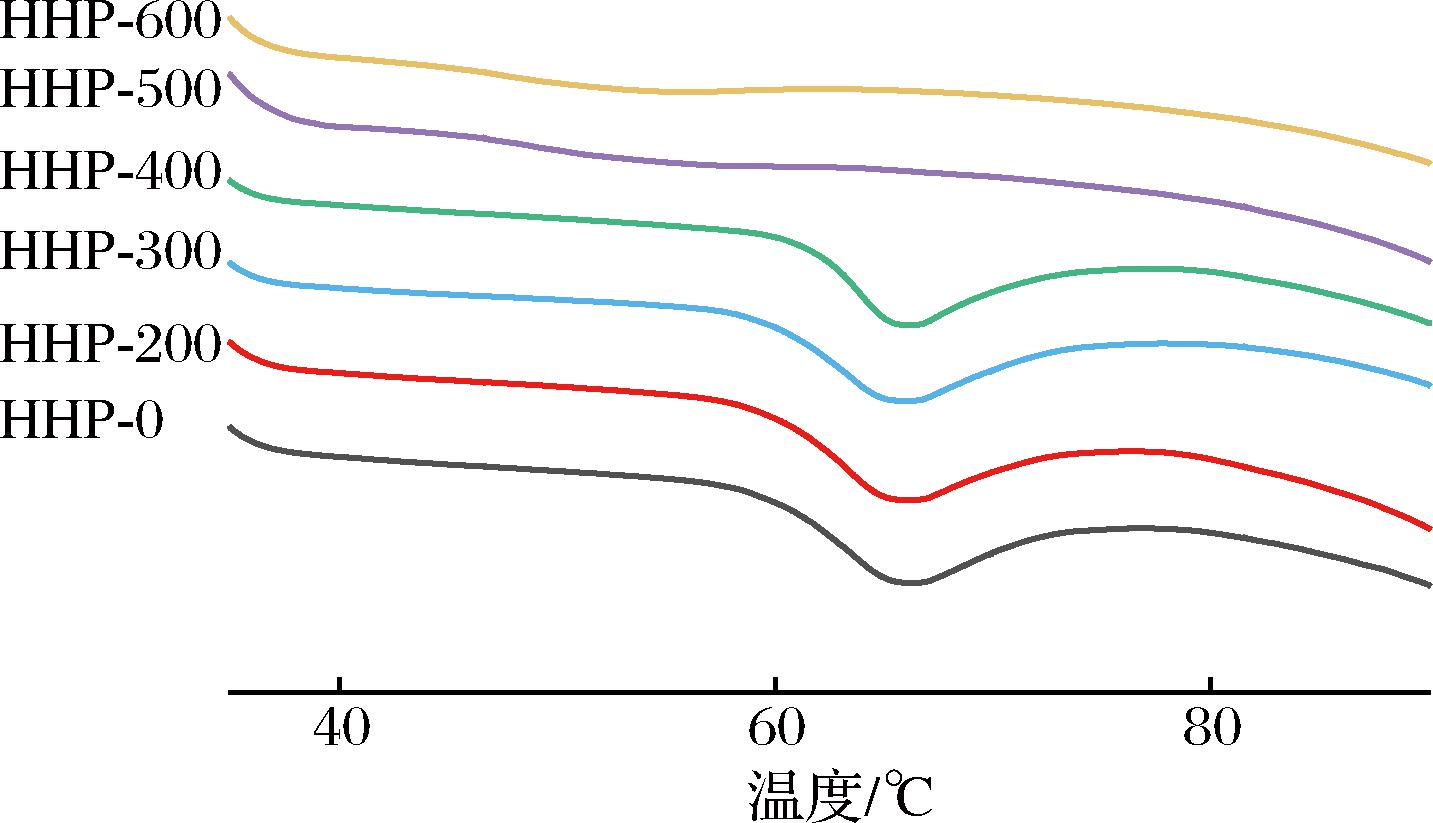
图3 HHP处理对荸荠淀粉热性能的影响
Fig.3 Effect of HHP treatment on thermal properties of water chestnut starch
2.1.4 HHP处理对荸荠淀粉凝胶流变特性的影响
淀粉的流变特性决定了其作为增稠剂或胶凝剂的潜在应用。经不同压力处理后的荸荠淀粉糊在25 ℃时表观黏度随剪切速率的变化如图4所示,处理组的表观黏度随着剪切速率的增大而减小并趋于稳定,呈剪切稀化现象,属于假塑性流体[22]。这是由于淀粉糊通常由凝胶化的膨胀颗粒或溶出直链淀粉分子组成,在剪切应力作用下,淀粉凝胶中的摩擦力减小,链内和链间的氢键因分子沿流体方向流动而断裂,凝胶体系被破坏导致表观黏度降低,当剪切速率增加到一定值时,淀粉分子重新定向至剪切方向,表观黏度保持恒定[14]。当剪切速率小于1 s-1时,0~300 MPa处理后的淀粉糊的表观黏度随着压力增加而增大,表明适当高压处理增强了淀粉凝胶的抗剪切性,与GUO等[23]研究现象一致。当压力大于300 MPa时,表观黏度随着压力增加而降低,在500和600 MPa时更显著降低(P<0.05);这可能是淀粉颗粒被高压力严重损坏,淀粉分子降解且直链淀粉溶解增加,最终导致淀粉凝胶流动过程中黏度显著降低[24]。
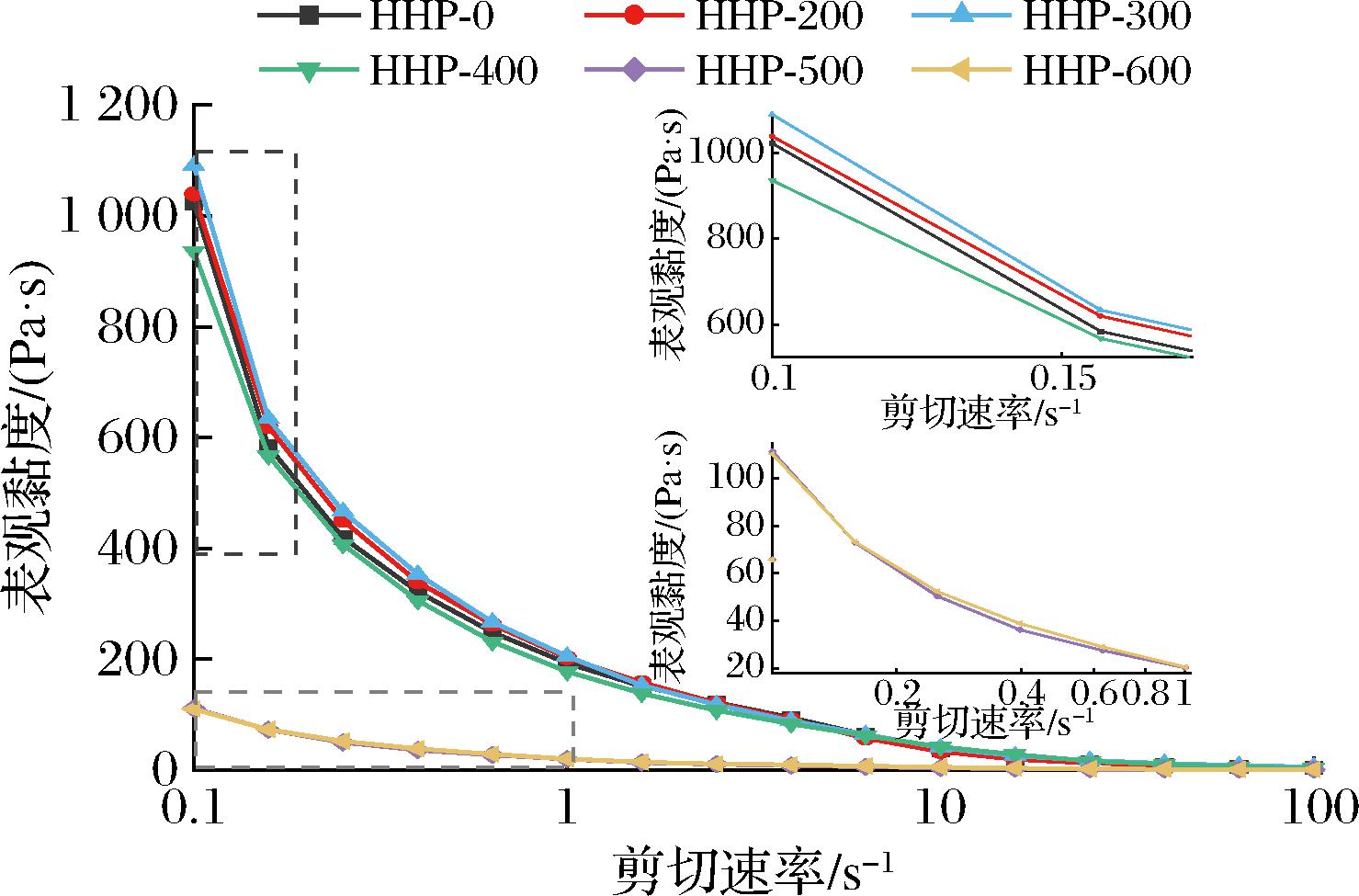
图4 HHP处理后荸荠淀粉凝胶黏度随剪切速率的变化
Fig.4 Changes of viscosity of water chestnut starch gels with shear rate after HHP treatment
经HHP处理的荸荠淀粉样品在加热后的储能模量(G′)和损耗模量(G″)随频率变化如图5-a和图5-b所示,所有样品在0~20 Hz频率范围内,G′明显大于G″且无交叉,表现出典型的弱凝胶结构。G′和G″均随频率增大而增大,且在低频时增加速率较快,高频时增加缓慢。如图5-a和图5-b所示,G'和G"随着压力的增加呈上升趋势,特别是压力大于300 MPa时显著增加(P<0.05)。流体性特征的增强可能是随着压力的增大,淀粉颗粒逐渐膨胀最终崩解,结晶区域被破坏,淀粉发生不同程度的糊化,从而导致G′和G″升高[25]。
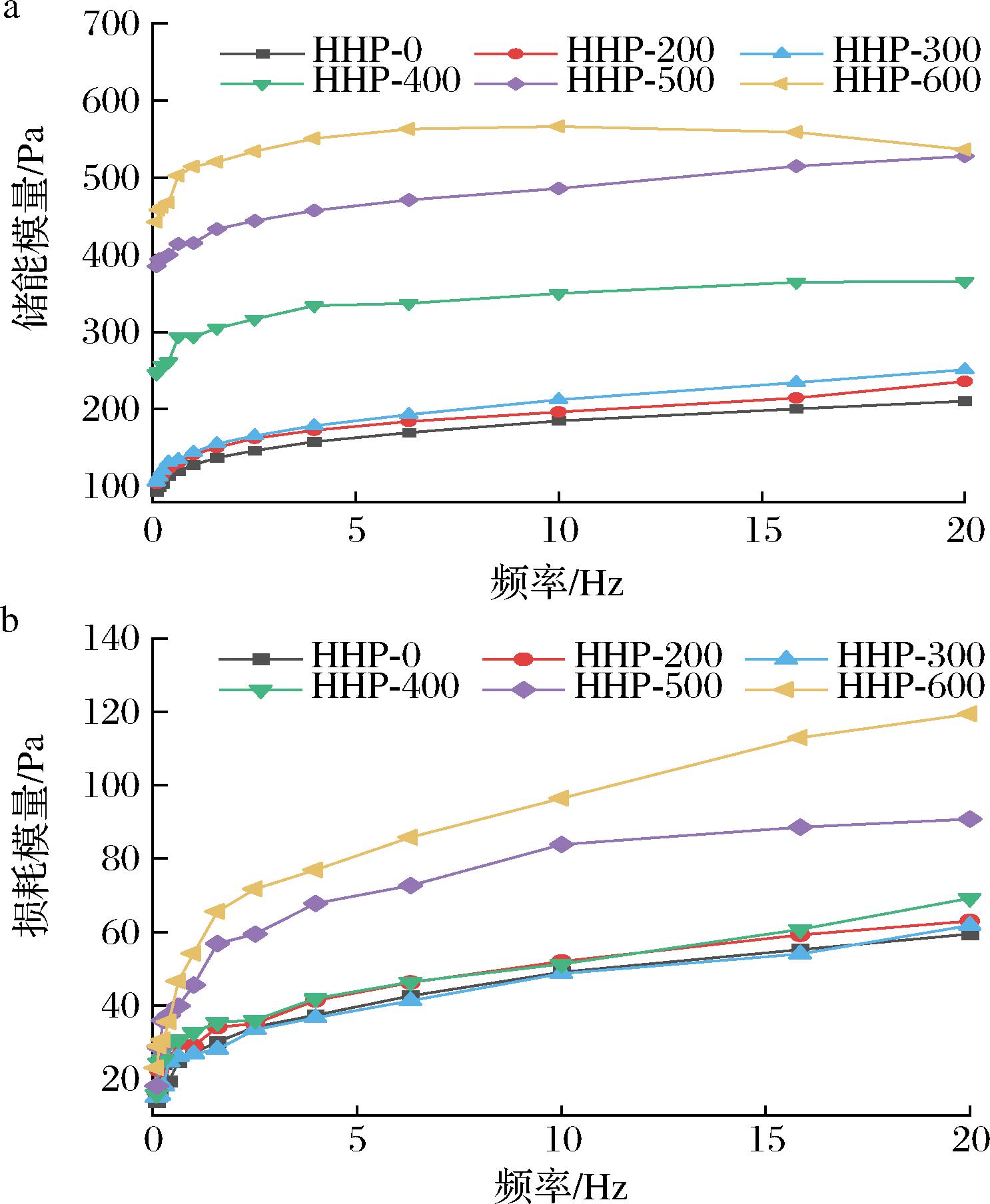
a-储能模量;b-损耗模量
图5 HHP处理后荸荠淀粉凝胶储能模量及损耗模量随频率的变化
Fig.5 Changes of storage modulus and loss modulus of water chestnut starch gels with frequency after HHP treatment
2.1.5 HHP处理对荸荠淀粉凝胶质构特性的影响
经HHP处理的荸荠淀粉凝胶的质构特性如表3所示。随着压力的增加,淀粉凝胶的凝胶强度、硬度、胶着性和咀嚼性总体呈先增加后减少的趋势,弹性、黏聚性、恢复性呈下降趋势。与对照组相比,300 MPa时的咀嚼性提高了55.98%,在400 MPa时硬度、凝胶强度和胶着性分别提高了47.07%、45.45%和25.34%;这可能是该压力处理后直链淀粉更易溶出,低温短期储存过程中连续相中膨胀的直链淀粉分子的再结合导致凝胶硬度的增强[18]。在500和600 MPa时,所有质构参数均显著降低(P<0.05);这可能与高压对淀粉颗粒的破坏有关,高压力下,淀粉颗粒已经溶胀破裂发生糊化,直链淀粉大量溶出,在加热贮藏时直链淀粉难以形成网络结构,淀粉凝胶中的游离水量增加,从而导致其凝胶强度、硬度等质构特性降低[26]。
表3 HHP处理对荸荠淀粉凝胶质构性能的影响
Table 3 Effect of HHP treatment on texture and properties of water chestnut starch gels

样品凝胶强度/g硬度/g弹性黏聚性胶着性/g咀嚼性/g恢复性HHP-074.32±0.37d229.13±2.62c1.45±0.05b0.80±0.01a186.85±2.29c187.29±6.20d0.62±0.00aHHP-20081.62±1.41b262.62±7.73b1.24±0.01c0.79±0.00a209.78±2.61b211.22±4.51c0.58±0.00bHHP-30076.31±0.14c254.55±7.02b1.29±0.01a0.80±0.00a209.05±4.62b292.13±6.86a0.63±0.01aHHP-400108.10±1.05a336.98±4.82a0.99±0.00c0.68±0.02b234.20±3.08a232.67±5.48b0.50±0.01cHHP-50013.46±0.98f16.46±0.83d0.91±0.00d0.55±0.02c5.25±0.18d4.75±0.18e0.03±0.00dHHP-60018.00±0.74e22.83±0.56d0.92±0.01d0.56±0.00c4.48±0.18d4.12±0.09e0.03±0.00d
2.2 HHP处理对荸荠淀粉结构特性的影响
2.2.1 HHP处理对荸荠淀粉粒径的影响
经HHP处理后的改性淀粉粒径分布结果如图6所示,0~400 MPa处理的淀粉呈单峰分布,压力低于300 MPa时最大分布峰约为15.41 μm,压力达到400 MPa 时,粒径分布右移,最大分布峰增至19.89 μm,大于400 MPa时呈双峰分布。由表4可以看出,压力小于300 MPa时各参数无明显变化,200 MPa时D10略微减小,从扫描电镜结果看,可能与压力处理时小颗粒的皱缩有关。400 MPa时D90明显增加,这与淀粉吸水膨胀导致淀粉颗粒黏附或聚集有关[27]。当压力达到500和600 MPa时,产生更宽的分布曲线和更大的颗粒,相比于对照组,600 MPa的D10、D50、D90、D[3,2]、D[4,3]分别增加了1.11、5.35、10.49、2.20和6.72倍,均显著大于其他压力水平(P<0.05);HHP处理使荸荠天然淀粉颗粒结构向凝胶化转变,从而导致淀粉粒径的显著增加。
表4 HHP处理对荸荠淀粉粒径参数的影响
Table 4 Effect of HHP treatment on particle size parameters of water chestnut starch
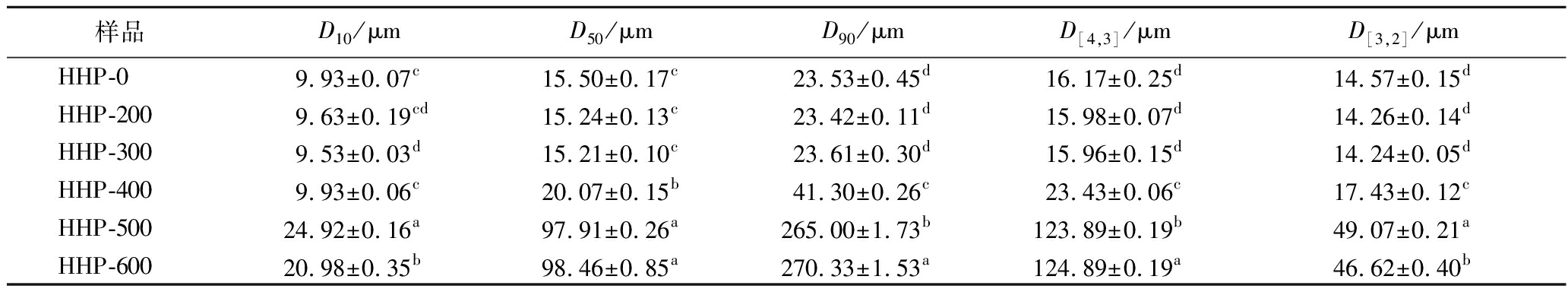
样品D10/μmD50/μmD90/μmD[4,3]/μmD[3,2]/μmHHP-09.93±0.07c15.50±0.17c23.53±0.45d16.17±0.25d14.57±0.15dHHP-2009.63±0.19cd15.24±0.13c23.42±0.11d15.98±0.07d14.26±0.14dHHP-3009.53±0.03d15.21±0.10c23.61±0.30d15.96±0.15d14.24±0.05dHHP-4009.93±0.06c20.07±0.15b41.30±0.26c23.43±0.06c17.43±0.12cHHP-50024.92±0.16a97.91±0.26a265.00±1.73b123.89±0.19b49.07±0.21aHHP-60020.98±0.35b98.46±0.85a270.33±1.53a124.89±0.19a46.62±0.40b
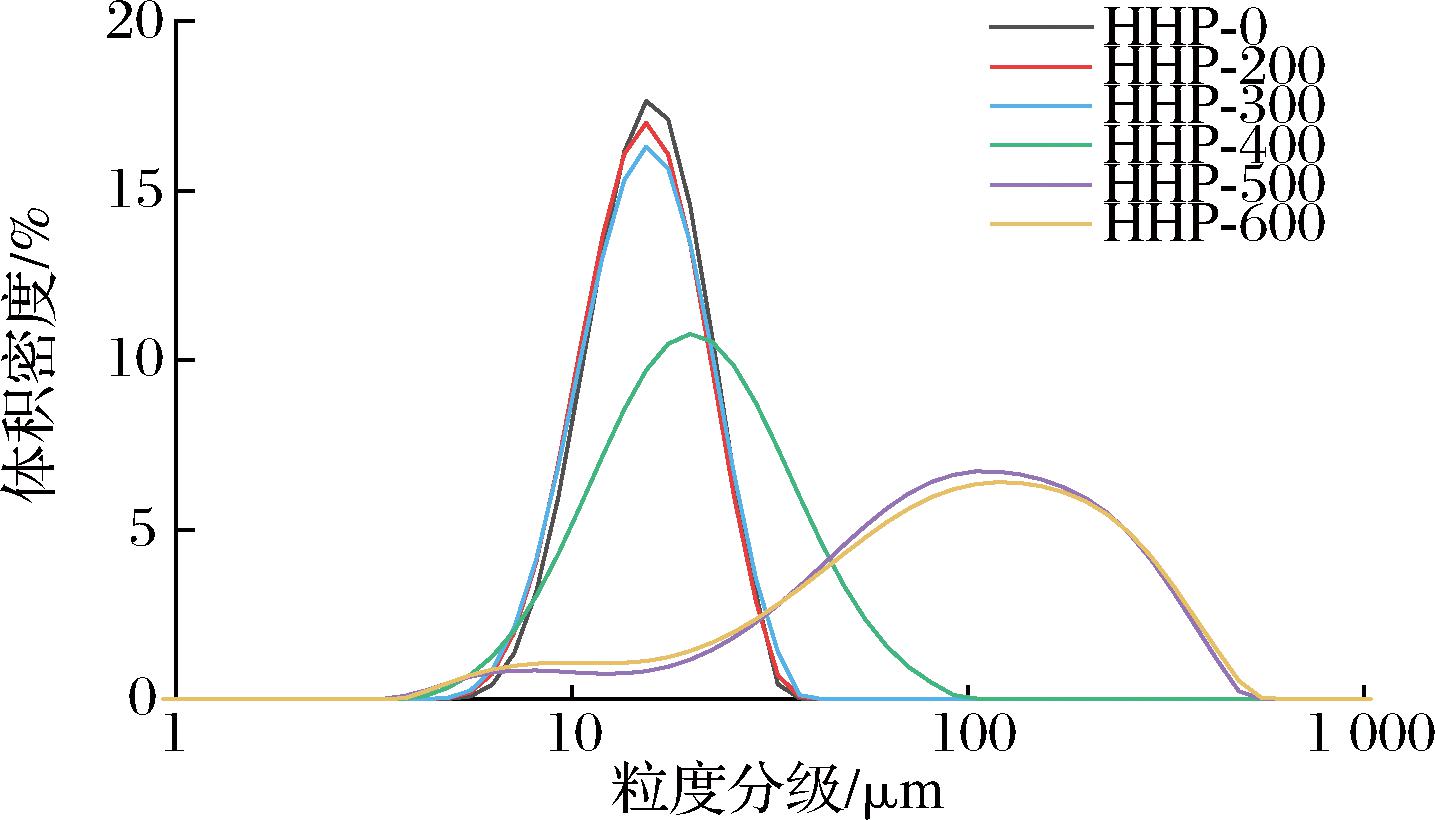
图6 HHP处理对荸荠淀粉粒径的影响
Fig.6 Effect of HHP treatment on particle size of water chestnut starch
2.2.2 HHP处理对荸荠淀粉颗粒形貌的影响
经HHP处理的荸荠淀粉扫描电镜结果如图7所示,0 MPa处理后的荸荠淀粉颗粒呈圆形、椭圆形和多边形,表面光滑,边缘清晰,粒径范围在4.30~37.66 μm。200和300 MPa处理后淀粉仍然有完整颗粒形貌,但有部分颗粒皱缩,这可能是由高压处理过程中水分阻塞通道而产生的压力差造成[28]。400 MPa处理后淀粉颗粒开始变形、断裂、黏附,出现聚集现象。淀粉在500 MPa处理后水合作用增强,淀粉颗粒的原始形状几乎被破坏,形成连续的团聚网络,网络结构具有形状不规则的大空腔以及粗糙的表面。当压力增加至600 MPa时,凝胶网络结构的大空腔被破坏,壁表面变得粗糙且不规则,出现较多碎片,ZHANG等[14]使用HHP处理百合淀粉后观察到类似凝胶网络结构。

A-HHP-0;B-HHP-200;C-HHP-300;D-HHP-400;E-HHP-500;F-HHP-600
图7 HHP处理后的荸荠淀粉SEM图
Fig.7 SEM image of water chestnut starch after HHP treatment
注:1-3 000×;2-6 000×。
2.2.3 HHP处理对荸荠淀粉长程有序结构的影响
经过不同压力处理后荸荠淀粉的XRD图谱如图8所示,未经压力处理的荸荠淀粉在15.24°、23.16°处有强衍射峰,在约17.04°和17.96°衍射角处具有未分辨的双峰,这表明荸荠淀粉是典型的A型结晶。0~400 MPa处理后,各特征峰的峰强逐渐减弱,23.16°处的特征峰峰宽变窄且峰高降低,结晶度从20.47%降至14.60%。当压力升至500和600 MPa时,15 °和23 °附近的峰消失,仅在17 °附近有微弱衍射峰,500 MPa时,已破坏了淀粉内部的结晶结构,晶体峰型从A型变为B型,600 MPa时结晶度降至2.21%,表明HHP处理后的荸荠淀粉结晶区域受到不同程度破坏,这与RAHMAN等[29]研究的玉米淀粉结果一致。HHP处理过程中,水分子会进入淀粉颗粒,使淀粉结晶区域中的双螺旋氢键被破坏,改变了晶胞,从而影响了晶体结构的排列和周期性,降低淀粉颗粒的结晶度[30]。
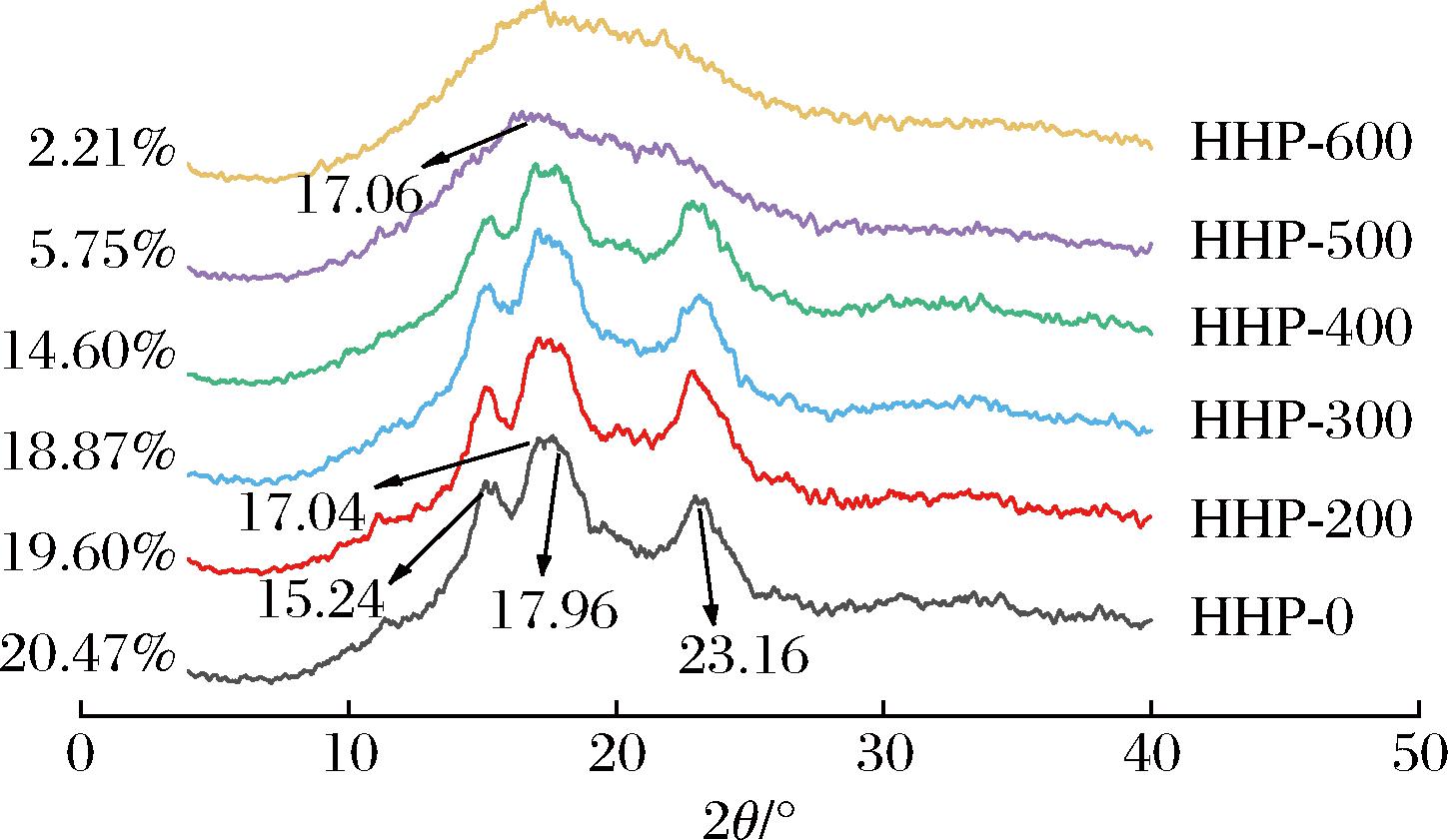
图8 HHP处理对荸荠淀粉XRD图谱的影响
Fig.8 Effect of HHP treatment on XRD pattern of water chestnut starch
2.2.4 HHP处理对荸荠淀粉短程有序结构的影响
经HHP处理的淀粉的傅里叶变换红外光谱图如图9所示,图中未有新峰的产生和旧峰的消失,表明经HHP处理后没有改变荸荠淀粉的化学结构;但是1 000 cm-1左右的峰强度发生改变,说明荸荠淀粉短程有序结构改变。3 200~3 700 cm-1处的峰与淀粉分子羟基的拉伸振动有关,随着处理压力的增加,该处的峰强逐渐减弱,500和600 MPa处理后更为明显,这可能是压力的增加使淀粉主链中分子间和分子内氢键断裂,从而导致由氢键结合的双螺旋结构被破坏[31]。1 022和1 047 cm-1处的峰强度与淀粉颗粒的无定形区和结晶区有关,1 047和1 022 cm-1处吸光度的比值可用来表示淀粉分子在短程范围的有序度[32]。从表2可以看出随着压力的增加,R1 047/1 022值逐渐减小,在500和600 MPa时变化显著(P<0.05),从2.15降低至1.34,短程有序度下降,这可能是过高压力会破坏淀粉分子内与分子间的相互作用[31]。
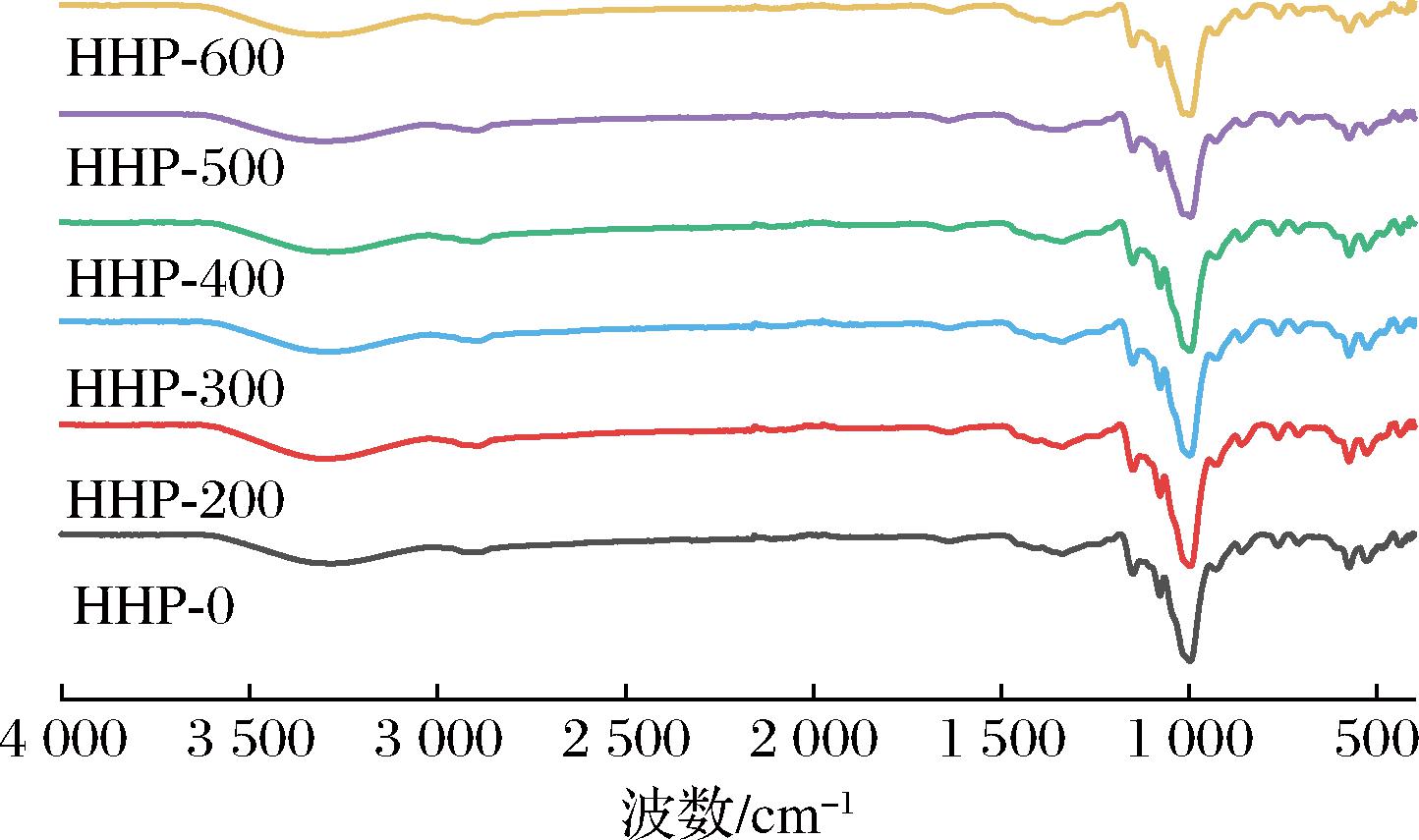
图9 HHP处理对荸荠淀粉短程有序结构的影响
Fig.9 Effect of HHP treatment on the short-range ordered structure of water chestnut starch
2.3 HHP处理对荸荠淀粉消化特性的影响
淀粉的消化效率取决于多种因素,如颗粒的大小和损伤程度、淀粉结晶度、直链淀粉和支链淀粉比例等[33]。经HHP处理后的荸荠淀粉的体外消化结果如表5所示,HHP处理能对荸荠淀粉的消化特性产生显著影响(P<0.05),随着处理压力的增大,RDS相对含量逐渐降低、SDS相对含量增大、RS相对含量先降低后增加。200~400 MPa处理后,荸荠淀粉的SDS相对含量为27.36%~29.27%,RS相对含量为17.59%~19.87%,400 MPa时SDS相对含量增加到29.27%,这可能是HHP处理降低了淀粉分子的回旋半径,使结构更加紧凑,酶不易进入淀粉内部结构与相关位点结合[34]。当压力为500 MPa和600 MPa时,RDS相对含量分别降至45.10%和43.83%,RS相对含量分别增加到27.46%和28.04%,这可能与HHP处理导致双螺旋中线性链的去支化后又重新聚集、排列产生新的晶体结构有关,新的晶体结构的抗酶解性增强从而导致RS相对含量增加[35],BAJAJ等[18]在研究HHP处理对块茎淀粉消化特性时也出现RS相对含量增加的现象。
表5 HHP处理对荸荠淀粉消化性的影响
Table 5 Effect of HHP treatment on digestibility of water chestnut starch
样品RDS/%SDS/%RS/%HHP-058.79±1.00a18.14±0.71b23.07±1.34bHHP-20055.04±0.66b27.36±1.07a17.59±1.69dHHP-30052.17±0.74c27.96±1.30a19.87±0.75cHHP-40050.92±0.07d29.27±1.14a19.81±1.20cHHP-50045.10±0.80e27.44±1.13a27.46±0.38aHHP-60043.83±0.48f28.13±0.41a28.04±0.35a
3 结论
超高压处理后荸荠淀粉发生非热糊化,理化特性改变。适当的压力处理后淀粉凝胶的硬度、凝胶强度和抗剪切性均显著提高,可以将改性后的淀粉作为食品胶凝剂应用于鱼糜制品、火腿肠和腊肠等产品中。500~600 MPa处理后荸荠淀粉的溶解度、膨胀力和糊化特性参数均显著降低,淀粉晶型由A型转为B型,颗粒形貌消失并形成凝胶网络结构。体外消化结果表明,经HHP处理后的荸荠淀粉快消化淀粉相对含量减少,慢消化淀粉相对含量增加,可降低血糖生成速率,用于开发适合糖尿病患者的功能产品。后续还可以协同其他非热物理改性技术,如超声、臭氧、冷离子体处理等方法对荸荠淀粉进行双重或多重改性,以期获得更多不同性质的改性淀粉,扩大荸荠淀粉在食品领域中应用。
[1] GAO M P, JIANG W, WEI S L, et al. High-efficiency propagation of Chinese water chestnut[Eleocharis dulcis (Burm.f.) Trin. ex Hensch] using a temporary immersion bioreactor system[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2015, 121(3):761-772.
[2] GUL K, RIAR C S, BALA A, et al. Effect of ionic gums and dry heating on physicochemical, morphological, thermal and pasting properties of water chestnut starch[J]. LWT-Food Science and Technology, 2014, 59(1):348-355.
[3] 刘小林, 孟祥志. 荸荠的资源开发利用研究进展[J]. 食品研究与开发, 2021, 42(3):212-217.LIU X L, MENG X Z. Progress research on resource development and utilization of water chestnut[J]. Food Research and Development, 2021, 42(3):212-217.
[4] WU Z T, QIAO D L, ZHAO S M, et al. Nonthermal physical modification of starch: An overview of recent research into structure and property alterations[J]. International Journal of Biological Macromolecules, 2022, 203:153-175.
[5] LEITE T S, DE JESUS A L T, SCHMIELE M, et al. High pressure processing (HPP) of pea starch: Effect on the gelatinization properties[J]. LWT-Food Science and Technology, 2017, 76:361-369.
[6] CASTRO L M G, ALEXANDRE E M C, SARAIVA J A, et al. Impact of high pressure on starch properties: A review[J]. Food Hydrocolloids, 2020, 106:105877.
[7] DOMINGUEZ-AYALA J E, SOLER A, MENDEZ-MONTEALVO G, et al. Supramolecular structure and technofunctional properties of starch modified by high hydrostatic pressure (HHP): A review[J]. Carbohydrate Polymers, 2022, 291:119609.
[8] XIAO L Y, CHEN J H, WANG X C, et al. Structural and physicochemical properties of chemically modified Chinese water chestnut[Eleocharis dulcis (Burm. f.) Trin. ex Hensch]starches[J]. International Journal of Biological Macromolecules, 2018, 120:547-556.
[9] LUTFI Z, NAWAB A, ALAM F, et al. Influence of xanthan, guar, CMC and gum Acacia on functional properties of water chestnut (Trapa bispinosa) starch[J]. International Journal of Biological Macromolecules, 2017, 103:220-225.
[10] LUTFI Z, ALAM F, NAWAB A, et al. Effect of NaCl on physicochemical properties of xanthan gum-Water chestnut starch complexes[J]. International Journal of Biological Macromolecules, 2019, 131:557-563.
[11] LIU H, WANG L J, CAO R, et al. In vitro digestibility and changes in physicochemical and structural properties of common buckwheat starch affected by high hydrostatic pressure[J]. Carbohydrate Polymers, 2016, 144:1-8.
[12] 黄艺, 张同芳, 张甫生, 等. 方竹笋超微粉对大米淀粉理化和结构特性的影响[J]. 食品与发酵工业, 2022, 48(22):95-100, 109.HUANG Y, ZHANG T F, ZHANG F S, et al. Effects of Chimonobambusa quadrangularis shoot superfine powder on physicochemical and structural properties of rice starch[J]. Food and Fermentation Industries, 2022, 48(22):95-100, 109.
[13] SHEN H S, YU J T, BAI J Q, et al. A new pre-gelatinized starch preparing by spray drying and electron beam irradiation of oat starch[J]. Food Chemistry, 2023, 398:133938.
[14] ZHANG D L, XU H S, JIANG B, et al. Effects of ultra-high pressure on the morphological and physicochemical properties of lily starch[J]. Food Science &Nutrition, 2021, 9(2):952-962.
[15] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3):426-428.
[16] HU X P, ZHANG B, JIN Z Y, et al. Effect of high hydrostatic pressure and retrogradation treatments on structural and physicochemical properties of waxy wheat starch[J]. Food Chemistry, 2017, 232:560-565.
[17] LI W H, GAO J X, SALEH A S M, et al. The modifications in physicochemical and functional properties of proso millet starch after ultra-high pressure (UHP) process[J]. Starch-Stärke, 2018, 70(5-6):1700235.
[18] BAJAJ R, SINGH N, GHUMMAN A, et al. Effect of high pressure treatment on structural, functional, and in-vitro digestibility of starches from tubers, cereals, and beans[J]. Starch-Stärke, 2022, 74(1-2):2100096.
[19] LIU M, WU N N, YU G P, et al. Physicochemical properties, structural properties, and in vitro digestibility of pea starch treated with high hydrostatic pressure[J]. Starch-Stärke, 2018, 70(1-2):1700082.
[20] LI G T, ZHU F. Effect of high pressure on rheological and thermal properties of quinoa and maize starches[J]. Food Chemistry, 2018, 241:380-386.
[21] SUN Q J, GONG M, LI Y, et al. Effect of retrogradation time on preparation and characterization of proso millet starch nanoparticles[J]. Carbohydrate Polymers, 2014, 111:133-138.
[22] LIU Y T, SELOMULYO V O, ZHOU W B. Effect of high pressure on some physicochemical properties of several native starches[J]. Journal of Food Engineering, 2008, 88(1):126-136.
[23] GUO Z B, ZENG S X, ZHANG Y, et al. The effects of ultra-high pressure on the structural, rheological and retrogradation properties of Lotus seed starch[J]. Food Hydrocolloids, 2015, 44:285-291.
[24] CHEN L, MCCLEMENTS D J, TIAN Y Q, et al. Pasting and rheological properties of non-crystalline granular starch[J]. Starch-Stärke, 2019, 71(7-8):1800338.
[25] 王子妍, 贾健辉, 张煜, 等. 不同糊化度留胚米粉理化性质和体外消化性研究[J]. 食品安全质量检测学报, 2022, 13(19):6147-6154.WANG Z Y, JIA J H, ZHANG Y, et al. Study on physicochemical properties and in vitro digestibility of embryo rice flour with different degrees of dextrinization[J]. Journal of Food Safety &Quality, 2022, 13(19):6147-6154.
[26] XU F, LIU W, ZHANG L, et al. Retrogradation and gelling behaviours of partially gelatinised potato starch as affected by the degree of pre-gelatinisation[J]. International Journal of Food Science &Technology, 2022, 57(1):426-435.
[27] OLIVEIRA L C, MACNAUGHTAN B, GOUSETI O, et al. Extending the functionality of arrowroot starch by thermally assisted high hydrostatic pressure[J]. Journal of Food Processing and Preservation, 2021, 45(9): e15756.
[28] CHEN Z G, YAO Y, PU H Y, et al. The effects of high-pressure treatment on starch pasting, retrogradation, thermal, crystalline, rheological and digestive properties—A review[J]. International Journal of Food Science &Technology, 2023, 58(5):2189-2198.
[29] RAHMAN M H, MU T H, ZHANG M, et al. Comparative study of the effects of high hydrostatic pressure on physicochemical, thermal, and structural properties of maize, potato, and sweet potato starches[J]. Journal of Food Processing and Preservation, 2020, 44(11): e14852.
[30] JANE J L, WONG K S, MCPHERSON A E. Branch-structure difference in starches of A- and B-type X-ray patterns revealed by their Naegeli dextrins[J]. Carbohydrate Research, 1997, 300(3):219-227.
[31] WANG C, XUE Y, YOUSAF L, et al. Effects of high hydrostatic pressure on the ordered structure including double helices and V-type single helices of rice starch[J]. International Journal of Biological Macromolecules, 2020, 144:1034-1042.
[32] XU J B, MA Z, REN N M, et al. Understanding the multi-scale structural changes in starch and its physicochemical properties during the processing of chickpea, navy bean, and yellow field pea seeds[J]. Food Chemistry, 2019, 289:582-590.
[33] SVIHUS B, HERVIK A K. Digestion and metabolic fates of starch, and its relation to major nutrition-related health problems: A review[J]. Starch-Stärke, 2016, 68(3-4):302-313.
[34] CHEN Z G, ZHANG H H, KEIPPER W, et al. The analysis of the effects of high hydrostatic pressure (HHP) on amylose molecular conformation at atomic level based on molecular dynamics simulation[J]. Food Chemistry, 2020, 327:127047.
[35] BELLO-PEREZ L A, FLORES-SILVA P C, AGAMA-ACEVEDO E, et al. Starch digestibility: Past, present, and future[J]. Journal of the Science of Food and Agriculture, 2020, 100(14):5009-5016.