玫瑰(Rosa rugosa Thunb.)是蔷薇科蔷薇属的落叶灌木,是世界上栽培最广,分布最多的花卉之一[1]。玫瑰花中富含多种活性成分,如挥发油、多糖、多酚和黄酮类物质,同时还含有亚油酸、维生素、氨基酸、膳食纤维和微量元素等人体必需的营养成分[2]。这些成分赋予了玫瑰花抗菌、抗氧化、降血糖、降血脂以及调节免疫力等多种功能活性[1,3]。玫瑰作为一种兼有食用价值和药用价值的特殊花卉,具有广阔的开发利用前景。
玫瑰花可经加工制成玫瑰花茶,玫瑰花茶因具有多种保健功效、独特的香气和滋味深受消费者喜爱,但目前相关研究主要集中于其生物活性成分及品质评价等方面[4-5],加工方面则集中于以玫瑰花窨制红茶,主要目的为获得具有玫瑰花香气的茶叶,但该法中玫瑰花多不会出现在成品产品中[6]。当前玫瑰花茶加工方式主要为挑选新鲜玫瑰花蕾或玫瑰花瓣后直接热风干燥制得[7],加工方法较为单一,该法制得的玫瑰花茶普遍存在青辛味较重,滋味略苦涩等问题,未得到消费者广泛认可[6]。滇红玫瑰是云南食用玫瑰的主要品种之一,其花瓣呈紫红色,花朵较大,花形优美。而单纯以新鲜滇红玫瑰花瓣采用传统红茶加工工艺制作的玫瑰花红茶的研究还未见报道。
代谢组学是在特定条件下对生物体所含代谢物整体进行定性定量,可揭示特定时间和特定条件下代谢物的种类和含量,已经被广泛运用于食品研究中[8-9]。毛鸿霖等[10]通过非靶向代谢组学技术对德昂酸茶与普洱熟茶中的代谢产物进行检测分析,结果表明,虽然德昂酸茶和普洱熟茶所用原料都为云南大叶种茶树,但因两者加工方式不同,导致代谢物差异较大。燕飞等[11]利用非靶向代谢组学方法分析杜仲金花茶发酵过程中代谢物的变化规律,结果表明发酵后L-谷氨酰胺、葡萄糖醛酸、20-羟二十碳四烯酸、反式阿魏酸、诺缬氨酸和金丝桃苷等代谢物含量提高,这些活性成分赋予了杜仲金花茶抗氧化、降血压、解毒、抗炎以及提高免疫力等保健功效。但目前关于玫瑰花发酵前后的物质组成和功能变化研究鲜见报道。
本研究以云南滇红玫瑰食用鲜花(R.gallica L.‘Dianhong’),按照传统红茶加工工艺制成玫瑰花红茶,研究玫瑰花发酵前后代谢物的变化。采用超高效液相色谱-串联质谱(ultra high perssure liquid chromatography-Q-exactive-mass spectrometry, UHPLC-QE-MS)非靶向代谢组学技术分析玫瑰干花水提物(dried rose petal water extract, RWE)与玫瑰花红茶水提物(rose black tea aqueous extract, RBTE)中的代谢产物,解析玫瑰干花水提物与玫瑰花红茶水提物的代谢物种类和数量的变化规律,并评估其抗氧化活性变化,旨在为玫瑰花红茶开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
滇红玫瑰花(R.gallica L.‘Dianhong’,2022年5月),采自昆明;没食子酸、葡聚糖、Folin-Phenol试剂,索莱宝科技有限公司;DPPH,成都润泽本土化工有限公司;抗坏血酸(维生素C),成都金山化学试剂有限公司;ABTS,成都市科龙化学品有限公司;所用化学试剂均为分析纯。甲醇、乙腈(HPLC级),Fisher Chermical公司;甲酸(HPLC级),CNW公司;异丙醇(HPLC级),Merck公司;2-氯-L-苯丙氨酸(纯度不低于98%),Adamas-beta公司。
1.2 仪器与设备
220BC型茶叶揉捻机,长沙欧龙机械设备有限公司;HS 153型卤素水分测定仪,瑞士梅特勒公司;Synergy H1型全波长荧光酶标仪,美国伯腾仪器有限公司;Centrifuge 5430R型高速冷冻离心机,德国Eppendorf公司;超高效液相色谱串联傅里叶变换质谱UHPLC-Q Exactive HF-X,赛默飞公司;HSS T3色谱柱(100 mm×2.1 mm i.d.,1.8 μm),美国Waters公司;JXDC-20型氮气吹扫仪,上海净信实业发展有限公司。
1.3 实验方法
1.3.1 滇红玫瑰花红茶的工艺优化
1.3.1.1 滇红玫瑰花红茶的加工工艺
原料按照传统红茶工序加工,具体操作如图1所示。将采摘的新鲜滇红玫瑰花朵进行分选,剔除损伤、发黄的花瓣,将重叠在一起的花瓣打散分开。自然萎凋,水分含量控制在70%~75%;揉捻过程依次为轻揉15~18 min、重揉15~20 min、轻揉12~15 min,揉捻机转速58 r/min,单次滇红玫瑰花上样量为1 500×g,中间根据茶团黏结情况进行解块;将揉捻后的玫瑰花瓣彻底解块打散,进行发酵(厚度为8~10 cm,湿度>90%);干燥阶段毛火温度为100 ℃,30 min翻动一次,烘至约7成干(水分含量<30%),再将温度控制在70 ℃烘至足干(水分含量5%~6%)。

图1 滇红玫瑰花红茶加工工艺
Fig.1 Processing of R.gallica L.‘Dianhong’ black tea
滇红玫瑰干花茶以云南新鲜滇红玫瑰花瓣为原料,直接干燥(60 ℃)制得。
1.3.1.2 滇红玫瑰花红茶的感官审评
参考GB/T 23776—2018《茶叶感官审评方法》,取3 g茶样,加入150 mL沸水冲泡5 min,然后由15位专业人员组成的评定小组对滇红玫瑰花红茶的外形、汤色、滋味、香气、叶底5个方面进行审评。按照评分标准进行评分(总分=外形+汤色+香气+滋味+叶底),具体评分标准如表1所示。
表1 滇红玫瑰花红茶感官评定标准
Table 1 Sensory evaluation standard of R.gallica L.‘Dianhong’ black tea
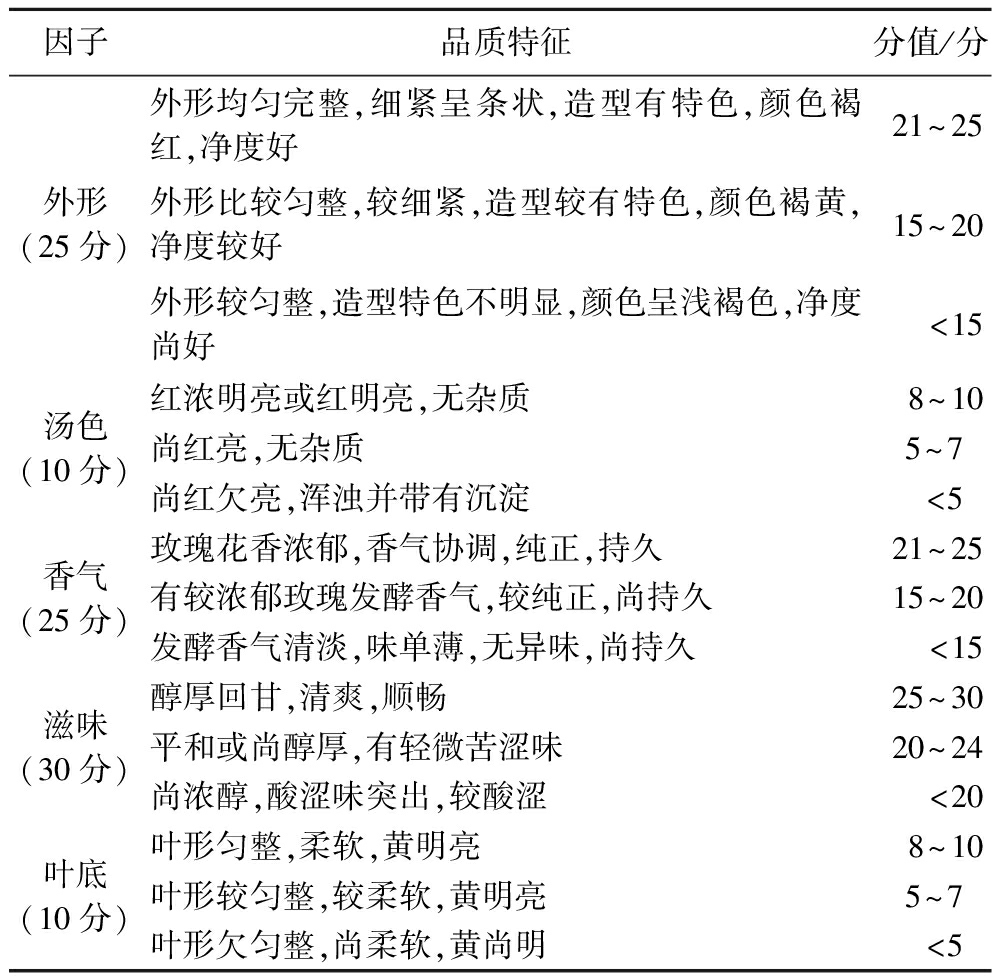
因子品质特征分值/分外形(25分)外形均匀完整,细紧呈条状,造型有特色,颜色褐红,净度好21~25外形比较匀整,较细紧,造型较有特色,颜色褐黄,净度较好15~20外形较匀整,造型特色不明显,颜色呈浅褐色,净度尚好<15汤色(10分)红浓明亮或红明亮,无杂质8~10尚红亮,无杂质5~7 尚红欠亮,浑浊并带有沉淀<5 香气(25分)玫瑰花香浓郁,香气协调,纯正,持久21~25有较浓郁玫瑰发酵香气,较纯正,尚持久15~20发酵香气清淡,味单薄,无异味,尚持久<15滋味(30分)醇厚回甘,清爽,顺畅25~30平和或尚醇厚,有轻微苦涩味20~24尚浓醇,酸涩味突出,较酸涩<20叶底(10分)叶形匀整,柔软,黄明亮8~10叶形较匀整,较柔软,黄明亮5~7 叶形欠匀整,尚柔软,黄尚明<5
1.3.1.3 单因素试验
以滇红玫瑰花红茶的感官得分为评价指标进行3因素5水平的单因素试验,萎凋时间4、8、12、16、20 h,发酵温度20、25、30、35、40 ℃,发酵时间3、6、9、12、15 h,以此优化玫瑰花红茶的加工工艺。在选择不同因素时,其他固定条件分别为萎凋时间12 h、发酵温度30 ℃、发酵时间9 h。
1.3.1.4 均匀设计试验
在单因素试验的基础上,设计U5 (53)均匀设计实验,以萎凋时间(X1),发酵温度(X2),发酵时间(X3)进行3因素5水平组合试验,均匀设计实验方案见表2。
表2 滇红玫瑰花红茶加工工艺均匀实验设计方案
Table 2 Uniform experimental design scheme ofR.gallica L.‘Dianhong’ black tea processing technology
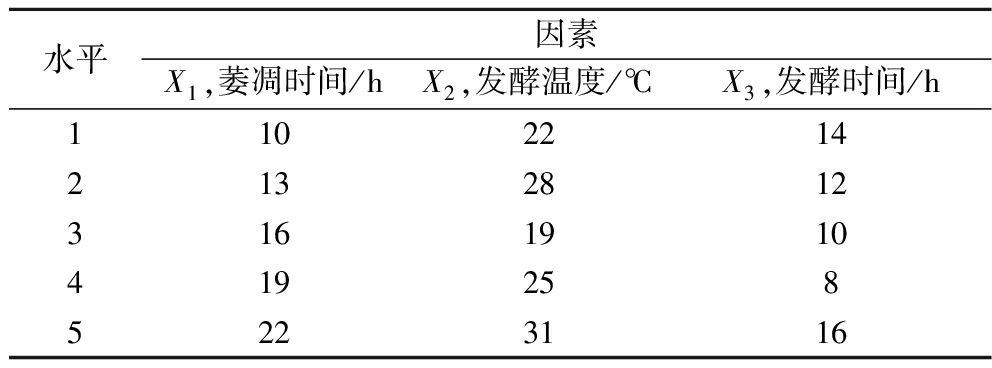
水平因素X1,萎凋时间/hX2,发酵温度/℃X3,发酵时间/h1102214213281231619104192585223116
1.3.2 玫瑰花水提物的制备
水提物制备工艺:
滇红玫瑰花红茶(干制滇红玫瑰花)→粉碎→粉末(过50目筛)→35倍蒸馏水浸提3次(94 ℃,90 min)→过滤→减压浓缩(60 ℃)→真空冷冻干燥→冻干物粉碎→水提物
1.3.3 RBTE与RWE基础成分含量测定
水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中第一法——直接干燥法,采用快速水分测定仪测定;总多酚含量参照GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》,采用福林-酚比色法测定;总黄酮含量采用硝酸铝法测定[12];蛋白质含量采用考马斯亮蓝法测定[13];游离氨基酸含量参照GB/T 8314—2013《茶 游离氨基酸总量的测定》,采用茚三酮比色法测定;多糖含量采用苯酚-硫酸法测定[14];花青素含量的测定采用pH示差法[15]。
1.3.4 代谢物非靶向代谢组学分析
代谢物提取:称取25 mg待测样品,加入0.4 mL甲醇-水(体积比=4∶1)提取液含0.02 mg/mL的内标(L-2-氯苯丙氨酸)进行代谢物提取。研磨6 min(-10 ℃,50 Hz)后,低温超声提取30 min(5 ℃,40 kHz),将样品静置于-20 ℃保存。将样品离心15 min(4 ℃,13 000×g),收集上清液上机分析。
LC-MS/MS分析的仪器平台如1.2节所述。色谱条件:柱温40 ℃,流速0.4 mL/min,流动相A[V(水)∶V(乙腈)=95∶5,含0.1%甲酸溶液],流动相B A[V(乙腈)∶V(异丙醇)∶V(水)=47.5∶47.5∶5,含0.1%甲酸溶液]。质谱条件:质谱扫描范围m/z为70~1 050;鞘气流速50 arb;辅助气流速13 arb;加热器温度425 ℃;离子传输管温度为325 ℃;离子喷雾电压,正离子电压3 500 V,负离子电压-3 500 V;S-Lens RF Level为50%;归一化的碰撞能为20 V-40 V-60 V循环碰撞能。一级质谱分辨率60 000,二级质谱分辨率7 500,采用DDA模式采集数据。
将代谢物数据进行缺失值和归一化处理,使用R软件包ropls(Version1.6.2)进行主成分分析(principal component analysis, PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA),同时通过多变量分析(variable important in projection, VIP)、差异倍数结合Student’s T检验的P值筛选差异代谢物。将筛选得到的差异代谢物通过KEGG代谢通路数据库进行注释解析。
1.3.5 RBTE与RWE抗氧化能力的测定
参照陆秀云等[16]的方法。
1.4 数据统计分析
所有数据以平均值±标准偏差(n=3)表示。使用SPSS 25.0软件中的单因素方差(ANOVA)进行差异显著性统计分析(P<0.05为差异显著),使用GraphPad Prism 8软件对数据进行计算和绘图。
2 结果与分析
2.1 均匀设计实验结果与回归分析
2.1.1 回归分析
依据均匀设计实验结果表3进行回归分析,多元线性回归方差分析结果如表4所示,方差分析显著性结果P=0.059>0.05,说明多元线性回归模型不能显著性地解释自变量与因变量之间的变化,因此采用多元非线性回归模型优化玫瑰花红茶加工工艺。使用SPSS 25.0软件对多元二项式回归数据进行统计分析。由表5可知,复相关系数R和决定系数R2均为1.000,表明回归模型具有显著性(P<0.05)。依据多项式回归模型试验数据去除不显著项后,确定回归方程为:![]() 其中X2与X3存在交互作用,X1、X2与感官评价得分呈正相关,
其中X2与X3存在交互作用,X1、X2与感官评价得分呈正相关,![]() 呈负相关。
呈负相关。
表3 均匀设计试验结果
Table 3 Uniform experimental design and results
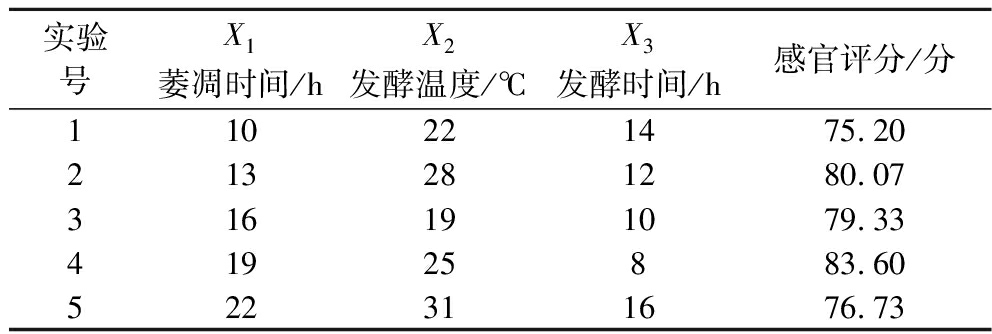
实验号X1萎凋时间/hX2发酵温度/℃X3发酵时间/h感官评分/分110221475.20213281280.07316191079.3341925883.60522311676.73
表4 多元线性回归方差分析
Table 4 Multiple linear regression analysis of variance
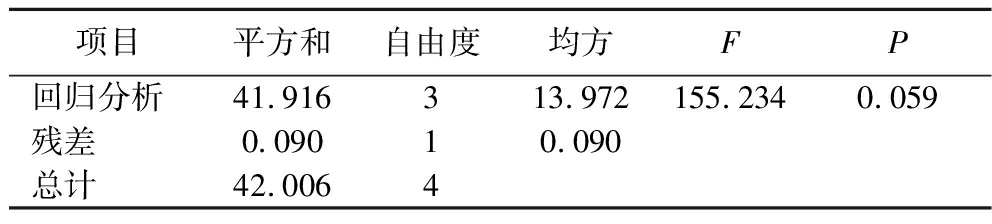
项目平方和自由度均方FP回归分析41.916313.972155.2340.059残差0.09010.090总计42.0064
表5 多元多项式回归模型摘要
Table 5 Summary of multivariate polynomial regression model
模型RR2调整后R2标准误差德宾-沃森11.0001.0000.0000.0001.000
表6 多元多项式回归模型偏相关系数表
Table 6 Partial correlation coefficients for multiple poly notion models
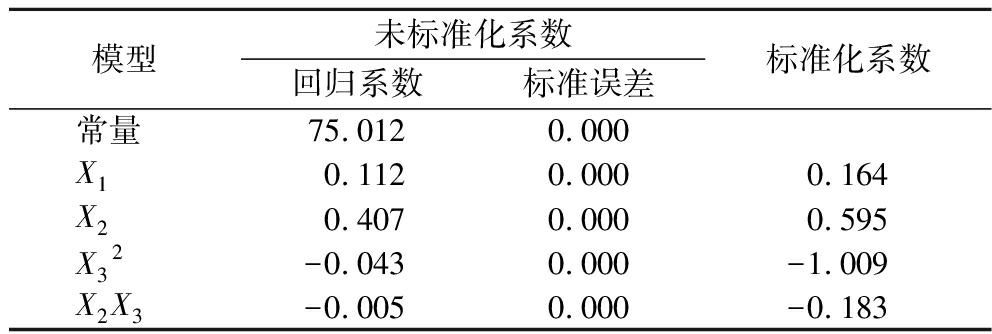
模型未标准化系数回归系数标准误差标准化系数常量75.0120.000X10.1120.0000.164X20.4070.0000.595X32-0.0430.000-1.009X2X3-0.0050.000-0.183
2.1.2 最优化方案分析结果验证
通过Excel规划求解分析回归方程获得滇红玫瑰花红茶的最佳加工工艺为:萎凋时间22 h、发酵温度31 ℃、发酵时间8 h。因多元回归模型具有多样性,分别进行3次验证试验,将直观分析法获得的试验因素优化方案数值代入回归方程中进行计算,在验证试验的优化条件下得到感官评分Y=83.56,低于Excel规划求解所得Y=86.10,表明回归模型可靠,可以认为通过三元二次多项式回归和Excel规划求解运算获得的优化方案可靠[17]。
2.2 RBTE与RWE基础成分含量分析
由表7可知,RBTE与RWE在水分含量、总黄酮、蛋白质含量上无显著差异(P>0.05),在总多酚、游离氨基酸、多糖、花青素含量存在差异,RBTE总多酚、多糖含量显著高于RWE,RWE花青素以及游离氨基酸含量显著高于RBTE(P<0.05)。RBTE与RWE的总多酚含量平均值均高于20%,总黄酮含量>10%,结果表明多酚类物质是2种水提物中的主要成分。RBTE花青素含量显著低于RWE,原因是在加工过程中花青素成分能在多酚氧化酶(polyphenol oxidase, PPO)作用下氧化或在高温条件下发生降解[18]。
表7 RBTE与RWE基础成分含量
Table 7 Chemical composition of RBTE and RWE

样品名称水分含量/%总多酚含量/%总黄酮含量/%蛋白质含量/%游离氨基酸含量/%多糖含量/%花青素/(mg/100 g)RWE9.64±1.23a20.24±0.84b12.19±0.41a3.62±0.40a5.59±0.07a5.12±0.63b25.26±1.54aRBTE9.84±0.97a31.13±0.28a13.56±0.85a4.15±0.32a3.33±0.02b7.06±0.51a7.49±2.13b
注:不同小写字母表示同列不同加工方法数据间差异显著(P<0.05)。
2.3 RBTE与RWE非靶向代谢组学分析
在超高效液相色谱串联傅里叶变换质谱(UHPLC-Q Exactive HF-X)检测2种滇红玫瑰花提取物中的所有代谢产物中,鉴定到能同时与数据库物质的一级m/z和数据库的碎片离子(二级)m/z匹配到的物质,共2 028个代谢物,其中正离子模式下鉴定数量为1 161个,负离子模式下鉴定数量为867个。注释到HMDB 4.0数据库中的代谢物共1 889个,各类代谢物数量所占比例如图2所示。其中脂质和类脂分子、苯丙素类和聚酮类化合物、有机氧化合物、有机杂环化合物、有机酸及其衍生物、苯环型化合物占比较大,共占比93.97%。
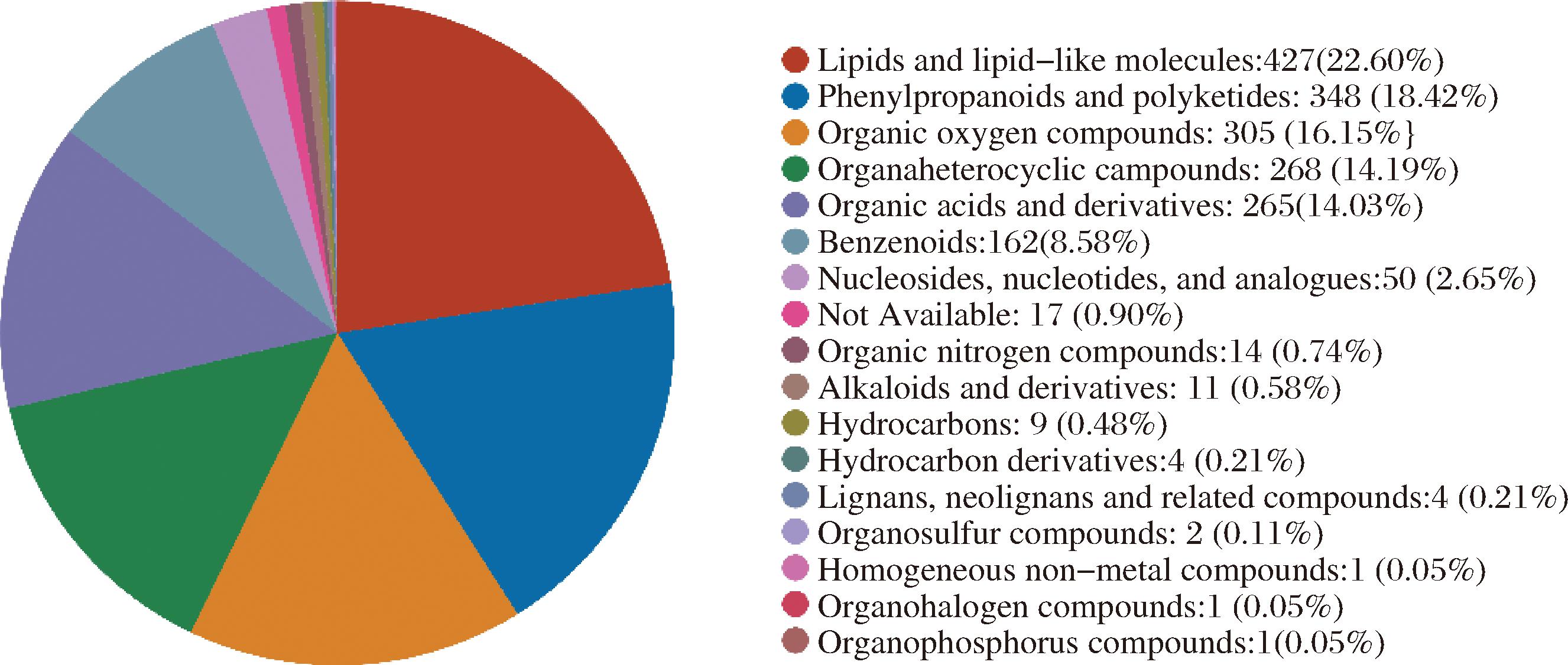
图2 鉴定的代谢物在各化学分类的数量占比
Fig.2 The proportion of identified metabolites in each chemical classification
2.3.1 总体样本主成分分析
图3-A和图3-B分别为正、负离子模式下RWE和RBTE的PCA得分图,正、负离子模式下的模型参数R2X分别为0.85和0.906,R2X为模型对X变量的解释性,数值越接近1说明模型拟合性越好,模型越可靠。由图3可知,正离子和负离子模式下PC1和PC2累计贡献率分别为81.99%和88.88%,表明2个主成分可解释样本大部分的变化。同一颜色的点表示组内的各个生物学重复,由点的分布状态可以看出,该模型可以明显区分2组样本,组间样本的数据点很好地集中在一起,说明RWE与RBTE的代谢物存在一定的差异,可对样本数据进一步进行分析研究。
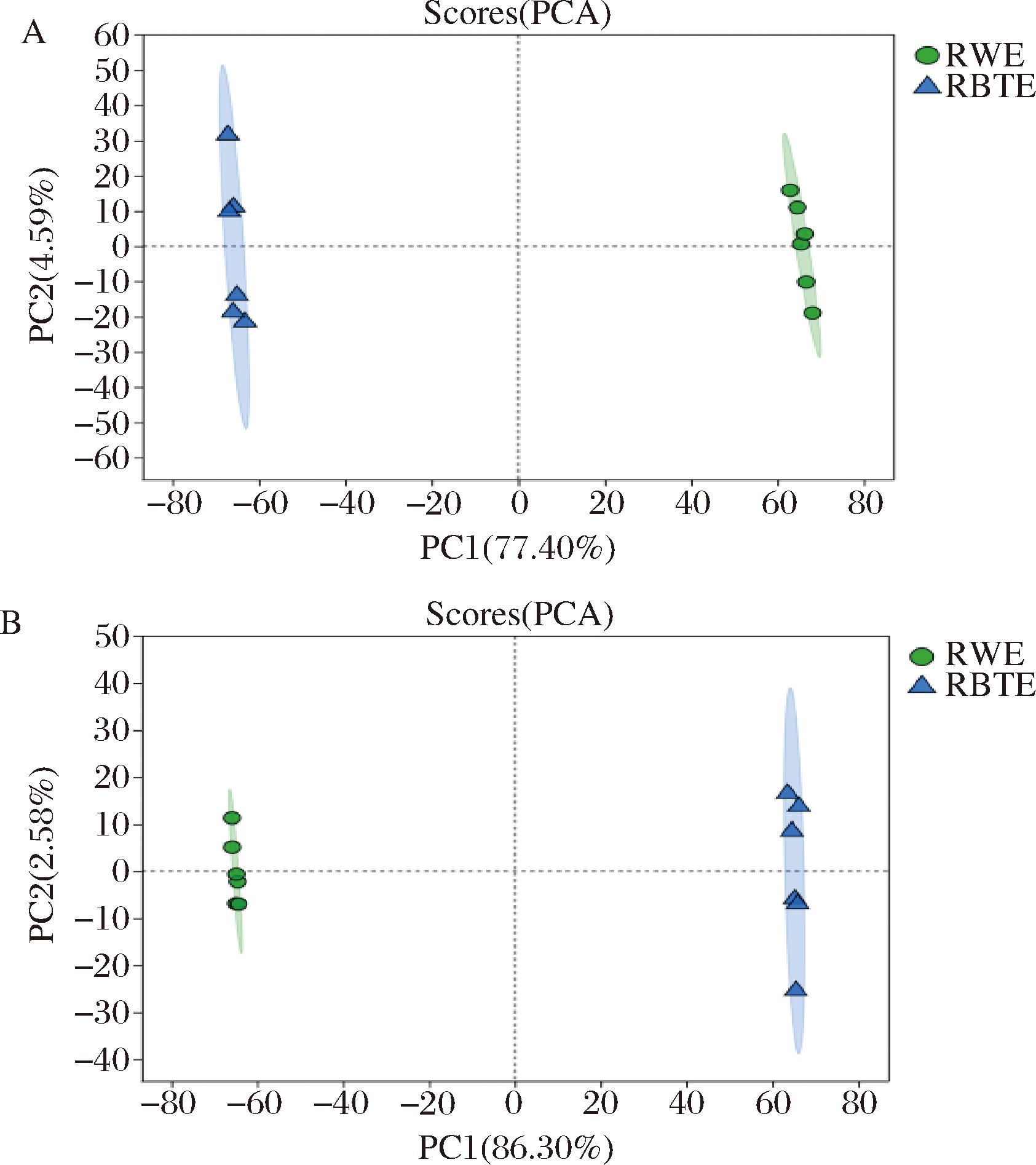
A-正离子模式;B-负离子模式
图3 正负离子模式下PCA得分图
Fig.3 PCA score under positive and negative ion mode
2.3.2 正交偏最小二乘判别分析
OPLS-DA是一种有监督的分析方法,由于在建立模型时预先提供了分组信息,可以有效降低组内差异、放大组间差异,排除无关变量对实验数据造成的影响,提高模型的有效性和解析能力[19]。图4-A和图4-B分别为正负离子模式下RWE和RBTE的OPLS-DA得分图,正负离子模式下R2Y和Q2均大于0.5,表明模型稳定可靠,预测能力较好。图4-C和图4-D分别为正负离子模式下RWE和RBTE的OPLS-DA置换检验图,正负离子模式下模型R2Y和Q2的回归线与横坐标相交均小于0,模型的Q2值均小于原模型的Q2值,说明原模型有较好的稳定性,不存在过度拟合现象,可以进行后续差异代谢物的筛选分析。
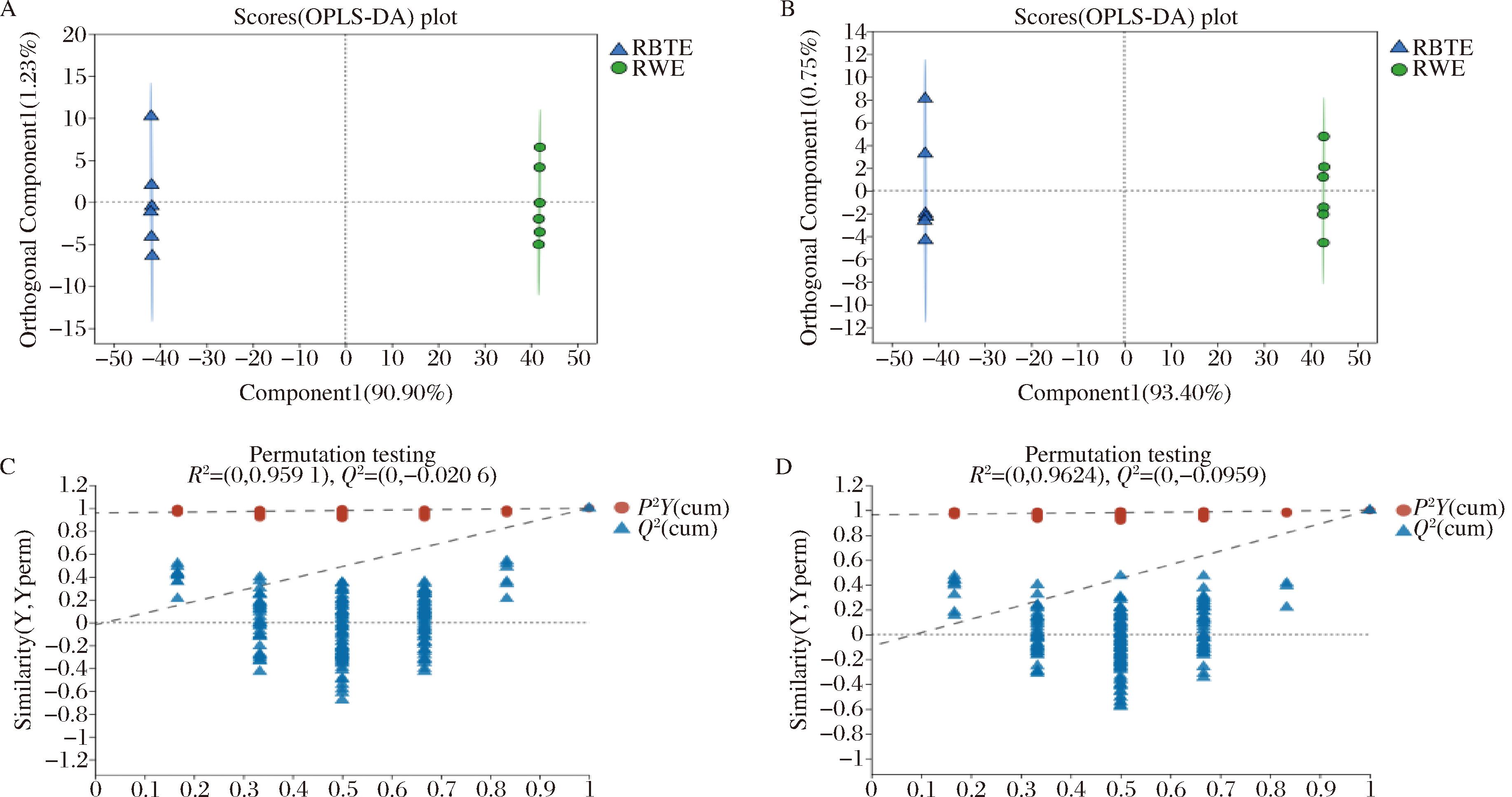
A-正离子模式下得分图;B-负离子模式得分图;C-正离子模式下置换检验图;D-负离子模式下置换检验图
图4 正负离子模式下OPLS-DA模型及置换检验图
Fig.4 OPLS-DA model and permutation test diagram in positive and negative ion mode
2.3.3 差异代谢物筛选及分析
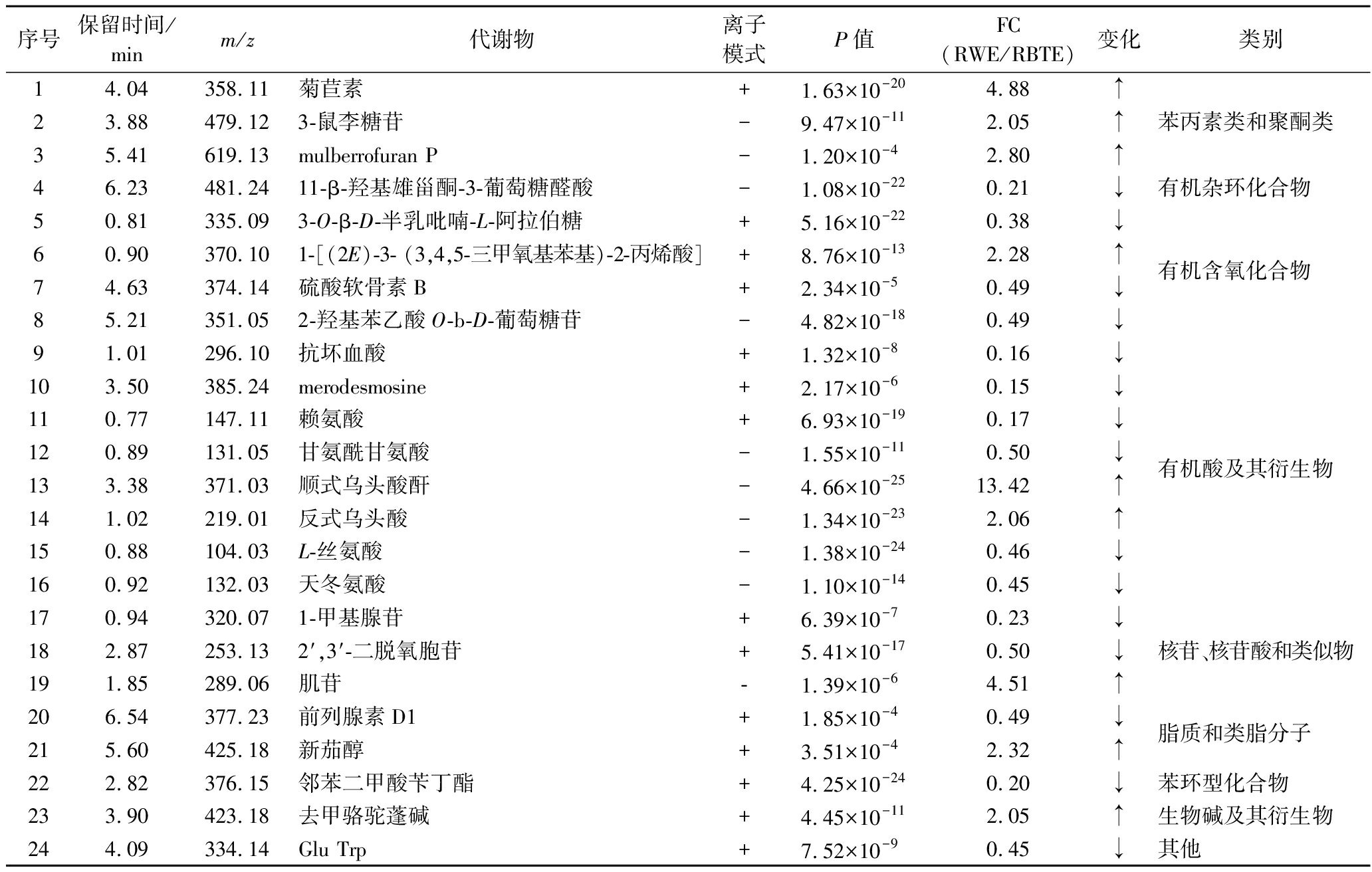
根据OPLS-DA结果,以VIP>1,P<0.05,FC≥2或FC≤0.5为筛选标准,对RWE和RBTE显著差异代谢物进行筛选,共筛选到24种差异代谢物,结果如表8所示,其中有机酸及其衍生物类8种,有机氧化合物类4种,核苷、核苷酸和类似物类3种,苯丙素类和聚酮化合物类3种,脂质和类脂分子2种,生物碱及其衍生物类1种,苯环型化合物1种,有机杂环化合物1种,其他类1种。其中显著上调的差异代谢物有9种,显著下调的代谢物有15种。在本次实验中,下调差异代谢物多于上调差异代谢物,下调差异代谢物有机酸及其衍生物类为最多。相关研究表明,酸味通常会降低红茶的感官品质,而有机酸被认为是其主要贡献者之一[20]。
表8 RWE与RBTE主要差异代谢物信息及变化情况
Table 8 Information and changes of main differential metabolites between RWE and RBTE
序号保留时间/minm/z代谢物离子模式P值FC(RWE/RBTE)变化类别14.04358.11菊苣素+1.63×10-204.88↑23.88479.123-鼠李糖苷-9.47×10-112.05↑苯丙素类和聚酮类35.41619.13mulberrofuran P-1.20×10-42.80↑46.23481.2411-β-羟基雄甾酮-3-葡萄糖醛酸-1.08×10-220.21↓有机杂环化合物50.81335.093-O-β-D-半乳吡喃-L-阿拉伯糖+5.16×10-220.38↓60.90370.101-[(2E)-3- (3,4,5-三甲氧基苯基)-2-丙烯酸]+8.76×10-132.28↑有机含氧化合物74.63374.14硫酸软骨素B+2.34×10-50.49↓85.21351.052-羟基苯乙酸O-b-D-葡萄糖苷-4.82×10-180.49↓91.01296.10抗坏血酸+1.32×10-80.16↓103.50385.24merodesmosine+2.17×10-60.15↓110.77147.11赖氨酸+6.93×10-190.17↓120.89131.05甘氨酰甘氨酸-1.55×10-110.50↓有机酸及其衍生物133.38371.03顺式乌头酸酐-4.66×10-2513.42↑141.02219.01反式乌头酸-1.34×10-232.06↑150.88104.03L-丝氨酸-1.38×10-240.46↓160.92132.03天冬氨酸-1.10×10-140.45↓170.94320.071-甲基腺苷+6.39×10-70.23↓182.87253.132′,3′-二脱氧胞苷+5.41×10-170.50↓核苷、核苷酸和类似物191.85289.06肌苷-1.39×10-64.51↑206.54377.23前列腺素D1+1.85×10-40.49↓脂质和类脂分子215.60425.18新茄醇+3.51×10-42.32↑222.82376.15邻苯二甲酸苄丁酯+4.25×10-240.20↓苯环型化合物233.90423.18去甲骆驼蓬碱+4.45×10-112.05↑生物碱及其衍生物244.09334.14Glu Trp+7.52×10-90.45↓其他
注:↑表示含量增加,↓表示含量减少。
图5为RWE和RBTE差异代谢物相对含量变化热图及聚类分析结果。图中每行代表一个代谢物,每列代表一个样本,颜色表示相对含量,红色越深代表该代谢物相对含量越高,蓝色越深代表该代谢物相对含量越低。差异代谢物在2种不同提取物中的相对含量明显区分。其中RWE相对含量较高的代谢物共有15种,包括11-β-羟基雄甾酮-3-葡萄糖醛酸、3-O-β-D-半乳吡喃-L-阿拉伯糖、硫酸软骨素B、2-羟基苯乙酸O-b-D-葡萄糖苷、抗坏血酸、merodesmosine、赖氨酸、甘氨酰甘氨酸、L-丝氨酸、天冬氨酸、1-甲基腺苷、2′,3′-二脱氧胞苷、前列腺素D1、邻苯二甲酸苄丁酯、Glu Trp;主要为有机含氧化合物、氨基酸和有机酸类物质。RBTE相对含量较高的代谢物有共9种,包括菊苣素、3-鼠李糖苷、mulberrofuran P、1-[(2E)-3-(3,4,5-三甲氧基苯基)-2-丙烯酸]、顺式乌头酸酐、反式乌头酸、肌苷、新茄醇、去甲骆驼蓬碱;主要有苯丙素类和聚酮类化合物及有机酸类等物质。

图5 RWE与RBTE差异代谢物聚类分析热图
Fig.5 Heatmap of cluster analysis of differential metabolites between RWE and RBTE
作为一种生物香豆素,菊苣素具有抑制体重增加和血脂谱异常的功能。此外,还能抑制心肌组织中的脂质和脂毒性累积[21]。肌苷是一种天然存在的嘌呤核苷,由腺苷分解形成,参与机体物质代谢和能量代谢[22]。许多研究报道肌苷具有神经保护作用。认为肌苷的神经保护潜力与其抗氧化和抗炎作用有关[23-24]。此外,肌苷是合成增鲜剂5′-肌苷酸二钠最重要的前体物质,广泛应用于食品工业中[25]。去甲骆驼蓬碱是天然植物源性β-咔啉类生物碱,可通过抑制髓过氧化物酶(myeloperoxidase, MPO)活力,发挥其抗炎作用[26]。在这些苯丙素类和聚酮类化合物、生物碱及核苷的共同作用下,玫瑰花红茶不仅具有独特的风味还具有生理调控、抗氧化及抗炎等功能。由此可见,以新鲜玫瑰花为原料制成玫瑰花红茶具有开发成抗氧化和抗炎等一系列生理活性产品的潜能和前景。
玫瑰花红茶提取物中甘酰胺甘氨酸、天冬氨酸、赖氨酸及L-丝氨酸等氨基酸的相对含量较低。玫瑰花红茶在加工过程中,随着玫瑰花瓣的水分、温度以及叶细胞损伤程度的变化,氨基酸与其他多酚类物质会在酶的催化作用下发生反应生成褐色色素,或与糖类物质发生美拉德反应,这可能是导致玫瑰花红茶氨基酸含量下降的主要原因[27]。游离氨基酸是茶汤滋味的重要贡献者,一些游离氨基酸不仅具有生物活性,还具有酸、甜、苦、涩、鲜等特殊滋味[28]。其中天冬氨酸既呈酸味,也呈鲜味;L-丝氨酸属于甜味氨基酸;赖氨酸属于苦味氨基酸[29]。此外,有机酸类物质抗坏血酸含量也与茶汤的酸味有关[30]。呈酸味、苦味物质含量的降低,有利于降低茶汤酸涩味,对玫瑰花红茶品质的形成具有重要影响。
2.3.4 代谢通路分析
植物生长是一个十分复杂的代谢过程,受多种物质和反应共同调控,并不能仅仅依据某一种物质含量的高低进行整体判断,因此需进一步分析其代谢途径[31]。将上述筛选鉴定的差异代谢物通过KEGG Pathway数据库对其进行富集分析和拓扑学分析,并以P值≤0.5及Impact值>0.1为条件,筛选出最为显著的具体关键代谢通路共有5条,结果以气泡图的形式显示(图6)。由图6可知,玫瑰花红茶制作过程中影响最大的5条通路分别为:a)丙氨酸、天冬氨酸和谷氨酸代谢;b)氨酰tRNA生物合成;c)赖氨酸降解;d)甘氨酸、丝氨酸和苏氨酸代谢;e)赖氨酸生物合成。其中丙氨酸、天冬氨酸和谷氨酸代谢处的气泡最大、气泡颜色相对最深,说明在新鲜玫瑰花瓣在加工成玫瑰花红茶过程中,对玫瑰花红茶中氨基酸类物质的影响最显著。

图6 RWE与RBTE差异物质的代谢通路富集分析
Fig.6 Metabolic pathway enrichment analysis of differential substances between RWE and RBTE
2.4 RBTE与RWE抗氧化活性评价
自由基清除率可反映天然产物抗氧化能力,研究中通常采用IC50值评价自由基清除能力大小,IC50值越小表明对DPPH自由基清除能力越强,则抗氧化能力越强。由于抗氧化作用机理复杂,因此选择多种不同作用原理的抗氧化方法对RBTE与RWE的抗氧化能力进行综合评价[32]。由图7可知,玫瑰花经发酵后抗氧化能力均有不同程度的增加,但2种提取物对DPPH自由基、ABTS阳离子自由基及羟自由基的清除效果均显著低于对照品抗坏血酸。其中,RBTE和RWE对ABTS阳离子自由基清除率的IC50值分别为(15.16±0.16) μg/mL和(15.76±0.62) μg/mL,两者对ABTS阳离子自由基清除能力无显著区别(P>0.05),表明RBTE和RWE对ABTS阳离子自由基清除能力相当。RBTE和RWE对DPPH自由基清除率的IC50值分别为(17.98±0.44) μg/mL和(19.59±0.63) μg/mL,对羟自由基自由基清除率的IC50值分别为(1.39±0.00) mg/mL和(1.76±0.01) mg/mL,由此可知,RBTE对DPPH自由基、羟自由基清除率的IC50值均显著小于RWE(P<0.05),即玫瑰花发酵后对DPPH自由基和羟自由基的清除能力得到提高。
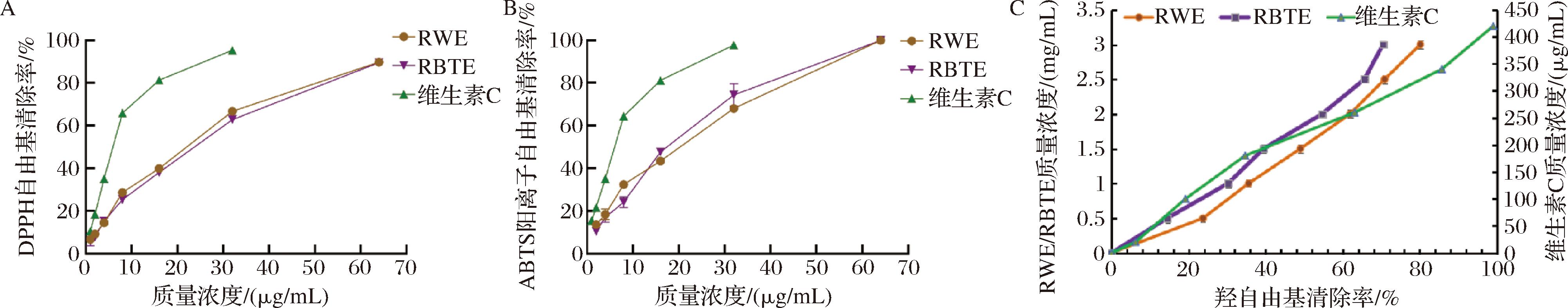
A-DPPH自由基清除率;B-ABTS阳离子自由基清除率;C-羟自由基清除率
图7 玫瑰花发酵前后抗氧化能力比较
Fig.7 Comparison of rose antioxidant capacity before and after fermentation
玫瑰花中含有300多种成分,其中与玫瑰花呈现出的自由基清除能力、抗氧化性等特性最相关的活性化学成分为多酚类和多糖类等[6,33]。RBTE对DPPH自由基、羟自由基的清除效显著优于RWE,这可能与RBTE中多酚、多糖含量较高有关。顾秋亚等[34]研究发现,沙棘叶发酵后总黄酮和总酚含量增加,对DPPH自由基、ABTS阳离子自由基的清除能力比发酵前有所提高,化洪苓等[35]也发现刺五加发酵后黄酮含量提高,对DPPH自由基、羟自由基、ABTS阳离子自由基和超氧阴离子自由基清除能力以及总还原力均比未发酵刺五加的强。这与本研究中观察到的结果相似,这可能是由于多酚类物质有一定的体外抗氧化活性,发酵后多酚类物质含量增加,提高了清除自由基的能力[36]。另外,在发酵过程中可能产生了某种具有抗氧化活性的新物质,能够作为氢质子或电子的供给体,直接猝灭或抑制自由基,终止自由基的连锁反应,发挥抗氧化功能[37]。根据非靶向代谢组学分析结果,推测玫瑰花发酵后产生的具有抗氧化活性的新物质可能为肌苷、去甲骆驼蓬碱,这些原因可能共同造成玫瑰花发酵后的抗氧化活性上升。
3 结论
本实验通过单因素试验和均匀设计试验得到滇红玫瑰花红茶的最优工艺参数为:萎凋时间22 h、发酵温度31 ℃、发酵时间8 h,玫瑰花发酵前后在总黄酮、蛋白质含量上无显著差异,但在总多酚、游离氨基酸、多糖和花青素含量上具有显著性差异。通过非靶向代谢组学分析共筛选出24种显著差异代谢产物,其中菊苣素、肌苷、新茄醇和去甲骆驼蓬碱等9种代谢物在玫瑰花红茶相对含量较高,代谢物菊苣素、肌苷和去甲骆驼蓬碱赋予了玫瑰花红茶生理调控、抗氧化及抗炎等功能。KEGG代谢通路分析发现,涉及氨基酸代谢相关的通路对玫瑰花发酵后的滋味品质形成有着重要影响。抗氧化活性测定结果表明,玫瑰花发酵后抗氧化能力均有不同程度的增加,这印证了非靶向代谢组学分析结果。本研究可为进一步开发玫瑰花产品及扩展玫瑰花在保健食品等行业中的应用提供科学依据。
[1] 鲁雷震, 贾紫伟, 封成玲, 等. 玫瑰植物中活性物质及其功效研究进展[J]. 食品研究与开发, 2021, 42(20): 206-213.LU L Z, JIA Z W, FENG C L, et al. Review of biologically active substances in rose plants and their functions[J]. Food Research and Development, 2021, 42(20): 206-213.
[2] 张月, 周航, 吴海军. 玫瑰在食品中的应用及前景展望[J]. 现代食品, 2021, 27(11): 25-27.ZHANG Y, ZHOU H, WU H J. Application and prospect of rosa rugosa in food[J]. Modern Food, 2021, 27(11): 25-27.
[3] ZHANG Q Q, RUI X, LI W, et al. Anti-swarming and -biofilm activities of rose phenolic extract during simulated in vitro gastrointestinal digestion[J]. Food Control, 2016, 64: 189-195.
[4] 刘真, 汤晓娟, 王彬, 等. 基于风味成分分析的不同干燥方式玫瑰花茶鉴别技术研究[J]. 食品安全质量检测学报, 2022, 13(12): 3842-3849.LIU Z, TANG X J, WANG B, et al. Study on identification technology of rose tea with different drying methods based on flavor compounds analysis[J]. Journal of Food Safety and Quality, 2022, 13(12): 3842-3849.
[5] 刘芳, 任启飞, 李占彬, 等. 贵州玫瑰花茶的氨基酸组成及其品质综合评价[J]. 食品安全质量检测学报, 2022, 13(14): 4706-4714.LIU F, REN Q F, LI Z B, et al. Amino acid composition and comprehensive quality evaluation of Guizhou rose tea[J]. Journal of Food Safety and Quality, 2022, 13(14): 4706-4714.
[6] 郑新琰, 矣润梅, 许冬月, 等. 不同加工方法对墨红玫瑰花茶产品质量指标及酶活的影响及相关性分析[J]. 食品工业科技, 2023, 44(15): 337-345.ZHENG X Y, YI R M, XU D Y, et al. Effect of different processing methods on the quality indexes and enzyme activities of rosa crimson glory tea and correlation analysis[J]. Science and Technology of Food Industry, 2023, 44(15): 337-345.
[7] LIU Z, LIU L X, HAN Q D, et al. Quality assessment of rose tea with different drying methods based on physicochemical properties, HS-SPME-GC-MS, and GC-IMS[J]. Journal of Food Science, 2023, 88(4): 1378-1391.
[8] XIE H M, WANG H D, CHEN B X, et al. Untargeted metabolomics analysis to unveil the chemical markers for the differentiation among three Gleditsia sinensis-derived herbal medicines by ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Arabian Journal of Chemistry, 2022, 15(5): 103762.
[9] 赵丹, 杜仁鹏, 刘鹏飞, 等. 代谢组学技术在植物源性食品研究中的应用研究进展[J]. 食品科学, 2015, 36(3): 212-216.ZHAO D, DU R P, LIU P F, et al. A review of applications of metabolomics techniques in plant-derived food research[J]. Food Science, 2015, 36(3): 212-216.
[10] 毛鸿霖, 杨莉, 肖蓉, 等. 基于非靶向代谢组学方法探究德昂酸茶与普洱茶(熟茶)之间的成分差异[J].食品科学, 2022, 43(18): 236-242.MAO H L, YANG L, XIAO R, et al. Non-targeted metabolomic analysis reveals the difference in metabolite composition between De’ang sour tea and ripe Pu’er tea[J]. Food Science, 2022, 43(18): 236-242.
[11] 燕飞, 曲东, 纪鹏彬, 等. 基于非靶向代谢组学分析杜仲金花茶发酵过程中代谢物的特征[J]. 食品科学, 2023, 44(10): 300-309.YAN F, QU D, JI P B, et al. Non-targeted metabolomic characterization of metabolites during the fermentation of ‘Golden Flower’ Eucommia ulmoides leaf tea[J]. Food Science, 2023, 44(10): 300-309.
[12] 王刚, 姚雷, 李正娟. 利用苦水玫瑰花渣提取总黄酮可行性分析[J]. 上海农业科技, 2019, 49(2):35-37;45.WANG G, YAO L, LI Z J. Feasibility analysis of extracting total flavonoids from bitter rose residue[J]. Shanghai Agricultural Science and Technology, 2019, 49(2): 35-37;45.
[13] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2): 248-254.
[14] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[15] 李建伟. pH示差法测定山楂中花青素的含量[J]. 长治医学院学报, 2015, 29(3): 177-179.LI J W. Determination of anthocyanin conten in crataegi fructus by pH-differential method[J]. Journal of Changzhi Medical College, 2015, 29(3): 177-179.
[16] 陆秀云, 王波, 曹佳敏, 等. 响应面法优化苦水玫瑰精油提取后废弃物中总黄酮分离纯化工艺及抗氧化活性研究[J]. 食品工业科技, 2017, 38(11): 258-265.LU X Y, WANG B, CAO J M, et al. Response surface optimization and purification technology and antioxidant activity of total flavonoids from Kushui rose oil distillation waste[J]. Science and Technology of Food Industry, 2017, 38(11): 258-265.
[17] 陶继芳, 范江平, 魏光强, 等. 均匀设计和模糊数学联用优化辣椒蘸水配方[J]. 云南农业大学学报(自然科学), 2023, 38(4): 667-672.TAO J F, FAN J P, WEI G Q, et al. Uniform design and fuzzy mathematics combined to optimize the chili dipping sauce formula[J]. Journal of Yunnan Agricultural University (Natural Science), 2023, 38(4): 667-672.
[18] JOSHI R, RANA A, GULATI A. Studies on quality of orthodox teas made from anthocyanin-rich tea clones growing in Kangra valley, India[J]. Food Chemistry, 2015, 176: 357-366.
[19] 刘晗璐, 张九凯, 韩建勋, 等. 基于UPLC-QTOF-MS代谢组学技术的NFC和FC橙汁差异成分比较[J]. 食品科学, 2021, 42(6):229-237.LIU H L, ZHANG J K, HAN J X, et al. Analysis of differential composition between not from concentrate and from concentrate orange juices using UPLC-QTOF-MS-based metabolomics[J]. Food Science, 2021, 42(6):229-237.
[20] YU F, CHEN C, CHEN S N, et al. Dynamic changes and mechanisms of organic acids during black tea manufacturing process[J]. Food Control, 2022, 132:108535.
[21] KHALIL H E, ABDELWAHAB M F, IBRAHIM H I M, et al. Cichoriin, a biocoumarin, mitigates oxidative stress and associated adverse dysfunctions on high-fat diet-induced obesity in rats[J]. Life, 2022, 12(11):1731.
[22] 朱彦凯, 刘铁重, 伍法清, 等. 代谢工程改造大肠杆菌生产肌苷[J]. 食品与发酵工业, 2022, 48(24):1-9.ZHU Y K, LIU T Z, WU F Q, et al. Metabolic engineering of Escherichia coli for inosine production[J]. Food and Fermentation Industries, 2022, 48(24):1-9.
[23] TEIXEIRA F C, GUTIERRES J M, SOARES M S P, et al. Inosine protects against impairment of memory induced by experimental model of Alzheimer disease: A nucleoside with multitarget brain actions[J]. Psychopharmacology, 2020, 237(3):811-823.
[24] EL-SHAMARKA M E A, KOZMAN M R, MESSIHA B A S. The protective effect of inosine against rotenone-induced Parkinson′s disease in mice; role of oxido-nitrosative stress, ERK phosphorylation, and A2AR expression[J]. Naunyn-Schmiedeberg′s Archives of Pharmacology, 2020, 393(6): 1041-1053.
[25] 何峰, 李科, 张晓红, 等. 不同有机氮源对发酵法生产肌苷影响的研究[J]. 中国酿造, 2018, 37(4): 88-92.HE F, LI K, ZHANG X H, et al. Effects of different organic nitrogen sources on the production of inosine by fermentation[J]. China Brewing, 2018, 37(4): 88-92.
[26] BENSALEM S, SOUBHYE J, ALDIB I, et al. Inhibition of myeloperoxidase activity by the alkaloids of Peganum harmala L. (Zygophyllaceae)[J]. Journal of Ethnopharmacology, 2014, 154(2): 361-369.
[27] 陈琳琳, 邱树毅, 罗小叶, 等. 夏秋茶发花工艺及发花过程中主要物质成分变化[J]. 食品工业, 2017, 38(9): 71-75.CHEN L L, QIU S Y, LUO X Y, et al. The fungus grow processing of summer-autumn tea and the changes of main components during the fungus growing[J]. The Food Industry, 2017, 38(9): 71-75.
[28] 胡明珍, 刘慧燕, 潘琳, 等. 基于非靶向代谢组学分析副干酪乳杆菌发酵枸杞汁各阶段代谢差异[J]. 食品科学, 2022, 43(8): 142-149.HU M Z, LIU H Y, PAN L, et al. Non-targeted metabolomics analysis of differential metabolite profiles of goji juice fermented by Lactobacillus paracasei[J]. Food Science, 2022, 43(8): 142-149.
[29] 许皓, 肖虹菲, 林家威, 等. 现代工艺六堡茶渥堆过程中茶汤色泽及主要滋味品质成分动态变化[J]. 食品与发酵工业, 2024,50(11): 317-326.XU H, XIAO H F, LIN J W et al. Dynamic changes of tea soup color and main taste quality during process of modern craft Liupao tea fermentation[J]. Food and Fermentation Industries, 2024,50(11): 317-326.
[30] CHEN H B, YU F, KANG J X, et al. Quality chemistry, physiological functions, and health benefits of organic acids from tea (Camellia sinensis)[J]. Molecules, 2023, 28(5): 2339-2339.
[31] 张舒, 王长远, 冯玉超, 等. 气相色谱-质谱联用代谢组学技术分析不同产地稻米代谢物[J]. 食品科学, 2021, 42(8): 206-213.ZHANG S, WANG C Y, FENG Y C, et al. Analysis of metabolites in rice produced in different regions by GC-MS-based metabonomics[J]. Food Science, 2021, 42(8): 206-213.
[32] LU W, SHI Y, WANG R, et al. Antioxidant activity and healthy benefits of natural pigments in fruits: A review[J]. International Journal of Molecular Sciences, 2021, 22(9): 4945.
[33] QIN H, DENG X Q, LI B C, et al. Volatiles, polysaccharides and total polyphenols in Chinese rose tea infusions and their antioxidant activities[J]. Journal of Food Processing and Preservation, 2018, 42(1): e13323.
[34] 顾秋亚, 李姝瑶, 杨文华, 等. 富含黄酮苷元沙棘叶发酵茶的制备及其生物活性[J]. 食品研究与开发, 2022, 43(24): 118-124.GU Q Y, LI S Y, YANG W H, et al. Preparation and activity of the fermented tea of seabuckthorn leaf rich in flavonoid glycosides[J]. Food Research and Development, 2022, 43(24): 118-124.
[35] 化洪苓, 尹文哲, 张智, 等. 刺五加发酵茶工艺优化及其抗氧化活性[J]. 食品科学技术学报, 2018, 36(3): 56-65.HUA H L, YIN W Z, ZHANG Z, et al. Optimization of antimicrobial process of Acanthopanax senticosus fermented tea[J]. Journal of Food Science and Technology, 2018, 36(3): 56-65.
[36] YUE Q L, WANG Z J, YU F P, et al. Changes in metabolite profiles and antioxidant and hypoglycemic activities of Laminaria japonica after fermentation[J]. LWT, 2022, 158: 113122.
[37] 谭榀新, 叶涛, 刘湘新, 等. 植物提取物抗氧化成分及机理研究进展[J]. 食品科学, 2010, 31(15): 288-292.TAN P X, YE T, LIU X X, et al. Research advances in antioxidant composition of botanical extracts and their action mechanisms[J]. Food Science, 2010, 31(15): 288-292.