大豆酸奶是一种营养健康的新兴植物基酸奶,是以大豆为主要原料,接种乳酸菌或混合其他菌株制成的发酵型植物蛋白饮品,具有零胆固醇、零反式脂肪酸、零乳糖且富含膳食纤维等优点,同时有益于肠道健康,缓解乳糖不耐受、牛乳过敏等症状[1]。大豆酸奶符合“传承以植物性食物为主、动物性食物为辅的优良膳食传统”国家发展纲要,顺应了“人民日益增长的美好生活需要”,市场应用前景广阔。
大豆是制备植物基酸奶优质的蛋白来源,其蛋白质含量高达30%~40%,含有大量的多不饱和脂肪酸和必需氨基酸,并且膳食纤维、微量元素及活性物质含量丰富[2]。大豆蛋白中的主要成分是7S和11S球蛋白,占蛋白总量的65%~80%。7S组分是分子质量约150~200 kDa的β-伴大豆球蛋白,含有约5%的糖类,是由β(~47.8 kDa)、α(~63.5 kDa)和α′(~67.2 kDa)这3个亚基通过氢键、静电相互作用和疏水相互作用组成的三聚糖蛋白[3]。11S组分是分子质量约为320~375 kDa的大豆球蛋白,由酸性亚基A(~38 kDa)和碱性亚基B(~20 kDa)通过二硫键连接形成的六聚体蛋白质[4]。
目前,大豆酸奶存在特殊的“豆腥味”,凝胶结构刚性较强,与牛奶酸奶的细腻口感存在差异,从而阻碍了大豆酸奶的发展[5]。此外,大豆中只含有一定的蔗糖、水苏糖和棉子糖等低聚糖,乳酸菌易利用的乳糖含量较少,保加利亚乳杆菌缺乏分解蔗糖、水苏糖等二糖的酶系,嗜热链球菌可以分解蔗糖,但是产酸能力弱,进而引发产酸不足[6]。因此,简单采用嗜热链球菌和保加利亚乳杆菌这一对经典的酸奶发酵剂组合,两者协同发酵的效果不佳,大豆酸奶缺乏典型发酵乳风味,并容易产生令人不快的豆腥味或馊味。
通过文献报道和前期预实验,保加利亚乳杆菌-嗜热链球菌-植物乳杆菌-益生元菊粉协同发酵,有利于降低大豆酸奶的豆腥味,然而相关机制尚不明确[7-8]。研究报道,一些发酵过程中的风味物质能与体系中的蛋白质发生相互结合,其结合能力取决于风味物质的种类、结合作用力的强弱、蛋白质的结构状态(结合位点的数目、分布、亲和力等)、体系所处环境条件(溶剂、pH值、温度、水分含量、离子强度等)等因素[9-10]。7S和11S作为大豆蛋白的2个主要组分,由于其结构的固有差异,在发酵过程中对于大豆酸奶凝胶结构、豆腥味及酸奶风味形成的相关机制还有待考证。
本研究通过盐析等电点沉淀法从大豆中分离纯化出大豆乳清、7S和11S蛋白组分,探究不同组分在乳酸菌发酵过程中pH值、酸度、乳酸菌增殖、蛋白质水解程度、粒径的变化,以及发酵产物流变特性、微观结构、挥发性化合物以及感官特性的差异,以期阐明对酸奶质地和风味形成起关键作用的组分,初步探讨大豆蛋白组分理化性质变化与豆腥味化合物的相互作用,为工业中高品质低腥味大豆酸奶的生产提供理论指导。
1 材料与方法
1.1 材料与试剂
大豆,黑龙江贡谷商贸有限公司;嗜热链球菌粉、保加利亚乳杆菌粉、植物乳杆菌粉(活菌数≥100亿cfu/g),西安聚生原生物科技有限公司;菊粉(纯度>90%),美凯威医药科技有限公司;电泳试剂盒,武汉赛维尔生物科技有限公司;邻苯二甲醛(o-phthalaldehyde,OPA)、罗丹明B,上海阿拉丁生化科技股份有限公司;MRS肉汤培养基,广东中山百微生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
SP118S破壁机,浙江绍兴苏泊尔生活电器有限公司;HH-2数显恒温水浴锅,金坛市杰瑞尔电器有限公司;PHS-3E pH计,上海仪电科学仪器股份有限公司;HC-3018R冷冻离心机,安徽中科中佳科学仪器有限公司;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;DYY-12直流稳压电泳仪,北京佳航博创科技有限公司;DNP-9052BS-Ⅲ电热恒温培养箱,上海新苗医疗器械制造有限公司;SN-CJ-2G超净工作台,上海尚仪仪器设备有限公司;UV-4802紫外分光光度计,上海尤尼柯仪器有限公司;Mastersizer 2000激光粒度仪,英国Malvern仪器有限公司;DHR-1流变仪,美国TA仪器有限公司;FV3000激光共聚焦显微镜,日本Olympus仪器有限公司;S-3700 N扫描电子显微镜,北京日立科学仪器有限公司;7890B-5977B气相色谱-质谱联用仪(GC-MS),美国安捷伦公司;PEN3型电子鼻,德国Airsense公司。
1.3 实验方法
1.3.1 大豆乳清、7S和11S蛋白组分的制备
大豆乳清、7S和11S蛋白组分的制备参考施小迪[10]的方法。
大豆乳清组分:将大豆清洗去杂,浸泡溶胀后捞出沥干,加入5倍质量的蒸馏水,使用破壁机打浆5 min,即得到生豆乳。量取100 mL生豆乳,用4 mol/L的HCl溶液调节pH值至4.5,以8 000×g离心15 min,收集上清液,用NaOH溶液调节pH值至7.3,即得大豆乳清。
11S蛋白组分:在浸泡沥干的大豆中加入10倍质量的蒸馏水,使用破壁机打浆5 min,用4 mol/L的NaOH溶液调节pH值至7.5,并于室温下搅拌1.5 h。以9 000×g离心30 min后,收集上清液,得大豆蛋白提取液。在提取液中添加0.98 g/L的NaHSO3溶液,调节pH值至6.4,冰浴过夜。再以6 500×g离心30 min,分别收集沉淀和上清液。将沉淀水洗2遍后加水复溶,调节pH值至7.3左右,得到11S组分。
7S蛋白组分:将上步反应中的上清液以NaCl调整离子强度达0.25 mol/L,调节pH值至5.0,放置1 h,以9 000×g离心30 min,得上清液。将上清液用冰水稀释至2倍,调节pH值至4.8,再以6 500×g离心30 min,收集沉淀。将沉淀水洗2遍后加水复溶,调节pH值至7.3左右,得到7S蛋白组分。
将提取的大豆乳清、7S和11S蛋白组分用截留分子质量为10 kDa的透析袋在4 ℃下透析24 h,冷冻干燥,得到固体冻干粉,备用。
1.3.2 SDS-PAGE凝胶电泳
将提取的大豆乳清、7S和11S蛋白配制成5 mg/mL的溶液,备用。按照试剂盒说明书配制质量分数为12%的分离胶和质量分数为5%的浓缩胶。将样品与上样缓冲液1∶1(体积比)混合后,沸水浴蒸煮10 min,冷却后取20 μL上样。接通电泳仪,浓缩胶电压设置为90 V,进入分离胶后改为120 V,直至溴酚蓝距离凝胶底部0.5 cm左右结束电泳,关闭电源,起胶。将凝胶置于培养皿中,用考马斯亮蓝R-250染色,并用脱色液(40%甲醇和10%冰醋酸,体积分数)洗脱3~4次,直至背景清晰。
1.3.3 大豆乳清、7S和11S蛋白乳酸菌发酵产物制备
不同大豆蛋白组分乳酸菌发酵产物的制备参数参考先前的研究结果以及CHUN等[11]的方法。将大豆乳清、7S和11S蛋白分别配制成100 g/L的溶液,置于100 mL洁净的发酵瓶中,加入60 g/L的菊粉,搅拌至溶解后,置于70 ℃水浴锅中加热30 min灭菌,待冷却至室温,接入0.4 g/L植物乳杆菌、24 g/L嗜热链球菌和6 g/L保加利亚乳杆菌,于37 ℃恒温培养箱中发酵10 h达到发酵终点,即获得大豆乳清、7S和11S蛋白乳酸菌发酵产物。
1.3.4 pH值和酸度测定
对不同发酵时间(2、4、6、8、10 h)的大豆乳清、7S和11S蛋白发酵产物进行取样。使用pH计测定不同样品的pH值。参照国标GB 5009.239—2016《食品安全国家标准 食品酸度的测定》的方法进行酸度测定。
1.3.5 乳酸菌增殖检测
1.3.5.1 乳酸菌增殖曲线测定
制备液体培养基:1 000 mL水中加入54 g的MRS培养基,搅拌加热煮沸至完全溶解,每支试管分装10 mL,120 ℃高压蒸汽灭菌15 min;
制备样品:对不同发酵时间的大豆乳清、7S和11S蛋白发酵产物进行取样。5 000 r/min离心15 min后,收集上清液。
接种样品:在超净工作台中,取适量上清液接种于液体培养基中,置于恒温箱中37 ℃培养24 h。
检测:取出后稀释样品,用紫外分光光度计在600 nm处检测OD值,以未加样品的液体培养基做空白对照。
1.3.5.2 乳酸菌菌落形态与数量检测
在相同的实验条件下,配制固体MRS培养基,取发酵10 h后的大豆乳清、7S和11S蛋白发酵产物上清液,梯度稀释至10-6、10-7。取100 μL稀释后的样品,均匀涂布于培养皿中,倒置后,在37 ℃恒温培养箱内培养48 h,观察乳酸菌菌落生长形态并进行计数。
1.3.6 蛋白水解活力测定
采用OPA法测定不同发酵时间下大豆乳清、7S和11S蛋白发酵产物的蛋白水解活力[12]。首先,配制OPA试剂:将80 mg OPA溶解于2 mL甲醇,加入200 μL的β-巯基乙醇,再加入50 mL 100 mmol/L四硼酸钠溶液以及5 mL 20%(质量分数)十二烷基硫酸钠溶液,混合均匀后,用去离子水定容至100 mL。取2 mL发酵样品和1 mL去离子水混匀,加入5 mL 0.75 mol/L三氯乙酸混合均匀,静置10 min后,4 000×g离心10 min,收集上清液。取200 μL上清液,加入4 mL 的OPA试剂,混匀,室温下反应10 min后于340 nm波长处测定吸光度。以去离子水作为对照。
1.3.7 平均粒径测定
通过激光粒度仪测定大豆乳清、7S和11S蛋白发酵过程中粒径的变化。取10 mL发酵后的样品分散于蒸馏水中,颗粒折射率为1.45,颗粒吸收率为0.001,分散剂为水,分散剂折射率为1.33。使用体积平均直径D(4,3)表示平均粒径。
1.3.8 流变特性测定
使用DHR-1流变仪测定大豆乳清、7S和11S蛋白发酵液的静态剪切流变学特性。打开流变仪,选用直径40 mm的平板夹具,设定测试间距为1 mm,取适量的样品放置在平台上,使夹具下降至所设高度刮边,测试温度为25 ℃,剪切速率为0.01~100 1/s,测定剪切应力和表观黏度随剪切速率的变化情况。
1.3.9 扫描电镜观察
通过扫描电子显微镜观察发酵样品的微观结构。将大豆蛋白乳清、7S、11S蛋白发酵液样品均匀薄涂在培养皿内壁上,在液氮中冷冻后迅速放入真空冷冻干燥机中进行干燥处理,然后采用离子溅射方法镀金,进行扫描电镜制片,在电子加速电压为30 kV,放大倍数为5 000×下扫描观察样品。
1.3.10 激光共聚焦显微镜检测
参考何玉洁[13]的方法,对大豆乳清、7S、11S蛋白发酵液进行激光共聚焦显微镜观察,略作修改。首先,配制质量浓度为0.12 g/L的罗丹明B水溶液。然后,吸取50 μL荧光染液加入到10 g样品中混合均匀,收集图像前置于4 ℃冰箱约l h。将染色后的混合样品置于带凹槽的载玻片中心,小心盖上盖玻片,避免产生气泡,且涂覆硅油以防止水分蒸发。设置荧光样品的激发光波长为544 nm,发射波长为576 nm,用激光共聚焦显微镜观察并对共聚焦图像进行拍照。
1.3.11 挥发性化合物检测
固相微萃取:取2 mL样品与0.44 g NaCl置于20 mL顶空瓶中,密封后在50 ℃水浴下孵育15 min,然后采用二乙烯基苯/羧基/聚二甲基硅氧烷固相微萃取纤维头,对样品中挥发性化合物萃取30 min。
气相色谱条件:色谱柱为DB-WAX(30 m×0.25 mm,0.25 μm);进样温度:250 ℃,解吸5 min;不分流;载气:氦气(99.999%);流量:1 mL/min;柱温:40 ℃保持5 min,以5 ℃/min升至220 ℃,以20 ℃/min升至250 ℃保持2.5 min。
质谱条件:接口温度:260 ℃;离子源温度:230 ℃;四级杆温度:150 ℃;电离方式:EI+,70 eV;扫描方式:全扫描;质量范围:29~400。
1.3.12 电子鼻的测定
参考葛晓佳等[14]的方法,使用PEN3型电子鼻对大豆乳清、7S和11S蛋白发酵产物的气味进行分析,略作修改。将5 mL样品置于20 mL顶空瓶中并封口,50 ℃水浴孵育30 min。电子鼻数据采集时间90 s,载气为干燥洁净的空气,内部流量400 mL/min,进样流量400 mL/min,样品准备时间5 s,传感器清洗时间180 s,每个样品重复测定3次,取平均值。测定时保持室温20 ℃,且测定环境无异味。电子鼻传感器的性能描述如表1所示。
表1 电子鼻10种气敏传感器阵列的特征描述
Table 1 Characterization of ten kinds of gas sensor arrays of electronic nose
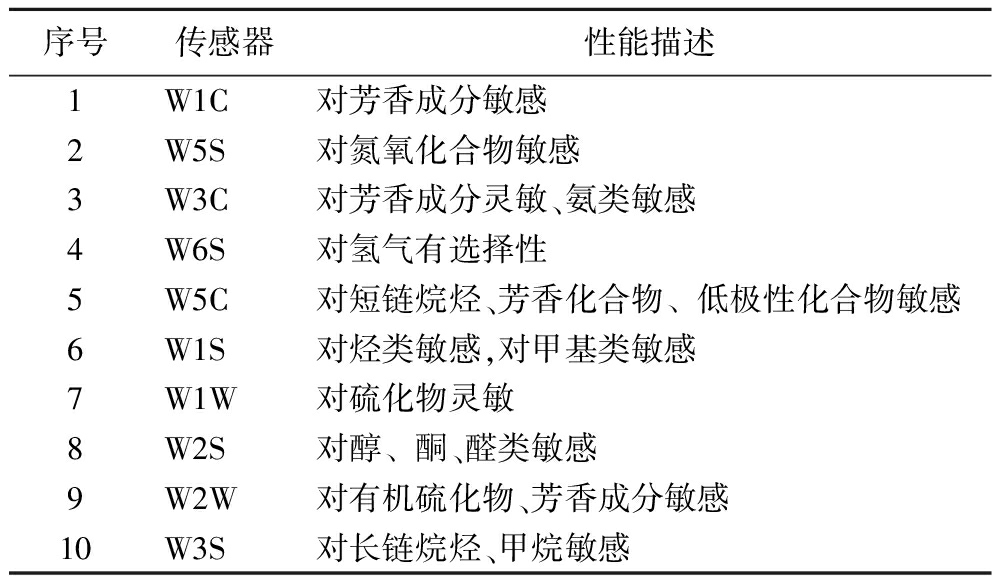
序号传感器性能描述1W1C对芳香成分敏感2W5S对氮氧化合物敏感3W3C对芳香成分灵敏、氨类敏感4W6S对氢气有选择性5W5C对短链烷烃、芳香化合物﹑低极性化合物敏感6W1S对烃类敏感,对甲基类敏感7W1W对硫化物灵敏8W2S对醇﹑酮、醛类敏感9W2W对有机硫化物、芳香成分敏感10W3S对长链烷烃、甲烷敏感
1.3.13 感官评价
大豆乳清、7S和11S蛋白发酵产物的感官评价参考赵泰霞等[15]的方法,略作修改。选出12位评价员组成评价小组,其中女性6位、男性6位,该小组成员事先都接受过大豆酸奶风味评价训练,分别从色泽、口感、组织状态和气味等方面对样品进行感官评价。感官评分标准见表2所示。
表2 感官评分标准表
Table 2 Sensory score standard

项目评价指标评分/分色泽乳白色或微黄色,色泽均匀,有光泽浅黄色,色泽均匀,光泽度略差色泽不均一,光泽度差8~104~71~3口感口感细腻,酸甜适中口感适中,稍酸或稍甜口感粗糙,过酸或过甜8~104~71~3组织状态质地均匀细腻质地不均匀质地粗糙8~104~71~3气味几乎无豆腥味,气味协调轻微豆腥味,气味不协调豆腥味严重且有异味8~104~71~3整体喜好度非常喜好比较喜好不喜好8~104~71~3
1.4 数据处理与分析
每一组实验至少重复3次,实验结果用平均值(mean)±标准差(SD)表示,采用Excel 2010软件进行数据处理,使用Origin软件进行作图。采用SPSS 22.0软件进行实验数据单因素方差分析,P<0.05为显著差异。
2 结果与分析
2.1 SDS-PAGE蛋白质凝胶电泳结果
采用SDS-PAGE蛋白质凝胶电泳对大豆乳清、7S和11S蛋白组分及分子质量进行表征。如图1所示,大豆乳清中蛋白质含量较少,主要集中在95 kDa附近,7S蛋白组分在71、67、50 kDa附近有明显的3条条带,主要是其α′、α和β这3个亚基,而在11S蛋白组分中也发现其特有的碱性亚基和酸性亚基,这与过去报道的大豆7S和11S蛋白组分亚基分布与分子质量大致相同[16]。采用SDS-PAGE蛋白质凝胶电泳实验,证明已成功从大豆蛋白中分离出大豆乳清、7S和11S蛋白组分。
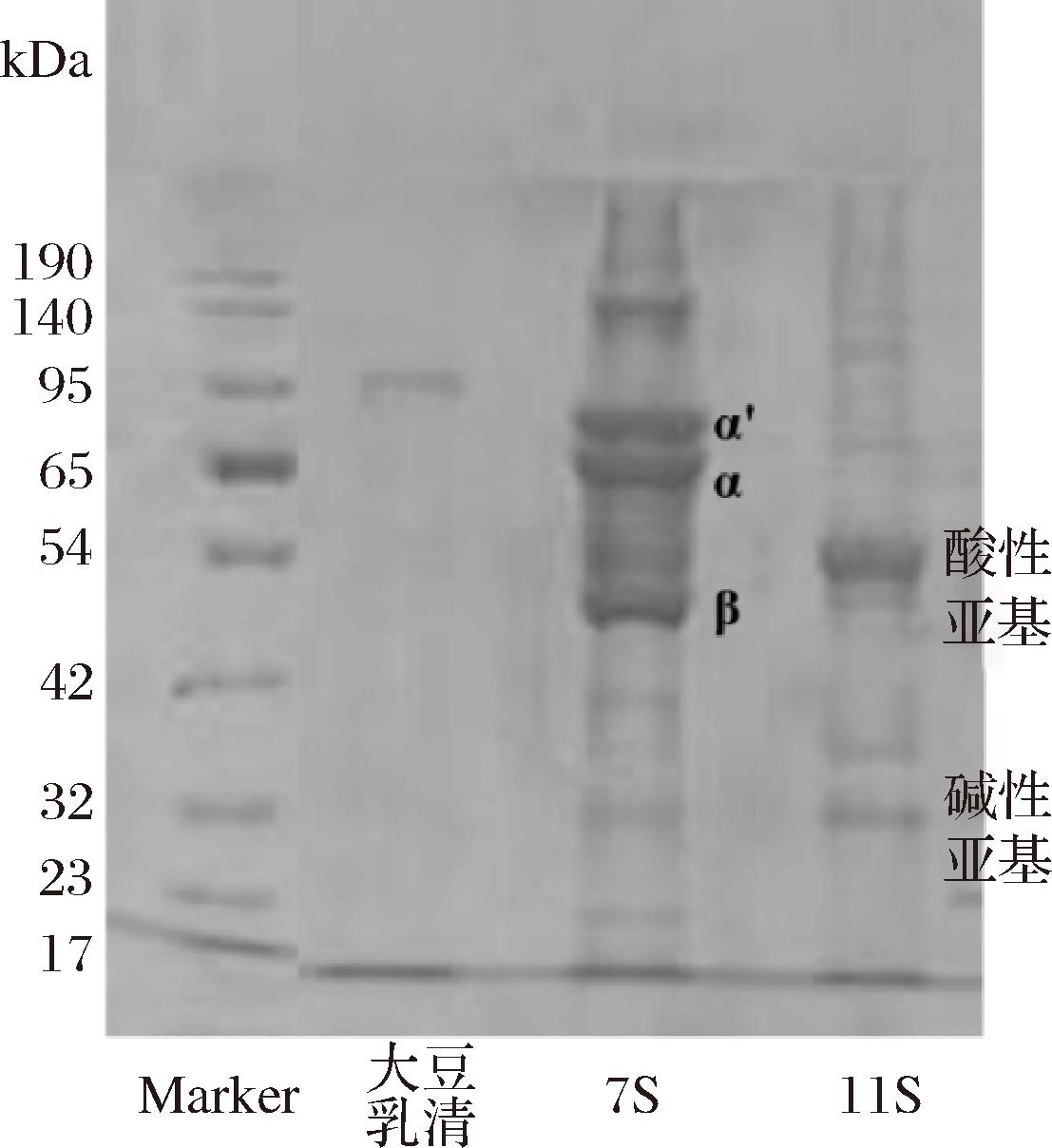
图1 大豆乳清、7S和11S蛋白组分SDS-PAGE蛋白质凝胶电泳图
Fig.1 SDS-PAGE protein gel electrophoresis of soybean whey, 7S and 11S protein components
2.2 pH值和酸度的变化
大豆乳清、7S和11S蛋白发酵过程中pH值和酸度的变化如图2所示。随着发酵时间的延长,不同组分发酵产物的pH值显著(P<0.05)下降,而可滴定酸显著(P<0.05)增加。发酵结束后,11S组分发酵产物的pH值最低,为4.63,可滴定酸度值最高,为58.59 °T;大豆乳清组分发酵产物pH值最高,为4.95,可滴定酸度值最低,为52.73 °T。pH值和酸度是影响大豆酸奶品质的重要理化因子,pH的降低和可滴定酸度的升高主要是由于乳酸菌利用大豆组分中的碳水化合物及外源菊粉发酵产生了乳酸等有机酸[17]。当pH降低到等电点附近,蛋白质表面电荷得到了中和,将有利于蛋白质絮凝沉淀形成酸奶的凝胶结构。当发酵10 h时,11S蛋白组分发酵产物的pH值最低,酸度值最高,表明11S蛋白组分更利于乳酸菌发挥产酸能力,有利于大豆酸奶凝胶结构的形成。
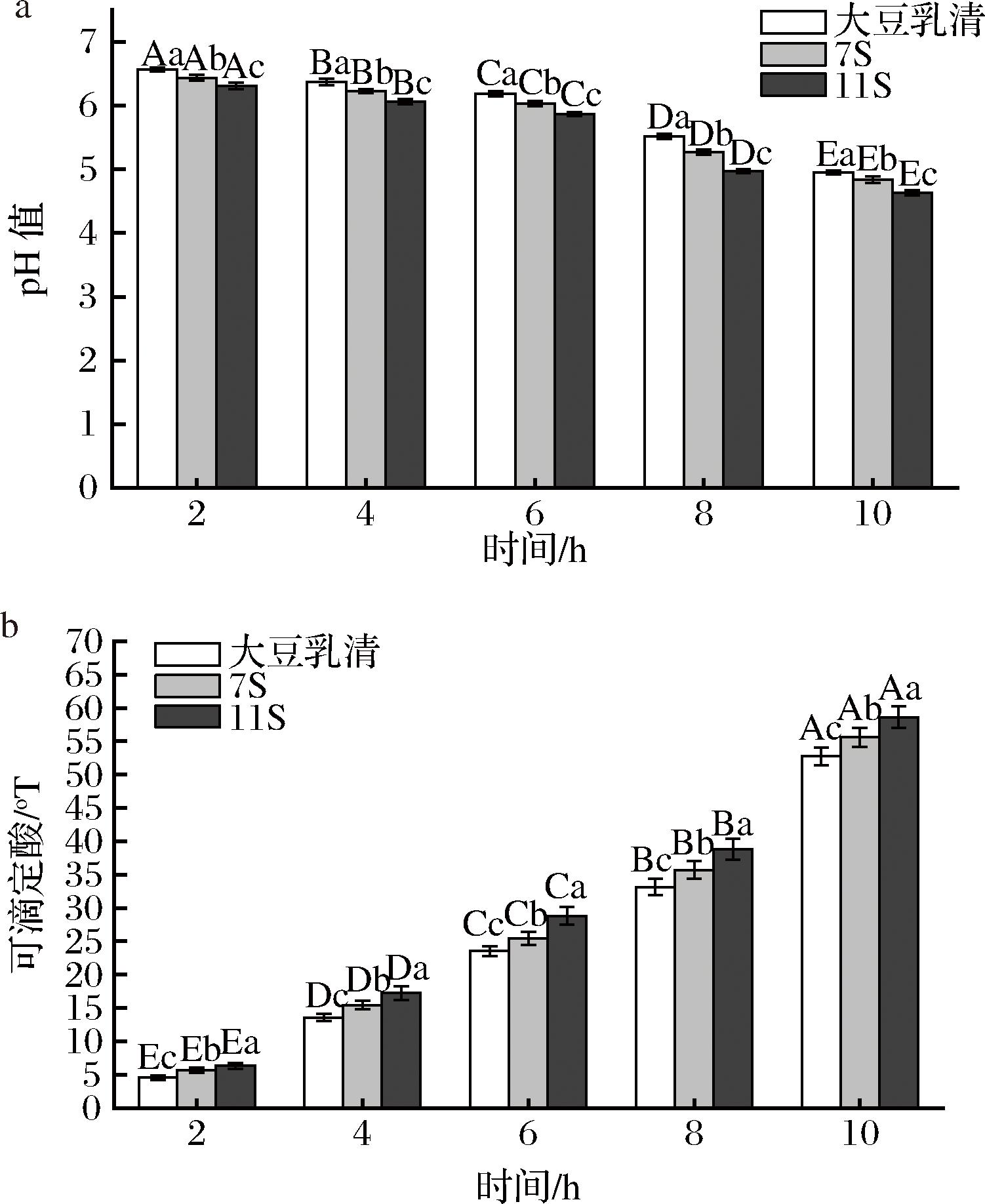
a-pH值;b-可滴定酸
图2 大豆乳清、7S和11S蛋白发酵过程中pH值和酸度的变化
Fig.2 Changes in pH and acidity of soybean whey, 7S and 11S protein during fermentation
注:不同的大写字母表示不同发酵时间下同一样品数据差异显著(P<0.05),不同的小写字母表示不同大豆蛋白组分同一时间下发酵产物样品数据差异显著(P<0.05)(下同)。
2.3 乳酸菌的增殖
大豆乳清、7S和11S蛋白发酵产物乳酸菌增殖曲线如图3所示。随着发酵时间的延长,不同组分发酵产物的OD值显著(P<0.05)增加,并且逐渐趋于平缓,说明乳酸菌随着发酵时间的延长而不断增殖。大量的研究证明,菊粉作为一种益生元能够促进保加利亚乳杆菌、嗜热链球菌和植物乳杆菌的增殖,并且可以提高乳酸菌的活力[18-19]。此外,乳酸菌中存在蛋白水解系统,其胞外蛋白酶可以将大分子蛋白水解成多肽,接着转移系统将降解产物转运通过细胞质膜,而细胞内的多种肽酶可以将转运进入细胞的多肽进一步水解成游离氨基酸,这些氨基酸最终会被代谢或用于蛋白质的合成[20]。其中,11S蛋白发酵产物的OD值始终大于7S蛋白和大豆乳清,说明11S蛋白可能更有利于被乳酸菌代谢来促进其增殖。
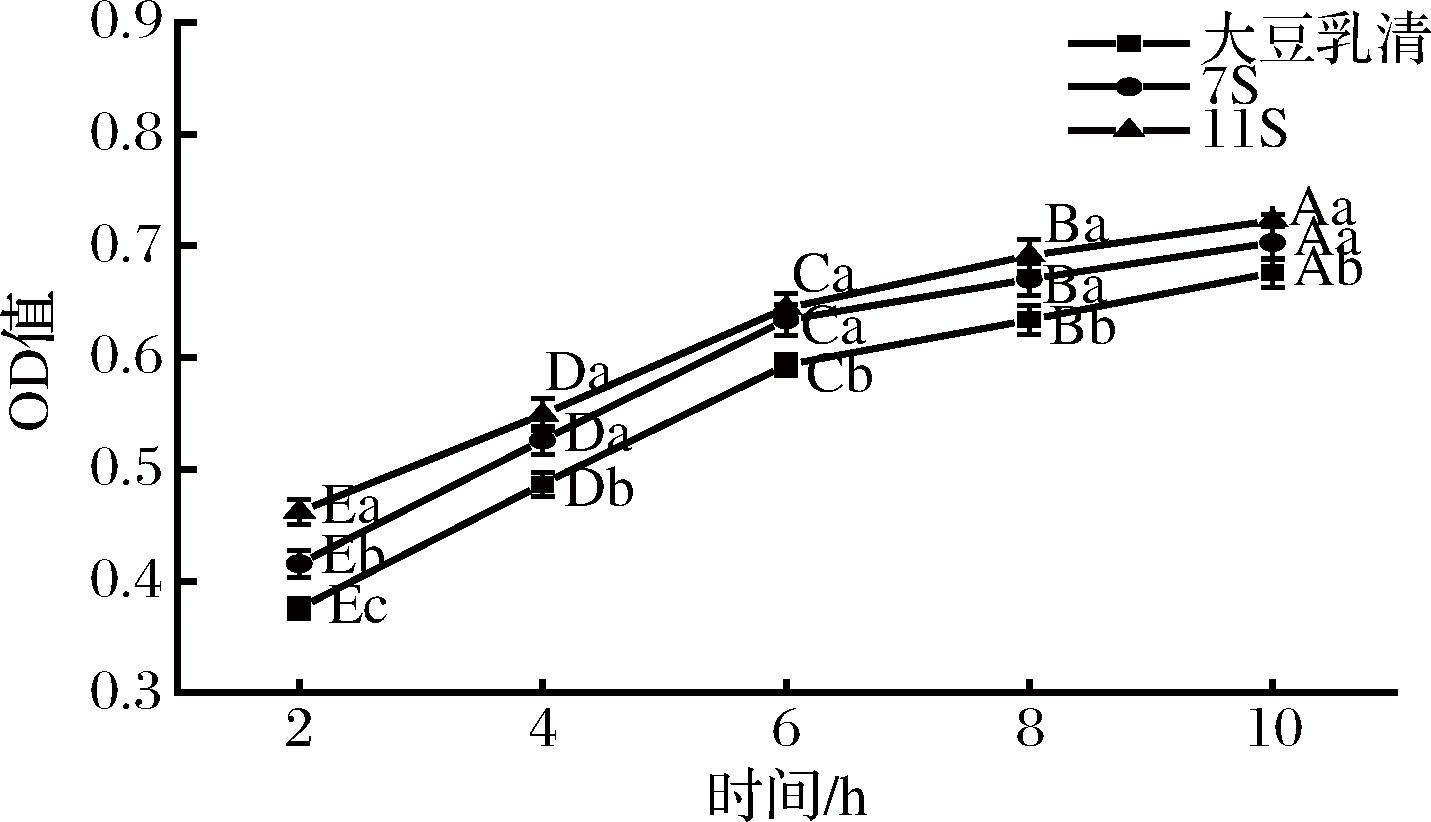
图3 大豆乳清、7S和11S蛋白发酵产物乳酸菌增殖曲线
Fig.3 Proliferation curve of lactic acid bacteria from soybean whey, 7S and 11S protein fermentation products
不同蛋白组分发酵产物在MRS固体培养下乳酸菌的菌落形态和数量如图4所示。乳酸菌的菌落形态大致呈现小短杆,圆形,中心突起,乳白色,边缘整齐,结果与先前的报道类似[21]。当样品的稀释倍数达到10-6时,大豆乳清、7S和11S蛋白发酵产物的乳酸菌菌落数分别为103、156和290;当样品的稀释倍数达到10-7时,乳酸菌菌落数则分别为21、24和251。这一结果进一步说明11S蛋白组分在大豆酸奶发酵过程中有利于促进乳酸菌的增殖,乳酸菌活菌数量的增加将会产生更多有益的代谢产物。

图4 大豆乳清、7S和11S蛋白发酵产物的乳酸菌菌落形态与数量
Fig.4 Morphology and quantity of lactic acid bacteria in soybean whey, 7S and 11S protein fermentation products
2.4 蛋白水解活力的变化
基于OPA的分光光度法检测大豆蛋白不同组分水解后释放的游离氨基,从而表征蛋白质的水解活力。如图5所示,随着发酵时间的延长,大豆乳清、7S和11S蛋白的水解活力逐渐增加,水解活力的大小关系呈现出11S蛋白>7S蛋白>大豆乳清。在发酵10 h时,11S蛋白水解度达到最大,显著(P<0.05)高于其他组分。研究报道,保加利亚乳杆菌与嗜热链球菌等复合发酵剂通常具有较强的蛋白水解活性,其一系列蛋白酶和肽酶可催化底物蛋白降解为丙氨酸、苏氨酸、甘氨酸、丝氨酸和半胱氨酸等多种氨基酸,它们经过各自固有的生物途径代谢为丙酮酸,最后可转化为乳酸[20]。在益生元菊粉的促进作用下,植物乳杆菌、嗜热链球菌和保加利亚乳杆菌产生的蛋白酶,可以作用于不同大豆蛋白组分的肽键,使其水解生成小分子的多肽和氨基酸。其中,11S蛋白发酵产物水解程度最大,说明11S蛋白可能具有较多的蛋白酶作用位点。
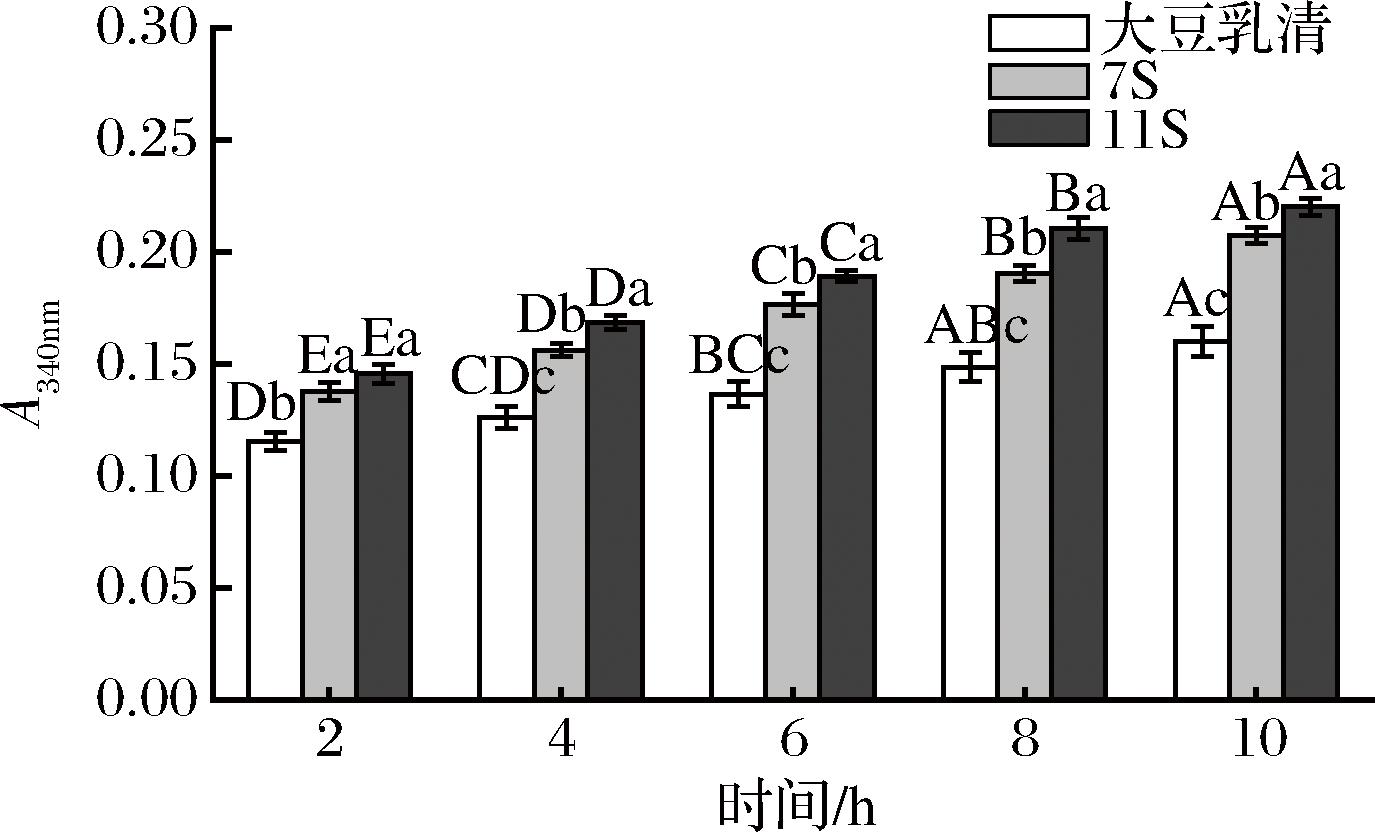
图5 大豆乳清、7S和11S蛋白发酵过程中蛋白水解活力的变化
Fig.5 Changes of proteolytic activity of soybean whey, 7S and 11S protein during fermentation
2.5 粒径的变化
大豆乳清、7S和11S蛋白发酵过程中平均粒径的变化如图6所示。随着发酵时间的延长,大豆乳清、7S和11S蛋白的平均粒径显著(P<0.05)增加,平均粒径的大小关系为11S蛋白>7S蛋白>大豆乳清。在发酵10 h时,11S蛋白发酵产物粒径达到最大,为59.33 μm,显著(P<0.05)高于其他组分。当植物乳杆菌、嗜热链球菌、保加利亚乳杆菌和菊粉协同发酵时会产生乳酸等有机酸,降低体系的pH,当pH接近蛋白质的等电点附近时,蛋白质分子表面的电荷被中和,导致蛋白质之间的静电排斥作用降低,然后通过疏水作用相互聚集形成絮凝,使体系的粒径增大[22]。平均粒径的大小关系说明11S蛋白在发酵过程中更容易发生絮凝沉淀,形成较大分子的颗粒,这对大豆酸奶凝胶结构的形成起到积极作用。这一结果与PANG等[23]的报道一致,大豆11S球蛋白中存在比7S更多的巯基,有利于促进由二硫键稳定的大聚集体的产生,此外,11S比7S具有更高的疏水性,也能诱导形成更大的颗粒。
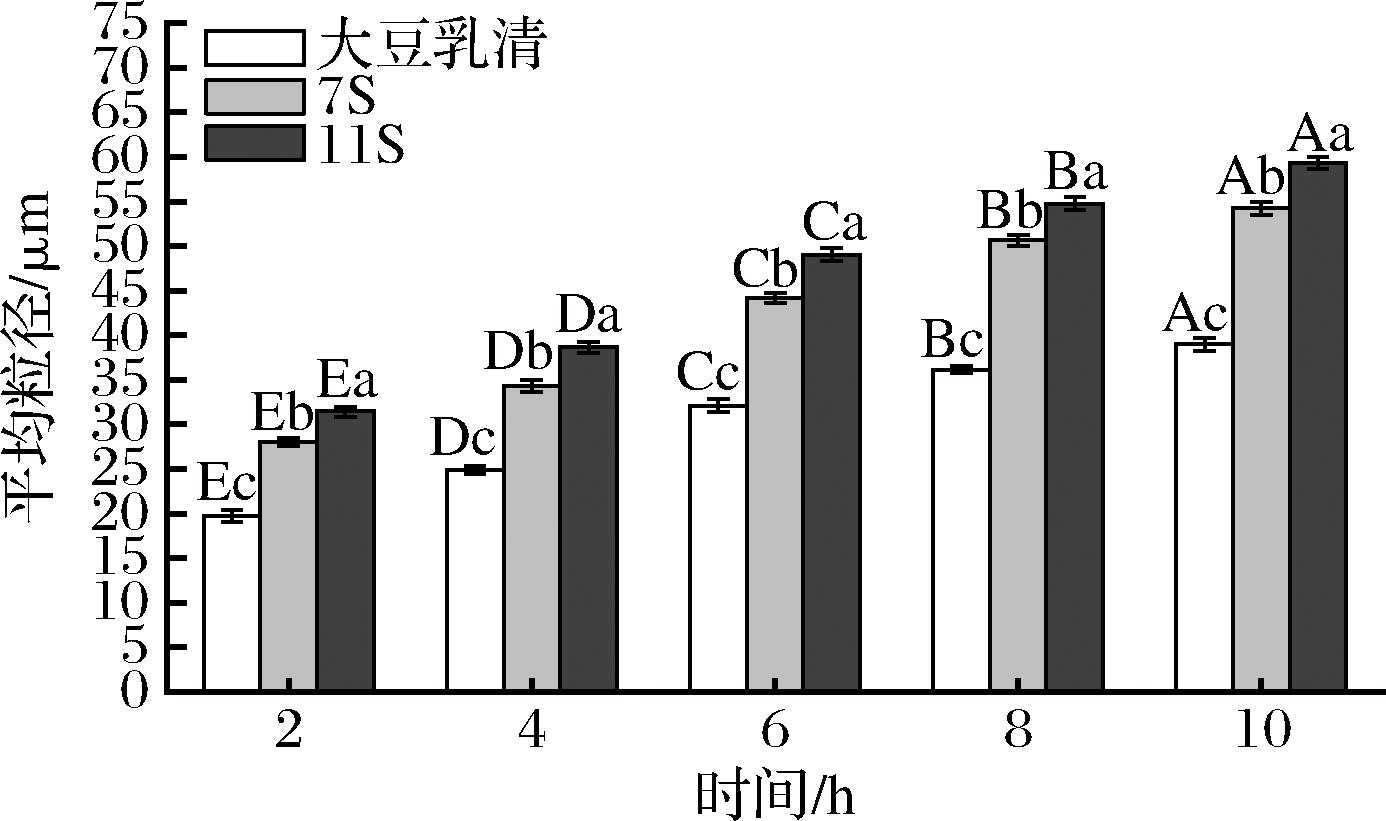
图6 大豆乳清、7S和11S蛋白发酵过程中平均粒径的变化
Fig.6 Changes of average particle size of soybean whey, 7S and 11S protein during fermentation
2.6 流变特性的变化
大豆乳清、7S和11S蛋白发酵产物的流变特性如图7所示。随着剪切速率的升高,剪切应力逐渐增大,且在较高剪切速率下趋于稳定,表观黏度则随剪切速率的增大而减小,不同组分的发酵产物均表现出典型的剪切稀化非牛顿流体的特性[24]。同时,剪切应力-剪切速率曲线与表观黏度-剪切速率曲线的斜率呈现出11S蛋白>7S蛋白>大豆乳清,说明不同组分发酵产物的黏稠程度具有一定的差异,11S蛋白发酵产物的黏稠程度最高。结合上述实验结果,可能是乳清组分中蛋白质含量少且整体稀疏,而11S蛋白发酵物中蛋白质凝聚状态更佳,蛋白质表面电荷得到了中和,产生絮凝,从而黏稠度较高。此外,11S蛋白发酵物中植物乳杆菌等乳酸菌增殖数量较大,植物乳杆菌生长代谢过程分泌的胞外多糖也有利于提高产物的黏度[25]。
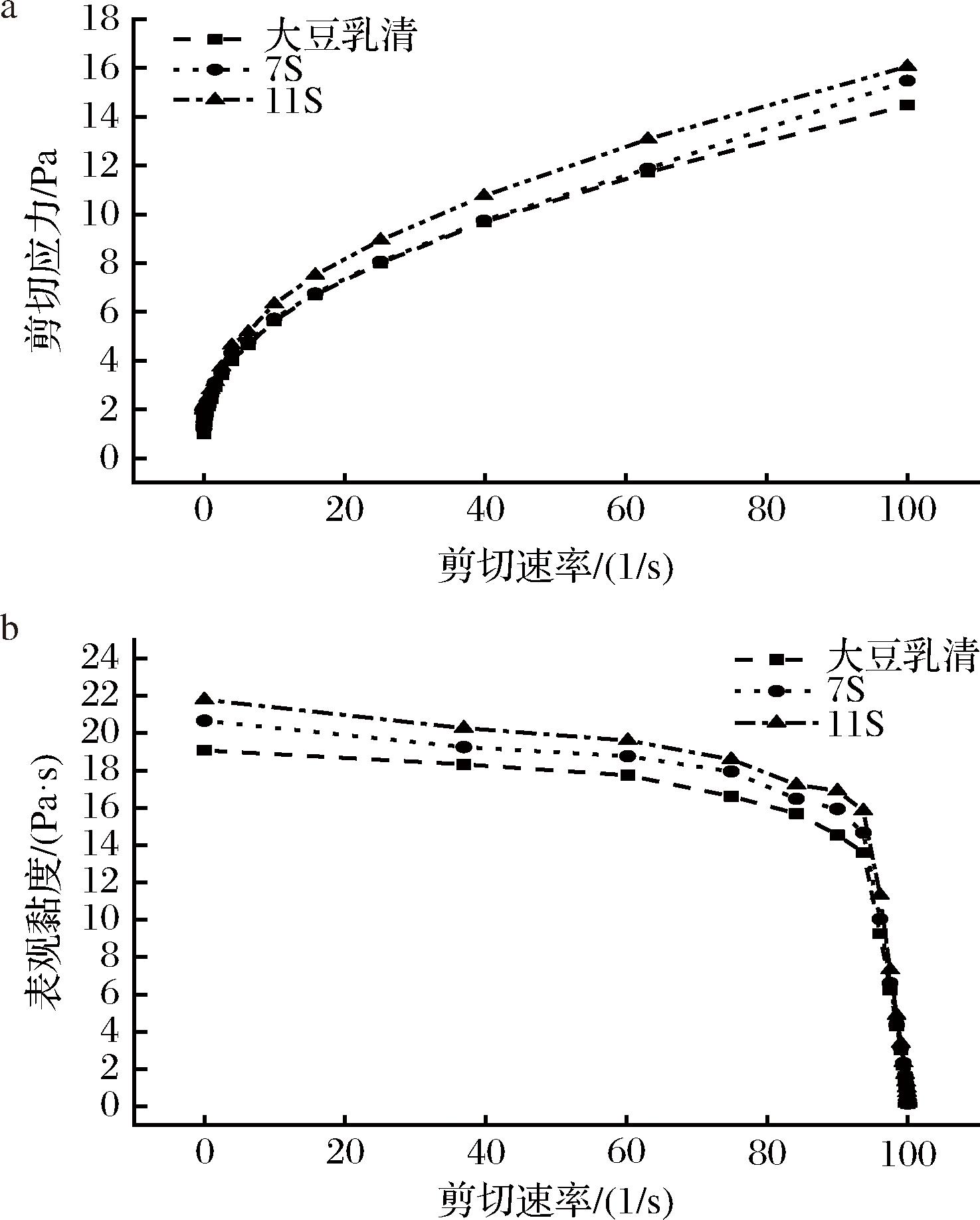
a-剪切应力;b-表观黏度
图7 大豆乳清、7S和11S蛋白发酵产物的流变特性
Fig.7 Rheological properties of soybean whey, 7S and 11S protein fermentation products
2.7 扫描电镜微观结构分析
大豆乳清、7S和11S蛋白发酵产物扫描电镜结果如图8所示。不同发酵产物中的蛋白质组分都凝聚形成了具有片层结构的蛋白质颗粒,但是并未观察到蛋白颗粒形成三维交联网络结构,酸奶的网状结构可能是多组分共同相互作用的结果。同时,三者的电镜微观结构表现出一定的差异,大豆乳清发酵产物蛋白质颗粒整体凝聚较为稀疏,且表面较为光滑,7S和11S蛋白发酵产物蛋白质颗粒凝聚较为紧密,且颗粒表面较为粗糙,含有较多的空隙。有研究报道,11S比7S具有更多的巯基和更高的疏水性,这可能导致形成大的蛋白质簇,且粗糙的空隙结构有利于为大豆酸奶提供更高的持水力和更好的流变性能[23]。

图8 大豆乳清、7S和11S蛋白发酵产物扫描电镜图
Fig.8 Scanning electron microscopy of soybean whey, 7S and 11S protein fermentation products
2.8 激光共聚焦显微镜微观结构分析
大豆乳清、7S和11S蛋白发酵产物激光共聚焦显微镜结果如图9所示。经过罗丹明B染色后,蛋白质在显微照片上呈现红色,而凝胶网络中的间隙呈现黑色。在3个样品中,大豆乳清发酵产物的空隙最大,结构更疏松,具有较弱的多孔凝胶结构,7S和11S蛋白组分的结构都更为紧密,且孔隙明显变小,但7S组分结构均一性较差,11S组分发酵产物的凝聚状态最为紧密与均匀,发酵状态最稳定。这一结果与ZHOU等[26]的报道类似,11S组分的等电点(4.9)大于7S组分(4.8),发酵过程中可以产生较大的静电斥力,有利于阻止蛋白质颗粒随机聚集,同时限制了蛋白凝胶的相分离。此外,植物乳杆菌发酵有利于提高大豆分离蛋白凝胶结构,使其更致密均匀、硬度更高[27]。同时,添加菊粉制备的大豆酸奶表面光滑、致密、规则,可能由于菊粉的增稠作用降低了蛋白质的流动性[28]。

图9 大豆乳清、7S和11S蛋白发酵产物激光共聚焦显微镜图
Fig.9 Laser confocal microscopy of soybean whey, 7S and 11S protein fermentation products
2.9 挥发性化合物分析
大豆乳清、7S和11S蛋白发酵产物的挥发性化合物如图10所示,主要包括10种醛类、11种酮类、14种醇类、3种酸类、1种酯类和4种呋喃类化合物。大豆中固有的豆腥味主要来自脂肪氧合酶催化亚油酸、亚麻酸等多不饱和脂肪酸的氧化,包括己醛、戊醛、(E)-2-己烯醛、(E)-2-庚烯醛、苯甲醛、(E,E)-2,4-癸二烯醛、1-戊醇、1-己醇、1-辛烯-3-醇、乙酸和2-戊基呋喃等,表现出令人不快的“青草味”和“油脂氧化味”[29-30]。2-庚酮、2-辛酮和2-壬酮等酮类化合物具有理想的黄油、奶油或水果香气,这些香气化合物主要来自亚油酸的生物转化,并有助于形成大豆发酵酸奶的香气[31]。此外,2,3-丁二酮、2,3-戊二酮和乙偶姻等化合物来源于乳酸菌的丙酮酸代谢途径,是形成酸奶香气的主要原因[32]。经GC-MS分析,7S蛋白经发酵后能产生较多的酸奶特征香气化合物,如2-己酮、2-辛酮、2-壬酮、2,3-丁二酮、2,3-戊二酮和乙偶姻,而11S组分发酵后则会产生较多的己醛、戊醛、(E)-2-庚烯醛、(E)-2-己烯醛、1-己醇、1-戊醇、1-辛烷-3-醇、苯甲醛、乙酸和2-戊基呋喃等豆腥味化合物。研究发现,在大豆酸奶制备过程中11S蛋白组分与豆腥味化合物具有较强的亲和力,可以提供更多的结合位点与己醛、戊醛和戊醇等物质结合,主要是由于末端氨基和羧基能与豆腥物质以氢键、静电作用、范德华力和疏水作用发生牢固结合,从而降低乳酸菌对其的降解[10]。此外,发酵终点pH值的不同会对7S与11S蛋白结构状态产生不同程度的影响,可能引起蛋白与风味物质结合位点的数目、分布、亲和力的改变,造成2种组分发酵物气味的差异。

图10 大豆乳清、7S和11S蛋白发酵产物的挥发性化合物热图
Fig.10 Heat maps of volatile compounds in soybean whey, 7S and 11S protein fermentation products
2.10 电子鼻分析
电子鼻是一种客观、准确、快捷、重复性好的风味无损检测技术,其传感器信号强度可以反映样品中挥发性风味物质浓度的差异。如图11所示,通过电子鼻对大豆乳清、7S和11S蛋白发酵产物的挥发性化合物进行检测,W2S的信号强度最强,而其余信号强度较低且无显著性(P>0.05)差异,信号强度值普遍低于或保持在1.0附近。结果说明,3种不同组分的发酵产物中挥发性化合物主要是醛类、酮类和醇类化合物,几乎未产生氮氧化合物、短链烷烃、芳香烃类、有机硫化物等芳香化合物,与GC-MS的检测结果一致。同时,W2S的信号强度大小关系为11S蛋白发酵物>7S蛋白发酵物>大豆乳清发酵物,说明11S蛋白发酵物中含有的醛、酮、醇类化合物总含量最高,可能主要是己醛、戊醛、(E)-2-庚烯醛、(E)-2-己烯醛、1-己醇、1-戊醇、1-辛烷-3-醇、苯甲醛等豆腥味化合物。
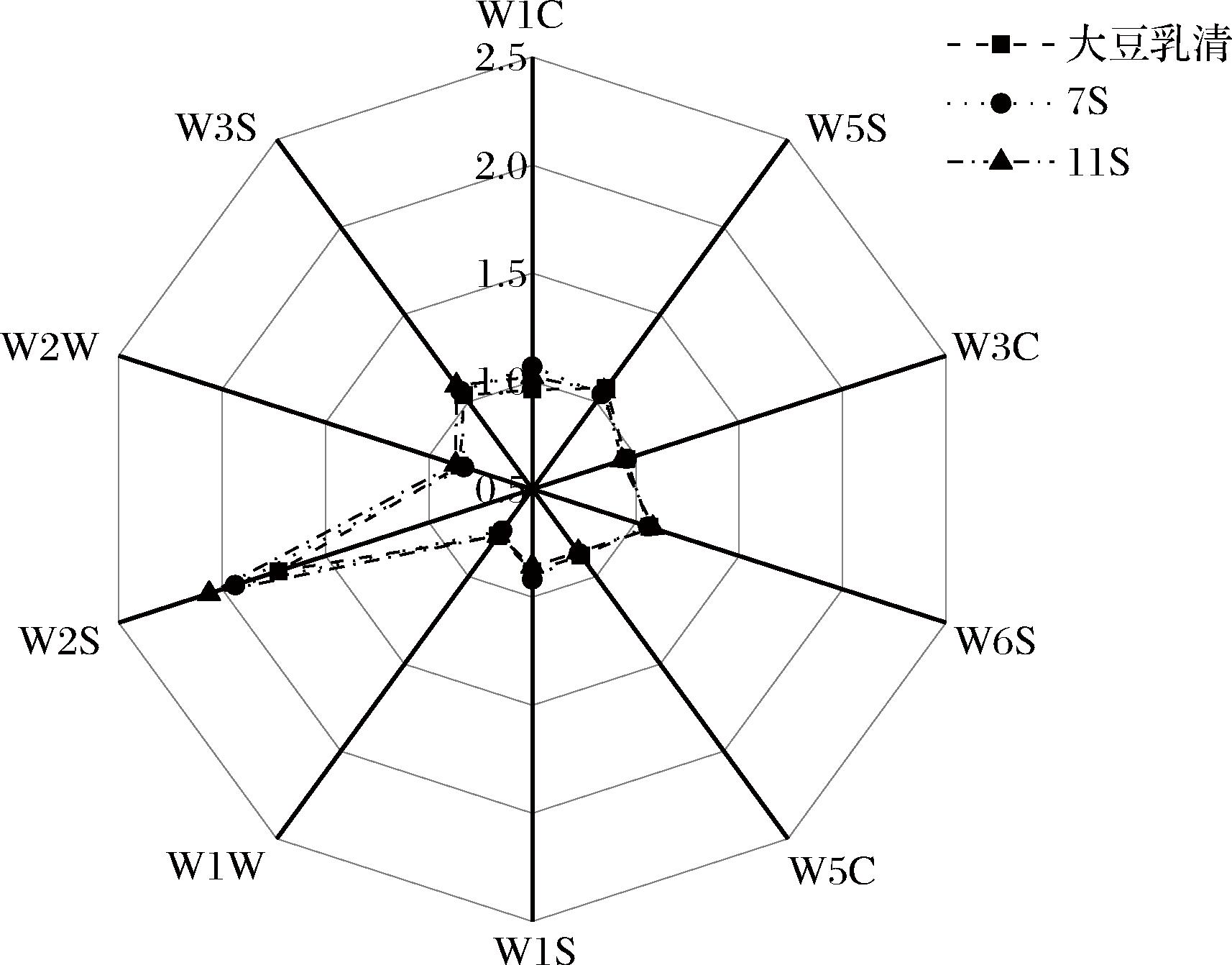
图11 不同发酵产物挥发性化合物的电子鼻雷达图
Fig.11 Electronic nose radar map of volatile compounds from different fermentation products
对大豆乳清、7S和11S蛋白发酵产物的挥发性化合物进行主成分分析,其结果如图12所示。主成分1(PC1)贡献率为56%,主成分2(PC2)贡献率为28%,2个主成分的累计贡献率达到84%,基本可以有效反映出绝大部分原始数据。同时,同一组分的发酵样品相互聚类在一起,不同组分的发酵样品在坐标系中相对分散,说明大豆中不同组分发酵产物的风味特点存在显著差异,大豆酸奶风味的形成是大豆乳清、7S和11S蛋白组分在发酵过程中共同作用的结果。
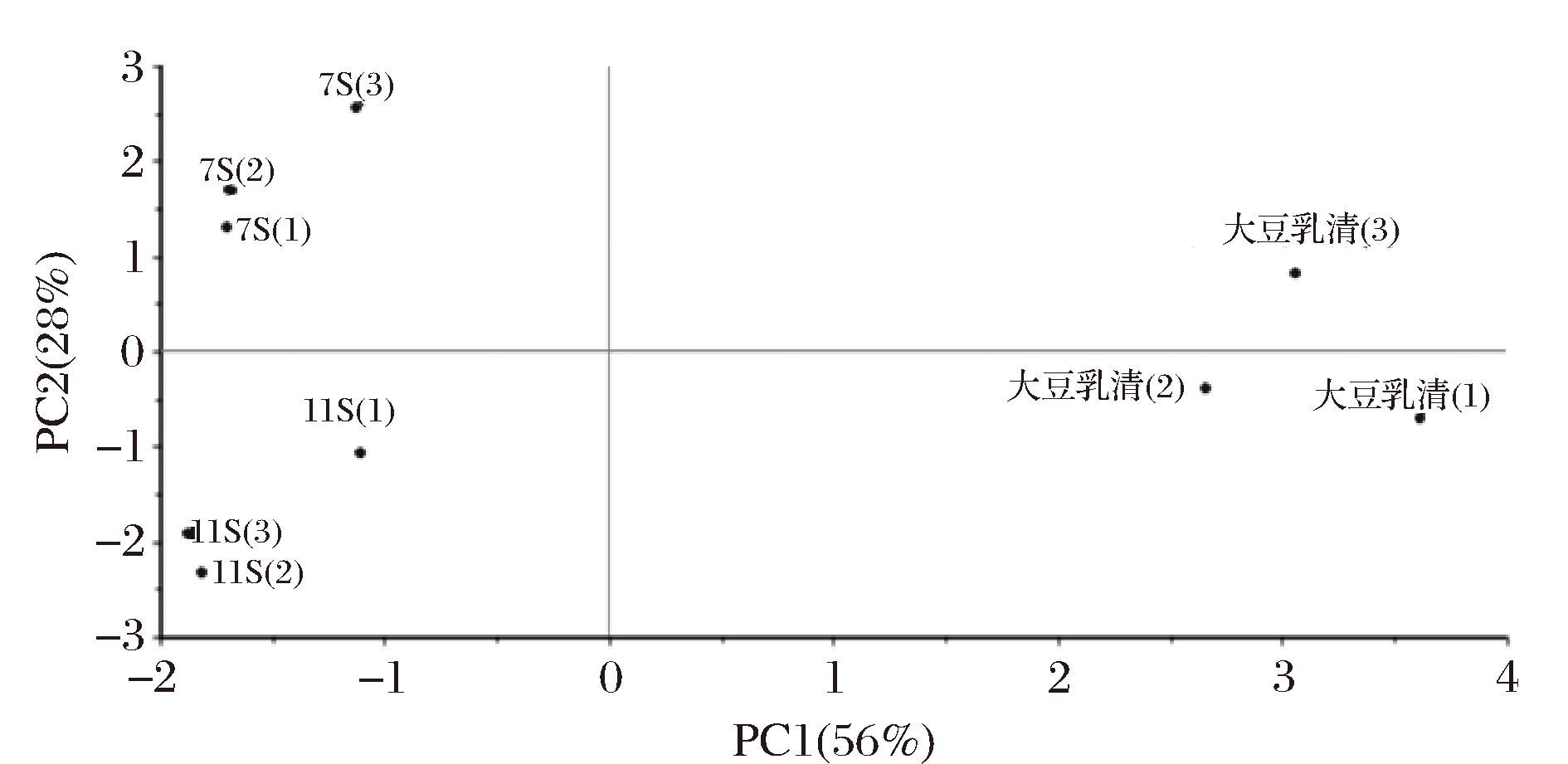
图12 电子鼻传感器响应值主成分分析图
Fig.12 Principal component analysis diagram of electronic nose sensor response value
2.11 感官评价分析
大豆乳清、7S和11S蛋白发酵产物感官评价结果如图13所示。结果表明,不同发酵产物在口感上无明显差异。色泽上,11S蛋白发酵液呈现浅黄色,色泽均匀,有一定光泽度,7S蛋白发酵液与乳清发酵液色泽均匀性较差。组织状态上,11S蛋白发酵液最佳,质地较为均匀细腻,乳清组分组织状态最不稳定。气味上,7S蛋白发酵液最佳,虽有轻微豆腥味但酸奶特征性芳香味突出,而11S蛋白发酵液豆腥味最重,感官得分最低。整体喜好度为:7S蛋白发酵物>11S蛋白发酵物>大豆乳清发酵物。

图13 大豆乳清、7S和11S蛋白发酵产物感官评价雷达图
Fig.13 Radar map for sensory evaluation of soybean whey, 7S and 11S protein fermentation products
3 结论
通过研究大豆酸奶发酵过程中不同蛋白组分理化性质与风味变化,结果发现11S蛋白在发酵过程中可以有效促进乳酸菌的增殖,同时pH值的下降,酸度、水解度、平均粒径和黏稠程度的增加可以促进蛋白凝胶结构形成,是大豆酸奶质地形成的关键组分。同时,11S蛋白也是与豆腥味化合物相互结合与作用的主要组分,可能通过pH值、结合位点及聚集状态的变化,改变其与豆腥物质的结合,是大豆酸奶发酵降低豆腥味的首要研究对象。7S蛋白则是产生大豆酸奶特征香味的重要组分。该研究有利于为食品工业中低豆腥味大豆酸奶的生产提供新策略。
[1] 黄祖贤, 李松泽, 李营威, 等. 大豆酸奶风味物质研究进展[J]. 食品安全质量检测学报, 2023, 14(11):103-110.HUANG Z X, LI S Z, LI Y W, et al. Research progress on flavor substances of soybean yogurt[J]. Journal of Food Safety &Quality, 2023, 14(11):103-110.
[2] XU X Y, CUI H T, XU J X, et al. Effects of different probiotic fermentations on the quality, soy isoflavone and equol content of soy protein yogurt made from soy whey and soy embryo powder[J]. LWT, 2022, 157:113096.
[3] 田然, 冯俊然, 隋晓楠, 等. 高强度超声处理对大豆7S和11S球蛋白结构和理化性质的影响[J]. 食品工业科技, 2022, 43(5):87-97.TIAN R, FENG J R, SUI X N, et al. Effect of high intensity ultrasound on the conformational and physicochemical properties of soy 7S and 11S globulin[J]. Science and Technology of Food Industry, 2022, 43(5):87-97.
[4] 张麒, 吴海波, 颜文文, 等. 大豆7S与11S球蛋白理化特性及其改性修饰的研究进展[J]. 食品与发酵工业, 2022, 48(9):324-335.ZHANG Q, WU H B, YAN W W, et al. Research progress on physicochemical properties and modification of soybean 7S and 11S globulins[J]. Food and Fermentation Industries, 2022, 48(9):324-335.
[5] 刘婷, 赵良忠, 周小虎, 等. 酸豆奶发酵过程中大豆异黄酮及风味物质变化规律[J]. 食品与发酵工业, 2022, 48(6):181-187.LIU T, ZHAO L Z, ZHOU X H, et al. Changes of soybean isoflavones and flavor substances in fermented soybean milk[J]. Food and Fermentation Industries, 2022, 48(6):181-187.
[6] 尹新雅, 王爽, 朱玲, 等. 植物酸奶品质优化的研究进展[J]. 食品工业科技, 2024, 45(3):397-405.YIN X Y, WANG S, ZHU L, et al. Advances in quality optimization of plant-based yogurt[J]. Science and Technology of Food Industry, 2024, 45(3):397-405.
[7] DU L, RO K S, ZHANG Y J, et al. Effects of Lactiplantibacillus plantarum X7021 on physicochemical properties, purines, isoflavones and volatile compounds of fermented soymilk[J]. Process Biochemistry, 2022, 113:150-157.
[8] KAMEL D G, HAMMAM A R A, ALSALEEM K A, et al. Addition of inulin to probiotic yogurt: Viability of probiotic bacteria (Bifidobacterium bifidum) and sensory characteristics[J]. Food Science &Nutrition, 2021, 9(3):1743-1749.
[9] WANG K, ARNTFIELD S D. Binding of carbonyl flavours to canola, pea and wheat proteins using GC/MS approach[J]. Food Chemistry, 2014, 157:364-372.
[10] 施小迪. 豆乳及豆乳发酵液不良风味的形成及改善途径研究[D]. 北京: 中国农业大学, 2017.SHI X D. Study on the formation and improving methods for off-flavor of soymilk and soymilk fermented liquid[D]. Beijing: China Agricultural University, 2017.
[11] CHUN J, KWON D Y, KIM J S, et al. Sensory properties of soy yoghurts prepared from yellow and black soymilk using Streptococcus infantarius 12 and Weisellia sp. 4[J]. Journal of the Science of Food and Agriculture, 2008, 88(10):1845-1849.
[12] 李思宁, 唐善虎, 任然. 动物双歧杆菌、植物乳杆菌与传统发酵剂共培养对发酵乳抗氧化特性的影响[J]. 食品科学, 2021, 42(18):127-134.LI S N, TANG S H, REN R. Effect of co-fermentation with Bifidobacterium animalis, Lactobacillus plantarum and traditional starter cultures on antioxidant properties of fermented milk[J]. Food Science, 2021, 42(18):127-134.
[13] 何玉洁. 罗望子胶在凝固型酸奶中的应用及稳定机理研究[D]. 上海: 上海应用技术大学, 2018.HE Y J. Study on the application and stability mechanism of tamarind gum in solidified yogurt[D]. Shanghai: Shanghai Institute of Technology, 2018.
[14] 葛晓佳, 唐楠煜, 杨瑞, 等. 沙棘添加对乳酸菌发酵牛乳风味和消费者接受度的影响[J]. 食品工业科技, 2022, 43(3):97-105. GE X J, TANG N Y, YANG R, et al. Study on the effect of sea buckthorn on the flavor and consumer acceptance of Lactobacillus fermented milk[J]. Science and Technology of Food Industry, 2022, 43(3):97-105.
[15] 赵泰霞, 徐新丽, 范俐. 纯大豆植物酸奶的研制[J]. 农产品加工, 2022(20):13-17.ZHAO T X, XU X L, FAN L. The preparation of soybean plant-based yogurt[J]. Farm Products Processing, 2022(20):13-17.
[16] 孙贺, 于寒松, 刘珊珊, 等. α'亚基对大豆分离蛋白微观形态及水溶液特性的影响[J]. 粮食与油脂, 2022, 35(4):72-75.SUN H, YU H S, LIU S S, et al. Effects of α'subunit on microstructure and properties of aqueous solution of soy protein isolate[J]. Cereals &Oils, 2022, 35(4):72-75.
[17] 吴俊霞, 程建明, 薛峰. 枸杞大豆蛋白植物基酸奶理化性质研究[J]. 食品与发酵工业, 2023, 49(10):193-198.WU J X, CHENG J M, XUE F. Physiochemical properties of plant-based yogurt prepared by wolfberry and soy protein[J]. Food and Fermentation Industries, 2023, 49(10):193-198.
[18] NARALA V R, JUGBARDE M A, ORLOVS I, et al. Inulin as a prebiotic for the growth of vegan yoghurt culture in pea protein-based vegan yoghurt-ice cream, while improving the textural properties[J]. Applied Food Research, 2022, 2(2):100136.
[19] DHEWA T, PANT S, MISHRA V. Development of freeze dried synbiotic formulation using a probiotic strain of Lactobacillus plantarum[J]. Journal of Food Science and Technology, 2014, 51(1):83-89.
[20] 张爽. 乳酸菌发酵特性及其蛋白酶对凝乳品质影响研究[D]. 哈尔滨: 哈尔滨工业大学, 2015.ZHANG S. Study on fermentation characteristics of lactic acid bacteria and the effect of protease on curd quality[D]. Harbin: Harbin Institute of Technology, 2015.
[21] 许女, 王佳丽, 陈旭峰, 等. 优良乳酸菌的筛选、鉴定及在酸奶中的应用[J]. 中国食品学报, 2019, 19(2):98-107.XU N, WANG J L, CHEN X F, et al. Screening, identification of lactic acid bacteria and application in fermented yogurt[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(2):98-107.
[22] 惠丹阳, 华舒雨, 唐裕芳, 等. 大豆蛋白部分替代牛乳蛋白对酸奶理化性质及结构的影响[J]. 食品与发酵工业, 2023, 49(15):122-128.HUI D Y, HUA S Y, TANG Y F, et al. Effect of partial replacement of milk protein by soy protein on the physicochemical properties and structure of yogurt[J]. Food and Fermentation Industries, 2023, 49(15):122-128.
[23] PANG Z H, SAFDAR B, WANG Y L, et al. Improvement of tribo-rheological properties of acid soymilk gels by reinforcement of 7S or 11S proteins[J]. Food Hydrocolloids, 2021, 110:106173.
[24] PENG X H, LIAO Y, REN K Y, et al. Fermentation performance, nutrient composition, and flavor volatiles in soy milk after mixed culture fermentation[J]. Process Biochemistry, 2022, 121:286-297.
[25] TIWARI S, KAVITAKE D, DEVI P B, et al. Bacterial exopolysaccharides for improvement of technological, functional and rheological properties of yoghurt[J]. International Journal of Biological Macromolecules, 2021, 183:1585-1595.
[26] ZHOU Y P, LI X F, HUA Y F, et al. The absence of lipoxygenase and 7S globulin of soybeans and heating temperatures on the properties of soymilks and soy yogurts[J]. Lwt, 2019, 115:108431.
[27] YANG X Y, KE C X, LI L. Physicochemical, rheological and digestive characteristics of soy protein isolate gel induced by lactic acid bacteria[J]. Journal of Food Engineering, 2021, 292:110243.
[28] NAIBAHO J, JONUZI E, BUTULA N, et al. Soy-based yogurt-alternatives enriched with brewers’ spent grain flour and protein hydrolysates: Microstructural evaluation and physico-chemical properties during the storage[J]. Lwt, 2023, 178:114626.
[29] 邢常辉, 李文钊, 孙妮, 等. 酵母抽提物对大豆酸奶风味的影响[J]. 食品研究与开发, 2022, 43(18):63-69.XING C H, LI W Z, SUN N, et al. Effect of yeast extract on the flavor and texture of solidified soy yogurt[J]. Food Research and Development, 2022, 43(18):63-69.
[30] LV Y C, SONG H L, LI X, et al. Influence of blanching and grinding process with hot water on beany and non-beany flavor in soymilk[J]. Journal of Food Science, 2011, 76(1): S20-S25.
[31] ZHENG Y, FEI Y T, YANG Y, et al. A potential flavor culture: Lactobacillus harbinensis M1 improves the organoleptic quality of fermented soymilk by high production of 2, 3-butanedione and acetoin[J]. Food Microbiology, 2020, 91:103540.
[32] HAO Z Q, ZHANG X, PENG X Y, et al. Identification of the key off-flavor odorants for undesirable spoiled odor in thermally sterilized fermented soymilk[J]. Food Research International, 2023, 164:112407.