灯笼果(Physalis peruviana L.)为茄科(Solanaceae)酸浆属(Physalis)草本植物,原产于南美洲,主要分布于秘鲁和巴西等国家。国外学者报道灯笼果各部位中含有酚类[1]、甾体[2-4]、脂肪酸[5]等化合物,且这些物质显示了抑制自由基抗氧化、降血糖和抗肿瘤等功效。2021年统计结果显示全世界14个国家传统医疗使用灯笼果,用于治疗胃肠道和皮肤病等疾病,且叶片以近50%的使用率位居灯笼果药用部位之首[6]。
灯笼果在我国分布于云南、东北地区及广东等地,药食同源,其果实又名菇娘果,古典记载其具有清热解毒、主热烦满、定志益气、利水道、利湿除热等功效[7]。因消费者对其黄色小巧果形和酸甜口感的喜爱,灯笼果在水果市场的销量持续上升,近年来在东北地区广泛种植,成为当地特色水果产业。与此同步,夏秋霞等[8]报道了超声辅助醇提灯笼果果实总黄酮最佳提取工艺,提取率0.23%。马媛[9]鉴定了其果实含有木犀草素、异槲皮苷和槲皮素等化合物,并具有抗氧化和酶抑制活性。
过量活性氧(reactive oxygen species,ROS)引起的氧化应激会加速人体衰老或产生慢性疾病,仅靠内源性抗氧化剂无法使人体细胞免受氧化应激带来的损伤,需要合理摄入外源抗氧化剂以维持氧化平衡,减少细胞和组织的氧化损伤。植物中的黄酮、酚酸等次级代谢产物可清除自由基,能有效缓解机体氧化压力,是优质的天然抗氧化剂。鉴于灯笼果在国内外的应用传统、已有研究数据和市场销售现状,灯笼果中含有值得利用的天然抗氧化剂,可为相关功能性食品的开发提供优质原料。
但对比国外,我国对灯笼果资源的利用与研究极不充分。利用不充分体现在售卖食用鲜果后扔弃了叶片和宿萼等国外传统药用部位。研究方面则仅关注果实成分,缺乏其他部位的相关数据。为减少绿色资源浪费,科学提高灯笼果产品附加值,本文拟采用超声辅助醇提法提取灯笼果叶片、宿萼和果实,测定其总酚和总黄酮含量,使用超高效液相色谱-质谱联用技术(ultra performance liquid chromatography-mass spectrometry)鉴定3个部位中化合物,并定量特征化合物,同时测试三部位提取物体外抗氧化活性,研究结果将完善我国灯笼果次级代谢产物数据,为灯笼果绿色资源现代化开发利用提供科学支撑,为抗氧化功能食品市场提供更多优质原料。
1 材料与方法
1.1 材料与试剂
灯笼果叶片、宿萼和果实,黑龙江省齐齐哈尔市;无水乙醇(分析纯)、无水甲醇(分析纯),天津致远化学试剂有限公司;紫云英苷(98%),成都埃法生物科技有限公司;三氯化铝(分析纯),阿拉丁公司;芦丁(≥98%)、没食子酸(≥98%)、金丝桃苷(≥98%)、槲皮素(≥98%)、阿魏酸(≥98%)、松萝酸(≥98%)、二丁基羟基甲苯(2,6-Di-tert-butyl-4-methylphenol, BHT)(≥98%)、碳酸钠(分析纯)等其他试剂,上海源叶生物科技有限公司;盐酸(分析纯),北京化工厂;DPPH(96%)、2,4,6-三吡啶基三嗪(2,4,6-Tris(2-pyridyl)-s-triazine, TPTZ)(99%)、ABTS(98%)、水溶性维生素 E(6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid, Trolox)(97%)、水杨酸(分析纯)、福林酚(BR)、过硫酸钾(分析纯)等其他试剂,上海麦克林公司;过氧化氢(分析纯),天津市大茂化学试剂厂;甲酸(色谱纯),DIKMA公司;乙腈(色谱纯),赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
600Y高速粉碎机,永康市铂欧五金制品有限公司;BHS-2精密数显恒温水浴锅,上海垒固仪器有限公司;R-215旋转蒸发仪,瑞士步奇公司;MZX-D循环水式真空泵,北京精锐泽祥实验仪器有限公司;V-750紫外分光光度计,JASCO公司;KS-5200DA液晶超声波清洗器,昆山市超声仪器有限公司;BT224S电子分析天平,北京赛多利斯仪器系统有限公司;Super Mini Dancer离心机,生工生物工程(上海)股份有限公司;EnSpire酶标仪,美国PerkinElmer公司;96孔板,美国Corning公司;其他玻璃仪器,北京精锐泽祥实验仪器有限公司;Acquity UPLC H-Class PLUS超高效液相色谱仪、Waters Acquity UPLC I-Class PLUS Xevo G2XS QTOF MS超高效液相色谱与质谱联用仪,美国沃特世公司;Wonda Vial样品瓶,日本岛津GL公司。
1.3 实验方法
1.3.1 灯笼果叶片、宿萼和果实提取物制备
将灯笼果叶片、宿萼和果实用蒸馏水清洗干净,叶片和宿萼置于通风处阴干,果实冻干,粉碎,以料液比1∶20(g∶mL),70%乙醇(体积分数)和超声时间30 min为提取条件,抽滤留取上清液,残渣重复提取1次,收集滤液,在40 ℃温度条件下用旋转蒸发器将滤液中的挥发性物质蒸发出来,直至醇味消失,吹干,得灯笼果三部位浸膏,并称重,保存备用。
1.3.2 总酚含量的测定
总酚含量测定采用Folin-Ciocalteu法[10],配制0.15 mg/mL没食子酸溶液,用甲醇稀释为0.06~0.12 mg/mL浓度梯度的没食子酸溶液,取0.2 mL各浓度没食子酸溶液于比色管中,加0.7 mL福林酚溶液,室温避光反应5 min,反应结束后加入3 mL 5%(质量分数)碳酸钠溶液,蒸馏水定容至10 mL,40 ℃水浴120 min,在759 nm处测吸光值,绘制标准曲线,得到线性回归方程为y=0.144 3x+0.044 2,R2=0.999 3。
用甲醇制备一定浓度的灯笼果叶片、宿萼和果实提取液,按照上述方法于759 nm处测吸光度值,将所得结果代入标准曲线,重复3次测试,结果取平均值,最终以每克干重样品含有的没食子酸当量表示(mg GAE/g DW)。
1.3.3 总黄酮含量的测定
总黄酮含量测定采用三氯化铝比色法,用70%(体积分数)乙醇配制0.12 mg/mL的芦丁母液,并稀释为0.032~0.128 mg/mL的各浓度溶液,每个比色管中分别加入0.5 mL各浓度芦丁溶液,再移取0.8 mL 0.2 mol/L AlCl3溶液至试管中,并用蒸馏水定容至10 mL,室温条件下避光反应30 min,在272 nm处测吸光度值,以芦丁浓度为横坐标,对应吸光值为纵坐标,绘制标准曲线,得到线性方程为y=0.045 1x+0.068 3,R2=0.999 3。
用体积分数70%乙醇配制各浓度灯笼果叶片、宿萼和果实提取液,按照上述方法于272 nm处测吸光值,将吸光度值代入芦丁标准曲线,重复3次,取平均值,最终以每克干重样品含有的芦丁当量表示(mg RT/g DW)。
1.3.4 化学成分鉴定
采用配备光电二极管阵列(photodiode array,PDA)探测器的Acquity UPLC系统进行定性分析,样品均经0.22 μm尼龙膜过滤。色谱柱:ACQUITY UPLC BEH C18 Column (130 Å, 1.7 μm, 2.1 mm×100 mm);流动相:A相为0.1%甲酸水,B相为乙腈;系统流速:0.4 mL/min;柱温:34 ℃;样品进样量为1 μL;紫外检测器设置为:210 nm、253 nm、280 nm、350 nm;洗脱程序:0~0.2 min,10% B;0.2~12 min,10%~40% B;12~21 min,40%~100% B;21~23 min,100%~10% B。
使用Xevo G2XS QTOF MS 质谱系统(Waters),在正离子和负离子模式下工作的电喷雾电离(electrospray ionization,ESI)源,电喷雾离子化ESI源:离子源温度300 ℃;扫描范围m/z:50~1 200 Da;锥孔电压60 V;碰撞能量:MS碰撞能量低(20.0 eV),MS碰撞能量高(60.0 eV)。采用MassLynx 4.2 软件进行数据分析。
1.3.5 化合物定量分析
精确称取松萝酸、槲皮素、紫云英苷、金丝桃苷标准品各1 mg,甲醇定容至1 mL,配制1 mg/mL的标准品溶液,过0.22 μm滤膜,用作定量分析。精确称取阿魏酸标准品1 mg,甲醇定容至1 mL,过0.22 μm滤膜,用作半定量分析。进样程序同1.3.4节进样条件。
1.3.6 抗氧化活性测定
1.3.6.1 DPPH自由基清除活性
参考SHENG等[11]的方法,并稍作修改,用甲醇配制0.1 mmol/L的DPPH溶液和各浓度的BHT溶液以及样品溶液。在96孔板中加入100 μL各浓度梯度样品液和100 μL DPPH溶液,振荡混匀,室温下避光反应30 min,在517 nm处测吸光度值,将BHT代替样品液进行上述反应,测吸光值。灯笼果3个部位提取物的DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0为空白对照的吸光度值;A1为样品的吸光度值;A2为样品空白的吸光度值。
1.3.6.2 羟自由基清除活性
参考谭亮等[12]的方法,并稍作调整。配制6 mmol/L FeSO4溶液和6 mmol/L水杨酸-乙醇溶液和0.1%(体积分数)H2O2溶液备用。在96孔板中加入100 μL不同浓度提取液,再依次加入FeSO4溶液、水杨酸-乙醇溶液和H2O2溶液各40 μL,振荡摇匀后于37 ℃避光环境下反应30 min,在波长510 nm处测定吸光度值A1,以等体积蒸馏水代替H2O2溶液测定吸光值A2,以等体积蒸馏水代替样品测定吸光值A0。以维生素C作阳性对照,灯笼果各部位对羟自由基清除率的计算如公式(2)所示:
羟自由基清除率![]()
(2)
式中:A0为空白组的吸光值;A1为样品组的吸光值;A2为样品空白的吸光值。
1.3.6.3 ABTS阳离子自由基清除活性
参考LIU等[13]的方法,稍作修改。分别用甲醇和超纯水配制7 mmol/L的ABTS溶液和2.6 mmol/L的过硫酸钾溶液,等比混合,于黑暗室温环境中反应12~16 h,用甲醇稀释工作液至吸光值为0.70±0.02。吸取20 μL各浓度梯度的Trolox标准溶液和180 μL ABTS工作液,充分振荡混匀后在734 nm处测定吸光度,以Trolox溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。将各部位样品液代替Trolox标准溶液与ABTS工作液反应,测得吸光值代入标准曲线,计算抗氧化活性,结果以Trolox当量(mmol TE/g)表示。
1.3.6.4 铁离子还原能力
参考翟小童等[14]的方法,并适当调整。用超纯水配制0.3 mol/L的醋酸钠溶液和20 mmol/L的FeCl3·6H2O溶液,用40 mmol/L盐酸配制10 mmol/L的TPTZ溶液,将醋酸钠溶液、FeCl3·6H2O溶液和TPTZ溶液以体积比10∶1∶1混合得FRAP工作液,避光备用。在96孔板中加入20 μL不同浓度梯度的FeSO4溶液和180 μL FRAP工作液,混匀后在593 nm处测定吸光度值,以FeSO4溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。将灯笼果各部位样品液代替FeSO4溶液进行以上操作,所得吸光度值代入标准曲线,样品铁离子还原能力以Fe2+当量表示(mmol Fe2+/g)。
1.4 数据分析
实验重复3次,采用Excel、SPSS等软件进行数据处理,结果以平均值±标准差表示。
2 结果与分析
2.1 灯笼果不同部位总酚、总黄酮含量
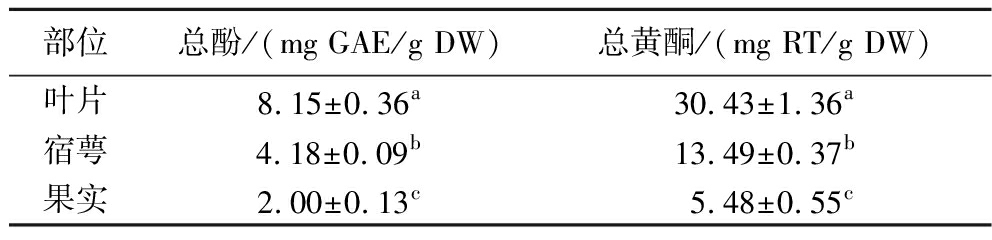
由表1可知,灯笼果叶片提取物的总酚和总黄酮含量最高,其值分别为8.15 mg GAE/g DW和30.43 mg RT/g DW,显著高于其他部位,但低于阿尔及利亚灯笼果叶片煎煮所得醇提物的总酚(12.21 mg GAE/g DW)和浸渍醇提物总酚(17.75 mg GAE/g DW)含量,测试结果差异可能与产地和制备方式等因素有关[15]。宿萼提取物总酚含量和总黄酮含量低于叶片提取物,果实提取物总酚和总黄酮含量较低,分别不足叶片提取物的1/4和1/5。夏秋霞等[8]在灯笼果果实黄酮工艺研究中以芦丁为标准品,采用百分比方式计算了果实提取物黄酮含量,其最优工艺条件下黄酮含量0.23%。
表1 灯笼果叶片、宿萼和果实总酚和总黄酮含量
Table 1 Contents of total phenol and total flavone in leaf, calyx, and fruit extracts of P.peruviana L.
部位总酚/(mg GAE/g DW)总黄酮/(mg RT/g DW)叶片8.15±0.36a30.43±1.36a宿萼4.18±0.09b13.49±0.37b果实2.00±0.13c5.48±0.55c
注:同一列不同字母表示样品间存在显著性差异(P<0.05)。
2.2 提取物成分分析
对所得样品的分子母离子、碎片离子和保留时间等数据与标准品、文献和数据库的相应数据进行对比,初步鉴定化合物结构。如表2和图1所示,从灯笼果叶片提取物中鉴定出8种化合物,宿萼提取物中鉴定出6种化合物,果实提取物中鉴定出1种化合物,共鉴定得到10种化合物。
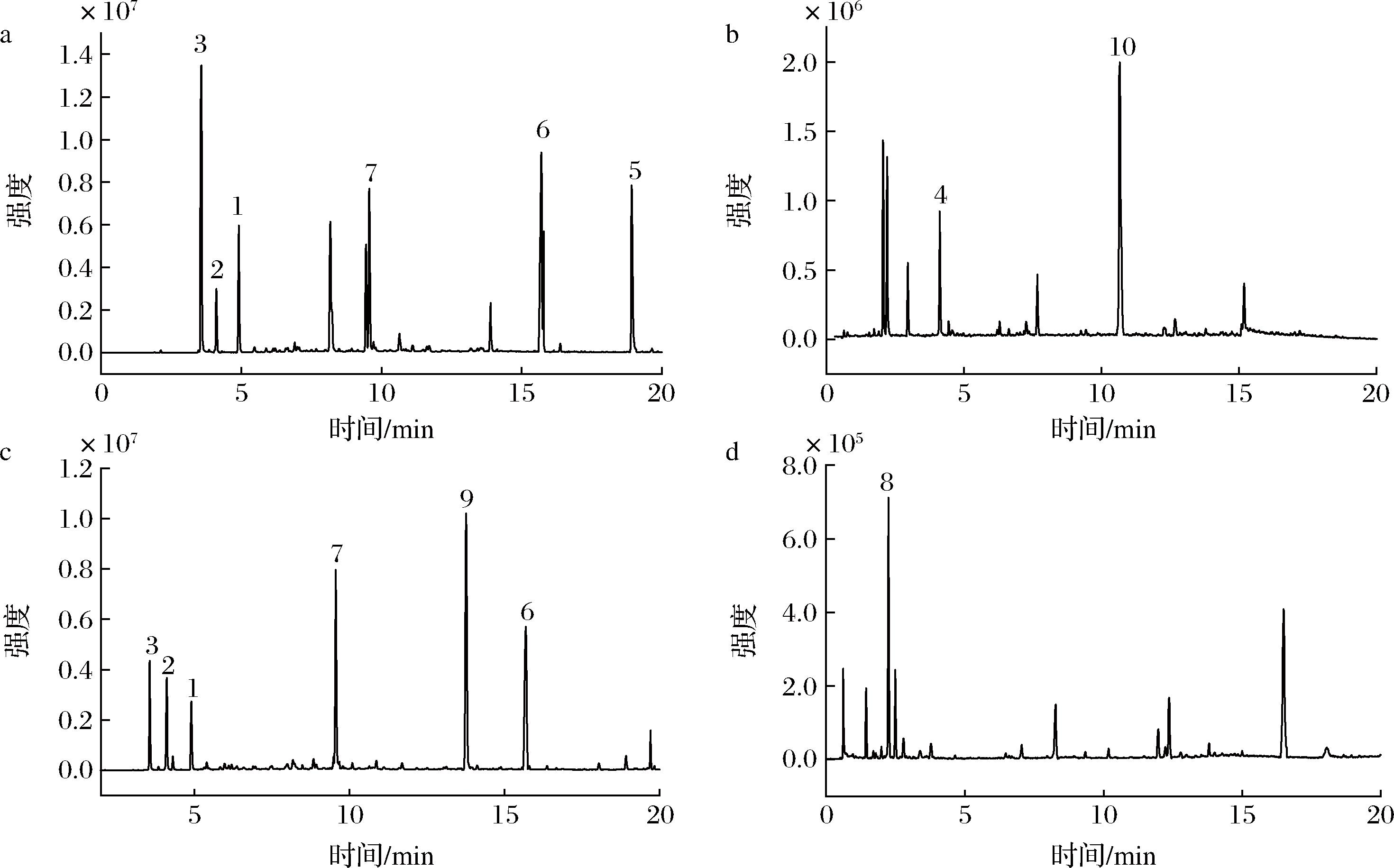
a-叶片提取物(负离子模式);b-叶片提取物(正离子模式);c-宿萼提取物;d-果实提取物
图1 灯笼果叶片、宿萼和果实提取物总离子流图
Fig.1 Total ion current diagram of leaf, calyx, and fruit extracts from P. peruviana L.
表2 灯笼果叶片、宿萼和果实提取物中鉴定的化合物
Table 2 Identification of compounds in leaf, calyx, and fruit extracts of P.peruviana L.
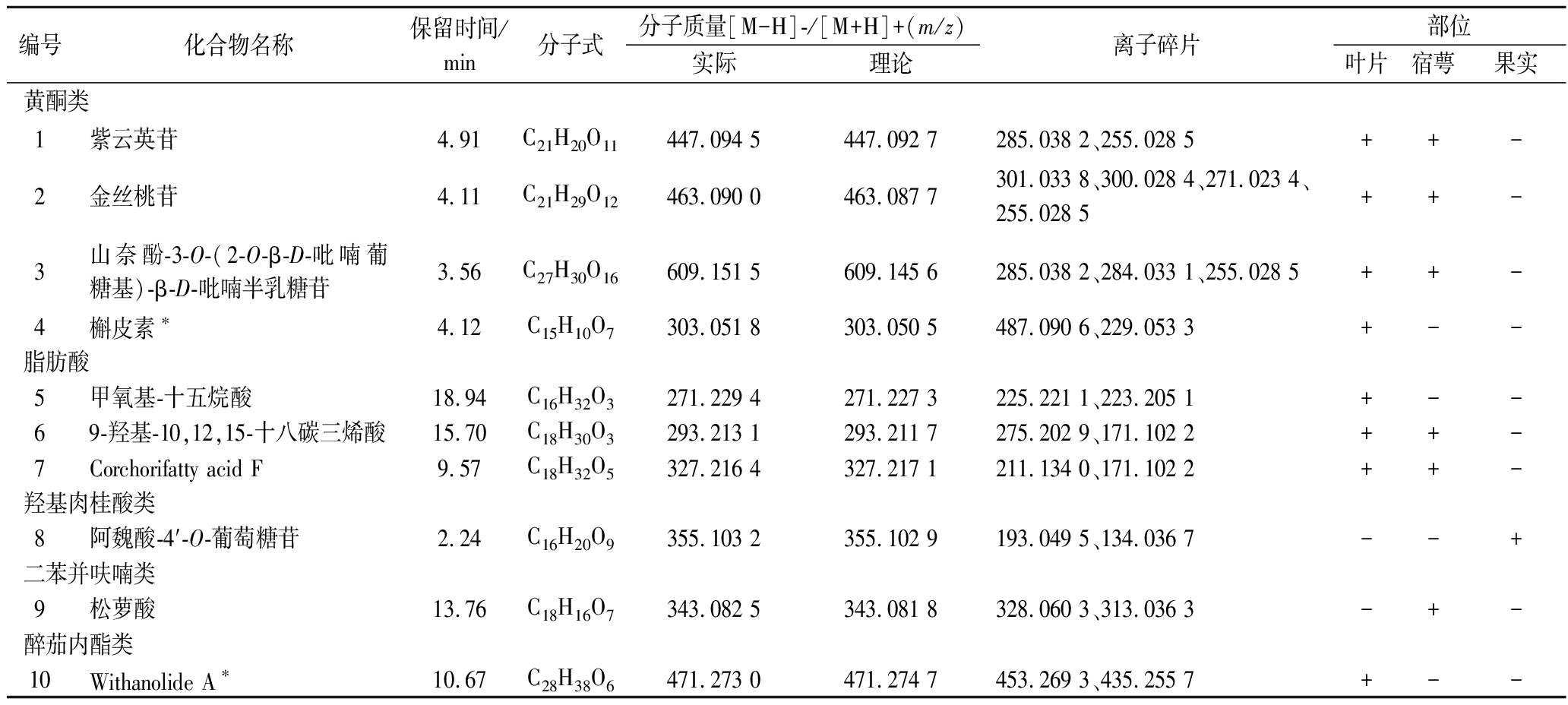
编号化合物名称保留时间/min分子式分子质量[M-H]-/[M+H]+(m/z)实际理论离子碎片部位叶片宿萼果实黄酮类1紫云英苷4.91C21H20O11447.094 5447.092 7285.038 2、255.028 5++-2金丝桃苷4.11C21H29O12463.090 0463.087 7301.033 8、300.028 4、271.023 4、255.028 5++-3山奈酚-3-O-(2-O-β-D-吡喃葡糖基)-β-D-吡喃半乳糖苷3.56C27H30O16609.151 5609.145 6285.038 2、284.033 1、255.028 5++-4槲皮素∗4.12C15H10O7303.051 8303.050 5487.090 6、229.053 3+--脂肪酸5甲氧基-十五烷酸18.94C16H32O3271.229 4271.227 3225.221 1、223.205 1+--69-羟基-10,12,15-十八碳三烯酸15.70C18H30O3293.213 1293.211 7275.202 9、171.102 2++-7Corchorifatty acid F9.57C18H32O5327.216 4327.217 1211.134 0、171.102 2++-羟基肉桂酸类8阿魏酸-4′-O-葡萄糖苷2.24C16H20O9355.103 2355.102 9193.049 5、134.036 7--+二苯并呋喃类9松萝酸13.76C18H16O7343.082 5343.081 8328.060 3、313.036 3-+-醉茄内酯类10Withanolide A∗10.67C28H38O6471.273 0471.274 7453.269 3、435.255 7+--
注:*为在正离子模式下检测,+表示提取物内含有该化合物,-表示提取物内不含该化合物。
2.2.1 黄酮类化合物
化合物1、2和4裂解方式与各自标准品一致,分别被鉴定为紫云英苷、金丝桃苷和槲皮素。紫云英苷和金丝桃苷在叶片和宿萼中均被鉴定,但槲皮素仅从叶片中检出,IVANOVA等[16]在灯笼果叶片中也发现存在该化合物。化合物3在裂解过程中产生的特征碎片m/z 285.038 2(表2、图2)为分子母离子脱去一分子葡萄糖和一分子半乳糖,其进一步脱去一分子CH2O产生碎片离子m/z 255.028 5。通过与文献对比上述离子,化合物3被鉴定为山奈酚-3-O-(2-O-β-D-吡喃葡糖基)-β-D-吡喃半乳糖苷[17]。
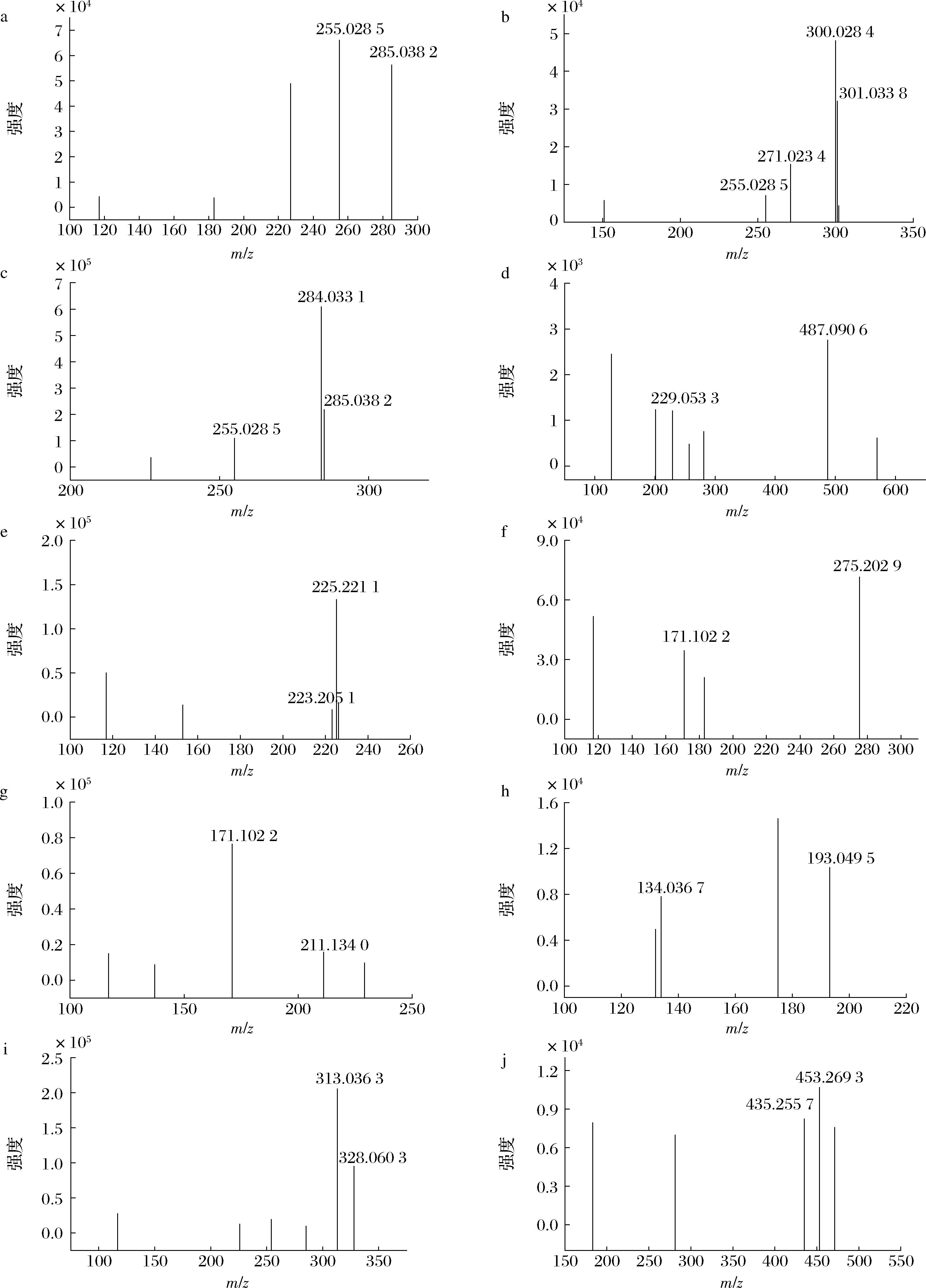
a-紫云英苷;b-金丝桃苷;c-山奈酚-3-O-(2-O-β-D-吡喃葡糖基)-β-D-吡喃半乳糖苷;d-槲皮素;e-甲氧基-十五烷酸;f-9-羟基-10,12,15-十八碳三烯酸;g-Corchorifatty acid F;h-阿魏酸-4′-O-葡萄糖苷;i-松萝酸;j-Withanolide A
图2 化合物质谱离子碎片图谱
Fig.2 Mass spectrometry ion fragment spectrum of compounds
2.2.2 脂肪酸类化合物
化合物5在裂解过程中产生了碎片离子m/z 225.221 1和m/z 223.205 1(表2、图2),通过与文献比对,被鉴定为甲氧基-十五烷酸[18]。化合物6被鉴定为9-羟基-10,12,15-十八碳三烯酸,负离子模式下分子离子峰m/z 293.213 1,二级质谱产生m/z 275.202 9、171.102 2特征碎片离子,与参考文献[19]相符,其中m/z 275.202 9为母离子脱去一分子H2O。化合物7在裂解过程中产生碎片离子m/z 211.134 0,为分子母离子脱去一分子C6H12O2,裂解方式与参考文献相符[20],推测其为Corchorifatty acid F。
2.2.3 羟基肉桂酸类化合物
化合物8在负离子模式下分子母离子m/z 355.103 2,分子式为C16H20O9,母离子进一步脱去一分子葡萄糖得到二级碎片离子m/z 193.049 5,二级碎片离子m/z 193.049 5和m/z 134.036 7与文献裂解方式一致[21],推断该化合物为阿魏酸-4′-O-葡萄糖苷。
2.2.4 二苯并呋喃类化合物
化合物9松萝酸,在负离子模式下分子母离子m/z 343.082 5,母离子进一步分别脱去一分子和两分子甲基得到二级碎片离子m/z 328.060 3和m/z 313.036 3,与参考文献中松萝酸裂解行为一致[22],初步推测该化合物为松萝酸。
2.2.5 醉茄内酯类化合物
化合物10在正离子模式下分子母离子m/z 471.273 0,分子式为C28H38O6,二级碎片离子m/z 453.269 3和m/z 435.255 7与文献报道Withanolide A一致[23],其中m/z 453.269 3为分子母离子脱去一分子H2O,然后进一步脱去一分子H2O,得到碎片离子m/z 435.255 7,初步推测该化合物为Withanolide A。
从灯笼果的三部位中鉴定了4个以槲皮素和山奈酚为苷元的黄酮醇类化合物(1~4),其中槲皮素(4)可通过信号转导途径发挥抗氧化活性[24]。肯尼亚灯笼果叶片提取物含有脂肪酸类化合物[5],德国灯笼果全株提取物含有醉茄内酯类化合物[3],而埃及灯笼果果汁提取物中检出阿魏酸[25]。这些化合物类型与本研究所得数据类型(表2)相似,但迄今未见国产灯笼果中含有紫云英苷(1)和金丝桃苷(2)的报道,更未见国内外学者报道灯笼果中含有二苯并呋喃类衍生物松萝酸(9)。
2.3 化合物含量
因国产灯笼果中化合物含量数据鲜见,在此采用外标一点法定量化合物,测定了叶片和宿萼共有化合物紫云英苷(1)和金丝桃苷(2)含量,其中叶片和宿萼提取物金丝桃苷(2)含量分别为344.18 μg/g DW和 162.10 μg/g DW,叶片提取物紫云英苷(1)含量(492.03 μg/g DW)远高于宿萼提取物中紫云英苷(1)含量(23.58 μg/g DW)。叶片提取物中检出槲皮素(4),含量为240.19 μg/g DW。宿萼提取物中松萝酸(9)含量为121.97 μg/g DW。智利学者报道灯笼果果实提取物中阿魏酸含量为158.90 μg/g DW[1],本研究果实提取物中仅发现阿魏酸-4′-O-葡萄糖苷(8),以其苷元阿魏酸对其进行了半定量,含量为137.37 μg/g DW。
2.4 抗氧化活性评价
2.4.1 DPPH自由基清除能力
灯笼果叶片、宿萼和果实提取物和阳性对照BHT对DPPH自由基清除活性如图3所示,BHT对DPPH自由基的半数清除率为SC50=0.01 mg/mL,灯笼果3个部位提取物均表现出清除DPPH自由基的能力,质量浓度与清除率之间呈量效关系。宿萼提取物清除能力最强,且差异显著(P<0.05),在质量浓度为0.05~0.4 mg/mL时,清除率随浓度变化呈快速上升趋势,质量浓度为0.4~0.8 mg/mL时,上升趋势变缓,最终清除率达到了91.77%,SC50值0.19 mg/mL。叶片提取物SC50值为0.38 mg/mL。果实提取物清除DPPH自由基能力较弱,在质量浓度为0.8 mg/mL时,清除率为40.26%,变化趋势始终平缓,最高清除率60.50%,SC50值1.15 mg/mL,约是宿萼提取物的6.05倍。所得数据与墨西哥学者报道的同属植物苦蘵(P.angulata L.)的未成熟宿萼是清除DPPH自由基的最佳部位(SC50=0.12 mg/mL)结果相似[26]。黄酮醇类化合物的酚羟基向自由基提供氢原子发挥抗氧化活性[27],从表2可知,叶片和宿萼提取物均含有这类化合物。杨超[28]发现金丝桃苷对DPPH自由基有较强清除功效,可能由于金丝桃苷化合物B环存在邻二酚羟基,使其抗氧化能力比其他黄酮化合物更强。缩酚酸和二苯并呋喃类化合物也被证实有一定的自由基清除能力,唐燕霞[29]研究发现松萝酸的终浓度达13.75 μmol/L和55 μmol/L时的DPPH自由基清除率接近BHT在终浓度为110 μmol/L时的清除率。宿萼提取物丰富的化合物类型应该是其清除DPPH自由基能力最强的原因。
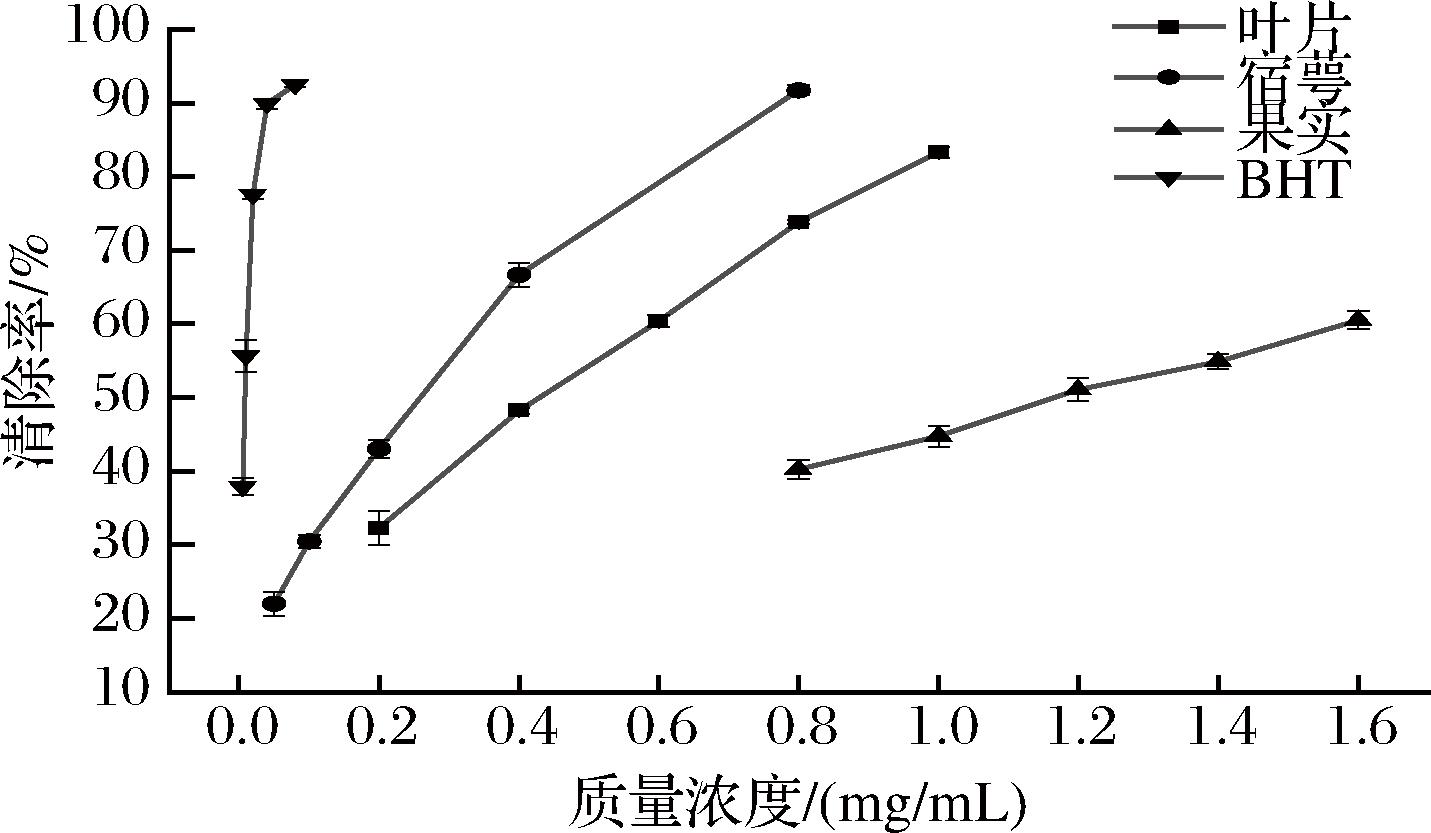
图3 灯笼果叶片、宿萼和果实提取物对DPPH自由基清除能力
Fig.3 DPPH free radical scavenging ability of leaf, calyx, and fruit extracts of P.peruviana L.
2.4.2 羟自由基清除能力
灯笼果叶片、宿萼和果实提取物及阳性对照维生素C清除羟自由基活性结果见图4,3个部位提取物清除能力随质量浓度增加而增大,由强到弱依次为:叶片提取物>果实提取物>宿萼提取物,叶片提取物表现出最强清除羟自由基活性,在质量浓度为0.1 mg/mL时,清除率为41.97%,当质量浓度升至1.7 mg/mL时,清除率达到56.70%,半数清除率SC50值为0.61 mg/mL。其次是果实提取物,当质量浓度为1.3 mg/mL时,清除率超过50%,最高质量浓度清除率达到57.53%。宿萼提取物羟自由基清除活性较弱,SC50值约为叶片提取物的2.31倍。房玉林等[30]研究发现槲皮素和阿魏酸等单体化合物可有效清除羟自由基,且含量与羟自由基呈相关性。表3表明,叶片提取物槲皮素(4)含量240.19 μg/g DW,果实提取物阿魏酸-4′-O-葡萄糖苷(8)含量137.37 μg/g DW,这可能是二者清除羟自由基效果优于宿萼提取物的原因。但3个部位清除率均弱于维生素C(SC50=0.04 mg/mL)且呈显著性差异,这可能由于灯笼果提取物中虽含有黄酮醇及羟基肉桂酸类等化合物,但仍存在部分化合物水溶性较差,无法在测试实验中与底物有效结合,从而限制其发挥清除羟自由基的功效。
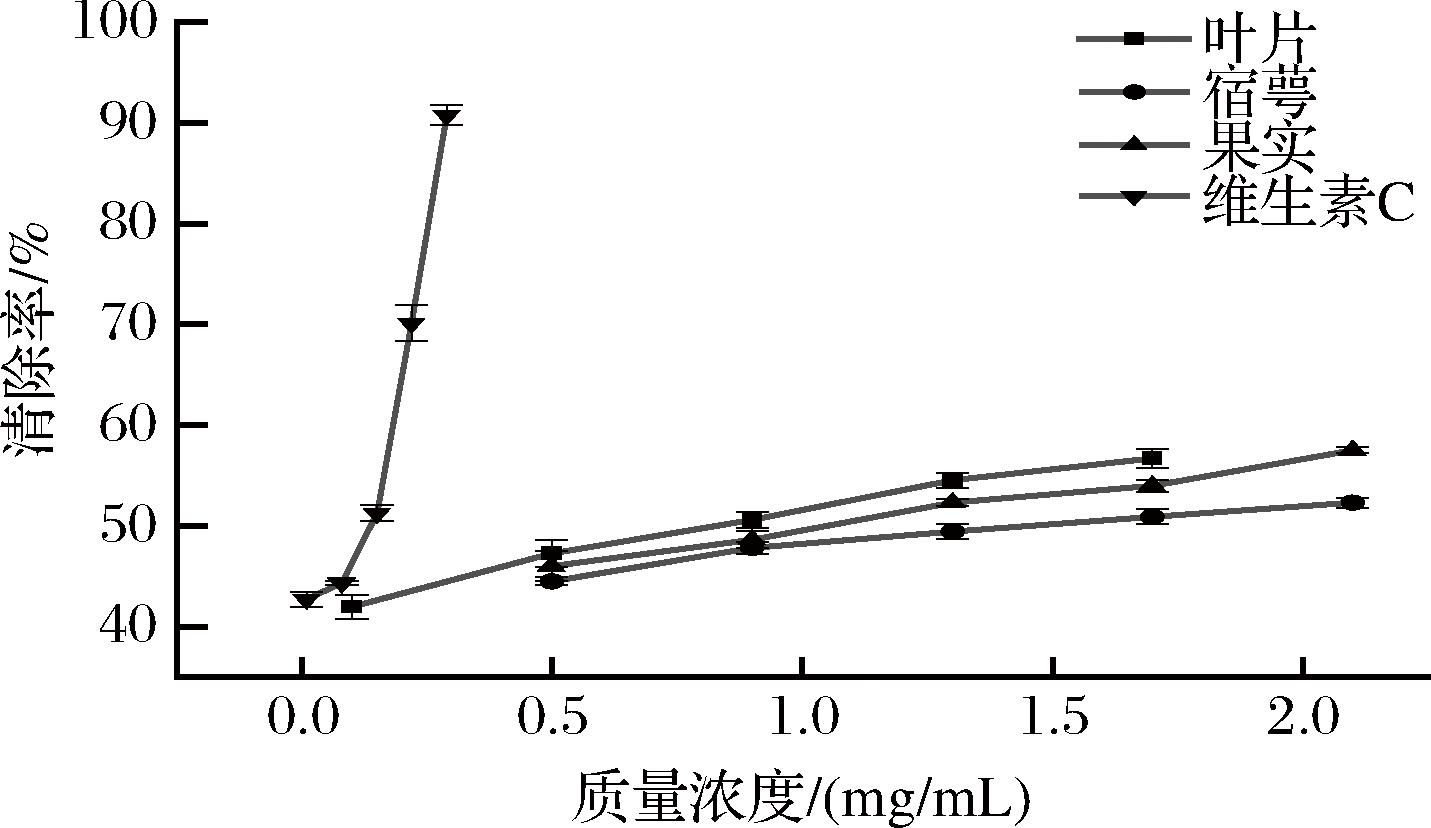
图4 灯笼果叶片、宿萼和果实提取物对羟自由基清除能力
Fig.4 Hydroxyl radical scavenging ability of leaf, calyx, and fruit extracts of P.peruviana L.
表3 灯笼果叶片、宿萼和果实提取物中化合物含量
Table 3 Contents of compounds in leaf, calyx, and fruit extracts of P.peruviana L.

化合物名称和编号标准曲线叶片/(μg/g DW)宿萼/(μg/g DW)果实/(μg/g DW)紫云英苷(1)y=9 732.9x+24 060492.03±61.0823.58±2.75-金丝桃苷(2)y=8 037.6x+17 831344.18±8.81162.10±27.08-槲皮素(4)y=4 403.6x+55 329240.19±22.39--阿魏酸-4′-O-葡萄糖苷(8)y=3 018.9x+6 073.1--137.37±14.02松萝酸(9)y=27 674x+258 331-121.97±17.44-
2.4.3 ABTS阳离子自由基清除能力
以Trolox溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线,回归方程为y=-2.078 3x+0.716 9,R2=0.999 6,线性关系良好,可用于检测灯笼果各部位ABTS阳离子自由基清除能力,清除能力用Trolox当量mmol TE/g表示,当量值越大清除能力越强。
灯笼果不同部位提取物ABTS阳离子自由基清除能力如图5,表明3个部位提取物均具有一定程度清除能力,能力强弱顺序为宿萼提取物(0.13 mmol TE/g)>叶片提取物(0.11 mmol TE/g)>果实提取物(0.10 mmol TE/g)。宿萼提取物所鉴定的酚羟基化合物分属于黄酮醇和二苯并呋喃两类型,而叶片提取物仅有黄酮醇一类,果实提取物只有羟基肉桂酸一类,在此推测化合物类型更丰富可能导致宿萼提取物清除ABTS阳离子自由基能力最优。
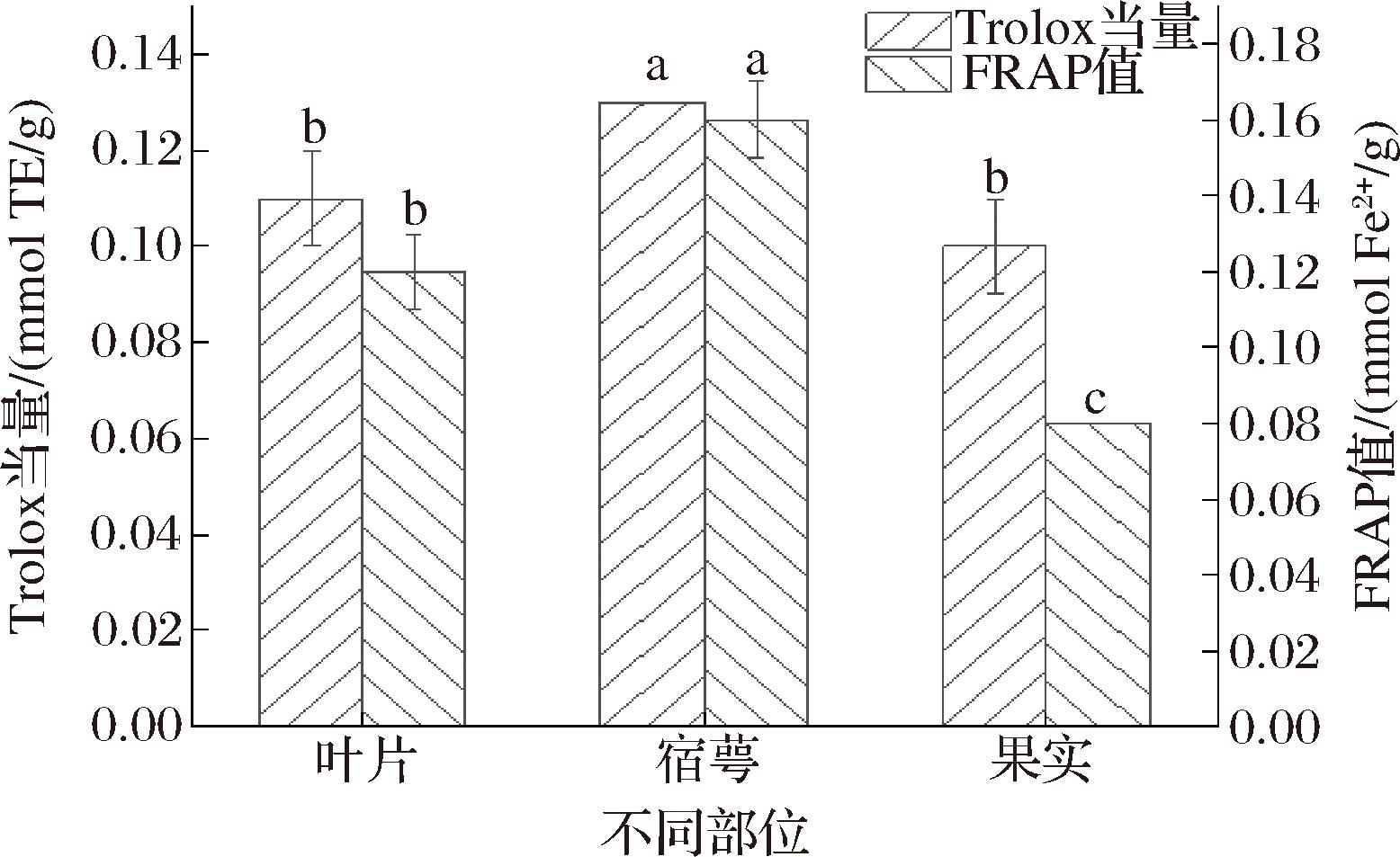
图5 灯笼果叶片、宿萼和果实提取物对ABTS阳离子自由基清除能力和铁离子还原能力
Fig.5 ABTS cation free radical scavenging ability and iron ion reduction ability of leaf, calyx, and fruit extracts of P.peruviana L.
注:不同字母表示不同部位具有显著性差异(P<0.05)。
2.4.4 铁离子还原能力
以Fe2+溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得到回归方程y=1.501 6x+0.186 9,R2=0.999 3,线性关系良好,可用于检测灯笼果各部位的铁离子还原能力,还原能力用mmol Fe2+/g当量表示,当量值越大还原能力越强。
灯笼果叶片、宿萼和果实提取物铁离子还原能力如图5所示,宿萼提取物和叶片提取物铁离子还原能力较强,分别为0.16 mmol Fe2+/g和0.12 mmol Fe2+/g。叶片和宿萼提取物均含有脂肪酸类和黄酮醇类化合物,其中脂肪酸能通过供氢或使双键断裂产生抗氧化活性[31],而黄酮醇类化合物因B环中邻苯二酚结构单元以及C环中羰基、2,3位双键及其上的羟基形成的P-π共轭体系均有利于其发挥抗氧化活性[32]。刘庆庆等[33]研究发现槲皮素和金丝桃苷在FRAP实验中均显示出较强还原能力,且金丝桃苷含量与FRAP呈正相关[34]。3种提取物中化合物组成复杂,在化合物间协同或拮抗作用综合影响下宿萼提取物还原能力稍优于叶片提取物。果实中较高水分含量使其有效成分含量较低,其展现了较低还原能力,0.08 mmol Fe2+/g。
3 结论
灯笼果不同部位的总酚含量和总黄酮含量分别为2.00~8.15 mg GAE/g DW和5.48~30.43 mg RT/g DW。相较于果实,叶片和宿萼提取物具有更高的总酚与总黄酮含量,化合物种类丰富且含量较高,但果实提取物也含有活性成分。灯笼果三部位提取物均表现出良好的自由基清除能力和铁离子还原能力,其中叶片提取物清除羟自由基活性最优,宿萼提取物具有良好的清除DPPH自由基和ABTS阳离子自由基活性及铁离子还原能力。本论文研究结果表明,灯笼果中次级代谢产物丰富,分离鉴定挑战性强,叶片、宿萼和果实3个部位均具有开发天然抗氧化剂的潜在价值。随着我国灯笼果种植产业的发展,应杜绝浪费绿色资源,在采收果实后合理利用其丰富的叶片和宿萼,科学增加灯笼果附加值,为抗氧化食品及医药领域相关产品开发提供优质原料。
[1] MU OZ P, PARRA F, SIMIRGIOTIS M J, et al. Chemical characterization, nutritional and bioactive properties of Physalis peruviana fruit from high areas of the Atacama desert[J]. Foods, 2021, 10(11):2699.
OZ P, PARRA F, SIMIRGIOTIS M J, et al. Chemical characterization, nutritional and bioactive properties of Physalis peruviana fruit from high areas of the Atacama desert[J]. Foods, 2021, 10(11):2699.
[2] FUKUSHIMA A, NAKAMURA M, SUZUKI H, et al. Comparative characterization of the leaf tissue of Physalis alkekengi and Physalis peruviana using RNA-seq and metabolite profiling[J]. Frontiers in Plant Science, 2016, 7:1883.
[3] STEIN A, COMPERA D, KARGE B, et al. Isolation and characterisation of irinans, androstane-type withanolides from Physalis peruviana L[J]. Beilstein Journal of Organic Chemistry, 2019, 15:2003-2012.
[4] FANG S T, LIU J K, LI B. A novel 1, 10-seco withanolide from Physalis peruviana[J]. Journal of Asian Natural Products Research, 2010, 12(7):618-622.
[5] PETER K K, ZIPPORAH N, FRANCIS M N, et al. In vitro antiplasmodial, cytotoxicity assay and partial chemical characterization of Kenyan Physalis peruviana L. (Solanaceae family) extracts[J]. Journal of Medicinal Plants Research, 2020, 14(2):73-80.
[6] KASALI F M, TUSIIMIRE J, KADIMA J N, et al. Ethnotherapeutic uses and phytochemical composition of Physalis peruviana L.: An overview[J]. The Scientific World Journal, 2021, 2021:5212348.
[7] 李振山, 孔倩倩, 刘燕琳. 酸浆果治疗糖尿病研究进展[J]. 中国当代医药, 2016, 23(20):18-20.LI Z S, KONG Q Q, LIU Y L. Research progress of Physalis Peruviana L. in the treatment of diebetes[J]. China Modern Medicine, 2016, 23(20):18-20.
[8] 夏秋霞, 段腾飞, 柳雅丽, 等. 真空耦合超声波提取酸浆果中黄酮的工艺研究[J]. 佳木斯大学学报(自然科学版), 2021, 39(1):95-101.XIA Q X, DUAN T F, LIU Y L, et al. Study on extraction technology of flavonoids from Physalis peruviana L. by vacuum coupled ultrasonic wave[J]. Journal of Jiamusi University (Natural Science Edition), 2021, 39(1):95-101.
[9] 马媛. 酸浆果黄酮的组分分析及体外活性的研究[D]. 太谷: 山西农业大学, 2016.MA Y. Component analysis and in vitro activity of flavonoids from sour berries[D]. Taigu: Shanxi Agricultural University, 2016.
[10] FIGUEIRA J A, PORTO-FIGUEIRA P, PEREIRA J A M, et al. Free low-molecular weight phenolics composition and bioactivity of Vaccinium padifolium Sm fruits[J]. Food Research International, 2021, 148:110580.
[11] SHENG Y Y, MA Z H, WANG X, et al. Ethanol organosolv lignin from different agricultural residues: Toward basic structural units and antioxidant activity[J]. Food Chemistry, 2022, 376:131895.
[12] 谭亮, 杲秀珍, 云忠祥, 等. 黄秋葵抗氧化活性研究[J]. 中成药, 2023, 45(3):829-835.TAN L, GAO X Z, YUN Z X, et al. Study of antioxidant activity of Abelmoschus esculentus[J]. Chinese Traditional Patent Medicine, 2023, 45(3):829-835.
[13] LIU Y T, HUANG W M, ZHANG C Y, et al. Targeted and untargeted metabolomic analyses and biological activity of Tibetan tea[J]. Food Chemistry, 2022, 384:132517.
[14] 翟小童, 韩林, 乔聪聪, 等. 玉米籽粒次生代谢物质分布及其抗氧化活性[J]. 食品科学, 2023, 44(2):296-303.ZHAI X T, HAN L, QIAO C C, et al. Secondary metabolite distribution and antioxidant activities of corn kernel[J]. Food Science, 2023, 44(2):296-303.
[15] LEZOUL N E H, BELKADI M, HABIBI F, et al. Extraction processes with several solvents on total bioactive compounds in different organs of three medicinal plants[J]. Molecules, 2020, 25(20):4672.
[16] IVANOVA T, POPOVA V, MAZOVA N, et al. Extracts from Physalis leaves (Physalis peruviana L.) for prospective application in medicine and cosmetics[J]. Ukrainian Food Journal, 2019, 8(1):34-44.
[17] 范姣姣. 基于液质联用技术的消癌解毒方药效物质基础研究[D]. 南京: 南京中医药大学, 2014.FAN J J. Study on pharmacological material basis of xiaoai Jiedu recipe based on LC-MS technology[D]. Nanjing: Nanjing University of Chinese Medicine, 2014.
[18] 钟艳梅, 冯毅凡, 郭姣. 基于UPLC-Q-TOF-MS的广佛手化学成分快速鉴定研究[J]. 天然产物研究与开发, 2014, 26(12):1965-1970; 2040.ZHONG Y M, FENG Y F, GUO J. Rapid identification of components from fructus citri sarcodactylis based on ultra-high performance liquid chromatography time-of-flight mass spectrometry[J]. Natural Product Research and Development, 2014, 26(12):1965-1970; 2040.
[19] 韦志. 海南砂仁活性成分研究及产品开发[D]. 南昌: 南昌大学, 2021.WEI Z. Study on active components of Amomum villosum in Hainan and its product development[D]. Nanchang: Nanchang University, 2021.
[20] 陈学钊. 豆腐柴叶物质基础及抗炎作用研究[D]. 杭州: 浙江大学, 2022.CHEN X Z. Study on material basis and anti-inflammatory effect of leaves of Tofu Chai[D]. Hangzhou: Zhejiang University, 2022.
[21] ESCUDERO-L PEZ B, CALANI L, FERN
PEZ B, CALANI L, FERN NDEZ-PACH
NDEZ-PACH N M S, et al. Absorption, metabolism, and excretion of fermented orange juice (poly)phenols in rats[J]. BioFactors, 2014, 40(3):327-335.
N M S, et al. Absorption, metabolism, and excretion of fermented orange juice (poly)phenols in rats[J]. BioFactors, 2014, 40(3):327-335.
[22] 马英华, 田婷婷, 解伟伟, 等. 采用UHPLC-Triple-TOF-MS法鉴定松萝主要酚酸类化学成分[J]. 中草药, 2016, 47(3):392-400.MA Y H, TIAN T T, XIE W W, et al. Major phenolic acids in usneae Filum by UHPLC-triple-TOF-MS[J]. Chinese Traditional and Herbal Drugs, 2016, 47(3):392-400.
[23] GAJBHIYE N A, MAKASANA J, KUMAR S. Accumulation of three important bioactive compounds in different plant parts of Withania somnifera and its determination by the LC-ESI-MS-MS (MRM) method[J]. Journal of Chromatographic Science, 2015, 53(10):1749-1756.
[24] XU D, HU M J, WANG Y Q, et al. Antioxidant activities of quercetin and its complexes for medicinal application[J]. Molecules, 2019, 24(6):1123.
[25] DARWISH A, SHAKER E. Physalis peruviana juice and seeds methanolic extracts; gas chromatography mass spectrometry; antioxidant and anticancer against human A549, HepG2[J]. Pharmacognosy Magazine, 2021, 17(73):1.
[26] COBALEDA-VELASCO M, ALANIS-BA UELOS R E, ALMARAZ-ABARCA N, et al. Phenolic profiles and antioxidant properties of Physalis angulata L. as quality indicators[J]. Journal of Pharmacy &Pharmacognosy Research, 2017, 5(1):114-128.
UELOS R E, ALMARAZ-ABARCA N, et al. Phenolic profiles and antioxidant properties of Physalis angulata L. as quality indicators[J]. Journal of Pharmacy &Pharmacognosy Research, 2017, 5(1):114-128.
[27] KOTHARI D, LEE W D, KIM S K. Allium flavonols: Health benefits, molecular targets, and bioavailability[J]. Antioxidants, 2020, 9(9):888.
[28] 杨超. 莲子心黄酮类化合物及其活性研究[D]. 广州: 广东工业大学, 2020.YANG C. Study on flavonoids from plumula Nelumbinis and their activities[D]. Guangzhou: Guangdong University of Technology, 2020.
[29] 唐燕霞. 硬枝树花的化学成分及药理作用研究[D]. 长春: 吉林农业大学, 2014.TANG Y X. Studies on chemical constituents and pharmacological effects of tree flowers with hard branches[D]. Changchun: Jilin Agricultural University, 2014.
[30] 房玉林, 孟江飞, 张昂, 等. 罐储时间对赤霞珠葡萄酒中酚类化合物及抗氧化活性的影响[J]. 食品科学, 2011, 32(11):14-20.FANG Y L, MENG J F, ZHANG A, et al. Effect of storage time on phenolic components and antioxidant activity of red wine[J]. Food Science, 2011, 32(11):14-20.
[31] 解玉军, 闫艳, 李泽, 等. 基于1H NMR和GC-MS技术评价不同干燥方法对酸枣仁活性成分及抗氧化活性的影响[J]. 食品工业科技, 2022, 43(21):282-293.XIE Y J, YAN Y, LI Z, et al. Evaluating the effects of different drying methods on the bioactive components and antioxidant activities of ziziphi spinosae Semen based on 1H NMR and GC-MS approach[J]. Science and Technology of Food Industry, 2022, 43(21):282-293.
[32] KAWABATA K, MUKAI R E, ISHISAKA A. Quercetin and related polyphenols: New insights and implications for their bioactivity and bioavailability[J]. Food &Function, 2015, 6(5):1399-1417.
[33] 刘庆庆, 张薇娜, 刘琴. 不同方法比较黄酮类化合物抗氧化性及其构效关系分析[J]. 食品工业科技, 2016, 37(23):109-114; 175.LIU Q Q, ZHANG W N, LIU Q. Comparison studies on antioxidant capacities of flavonoids by different assays and the structure-activity relationship implication[J]. Science and Technology of Food Industry, 2016, 37(23):109-114; 175.
[34] 范慧群. 草果酚类物质鉴定及其降血糖活性研究[D]. 南昌: 南昌大学, 2023.FAN H Q. Identification of phenols from Amomum tsaoko and study on its hypoglycemic activity[D]. Nanchang: Nanchang University, 2023.