花生含有大量的蛋白质、脂肪、碳水化合物和纤维素等,是一种营养丰富、口感醇厚的食物。近年来,由于食品供应链的全球化和饮食文化的多元化,花生和花生制品的消费量逐渐增加。然而,对于花生过敏原易过敏人群而言,即使接触到微量的花生成分也有可能会引起严重的皮肤、胃肠道以及呼吸系统等方面的过敏反应[1]。截至目前,已被鉴定出的花生过敏原有18种(Ara h l~Ara h 18),其中花生过敏原Ara h 2是引起花生过敏的主要致敏物质之一,占花生总蛋白量的5.9%~9.3%,其能够被90%以上花生过敏患者的IgE识别[2-4]。Ara h 2属于2S白蛋白家族,在结构上有4个二硫键,具有高度稳定性,传统的食品加工方式很难消除其致敏性[5-6]。为了保证食品安全和保护对花生过敏原成分易过敏人群,开发一种能够迅速、准确和高灵敏度检测花生过敏原Ara h 2存在和含量的方法至关重要。
目前,针对花生过敏原的检测方法主要有:聚合酶链式反应(polymerase chain reaction,PCR)[7]、质谱法(mass spectrometry,MS)[8]、酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)[9]等方法。PCR法灵敏度高,但易出现假阳性。MS法虽然可以对花生过敏原进行准确定量,但仪器操作难度高,样品处理过程较复杂。相比以上方法,ELISA方法具有灵敏度高、操作简单、快速、可应用于现场大规模快速检测等优点,在食物过敏原检测中被广泛使用[10]。目前,已有花生过敏原ELISA方法的报道[11-12],但在灵敏度上还存在一定的局限。近年来,化学发光酶免疫分析法(chemiluminescent enzyme-linked immunosorbent assay,CLEIA)受到了广泛的关注。CLEIA是将化学发光原理和酶联免疫吸附法原理相结合,与传统的ELISA相比,CLEIA不仅操作流程更简便,而且具有更高的检测灵敏度[13-15]。QUAN等[16]建立一种基于pAb的CLEIA法用于检测食物中伏马菌素B1,检出限为90 ng/L,IC50为320 ng/L,与使用相同抗体的ELISA相比,CLEIA的灵敏度提高了10倍,检测时间短了30%。令海英[17]利用化学发光法和ELISA法对100例乙肝患者进行乙肝病毒血清学检验,二者相比,化学发光法准确率更高。因此,CLEIA在食品、医疗等领域有着广泛的应用前景[18]。
本研究以自制的花生过敏原Ara h 2兔源pAb和鼠源单克隆抗体(monoclonal antibody,mAb)为基础,基于鲁米诺发光体系,建立一种间接双抗夹心CLEIA用于检测花生过敏原Ara h 2,并对其检测特性进行评价。旨在探索并建立一种快速灵敏的花生过敏原Ara h 2检测方法,更好的保护花生过敏原成分易过敏人群的食品安全。
1 材料与方料
1.1 材料与试剂
牛血清白蛋白(bovine serum albumin,BSA)、酪蛋白(casein)、大豆Kunitz胰蛋白酶抑制因子(KTI)、卵清蛋白(ovalbumin,OVA)溶液、大豆Bowman-Birk抑制剂(BBI)、弗氏完全佐剂(freund’s complete adjuvant,FCA)、大豆凝集素(soybean agglutinin,SBA)和弗氏不完全佐剂(freund’s incomplete adjuvant,FIC),美国Sigma-Aldrich试剂公司;花生过敏原Ara h 1、Ara h 2,美国INDOOR生物技术公司;HRP标记的山羊抗兔IgG抗体,索莱宝生物科技公司;超敏型ECL发光液,新赛美生物科技有限公司;Ara h 2鼠源mAb、Ara h 2兔源pAb及超纯水由实验室制备;包被缓冲液[0.05 mol/L碳酸盐缓冲液(carbonate buffer solution,CBS)];稀释缓冲液[0.01 mol/L磷酸盐缓冲液磷酸盐缓冲液[(phosphate buffer solution,PBS)];洗涤缓冲液[含0.05%tween-20的PBS(PBST)];封闭液(含质量分数5%脱脂奶的PBST溶液);豆奶,福建达利食品集团有限公司;其他试剂(均为市售分析级)。
1.2 仪器与设备
BSA224S型电子天平,德国Sartorius公司;Omega series BMG多功能酶标仪,德国BMG LABTECH公司;WH-866型漩涡混合机,上海康华生化仪器制造厂;SZCL-2型加热磁力搅拌器,巩义市予华仪器有限责任公司;HPX-9 052MBE型恒温培养箱,上海博迅实业有限公司。
1.3 实验方法
1.3.1 Ara h 2抗体的制备
1.3.1.1 兔源pAb的制备及免疫学特性评价
采用低剂量、多次免疫的方法,取2只健康的雌性新西兰大白兔,将Ara h 2蛋白与弗氏佐剂混合,完全乳化后,以100 μg/只的剂量进行背部皮下多点免疫,共进行4次免疫。首次免疫采用FCA与Ara h 2溶液进行乳化,后3次强化免疫将FCA替换为FIC,其他条件不变。4次免疫间隔10 d后,对新西兰大白兔的耳缘静脉进行取血,稀释到适当浓度,运用ELISA方法进行效价检测,当效价达到要求后,进行兔心脏采血,收集血液,将采集来的兔血4 ℃放置过夜后,4 500 r/min离心20 min,用移液枪将上清液取出后弃掉沉淀,用离心管分装后,在-80 ℃进行冻存。根据文献[11,19]所述的ELISA操作步骤。采用间接ELISA对兔源pAb进行效价检测,使用间接竞争ELISA对兔源pAb的敏感性进行检测。
1.3.1.2 鼠源mAb的制备及免疫学特性评价
取3只健康雌性BALB/c小鼠,以质量浓度为50 μg/mL的Ara h 2-弗氏佐剂乳液对每只小鼠进行背部皮下免疫200 μL。4次免疫后,将小鼠尾尖剪断进行采血,用ELISA方法测效价和敏感性,选择效价高,敏感性好的小鼠进行细胞融合实验。首先取小鼠眼球血后将小鼠处死,在无菌环境中剪开腹腔,取出小鼠脾脏,制备脾细胞悬液,采用PEG法对小鼠脾细胞和骨髓瘤细胞SP2/0进行细胞融合,将融合好的细胞加入96孔细胞培养板中进行培养,取细胞上清液进行阳性杂交瘤细胞株的筛选,以获得能够稳定分泌mAb的阳性杂交瘤细胞株。采用体内诱生腹水法,将处于对数旺盛生长期的阳性杂交瘤细胞株注射到提前免过液体石蜡的小鼠腹腔内,进行大量制备Ara h 2 mAb,约1~2周后,当小鼠腹部出现明显肿胀且精神状态变差时进行腹水采集,将采集的腹水4 500 r/min离心20 min,将上清液吸出,于-80 ℃冻存。运用ELISA方法对所获得的Ara h 2 mAb的效价和敏感性进行测定。具体方法步骤参照文献[20-21]进行。以鼠源mAb作为捕获抗体,兔源pAb作为检测抗体,建立检测Ara h 2的间接双抗夹心CLEIA方法。
1.3.2 间接双抗夹心CLEIA方法的建立
1.3.2.1 间接双抗夹心CLEIA方法基本步骤
a)使用CBS稀释mAb到1∶4 000倍,加入到化学发光酶标板中(100 μL/孔),4 ℃冰箱孵育8~12 h,PBST洗涤后拍干。
b)在37 ℃培养箱中用质量分数5%脱脂奶封闭液(200 μL/孔)封闭1 h后,PBST洗涤拍干,4 ℃冰箱保存备用。
c)根据试验需要,取已包被鼠源mAb的化学发光酶标板若干,恢复至室温,用PBS稀释Ara h 2标准品,加入化学发光酶标板中(100 μL/孔),并设置阴性孔,37 ℃培养箱中孵育30 min,PBST洗涤后拍干。
d)加入适当浓度的兔源pAb(100 μL/孔),37 ℃ 培养箱中孵育30 min,PBST洗涤后拍干。
e)加入封闭液的HRP标记的山羊抗兔IgG抗体(GaRIgG-HRP)溶液(100 μL/孔),37 ℃恒温培养箱中孵育30 min,PBST洗涤后拍干。
f)按照ECL发光液试剂盒使用说明要求将其中的A、B两种液体等量混合等量混合,以100 μL/孔加入化学发光酶标板孔中。读取发光信号强度(relative light unit,RLU)。
1.3.2.2 捕获抗体和检测抗体工作浓度的确定
采用方阵棋盘法优化最佳工作浓度[23]。
a)CBS将mAb分别稀释1 000、2 000、4 000、8 000 倍,将4个稀释倍数的mAb分别加入化学发光酶标板中(100 μL/孔),每个稀释倍数包被2行(包被程序同上)。
b)在包被相同稀释倍数mAb的两行中,第1行用PBS稀释Ara h 2标准品,加入化学发光酶标板中(100 μL/孔),第2行作为阴性孔仅加入PBS,37 ℃培养箱中孵育30 min,PBST洗涤拍干。
c)将兔源pAb分别稀释1 000、2 000、4 000、8 000、10 000、12 000倍,加入2列化学发光酶标板中(100 μL/孔),37 ℃培养箱中孵育30 min,PBST洗涤拍干。
其余试验步骤同1.3.1节中的e)、f)步骤,读取发光信号强度,计算比较各组P/N值,P/N值越大且N值越小越好,以确定最佳工作浓度。
1.3.2.3 灵敏度评价
为确定间接双抗夹心CLEIA的灵敏度,利用该方法检测了一系列浓度梯度的Ara h 2标准溶液。以检测所得阳性发光信号强度值与阴性值的比值作为纵坐标,标准溶液浓度对数值为横坐标,绘制间接双抗夹心CLEIA的标准曲线图。然后重复测量11次空白发光信号强度值,求出标准差(standard deviation,SD),根据3δ规则,通过公式(1)计算检出限(limit of detection,LOD),通过检出限来判定灵敏度,检出限越低,则灵敏度越高[24]。
(1)
式中:δ,回归方程的斜率;SD,空白样品读值的标准差。
1.3.2.4 准确度评价和精密度评价
以不含花生成分的大豆豆奶作为添加基质,进行添加回收实验。用PBS缓冲液将豆奶稀释10倍,然后用0.22 μm的滤膜过滤后,向所得滤液中加入不同量的Ara h 2标准品[22]。在同一时间段,进行检测,然后计算添加回收试验的平均回收率以评价方法的准确度,根据化学发光值计算批次内变异系数(coefficient of variation,CV)。在3个不同的时间段采用相同条件,分别对不同浓度的样品液进行CLEIA试验,根据其化学发光值计算批次间变异系数。通过批次内及批次间试验的变异系数来衡量精密度,CV值越低,精密度越高[25]。
1.3.2.5 特异性评价
以100 μg/mL的花生过敏原Ara h 1以及其他常见食物过敏原Casein、SBA、KTI、BBI、BSA、OVA的PBS溶液作为检测样品,按照间接双抗夹心CLEIA方法进行试验,计算P/N值。若P/N值均小于2.1,则表明所建立的方法特异性良好[26]。
2 结果与分析
2.1 花生过敏原Ara h 2抗体的制备
2.1.1 兔源pAb效价和敏感性测定
本实验共免疫新西兰大白兔4次,分别采用间接ELISA和间接竞争ELISA对兔源pAb的效价和敏感性进行测定,所测兔源pAb效价的OD450值,如表1所示,兔源pAb效价为1∶512 000。图1为Ara h 2对兔源pAb的抑制曲线,将抑制率(B/B0)作为纵坐标,Ara h 2质量浓度(ng/mL)的对数值作为横坐标,使用数据处理软件绘制抑制曲线图,得到线性方程:y=-0.374 2x+1.491 7,R2=0.990 8,当纵坐标值为0.5时,将其带入到线性回归方程中,可计算出多抗血清的IC50值为446.067 ng/mL,可满足以下实验要求。
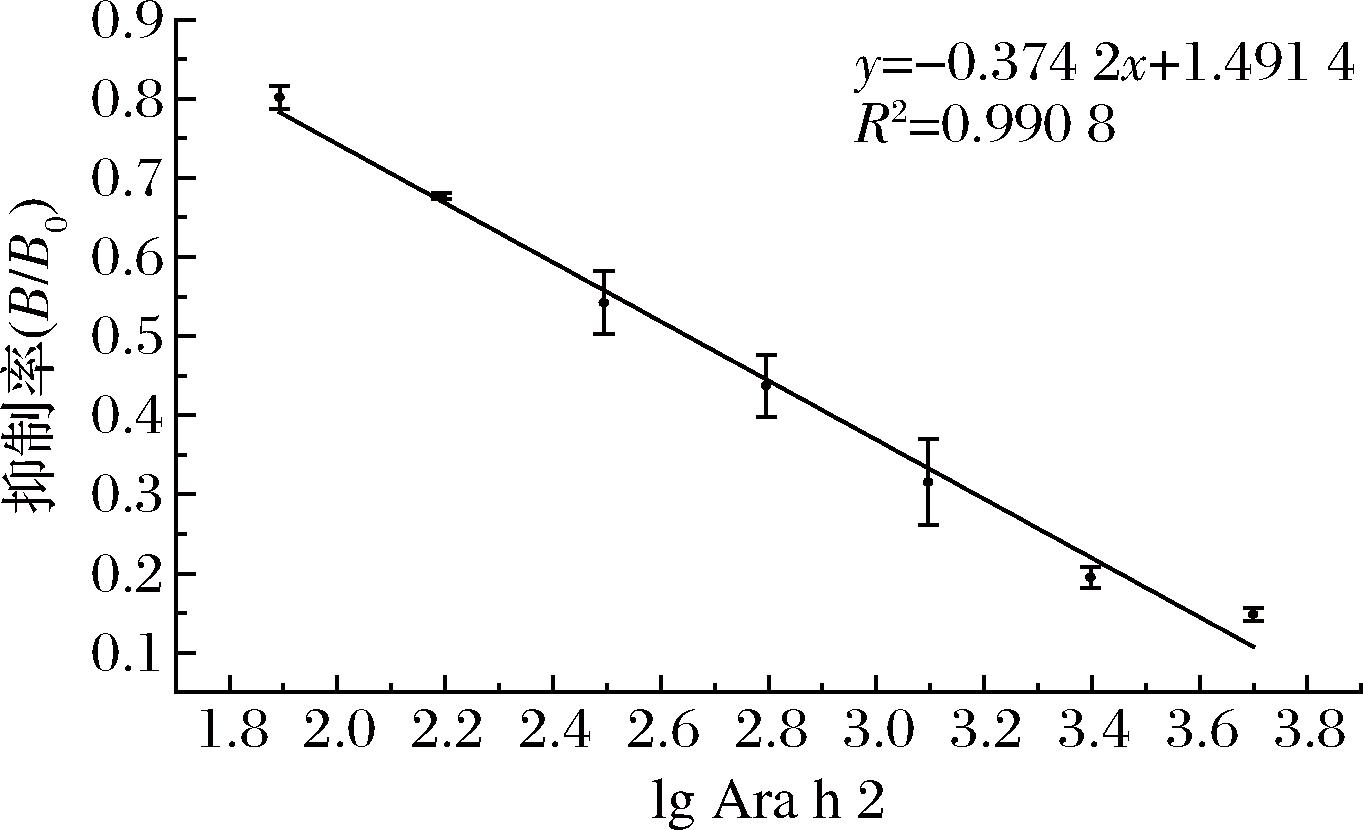
图1 Ara h 2对兔源多克隆抗体的抑制曲线
Fig.1 Inhibitory curve of Ara h 2 on rabbit polyclonal antibody
表1 兔源pAb效价测定结果
Table 1 Determination of pAb titer from rabbit
稀释倍数32 00064 000128 000256 000512 0001 024 000阴性对照空白对照OD450值1.6791.5170.6800.3540.2200.1330.0460.062
2.1.2 鼠源pAb效价和敏感性测定
采用间接ELISA对3只小鼠进行效价测定,表2为所测3只小鼠的OD450值,1号小鼠和3号小鼠效价达1∶12 800,2号小鼠效价为1∶1 600,对3只小鼠进行敏感性评价,3号小鼠敏感性最好,如图2所示,Ara h 2对3号小鼠多克隆抗体产生了明显的抑制效果,IC50值为471.07 ng/mL。选择3号小鼠进行后续实验。
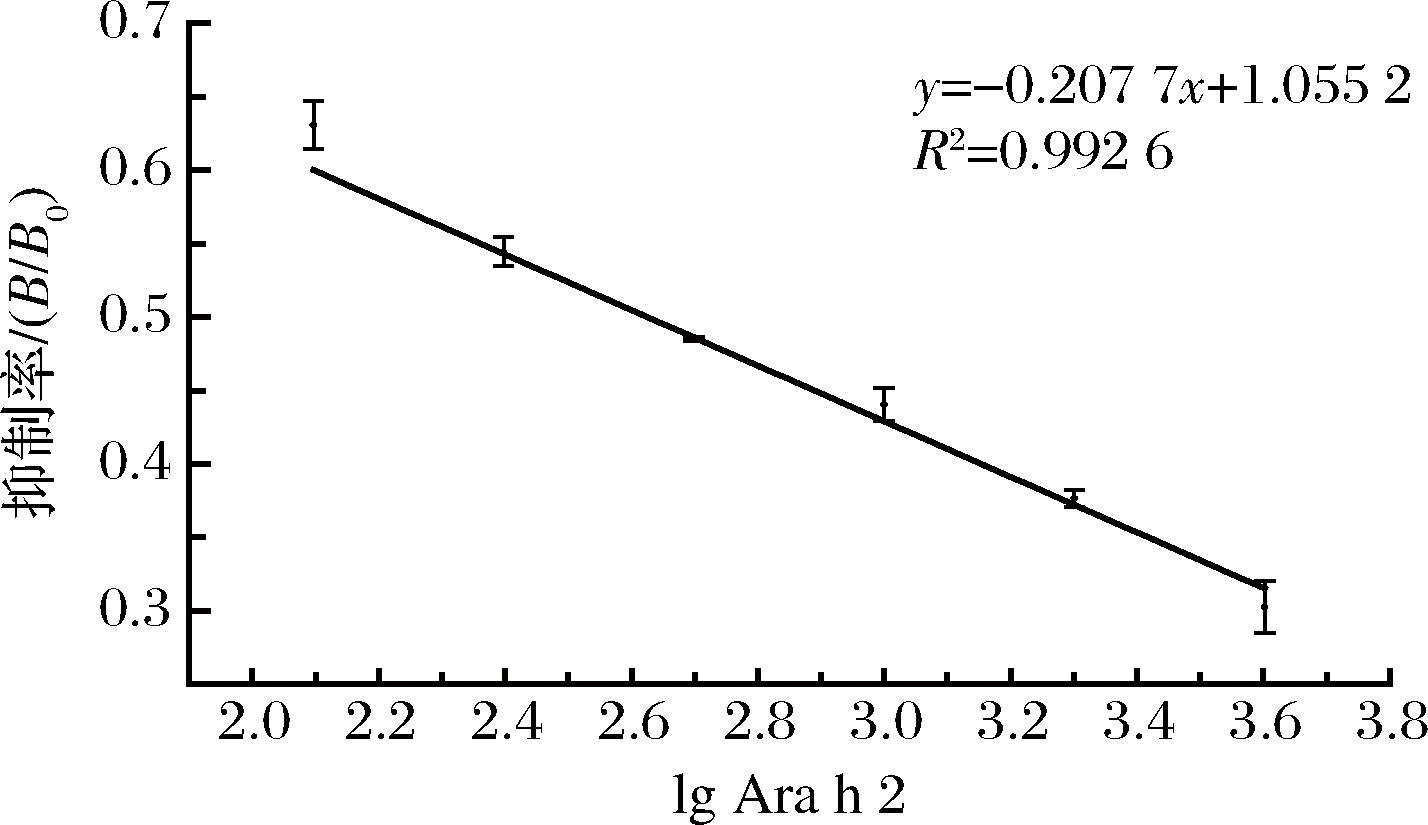
图2 Ara h 2对3号小鼠抑制曲线
Fig.2 Inhibition curve of Ara h 2 on No.3 mice
表2 鼠源多抗效价的间接ELISA测定结果
Table 2 indirect ELISA determination results of mouse polyclonal antibody titer
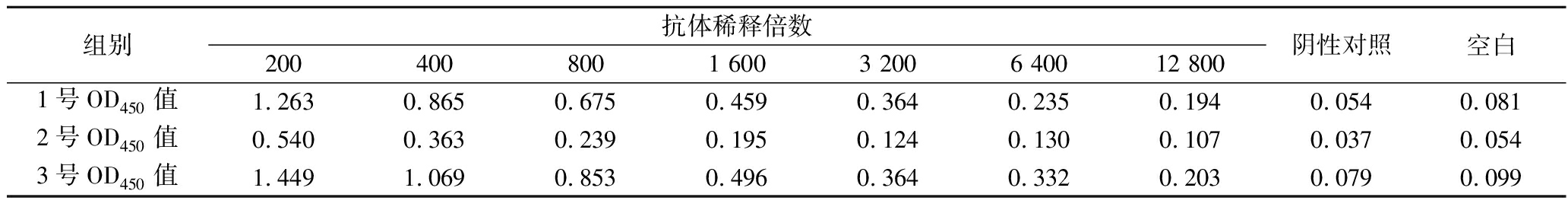
组别抗体稀释倍数2004008001 6003 2006 40012 800阴性对照空白1号OD450值1.2630.8650.6750.4590.3640.2350.1940.0540.0812号OD450值0.5400.3630.2390.1950.1240.1300.1070.0370.0543号OD450值1.4491.0690.8530.4960.3640.3320.2030.0790.099
2.1.3 鼠源mAb效价和敏感性测定
选择效价高敏感性好的3号小鼠进行细胞融合实验,最终通过ELISA方法对融合后的细胞进行系列筛选,得到一株能够稳定分泌抗Ara h 2 mAb的细胞株,命名为7B7B2,采用小鼠体内诱生腹水法得到大量7B7B2腹水,通过间接ELISA对7B7B2 mAb进行效价测定,如表3所示,效价达1∶256 000。通过间接竞争ELISA对7B7B2 mAb的敏感性进行测定,抑制曲线如图3所示。由抑制曲线的线性回归方程y=-0.433 4x+1.615 5,R2=0.991 1,计算得到7B7B2 mAb的IC50为374.80 ng/mL,相对于小鼠多克隆抗体,效价和敏感性有了显著提高。
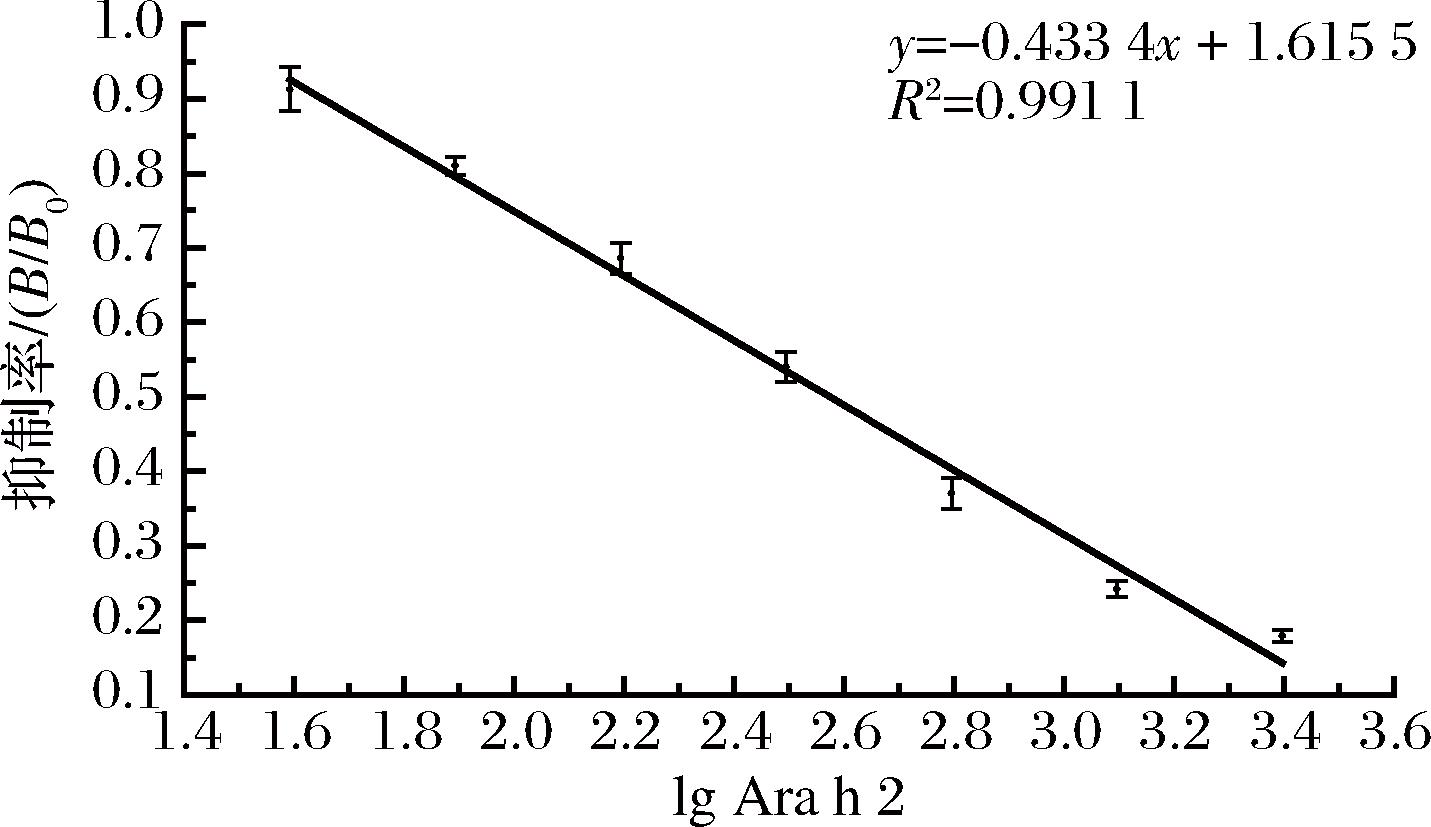
图3 Ara h 2对7B7B2 mAb的抑制曲线
Fig.3 Inhibition curve of Ara h 2 on 7B7B2 mAb
表3 7B7B2 mAb效价测定结果
Table 3 Determination Result of Mab titer of 7B7B2
抗体稀释倍数8 00016 00032 00064 000128 000256 000512 0001 024 000阴性对照空白OD450值1.5631.1510.7200.5700.3240.2220.1430.0640.0620.031
2.2 间接双抗夹心CLEIA方法的建立
2.2.1 抗体工作浓度的确定
以1 000 ng/mL的Ara h 2溶液作为阳性孔,采用方阵棋盘法确定鼠源mAb和兔源pAb的最佳工作浓度,结果如表4所示。选取P/N值最大且N值较小的抗体浓度为最佳工作浓度,当鼠源mAb稀释倍数为1∶4 000,兔源pAb稀释倍数为1∶10 000时,P/N值为62.690,达到最大,且N值较小,即确定鼠源mAb和兔源pAb的最佳稀释倍数分别为1∶4 000和1∶10 000。
表4 捕获抗体和检测抗体工作浓度的优化结果
Table 4 Optimization result of working concentration of capture antibody and detection antibody

7B7B2鼠源mAb稀释倍数Ara h 2兔源pAb稀释倍数1 0002 0004 0008 00010 00012 000P1 259 5541 192 4641 144 8251 043 228929 120793 7961 000N65 20453 92643 16626 93922 14722 986P/N19.31722.11326.52138.72641.95234.534P1 216 1041 171 4361 135 187981 767872 320750 4322 000N57 59743 03433 20420 29616 13714 687P/N21.11427.22134.18848.37254.05751.095P1 067 0971 080 140967 646802 504698 306570 6414 000N48 07335 86329 81216 18111 13910 824P/N22.19730.11832.45849.59562.69052.720P671 410518 823504 657421 265313 244210 3858 000N36 87130 37622 02713 03010 1048 932P/N18.21017.08022.91132.33031.00223.554
2.2.2 灵敏度评价
将Ara h 2标准溶液质量浓度用PBS缓冲液配制为400.000、200.000、100.000、50.000、25.000、12.500、6.250、3.125 ng/mL,用于建立检测Ara h 2的CLEIA标准曲线,如图4可知,该方法的线性检测范围为3.12~200 ng/mL,回归方程为y=31.803 0x-4.013 1,R2=0.990 3。采用重复多次检测空白样品的方法,用于计算检测结果SD,根据公式(1),计算方法检出限为1.085 ng/mL,利用相同的抗体,同时建立的夹心ELISA试验,绘制标准曲线如图5所示,计算其检出限为5.04 ng/mL,相比之下,间接双抗夹心CLEIA的灵敏度较高。
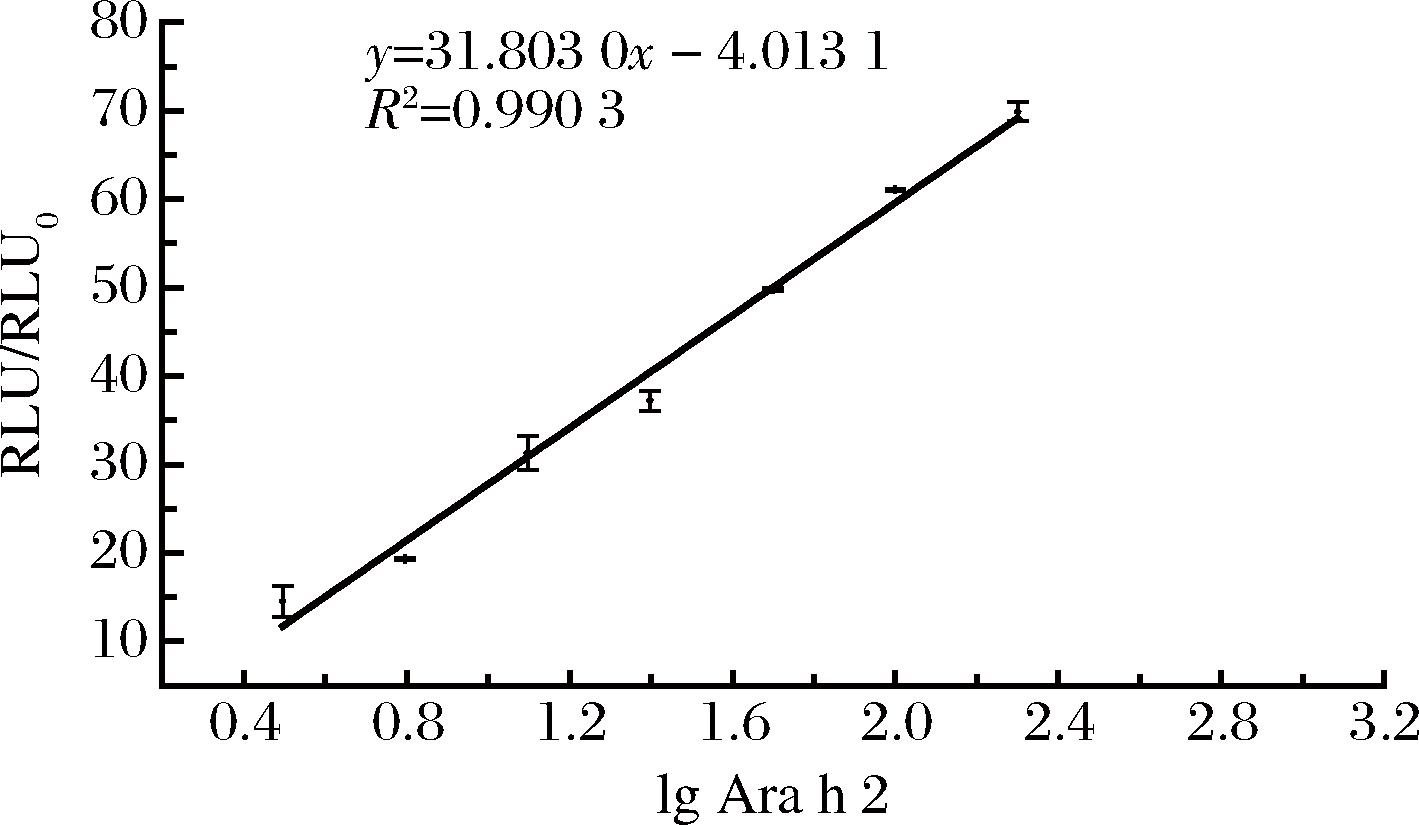
图4 Ara h 2 CLEIA检测方法标准曲线
Fig.4 Standard curve of Ara h 2 CLEIA detection method
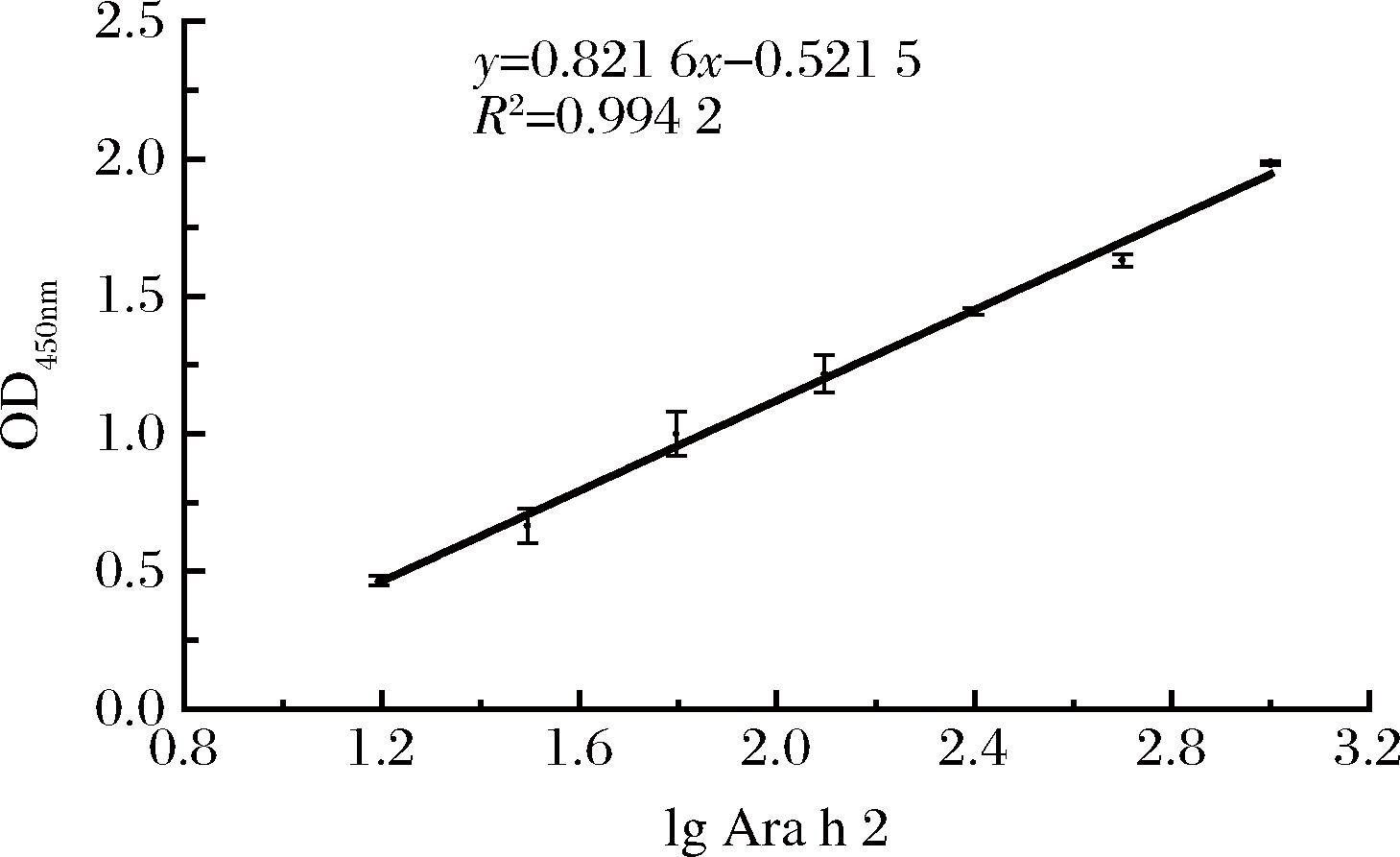
图5 Ara h 2 ELISA检测方法标准曲线
Fig.5 Standard curve of Ara h 2 ELISA detection method
2.2.3 准确度评价和精密度评价
将Ara h 2标准品添加到处理后的豆奶样品中,配制成3、25、200 ng/mL 3个质量浓度的溶液,使用所建立的方法重复进行6次测定。3个添加浓度溶液样品的平均回收率及批内、批间CV值结果如表5所示。批内试验平均添加回收率为83.66%~94.39%,CV值处于1.18%~2.09%,批间试验平均添加回收率为78.30%~87.76%,CV值处于3.71%~6.35%,样品的平均添加回收率在正常范围内,且CV值均小于10%,结果表明所建立的方法具有较好的准确度和精密度。
表5 间接双抗夹心CLEIA方法准确度和精密度评价结果
Table 5 Accuracy and precision identification results of indirect double antibody sandwich CLEIA method
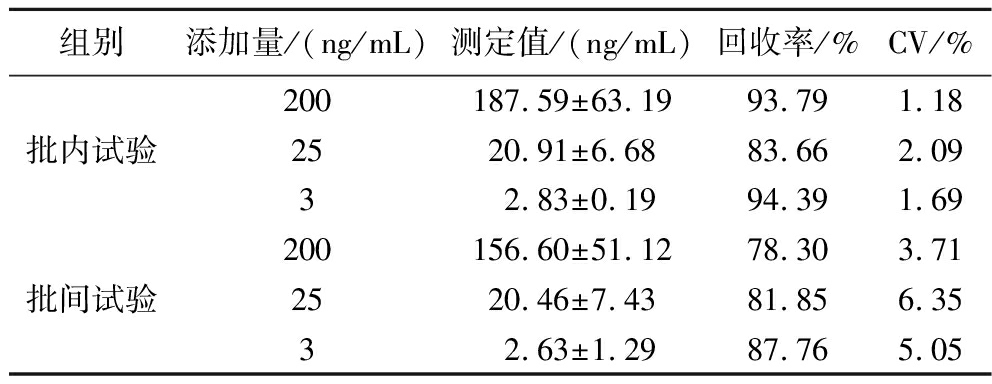
组别添加量/(ng/mL)测定值/(ng/mL)回收率/%CV/%200187.59±63.1993.791.18批内试验2520.91±6.6883.662.0932.83±0.1994.391.69200156.60±51.1278.303.71批间试验2520.46±7.4381.856.3532.63±1.2987.765.05
2.2.4 特异性评价
分别将Ara h 1、Casein、SBA、KTI、BBI、BSA和OVA配制成质量浓度为100 μg/mL的溶液,利用间接双抗夹心CLEIA方法进行检测,所得RLU值(P值)和阴性对照RLU值(N值)结果如图6所示。各过敏原的P/N值均小于2.1,证明建立的间接双抗夹心CLEIA方法特异性良好,与Ara h 1等过敏原均无交叉反应。
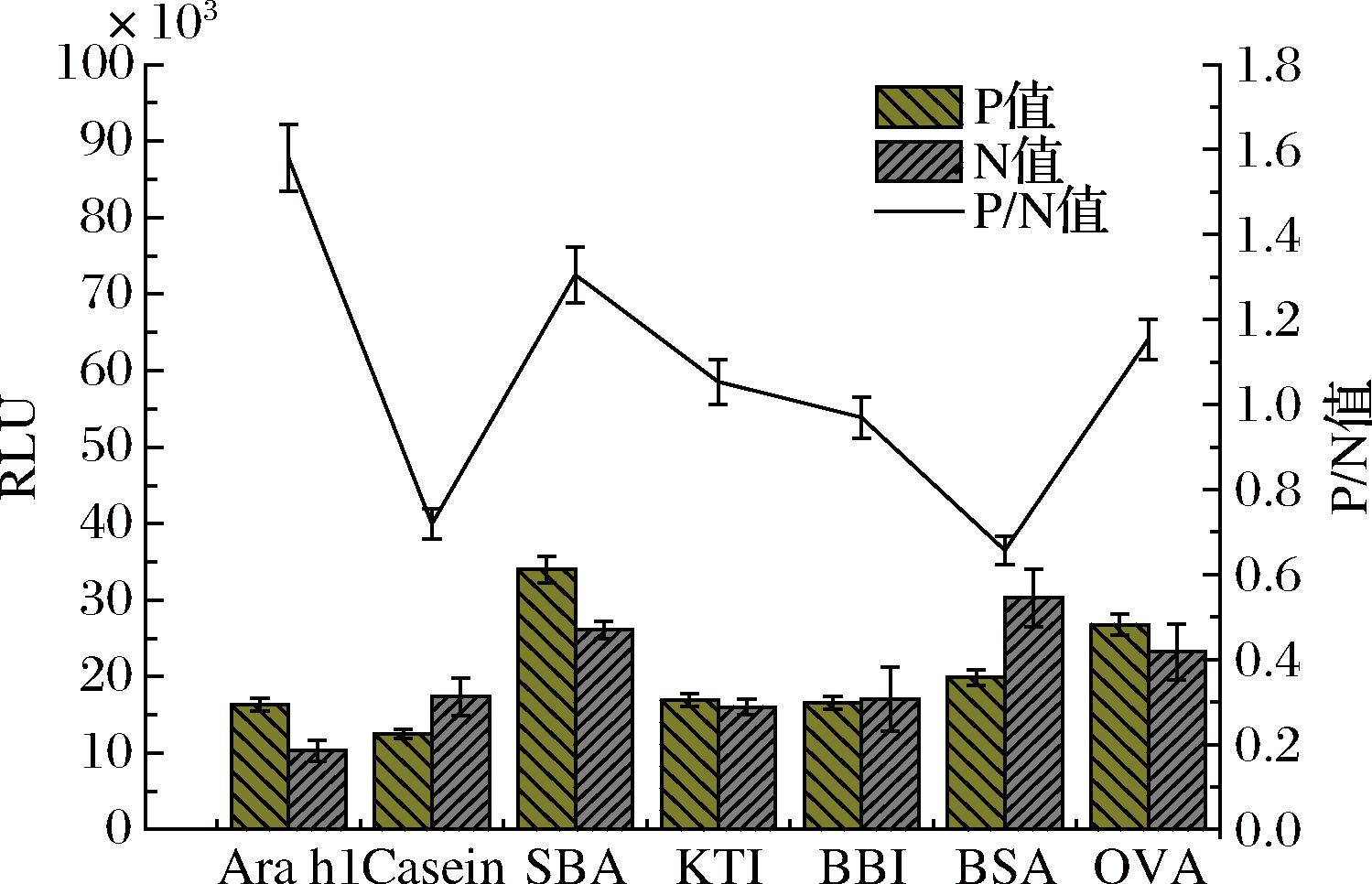
图6 间接双抗夹心CLEIA方法特异性评价结果
Fig.6 Specific identification results of indirect double antibody sandwich CLEIA method
3 结论
本研究制备了可识别Ara h 2的鼠源mAb和兔源pAb,采用夹心法检测模式,以鼠源mAb作为捕获抗体,提高对Ara h 2的特异性,以兔源pAb作为夹心检测抗体,增强对Ara h 2的识别能力,并采用鲁米诺发光体系,建立了可高灵敏检测花生过敏原Ara h 2间接双抗夹心CLEIA的方法。通过对该方法的抗体工作浓度的优化以及检测特性的评价,该方法检测限为1.08 ng/mL,而相同抗体所建立的双抗夹心ELISA检测方法的检出限为5.04 ng/mL,相比之下,间接双抗夹心CLEIA方法表现出更高的灵敏度。在添加回收试验中,该方法的回收率达到了78.30%~94.39%,CV值处于1.18%~6.35%,可以满足定量检测的需求,并且与Ara h 1等过敏原无交叉反应,所建立的Ara h 2间接双抗夹心CLEIA方法可为食品中Ara h 2过敏原成分检测提供可靠的技术支持。
[1] CHIZOBA EKEZIE F G, CHENG J H, SUN D W.Effects of nonthermal food processing technologies on food allergens:A review of recent research advances[J].Trends in Food Science and Technology, 2018, 74:12-25.
[2] 赵兴华. 栽培种花生过敏原蛋白的鉴定与分子进化研究[D].福州:福建农林大学, 2020.ZHAO X H.Identification and molecular evolution of allergenic proteins from cultivated peanut species[D].Fuzhou:Fujian Agriculture and Forestry University, 2020.
[3] HEMMINGS O, DU TOIT D G, RADULOVIC S, et al.Ara h 2 is the dominant peanut allergen despite similarities with Ara h 6[J].The Journal of Allergy and Clinical Immunology, 2020, 146(3):621-630.
[4] 田阳, 饶欢, 陶莎, 等.花生致敏蛋白Ara h 2提取纯化及免疫分析[J].粮食与油脂, 2016, 29(12):29-32.TIAN Y, RAO H, TAO S et al.Purification and immune identification of peanut allergen Ara h 2[J].Cereals &Oils, 2016, 29(12):29-32.
[5] 韩远龙, 吴志华, 李璞, 等.花生过敏原结构及加工研究进展[J].食品科学, 2013, 34(9):310-315.HAN Y L, WU Z H, LI P, et al.Progress in research on peanut allergens and effect of processing on their structure[J].Food Science, 2013, 34(9):310-315.
[6] 王闽佳, 丁岩汀, 陈嘉惠, 等.不同处理方式对花生蛋白致敏性的影响[J].食品研究与开发, 2019, 40(3):206-212.WANG M J, DING Y T, CHEN J H, et al.Influence of different treatments on the allergenicity of peanut protein[J].Food Research and Development, 2019, 40(3):206-212.
[7] SANCHIZ A, SANCHEZ-ENCISO P, CUADRADO C, et al.Detection of peanut allergen by real-time PCR:Looking for a suitable detection marker as affected by processing[J].Foods, 2021, 10(6):1421.
[8] DALY M, ANSARI P, H UBL G, et al.Assessing almond and peanut allergens using commercially available immunoanalytical kits and LC-MS/MS:A case study[J].Journal of AOAC International, 2018, 101(1):96-101.
UBL G, et al.Assessing almond and peanut allergens using commercially available immunoanalytical kits and LC-MS/MS:A case study[J].Journal of AOAC International, 2018, 101(1):96-101.
[9] 刘胜男, 孟继秋, 王珊, 等.花生致敏蛋白免疫学检测方法研究进展[J].粮食与油脂, 2020, 33(11):14-16.LIU S N, MENG J Q, WANG S, et al.Research progress on immunological methods in peanut allergenic proteins detection[J].Cereals &Oils, 2020, 33(11):14-16.[10] 王成宾, 胡骁飞, 孙亚宁, 等.花生致敏蛋白及其检测方法研究进展[J].食品与发酵工业, 2022, 48(18):292-299.WANG C B, HU X F, SUN Y N, et al.Peanut allergenic protein and current methods of detection:A review[J].Food and Fermentation Industries, 2022, 48(18):292-299.
[11] 闫飞, 周宁菱, 罗春萍, 等.基于Ara h 6的花生间接竞争ELISA检测方法的建立[J].食品工业科技, 2012, 33(17):303-306.YAN F, ZHOU N L, LUO C P, et al.A method for detecting peanut based on Ara h 6 by indirect competitive enzyme-linked immuno sorbent assay[J].Science and Technology of Food Industry, 2012, 33(17):303-306.
[12] 吉坤美, 陈家杰, 汤慕瑾, 等.双抗体夹心ELISA法测定食物中花生过敏原蛋白成分[J].食品研究与开发, 2009, 30(6):110-114.JI K M, CHEN J J, TANG M J, et al.Detection of peanut allergen protein trace in food products by sandwich-antibody enzyme linked immunosorbent assay[J].Food Research and Development, 2009, 30(6):110-114.
[13] 李静雯, 刘清珺, 杜美红, 等.化学发光免疫分析技术在微生物检测中的应用[J].分析测试学报, 2017,36(11):1409-1416. LI J W, LIU Q J, DU M H, et al.Application of chemiluminescence immunoassay in microbiological detection[J].Journal of Instrumental Analysis, 2017,36(11):1409-1416.
[14] 刘享享, 兰文军.化学发光免疫分析在调味食品原料安全检测中的应用[J].中国调味品, 2018, 43(6):176-179;186.LIU X X, LAN W J.Application of chemiluminescence immunoassay in seasoning food ingredients safety detection[J].China Condiment, 2018, 43(6):176-179;186.
[15] XIE G, ZHU M, LIU Z J, et al.Development and evaluation of the magnetic particle-based chemiluminescence immunoassay for rapid and quantitative detection of aflatoxin B1 in foodstuff[J].Food and Agricultural Immunology, 2018, 29(1):564-576.
[16] QUAN Y, ZHANG Y, WANG S, et al.A rapid and sensitive chemiluminescence enzyme-linked immunosorbent assay for the determination of fumonisin B1 in food samples[J].Analytica Chimica Acta, 2006, 580(1):1-8.
[17] 令海英. 化学发光与酶联免疫吸附试验在乙肝病毒血清学检验中的应用对比[J].智慧健康, 2023, 9(23):13-16;21.LING H Y.Application comparison of chemiluminescence and ELISA in serological test of hepatitis B virus[J].Smart Healthcare, 2023, 9(23):13-16;21.
[18] 蒋艳, 余姓鸿, 谢礼, 等.化学发光免疫方法在食品安全检测中的应用及展望[J].食品安全质量检测学报, 2020, 11(20):7603-7609.JIANG Y, YU X H, XIE L, et al.Application and prospect of chemiluminescence immunoassay in food safety detection[J].Journal of Food Safety and Quality, 2020, 11(20):7 603-7 609.
[19] 皮江一, 席俊, 贺梦雪, 等.β-伴大豆球蛋白多克隆抗体的制备及纯化前后免疫学特性鉴定[J].粮食与油脂, 2018, 31(4):51-53.PI J Y, XI J, HE M X, et al.Preparation of polyclonal antibody against β-conglycinin and identification of their immunological properties before and after purification[J].Cereals and Oils, 2018, 31(4):51-53.
[20] 胡骁飞, 李燕虹, 邢云瑞, 等.高亲和力大豆凝集素单抗制备及免疫学特性鉴定[J].核农学报, 2020, 34(11):2477-2483.HU X F, LI Y H, XING Y R, et al.Preparation and immunological characteristics identification of soybean agglutinin’s monoclonal antibody with high affinity[J].Journal of Nuclear Agricultural Sciences, 2020, 34(11):2477-2483.
[21] 王耀. 大豆致敏蛋白glycinin和β-conglycinin免疫学快速检测技术研究[D].杨陵:西北农林科技大学, 2015.WANG Y.Immunological rapid detection technology of soybean allergenic proteins glycinin and β-conglycinin[D].Yangling:Northwest A and F University, 2015.
[22] 王耀, 刘胜男, 邢荣花, 等.双抗体夹心ELISA检测花生致敏蛋白Ara h 2的方法建立[J].食品工业, 2021, 42(3):290-293.WANG Y, LIU S N, XING R H, et al.Establishment of double antibody sandwich ELISA for Peanut Al ergenic protein Ara h 2[J].Food Industry, 2021, 42(3):290-293.
[23] 董阳灿, 唐昊.时间分辨荧光结合微流控芯片技术应用于肌红蛋白的便捷检测[J].中国科技论文在线精品论文, 2022, 15(4):507-513.DONG Y C, TANG H.Time-resolved fluorescence combined with microfluidic chip technology for convenient detection of myoglobin[J].Highlights of Sciencepaper Online, 2022, 15(4):507-513.
[24] PENG J, SONG S S, LIU L Q, et al.Development of sandwich ELISA and Immunochromatographic strip for the detection of peanut allergen Ara h 2[J].Food Analytical Methods, 2015, 8(10):2605-2611.
[25] WANG Y, LI Y H, WU J B, et al.Development of an immunochromatographic strip test for the rapid detection of soybean Bowman-Birk inhibitor[J].Food and Agricultural Immunology, 2019, 30(1):1202-1211.
[26] XU L G, SONG Y H, LIU L Q, et al.Sandwich ELISA and immunochromatographic strip of Kunitz trypsin inhibitor using sensitive monoclonal antibodies[J].Food and Agricultural Immunology, 2016, 27(6):772-782.