肉苁蓉(Cistanches Herba)为列当科植物肉苁蓉或管花肉苁蓉的干燥带鳞叶的肉质茎,最早见于《神农本草经》,位列上品,是一种药食两用的珍贵中药材,因其多生长于内蒙古、新疆、甘肃、宁夏等干旱地区,还有“沙漠人参”的美誉。肉苁蓉性甘、咸、温,归肾、大肠经;具有补肾阳、益精血、润肠通便等功效,常用于治疗肾阳不足、精血亏虚、阳痿不孕、筋骨无力等疾病[1-4]。苯乙醇苷类成分是肉苁蓉中最主要的活性成分,也是肉苁蓉成分研究中被报道的最多的一类物质[5]。
肉苁蓉传统寄主植物为藜科梭梭属植物梭梭[Haloxylon ammodendron (C.A.Mey.) Bunge],但梭梭生长缓慢,且经济价值不高,小于3年龄的梭梭植株很难用于培育肉苁蓉。为了缓解肉苁蓉药材市场的供求矛盾,提高肉苁蓉产量,实现肉苁蓉规模化和规范化培育。科研人员在甘肃引种四翅滨藜[Atriplex canescens(Pursh)Nutt]成功,但这一树种能否作为肉苁蓉新的寄主植物,且生长表现是否优于梭梭则成为广泛关注的热点问题[6]。四翅滨藜能否完全替代梭梭来培育肉苁蓉仍然需要更广泛、更全面和深入的基础研究成果来支撑。在我国,尽管从引种育苗、成分分析等方面对四翅滨藜开展了较广泛的研究[7-10],但对四翅滨藜接种肉苁蓉的报道非常缺乏。过去主要集中在对肉苁蓉生长动态、药理等的开发利用特征方面的研究[11-14],而对2种寄主肉苁蓉有效成分的研究还未见报道,尤其是采用不同干燥工艺后2种寄主肉苁蓉活性成分的保留量差异的研究尚不多见。
超高效液相色谱-三重四极杆串联质谱(ultra-high performance liquid chromatography-triple quadrupole mass spectrometry, UPLC-QQQ-MS)是以UPLC为色谱分离系统,三重四极杆作为分析器串联而成的一种液质联用技术,对多组分复杂体系分离效果好,可迅速、准确地对中药复杂成分进行定量分析[15-16]。本实验采用UPLC-QQQ-MS技术测定2种寄主肉苁蓉经过不同干燥处理后的干燥品中松果菊苷、毛蕊花糖苷、异毛蕊花糖苷、管花苷A等10种苯乙醇苷类成分进行定量分析,比较不同干燥方式和不同寄主肉苁蓉中这些成分的含量,为肉苁蓉的苯乙醇苷类开发及精准利用提供理论依据。
1 材料与方法
1.1 材料与试剂
梭梭寄生肉苁蓉和四翅滨黎寄生肉苁蓉均采于甘肃省景泰县肉苁蓉种植基地,采收时间为2023年3月,经甘肃农业大学郭晔红教授鉴定为肉苁蓉带鳞叶的肉质茎。对照品松果菊苷(C35H46O20,CAS号:82854-37-3,纯度98.30%)、毛蕊花糖苷(C29H36O15,CAS号:61276-17-3,纯度99.35%)、管花苷A(C37H48O21,CAS号:112516-05-9,纯度99.74%)、异毛蕊花糖苷(C29H36O15,CAS号:61303-13-7,纯度97.77%)、栀子苷(C17H24O10,CAS号:24512-63-8,纯度99.11%)、2′-乙酰毛蕊花糖苷(C31H38O16,CAS号:94492-24-7,纯度97.12%)、红景天苷(C14H20O7,CAS号:10338-51-9,纯度98.43%)、益母草苷(C15H24O9,CAS号:52949-83-4,纯度97.64%)、肉苁蓉苷A(C36H48O20,CAS号:93236-42-1,纯度93.24%)、管花苷B(C31H38O16,CAS号:112516-04-8,纯度98.57%),成都普菲德生物技术有限公司;甲醇、乙腈均为色谱纯,上海安谱试验科技股份有限公司;甲酸,天津科密欧化学试剂有限公司;水为超纯水。
1.2 仪器与设备
DESKTOP-T2G6S78【460超高效液相色谱-三重四极杆串联质谱仪,美国Agilent公司;AL104电子分析天平,瑞士梅特勒-托利多仪器有限公司;LyoQuest-85冷冻干燥机,西班牙泰事达公司。
1.3 实验方法
1.3.1 不同干燥工艺肉苁蓉样品制备
将不同寄主肉苁蓉鲜品切制成3 mm的厚片,按如下操作进行处理。
(1)晒干:将切片蒸5 min后平铺于阳光充沛处晾晒,检测含水量的变化,当含水量<10%时收起备用。
(2)烘干:将切片蒸5 min后置于40、60、80 ℃烘箱内烘干,烘至含水量<10%时收起备用。
(3)真空冷冻干燥:将切片置于-80 ℃冰箱内预冷2 h后,放入真空冷冻干燥机中(真空度650 Pa、冷冻温度-55 ℃),干燥48 h后收起备用。
1.3.2 色谱条件
Agilent Eclipse Plus C18柱(2.1 mm×150 mm,1.8 μm);流速:0.3 mL/min;进样量1 μL;流动相:A相为0.1%甲酸水溶液,B相为色谱乙腈。流动相A、B的洗脱梯度为0~1.5 min,10%~15% B;1.5~2 min,15%~20% B;2~3 min,20%~25% B;3~4 min,25%~30% B;4~5 min,30%~32% B;5~6 min,32%~34% B;6~7 min,34%~36% B;7~8 min,36%~38% B;8~9 min,38%~40% B;9~9.5 min,40%~45% B;9.5~9.6 min,45%~10% B;9.6~10 min,10% B。
1.3.3 优化的质谱条件
离子源类型:电子喷雾离子源;扫描方式:负离子扫描;离子源温度:350 ℃;雾化器:35 psi;多反应监测模式及动态多反应模式监测分析各个化合物。10种物质质谱优化后条件见表1。
表1 优化的10种化合物的质谱条件
Table 1 Optimized mass spectrometry conditions for 10 compounds

化合物母离子m/z定性离子m/z定量离子m/z保留时间/min电压/V碰撞能量/eVESI电离模式管花苷A827.3161.0665.24.61722044N毛蕊花糖苷623.2161.0461.14.86115729N松果菊苷785.3161.1623.34.00817241N异毛蕊花糖苷623.2161.0461.15.1311305N栀子苷387.2101.0225.13.5941825N2′-乙酰毛蕊花糖苷665.2161.0461.25.61717737N红景天苷299.189.1119.13.162939N益母草苷347.2167.2184.82.0941305N管花苷B665.2161.0461.26.09117737N肉苁蓉苷A799.3161.0431.14.38620545N
注:N表示负离子检测模式。
1.3.4 对照品溶液及标准曲线溶液的制备
精密称取松果菊苷、毛蕊花糖苷、管花苷A、异毛蕊花糖苷、栀子苷、2′-乙酰毛蕊花糖苷、红景天苷、益母草苷、肉苁蓉苷A及管花苷B标准品粉末,加50%甲醇制成每1 mL各含0.2 mg的混合对照品溶液;用50%甲醇稀释成40.96、102.4、256、640、1 600、4 000 μg/L的标准系列混合溶液,按1.3.2、1.3.3节条件从低浓度到高浓度依次进样,再利用定量软件(agilent mass hunter)采用过原点的标准曲线对检测结果进行处理。以物质量浓度为X(ng/mL)为横坐标、离子响应值Y为纵坐标进行线性回归,计算回归方程和相关系数,如表2所示,10种苯乙醇苷类成分在各自的浓度范围内与离子响应值线性关系良好。
表2 10种对照品的线性关系及相关系数
Table 2 Linear equation and correlation coefficient (R2) of 10 compounds

对照品线性方程相关系数R2管花苷Ay=0.957 011x+23.654 2150.999 89毛蕊花糖苷y=2.482 821x+654.119 7690.999 80 松果菊苷y=0.734 268x+216.795 5100.999 70 异毛蕊花糖苷y=2.089 291x+196.836 8320.999 98栀子苷y=0.004 623x+1.174 1830.999 222′-乙酰毛蕊花糖苷y=3.212 423x+180.159 0380.999 99红景天苷y=0.005 467x+0.381 2320.999 88益母草苷y=0.004 880x-0.259 8540.999 21管花苷By=3.540 941x+1468.085 3110.998 27肉苁蓉苷Ay=2.878 539x+225.137 3560.999 99
1.3.5 供试品溶液的制备
取肉苁蓉粉末(过四号筛)约0.2 g,精密称定,置于10 mL离心管中,精密加入40倍50%甲醇溶液,浸泡30 min,超声提取40 min(功率250 W,频率35 kHz),放冷,加入50%甲醇溶液补足失量,摇匀,取上清液,用0.22 μm膜滤过,即得。
1.3.6 方法学考察
1.3.6.1 精密度试验
取混合对照品溶液,按1.3.2节、1.3.3节条件连续进样测定6次,计算得到松果菊苷、毛蕊花糖苷、管花苷A、异毛蕊花糖苷、栀子苷、2′-乙酰毛蕊花糖苷、红景天苷、益母草苷、肉苁蓉苷A、管花苷B峰面积的相对标准差(relative standard deviation,RSD)分别为0.98%、0.68%、0.91%、0.49%、0.77%、0.79%、0.84%、0.69%、0.54%、0.62%,说明仪器精密度良好。
1.3.6.2 稳定性试验
吸取同一肉苁蓉供试品溶液,按1.3.2节、1.3.3节条件,于0、2、4、6、8、10、12、24 h进样测定,计算得到上述成分峰面积的RSD分别为0.28%、0.43%、0.75%、1.14%、0.89%、1.07%、1.23%、1.01%,表明该仪器精密度良好。
1.3.6.3 重复性试验
取同一批供试品6份,每份1.0 g称定,按1.3.5节方法制备供试品溶液,按1.3.2节、1.3.3节条件进样测定,计算上述10种成分含量的RSD分别为0.41%、0.27%、0.49%、0.36%、0.57%、0.97%、0.24%、0.61%、0.32%、0.63%,表明该方法重复性良好。
1.3.6.4 加样回收率试验
取已分析检测10种苯乙醇苷类成分含量供试品溶液,分别加入与样品中10种苯乙醇苷类成分相同的对照品储备液(每种成分质量浓度均为100 μg/L)的50%、100%、150%,按1.3.2节、1.3.3节条件进样测定,计算得到上述10种成分的加样回收率为100.21%~107.92%,RSD为0.03%~1.09%,见表3。由此可见,该方法准确性良好。
表3 10种苯乙醇苷类成分的回收率和相对标准差
Table 3 Recoveries and RSDs of ten phenylethanoid glycosides
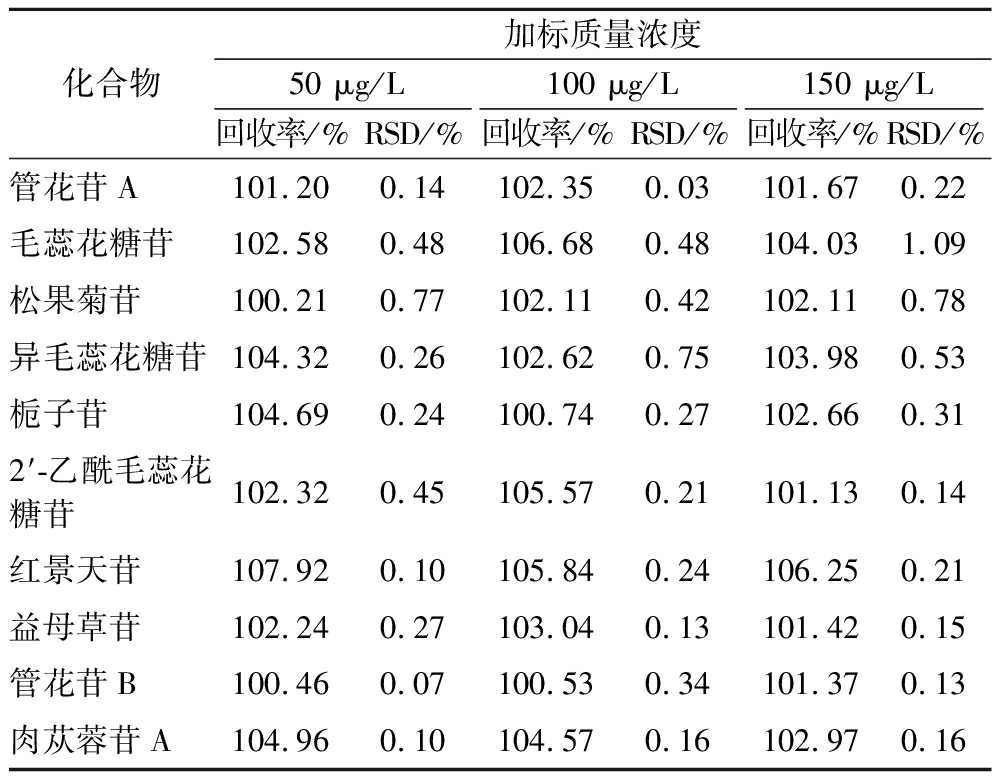
化合物加标质量浓度50 μg/L100 μg/L150 μg/L回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%管花苷A101.200.14102.350.03101.670.22毛蕊花糖苷102.580.48106.680.48104.031.09松果菊苷100.210.77102.110.42102.110.78异毛蕊花糖苷104.320.26102.620.75103.980.53栀子苷104.690.24100.740.27102.660.312′-乙酰毛蕊花糖苷102.320.45105.570.21101.130.14红景天苷107.920.10105.840.24106.250.21益母草苷102.240.27103.040.13101.420.15管花苷B100.460.07100.530.34101.370.13肉苁蓉苷A104.960.10104.570.16102.970.16
2 结果与分析
2.1 样品方差分析
采用SPSS 20.0.0,规定5种干燥方式为自变量,10种苯乙醇苷类成分的含量为因变量,进行单因素方差分析(表4、表5)。分析结果表明,四翅滨黎寄生肉苁蓉和梭梭寄生肉苁蓉的主要化学成分基本相同,但含量差距较大,而且除毛蕊化糖苷外,不同的干燥处理对所检测的每一种苯乙醇苷类成分都具有显著差异(P<0.05),其中在四翅滨藜寄主的肉苁蓉中,晒干处理后的肉苁蓉中栀子苷含量最高,80 ℃烘干处理后的肉苁蓉中益母草苷、红景天苷、肉苁蓉苷A含量最高,冷冻干燥处理后的肉苁蓉中松果菊苷、管花苷A、毛蕊花糖苷、异毛蕊花糖苷、管花苷B和2′-乙酰毛蕊花糖苷含量最高;在梭梭寄主的肉苁蓉中,晒干处理后的肉苁蓉中栀子苷含量最高,80 ℃烘干处理后的松果菊苷、肉苁蓉苷A含量最高,冷冻干燥处理后的红景天苷、管花苷A、毛蕊花糖苷、管花苷B、异毛蕊花糖苷和2′-乙酰毛蕊花糖苷含量最高。
表4 四翅滨藜寄主肉苁蓉10种苯乙醇苷类成分在不同干燥样品中的含量(n=3) 单位:ng/mg Table 4 Determination of ten phenylethanoid glycosides from Atriplex canescens Cistanches Herbai by different drying methods

化合物干燥方式晒干40 ℃烘干60 ℃烘干80 ℃烘干冷冻干燥益母草苷134 217.33±1 688.80b62 879.30±1 806.35d84 238.33±2 816.55c152 491.67±989.08a33 883.07±132.78e红景天苷2 245.48±21.82e 7 849.82±5.76b2 456.02±41.06d13 424.57±1.09a3 064.90±0.52c栀子苷7 766.82±13.03a 385.70±1.52e3 863.76±34.52c4 932.99±4.31b875.13±2.89d松果菊苷 85.38±1.34e16 954.93±44.10d54 706.27±200.63c71 699.30±44.54b115 876.67±54.78a肉苁蓉苷A9 891.46±6.83e 13 894.10±5.81b12 151.40±5.52c18 532.13±80.91a12 049.00±35.05d管花苷A 313.71±0.92e1 748.25±11.20d6 738.20±21.58b5 635.33±28.11c35 480.97±306.77a毛蕊花糖苷 92.80±0.24c1 726.41±7.73c45 638.90±487.39b41 584.33±445.08b133 615.33±8 093.98a异毛蕊花糖苷255.55±3.16e1 221.95±24.30d9 484.40±2.97c12 795.53±34.58b68 749.40±679.94a管花苷B142.778±1.80d 55.51±0.27e2 858.77±12.02b2 188.19±1.58c26 810.90±69.43a2′-乙酰毛蕊花糖苷610.68±1.21e5 940.25±3.83d32 592.37±310.90b18 745.00±9.38c110 581.33±324.64a
注:同行不同字母表示处理间差异显著(P<0.05)(下同)。
表5 梭梭寄主肉苁蓉10种苯乙醇苷类成分在不同干燥样品中的含量(n=3) 单位:ng/mg Table 5 Determination of ten phenylethanoid glycosides from Haloxylon ammodendron Cistanches Herba by different drying methods

化合物干燥方式晒干40 ℃烘干60 ℃烘干80 ℃烘干冷冻干燥益母草苷59 107.23±391.79a28 638.97±51.80e34 899.70±40.97d43 512.33±178.20b39 710.43±129.64c红景天苷3 259.99±43.67b2 146.03±13.91d2 171.03±10.64c2 103.97±2.72e5 693.48±1.33a栀子苷21 427.77±116.22a782.65±1.98e1 744.54±0.29c2 593.18±5.87b994.07±4.69d松果菊苷59 582.27±80.05d19 546.33±78.64e63 546.27±35.98c121 307.33±182.10a102 169.33±341.13b肉苁蓉苷A12 346.43±19.27c3 050.23±4.73e9 558.55±67.09d21 376.03±9.67a14 923.33±47.15b管花苷A3 875.83±15.11e4 051.77±48.36d5 364.33±11.61c11 991.83±5.85b22 599.87±100.03a毛蕊花糖苷26 666.97±123.46c3 251.69±5.01c30 077.57±34.45b48 753.33±582.78b86 072.60±42.81a异毛蕊花糖苷3 365.47±11.28d480.28±1.75e4 248.69±33.80c8 807.42±88.31b8 921.27±9.30a管花苷B383.25±2.12d73.30±1.29e1 328.89±14.91b1 081.82±12.61c3 760.16±24.97a2′-乙酰毛蕊花糖苷13 363.67±117.31e20 843.83±552.37b17 638.67±39.76d20 065.53±61.29c109 028.67±441.40a
2.2 样品标准化处理分析
为了更加科学、直观地阐述不同干燥方法对不同寄主肉苁蓉10种苯乙醇苷类成分含量的影响,采用SPSS 20.0.0中的Z-score标准化处理数据(表6),从中可以看出四翅滨藜寄生肉苁蓉经过冷冻干燥后的苯乙醇苷类成分含量综合评分最高,其次是80 ℃烘干处理;梭梭寄主肉苁蓉经过冷冻干燥后的苯乙醇苷类成分含量综合评分最高,其次是80 ℃烘干处理。由此也反映出冷冻干燥处理后的2种寄主肉苁蓉中10种苯乙醇苷类成分总含量均是最高,其次是80 ℃烘干。
表6 标准化处理后的结果
Table 6 Standardized processing of test data

干燥方式化合物益母草苷红景天苷栀子苷松果菊苷肉苁蓉苷A管花苷A毛蕊花糖苷异毛蕊花糖苷管花苷B2′-乙酰毛蕊花糖苷综合评分/分A-晒干1.59-0.60.51-1.49-0.57-0.86-1.03-0.57-0.46-0.85-7.51A-40 ℃烘干-0.120.92-0.65-1.090.22-0.73-0.99-0.52-0.47-0.72-4.13A-60 ℃烘干0.31-0.55-0.11-0.19-0.12-0.280.12-0.11-0.12-0.05-1.11A-80 ℃烘干1.942.440.060.221.14-0.380.020.05-0.21-0.44.89A-冷冻干燥-0.76-0.37-0.571.27-0.152.322.122.782.811.8711.32B-晒干-0.18-0.312.65-0.07-0.09-0.53-0.36-0.41-0.43-0.54-0.27B-40 ℃烘干-0.88-0.62-0.59-1.02-1.94-0.52-0.95-0.56-0.46-0.34-7.88B-60 ℃烘干-0.74-0.61-0.440.03-0.64-0.4-0.27-0.37-0.31-0.43-4.19B-80 ℃烘干-0.54-0.63-0.31.41.710.20.19-0.15-0.34-0.371.17B-冷冻干燥-0.620.34-0.560.940.421.171.15-0.14-0.021.844.53
注:A为四翅滨藜寄生肉苁蓉,B为梭梭寄生肉苁蓉。
3 结论与讨论
本研究建立了利用UPLC-QQQ-MS同时分析检测益母草苷、红景天苷、栀子苷、松果菊苷、肉苁蓉苷A、管花苷A、毛蕊花糖苷、异毛蕊花糖苷、管花苷B及2′-乙酰毛蕊花糖苷的方法。加入甲醇后,经超声提取,在电子喷雾负离子模式下,用三重四极杆质谱仪进行多反应分析。本方法能够迅速、精准、便利地对不同寄主肉苁蓉中的10种苯乙醇苷类成分分析,并且具有很高的灵敏度和分辨率。
经过不同的统计学方法分析结果可知,不同干燥处理方式对不同寄主肉苁蓉中10种苯乙醇苷类成分含量具有显著影响。本实验检测的10种苯乙醇苷类成分在2种寄主肉苁蓉的冷冻干燥样品中均总含量最高,其次是80 ℃烘干样品,但2种寄主肉苁蓉在相同条件下干燥所得的样品中苯乙醇苷类成分含量也具有显著差异,总含量由高到低依次为四翅滨藜寄主肉苁蓉冷冻干燥样品>四翅滨藜寄主肉苁蓉80 ℃烘干样品>梭梭寄主肉苁蓉冷冻干燥样品>梭梭寄主肉苁蓉80 ℃烘干样品。黄翔等[17]、王立民等[18]、冯洁等[19]等研究显示梭梭寄主肉苁蓉经冷冻干燥和80 ℃烘干所含有的有效成分保留量最多,且不同寄主肉苁蓉中有效成分含量具有显著差异,其中四翅滨藜寄生肉苁蓉药材中苯乙醇苷类成分含量整体高于梭梭寄生肉苁蓉,但在其文献里所检测的成分集中在松果菊苷、毛蕊花糖苷、肉苁蓉苷A、异毛蕊花糖苷、2′-乙酰毛蕊化糖苷,本实验所得结果与文献一致,且补充了更多苯乙醇苷类成分含量的检测,进一步加强了试验结论的准确性和理论依据。
《中国药典》(2020年版)中将毛蕊花糖苷和松果菊苷列为肉苁蓉的指标性成分,再基于所有的分析结果表明,2种寄主肉苁蓉经冷冻干燥和80 ℃烘干处理后的样品均比其他干燥方法具有明显优势,其中冷冻干燥比80 ℃烘干所费时长要多2~3倍,且实验时是将肉苁蓉切成3 mm厚片进行干燥,而在工厂工业加工时往往是一整根肉苁蓉进行干燥,因此冷冻干燥与烘干的时长对比可能比实验时间的差异更大,再加上烘干前有杀青的过程,通过破坏酶活力来减缓药效成分流失[11],但冻干前需将鲜样置于-80 ℃冰箱预冷一段时间,没有杀青破坏酶活力,当采收期肉苁蓉大量囤积时,冻干效率低的问题会很大程度上影响药材品质,因此从耗时、成分保留、机械成本和操作难度上考虑均不利于大规模生产,所以80 ℃烘干更具有经济效益。本实验仅通过苯乙醇苷类成分含量的角度提供2种寄主肉苁蓉的干燥方式的建议,为肉苁蓉药材的处理及相关食品的质量控制提供一定的理论参考,后续将从药理、药效方面进行更深入的研究。
[1] 国家药典委员会.中华人民共和国药典(一部,2020年版)[M].北京:中国医药科技出版社,2020.Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China (Volume I,2020 Edition)[M].Beijing:China Medical Science and Technology Press,2020.
[2] 屠鹏飞, 姜勇,郭玉海, 等.发展肉苁蓉生态产业推进西部荒漠地区生态文明[J].中国现代中药, 2015, 17(4):297-301.TU P F, JIANG Y, GUO Y H, et al.Developing ecological industry of Cistanches Herba for promoting ecological civilization of the western desert region[J].Modern Chinese Medicine, 2015,17(4):297-301.
[3] WANG T, ZHANG X Y, XIE W Y.Cistanches Herba Y.C.Ma,“Desert ginseng”:A review[J].The American Journal of Chinese Medicine, 2012, 40(6):1123-1141.
[4] 杨峻山. 沙漠人参:肉苁蓉[J].中国药学杂志, 2011, 46(12):881.YANG J S.Desert ginseng: Cistanches Herba[J].Chinese Pharmaceutical Journal, 2011, 46(12):881.
[5] LEI H B, ZHANG Y H, ZU X P, et al.Comprehensive profiling of the chemical components and potential markers in raw and processed Cistanche tubulosa by combining ultra-high-performance liquid chromatography coupled with tandem mass spectrometry and MS/MS-based molecular networking[J].Analytical and Bioanalytical Chemistry, 2021, 413(1):129-139.
[6] 潘雅清. 四翅滨藜耐盐抗旱的生理机制研究[D].兰州:兰州大学, 2016.PAN Y Q. Study on physiological mechanism of salt tolerance and drought resistance of Atriplex quadriptera[D]. Lanzhou: Lanzhou University, 2016.
[7] 李昌龙, 赵明, 王玉魁.不同密度四翅滨藜人工种群的分枝格局可塑性分析[J].西北林学院学报, 2007, 22(2):5-8.LI C L, ZHAO M, WANG Y K.An analysis on branching pattern plasticity of Atyiplex canescen populations in different densities[J].Journal of Northwest Forestry University, 2007, 22(2):5-8.
[8] 张震中, 张潭, 李倩, 等.四翅滨藜生理生化特征对盐胁迫的响应[J].西北植物学报, 2017, 37(12):2435-2443.ZHANG Z Z, ZHANG T, LI Q, et al.Physiological and biochemical responses of Atriplex canescens seedlings to salt stress[J].Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(12):2435-2443.
[9] 徐秀梅, 张新华, 王汉杰.四翅滨藜抗旱生理特性研究[J].南京林业大学学报(自然科学版), 2004, 28(5):54-58.XU X M, ZHANG X H, WANG H J.Physiological property in drought resistance of Atriplex canescens[J].Journal of Nanjing Forestry University(Natural Sciences Edition), 2004, 28(5):54-58.[10] 石光明. 四翅滨藜在沙区垦荒退化修复中的应用[J].农业灾害研究, 2023,13(6):161-163.SHI G M.Application of Atriplex tetraptera in reclamation and degradation restoration in sandy areas[J].Journal of Agricultural Catastrophology, 2023, 13(6):161-163.
[11] 苗远晴, 郭晔红, 李梅英, 等.打顶和杀青方式对肉苁蓉有效成分保留量的影响[J].中药材, 2017, 40(4):823-827.MIAO Y Q, GUO Y H, LI M Y, et al.Effects of top cutting and green-killing treatments on effective components retention in Cistanche deserticola stem[J].Journal of Chinese Medicinal Materials, 2017, 40(4):823-827.
[12] 路帆, 李宏业, 殷贝贝, 等.气调包装技术在鲜切肉苁蓉保鲜中的应用[J].食品与发酵工业, 2023, 49(6):170-178.LU F, LI H Y, YIN B B, et al.Application of modified atmosphere packaging technology on fresh-cut Cistanche deserticolam preservation[J].Food and Fermentation Industries, 2023, 49(6):170-178.
[13] 高云佳, 姜勇, 戴昉, 等.肉苁蓉润肠通便的药效物质研究[J].中国现代中药, 2015, 17(4):307-310;314.GAO Y J, JIANG Y, DAI F, et al.Study on laxative constituents in Cistanche deserticola Y.C.Ma[J].Modern Chinese Medicine, 2015, 17(4):307-310;314.
[14] 范亚楠, 黄玉秋, 贾天柱, 等.肉苁蓉炮制前后对便秘大鼠的通便作用[J].中成药, 2016, 38(12):2684-2687.FAN Y N, HUANG Y Q, JIA T Z, et al. The laxative effect of Cistanche deserticola before and after processing on constipation rats[J]. Chinese Traditional Patent Medicine, 2016, 38(12):2684-2687.
[15] 徐东升, 何云娇, 钟灵佼.UPLC-QQQ-MS/MS在中药分析中的应用研究进展[J].中医药临床杂志, 2021, 33(11):2247-2250.XU D S, HE Y J, ZHONG L J.Research progress in the application of UPLC-QQQ-MS/MS in the analysis of traditional chinese medicine[J].Clinical Journal of Traditional Chinese Medicine, 2021, 33(11):2247-2250.
[16] 张耀海, 张念, 王成秋, 等.基于超高效液相色谱-三重四极杆串联质谱技术的柚果实不同成熟期生物活性成分的靶向筛查与定量[J].食品与发酵工业, 2023, 49(15):279-287.ZHANG Y H, ZHANG N, WANG C Q, et al.Targeted screening and quantification of bioactive components of pomelo fruits at different maturity stages based on ultra-high performance liquid chromatography-quadrupole-tandem mass spectrometry[J].Food and Fermentation Industries, 2023, 49(15):279-287.
[17] 黄翔, 郭晔红, 贾存勤, 等.肉苁蓉提取工艺及干燥方式研究[J].中草药, 2019, 50(15):3622-3630.HUANG X, GUO Y H, JIA C Q, et al.Extraction parameters and drying methods of Cistanche deserticola[J]. Chinese Traditional and Herbal Drugs, 2019, 50(15):3622-3630.
[18] 王立民, 郭晔红, 贺斌, 等.干燥方式对肉苁蓉有效成分保留量的影响[J].资源开发与市场, 2017, 33(4):477-480.WANG L M, GUO Y H, HE B, et al.Effects of drying methods on content retention of effective components in Herba Cistanches[J].Resource Development &Market, 2017, 33(4):477-480.
[19] 冯洁, 郭晔红, 朱文娟, 等.不同寄主、产地和采收期对肉苁蓉有效成分含量的影响[J].中国野生植物资源, 2021, 40 (5):18-23.FENG J, GUO Y H, ZHU W J, et al.Effects of different hosts, producing areas and harvesting time on the active components of Cistanche deserticola[J].Chinese Wild Plant Resources, 2021, 40(5):18-23.