马波沙星(marbofloxacin, MAR)属于第三代氟喹诺酮类药物,是一种抗菌谱广、抗菌活性高的兽用抗菌药,已被广泛用于动物疾病的预防和治疗[1-2]。然而,滥用马波沙星的情况时有发生,其残留毒性和耐药性不仅会影响动物源性食品的质量,还会对消费者的健康造成不同程度的危害,如产生耐药菌株、发生过敏反应、干扰肠道菌群等。为此,国家标准GB 31650.1—2022《食品安全国家标准 食品中41种兽药最大残留限量》规定MAR在猪、牛肌肉中的最大残留限量为150 μg/kg。目前检测MAR的分析方法有超高效液相色谱法[3-4]、超高效液相色谱-串联质谱法[5]、胶束电动毛细管色谱法[6]、酶联免疫吸附法[7-8]、金标免疫层析法[9-10]、荧光分析法[11-12]等。仪器检测法存在设备昂贵、对技术人员要求高等局限性[13];酶联免疫吸附法耗时长、容易受外界环境影响而出现假阴性或假阳性[14];金标免疫层析法的灵敏度较低,标记物不稳定,利用肉眼观察无法满足定量检测的需求[15];荧光分析法存在荧光背景干扰强、易发生光漂白、检测时间短等局限性[16]。与上述方法相比,电化学免疫传感器具有灵敏度高和检测设备可微缩化的优点[17]。
氧化石墨烯(graphene oxide, GO)是石墨烯最重要的衍生物之一,具有丰富的含氧基团(环氧、羧基和羟基)和较大的表面积[18]。借助壳聚糖大分子,可增加氧化石墨烯在溶液中的分散性,增大固定抗体的表面积,提高电化学免疫传感器的灵敏度[19-20]。另外,金纳米粒子(gold nanoparticles, AuNPs)具有优良的生物相容性和导电性,故将其电沉积到氧化石墨烯上,能增强电极的导电性,进而提高传感器的灵敏度[21-22]。因此,本文利用金纳米粒子/氧化石墨烯复合膜对玻碳电极进行修饰,构建了一种灵敏检测MAR的电化学免疫传感器。
1 材料与方法
1.1 材料与试剂
MAR抗体,实验室自制;氧化石墨烯,上海源叶生物有限公司;氯金酸,国药集团;壳聚糖(chitosan,CS)、MAR、诺氟沙星、洛美沙星、氧氟沙星、环丙沙星、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、N-羟基丁二酰亚胺,上海阿拉丁有限公司;牛血清白蛋白(borine serum albumin,BSA),Sigma公司;铁氰化钾、亚铁氰化钾,天津德恩化学试剂有限公司。
1.2 仪器与设备
CHI610E电化学工作站、采用三电极体系:玻碳电极、AgCl电极、铂丝电极,上海辰华仪器有限公司;JSM-7500F扫描电子显微镜,日本日立公司;KQ-500DE数控超声清洗仪,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 GO-CS的制备与表征
称取一定量的CS溶于0.05 mol/L HCl溶液中,制备1 mg/mL CS溶液;然后称取一定量的GO加入上述CS溶液中,使溶液中GO的质量浓度为2 mg/mL,超声分散1 h,得到混合均匀的GO-CS溶液,4 ℃保存备用。用扫描电子显微镜(scanning electron microscopy, SEM)对GO和GO-CS复合物进行表征。
1.3.2 电极的修饰和表征
用氧化铝抛光裸玻碳电极(glassy carbon electrode, GCE)后,放入含有![]() 混合物(10 mmol/L,摩尔比1∶1)的0.1 mol/L pH 7.4 磷酸盐缓冲液中,用循环伏安法(cyclic voltammetry, CV)进行扫描,要求抛光裸玻碳电极的还原峰电位与氧化峰电位的差值小于90 mV。然后将玻碳电极依次用乙醇和蒸馏水进行超声清洗,50 ℃下干燥。先将GO-CS溶液超声5 min,以获得均匀的悬浮液。准确量取10 μL GO-CS悬浮液垂直滴在玻碳电极表面,室温孵育24 h。将电极置于含0.5 mmol/L HAuCl4的0.1 mol/L磷酸盐缓冲溶液中,通过电沉积AuNPs,提高电极的导电性,得到AuNPs/GO-CS/GCE。将电极放在0.1 mol/L磷酸盐缓冲溶液中进行电化学还原,将GO-CS还原成rGO-CS。然后在电极表面滴加10 μL MAR抗体,37 ℃孵育1 h,继续滴加10 μL 50 g/L BSA封闭1 h,用循环伏安法在-0.2~0.6 V的电位范围内对电极的修饰过程进行表征。
混合物(10 mmol/L,摩尔比1∶1)的0.1 mol/L pH 7.4 磷酸盐缓冲液中,用循环伏安法(cyclic voltammetry, CV)进行扫描,要求抛光裸玻碳电极的还原峰电位与氧化峰电位的差值小于90 mV。然后将玻碳电极依次用乙醇和蒸馏水进行超声清洗,50 ℃下干燥。先将GO-CS溶液超声5 min,以获得均匀的悬浮液。准确量取10 μL GO-CS悬浮液垂直滴在玻碳电极表面,室温孵育24 h。将电极置于含0.5 mmol/L HAuCl4的0.1 mol/L磷酸盐缓冲溶液中,通过电沉积AuNPs,提高电极的导电性,得到AuNPs/GO-CS/GCE。将电极放在0.1 mol/L磷酸盐缓冲溶液中进行电化学还原,将GO-CS还原成rGO-CS。然后在电极表面滴加10 μL MAR抗体,37 ℃孵育1 h,继续滴加10 μL 50 g/L BSA封闭1 h,用循环伏安法在-0.2~0.6 V的电位范围内对电极的修饰过程进行表征。
1.3.3 电化学免疫传感器的构建
MAR电化学免疫传感器检测原理见图1。用氧化石墨烯-壳聚糖修饰玻碳电极后,通过电沉积AuNPs和电化学还原AuNPs/GO-CS中的GO,提高玻碳电极的导电性。用活性酯法活化AuNPs/rGO-CS复合膜上的羧基,MAR抗体通过Au—N键或酰胺键偶联到AuNPs/rGO-CS复合膜上[23-24]。检测阳性样品时,则MAR抗体会捕获MAR,阻碍检测底液中电化学探针![]() 向电极表面扩散,使电极的响应峰值电流降低[25]。根据MAR浓度与峰值电流变化量之间的相关性,建立MAR的定量检测方法。
向电极表面扩散,使电极的响应峰值电流降低[25]。根据MAR浓度与峰值电流变化量之间的相关性,建立MAR的定量检测方法。
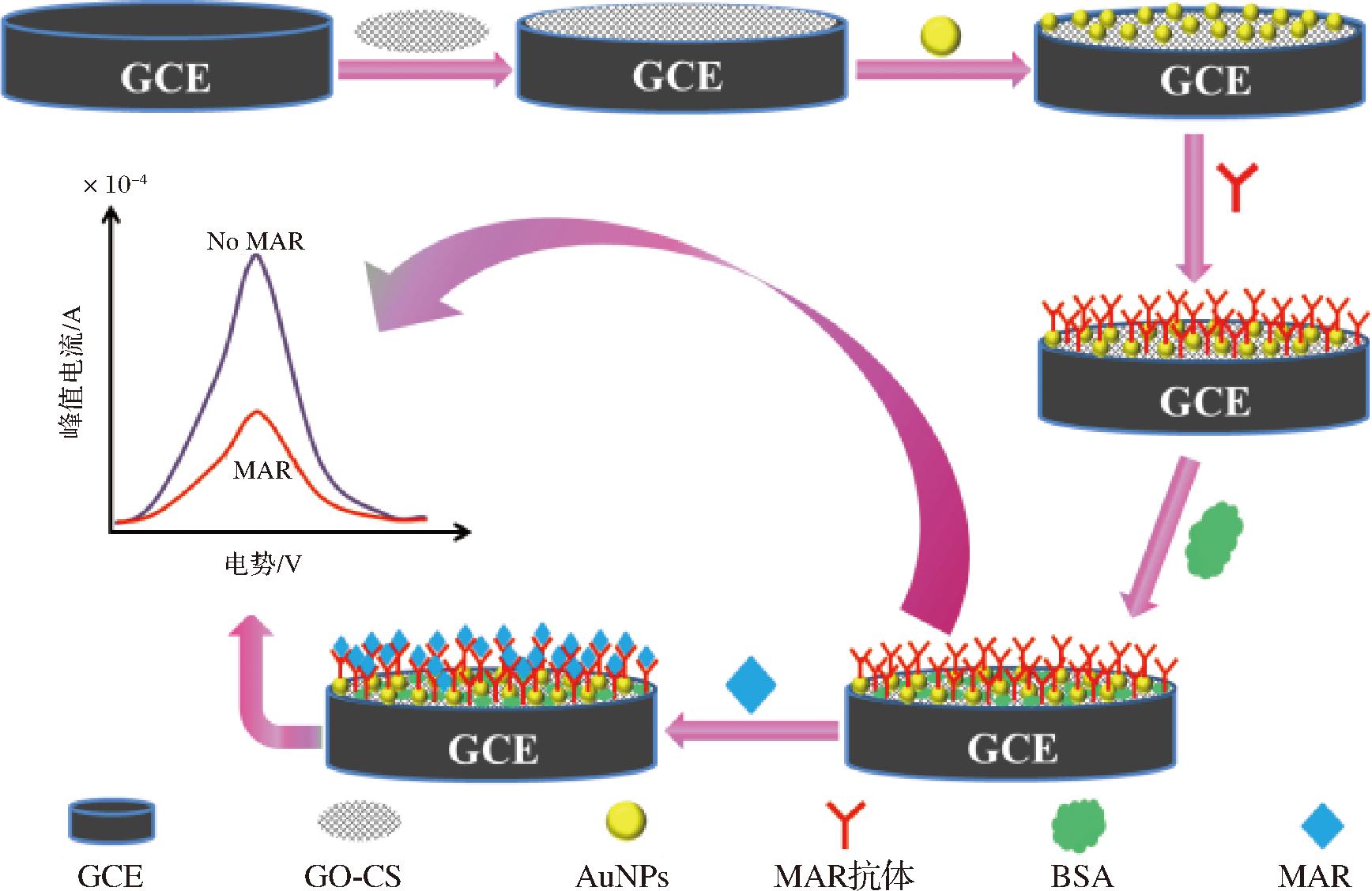
图1 MAR/BSA/MAR抗体/AuNPs/rGO-CS/GCE免疫传感器的制备示意图
Fig.1 Fabrication of MAR/BSA/anti-MAR/AuNPs/rGO-CS/GCE immunosensor
1.3.4 电化学免疫传感器灵敏度、特异性和稳定性评价
称取一定量的MAR溶于0.01 mol/L磷酸盐缓冲液,配成1 mg/mL MAR标准溶液,然后再稀释成不同浓度的MAR标准溶液。用移液器量取10 μL一定浓度的MAR标准溶液(或样品处理液),滴加在免疫传感器的电极上,37 ℃下孵育50 min。采用含有0.1 mol/L KCl和10 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6] (摩尔比1∶1)的0.1 mol/L磷酸盐缓冲液作为电化学免疫传感器的测试底液,扫描速率为0.05 V/s,用差分脉冲伏安法(differential pulse voltammetry, DPV)对不同浓度的MAR在-0.2~0.6 V的电位范围内进行测量,记录其峰值电流。以MAR浓度为横坐标,以峰值电流变化量[ΔI,计算如公式(1)所示]为纵坐标绘制标准曲线,按公式(2)计算MAR检测限(limit of detection, LOD)[26]:
ΔI=I空白-IMAR
(1)
式中:I空白,不含MAR溶液的峰值电流;IMAR,MAR指定浓度下的峰值电流。
(2)
式中:δ,空白标准偏差;S,标准曲线斜率。
为了考察MAR电化学免疫传感器的特异性,在含有50 ng/mL MAR的溶液中分别加入10倍MAR的结构类似物(培氟沙星、诺氟沙星、氧氟沙星、环丙沙星)作为干扰物质进行检测,并记录峰值电流。
为了评估所制备传感器的稳定性,将制备的修饰电极保存在4 ℃冰箱中,保存20 d,每隔4 d放置在相同测试底液中测定峰值电流变化量。
1.3.5 样品预处理
将市售猪肉、鸡肉和牛肉样品分别准确称取5.0 g,绞碎,转移至试管中。每管分别加入6.5 g硫酸钠和15.0 mL甲醇,振荡混匀12 min,沉淀蛋白质。离心(10 000 r/min, 10 min),保留上清液,4 ℃保存。使用时,用pH 7.4的0.01 mol/L磷酸盐缓冲液稀释2倍,用所制备的电化学免疫传感器对样品处理液进行检测[27]。
2 结果与分析
2.1 GO-CS复合物的表征
对上述制备的GO和GO-CS用SEM进行表征,结果如图2所示。

a-GO;b-GO-CS
图2 GO和GO-CS扫描电镜图
Fig.2 SEM diagrams of GO and GO-CS
由图2-a可知,GO是一种具有特殊褶皱的片层材料。由图2-b中可以看出,GO与CS结合后,形成一层更光滑的薄膜。因为壳聚糖拥有良好的成膜性和生物相容性,有效地分散了氧化石墨烯材料,避免其发生堆叠和团聚[28]。
2.2 电化学还原AuNPs/GO-CS复合膜
在扫速100 mV/s,0.2~-1.6 V的电位范围内,在pH 7.4 0.1 mol/L磷酸盐缓冲液中用电化学法还原玻碳电极上的AuNPs/GO-CS复合膜,结果见图3。
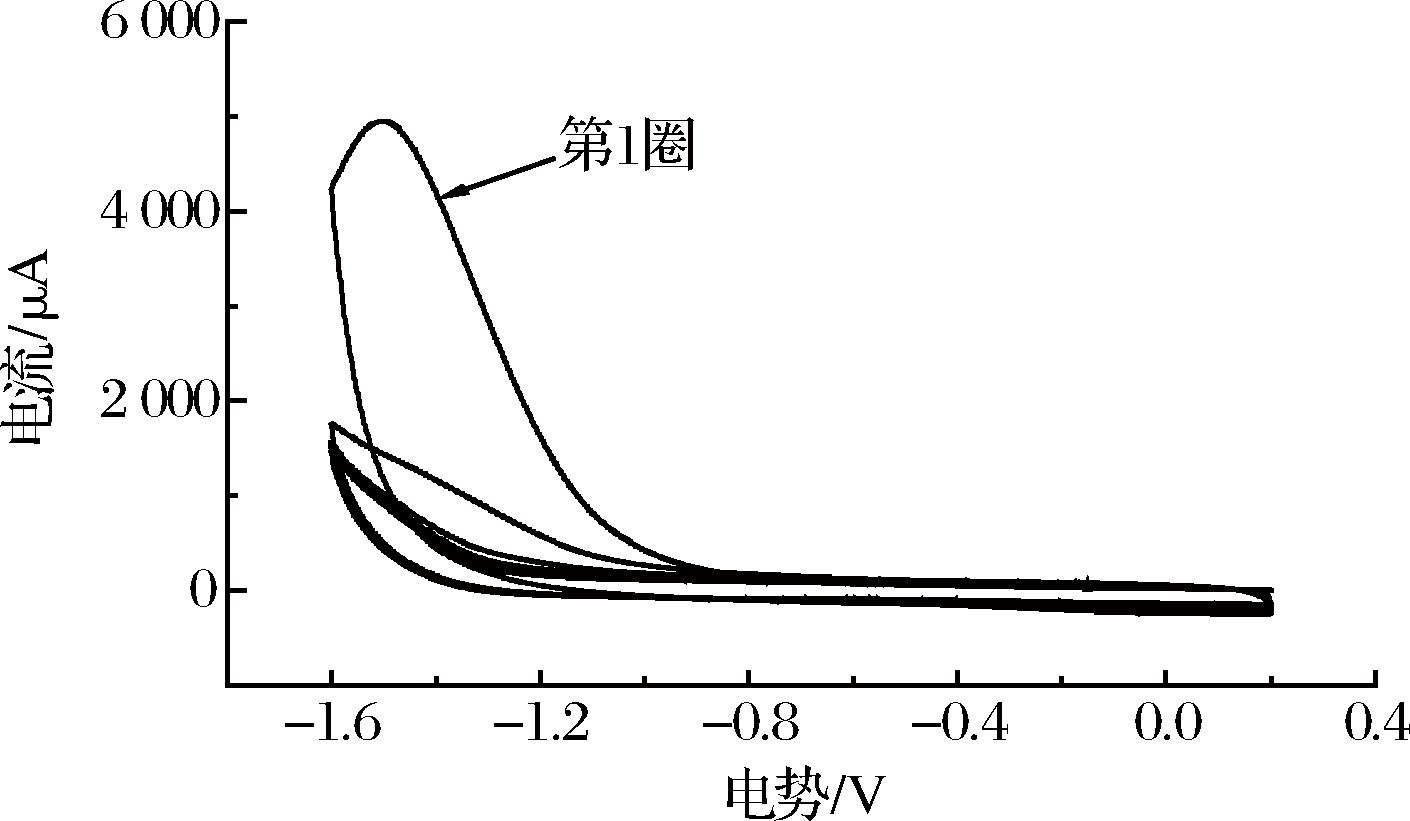
图3 GO-CS电还原CV图
Fig.3 CV curves of GO-CS electroreduction
由图3可以看出,第1圈CV扫描时在-1.4 V处出现了一个较高的还原峰,是由含氧官能团的还原过程形成的。随着电化学还原过程的发生,还原峰逐渐降低甚至消失,说明电极表面修饰的GO被还原成rGO。GO经电化学还原后,表面的含氧基团逐渐减少,使电极的电子传输能力增强。因此,复合膜中GO被电化学还原后,会增强修饰电极的导电性,提高电化学免疫传感器的灵敏度[29]。
2.3 电极修饰过程的表征
用CV法表征不同修饰过程电极的电化学行为,结果见图4。
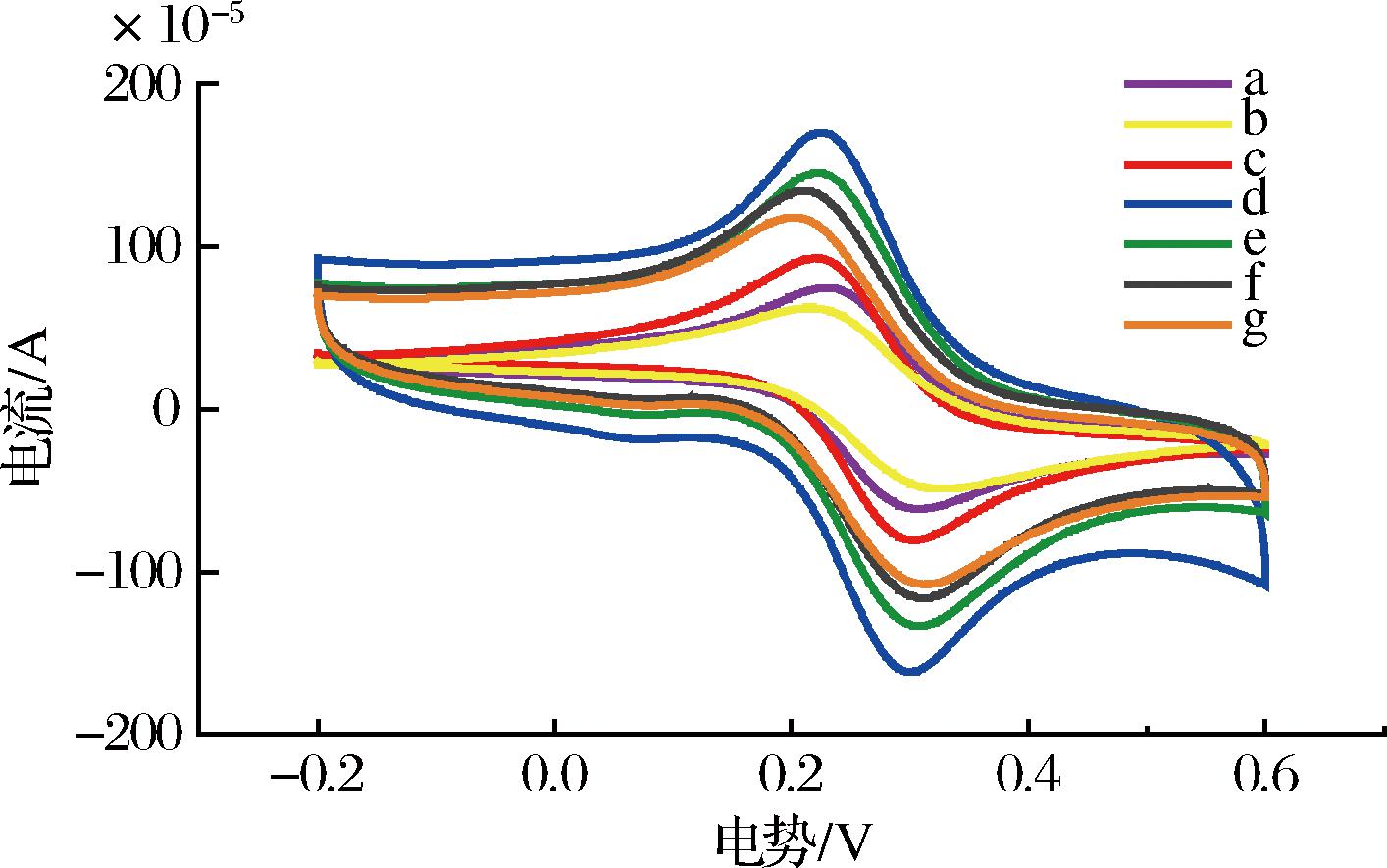
a-GCE;b-GO-CS/GCE;c-AuNPs/GO-CS/GCE;d-AuNPs/rGO-CS/GCE;e-anti-MAR/AuNPs/rGO-CS/GCE;f-BSA/anti-MAR/AuNPs/rGO-CS/GCE;g-MAR/BSA/anti-MAR/AuNPs/rGO-CS/GCE
图4 不同修饰电极的CV图
Fig.4 Cyclic voltammograms of different modified electrodes
由图4-a可见,裸玻碳电极表面呈现一对可逆性良好的氧化还原峰。在GCE表面修饰GO-CS后,由于GO表面丰富的含氧官能团,导致电极的导电性变差,从而引起峰值电流减小(图4-b)。将金纳米粒子通过电沉积法附着在GCE表面后,加速了电子传递过程,峰值电流相对增加(图4-c)。通过电化学法还原GO-CS复合膜上的含氧官能团,使GCE的导电性增强,故峰值电流显著增大(图4-d)。当MAR抗体固定在纳米复合膜修饰的电极表面上时,由于MAR抗体分子的固定阻碍了电子的传递,从而使峰值电流降低(图4-e)。用BSA溶液封闭电极上剩余结合位点后,峰值电流进一步减小(图4-f)。在电极表面结合抗原后,峰值电流继续减小(图4-g)。上述结果表明,试验成功构建了电化学免疫传感器的电极。
2.4 扫描速率的影响
在MAR质量浓度为50 ng/mL,抗体质量浓度为50 μg/mL,测试底液中![]() 的浓度为10 mmol/L,pH值为7.4条件下,考察不同扫描速率(10、20、30、40、50、60、70、80、90、100、110、120、130 mV/s)对AuNPs/rGO-CS/GCE的影响,结果见图5。
的浓度为10 mmol/L,pH值为7.4条件下,考察不同扫描速率(10、20、30、40、50、60、70、80、90、100、110、120、130 mV/s)对AuNPs/rGO-CS/GCE的影响,结果见图5。
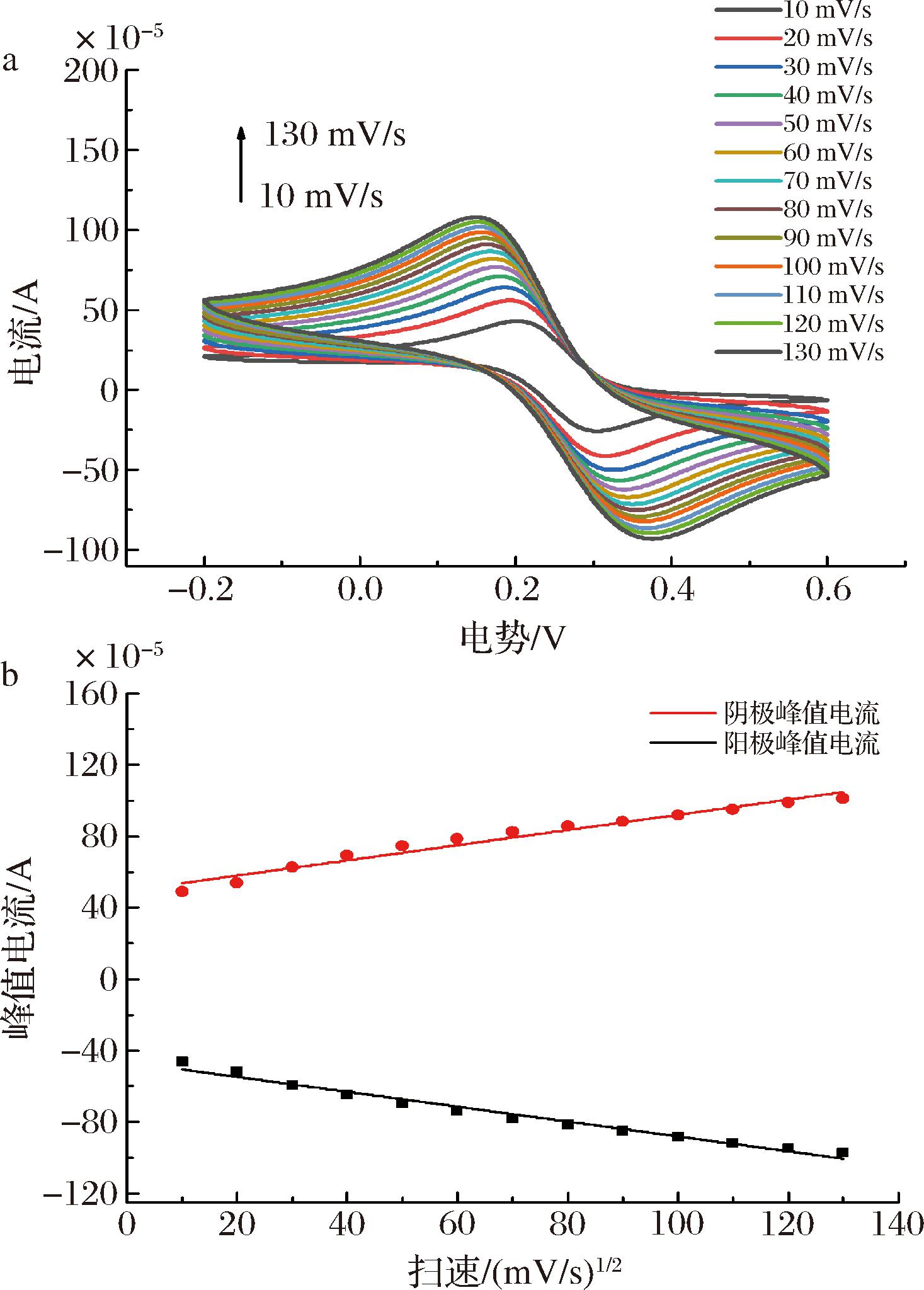
a-CV图;b-峰值电流与扫速平方根的线性拟合图
图5 不同扫速下AuNPs/rGO-CS/GCE的CV图和扫速平方根与峰值电流的关系图
Fig.5 CV curves of AuNPs/rGO-CS/GCE at different scan rates and the relation plots between peak current and the square roots of scan rate
如图5-a所示,AuNPs/rGO-CS/GCE的氧化还原峰电流随着扫描速率的增加而增大,与扫描速率的平方根在10~130 mV/s范围内呈现出良好的线性关系。阳极峰值电流的回归方程为:Ipa=-0.416 7-46.451 0 v1/2,相关系数r=0.983 8,阴极峰值电流的回归方程为:Ipc=0.425 7+49.527 0 v1/2,相关系数r=0.988 7,说明电极表面的反应是受扩散过程控制的可逆过程[30]。
2.5 电化学检测条件的优化
2.5.1 抗体质量浓度的确定
电极表面孵育的抗体质量浓度是影响MAR检测的重要因素,在MAR质量浓度为50 ng/mL,测试底液中![]() 的浓度为10 mmol/L,pH值为7.4条件下,研究不同质量浓度(10、20、30、40、50、60、70 μg/mL)抗体修饰电极对传感器电化学检测性能影响,结果见图6。
的浓度为10 mmol/L,pH值为7.4条件下,研究不同质量浓度(10、20、30、40、50、60、70 μg/mL)抗体修饰电极对传感器电化学检测性能影响,结果见图6。
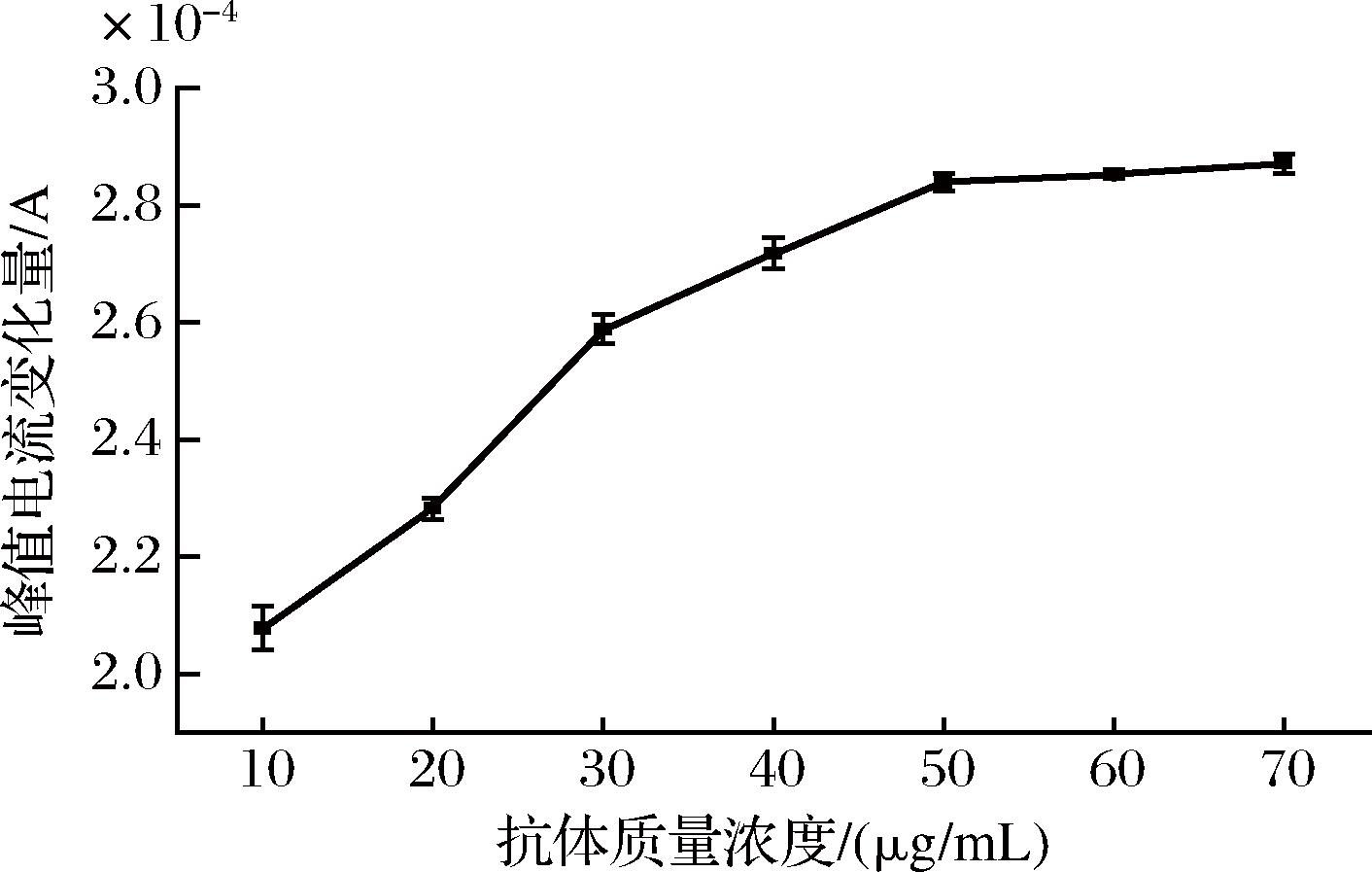
图6 抗体质量浓度的优化
Fig.6 Optimization of antibody concentration
由图6可以看出,随着抗体质量浓度的增加,峰值电流变化量迅速升高,表明抗体被固定在AuNPs/rGO-CS/GCE上,抗体分子的固定阻碍了电子的传递,使峰值电流变小,峰值电流变化量增大;当抗体质量浓度超过50 μg/mL时,抗体与AuNPs/rGO-CS/GCE的结合基本达到饱和,峰值电流变化量趋于平缓。因此,选择50 μg/mL为MAR抗体的最佳质量浓度。
2.5.2 测试底液![]() 浓度的确定
浓度的确定
在MAR质量浓度为50 ng/mL,抗体质量浓度为50 μg/mL,测试底液pH值为7.4条件下,考察测试底液中不同浓度![]() 对传感器电化学检测性能的影响,结果见图7。
对传感器电化学检测性能的影响,结果见图7。
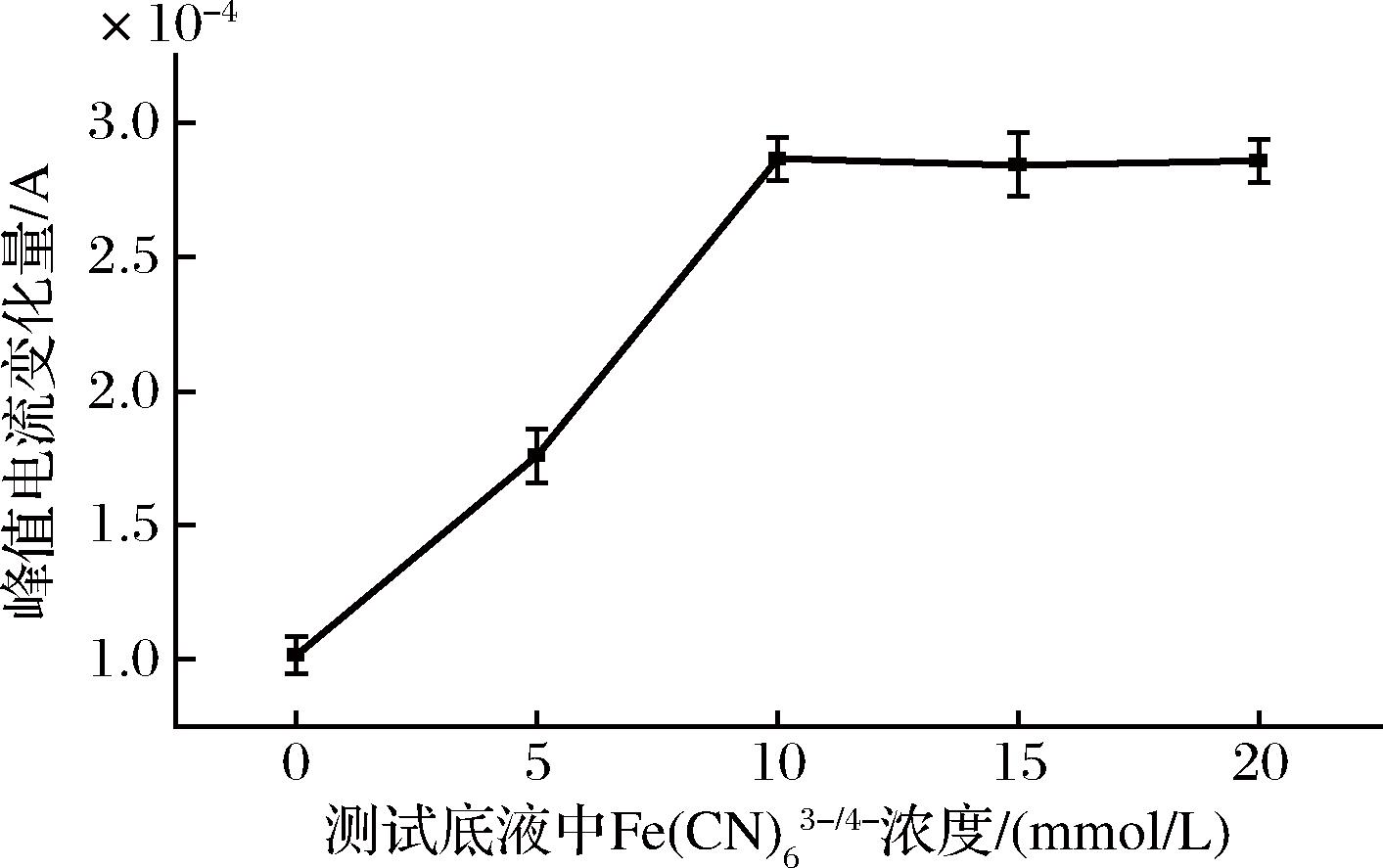
图7 测试底液中![]() 浓度的优化
浓度的优化
Fig.7 Optimization of ![]() concentration in test base solution
concentration in test base solution
由图7可知,峰值电流变化量随着测试底液中![]() 浓度的增大而增加;当
浓度的增大而增加;当![]() 浓度达到10 mmol/L时,峰值电流变化量达到最大。当
浓度达到10 mmol/L时,峰值电流变化量达到最大。当![]() 浓度继续增大时,峰值电流变化量趋于平缓。因此,选择测试底液中
浓度继续增大时,峰值电流变化量趋于平缓。因此,选择测试底液中![]() 的最适浓度为10 mmol/L。
的最适浓度为10 mmol/L。
2.5.3 测试底液pH的确定
测试底液的pH是影响抗体活性的重要因素之一,对免疫传感器的检测性能有较大影响。在MAR质量浓度为50 ng/mL,抗体质量浓度为50 μg/mL,测试底液中![]() 的浓度为10 mmol/L条件下,研究不同测试底液pH值(6.0、6.5、7.0、7.5、8.0)对传感器电化学检测性能的影响,结果见图8。
的浓度为10 mmol/L条件下,研究不同测试底液pH值(6.0、6.5、7.0、7.5、8.0)对传感器电化学检测性能的影响,结果见图8。
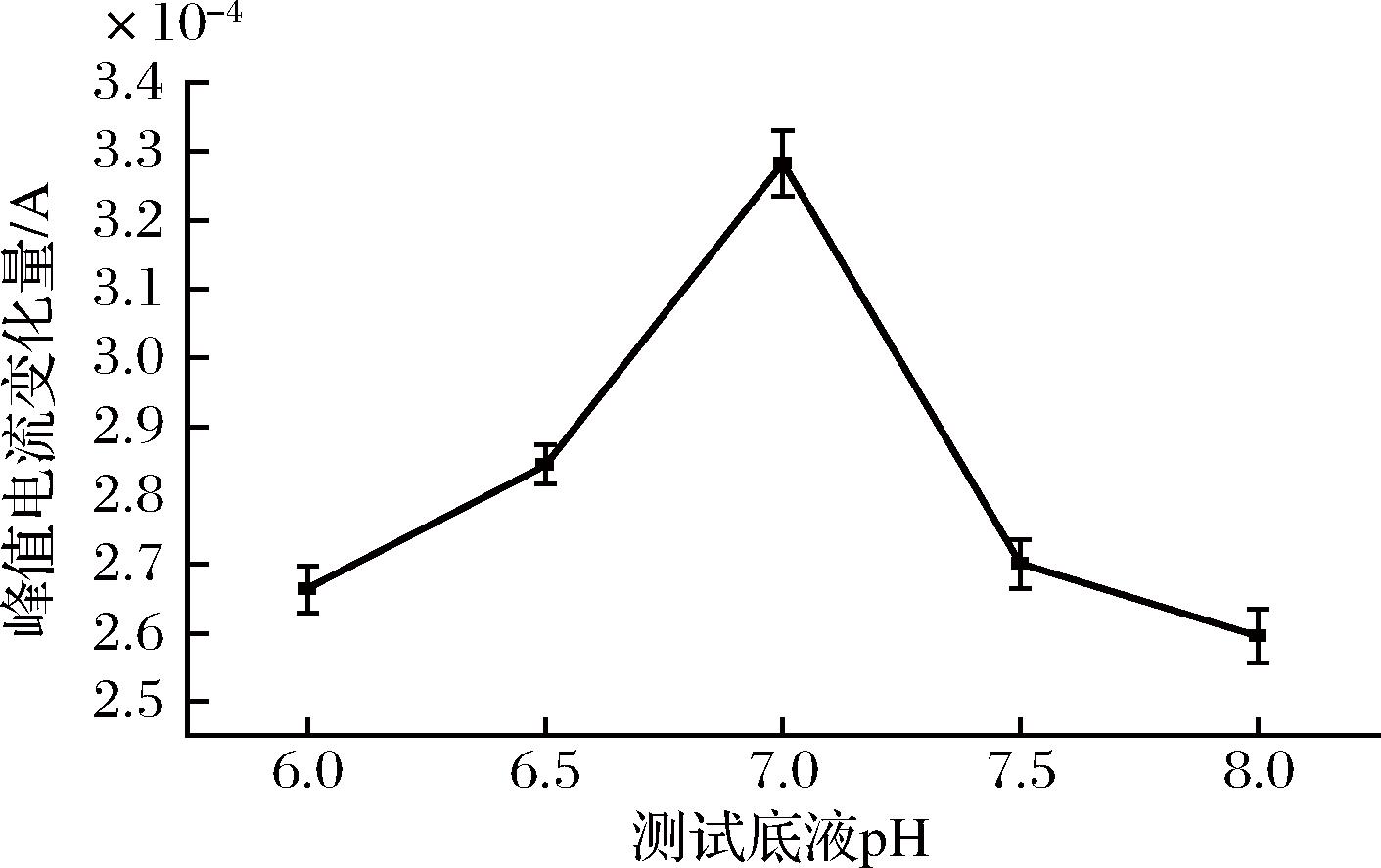
图8 测试底液pH的优化
Fig.8 Optimization of pH in test base solution
如图8所示,峰值电流变化量先随pH值的增加而增大,在pH值为7.0时达到最大值,表明此时抗体反应活性最佳。pH继续增大后,峰值电流变化量明显下降。说明pH过大,导致抗体活性下降,使其结合MAR的量减少,引起峰值电流变化量下降。因此,选择pH 7.0为测试底液的最适pH。
2.6 免疫传感器性能分析
2.6.1 线性关系及检测限
在最适条件下,用构建的电化学免疫传感器对MAR的一系列质量浓度(0.5、5、10、25、50、100、200、300、400 ng/mL)进行测定,结果见图9。

a-DPV图;b-标准曲线
图9 电化学免疫传感器对不同质量浓度MAR响应的DPV曲线和标准曲线
Fig.9 DPV curves of the electrochemical biosensor to different concentrations of MAR and standard curve
由图9-a可见,随着MAR浓度的增加,峰值电流逐渐降低。图9-b显示了在0.5~400 ng/mL范围内,DPV峰值电流变化量与MAR浓度呈线性关系。线性回归方程为y=1.031 3+0.007 8x,相关系数r=0.999 2,检测限为0.05 ng/mL。
2.6.2 免疫传感器的特异性和稳定性
考察免疫传感器的特异性和稳定性结果,结果见图10。
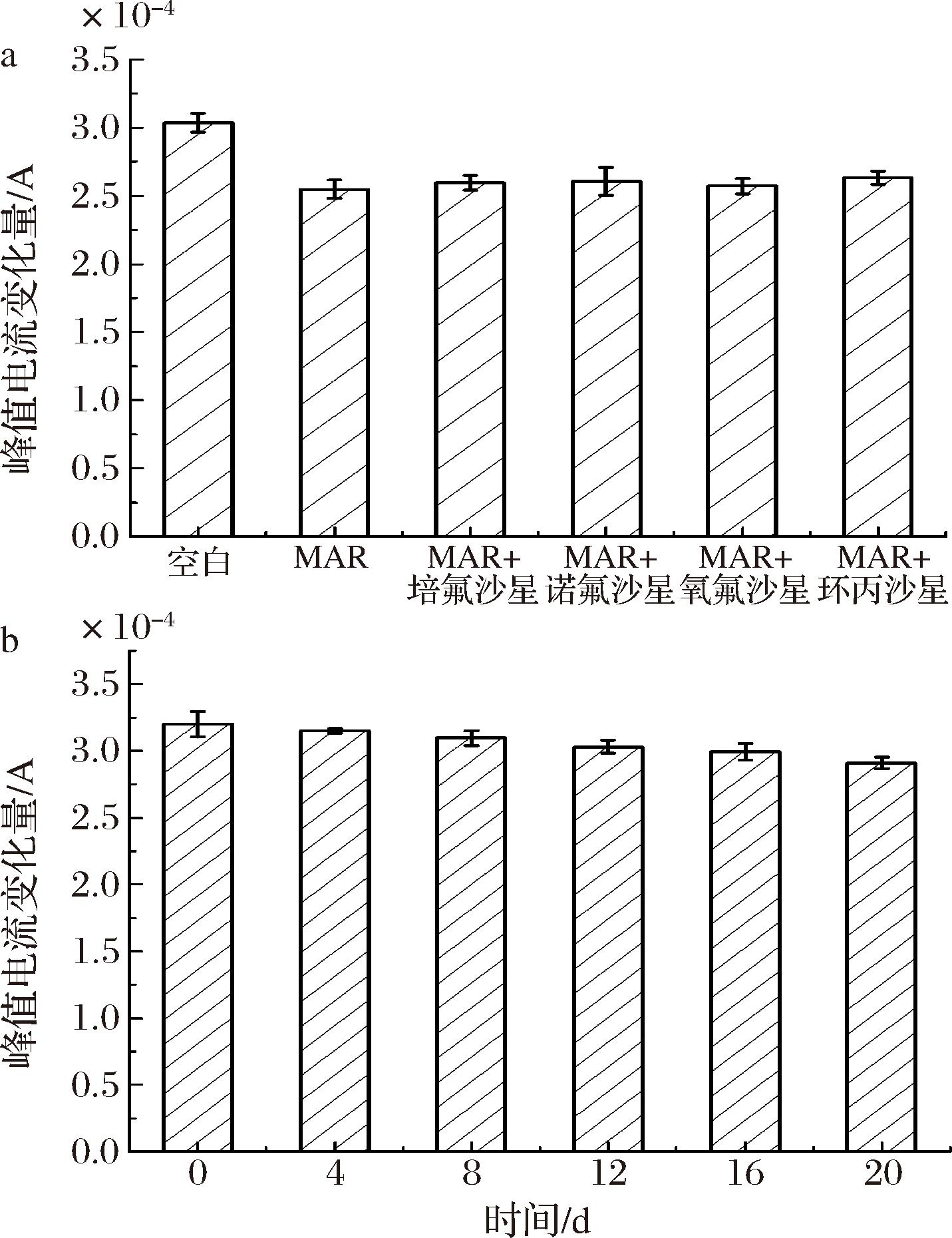
a-特异性图;b-稳定性图
图10 电化学免疫传感器的特异性和稳定性
Fig.10 Specificity and stability of electrochemical immunosensors
由图10-a可知,与只加入50 ng/mL MAR的溶液对比,加入干扰物后所得电流响应值分别增加1.96%、2.35%、0.78%、3.14%,相对标准偏差都小于5%,表明上述药物基本不干扰MAR的测定,因此该免疫传感器对马波沙星具有良好的特异性。由图10-b可知,20 d后传感器的峰值电流变化量相较第1天下降约9.1%,因此,表明该传感器的稳定性良好。
2.7 鲜肉样品的分析
2.7.1 校正曲线
采用超高效液相色谱-串联质谱法测定3种鲜肉,得出3种样品均为阴性样品。按照1.3.5节方法处理猪肉、鸡肉、牛肉样品,用得到的样品处理液分别稀释MAR标准品溶液,得到一系列MAR浓度(0.5、10、25、50、100、200、300、400 μg/kg)的样品溶液。用所建立的电化学免疫传感器对上述溶液进行检测,得到校正标准曲线。结果表明,MAR浓度在0.5~400 μg/kg内,所制备的免疫传感器在含有10 mmol/L![]() 的测试底液中的氧化峰电流值变化量与MAR浓度之间具有良好的线性关系。猪肉样的线性方程为y=1.216 0+0.007 4x,相关系数r=0.999 4,检测限为0.09 μg/kg,鸡肉样的线性方程为y=1.101 6+0.007 1x,相关系数r=0.999 3,检测限为0.10 μg/kg,牛肉样的线性方程为y=1.104 2+0.007 7x,相关系数r=0.999 1,检测限为0.09 μg/kg。
的测试底液中的氧化峰电流值变化量与MAR浓度之间具有良好的线性关系。猪肉样的线性方程为y=1.216 0+0.007 4x,相关系数r=0.999 4,检测限为0.09 μg/kg,鸡肉样的线性方程为y=1.101 6+0.007 1x,相关系数r=0.999 3,检测限为0.10 μg/kg,牛肉样的线性方程为y=1.104 2+0.007 7x,相关系数r=0.999 1,检测限为0.09 μg/kg。
2.7.2 添加回收试验
按照1.3.5节方法处理猪肉、鸡肉和牛肉样品,MAR在鲜肉中的加标量为5、100、200 μg/kg,平行处理3次,测定峰值电流,用上述校正曲线回归方程计算MAR浓度。同时,用超高效液相色谱-串联质谱法对上述加标样品进行检测,结果见表1。
表1 添加回收试验结果(N=3)
Table 1 Results of spiked experiment (N=3)

样品本方法HPLC-MSMAR标准浓度/(μg/kg)加标量回收量回收率/%相对标准偏差/%回收量回收率/%相对标准偏差/%54.61±0.1492.182.944.49±0.1789.873.69猪肉10084.53±1.2484.531.4791.97±2.0091.972.18200184.57±2.7492.291.49205.22±3.33102.611.6254.14±0.1482.813.404.77±0.1395.452.73鸡肉10096.43±1.1896.431.2291.16±2.1491.162.35200203.22±1.72101.610.85201.87±3.35100.941.6655.10±0.15101.992.944.51±0.1890.134.09牛肉10089.47±0.7289.470.8087.97±2.1387.972.42200194.67±5.4497.332.79182.08±1.9391.041.06
由表1可以看出,免疫传感器测定样品的回收率为82.81%~101.99%,相对标准偏差≤3.40%。说明该方法可用于鲜肉中MAR的检测。超高效液相色谱-串联质谱法检测回收率在87.97%~102.61%,相对标准偏差≤ 4.09%。结果表明,该电化学免疫传感器检测结果与超高效液相色谱-串联质谱法检测结果基本一致。综上可知,本方法可作为MAR常规检测的替代方法。
3 结论
利用AuNPs/rGO-CS复合膜修饰玻碳电极后,固定抗体,构建了一种检测MAR的电化学免疫传感器。该传感器检测MAR的线性范围为0.5~400 ng/mL,线性系数为0.999 2,检测限为0.05 ng/mL。所制备的免疫传感器在长期贮存中均显示出良好的稳定性。对猪肉、鸡肉和牛肉样品的检测限分别为0.09、0.10、0.09 μg/kg,添加回收率82.81%~101.99%,相对标准偏差≤3.40%。经超高效液相色谱-串联质谱法验证,表明所建立的电化学免疫传感器可用于鲜肉中MAR的定量检测。该方法具有成本低、灵敏度高、特异性强和稳定性好的优点,故在MAR快速检测中具有巨大的应用潜力。
[1] ALTAN F, CORUM O, DURNA CORUM D, et al.Pharmacokinetics of marbofloxacin following intramuscular administration at different doses in sheep[J].Small Ruminant Research, 2019, 174:88-91.
[2] 宋亚宁, 胡超琼, 王冲, 等.核酸适配体生物传感器在食品中氟喹诺酮类兽药残留检测中的应用[J].中国食品学报, 2021, 21(8):409-419.SONG Y N, HU C Q, WANG C, et al.Application of aptamer biosensor in the determination of fluoroquinolones residues in food[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(8):409-419.
[3] ARESTA A, COTUGNO P, ZAMBONIN C.Determination of ciprofloxacin, enrofloxacin, and marbofloxacin in bovine urine, serum, and milk by microextraction by a packed sorbent coupled to ultra-high performance liquid chromatography[J].Analytical Letters, 2019, 52(5):790-802.
[4] MOEMA D, MAKWAKWA T A, GEBREYOHANNES B E, et al.Hollow fiber liquid phase microextraction of fluoroquinolones in chicken livers followed by high pressure liquid chromatography:Greenness assessment using National Environmental Methods Index Label (NEMI), green analytical procedure index (GAPI), analytical GREEnness metric (AGREE), and Eco Scale[J].Journal of Food Composition and Analysis, 2023, 117:105131.
[5] LI W Z, WANG P X, CHU B B, et al.A highly-sensitive sensor based on carbon nanohorns@reduced graphene oxide coated by gold platinum core-shell nanoparticles for electrochemical detection of carbendazim in fruit and vegetable juice[J].Food Chemistry, 2023, 402:134197.
[6] YU K L, YUE M E, XU J, et al.Determination of fluoroquinolones in milk, honey and water samples by salting out-assisted dispersive liquid-liquid microextraction based on deep eutectic solvent combined with MECC[J].Food Chemistry, 2020, 332:127371.
[7] LUO M X, XING K Y, GUO Z, et al.Sensitive immunoassays based on a monoclonal antibody for detection of marbofloxacin in milk[J].Journal of Dairy Science, 2020, 103(9):7791-7800.
[8] ZHANG B, LANG Y H, GUO B W, et al.Indirect competitive enzyme-linked immunosorbent assay based on broad-spectrum antibody for simultaneous determination of thirteen fluoroquinolone antibiotics in rana catesbeianus[J].Foods, 2023, 12(13):2530.
[9] PENG J, LIU L Q, XU L G, et al.Gold nanoparticle-based paper sensor for ultrasensitive and multiple detection of 32 (fluoro) quinolones by one monoclonal antibody[J].Nano Research, 2017, 10(1):108-120.[10] XIAO J X, YANG H F, QIN L N, et al.Rapid detection of fluoroquinolone residues in aquatic products based on a gold-labeled microwell immunochromatographic assay[J].Food Quality and Safety, 2022, 6:597-607.
[11] DUAN Y Y, YU Y L, WANG L M, et al.Dual-emission LaF3∶Tb@DPA-Eu nanoparticles as a ratiometric fluorescence probe for the detection of marbofloxacin[J].Microchemical Journal, 2021, 168:106469.
[12] LIU Z P, ZHOU J, WANG X F, et al.Graphene oxide mediated CdSe quantum dots fluorescent aptasensor for high sensitivity detection of fluoroquinolones[J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2024, 305:123497.
[13] RUDNICKI K, SIPA K, BRYCHT M, et al.Electrochemical sensing of fluoroquinolone antibiotics[J].TrAC Trends in Analytical Chemistry, 2020, 128:115907.
[14] XIAO X Y, HU S, LAI X C, et al.Developmental trend of immunoassays for monitoring hazards in food samples:A review[J].Trends in Food Science &Technology, 2021, 111:68-88.
[15] YU Q, WU T, TIAN B S, et al.Recent advances in SERS-based immunochromatographic assay for pathogenic microorganism diagnosis:A review[J].Analytica Chimica Acta, 2024, 1286:341931.
[16] 戴煌, 黄周梅, 李占明, 等.免疫法在食品黄曲霉毒素检测中的应用[J].中国食品学报, 2021, 21(10):287-304.DAI H, HUANG Z M, LI Z M, et al.Application of immunoassays in food aflatoxins detection[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):287-304.
[17] FANG L, LIAO X F, JIA B Y, et al.Recent progress in immunosensors for pesticides[J].Biosensors and Bioelectronics, 2020, 164:112255.
[18] XU J H, WANG Y Z, HU S S.Nanocomposites of graphene and graphene oxides:Synthesis, molecular functionalization and application in electrochemical sensors and biosensors.A review[J].Microchimica Acta, 2017, 184(1):1-44.
[19] YAO Y, WANG G X, CHU G L, et al.The development of a novel biosensor based on gold nanocages/graphene oxide-chitosan modified acetylcholinesterase for organophosphorus pesticide detection[J].New Journal of Chemistry, 2019, 43(35):13816-13826.
[20] HUANG J L, XIE Z X, HUANG Y H, et al.Electrochemical immunosensor with Cu(I)/Cu(II)-chitosan-graphene Nanocomposite-based signal amplification for the detection of Newcastle disease virus[J].Scientific Reports, 2020, 10(1):13869.
[21] BISHT N, PATEL M, DWIVEDI N, et al.Bio-inspired polynorepinephrine based nanocoatings for reduced graphene oxide/gold nanoparticles composite for high-performance biosensing of Mycobacterium tuberculosis[J].Environmental Research, 2023, 227:115684.
[22] SONG X J, WANG D H, KIM M.Development of an immuno-electrochemical glass carbon electrode sensor based on graphene oxide/gold nanocomposite and antibody for the detection of patulin[J].Food Chemistry, 2021, 342:128257.
[23] 卢文卜, 鲍灿灿, 魏明, 等.基于纳米金修饰硼化钴纳米片的电化学免疫传感器用于检测人绒毛膜促性腺激素[J].分析化学, 2021, 49(12):2075-2085.LU W B, BAO C C, WEI M, et al.An electrochemical immunosensor based on gold nanoparticles decorated cobalt boride nanosheet arrays for detection of human chorionic gonadotropin[J].Chinese Journal of Analytical Chemistry, 2021, 49(12):2075-2085.
[24] ZHU Q, CAI F D, ZHANG J, et al.Highly sensitive electrochemiluminescent immunosensor based on gold nanoparticles-functionalized zinc oxide nanorod and poly(amidoamine)-graphene for detecting brombuterol[J].Biosensors and Bioelectronics, 2016, 86:899-906.
[25] 丁佳, 梁文煦, 周云雷, 等.电化学免疫传感器检测TET1蛋白[J].分析化学, 2022, 50(2):217-224.DING J, LIANG W X, ZHOU Y L, et al.An electrochemical immunosensor for detection of ten-eleven translocation 1 protein[J].Chinese Journal of Analytical Chemistry, 2022, 50(2):217-224.
[26] 尹起, 姜丽萍, 郭丰佳, 等.铜离子掺杂双金属纳米球免疫传感器检测前列腺特异性抗原[J].分析试验室, 2023, 42(9):1229-1235.YIN Q, JIANG L P, GUO F J, et al.Detection of prostate specific antigen by electrochemical immunosensor with Cu2+ doped bimetallic nanospheres[J].Chinese Journal of Analysis Laboratory, 2023, 42(9):1229-1235.
[27] ZHAO R, BI S Y, SHAO D, et al.Rapid determination of marbofloxacin by surface-enhanced Raman spectroscopy of silver nanoparticles modified by β-cyclodextrin[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 229:118009.
[28] ZHOU X C, ZHANG S H, SHI J, et al.An ultrasensitive competitive chemiluminescence immunosensor coupled flow injection cell modified by oxidized graphene-chitosan for the detection of Hg2+[J].Microchemical Journal, 2019, 149:103997.
[29] 饶红红, 薛中华, 王雪梅, 等.基于电化学还原氧化石墨烯的电化学传感[J].化学进展, 2016, 28(S2):337-352.RAO H H, XUE Z H, WANG X M, et al.Electrochemical sensors based on electrochemically reduced graphene oxide[J].Progress in Chemistry, 2016, 28(S2):337-352.
[30] YADAV A K, DHIMAN T K, LAKSHMI G B V S, et al.A highly sensitive label-free amperometric biosensor for norfloxacin detection based on chitosan-yttria nanocomposite[J].International Journal of Biological Macromolecules, 2020, 151:566-575.