葡萄籽是葡萄科植物葡萄(Vitis vinifera L.)的种子,约占整个鲜果粒重的5%,经晒干后分离葡萄皮、葡萄梗后所得[1],同时也是酿造葡萄酒或果汁加工产生的主要废渣,大部分无法得到妥善利用,这不仅是资源的浪费,同时也造成了一定的环境问题。因此,葡萄籽的再利用将为这些问题提供新的解决方案。
目前关于葡萄籽化学成分的研究表明,葡萄籽中含有多酚类、氨基酸、矿物质、脂质、维生素、脂肪酸等多种化合物,王丽娟等[2]采用气相色谱-质谱联用法对葡萄籽油脂的脂肪酸成分进行分析,其主要成分为亚油酸、油酸等;林童等[3]对不同品种的葡萄籽所含营养成分进行分析,研究表明其含有大量的蛋白质及多酚类物质,而葡萄籽多酚主要成分是原花青素(proanthocyanidins,PC),其含量最高可达60%。相较于常见的抗氧化类物质,原花青素具有更强的抗氧化活性[4],同时还具有抗炎[5]、心血管保护[6]、降血脂[7]、抑制抗糖尿病及其并发症[8]等作用,已广泛应用于食品、化妆品、药品等领域[9-10]。然而,葡萄籽提取物中的复杂混合物导致其化学成分分析困难,目前研究多集中在一类化合物,未对其进行全面分析,且原花青素作为混合物,其组成部分结构相似,分离较为困难,因此其组成部分的含量测定目前未见用具体分析方法解析的报道。而超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry, UPLC-MS/MS)作为新的定性定量分析方法,相较于LC-MS/MS,其分辨率、灵敏度更高,分析速度更快,分离度更好,能够区分同分异构体,对复杂混合物能进行更好的分离,同时该方法屏蔽了基质的干扰,确保了结果准确可靠,在天然产物的药效物质基础研究及传统民族药成分分析等研究领域已得到广泛的应用[11-13]。因此,本文首先通过超高效液相色谱-四级杆-飞行时间高分辨质谱(ultra performance liquid chromatography-quadrupole-time-of-flight high resolution mass spectrometry, UPLC-Q-TOF-MS/MS)技术对葡萄籽提取物进行快速定性分析;其次,基于超高效液相色谱三重四极杆质谱法(ultra performance liquid chromatography-triple quadrupole mass spectrometry,UPLC-QqQ-MS/MS)的多反应检测模式(multiple reaction monitoring,MRM)可以避免峰重叠引起的干扰的优势,同时测定葡萄籽提取物中4个有效成分的含量,从而建立一种快速、准确的定性定量方法,以期为葡萄籽的药效物质基础研究和合理开发利用提供数据基础。
1 材料与方法
1.1 材料与试剂
对照品:原花青素C1(批号wkq23060211,≥98%)、原花青素B2(批号wkq22093013,≥98%)、儿茶素(批号wkq23031010,≥98%)、表儿茶素(批号wkq23073106,≥98%),四川省维克奇生物科技有限公司;水为屈臣氏蒸馏水;甲酸为LC-MS级,上海麦克林生化科技股份有限公司;乙腈为质谱级,Fisher Chemical公司;甲醇为色谱级,上海麦克林生化科技股份有限公司;其余试剂为色谱纯。实验用葡萄籽提取物(批号20131203),新疆乡都酒业有限公司。
1.2 仪器与设备
KQ3200DE型超声清洗仪,昆山超声仪器有限公司;Xevo G2-XS Q-Tof超高效液相色谱四极杆串联飞行时间质谱联用仪、Waters Xevo TQ-S超高效液相三重四极杆质谱联用仪,美国Waters公司;ME155DU型电子天平(十万分之一),梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 UPLC-Q-TOF-MS/MS定性分析
1.3.1.1 溶液的制备
对照品溶液:分别取对照品原花青素B2、原花青素C1、儿茶素、表儿茶素各5 mg,用甲醇溶解定容,配制成质量浓度为500 μg/mL的对照品储备液,后稀释成质量浓度为10 μg/mL混合对照品溶液,即得。
供试品溶液:称取葡萄籽提取物10 mg置于锥形瓶中,加30 mL甲醇,超声处理(功率120 W) 20 min,放至室温,转移至100 mL容量瓶,甲醇定容,至澄清后,取上清液配制得质量浓度为100 μg/mL 的供试品溶液,经0.22 μm微孔膜滤过,即得。
1.3.1.2 色谱条件
色谱柱为ACQUITY UPLC BEH C18(100 mm× 2.1 mm, 1.7 μm),以A相0.1%甲酸水,B相乙腈做流动相,进行梯度洗脱(0~2 min,90%A;2~25 min,90%~10%A;25~28 min,10%~90%A;28~30.1 min,90%A)。流速 0.3 mL/min,柱温35 ℃,自动进样器温度10 ℃,进样量5 μL。
1.3.1.3 质谱条件
采用电喷雾离子源(ESI),正、负离子模式,扫描范围m/z 50~1 200,毛细管电压3.0 kV(ESI+),2.5 kV(ESI-),锥孔电压40 V,锥孔气流量50 L/h,脱溶剂气流速900 L/h,离子源温度120 ℃,脱溶剂气温度350 ℃。采用亮氨酸-脑啡肽为LockSpray校正标准液(200 pg/mL),使用甲酸钠溶液对仪器进行质谱质量轴校正。
1.3.1.4 数据采集与处理
采用MSEContinuum模式采集数据,然后通过UNIFI数据处理系统以自建数据库对葡萄籽提取物的化学成分进行自动识别,最后根据软件所给信息比较对照品图谱及文献对各主要化合物进行人工识别和确认。
1.3.2 UPLC-QqQ-MS/MS多成分含量测定
1.3.2.1 溶液的制备
对照品溶液:分别取对照品原花青素B2、原花青素C1、儿茶素、表儿茶素各3 mg,用甲醇溶解定容,制成质量浓度为30 μg/mL的对照品储备液,备用。
供试品溶液:同1.3.1.1节。
1.3.2.2 色谱条件
色谱柱为ACQUITY UPLC® HSS T3 色谱柱(2.1 mm×100 mm,1.8 μm),以0.2%乙酸水溶液(A)-乙腈(B)为流动相,梯度洗脱(0~4 min,90%~80%A;4~6 min,80%~65%A;6~7 min,65%~20%A;7~8 min,20%A;8~9 min,20%~90%A;9~10 min,90%A)。柱温35 ℃,流速0.3 mL/mim,梯度洗脱,进样量3 μL。
1.3.2.3 质谱条件
质谱采用电喷雾离子源,负离子模式(ESI-);MRM;毛细管电压:2.70 kV;锥孔电压:40 V;解离温度:400 ℃;解离气流速:800 L/h;锥孔气流速:150 L/h;碰撞气流速:25 mL /min,其他参数见表1。
表1 葡萄籽提取物中4种有效成分的质谱数据
Table 1 Mass Spectrometric data of four active components in grape seed extract

化学成分保留时间/min相对分子质量一级质谱m/z二级质谱m/z定量离子锥孔电压/V碰撞能/eV二级质谱m/z定性离子锥孔电压/V碰撞能/eV儿茶素2.69290.079 028924545202054520表儿茶素3.46290.079 028924545201794520原花青素B22.94578.142 457728945204254520原花青素C13.60866.205 8865.35577.14020695.14020
2 结果与分析
2.1 UPLC-Q-TOF-MS/MS定性分析
根据高分辨质谱数据,用UNIFI数据处理系统分析化合物的保留时间、准确的相对分子质量、碎片离子信息并结合对照品图谱与相关文献对比[14-25],共鉴别出20个化学成分,包括7个多酚类、1个三萜类,1个黄酮醇类、1个不饱和脂肪酸类、1个多羟基茋类、3个酚酸类、6个氨基酸类。总离子流色谱图见图1,化合物的相关鉴定信息见表2。
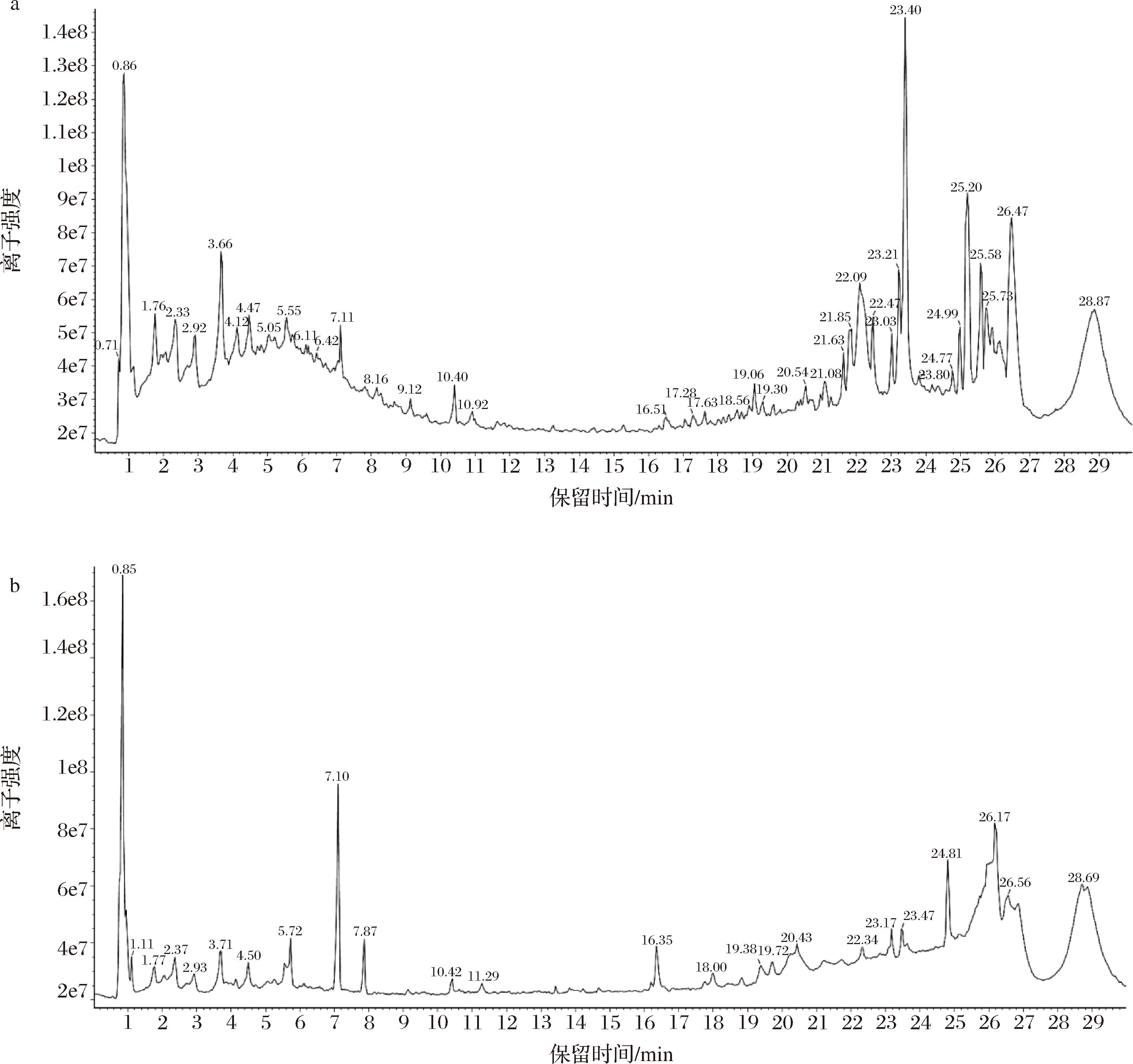
a-正离子模式;b-负离子模式
图1 葡萄籽提取物的UPLC-Q-TOF-MS/MS总离子流图
Fig.1 UPLC-Q-TOF-MS/MS total ion flow diagram of grape seed extrac
表2 葡萄籽提取物化学成分鉴定与分析结果
Table 2 Identification and analysis of chemical constituents of grape seed extract

化合物保留时间/min名称分子式m/z实测值化学位移/ppm碎片离子m/z13.68儿茶素C15H14O6291.086 1[M+H]+-0.6273.074 3,249.074 1,168.079 3,139.038 4,123.042 5289.070 8[M-H]--3.4271.059 9,179.032 5,161.022 8,151.038 3,137.022 8,125.022 9,109.028 125.51(-)-儿茶素没食子酸酯C22H18O10443.096 3[M+H]+-2.3303.049 0,271.059 5,163.057 6,153.017 0,123.047 0441.081 5[M-H]--2.8425.087 3,301.033 4,289.070 2,169.013 0,125.023 032.86原花青素B1C30H26O12579.149 2[M+H]+-0.8427.101 2,409.090 8,301.069 4,247.059 0,127.037 442.92原花青素B2C30H26O12577.134 8[M-H]--0.7451.101 8,425.085 8,407.075 6,289.070 4,161.022 9,125.023 055.68原花色素A2C30H24O12577.132 8[M+H]+-2.1425.085 4,289.070 0,271.059 4,137.058 0575.117 9[M-H]--2.8539.099 7,449.089 1,423.070 2,285.038 664.08原花青素C1C45H38O18867.212 5[M+H]+-0.7697.153 5,577.133 4,427.100 8,289.069 9,143.071 5865.198 0[M-H]--0.6739.166 0,695.138 6,577.133 2,451.102 8,407.075 5,289.069 8,161.022 5,125.022 974.38肉桂鞣质A2C60H50O241 155.275 3[M+H]+-1.0867.211 5,577.133 5,407.275 2,331.079 6,285.036 8,179.031 81 153.260 4[M-H]--1.4865.184 9,593.128 9,411.069 6,323.053 4,151.038 4823.38亚油酸C18H32O2281.246 7[M+H]+-2.9223.167 5,221.224 5,135.115 1,89.058 3279.231 5[M-H]--5.3261.102 4,191.054 7,71.038 0921.39齐墩果酸C30H48O3457.364 6[M+H]+-6.6275.199 0,203.178 3,121.101 1,95.083 9455.360 4[M-H]--1.2277.215 5107.28白藜芦醇C14H12O3229.084 9[M+H]+-4.3123.042 6,77.037 0227.069 3[M-H]--8.9205.838 5,185.052 4,83.048 6112.43对羟基苯甲酸C7H6O3139.038 4[M+H]+-4.0123.047 7,93.032 0,77.037 3137.022 7[M-H]--12.4136.013 4125.02没食子酸C7H6O5171.027 3[M+H]+-8.8153.016 9,139.037 4,127.037 2169.012 8[M-H]--8.5125.022 8133.67咖啡酸C9H8O4181.047 2[M+H]+-12.8137.058 0,122.035 2,110.034 6,93.032 5179.033 5[M-H]--8.4161.022 8,135.043 6,109.028 1148.32槲皮素C15H10O7303.049 3[M+H]+-2.0287.053 9,247.058 4,163.037 0,153.016 6,93.031 7C15H10O7301.033 7[M-H]--1.6243.028 5,151.002 6,107.012 6157.70苏氨酸C4H9NO3120.066 1[M+H]+-15.0115.052 7,91.052 71611.58缬氨酸C5H11NO2118.084 3[M+H]+-16.884.043 11717.23亮氨酸C6H13NO2132.140 3[M+H]+6.298.058 3185.77L-异亮氨酸C6H13NO2132.100 9[M+H]+-7.898.058 3,70.063 6190.85苯丙氨酸C10H13NO2166.100 6[M+H]+-7.1148.012 2,103.012 5C10H13NO2164.083 3[M-H]--11.8120.110 6,86.125 02013.20L-赖氨酸C6H14N2O2147.112 1[M+H]+-4.8129.100 9,116.069 0,94.038 9,84.959 0,55.053 5C6H14N2O2145.097 7[M-H]-6.6146.964 9
2.1.1 多酚类
化合物1在负离子模式下,产生m/z 289.070 8 [M-H]-的准分子离子峰,观察其质谱二级裂解图可以找到m/z 271.059 9、179.032 5、151.038 3、137.022 8、109.028 1二级离子碎片,其中m/z 271.059 9信号峰为分子离子峰289.070 8失去一分子H2O产生的[M-H2O-H]-碎片峰,而碎片m/z 137.022 8则为分子离子峰289.070 8发生RDA裂解失去C8H9O3所得到的[M-C8H9O3-H]-碎片峰,经与对照品对比,推断其为儿茶素,可能的裂解方式见图2。
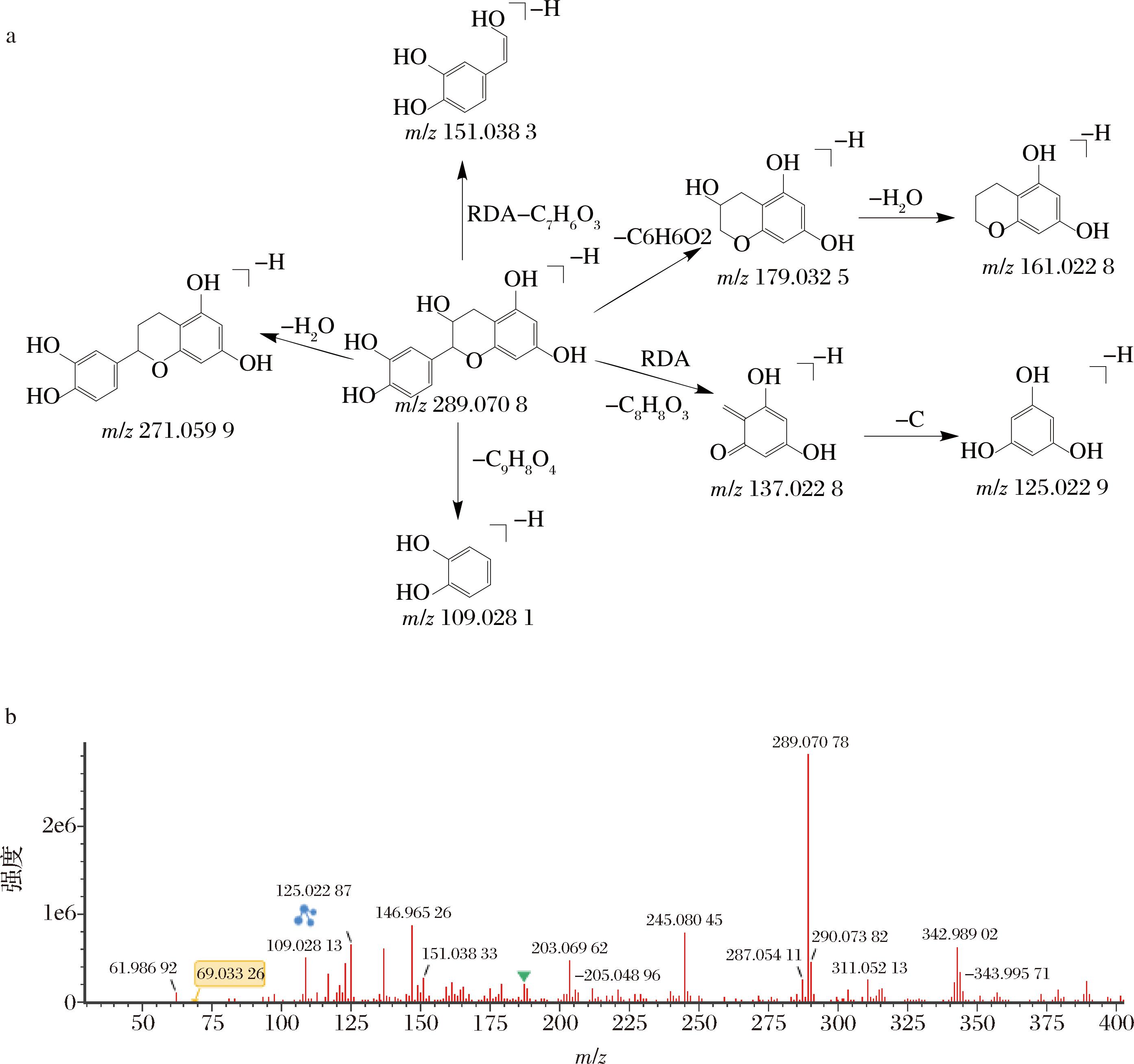
a-质谱裂解图;b-二级质谱碎片图
图2 儿茶素可能的质谱裂解途径及二级质谱碎片信息
Fig.2 Possible cleavage pathways of catechins and secondary mass spectrum fragment information
化合物2在正离子模式下,在质谱图上可观察到m/z 443.096 3[M+H]+的准分子离子峰,其保留时间为5.51 min,并产生m/z 303.049 0、271.059 5、163.057 6、153.017 0、123.047 0二级离子碎片,其中m/z 123.047 0为[M+H]+离子峰失去C15H11O8所产生的[M-C15H11O8+H]+离子信号峰,根据所查阅到的文献[14],确定该化合物为儿茶素没食子酸酯,分子式为C22H18O10。
化合物3和化合物4的质谱裂解形式十分相似,相应的保留时间分别为2.86、2.92 min,正离子模式下观察化合物3的图谱,可以找到m/z 579.1 492[M+H]+准分子离子峰,产生m/z 427.101 2、409.090 8、127.037 4离子信号峰,其中m/z 427.101 2为分子离子峰579.149 2失去C8H8O3所得到的[M-C8H8O3+H]+碎片峰;在负离子模式下,化合物4产生m/z 577.134 8[M-H]-准分子离子峰,产生的信号峰有m/z 425.085 8、407.075 6、127.037 4,其中m/z 425.085 8亦为分子离子峰577.134 8失去C8H8O3所得到的[M-C8H8O3-H]-碎片峰,通过比对对照品图谱及文献[15],确定为原花青素B1、原花青素B2,所推测的裂解方式见图3。

a-质谱裂解图;b-二级质谱碎片图
图3 原花青素B2可能的质谱裂解途径及二级质谱碎片信息
Fig.3 Possible pathways of proanthocyanidin B2 cleavage and secondary mass spectrum fragment information
化合物6在正离子模式下,观察其质谱图,可以在对应的保留时间处找到m/z 867.212 5[M+H]+的准分子离子峰,其产生的主要离子碎片有m/z 697.153 5、577.133 4、427.100 8、289.069 9、143.071 5,其中m/z 577.133 4为分子离子峰867.212 5失去C15H13O6,即失去一个聚合单元所形成的[M-C15H13O6+H]+碎片峰。与对照品图谱及相关数据对比,推测该化合物为原花青素C1,相对分子质量为866.205 8。
化合物7在负离子模式下,相应的保留时间为4.38 min,准分子离子峰的m/z为1 153.260 4,即[M-H]-为1 153.260 4,产生相应的二级碎片离子有m/z 865.184 9、593.128 9、411.069 6、323.053 4、151.038 4,进一步分析碎片离子m/z 865.184 9为分子离子峰1 155.2 753失去C15H12O6,即失去一个聚合单元所得到的[M-C15H12O6-H]-碎片峰。结合多酚类化合物裂解规律和参考文献[16],推断该化合物为肉桂鞣质A2(原花青素非酯型四聚体),分子式为C60H50O24。
2.1.2 不饱和脂肪酸类
化合物8在正离子模式下,对应的保留时间为23.38 min,其准分子离子峰的m/z为281.246 7,即[M+H]+为279.231 5,产生相应的二级碎片离子有m/z 221.224 5、135.115 1、89.058 3其中碎片离子m/z 221.224 5为分子离子峰281.246 7失去一分子CO2及CH3得到的[M-CO2-CH3+H]+碎片峰,综合查到的文献[19-20],通过比较推断其为亚油酸,相对分子质量为280.240 2。
2.1.3 三萜类
化合物9在正离子模式下产生的准分子离子峰为m/z 457.364 6[M+H]+,其对应的保留时间为21.39 min,形成的二级碎片离子有m/z 275.199 0、203.178 3、121.101 1、95.083 9,其中m/z 275.199 0为分子离子峰457.364 6失去两分子异戊二烯C5H8,一分子H2O和C2H3所得到的[M-2C5H8-H2O-C2H3+H]+碎片峰,结合裂解规律和文献[17]对比,推断其为齐墩果酸,分子式为C30H48O3。
2.1.4 多羟基茋类
化合物10在正离子模式下,产生保留时间为7.28 min,m/z 229.084 9[M+H]+的准分子离子峰,其产生的二级碎片离子有m/z123.042 6、77.037 0,进一步分析碎片离子m/z 123.042 6为分子离子峰229.084 9失去C7H5O所得的[M-C7H5O+H]+碎片峰,结合裂解规律和文献[21]对比,推断其为白藜芦醇,分子式为C14H12O3。
2.1.5 酚酸类
化合物11在正离子模式下,产生对应的保留时间为2.33 min,m/z 139.038 4 [M+H]+的准分子离子峰,观察图谱发现m/z 93.032 0为 [M+H]+离子峰失去一分子的CO2所形成的[M-CO2+H]+离子碎片峰,结合查阅的文献[18],通过比较推断该化合物为对羟基苯甲酸,分子式为C7H6O5。
化合物12在负离子模式下,产生的准分子离子峰为m/z 169.012 8 [M-H]-,其保留时间5.02 min,分析所知m/z 125.022 8信号峰为[M-H]-离子峰失去一分子CO2进而得到的[M-CO2-H]-特征碎片峰,对比查阅的参考文献[22],可以确定该化合物为没食子酸。
化合物13在负离子模式下,其保留时间为3.67 min,准分子离子峰的m/z为179.033 5,即[M-H]-为179.033 5,产生相应的二级碎片离子有m/z 161.022 8、135.043 6、109.028 1,其中碎片离子135.043 6为分子离子峰179.033 5失去一分子CO2得到的[M-CO2-H]-碎片峰,结合裂解规律和查到的文献[23],通过比较推断其为咖啡酸。
2.1.6 黄酮醇类
化合物14在负离子模式下,产生m/z 301.033 7 [M-H]-的准分子离子峰,相应的保留时间为8.32 min,其二级碎片离子为m/z 243.028 5、151.002 6、107.012 6,其中m/z 243.028 5离子信号峰为[M-H]-离子峰失去一分子C2H2O和一分子OH所得到的[M-C2H2O-OH-H]-碎片峰,通过图谱对比查到的参考文献[18],推断其为槲皮素,分子式为C15H10O7。
2.1.7 氨基酸类
氨基酸类化合物在质谱裂解过程中,由于其结构中含有—CH3、—NH2、—COOH等基团,通常可以通过掉落H2O分子、CO2分子、—CH3、—COOH等离子碎片,从而形成氨基酸分子的特征碎片峰。结合裂解规律、保留时间和相关文献[24-25],通过比较鉴定出6种氨基酸类化合物,包括有化合物15~20,分别为苏氨酸、缬氨酸、亮氨酸、L-异亮氨酸、苯丙氨酸、L-赖氨酸。以化合物18(L-异亮氨酸)为例,在正离子模式下,可确定其保留时间为5.77 min,同时在质谱图上可以找到m/z 132.100 9 [M+H]+的准分子离子峰,形成的二级碎片离子有m/z 98.058 3、78.063 6,进一步分析可知,其中m/z 98.058 3为分子离子峰132.100 9失去H2O和CH3所得到的[M-H2O-CH3-H]-碎片峰。
2.2 UPLC-QqQ-MS/MS多成分含量测定
2.2.1 专属性试验
精密吸取对照品、供试品溶液各10 μL,在1.3.2.2节、1.3.2.3节项条件下进样测定,结果见图4。由此可知,供试品溶液色谱图中各成分在对照品溶液色谱图相应位置处有色谱峰,两者光谱特征一致,并且各色谱峰之间无干扰,表明该方法专属性良好。

a1-对照品表儿茶素(epicatechin);a2-对照品儿茶素(catechin);a3-对照品原花青素B2(procyanidin B2);a4-对照品原花青素C1(procyanidin C1);b1-供试品表儿茶素(epicatechin);b2-供试品儿茶素(catechin);b3-供试品原花青素B2(procyanidin B2);b4-供试品原花青素C1(procyanidin C1)
图4 葡萄籽提取物4种成分UPLC-MS/MS色谱图
Fig.4 UPLC-MS/MS chromatogram of four components in grape seed extract
2.2.2 线性关系考察及定量限和检测限测定
精密吸取1.3.2.1节中对照品储备液适量,稀释制成质量浓度为0.1、0.5、1.0、1.5、2.0、2.5、3.0 μg/mL的系列标准溶液,在1.3.2.2节、1.3.2.3节中条件下进样测定,以峰面积(y) 为纵坐标,质量浓度(x) 为横坐标进行回归,并以信噪比S/N=3和S/N=10分别计算4个成分的检测限(limit of detection, LOD)和定量限(limit of quantification, LOQ),结果见表3,结果表明各成分在各自线性范围内线性关系良好。
表3 葡萄籽提取物各成分线性关系、LOD和LOQ Table 3 Linear relationship of various components in grape seed extract, LOD, and LOQ
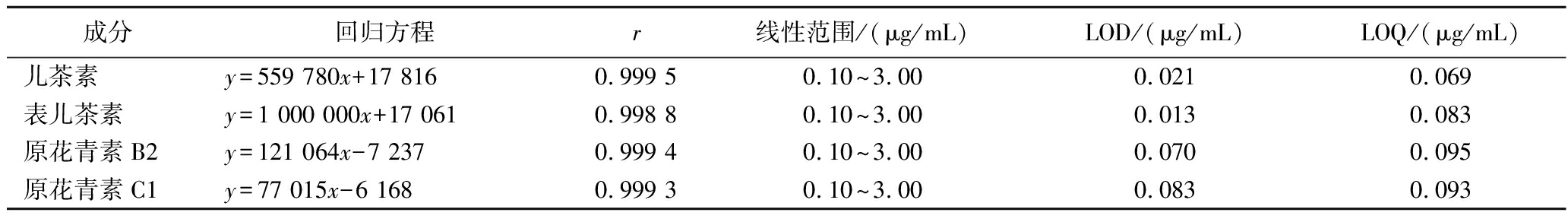
成分回归方程r 线性范围/(μg/mL)LOD/(μg/mL)LOQ/(μg/mL)儿茶素y=559 780x+17 8160.999 50.10~3.000.0210.069表儿茶素y=1 000 000x+17 0610.998 80.10~3.000.0130.083原花青素B2y=121 064x-7 2370.999 40.10~3.000.0700.095原花青素C1y=77 015x-6 1680.999 30.10~3.000.0830.093
2.2.3 精密度试验
精密吸取1.3.2.1节中对照品储备液各1 mL于5 mL量瓶,制成质量浓度为0.6 μg/mL的混合对照品溶液,在1.3.2.2节、1.3.2.3节条件下,连续进样6次。测得儿茶素、表儿茶素、原花青素B2、原花青素C1峰面积RSD分别为1.13%、1.98%、2.07%、1.84%,表明仪器精密度良好。
2.2.4 稳定性试验
按1.3.1.1节下方法制备供试品溶液,于0、2、4、8、16、24 h 在1.3.2.2节、1.3.2.3节条件下进样测定。测得儿茶素、表儿茶素、原花青素B2、原花青素C1峰面积RSD分别为0.97%、1.14%、1.75%、1.22%,表明供试品溶液在24 h内稳定性良好。
2.2.5 重复性试验
按1.3.1.1节中方法平行制备6份供试品溶液,在1.3.2.2节、1.3.2.3节条件下进样测定。测得儿茶素、表儿茶素、原花青素B2、原花青素C1含量的RSD分别为1.64%、3.31%、2.16%、1.31%,表明该方法重复性良好。
2.2.6 加样回收试验
精密称定9份已知含量的葡萄籽提取物(批号:20131203),每份约10 mg,分为3组,分别按已知含量的80%、100%、120%加入儿茶素、表儿茶素、原花青素B2、原花青素C1的对照品溶液,按1.3.1.1节方法制备供试品溶液,在1.3.2.2节、1.3.2.3节条件下进样测定,计算回收率。结果见表4,表明该方法准确性好。
表4 葡萄籽提取物各成分加样回收率试验结果(n=9)
Table 4 Results of recovery tests of various constituents in grape seed extract (n=9)
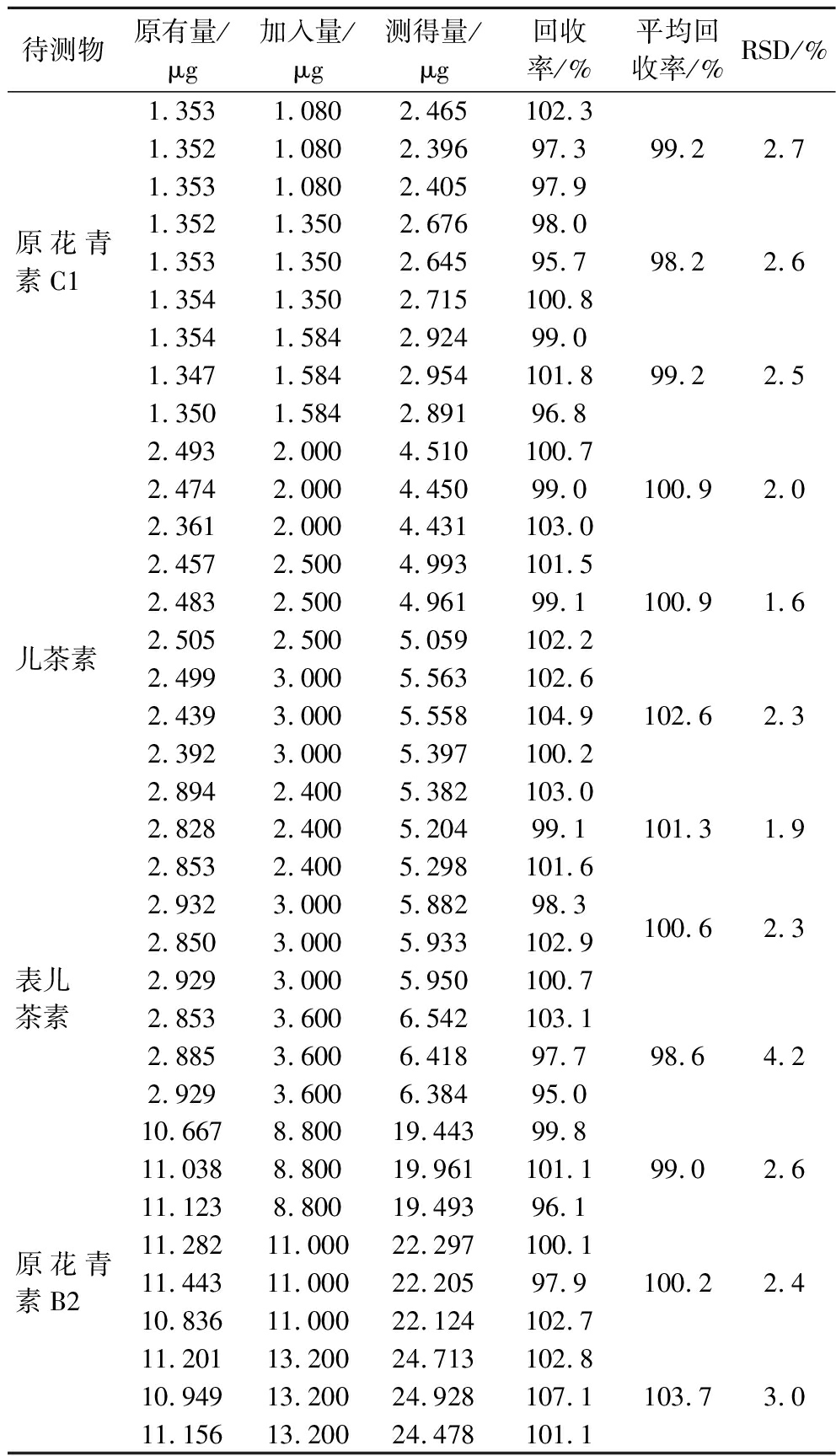
待测物原有量/μg加入量/μg测得量/μg回收率/%平均回收率/%RSD/%原花青素C11.353 1.080 2.465 102.31.352 1.080 2.396 97.399.2 2.71.353 1.080 2.405 97.91.352 1.350 2.676 98.01.353 1.350 2.645 95.798.22.6 1.354 1.350 2.715 100.81.354 1.584 2.924 99.01.347 1.584 2.954 101.899.22.51.350 1.584 2.891 96.8 儿茶素2.493 2.000 4.510 100.7 2.474 2.000 4.450 99.0100.9 2.02.361 2.000 4.431 103.0 2.457 2.500 4.993 101.5 2.483 2.500 4.961 99.1 100.9 1.6 2.505 2.500 5.059 102.2 2.499 3.000 5.563 102.6 2.439 3.000 5.558 104.9 102.6 2.32.392 3.000 5.397 100.22.894 2.400 5.382 103.0 2.828 2.400 5.204 99.1 101.3 1.9 2.853 2.400 5.298 101.6表儿茶素2.932 3.000 5.882 98.3 100.6 2.3 2.850 3.000 5.933 102.9 2.929 3.000 5.950 100.72.853 3.600 6.542 103.1 2.885 3.600 6.418 97.7 98.6 4.2 2.929 3.600 6.384 95.0原花青素B210.667 8.800 19.443 99.8 11.038 8.800 19.961 101.1 99.0 2.611.123 8.800 19.493 96.1 11.282 11.000 22.297 100.1 11.443 11.000 22.205 97.9100.2 2.4 10.836 11.000 22.124 102.7 11.201 13.200 24.713 102.8 10.949 13.200 24.928 107.1 103.7 3.011.156 13.200 24.478 101.1
2.2.7 样品含量测定
按1.3.1.1节方法制备供试品溶液,平行3份,在1.3.2.2节、1.3.2.3节条件下进样测定,标准曲线法计算含量,结果见表5。
表5 葡萄籽提取物各成分含量测定结果(n=3) 单位:mg/g Table 5 Results of content determination of various constituents in grape seed extract (n=3)
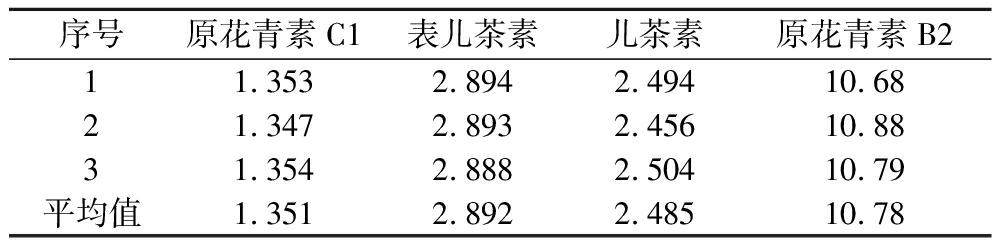
序号原花青素C1表儿茶素儿茶素原花青素B211.353 2.894 2.494 10.68 21.347 2.893 2.456 10.88 31.354 2.888 2.504 10.79 平均值1.351 2.892 2.485 10.78
3 结论与讨论
本研究首先运用UPLC-Q-TOF-MS/MS技术并结合UNIFI筛查平台对葡萄籽提取物中的化学成分进行快速的定性分析。在研究前期,考虑到葡萄籽提取物所含化合物种类较多,为了尽可能推测样品中的大部分化合物,因此对分析条件进行了多重优化,采用正、负离子2种扫描模式,以鉴定更多的化合物,最终从葡萄籽提取物中分离和鉴定出20个化合物。其次,再通过UPLC-QqQ-MS /MS 技术同时测定葡萄籽提取物中4个有效成分的含量,从而建立了一种快速、准确的定性定量分析方法,为葡萄籽后续的创新开发利用及医药领域的深入研究提供了数据基础,同时也为相关企业在葡萄籽废弃物处理方面提供了新思路。然而,由于对照品不足,且所建数据库信息量较少,使得部分响应较好的信号峰暂未解析出具体的化学结构。因此,葡萄籽提取物中的化学成分仍需进一步深入研究,从而更全面地揭示葡萄籽提取物的化学成分和潜在价值。
[1] 王霄倩, 王恒振, 刘丽娜, 等. 葡萄皮渣的营养价值及综合利用[J]. 中国农学通报, 2017, 33(27):147-151.WANG X Q, WANG H Z, LIU L N, et al. Nutritional value and comprehensive utilization of grape pomace[J]. Chinese Agricultural Science Bulletin, 2017, 33(27):147-151.
[2] 王丽娟, 杨宋琪, 郭兴霞, 等. 响应面法优化超声波辅助提取葡萄籽中油脂及其脂肪酸成分分析[J]. 粮食与油脂, 2018, 31(3):49-52.WANG L J, YANG S Q, GUO X X, et al. Optimization of ultrasonic-assisted extraction of grape seed oil by response surface methodology and its fatty acid composition analysis[J]. Cereals &Oils, 2018, 31(3):49-52.
[3] 林童, 卢贞希, 刘改霞, 等. 葡萄籽油的脂肪酸组成、抗氧化活性及其在可食性口红中的应用[J]. 中国油脂, 2021, 46(3):118-121.LIN T, LU Z X, LIU G X, et al. Fatty acid composition and antioxidant activity of grape seed oil and its application in edible lipstick[J]. China Oils and Fats, 2021, 46(3):118-121.
[4] 张王孝. 葡萄籽抗氧化活性研究进展[J]. 科技视界, 2014(21):63.ZHANG W X. Research progress on antioxidant activity of grape seeds[J]. Science &Technology Vision, 2014(21):63.
[5] JEKABSONE A, SILE I, COCHIS A, et al. Investigation of antibacterial and antiinflammatory activities of proanthocyanidins from Pelargonium sidoides DC root extract[J]. Nutrients, 2019, 11(11):2829.
[6] ZENG Y X, WANG S, WEI L, et al. Proanthocyanidins: Components, pharmacokinetics and biomedical properties[J]. The American Journal of Chinese Medicine, 2020, 48(4):813-869.
[7] ZHOU Q, HAN X, LI R B, et al. Anti-atherosclerosis of oligomeric proanthocyanidins from Rhodiola rosea on rat model via hypolipemic, antioxidant, anti-inflammatory activities together with regulation of endothelial function[J]. Phytomedicine, 2018, 51:171-180.
[8] QAED E, ALMOILIQY M, AL-HAMYARI B, et al. Procyanidins: A promising anti-diabetic agent with potential benefits on glucose metabolism and diabetes complications[J]. Wound Repair and Regeneration, 2023, 31(5):688-699.
[9] RIPPIN, SHARMA A K, BENIWAL V. Biosynthesis and medicinal applications of proanthocyanidins: A recent update[J]. Biocatalysis and Agricultural Biotechnology, 2022, 45:102500.
[10] 郭磊,杨静玉,王芳,等.葡萄籽提取物化学成分及药理活性的研究进展[J].沈阳药科大学学报,2008,25(S1):32-34. GUO L, YANG J Y, WANG F, et al. Research progress on chemical constituents and pharmacological activities of grape seed extract [J]. Journal of Shenyang Pharmaceutical University,2008,25(S1):32-34.
[11] 蔡定吉, 李志强, 彭万钱, 等. 基于UPLC-Q-TOF-MS技术的紫丁香化学成分及入血成分研究[J]. 中药材, 2023, 46(4):892-902.CAI D J, LI Z Q, PENG W Q, et al. Study on the chemical constituents and components into blood of Syringa oblata based on UPLC-Q-TOF-MS[J]. Journal of Chinese Medicinal Materials, 2023, 46(4):892-902.
[12] 周胡怿,赵希娟,焦必宁.基于UPLC-QqQ-MS/MS同时检测佛手中香豆素类化合物含量[J/OL].食品与发酵工业,1-12.https://doi.org/10.13995/j.cnki.11-1802/ts.035236. ZHOU H Z, ZHAO X J, JIAO B N. Simultaneous determination of coumarins in Radix formosanis based on UPLC-QqQ-MS/MS[J/OL]. Food and Fermentation Industries,1-12. https://doi.org/10.13995/j.cnki.11-1802/ts.035236.
[13] ZHANG F X, LI M, QIAO L R, et al. Rapid characterization of Ziziphi Spinosae Semen by UPLC/Qtof MS with novel informatics platform and its application in evaluation of two seeds from Ziziphus species[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 122:59-80.
[14] 黄彪, 刘文静, 方灵, 等. 基于UPLC-MS/MS同时分析福建乌龙茶和白茶中的儿茶素类物质[J]. 食品工业科技, 2020, 41(10):254-258;270.HUANG B, LIU W J, FANG L, et al. Simultaneous analysis of catechins in several Fujian oolong tea and white tea products by UPLC-MS/MS[J]. Science and Technology of Food Industry, 2020, 41(10):254-258; 270.
[15] 肖观林, 江洁怡, 李素梅, 等. 基于UPLC-Q-TOF-MS/MS技术的布渣叶化学成分分析[J]. 中国实验方剂学杂志, 2021, 27(3):138-148.XIAO G L, JIANG J Y, LI S M, et al. Analysis of chemical constituents in microctis folium by UPLC-Q-TOF-MS/MS[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(3):138-148.
[16] 杨代晓, 陈晓静, 胡秋菊, 等. 液相色谱—质谱联用法分析葡萄籽提取物中的5种多酚类成分[J]. 药物分析杂志, 2016, 36(8):1330-1337.YANG D X, CHEN X J, HU Q J, et al. LC-MS method for determination of 5 kinds of polyphenols in grape seed extract[J]. Chinese Journal of Pharmaceutical Analysis, 2016, 36(8):1330-1337.
[17] 谭金桃, 马丹凤, 方艳, 等. 基于UPLC-ESIQ-TOF-MS法分析灯台叶颗粒的主要活性成分[J]. 中南药学, 2017, 15(8):1111-1114.TAN J T, MA D F, FANG Y, et al. Identification and characterization of active chemical constituents in Dengtaiye particles with UPLC-ESIQ-TOF-MS[J]. Central South Pharmacy, 2017, 15(8):1111-1114.
[18] 武俊颖, 张武岗, 郎一帆, 等. 基于UPLC-Q-TOF-MS/MS的芒果核化学成分分析[J]. 天然产物研究与开发, 2023, 35(6):949-965.WU J Y, ZHANG W G, LANG Y F, et al. Chemical composition analysis of mango kernels by UPLC-Q-TOF-MS/MS[J]. Natural Product Research and Development, 2023, 35(6):949-965.
[19] 吴福林, 李平亚, 董庆海, 等. 基于UPLC-Q-TOF/MS分析止痛化徵胶囊的入血成分[J]. 中国中药杂志, 2018, 43(21):4339-4346.WU F L, LI P Y, DONG Q H, et al. Absorbed components analysis of Zhitong Huazheng Capsules in rat serum by UPLC-Q-TOF/MS[J]. China Journal of Chinese Materia Medica, 2018, 43(21):4339-4346.
[20] 罗媛, 王昌权, 巩仔鹏, 等. UPLC-Q-TOF-MS/MS分析苗药云实皮的化学成分[J]. 中国药房, 2020, 31(20):2481-2486.LUO Y, WANG C Q, GONG Z P, et al. Analysis of chemical compositions in Miao medicine Caesalpinia decapetala by UPLC-Q-TOF-MS/MS[J]. China Pharmacy, 2020, 31(20):2481-2486.
[21] YEO S C M, LUO W X, WU J Z, et al. Quantification of pinosylvin in rat plasma by liquid chromatography-tandem mass spectrometry: Application to a pre-clinical pharmacokinetic study[J]. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 2013, 931:68-74.
[22] 朱伟, 赵赫, 姚岚, 等. UFLC-MS/MS法同时测定肺宁颗粒中6种化学成分[J]. 解放军药学学报, 2017, 33(4):356-358, 362.ZHU W, ZHAO H, YAO L, et al. Smimultaneous UFLC-MS/MS quantitation of six chemical components in feining granules[J]. Pharmaceutical Journal of Chinese PLA, 2017, 33(4):356-358, 362.
[23] 翁倩倩, 杨滨, 李斌, 等. 瓜拉纳化学成分的UPLC-Q-TOF-MS分析[J]. 中国实验方剂学杂志, 2021, 27(15):68-75.WENG Q Q, YANG B, LI B, et al. Analysis of chemical constituents in Paullinia cupana dried seeds by UPLC-Q-TOF-MS[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(15):68-75.
[24] 王力彬, 冯甜, 王芳, 等. 基于UPLC-Q/Orbitrap/MS/MS对白虎加人参汤的全成分分析及化学成分鉴定[J]. 药物流行病学杂志, 2023, 32(2):198-206.WANG L B, FENG T, WANG F, et al. Analysis and identification of chemical constituents of Baihu-plus-Renshen decoction based on UPLC-Q/Orbitrap/MS/MS[J]. Chinese Journal of Pharmacoepidemiology, 2023, 32(2):198-206.
[25] 白伟娟, 张小江, 柳训才, 等. UPLC-MS/MS测定燕窝中18种氨基酸[J]. 食品工业, 2022, 43(10):296-302.BAI W J, ZHANG X J, LIU X C, et al. Determination of 18 amino acids in edible bird’s nest using UPLC-MS/MS[J]. The Food Industry, 2022, 43(10):296-302.