啤酒是一种深受全世界消费者欢迎的低酒精度饮料,其主要是以麦芽、酒花和水为原料经过啤酒酵母酿造而成。采用“高浓酿造,后稀释”工艺的啤酒高浓酿造技术极大地提高了啤酒的产量及设备利用率,降低能耗、节约清洗成本,同时增加了产品灵活性,带来了可观的经济效益,可以显著提升产品在市场上的竞争力[1]。在高浓酿造过程中,啤酒酵母细胞暴露在相较于常浓更强的压力胁迫中,例如高糖、高渗透压、低温、氧化以及高浓度的乙醇等。这些压力会影响酵母细胞的活性,抑制酵母细胞的生长,降低发酵性能。因此,具有较强环境耐受能力的啤酒酵母菌株在高浓稀释工艺中具有重要应用价值。
脯氨酸具有不同于α-氨基酸的环状结构,也被认为是较有效的渗透压保护剂和信号分子[2-3]。有报道显示,在面临渗透压胁迫时,多种细菌和植物会通过积累脯氨酸作为渗透压保护剂来应对胁迫[4];胞内脯氨酸积累含量较高的面包酵母菌株对各种与烘焙相关的压力都具有较强的耐受性,包括冻融、干燥和高蔗糖环境[5]。通过筛选胞内脯氨酸积累较多的啤酒酵母菌株可能能够获得环境抗性增强的菌株。因此,准确测定啤酒酵母胞内脯氨酸含量具有重要研究意义和实际应用价值。
目前有多种分析方法能准确地检测脯氨酸的含量。GC-MS或柱前衍生高效液相色谱结合荧光探针等色谱方法能够同时测定脯氨酸和其他氨基酸含量[6-7];流动注射分析(flow injection analysis, FIA)方法和高效阴离子交换层析-脉冲安培检测(high performance anion exchange chromatography-pulsed amperometric detector, HPAEC-PAD)被报道用于检测葡萄酒中的脯氨酸[8-9];超声波结合分光光度法被用于检测蜂蜜、葡萄酒和果汁中的脯氨酸含量[10]。邻苯二甲醛(o-phthalaldehyde, OPA)和2-巯基乙醇衍生后的荧光分光光度法也已被成功使用[11-12]。然而,当需要通过快速检测多样本量中的脯氨酸浓度来评估时,这些方法就过于繁琐和昂贵,因此需要一种能够快速、简单、经济的方法检测多样本量中的脯氨酸。有研究报道基于次氯酸钠氧化和OPA/N-乙酰半胱胺酸(N-acetylcysteine, NAC)荧光检测葡萄酒中的脯氨酸[13],该方法操作简单,不需要经过离心过滤且操作过程中不需要有机溶剂或高温条件,能够在塑料微孔板上进行多样本量的快速同时检测,是一种潜在的快速检测酵母胞内脯氨酸含量的方法。
本研究在优化了酵母破壁方法基础上,结合次氯酸钠氧化和OPA/NAC,搭建了一种基于荧光微孔板检测啤酒酵母胞内脯氨酸含量的方法,可以快速、准确测定酵母胞内脯氨酸浓度,为高脯氨酸积累啤酒酵母的筛选奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
拉格啤酒酵母菌株(Saccharomyces pastorianus)1、2、3、4、5、6,实验室保藏菌株。
1.1.2 实验试剂
葡萄糖、蛋白胨、酵母提取物、琼脂粉、磷酸、硼酸、NaClO、甲醇(色谱纯)、乙腈(色谱纯),美国TEDIA公司;四氢呋喃、三乙胺、盐酸、结晶乙酸钠、三氯乙酸均为分析纯,国药集团化学试剂有限公司;水为超纯水;OPA、NAC、脯氨酸标品,Sigma公司。
1.2 实验仪器
BSD-YX1600恒温摇床、SPX-250L恒温培养箱,上海博迅公司;SW-CJ-2FD无菌超净工作台,苏净集团安泰公司;E5052B柱前衍生反相高效液相色谱仪,美国安捷伦公司;Synergy H4全波长酶标仪,美国Biotek仪器有限公司;MK-16微型离心机,杭州米欧仪器有限公司;FE28 pH计,梅特勃-托利多仪器(上海)有限公司;Thermomixer C均质破碎仪,Eppendorf公司,BS-MP-96B黑色96微孔板,Bioland生物技术公司。
1.3 实验方法
1.3.1 培养基配制及菌株培养
YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母提取物10;固体配培养基添加20 g琼脂粉。
将酵母菌株接种至YPD培养基过夜活化,以1%(体积分数)的接种量转接至新的YPD培养基中,28 ℃摇床(180 r/min)培养至对数期。
1.3.2 荧光微孔板法结合珠磨法检测胞内脯氨酸
取培养至对数期的菌液,每个样品3个平行,ddH2O洗涤2次,菌液浓度调整至107 CFU/mL。取1 mL 菌液于装有小玻璃珠的破壁管中,振荡破壁循环6次。离心取100 μL上清液置于黑色96微孔板中。加入30 μL 30 mmol/L OPA,振荡4 min后加入25 μL 2 mmol/L NaClO后振荡2 min。最后加入50 μL OPA/NAC(3 mmol/6 mmol)振荡4 min(图1)。

图1 荧光微孔板法结合珠磨法检测啤酒酵母胞内脯氨酸含量示意图
Fig.1 Schematic diagram of detection of intracellular proline in brewer’s yeast by fluorescence microplate method combined with bead grinding method
1.3.3 方法的有效性分析
1.3.3.1 标准曲线、线性范围和检测限
a)荧光微孔板法的标准曲线和线性范围:用ddH2O将脯氨酸标品配制成100 μmol/L脯氨酸标准母液。之后用ddH2O将脯氨酸标准母液依次稀释为40、20、10、5 μmol/L脯氨酸标准溶液。取100 μL脯氨酸标准溶液,于黑色96微孔板中。加入30 μL的30 mmol/L OPA,振荡4 min后加入25 μL 2 mmol/L NaClO后振荡2 min。之后加入50 μL的OPA/NAC(3 mmol/6 mmol)振荡4 min,最后在荧光光谱仪上检测。以脯氨酸浓度为横坐标,以荧光响应值为纵坐标,绘制标准曲线。
b)检测限和定量限的计算:依照国际理论化学与应用化学联合会(International Union of Pure and Applied Chemistry, IUPAC)的定义,基于响应值标准偏差和标准曲线斜率法测定检测限(limit of detection, LOD)和定量限(limit of quantitation, LOQ),其计算分别如公式(1)和公式(2)所示:
(1)
(2)
式中,σ为标准偏差;S为斜率,使用截距的标准偏差计算检测限或定量限。
1.3.3.2 精密度、方法重现性和回收率
a)精密度的计算:通常用相对标准偏差(relative standard deviation, RSD)来表示分析测试结果的精密度。其计算如公式(3)所示:
(3)
b)方法重现性和回收率
将样品在液氮中冷冻保存,在6 d内分别进行6次平行测定来评估方法的重现性。
脯氨酸标品按照如下方法进行加标:
在脯氨酸标准品中:分别向10 mL脯氨酸标准溶液样品(10 mg/L)中加入10、20、40 μL脯氨酸母液(1 g/L),每个加标量制备3个平行样品。用荧光微孔板法测定每个样品加入标准溶液前后的脯氨酸浓度,然后计算脯氨酸的回收率。
1.3.4 氨基酸专用高效液相色谱法检测脯氨酸
取浓度为1×107 CFU/mL的菌液2 mL,珠磨法破碎后的取细胞上清液,用100 g/L三氯乙酸溶液等体系稀释,保证溶液体系中三氯乙酸的终质量浓度为50 g/L,静置2 h充分溶解。双层滤纸过滤后,取1.0 mL滤液在15 000 r/min离心30 min,上清液经0.22 μm滤膜再次过滤后用安捷伦1100高效液相色谱仪进行检测分析。检测条件如下:色谱柱:Agilent Hypersil ODS柱(250 mm×4.6 mm×5 μm);采用梯度洗脱,洗脱程序为:0 min,8% B;17 min, 50% B;20.1 min;100% B;24.0 min, 0% B;流动相流速为1.0 mL/min;柱温为40 ℃;紫外检测波长:338 nm(脯氨酸262 nm);氨基酸含量以外标法定量。流动相A(pH=7.2):27.6 mmol/L醋酸钠-三乙胺-四氢呋喃(体积比为500∶0.11∶2.5),流动相B(pH=7.2):80.9 mmol/L醋酸钠-甲醇-乙腈(体积比为1∶2∶2)。
2 结果与分析
2.1 荧光微孔板法检测脯氨酸的建立
2.1.1 脯氨酸荧光强度的稳定性分析
脯氨酸通过NaClO氧化后,与OPA和硫醇化合物形成的荧光物质异吲哚所产生的荧光值会随反应时间的延长而发生变化。为了确定反应后的最佳读数时间,将处理好的溶液经过NaClO氧化并与OPA和硫醇化合物形成相应的荧光异吲哚之后每5 min检测一次荧光强度,确定其荧光强度值的变化。如图2 所示,在反应结束的前5 min内荧光强度值基本保持不变,而在5 min后其荧光强度值有所升高。因此,使用该方法检测胞内脯氨酸的浓度时应在加样后5 min内读取荧光强度值。
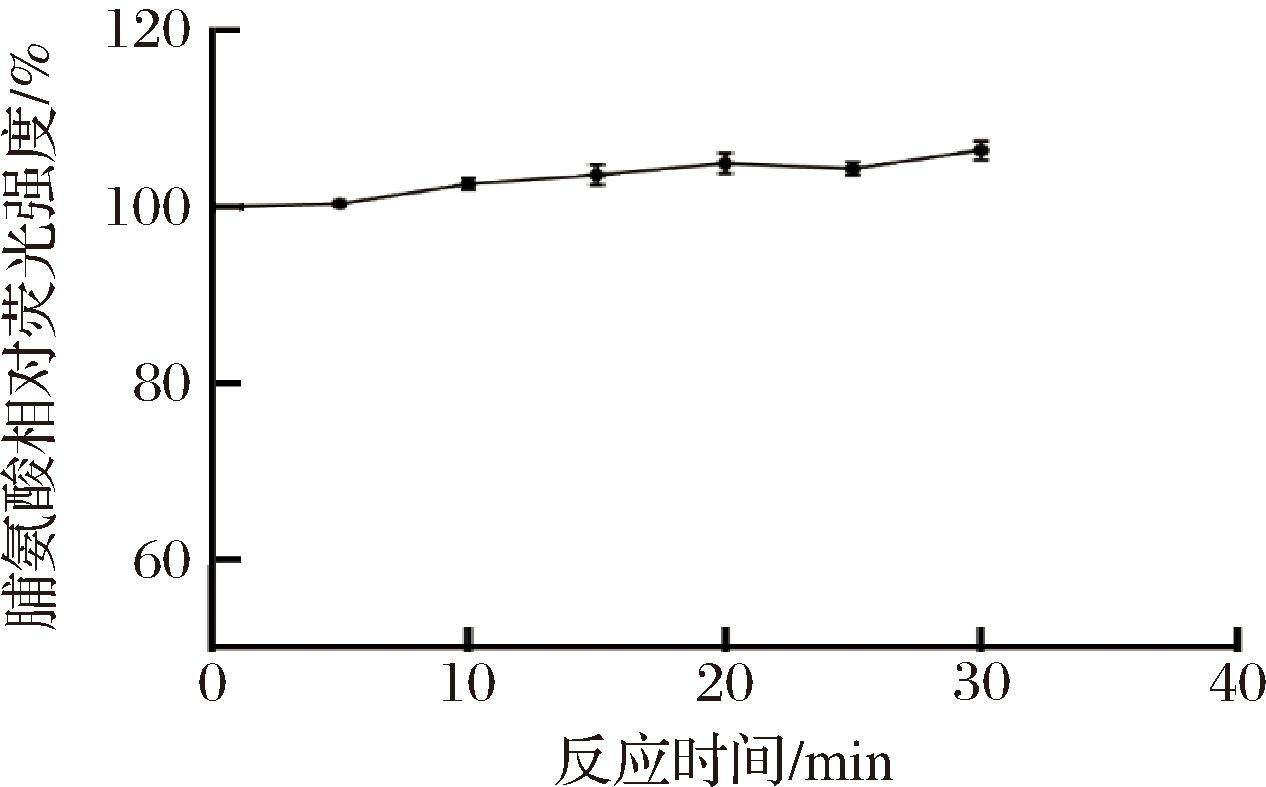
图2 反应开始后Pro荧光强度值的稳定性
Fig.2 Stability of the fluorescence intensity value of Pro after the reaction began
注:定义反应开始时的荧光强度值为100%。
2.1.2 荧光微孔板法检测脯氨酸含量的标准曲线及线性范围
为使通过荧光微孔板法检测的荧光强度与脯氨酸含量呈现线性关系,并确定其线性范围,按照1.3.3.1节所描述的方法,从测量的标准荧光强度中减去平均空白测量值来绘制校准曲线。如图3所示,当脯氨酸的含量为5~40 μmol/L(0.58~4.6 mg/L)时,脯氨酸的含量与荧光强度之间呈线性相关。以mg/L作为脯氨酸含量的单位时,R2=0.998 6,线性关系式为y=310.78x+2 392.6。因此,当脯氨酸含量为0.58~4.6 mg/L时,通过检测的荧光强度即可准确计算得到对应的脯氨酸含量。
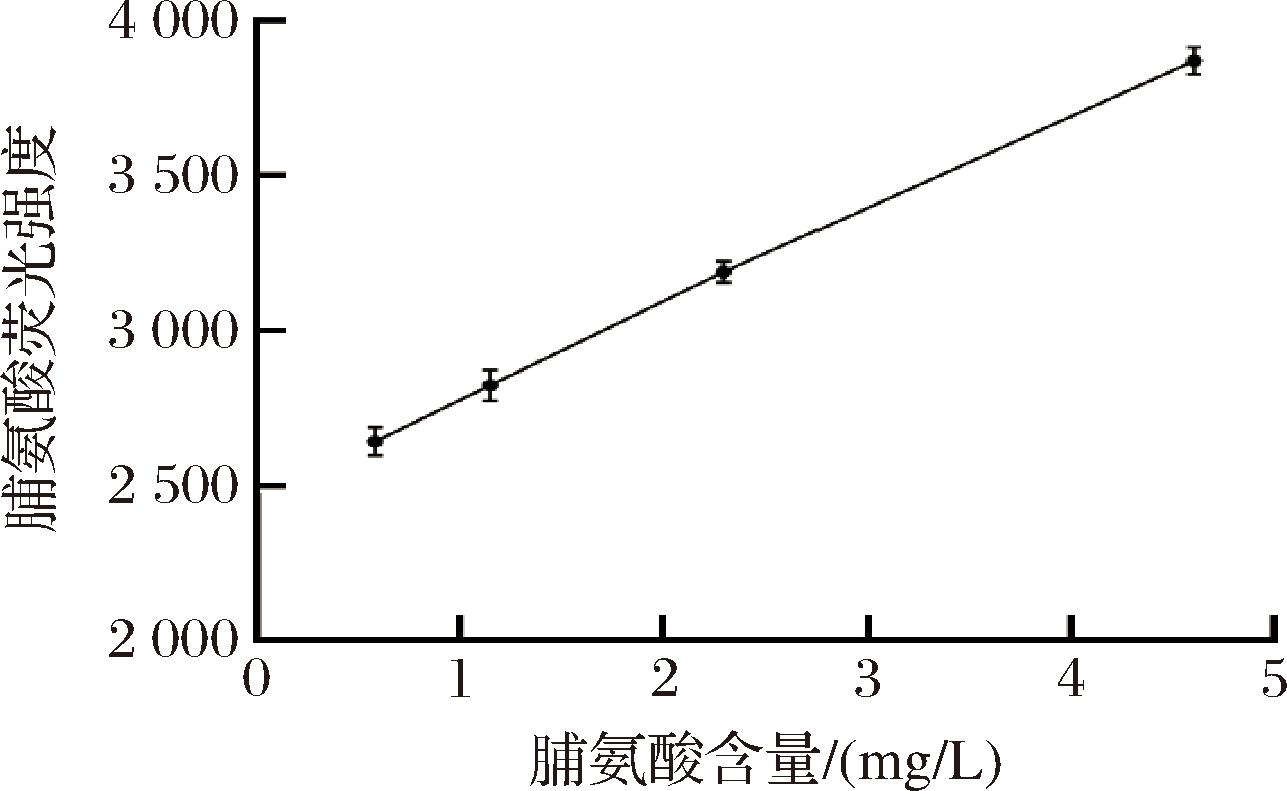
图3 脯氨酸荧光强度值与脯氨酸含量之间的关系
Fig.3 Relationship between Pro fluorescence intensity and concentration
2.1.3 检测方法的检测限、定量限、加标回收率、稳定性及重现性
基于荧光微孔板法的荧光强度和脯氨酸浓度的线性关系,按照1.3.3.1节所描述方法进行计算,LOD是1.93 mg/L,LOQ是5.85 mg/L。该方法的回收率和RSD如表1所示。在不同加标量条件下,回收率分别为73.33%、90%和105.5%,说明当待测样品质量浓度为10 mg/L时,加标量在2~4 mg/L回收率是比较合适的,其RSD为1.45%~3.85%,检测方法的稳定性较优。
表1 基于荧光微孔板法的方法有效性
Table 1 Effectiveness of the method based on fluorescence microplate
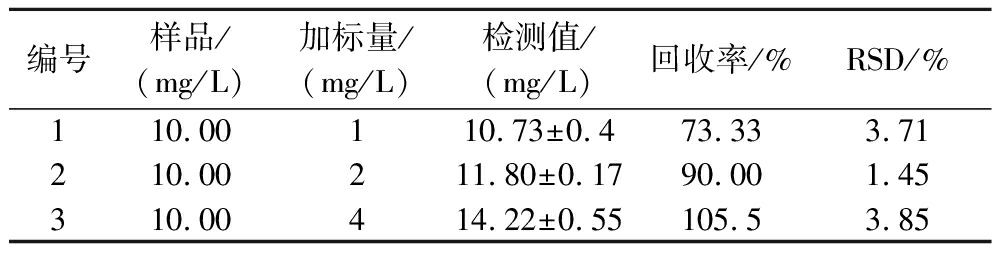
编号样品/(mg/L)加标量/(mg/L)检测值/(mg/L)回收率/%RSD/%110.00110.73±0.473.333.71210.00211.80±0.1790.001.45310.00414.22±0.55105.53.85
准备6份按照1.3.2节所述方法处理过的啤酒酵母样品,对每个平行样品中的脯氨酸含量进行检测,计算方法的精密度。如表2所示,6个样品的RSD为1.39%~18.63%,说明该检测方法的稳定性较好。
表2 基于荧光微孔板法的方法精密度
Table 2 Precision of the method based on fluorescence microplate
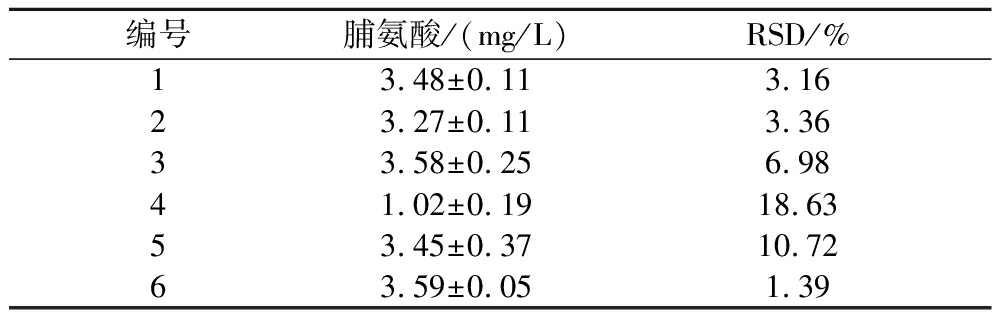
编号脯氨酸/(mg/L)RSD/%13.48±0.113.1623.27±0.113.3633.58±0.256.9841.02±0.1918.6353.45±0.3710.7263.59±0.051.39
注:1~6为啤酒酵母样品。
在6个样品中随机选取其中3份样品(样品3、样品4和样品5)按照1.3.3.2节所述方法进行重现性分析。如图4所示,荧光微孔板法检测3个样品的胞内脯氨酸含量的平行性较好,表明该检测方法具有较好的重现性。
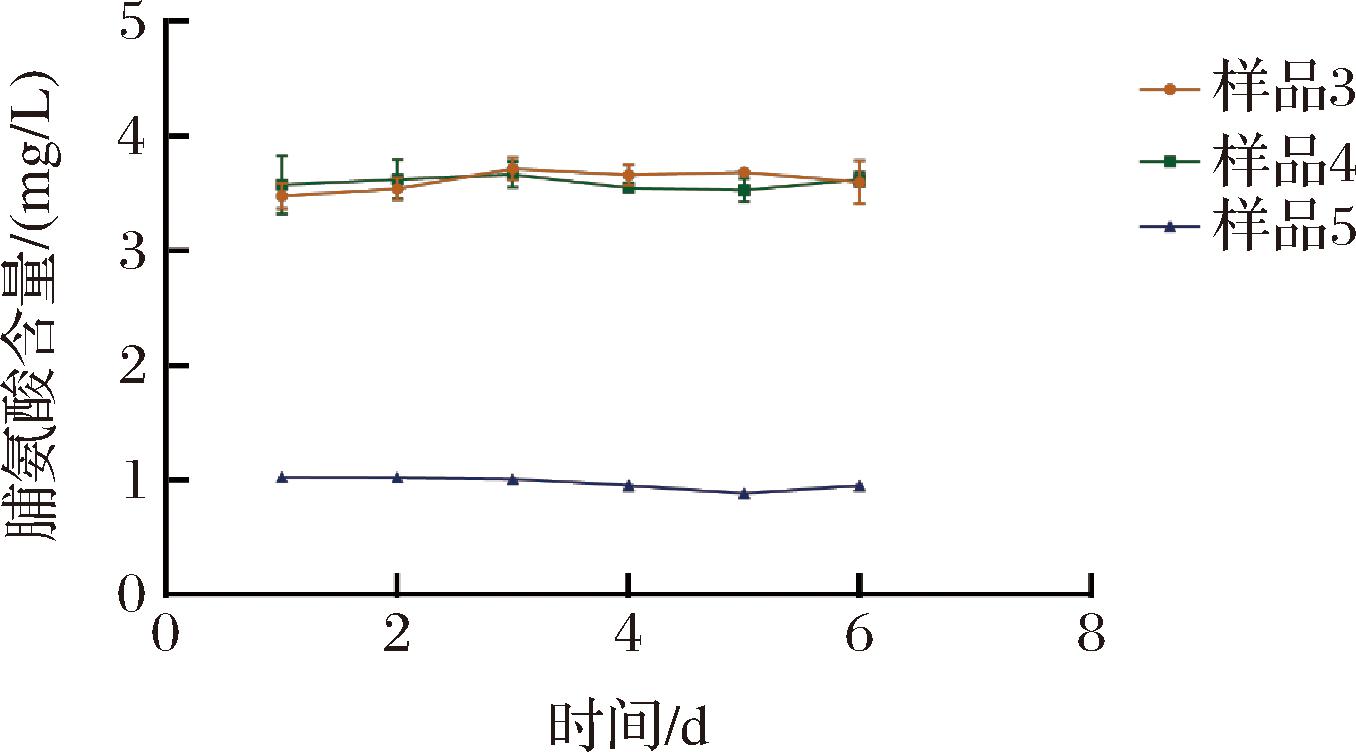
图4 荧光微孔板法的方法重现性
Fig.4 Method reproducibility of fluorescent microplate method
2.2 珠磨法破碎细胞壁的方法优化
2.2.1 均质破碎仪振荡循环数对脯氨酸浓度的影响
参考王增妹等[14]使用的珠磨法裂解酵母细胞测定ATP发光信号的方法,将培养至对数期的酵母细胞调整细胞浓度至1×106 CFU/L,分别于 2、4、6、8、10、12个循环后检测脯氨酸荧光强度,每个循环都重复在均质破碎仪上振荡1 min后将样品冰浴30 s。结果如图5所示,将荧光强度换算成浓度,循环次数在6~10次时,检测到的脯氨酸浓度不发生显著变化。因此,选取循环次数为6次。
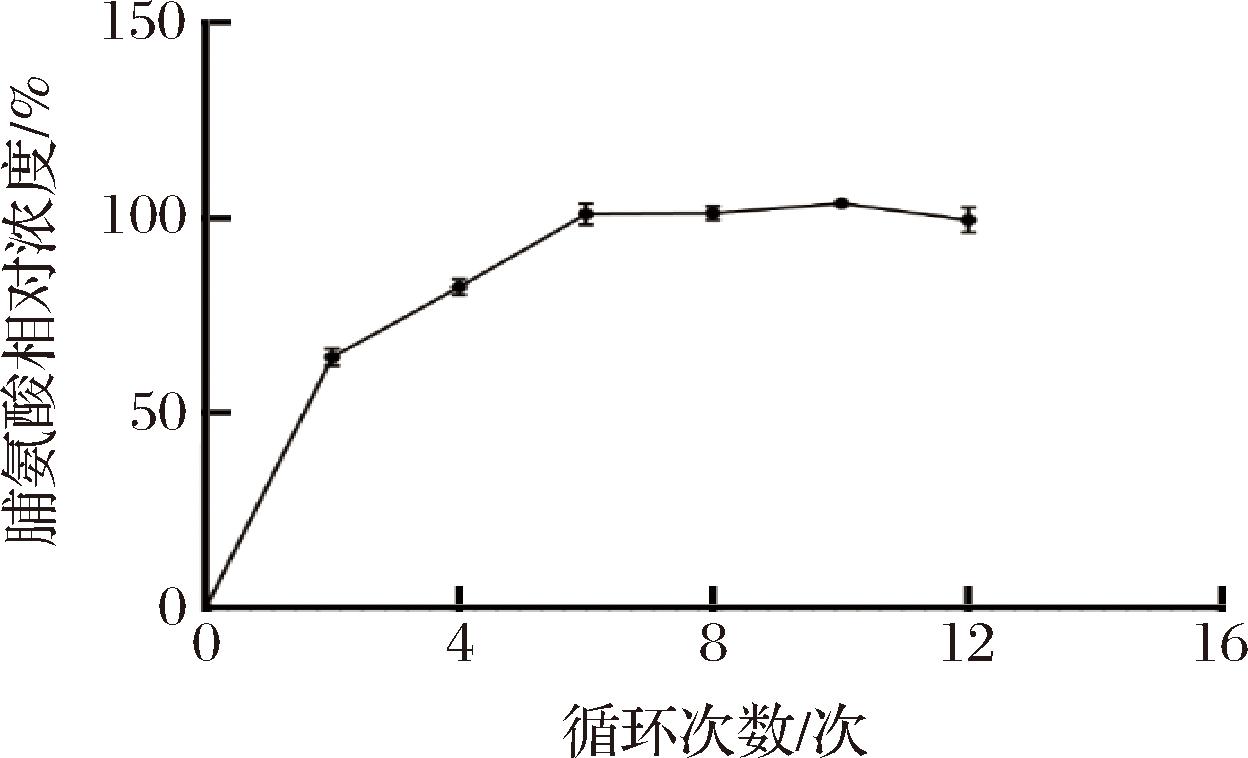
图5 振荡循环次数对脯氨酸浓度的影响
Fig.5 Influence of the number of cyclic oscillations on fluorescence intensity of Pro
注:定义循环数为6时检测到的浓度值为100%。
2.2.2 破壁后终次冰浴时间对脯氨酸稳定性的影响
按照1.3.2节所述方法处理啤酒酵母细胞,将处理好的细胞上清液冰浴中保存,分别于2、4、8、16 h后通过荧光微孔板法检测发光信号值。结果如图6所示,将荧光强度换算成浓度。由图6可知,在脯氨酸被提取后的16 h内,所检测的浓度值随着时间的延伸有所波动,在前2 h内呈现下降趋势,之后有所回升但仍略低于初始值。因此为保证脯氨酸的准确性应保证终次破壁冰浴30 s后立即进行后续的步骤。
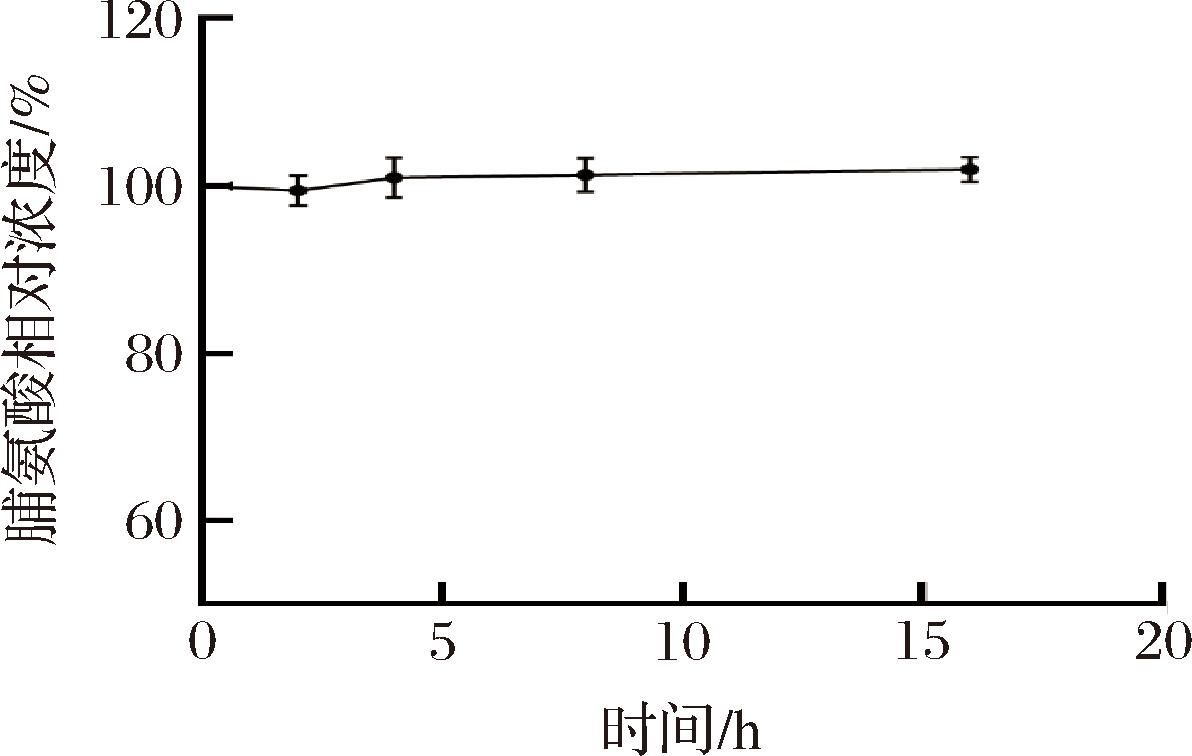
图6 脯氨酸被提取后的稳定性
Fig.6 Stability of Pro extracted from yeast cells
注:定义Pro刚被提取出时的浓度值为100%。
2.2.3 胞内脯氨酸含量与酵母细胞的菌浓之间的关系
基于上述优化步骤,探索拉格啤酒酵母胞内脯氨酸的荧光强度与菌液浓度之间的关系,找到针对啤酒酵母而言在荧光微孔板法标准曲线线性范围内的最适的菌液浓度,因此对不同菌浓的酵母细胞进行胞内脯氨酸荧光强度检测。如表3所示,将菌液浓度调整为1×107 CFU/mL,其对应的荧光强度在标准曲线的线性范围内,能直接计算脯氨酸的浓度。
表3 菌液浓度与脯氨酸荧光强度值的关系
Table 3 Relationship between fluorescence intensity of proline and cell concentration
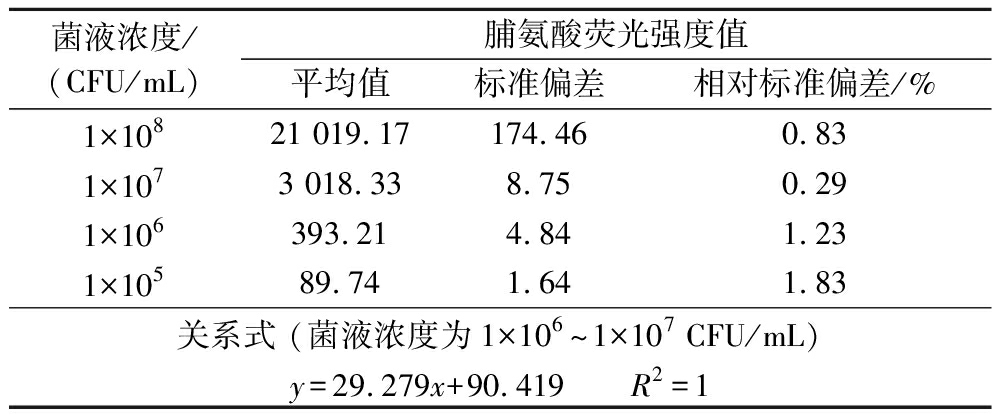
菌液浓度/(CFU/mL)脯氨酸荧光强度值平均值标准偏差相对标准偏差/%1×10821 019.17174.460.831×1073 018.338.750.291×106393.214.841.231×10589.741.641.83关系式 (菌液浓度为1×106~1×107 CFU/mL)y=29.279x+90.419 R2=1
2.3 荧光微孔板法与高效液相色谱法检测胞内脯氨酸的比较
为了检测该方法检测啤酒酵母细胞内脯氨酸的准确性,分别利用荧光微孔板法和氨基酸专用高效液相色谱法对以下6种样品中的脯氨酸含量进行检测,对比这2种方法结果如图7所示。将荧光微孔板法与氨基酸专用高效液相色谱法的结果进行显著性分析。经过SPSS单因素方差分析,7组样品的P值均>0.05,说明2种方法的检测结果直接无显著性差异。从效率上而言,和高效液相色谱法相比,该方法能在短时间内同时测量96个样品的胞内脯氨酸含量。此外,该方法从制样到检测仅需10 min即可完成,且该方法所需试剂价格较低,而高效液相色谱法从制样到检测单个样品耗时需将近2 h,且所用仪器试剂价格昂贵。相较于液相色谱法,采用荧光微孔板法测定酵母胞内脯氨酸含量更加经济高效,更适用于啤酒酵母胞内脯氨酸的检测。
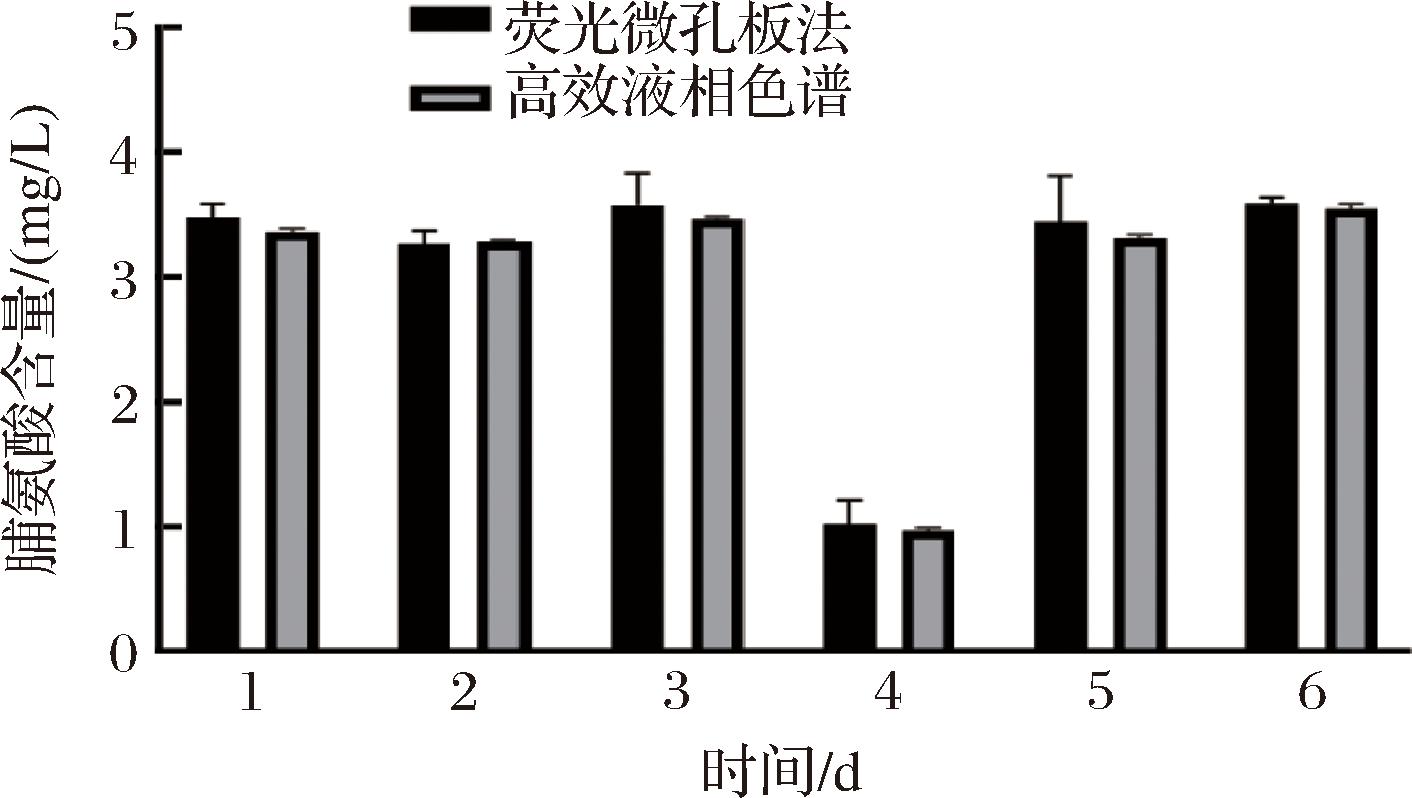
图7 荧光微孔板法和氨基酸专用高效液相色谱法检测啤酒酵母胞内的脯氨酸
Fig.7 Comparative determination of proline concentrations in brewer’s yeast by fluorescent microplate method and HPLC
3 结论
本研究提出了一种基于荧光微孔板法高通量检测啤酒酵母胞内脯氨酸含量的方法。荧光微孔板法测定脯氨酸的线性范围和回收率分别为5~40 μmol/L(0.58~4.6 mg/L)和73.33%~105.5%,通过比较该检测方法与氨基酸专用高效液相色谱法,发现两者测定胞内脯氨酸含量绝对值相比无显著性差异,但是荧光微孔板法操作简便快捷。因此,本研究建立的荧光微孔板法为测定酵母胞内脯氨酸提供了一种新思路,同时为适应高浓酿造胁迫的啤酒酵母筛选提供了一种新策略。
[1] GUAN Y, XU X, LIU C F, et al.Evaluating the physiology and fermentation performance of the lager yeast during very high gravity brewing with increased temperature[J].LWT, 2023, 173:114312.
[2] PICKERELL A T W.The influence of free alpha-amino nitrogen in Sorghum beer fermentations[J].Journal of the Institute of Brewing, 1986, 92(6):568-571.
[3] JONES M, B S, PIERCE J S, et al.Absorption of amino acids from wort by yeasts[J].Journal of the Institute of Brewing, 1964, 70(4):307-315.
[4] VERBRUGGEN N, HERMANS C.Proline accumulation in plants:A review[J].Amino Acids, 2008, 35(4):753-759.
[5] TSOLMONBAATAR A, HASHIDA K, SUGIMOTO Y, et al.Isolation of baker′s yeast mutants with proline accumulation that showed enhanced tolerance to baking-associated stresses[J].International Journal of Food Microbiology, 2016, 238:233-240..
[6] HEEMS D, LUCK G, FRAUDEAU C, et al.Fully automated precolumn derivatization, on-line dialysis and high-performance liquid chromatographic analysis of amino acids in food, beverages and feedstuff[J].Journal of Chromatography A, 1998, 798(1-2):9-17.
[7] MAYADUNNE R, NGUYEN T T, MARRIOTT P J.Amino acid analysis by using comprehensive two-dimensional gas chromatography[J].Analytical and Bioanalytical Chemistry, 2005, 382(3):836-847.
[8] CATALDI T R I, NARDIELLO D.Determination of free proline and monosaccharides in wine samples by high-performance anion-exchange chromatography with pulsed amperometric detection (HPAEC-PAD)[J].Journal of Agricultural and Food Chemistry, 2003, 51(13):3737-3742.
[9] COSTIN J W, BARNETT N W, LEWIS S W.Determination of proline in wine using flow injection analysis with tris(2,2′-bipyridyl)ruthenium(II) chemiluminescence detection[J].Talanta, 2004, 64(4):894-898.[10] ![]() S, ALTUNAY N, SAYMAN Y, et al.A new method of UA_CPE coupled with spectrophotometry for the faster and cost-effective detection of proline in fruit juice, honey, and wine[J].Food Chemistry, 2018, 255:31-40.
S, ALTUNAY N, SAYMAN Y, et al.A new method of UA_CPE coupled with spectrophotometry for the faster and cost-effective detection of proline in fruit juice, honey, and wine[J].Food Chemistry, 2018, 255:31-40.
[11] GORINSTEIN S, ZEMSER M, VARGAS-ALBORES F, et al.Proteins and amino acids in beers, their contents and relationships with other analytical data[J].Food Chemistry, 1999, 67(1):71-78.
[12] LONG D F, WILKINSON K L, POOLE K, et al.Rapid method for proline determination in grape juice and wine[J].Journal of Agricultural and Food Chemistry, 2012, 60(17):4259-4264.
[13] ROBERT-PEILLARD F, BOUDENNE J L, COULOMB B.Development of a simple fluorescence-based microplate method for the high-throughput analysis of proline in wine samples[J].Food Chemistry, 2014, 150:274-279.
[14] 王增妹, 王金晶, 李磊, 等.外源海藻糖对啤酒酵母在热胁迫下的保护作用[J].食品与生物技术学报, 2020, 39(8):43-50.WANG Z M, WANG J J, LI L, et al.Protective effects of exogenous trehalose on brewer′s yeast under heat stress[J].Journal of Food Science and Biotechnology, 2020, 39(8):43-50.